Vaccin contre la Covid-19
Un vaccin contre la maladie à coronavirus 2019 (Covid-19) entraîne et prépare le système immunitaire à reconnaître et à combattre le coronavirus SARS-CoV-2, ce qui permet de prévenir cette maladie.
Pour développer rapidement une gamme de vaccins contre la Covid-19, une collaboration inédite naît en 2020 entre l'industrie pharmaceutique multinationale, différents organismes gouvernementaux et des fondations philanthropiques. La mise au point d'un vaccin capable de protéger durablement contre le SARS-CoV-2 s'avère un défi technologique. Avant la pandémie de Covid-19, aucun vaccin contre une maladie infectieuse n'a été développé en moins d'un an et aucun vaccin n'existait pour lutter contre un coronavirus humain. Il préexistait toutefois une base de connaissances sur la structure et la fonction des coronavirus, causant des maladies comme le SRAS ou le syndrome respiratoire du Moyen-Orient.
Différentes approches technologiques ont été explorées. Certains vaccins ont été jugés prioritaires et ont été soutenus financièrement et institutionnellement. Des technologies dites de nouvelle génération, comme les vaccins à ARN ou les vaccins à vecteur viral, ont ainsi été favorisées. Des technologies plus traditionnelles comme les vaccins à virus inactivé ou de sous-unité protéique ont également été retenues. En revanche en 2021, aucun vaccin à virus vivant atténué n'est encore disponible. Les choix technologiques et la commercialisation des premiers vaccins contre la Covid-19 sont ceux effectués par l'Initiative ACT-A et l'Opération Warp Speed lancée le par le président américain Donald Trump, bénéficiant à quelques firmes occidentales[1]. L'Organisation mondiale de la santé (OMS) favorise l'émergence de sociétés de biotechnologie, telles que Afrigen en Afrique du Sud, qui puissent acquérir les technologies des vaccins à ARN, et puissent les produire et les rendre accessibles dans des pays aux revenus moins élévés[2],[3],[4].
En , selon l'Organisation mondiale de la santé (OMS), il y aurait 110 vaccins contre le coronavirus SARS-CoV-2 autorisés ou en phase d'étude clinique, ainsi que 184 vaccins potentiels à l'étude. Plusieurs vaccins étudiés lors d'essais cliniques de phase III ont affiché une efficacité vaccinale allant jusqu'à 95 % contre les souches du virus circulant au début 2021. Vingt-et-un vaccins sont approuvés par au moins une autorité nationale pour administration au public :
- deux vaccins à ARN par Pfizer-BioNTech et Moderna ;
- cinq vaccins à vecteur viral : Spoutnik V, Spoutnik Light, Oxford–AstraZeneca, Convidecia et Janssen ;
- six vaccins de sous-unité protéique : NVX-CoV2373, EpiVacCorona, ZF2001, Abdala, SOBERANA 02 et MVC-COV1901 (en) ; le VidPrevtyn Bêta de Sanofi et GSK complète cette liste en novembre 2022 ;
- neuf vaccins à virus inactivé : BBIBP-Corv, WIBP-CorV, CoronaVac, Covaxin, CoviVac, Covidful, KCONVAC, COVIran Barekat et QazCovid-in.
À l'exception des vaccins à virus inactivé qui permettent à l'organisme de se familiariser avec l'ensemble des protéines virales du SARS-CoV-2, la plupart des vaccins développés incorporent la protéine S de la souche de Wuhan (D614), reproduite à l'identique ou avec la mutation dite « 2P ». Quelques vaccins ciblent uniquement un fragment de la protéine S, appelé RBD. En 2022, des vaccins bivalents (Pfizer et Moderna) élargissent la couverture aux variants Omicron.
Plusieurs pays ont mis sur pied des campagnes de vaccination priorisant les groupes plus à risque, comme les personnes âgées ou à haut risque d'exposition. Début , près de 9 milliards de doses de vaccin anti-Covid ont été administrées dans le monde.
En , Katalin Karikó et Drew Weissman remportent le prix Nobel de médecine pour leurs découvertes ayant permis la mise au point de vaccins ARNm efficaces contre la Covid-19.
Historique
[modifier | modifier le code]En 2020, une pandémie se propage dans le monde et provoque un choc systémique sanitaire, sociétal et économique. L'agent infectieux en cause est un coronavirus, le SARS-CoV-2. Pour sortir de cette crise, des investissements considérables et le monde de la recherche sont mobilisés au niveau international pour développer des vaccins contre ce virus[5].
Expériences antérieures
[modifier | modifier le code]Avant la Covid-19, aucun vaccin contre une maladie infectieuse n'avait été développé en moins d'un an et aucun vaccin n'existait pour lutter contre un coronavirus humain[6]. Des projets antérieurs avaient tenté, sans grand succès, de développer des vaccins contre les coronavirus humains du SARS-CoV-1 et du MERS-CoV. Ces vaccins anti-SARS-CoV-1 et anti-MERS avaient été testés sur des animaux non humains, comme les singes[7],[8],[9].
Des vaccins ont été développés contre plusieurs coronavirus affectant les animaux. Un vaccin contre le coronavirus de la diarrhée épidémique porcine est disponible commercialement[10]. D'autres ont été développés avec plus ou moins de succès contre le virus de la bronchite infectieuse chez les oiseaux, le coronavirus canin et le coronavirus félin (FCoV)[11]. Les vaccins développés contre le FCoV ciblaient la protéine S. En présence d’anticorps ciblant directement la protéine S, ce coronavirus mute et les anticorps deviennent non neutralisants et facilitent l'infection des globules blancs. En détournant les anticorps à son profit, le virus développe un tropisme pour des globules blancs (les macrophages) où il se réplique activement. Ce qui dégénère en péritonite infectieuse féline (PIF)[12].
2020 : premiers vaccins
[modifier | modifier le code]En 2020, des dizaines de milliards de dollars ont été investis par des entreprises, des gouvernements, des organisations internationales de santé et des groupes de recherche universitaires pour développer des dizaines de vaccins candidats et se préparer à des programmes mondiaux de vaccination pour immuniser la population contre la Covid-19[13],[14],[15],[16]. En , l'OMS déclare ne pas s'attendre à avoir un vaccin disponible contre la Covid-19, avant 18 mois (horizon automne 2021)[17]. Fin , l'Initiative ACT-A est mise en place par le G20, l’OMS et la Fondation Bill-et-Melinda-Gates dans le but de coordonner et accélérer au niveau mondial, la mise au point et la production de produits de diagnostic, de traitements et de vaccins contre la Covid-19[18]. Dans les faits, les choix technologiques et la commercialisation des premiers vaccins contre la covid ont été orientés par l'Initiative ACT-A ainsi que par l'opération Warp Speed lancée le par le président américain Donald Trump[19].
Dès , plusieurs vaccins ont commencé à être élaborés en Russie[20],[21] ainsi qu'en Occident par la firme pharmaceutique Johnson & Johnson[22] ou à l'université d'Oxford[23]. En Allemagne, le Pr Uğur Şahin, patron de BioNTech, conçoit un vaccin à base d'ARN en l'espace d'un week-end[24]. En , une équipe de recherche de l'Imperial College de Londres affiche sa volonté de réduire le temps de développement normal du vaccin « de deux à trois ans à seulement quatorze jours »[25],[26], l'équipe de l'Imperial College étant alors au stade de test du vaccin sur les animaux[25]. En , au moins 35 entreprises et établissements universitaires développent chacun leur vaccin[27]. Quelque 300 études cliniques sont alors en cours[28]. Le , l'OMS recense 168 vaccins à l'étude dans le monde : 28 auraient déjà été évalués dans des essais cliniques sur l'homme, et six seraient en phase III des essais cliniques, avant l'homologation[29]. À la mi-octobre, ce nombre était de 193, dont 10 en phase III[30].
Le , la Haute Autorité de santé indique qu'il n'est actuellement pas nécessaire de vacciner systématiquement les personnes ayant déjà développé une forme symptomatique de la Covid-19. Elle précise que le recul actuel de 3 mois environ montre qu’il n’y a pas d’effet indésirable grave particulier lorsqu’une personne ayant déjà eu la Covid-19 se fait vacciner mais qu'il est cependant préférable de respecter un délai minimal de 3 mois à partir du début des symptômes[31]. Des études montrent qu'une personne contaminée pourrait être immunisée de 6 mois à plusieurs années, ce qui suggère qu’une campagne de vaccination serait efficace sans forcément avoir recours, pensait-on, à des injections fréquentes[32].
Développement
[modifier | modifier le code]Défis
[modifier | modifier le code]La mise au point d’un vaccin approprié capable de protéger durablement contre le SARS-CoV-2 s'avère être un défi technologique. Une étude suggère que l'immunité acquise avec quatre types de coronavirus de rhumes saisonniers ne dépasse pas un an[33],[34], ce qui laisserait présager qu'une réinfection est possible. Toutefois il est avéré qu'il existe chez les humains une immunité cellulaire de long terme contre différents coronavirus (HCoV-229E, HCoV-NL63, HCoV-OC43) provoquant un simple rhume[35],[36]. La question est de savoir si cette réinfection est asymptomatique, symptomatique ou aggravée.

Des virus tels que les coronavirus utilisent les récepteurs Fc pour infecter les globules blancs, par un mécanisme connu sous le nom de facilitation dépendante des anticorps[37]. Dans le cas du SARS-CoV-1, ce risque est constaté et a été bien documenté chez l'animal de laboratoire avec des vaccins inactivés et des vaccins exprimant la protéine S en entier[38],[39],[40]. Dans le cas du vaccin contre la COVID-19, ce risque est pris en compte par les agences de régulation et intégré dans les prérequis à une commercialisation[41],[42].
Outre le risque de la facilitation de l'infection par des anticorps, un autre risque théorique est le phénomène de « péché originel antigénique », appelé également « effet Hoskins »[43]. Selon un consensus d'experts tenu en , ces risques n'empêchent pas la recherche vaccinale, mais doivent être surveillés[44].
L'urgence de créer un vaccin contre la Covid-19 a conduit à raccourcir à quelques mois un processus qui nécessite généralement plusieurs années[45]. Depuis le début du XXIe siècle, la fusion de nouvelles techniques telles que les biotechnologies et la bio-informatique permet d'accélérer la vitesse de fabrication des vaccins. Par exemple, l'utilisation de ces outils permet de[46] :
- séquencer rapidement et massivement les génomes complets des microorganismes en suivant leur variété et évolution, et de les intégrer dans des bases de données ;
- identifier les structures moléculaires d'un microorganisme, susceptibles d'être à l'origine d'une réponse immunitaire.
L'ensemble de ces données est traité par une grande variété de logiciels qui permettent par exemple de classer les séquences génétiques, de donner la structure 3D d'une protéine virale, de comparer les épitopes, et de déterminer dans le cas du SARS-CoV-2 la glycoprotéine S (spike, spicule ou péplomère) du virus, comme la cible à privilégier pour une réponse immunitaire[46].
Dans le futur, d'autres vaccins pourraient cibler d'autres protéines virales, comme la protéine N du virus. Le meilleur scénario serait la production d'un vaccin universel contre les coronavirus[47].
Initiative ACT-A
[modifier | modifier le code]Afin de coordonner la réponse mondiale à la pandémie de Covid-19, en est mise en place par le G20 et l'OMS l'Initiative ACT-A. Elle réunit des gouvernements, des scientifiques, des entreprises, la société civile, des organismes philanthropiques et des organisations mondiales telles que la Fondation Bill-et-Melinda-Gates, la Coalition pour les innovations en matière de préparation aux épidémies (CEPI), la Fondation pour de nouveaux outils diagnostiques novateurs (FIND), Gavi L'Alliance du Vaccin, le Fonds mondial, Unitaid, Wellcome, et la Banque mondiale[18].
L'Initiative ACT-A est organisée en quatre piliers : (1) les vaccins (également appelés « COVAX »), (2) les diagnostics, (3) la thérapeutique et (4) une coordination des systèmes de santé[48]. Le dispositif COVAX (COVID-19 Vaccines Global Access) est codirigé par l'OMS, la CEPI et l'alliance Gavi. Son objectif est d’accélérer la mise au point de vaccins contre la Covid-19 et d'« en assurer un accès juste et équitable », à l’échelle mondiale[49]. L'OMS prévoit dès l'origine des essais cliniques internationaux, randomisés, de grande envergure et sur de multiples sites, pour permettre l'évaluation simultanée des avantages et des risques de chaque vaccin candidat dans un délai de 3 – 6 mois[50].
Certains vaccins ont été jugés prioritaires et ont été soutenus financièrement et institutionnellement par la Coalition pour les innovations en matière de préparation aux épidémies (CEPI) : le vaccin à vecteur développé par Oxford pour AstraZeneca, ceux à ARNm de CureVac et Moderna, celui à ADN d'Inovio Pharmaceuticals, celui à protéines recombinantes de Novavax et celui de l'université du Queensland[51]. Le vaccin développé par l'université du Queensland est le V451 (en). Il incorporait des anticorps contre le VIH (anti-gp41 (en)), et a du être abandonné en décembre 2020 après que les essais aient produit des faux positifs au VIH chez les personnes vaccinées[52].
Différents pays ont ainsi été incités à passer des commandes auprès de ces industriels, sous réserve que l'efficacité et l'innocuité des vaccins soient démontrées. Au , le budget consacré à ces pré-commandes est de 12 milliards de dollars aux États-Unis et de 2,3 milliards d'euros en Europe[53].
Essai clinique
[modifier | modifier le code]Le processus d'élaboration et d'évaluation de vaccins est un équilibre entre[54],[6] :
- l'efficacité des vaccins ;
- le niveau de toxicité acceptable du vaccin (sa sécurité) ;
- le bénéfice-risque pour les populations vulnérables ;
- la durée de la protection vaccinale ;
- des modes d'administration spéciaux (tels que par voie orale ou nasale, plutôt que par injection)
- le schéma posologique ;
- les caractéristiques de stabilité et de stockage ;
- l'autorisation d'utilisation d'urgence avant l'autorisation formelle ;
- la fabrication optimale pour passer à des milliards de doses ;
- l'homologation des vaccins.
Après des essais concluants sur modèle animal[55],[56], les essais de phase I testent principalement l'innocuité et le dosage préliminaire chez quelques dizaines de sujets sains, tandis que les essais de phase II - après le succès de la phase I - évaluent l'immunogénicité, les niveaux de dose (efficacité basée sur les biomarqueurs) et les effets indésirables du vaccin candidat, généralement sur des centaines des personnes. Un essai de phase I-II est généralement randomisé et contrôlé par placebo. Les essais de phase III impliquent généralement plus de participants sur plusieurs sites, incluent un groupe témoin et testent l'efficacité du vaccin pour prévenir la maladie (un essai «interventionnel» ou «pivot»), tout en surveillant les effets indésirables à la dose optimale. La définition de l'innocuité, de l'efficacité et des paramètres cliniques d'un vaccin dans un essai de phase III peut varier entre les essais de différentes sociétés, comme la définition du degré d'effets secondaires, de l'infection ou de la quantité de transmission, et si le vaccin prévient la Covid modérée ou sévère[57],[58].
Types de vaccins
[modifier | modifier le code]En , il existe au moins neuf technologies différentes ayant été mobilisées pour créer un vaccin contre la Covid-19. Ces approches vaccinales se focalisent sur la protéine S du SARS-CoV-2 de la souche d'origine de Wuhan (D614). Les vaccins à ARNm et les vaccins à vecteur sont des technologies dites de nouvelle génération. D'autres technologies ciblent un plus large panel de protéines du SARS-CoV-2, et ne se limitent pas à la seule protéine S, comme les vaccins à virus inactivés ou ceux à virus vivants atténués.
Les vaccins ciblant uniquement la protéine S et ceux à virus inactivés offrent une protection d'au moins six à huit mois, mais de durée réelle encore inconnue[59]. [source insuffisante]Malgré les mutations du SARS-CoV-2, certains vaccins sont susceptibles d'offrir une protection à vie ou du moins à long terme (10 ans), dont des vaccins traditionnels à virus vivants atténués ou des technologies de nouvelle génération, basées sur l'immunité cellulaire, et qui offrent une protection sans générer d'anticorps.
Vaccins diffusés dans les premières années 2020
[modifier | modifier le code]Vaccins ciblant la protéine S
[modifier | modifier le code]Chez la plupart des humains, il existe déjà un « répertoire antigénique » contre différentes protéines de coronavirus (HCoV-229E, HCoV-NL63, HCoV-OC43) provoquant un simple rhume. Dans le cas d’une infection au SARS-CoV-2, une immunité cellulaire croisée est généralement mobilisée pour lutter contre l’infection[35],[36]. Les vaccins contre le SARS-CoV-2 vont compléter cette immunité préexistante en ciblant généralement une seule protéine du virus : la protéine S. La protéine S va devenir une cible prioritaire pour les lymphocytes T et plus encore pour les lymphocytes B qui vont produire des anticorps pour la neutraliser.
Pour cibler la protéine S du SARS-CoV-2, différentes technologies ont été mobilisées : les vaccins à ARN messagers ou à ADN, les vaccins à vecteurs viraux non réplicatifs ou encore des vaccins à protéines recombinantes.
Mutation 2P
[modifier | modifier le code]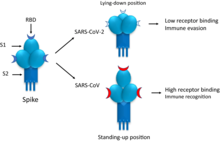
Plusieurs vaccins utilisent une « mutation 2P » pour verrouiller la protéine S dans sa configuration de pré-fusion (c'est-à-dire dans un état de conformation « masqué »), stimulant une réponse immunitaire au virus avant qu'il ne s'attache à une cellule humaine[60]. Concrètement une « mutation 2P » consiste en l’ajout de deux prolines (substitution d'acides aminés sur la protéine S aux codons K986P et V987P[61]) entre le heptad repeat 1 (HR1) et le central helix (CH) de la protéine S du SARS-CoV-2[62],[63].
Vaccins à ARNm
[modifier | modifier le code]
Les vaccins à ARNm sont des technologies dites de nouvelle génération. La biochimiste Katalin Karikó est à l'origine de la technologie des ARN messagers, et en 1997 elle rencontre l’immunologiste Drew Weissman avec lequel elle perfectionne sa technologie[65]. Les ARN messagers permettent aux cellules du muscle dans lesquelles ils sont injectés de synthétiser la protéine S du SARS-CoV-2. Des cellules se transforment ainsi en usine à produire des protéines S. Les cellules exposent les protéines S produites à leur surface, ce qui permet à des globules blancs de se familiariser avec la protéine S, de la reconnaître et de produire des anticorps contre celle-ci. L'ARN messager délivré par le vaccin est encapsulé dans des nanoparticules de lipide. Ces nanoparticules contiennent du polyéthylène glycol 2000[66]. Cette technologie est utilisée par les Américains Pfizer et Moderna, l’Allemand CureVac/Bayer, et est en projet pour le Français Sanofi Pasteur[35].
Le vaccin Pfizer-BioNtech a été conçu à la fin par le cofondateur de BioNTech (BNT), Uğur Şahin[67],[68]. Le , Pfizer annonce un partenariat avec BioNTech[69] et les sociétés développent deux formules, le « BNT162b1 » et le « BNT162b2 ». Le BNT162b1 ne fait produire par les cellules qu'un fragment de la protéine S, le domaine de liaison au récepteur (RBD)[70]. Le BNT162b2 fait produire par les cellules la protéine S de la souche d'origine (celle de Wuhan) dans son intégralité, avec comme seule modification la mutation 2P[71]. Finalement, seul le BNT162b2 est commercialisé, rebaptisé Tozinaméran.
Le National Institute of Allergy and Infectious Diseases (NIAID) des États-Unis a collaboré avec Moderna pour développer un vaccin à ARN[72] dont le nom de code est « mRNA-1273 ». Cet ARN messager est encapsulé dans des nanoparticules lipidiques avec comme seule modification la mutation 2P[73]. Comme le vaccin de Pfizer commercialisé (BNT162b2), c'est l'ensemble de la protéine S de la souche d'origine qui est synthétisée par des cellules et qui devient la cible d'anticorps[46].
Le vaccin Zorecimeran du laboratoire allemand CureVac/Bayer, tout comme le vaccin MRT5500 du laboratoire français Sanofi Pasteur, qui devaient tous les deux être commercialisés d'ici la fin 2021, intègrent également une protéine S de la souche d'origine avec la mutation 2P[74],[75]. Les deux développements sont abandonnés à l'automne 2021[76],[77].
En aout 2022, Moderna porte plaine contre Pfizer pour violation de brevet concernant leur vaccin à ARN messager[78].
Le , Katalin Karikó et Drew Weissman sont récompensés du prix Nobel de médecine pour « leurs découvertes concernant les modifications des bases nucléosidiques ayant permis la mise au point de vaccins ARNm efficaces contre le Covid-19 »[79].
Vaccins à vecteurs
[modifier | modifier le code]Les vaccins à vecteur utilisent un virus modifié dont une partie du génome a été remplacée par une séquence permettant de synthétiser la protéine S du SARS-CoV-2. Le vecteur utilisé peut être un adénovirus, le virus de la rougeole ou d'autres[40]. Des cellules de la personne vaccinée vont être infectées par ce vecteur, et vont se mettre à produire des protéines S comme dans le cas des vaccins à ARN.
Cinq vaccins à vecteur contre la Covid-19 ont été mis sur le marché :
- le vaccin Covishield / Vaxzevria du laboratoire britannique AstraZeneca, le vaccin Spoutnik V (2 doses) ou Spoutnik Light (unidose)[80] de l’Institut russe Gamaleïa et le vaccin Convidicea du laboratoire chinois CanSino ont en commun qu’ils présentent une protéine S entière de la souche d'origine (celle de Wuhan) sans aucune mutation[81] ;
- le vaccin Ad26.COV2.S du laboratoire américain Johnson & Johnson (Janssen) présente une protéine S entière de la souche d'origine avec la mutation 2P[81].
Le vaccin d'AstraZeneca-Oxford contre la Covid-19 est basé sur un vecteur adénoviral simien (chimpanzé) génétiquement modifié pour contenir la protéine S[82],[83]. Le vaccin Spoutnik V et le vaccin Convidicea utilisent comme vecteur un adénovirus de type 5 (Ad5), et le vaccin Janssen un adénovirus de type 26 (Ad26). L'Université de Hong Kong essaye de développer un vaccin avec un virus atténué de la grippe comme vecteur et n'incorpore qu'un fragment de la protéine S, appelé RBD[84]. L'Institut Pasteur qui utilisait un vecteur du virus de la rougeole a abandonné ses recherches sur ce type de vaccin[85].
Vaccins sous-unitaires
[modifier | modifier le code]Les vaccins sous-unitaires présentent directement un ou plusieurs antigènes de la protéine S sans les faire produire par des cellules de la personne vaccinée comme dans le cas des vaccins à ARN ou des vaccins à vecteur. Dans le cas des vaccins à protéines recombinantes, des protéines S du SARS-CoV-2 sont produites en laboratoire par un virus qui n’est pas le SARS-CoV-2, en l'occurrence un baculovirus (virus en forme de batonnet). Ces protéines S sont ensuite purifiées et injectées. Un adjuvant est ajouté pour booster la réponse immunitaire.
Cinq vaccins sous-unitaires contre la Covid19 ont déjà été mis sur le marché :
- le vaccin Abdala développé par le Centre Cubain pour l'Ingénierie Génétique et la Biotechnologie, le vaccin SOBERANA 02 développé par BioCubaFarma, et le vaccin ZF2001 du laboratoire chinois Anhui Zhifei Longcom, ont en commun qu’ils n’incorporent qu’un fragment de la protéine S, appelé RBD[86] ; Les vaccins Abdala et Soberana s'appuient sur une technique utilisée pour un vaccin contre l'hépatite B développé par Cuba il y a plusieurs années ; selon Merardo Pujol Ferrer, du CIGB, en novembre 2021, 24 millions de doses avaient déjà été administrées à 8 millions de personnes à Cuba ; et ces deux vaccins ont commencé à être exporté vers le Venezuela, le Vietnam, l'Iran et le Nicaragua alors qu'une demande d'approbation étaient faites à l'OMS[87].
- le vaccin EpiVacCorona développé par l’Institut russe VEKTOR, incorpore des fragments peptidiques de la protéine S : une fraction du RBD (codons 454 à 477) et une fraction du HR2 (codons 1179 à 1209)[88],[89] ;
- le vaccin MVC-COV1901 du laboratoire taiwanais Medigen, incorpore une protéine S entière de la souche d’origine, avec la mutation 2P[90]. Contrairement aux vaccins à ARN messager (ARNm) de Pfizer et Moderna, les vaccins protéiques ne nécessitent pas une conservation et un transport à des températures très basses et leurs effets secondaires pourraient être moindres que les vaccins d'AstraZeneca et de J&J[87].
D’ici la fin 2021, deux vaccins sous-unitaires contre la Covid19 pourraient être autorisés en Occident :
- Le vaccin NVX-CoV2373 développé par l’Américain Novavax incorpore une protéine S entière de la souche d’origine, avec la mutation 2P et une autre mutation appelée « 3Q » sur le site dit de la furine (mutations aux codons R682Q, R683Q et R685Q)[91] ;
- Le vaccin VAT00008 développé en commun par les laboratoires français Sanofi Pasteur et britannique GSK proposera soit un vaccin sous-unitaire avec une protéine S entière de la souche d'origine de Wuhan avec la mutation 2P, soit un vaccin sous-unitaire composé de deux protéines S entières combinant la souche d’origine (D614) avec le variant bêta (dit sud-africain) avec les mutations 2P[92]. Le vaccin à protéine recombinante VidPrevtyn Bêta (en) est autorisé pour les rappels de vaccination par l'Agence européenne des médicaments le [93].
Vaccins inactivés
[modifier | modifier le code]Parmi les vaccins contre le SARS-CoV-2 qui sont déjà sur le marché, une seule technologie cible un plus large panel de protéines virales du SARS-CoV-2 que la seule protéine S. Il s’agit des vaccins inactivés, qui utilisent des virus qui ont perdu tout pouvoir infectant par procédé physico-chimique. Plusieurs injections, par voie intramusculaire ou sous-cutanée, sont souvent nécessaires pour obtenir une immunisation suffisante. Neuf vaccins inactivés contre la Covid-19 ont déjà été mis sur le marché[94] :
- les vaccins BBIBP-CorV et WIBP-CorV du laboratoire chinois Sinopharm[95];
- le vaccin CoronaVac du laboratoire chinois Sinovac[96];
- le vaccin Covidful développé par l’Académie chinoise des sciences médicales ;
- le vaccin KCONVAC du laboratoire chinois Minhai Biotechnology[97];
- le vaccin Covaxin du laboratoire indien Bharat[98];
- le vaccin CoviVac du laboratoire russe Chumakov[99];
- le vaccin COVIran Barekat du laboratoire iranien Shifa Pharmed Industrial Group[100];
- le vaccin QazCovid-in développé par l'Institut de recherche sur les problèmes de sécurité biologique du Kazakhstan[101].
Un vaccin inactivé a également été développé par le laboratoire français Valneva. Ce vaccin - appelé VLA2001 - est en juillet 2021 en phase III, et il est prévu qu’une demande de mise sur le marché soit lancée au cours de l'automne 2021[102].
Vaccins en cours de développement
[modifier | modifier le code]Vaccins atténués
[modifier | modifier le code]Les vaccins à virus vivant entier et atténué comptent parmi les plus anciennes technologies vaccinales disponibles. Atténué signifie «affaibli». Affaiblir un virus vivant implique généralement de réduire sa virulence ou sa capacité à se répliquer. Le virus infecte toujours les cellules et provoque des symptômes bénins. L'utilisation d'un virus vivant atténué présente un avantage : la vaccination ressemble à une infection naturelle, ce qui conduit généralement à des réponses immunitaires robustes et à une mémoire des antigènes du virus qui peut durer de nombreuses années[103],[35].
Des inquiétudes ont été exprimées sur le fait qu’avec une telle technologie, il existe un risque théorique de mutation et de recombinaison avec un coronavirus sauvage pour recréer une souche sauvage. La HAS ajoute que « Ces vaccins posent également des problèmes de sécurité évidents lorsque l’on s’adresse à des infections potentiellement graves nécessitant de s’assurer de leur parfaite atténuation »[35],[103].
Un vaccin à virus vivant atténué peut facilement être produit à grande échelle et être distribué à bas prix. Au moins trois vaccins vivants atténués contre la Covid-19 sont développés respectivement par les laboratoires américains Codagenix[104] et Meissa[105], ainsi que par le Serum Institute of India[103].
Vaccins ciblant les épitopes de lymphocytes T
[modifier | modifier le code]De nouvelles biotechnologies utilisant des méthodes « immuno-informatiques » permettent de sélectionner des épitopes (déterminants antigéniques) à partir de sérum de convalescents. Ces épitopes sont choisis dans des zones des protéines du virus qui mutent très peu. Il s'agit de peptides servant de base à des vaccins susceptibles de stimuler préférentiellement les lymphocytes T[106].
Cette approche aurait l'avantage d'apporter une protection au niveau des muqueuses respiratoires, avec une immunité plus étendue et plus durable, par rapport aux vaccins basés sur la production d'anticorps ciblant la seule protéine S, et dont l'efficacité peut être réduite par l'apparition de nouveaux variants[107]. La mise au point de vaccins à lymphocytes T est un moyen d'éviter tout risque de facilitation de l'infection par des anticorps à la suite d'une vaccination[108]. Cependant cette technologie vaccinale doit encore faire ses preuves mais elle ouvre de nouvelles pistes[106].
Ces recherches vaccinales sont au stade de phase 1[109]. Elles sont effectuées, entre autres, par le laboratoire américain EpiVax Therapeutics[106], ou le laboratoire français Ose Immunotherapeutics[110],[111]. Dans le cas du vaccin CoVepiT développé par Ose, les 55 épitopes sélectionnés se trouvent sur 11 protéines du SARS-CoV-2 dont la protéine S et la protéine N[111].
Vaccins de seconde génération
[modifier | modifier le code]Les entreprises françaises GTP Bioways et LinKinVax s'associent pour le développement d'un vaccin de seconde génération, moins sensible aux mutations que les vaccins à ARN, et dont l'efficacité pourrait donc être plus longue. La technologie de ce vaccin repose sur des anticoprs monoclonaux qui vont agir sur certaines cellules du système immunitaire fondamentales pour la stimulation et la régulation des réponses immunitaires. GTP Bioways explique que les cellules ciblées par les anticorps du vaccin sont comme des professeurs qui « éduquent le système immunitaire pour lui apprendre à répondre ». La réponse immunitaire attendue ciblera des zones du virus dans lesquelles peu de mutations se produisent. Les premiers essais cliniques sont prévus en 2023[112],[113].
Le vaccin NDV-HXP-S
[modifier | modifier le code]Des chercheurs de l'Université du Texas à Austin ont mis au point "une protéine S-6P" (également appelée HexaPro), très stable, "où 6 acides aminés ont été substitués par des prolines". Cette protéine, très facile à produire industriellement, "peut être entreposée à température ambiante" et supporter 3 cycles de congélation/décongélation. La séquence d'ADN codant l'HexaPro est incorporée à un virus de la maladie de Newcastle (NDV) pour créer un nouveau vaccin recombinant, le NDV-HXP-S qui peut être produit dans des œufs comme le vaccin contre la grippe saisonnière. La version injectable du NDV-HXP-S est en études cliniques en Thaïlande, au Vietnam et au Brésil où, sous le nom de ButanVac, il est mis en fabrication fin avril 2021[114]. La version intranasale, évaluée au Mexique par le laboratoire Avi-Mex, facile à administrer et à produire, peu coûteuse, est "une option idéale pour généraliser la vaccination à tous les pays, quels que soient leurs moyens financiers ou l'état de leurs structures sanitaires"[115]. Le vaccin HexaPro est facilement adaptable à de nouveaux variants.
Une étude, conduite par une vingtaine de chercheurs australiens de l’Université Griffith et de l’Université du Queensland et publiée le 29 octobre 2021 dans la revue Science Advances[116], démontre la supériorité de l'administration du NDV-HXP-S par patch, pour produire une réponse immunitaire innée et adaptative, sur l'injection par aiguille[117],[118].
Vaccin BCG
[modifier | modifier le code]Les scientifiques ont cherché à savoir si les vaccins existants contre des affections non liées pouvaient stimuler le système immunitaire et réduire la gravité de l'infection au Covid-19. Il existe des preuves expérimentales que le vaccin BCG contre la tuberculose a des effets non spécifiques sur le système immunitaire. Fin , des essais cliniques sont effectués dans divers pays (France, Allemagne, Pays-Bas, Australie) dans le but de tester les propriétés immunologiques du BCG, vaccin antituberculeux[119]. « Deux études menées chez les adultes montrent une réduction de 70 % des infections respiratoires grâce au BCG », indique au Figaro Mihai Netea, spécialiste des maladies infectieuses au Centre médical de l’université Radboud de Nimègue aux Pays-Bas[120].
Une étude a démontré, sur une cohorte de 6 000 professionnels de santé, que le vaccin BCG protège de la Covid-19. Les professionnels de santé qui se sont fait re-vacciner avec le BCG sont moins susceptibles d’être testés positifs pour les anticorps anti-SARS-CoV-2, ce qui démontre que leur réponse immunitaire innée ou cellulaire est efficace contre le virus. Une vingtaine d’essais cliniques randomisés sont en cours pour vérifier si l'administration d'un rappel du BCG peut induire un effet protecteur contre l'infection par le SARS-CoV-2[121].
Vaccins administrés en Europe
[modifier | modifier le code]| Mode d'action | Date de disponibilité | Conservation | Efficacité | Principaux effets secondaires | Contre-indications | |
|---|---|---|---|---|---|---|
| Pfizer BioNTech Tozinaméran |
ARN messager | −70 °C −20 °C pendant 15 jours ou bien 2 à 8 °C pendant 5 jours |
82 % avec 1 dose après 12 jours 95 % avec 2 doses 100 % pour les 12 à 15 ans[123] |
Fatigue (63 %) Maux de tête (55 %) Douleurs musculaires (38 %) Frissons (31 %), douleurs articulaires (23 %) Fièvre (14 %)[124] |
Fortes allergies[125] | |
| Moderna mRNA-1273 |
ARN messager | 1er trimestre 2021 | −20 °C 1 semaine à +4 °C |
94,1 % avec 2 doses | Fatigue (68 %) Maux de tête (63 %) Douleurs musculaires (59 %) Douleurs articulaires (45 %) Frissons (43 %)[126] |
Déconseillé par la Haute Autorité de santé pour les moins de 30 ans en raison du risque plus élevé de myocardites[127] |
| Johnson & Johnson (Janssen) Ad26.COV2.S |
Vecteur viral | 1er trimestre 2021 | +4 °C | Moyennes avec 1 dose : Monde : 66 % États-Unis : 72 % Formes graves : 85 % Amérique latine : 66 % Afrique du Sud : 57 %[128],[129] 85 % contre formes graves[123] |
Fièvre (9 %)[128] | Interdit dans certains pays pour les patients jeunes (moins de 55 ans en France) |
| AstraZeneca Univ. Oxford AZD1222, alias Vaxzevria ou Covishield |
Vecteur viral | mi- | +4 °C | 62 % à 90 % selon dosage et âge[130] 70 % après une dose 80 % après la 2e dose injectée 12 semaines plus tard[131] 22 % contre variant sud-africain[132] 80 % pour les 65 ans et plus 100 % contre formes graves hospitalisables[123] |
Dans plus de 10 % des cas : Gonflement des ganglions lymphatiques, céphalées, nausées, douleurs musculaires et articulaires, douleur ou ecchymose au site d'injection, fatigue, malaise, état fiévreux, frissons[133] Faibles pour la 2e dose Faibles pour les personnes âgées[134] |
Maladie fébrile aiguë grave, infection aiguë[133] Séropositivité[134] Interdit dans certains pays pour les patients jeunes (moins de 55 ans en France)[135] |
| CureVac CVnCoV alias Zorecimeran |
ARN messager | 2e trimestre 2021 | +4 °C | 47 %[136] | ||
| VidPrevtyn Bêta (en) Sanofi Pasteur GSK |
Protéine recombinante | Fin 2021[137] ou début 2022 (nécessite nouvelle conception)[138]Autorisé en novembre 2022[139] |
+4 °C | Faible chez les plus de 50 ans | ||
| Novavax NVX-CoV2373 |
Protéine recombinante | +4 °C | 89 % en moyenne 95 % contre la souche historique 85 % contre le variant britannique 60 % contre le variant sud-africain. |
Vaccin pédiatrique
[modifier | modifier le code]Le vaccin Pfizer peut être administré à des enfants de 5 à 11 ans. Pour ce public, le dosage est diminué à un tiers de la dose destinée aux adultes et adolescents, ce qui suffit pour induire la réponse immunitaire attendue.
En France, la vaccination des enfants est simplement recommandée aux enfants souffrant de comorbidités ou ayant dans leur entourage des personnes immunodéprimées[140]. Le rappel s'effectue trois semaines apès la primoinjection[141].
Au Canada, la vaccination est recommandée à l'ensemble des enfants de 5 à 11 ans et la dose de rappel est offerte au moins 8 semaines après la primoinjection. Une troisième dose est recommandée pour les enfants ayant une immunodépression modérée à grave[142].
Vaccin bivalent
[modifier | modifier le code]Pfizer-BioNTech et Moderna ont développé des vaccins bivalents qui ciblent, en plus de la souche historique, le variant Omicron BA.1. Ces vaccins ont été autorisés par l'Agence européenne des médicaments (EMA) le . Ils permettent de se protéger contre de nouveaux variants, qui — comme le BA.5.3.1 ou le BA.2.75 — continuent à se développer dans la famille des variants Omicron.
Pfizer propose également un vaccin bivalent qui cible la souche historique et les sous-variants Omicron BA.4 ou BA.5. Il est autorisé par l'EMA le [143].
Efficacité et limites
[modifier | modifier le code]L'efficacité d'un nouveau vaccin est définie par son efficacité lors des essais cliniques. Dans le cas de la Covid-19, l'efficacité est évaluée au regard du risque de contracter une forme modérée ou sévère chez les participants vaccinés dans l'essai, comparé au risque de contracter la maladie chez les participants non vaccinés[144].
Sans vaccin, la réponse immunitaire face au SARS-CoV-2 diffère d'un patient à l'autre : 40 % sont asymptomatiques[145], 40 % sont symptomatiques légers type grippe, 15 % développent une forme modérée pouvant conduire à un Covid long[146], et 5 % risquent une forme sévère pouvant nécessiter des soins de réanimation[147].
Pour un vaccin contre la Covid-19, une efficacité de 0 % signifie que le vaccin ne protège pas plus qu'un placebo. Une efficacité de 50 % signifie qu'il y a deux fois moins de cas de forme modérée ou sévère que chez les individus non vaccinés. L'efficacité d'un vaccin anti-Covid reflète la prévention de la maladie mais n'empêche pas d'être infecté par le virus : les personnes vaccinées peuvent être asymptomatiques et contagieuses. Les vaccins semblent toutefois réduire la transmission de la maladie[148]. La Food and Drug Administration (FDA) des États-Unis et l'Agence européenne des médicaments (AEM) ont fixé un seuil de 50 % comme efficacité requise pour approuver un vaccin Covid-19[149],[150].
Les vaccins anti-Covid actuellement sur le marché ont une durée de protection inconnue. Ces vaccins ont été développés à partir de la souche initiale du virus. Et certains ont déjà une efficacité moindre pour certains variants apparus dès :
- le vaccin Oxford-AstraZeneca était initialement efficace de 71 à 91 % sur les souches d'origine. Face au variant Alpha (dit anglais) son efficacité varie de 42 à 89 %[151]. Face au variant Bêta (dit sud-africain), son efficacité n'offre qu'une «protection minimale»[152]. Le , le ministre de la Santé de l'Afrique du Sud a suspendu le déploiement prévu d'environ 1 million de doses de vaccin[153],[154] ;
- les vaccins à ARN Pfizer et Moderna restent efficace contre le variant Alpha[155],[156]. Il est même suggéré une diminution de 89,4 % du risque d'infections asymptomatiques sept jours après la deuxième dose du vaccin, ce qui suppose alors que la majorité des personnes vaccinées ne seraient à terme pas contagieuses[157]. En revanche contre le variant Bêta, leur activité de neutralisation est réduite pour certains de deux tiers[158], pour d'autres de seulement quelques pour cent[159]. Le variant Gamma (dit brésilien) semble d'après certains échapper partiellement à la vaccination avec le vaccin Pfizer / BioNtech[160], mais pas pour d'autres études[161]. Le , le laboratoire Pfizer annonce que son vaccin est 100 % efficace face au variant Bêta, lors d'une étude portant sur 800 personnes[162]. Selon le ministère israélien de la Santé en , face au variant Delta (dit indien), le vaccin protège dans 93 % des cas des formes sévères, en revanche en ce qui concerne la contamination et le développement de symptômes, le vaccin n'est efficace qu'à 64 %[163],[164] ;
- le vaccin Johnson & Johnson a signalé que son niveau de protection contre l'infection modérée à sévère par la Covid-19 était de 72 % aux États-Unis et de 57 % en Afrique du Sud[165] ;
- le vaccin Novavax est efficace à ~ 96 % contre la souche d'origine, ~ 86 % contre le variant Alpha et ~ 60 % contre le variant Bêta[166].
En , la FDA des États-Unis estime que tous les vaccins autorisés par la FDA restent en l'état efficaces pour se protéger contre les souches circulantes du SARS-CoV-2[167]. Aux États-Unis, en , sur 853 000 personnes hospitalisées pour cause de Covid-19, la quasi-totalité était non vaccinée, moins de 1 200 étant complètement vaccinées, soit environ 0,1 %[168], tandis que concernant les nouveaux variants, ce taux serait, début juillet au Royaume-Uni (où des vaccins sont assez différents), proche de 10 %[169].
En septembre 2021, l'OMS fait une proposition d'interdiction mondiale de 3ème dose jusqu'à la fin de l'année 2021, pour une meilleure répartition des doses à l'échelle mondiale et intensifier les efforts de vaccination dans les pays les moins riches[170].
Une étude publiée en décembre 2021 ayant testé l'efficacité de six vaccins face au variant Omicron observe que seuls 3 patients sur 13 ayant reçu deux doses du BBIBP-CorV de Sinopharm, 1 patient sur 12 ayant reçu le vaccin Janssen et aucun des 11 patients complètement vaccinés avec le Spoutnik V généraient des anticorps neutralisants contre le variant Omicron. Les trois autres vaccins testés, d'AstraZeneca, Moderna et Pfizer–BioNTech, étaient également moins efficaces avec seulement deux doses[171].
Début janvier 2022, des études aux États-Unis montrent que dans la classe d'âge 12-17 ans, avec la dose de rappel du vaccin Pfizer-BioNTtech, le risque d'hospitalisation est 11 fois moins important que chez les non-vaccinés[172].
Limites concernant la contagiosité
[modifier | modifier le code]Une étude réalisée en juillet 2021 indique que, dans un comté du Massachussetts, les trois quarts des personnes infectées lors de divers rassemblements de masse étaient entièrement vaccinées[173]. Cette étude offre des preuves clés renforçant l'hypothèse selon laquelle les personnes vaccinées peuvent propager la variante la plus transmissible en étant facteur d'une flambée estivale d'infections. Ces données, détaillées dans le rapport hebdomadaire du CDC sur la morbidité et la mortalité[174], ont aidé à convaincre les scientifiques du CDC d'inverser les recommandations sur le port du masque et de conseiller aux personnes vaccinées de porter des masques dans les lieux publics intérieurs accueillant de nombreux visiteurs. L'étude suggère que les individus vaccinés portaient autant de virus dans le nez que les individus non vaccinés. Cette étude et d'autres données récentes semblent montrer que les vaccins offrent une protection significative contre les formes graves ou mortelles, mais n'offrent pas de protection totale contre tout risque d'infection[173].
À la mi août 2021, l’augmentation rapide des contaminations en Israël malgré un taux élevé de couverture vaccinale fait dire aux autorités médicales que les vaccins ne sont pas suffisamment efficaces pour contrôler le variant delta[175],[176].
Fin septembre 2021, un article publié dans European Journal of Epidemiology étudie la relation entre le pourcentage de la population entièrement vaccinée et les nouveaux cas de COVID-19 dans 68 pays et dans 2 947 comtés aux États-Unis. Il note l'absence d'association significative entre le pourcentage de la population entièrement vaccinée et les nouveaux cas de COVID-19. Cette situation est illustrée, par exemple, par la comparaison de l'Islande et du Portugal. Ces deux pays ont plus de 75 % de leur population entièrement vaccinée et ont plus de cas de COVID-19 pour 1 million d'habitants que des pays comme le Vietnam et l'Afrique du Sud qui ont environ 10 % de leur population entièrement vaccinée. Israël, avec plus de 60 % de sa population entièrement vaccinée, a enregistré le taux de cas de COVID-19 par million de personnes le plus élevé en août 2021. Même si les vaccinations offrent une protection aux individus contre les hospitalisations graves et les décès, les Centres pour le contrôle et la prévention des maladies (CDC) aux États-Unis signalent une augmentation de 0,01 à 9 % et de 0 à 15,1 % (entre janvier et mai 2021) des taux d'hospitalisations et décès, respectivement, parmi les personnes complètement vaccinées[pas clair]. Les auteurs préconisent de mettre en place d'autres mesures, pharmacologiques et non pharmacologiques, parallèlement aux mesures visant à augmenter les taux de vaccination[177].
En octobre 2021, une étude qui s'est déroulée de septembre 2020 à septembre 2021 portant notamment sur le risque de contagion au sein des ménages montre que les personnes qui ont reçu deux doses de vaccin peuvent être tout aussi contagieuses que celles qui n'ont pas été vaccinées. Le risque qu'ils transmettent le virus à d'autres colocataires non vaccinés est d'environ deux sur cinq, soit 38 %. Ce chiffre tombe à un sur quatre, ou 25 %, si les colocataires sont également complètement vaccinés. En raison du fait que la susceptibilité à l'infection augmente déjà quelques mois après la deuxième dose de vaccin, les auteurs de l'étude recommandent aux personnes éligibles pour les injections de rappel de les recevoir rapidement[178].
Vaccin polyvalent
[modifier | modifier le code]En 2021, une équipe de chercheurs s'est intéressée aux anticorps produits après vaccination par le vaccin Pfizer-BioNTech chez différents publics dont des personnes déjà immunisées contre le SARS-CoV-1 de 2002. Ils se sont rendu compte que des anticorps produits chez ces personnes étaient efficaces contre les deux souches SARS-CoV-1 et SARS-CoV-2 mais aussi contre l'ensemble des sarbécovirus capables de se lier à l'ACE2 humain. Ces anticorps permettent donc une protection contre l'ensemble des variants actuels et pourraient mieux prévenir de futures sarbécoviroses[179],[180].
En effet, les anticorps neutralisants ciblent généralement le site de liaison au récepteur (RBS - Receptor Binding Site) de la spicule, mais la variabilité de cet épitope limite les capacités de neutralisation d'un anticorps. L'anticorps identifié se caractérise par une reconnaissance coordonnée de sites stables hors du RBS par la chaîne lourde et du RBS par la chaîne légère avec un angle de liaison imitant celui du récepteur ACE2. Ainsi la neutralisation est moins dépendante du RBS, très variable.
L'enseignement tiré de cet anticorps pourrait orienter la conception de médicaments ou vaccins contre un spectre plus large de sarbecovirus[180].
Effets indésirables
[modifier | modifier le code]Une étude sur les effets indésirables des vaccins BNT162b2, mRNA-1273 et ChAdOx1 contre la COVID-19, portant sur plus de 99 millions de personnes vaccinées, sélectionnées dans huit pays, a été publiée par Vaccine (groupe Elsevier) et mise en ligne le 12 février 2024. Elle a pour conclusion : « Cette analyse multi-pays a confirmé les signaux de sécurité préétablis pour la myocardite, la péricardite, le syndrome de Guillain-Barré et la thrombose du sinus veineux cérébral. D'autres signaux de sécurité potentiels nécessitant une enquête plus approfondie ont été identifiés[181]. »
Réactions locales
[modifier | modifier le code]Une observation publiée dans le NEJM rapporte une série de douze cas ayant développé une réaction d'hypersensibilité retardée au point d'injection, appelée « bras COVID-19 » (douleur, rougeur indurée jusqu'à plus de 10 cm de diamètre), après avoir reçu le vaccin Moderna MRNA-1273. Cette réaction apparait de quatre à onze jours après vaccination (première dose) et disparait en quatre à cinq jours, elle survient chez huit vaccinés sur mille, et elle ne contre-indique pas la deuxième dose[182].
Allergies
[modifier | modifier le code]En France, le , alors que plus de 500 000 personnes ont reçu une première injection par le vaccin Pfizer, l'Agence nationale de sécurité du médicament (ANSM) relève une centaine de cas « non graves » de réaction allergiques, une vingtaine de cas « graves » et cinq décès parmi les personnes vaccinées sans que des liens de cause à effet aient pu être établis[183]. Les données mises à jour en décembre 2021 aux États-Unis mentionnent que des réactions anaphylactiques sont survenues chez environ 5 personnes par million de personnes vaccinées[184]. L’agence américaine complète l’information en notant que ces effets existent pour tous types de vaccins et sont pris en charge immédiatement par les personnels de santé.
La vaccination avec Pfizer-BioNTech m-RNA SARS-CoV-2 est connue pour provoquer de rares réactions allergiques, allant de l'urticaire à l'anaphylaxie potentiellement mortelle en passant par le gonflement de la langue (1 cas sur 100 000), en particulier chez les personnes présentant des allergies connues[185].
Thromboses, thrombocytopénies
[modifier | modifier le code]Officiellement il n'y a pas de risque accru d'évènements thrombotiques après la vaccination par le mRNA COVID-19 de Pfizer et Moderna[186].
Pourtant le , les autorités danoises suspendent provisoirement et pour une période minimale de deux semaines l'utilisation du vaccin AstraZeneca. La suspension de ce vaccin a été décidée « après des rapports de cas graves de formation de caillots sanguins chez des personnes vaccinées », a expliqué l'Agence nationale danoise de la santé[187].
Le vaccin est abandonné définitivement par le Danemark le 14 avril 2021 et temporairement par la Norvège[188].
Le rapport de l'ANSM de pointe des risques de thrombose liés au vaccin d'AstraZeneca. Il considère cependant que la balance bénéfice-risque reste favorable pour les personnes de plus de 55 ans, mais déconseille son utilisation pour les personnes plus jeunes[189].
L'Italie suspend, le 11 juin 2021, l'utilisation du vaccin AstraZeneca pour les personnes de moins de 60 ans, à la suite du décès d'une jeune femme après avoir reçu ce vaccin. Selon un rapport de l'agence de presse Xinhua, une jeune femme de 18 ans est décédée d'un caillot sanguin le 10 juin après avoir reçu une première dose du vaccin AstraZeneca le . Il est dit que cette personne souffrait de thrombocytopénie auto-immune (faible taux de plaquettes sanguines) et qu'elle suivait une double thérapie hormonale[190].
Après plusieurs plaintes déposées contre AstraZaneca pour des cas de thrombose, plusieurs pays tels que la France, le Canada, l'Allemagne ont suspendu son utilisation en dessous d'un certain âge[191].
Syndromes neurologiques
[modifier | modifier le code]L'EMA (Agence européenne des médicaments) a classé le syndrome de Guillain-Barré comme effet secondaire « très rare » du vaccin contre la Covid-19 du laboratoire américain Johnson & Johnson, Janssen[192], de même ensuite pour le Syndrome de Parsonage-Turner[193].
Syndrome inflammatoire multisystémique
[modifier | modifier le code]Le syndrome inflammatoire multisystémique (SIM) chez l'enfant apparaît dès avril 2020 comme une conséquence possible de la maladie Covid-19, survenant dans une période de 2 à 6 semaines après guérison. En octobre 2020, un syndrome analogue est mis en évidence chez l'adulte[194].
En juillet 2021, le premier cas de SIM chez l'adulte vacciné est observé chez une femme à la suite d'une vaccination avec le vaccin Pfizer ; les symptômes de la patiente ont commencé par un « bras COVID-19 » qui a évolué vers un SIM[185].
Myocardites et péricardites
[modifier | modifier le code]Une augmentation des cas de myocardite et de péricardite a été signalée aux États-Unis et en Israël après la vaccination par le mRNA COVID-19 de Pfizer et Moderna, en particulier chez les adolescents et les jeunes adultes[195],[196].
Le phénomène reste toutefois marginal avec seulement 2,7 cas de myocardites supplémentaires pour 100 000 personnes dans la population vaccinée[197]. En comparaison l'augmentation des cas de myocardites causées par la Covid-19 est bien supérieure avec 16 fois plus de cas de myocardites. Le rapport bénéfice sur risque reste donc favorable à la vaccination[198].
Début octobre, l'Islande suspend l'utilisation du vaccin Moderna « invoquant de légers risques accrus d’inflammations cardiaques »[199]. La Suède[200] et la Finlande suspendent l’emploi du vaccin Moderna pour les moins de 30 ans. Le Danemark et la Norvège déconseillent formellement son usage pour les moins de 18 ans[199].
Début novembre 2021 parait une étude française menée par la structure Epi-Phare, associant l'Assurance maladie et l’Agence du médicament, qui confirme le risque de souffrir d’une myocardite ou d'une péricardite « particulièrement marqué » chez les hommes de 12 à 29 ans, dans la semaine suivant la deuxième injection des vaccins de Pfizer et surtout de Moderna. Chez les hommes de 30 à 50 ans, c'est un cas pour 211 000 doses de Pfizer et un pour 37 700 doses de Moderna[201]. Le , la Haute Autorité de santé déconseille le vaccin de Moderna pour les moins de 30 ans en raison d'un risque plus élevé de myocardite. Ce vaccin qui était suspendu depuis la mi-octobre pour les doses de rappel en France[127] est donc réautorisé pour les personnes de plus de 30 ans, avec une demi-dose (50 µg)[202]. Le , le Conseil scientifique, présidé par Jean-François Delfraissy recommande de revenir à la pleine dose de 100 µg pour mieux lutter contre le variant Omicron[203]. Un communiqué de presse de Moderna du 20 décembre affirme que la dose de 50 µg augmente le niveau des anticorps neutralisants contre le variant Omicron d'un facteur 37, celle à 100 µg d'un facteur 83[204].
Perturbation du cycle menstruel
[modifier | modifier le code]Début août 2021 de nombreux témoignages sont apparus sur les réseaux sociaux concernant un dérèglement du cycle menstruel après l'injection. Pour l'heure aucun lien avec le vaccin n'a été démontré. Il a été rapporté 229 cas avérés après injection du vaccin Pfizer et 36 après injection du vaccin Moderna. L'Agence Nationale de la sécurité médicament a prévu d'effectuer un signalement à l'Agence Européenne des médicaments et a classé ce trouble comme "signal potentiel" après injection du vaccin Pfizer ou Moderna[205],[206],[207],[208].
Selon une étude observationnelle publié en 2022, un saignement anormal serait au moins 30 fois plus probable lors de la 3ème dose que lors de la 1ère, et un cycle menstruel irrégulier 20 fois plus[209]. D'après une autre étude observationnelle, 8% des personnes rapportaient une augmentation de 8 jours ou plus de la durée de leur cycle menstruel, et jusqu'à 12% lorsque la vaccination ne se déroulait pas en phase lutéale[210].
D'après une étude suédoise publié en mai 2023, il existerait une légère augmentation du risque de recours à des soins de santé pour saignement post-ménopausique 8 à 90 jours après la deuxième (rapport de risque 1,14 avec un intervalle de confiance à 95 % 1,03 à 1,25) et la troisième (1,25, avec un intervalle de confiance allant de 1,04 à 1,50) dose de vaccin[211]. Cependant, l'association signalée avec la vaccination est considéré comme faible et le lien de causalité ne peut être établi, de sorte que toute personne présentant des saignements post-ménopausiques après la vaccination devrait toujours être encouragée à consulter un médecin et à faire l'objet d'une recherche de cancer de l'endomètre[212].
Adjuvants
[modifier | modifier le code]En , onze des vaccins candidats en développement clinique utilisent des adjuvants pour améliorer l'immunogénicité. Un adjuvant immunologique est une substance formulée avec un vaccin pour amplifier la réponse immunitaire à un antigène. Les adjuvants utilisés dans la formulation de vaccin anti-covid sont souvent nécessaires pour des vaccins à virus inactivé, des vaccins à base de protéines ou des vaccins à vecteurs recombinants. Les sels d'aluminium, appelés « alun », ont été le premier adjuvant utilisé pour les vaccins homologués et restent l'adjuvant de choix dans environ 80 % des vaccins avec adjuvant. L'adjuvant d'alun initie divers mécanismes moléculaires et cellulaires pour améliorer l'immunogénicité, y compris la libération de cytokines proinflammatoires[213],[214].
Les adjuvants des vaccins anti-covid qui sont impliqués dans des effets secondaires sont : le polyéthylène glycol (PEG 2000) des vaccins à ARN messager et le polysorbate 80 des autres vaccins. Les effets croisés éventuels entre les différents adjuvants sont surveillés[215].
Les adjuvants peuvent induire des effets indésirables, classées en 4 niveaux de gravité : bénin, modéré, sévère, et grave « niveau 4 ». Ces niveaux sont prédéfinis pour chaque type de réaction. De façon générale, le niveau 1 est celui des réactions qui ne gênent pas l'activité quotidienne, le 2 qui la perturbent, le 3 qui l'empêchent et le 4 qui nécessitent une hospitalisation, ou qui entraînent une gêne permanente. Généralement il s'agit de réactions locales (rougeur, gonflement, douleur) et réactions systémiques (fièvre, fatigue, maux de tête…)[216].
La surveillance des effets à plus long terme s'effectue par des études de suivi épidémiologique (avec par exemple des enquêtes de cohorte).
Responsabilité civile
[modifier | modifier le code]Les industriels qui fabriquent, distribuent, administrent ou utilisent des produits médicaux (y compris les vaccins) contre la Covid-19 bénéficient d'une immunité juridique dans différents pays, dont les États-Unis, afin d'échapper à des poursuites judiciaires en cas d'effets secondaires, à l'exclusion des « fautes volontaires »[217],[218]. Le , le secrétaire à la Santé et aux Services sociaux des États-Unis Alex Azar fait adopter une réglementation excluant toute poursuite d'un industriel en cas de négligence concernant les vaccins anti-Covid. Cette disposition réglementaire devrait rester en vigueur aux États-Unis jusqu'au [219].
La société Pfizer a exigé des exonérations de responsabilité de grande envergure et d'autres garanties de la part de pays comme l'Argentine et le Brésil[220],[221].
Dans l'Union européenne, les vaccins contre la Covid-19 sont homologués en vertu d'une autorisation de mise sur le marché (AMM) conditionnelle qui n'exempte pas les fabricants de poursuites en responsabilité civile et administrative[222]. Bien que les contrats d'achat avec les fabricants de vaccins restent secrets, ils semblent ne pas contenir d'exonération de responsabilité, même pour des effets secondaires inconnus au moment de l'homologation[223]. Dans l'Union européenne, des clauses prévoient que, dans certains cas, les États pourront prendre à leur charge les indemnités qui seraient demandées aux entreprises pharmaceutiques en cas d'effets secondaires imprévus[224],[225],[226]. Ces programmes de compensation - prévus pour les vaccinations - existent dans de nombreux pays développés. La France et l'Allemagne disposent de programmes de ce type depuis les années 1960[227].
En France, les victimes d'effets secondaires sont considérées comme des victimes « d'accidents médicaux », lesquelles sont indemnisées par l'État via l'Office national d'indemnisation des accidents médicaux (Oniam). Dans le cas des vaccins, cela ne concerne que les vaccins obligatoires, à savoir exclusivement ceux demandés dans le cadre de l’exercice d'une profession ou formation dans le domaine médical, ainsi que les vaccinations infantiles liées à la scolarisation[228]. Or, concernant les vaccins contre la covid-19, une «clause d’indemnisation» ou «clause de garantie», existe qui a pour effet de «transférer la charge de la réparation de la dette de responsabilité, des assureurs du laboratoire vers les Etats». «L’idée est de transférer la prise en charge financière du risque résultant de la mise sur le marché d’un nouveau médicament, compte tenu des circonstances particulières et de l’urgence liées au Covid-19. C’est la contrepartie d’un approvisionnement prioritaire en vaccins»[229].
En janvier 2022, un avocat marseillais, défendant un "adolescent de 13 ans qui a pratiquement perdu la vue après sa première injection du vaccin de Pfizer" dénonce le contrat où figure "une clause qui dédouane la société Pfizer de toute responsabilité dans le cas de survenance d'effets indésirables potentiels". Il dépose un "recours devant le tribunal administratif de Paris contre le contrat signé entre le fabricant de vaccins Pfizer et l'Etat Français car il précise que cette clause est illégale dans des contrats publics", soulignant cette clause, par laquelle "Pfizer se dégage en réalité de toute garantie minimale d'efficacité du vaccin et de toute nocivité minimale."[230]. En octobre 2022 le même avocat, défendant une autre victime, assigne le fabricant BioNtech, afin "d'engager la responsabilité du producteur du vaccin mais également dans le cadre de cette demande d'expertise d'obtenir des données fournies sur le vaccin ARNmessager par Pfizer pour obtenir l'autorisation sur le vaccin et sa composition exacte"[231].
Effet nocebo
[modifier | modifier le code]Selon une étude (parue le 18 janvier 2022 dans JAMA Network Open), 76 % des effets secondaires rapportés au vaccin (maux de tête, fatigue et douleurs au bras le plus souvent) sont en réalité imputables à l'effet nocebo (peur d'avoir quelque chose). Dans ces cas, ces effets sont associés à tort aux piqûres de vaccin COVID-19, ils ne sont pas dus aux composants du vaccin mais à l'anxiété, l'inquiétude, les attentes et l'attribution erronée d'autres maladies ou sensations au vaccin[232],[233]. Cette étude repose sur douze essais cliniques relatifs à divers vaccins contre la COVID, comparant la prévalence des effets secondaires systémiques tels que la fièvre, les maux de tête ou la fatigue et les effets locaux tels que douleur et gonflement au site d'injection entre les vaccinés et ceux qui ont reçu des injections de solution saline comme placebo[234]. Selon les auteurs, s'il est éthiquement nécessaire d'informer les participants, le public et les patients des effets secondaires de tout traitement, il faudrait aussi informer le public sur cet effet nocebo, qui est l'un des freins au consentement à la vaccination[234].
L'affirmation qui prétend que la vaccination favoriserait le risque d'infection relève d'une analyse biaisée des statistiques[235].
Stratégies de déploiement de vaccins
[modifier | modifier le code]L'optimisation du bénéfice sociétal de la vaccination peut bénéficier d'une stratégie adaptée à l'état de la pandémie, à la démographie d'un pays, à l'âge des receveurs, à la disponibilité des vaccins et au risque individuel de maladie grave: au Royaume-Uni, l'intervalle entre la dose d'amorçage et la dose de rappel[236] a été prolongé pour vacciner le plus de personnes possible le plus tôt possible[237], de nombreux pays commencent à donner un rappel supplémentaire aux immunodéprimés[238],[239] et aux personnes âgées[240], et à la recherche prédit un avantage supplémentaire de la personnalisation de la dose de vaccin dans le contexte de la disponibilité limitée des vaccins lorsqu'une vague de variantes virales préoccupantes frappe un pays[241].
Rappel / troisième dose
[modifier | modifier le code]En Israël, la majorité de la population a reçu une dose de rappel six mois après les deux premières doses[242]. « Une étude a été menée en Israël sur 1,4 million de personnes avec un groupe de patients qui avait reçu la deuxième dose il y a au moins cinq mois et un groupe de patients vacciné une troisième fois. La troisième dose a apporté une efficacité de 93 % contre l'hospitalisation, 92% contre les formes très graves de la maladie et 81 % contre les risques de décès. » Les participants avaient un âge médian de 52 ans (IQR 37-68). La durée médiane de suivi de cette étude observationnelle était de treize jours (IQR 6–21)[243].
Dans 28 pays de l'union européenne et de l'espace économique européen, 12 589 518 personnes de plus de 60 ans ont reçu une dose additionnelle (de rappel) en date du d'après l'ECDC tracker (France > 4M, Allemagne >3M, Espagne >3M, Hongrie > 1M)[244].
En Turquie, onze millions de troisièmes doses ou de doses de rappel ont été administrées.
Dans le Royaume-Uni ou la Grande-Bretagne, le nombre de troisièmes doses ou de dose de rappel est de dix millions[245].
En France, la troisième dose s'effectue avec les deux vaccins à ARN messager (Pfizer-BioNtech ou, pour les plus de 30 ans, Moderna dosé à 50 %). Elle est initialement réservée aux 65 ans et plus, six mois après la deuxième dose (ou 4 semaines après l'injection unique de Janssen). Cet intervalle est ramené à cinq mois avec la cinquième vague[246] puis à quatre mois à compter du pour mieux lutter contre le variant Omicron[247].
Quatrième dose
[modifier | modifier le code]Début 2022, certaines juridictions, comme Israël ou des provinces canadiennes, recommandent une quatrième dose pour les patients immunodéprimés[248],[249],[250]. La France a fait de même, pour les immunodéprimés, puis pour les plus de 60 ans (à partir du 7 avril 2022)[251].
Couverture vaccinale
[modifier | modifier le code]Monde
[modifier | modifier le code]Au 3 août 2021, selon l'OMS, 98 % des pays membres (191 sur 194) ont des vaccinations en cours. À l'échelle mondiale 3,86 milliards de doses ont été administrées, 1,5 milliard de personnes ont reçu au moins une dose, soit 19,4 % de la population mondiale[252].
Au 8 août 2021, selon le site Our World in Data, 4,46 milliards de doses ont été administrées, 30 % de la population mondiale a reçu au moins une dose, et 15,5 % a reçu deux doses. Seuls 1,1 % des personnes vivant en pays à bas revenu ont reçu au moins une dose[253].
Toujours au 8 août, la couverture vaccinale deux doses en Afrique est de 1,9 % et de 11,6 % en Asie. Dans l'Union Européenne, elle est de 51,5 %, et de 49,4 % en France. Les États-Unis sont à 49,8 % et le Canada à 61,8 %[253].
Union européenne et espace économique européen
[modifier | modifier le code]
Au 10 décembre 2021, 71 % de la population de l'espace économique européen comme de l'union européenne a reçu une dose ; deux-tiers de la population a reçu une vaccination normale, soit aux environs de 300 millions de personnes. Ces taux sont de 82 % et 78 % chez les adultes[244].
L'union européenne compte 15 % de doses additionnelles pour 60 millions de personnes dont 14 M en Allemagne, 11 en France, 9,7 en Italie, 5,2 en Espagne, 2,8 en Hongrie, 2,8 en Autriche, 2,4 en Belgique, 2 en Grèce, 1,8 au Portugal, 1,6en Suède, 1,4 en Tchéquie, 1 million en Irlande, 959 mille au Danemark et 852 mille aux Pays-Bas[244].
France
[modifier | modifier le code]
En France, en comparaison avec d'autres pays (Portugal, Espagne où les prises de rendez-vous sont systématiques[254]), on constate en , un taux plus faible de vaccination chez les plus de 70 ans[255]. Ce taux plus faible dans cette classe d'âge laisse envisager une prochaine hausse de la mortalité due à la reprise de l'épidémie[256] par les nouveaux variants (delta, epsilon)[257], alors que 93 % des personnes décédées avaient plus de 65 ans[258]. Cette hausse peut s'extrapoler des nouvelles augmentations du taux d'incidence observée depuis début aux Pays-Bas, en Espagne[259] ou au Royaume-Uni[260]. En France, les taux de vaccination semblent en particulier plus faibles pour les populations ayant le plus faible niveau de vie[261],[262], tandis que début juillet, 15 % des résidents d'Ehpad n'étaient pas vaccinés[263].
Fin juillet 2021, avec 102,66 doses pour 100 habitants en moyenne, l'Union européenne dépasse les États-Unis où le taux de vaccination n'est que de 102,44 doses pour 100 habitants[264].
En France, 92 % des adultes ont reçu au moins une dose et 90 % sont entièrement vaccinés[265]. Cependant les statistiques début décembre 2021 montrent que 83 % des non vaccinés de plus de 70 ans ont plus de 80 ans alors que le risque d'hospitalisation est 6 fois plus élevé en moyenne pour un non vacciné[266]. Cette classe d'âge est moins vaccinée que dans la plupart des pays européens[267],[268],[269]. Alors qu'ils constituent moins de 0,9 % de la population[270], les non vaccinés de plus de 80 ans représentent un faible pourcentage des hospitalisations [271],[272] et au moins 20 % des décès depuis décembre 2021[273],. Pour cette classe d'âge, comme pour les autres, le taux d'incidence a été à peu prés multiplié par 10[274] depuis le début de l'automne 2021. Ainsi, pour les plus de 60 ans non vaccinés le risque de décès est cinq fois plus élevé après 80 ans[275]. La vaccination par une troisième dose pour les plus 80 ans et 6 mois après les deux premières montre à la fois une diminution au moins par 6 du risque de décès[276],[277]et que l'efficacité vaccinale est nettement plus faible au delà de 6 mois pour personnes les plus à risque.
Au 9 décembre 2021, dans la tranche d'âge 70-79 ans, 99 % a reçu au moins une dose et 98 % est entièrement vaccinée[265]. En janvier 2022, à l'AP-HP parmi les patients admis en réanimation et ayant reçu trois doses de vaccin, les immunodéprimés[278],[279] comptent pour 70%, le reste étant principalement des patients ayant des comorbidités sévères[280]. Une étude plus large (Epi-Phare) portant sur 28 millions de personnes ayant eu un schéma vaccinal complet montre que moins de 10 % de celles qui ont été hospitalisées pour la Covid n'avaient aucune comorbidité[281].
Nouvelle vague
[modifier | modifier le code]À la suite d'une nouvelle vague[282],[283],[284], la Haute Autorité de Santé suggérait une obligation vaccinale pour certaines professions ou sous forme de recommandation annuelle pour les plus fragiles comme la grippe saisonnière[285],[286],[287], ainsi que sur les enfants de 2 à 17 ans[288].
Gaspillage
[modifier | modifier le code]En mars 2022 Le Monde révèle que des centaines de millions de doses de vaccin périmées ont été jetées, 73 % du vaccin Pfizer, 18 % d'AstraZeneca (en France, 218 000 doses d'AstraZeneca)[289]. Les vaccins envoyés en Afrique, l'ont été à la limite de péremption et n'ont pas pu, pour une grande part, être utilisés, ainsi en décembre 2021 100 millions de doses ont été refusées par les bénéficiaires du dispositif COVAX[290].
Rumeurs et théories du complot
[modifier | modifier le code]Différentes rumeurs et théories du complot ont circulé à propos des vaccins. Selon un rapport du CCDH (Center for Countering Digital Hate), les deux-tiers des messages antivaccinaux partagés sur Facebook et Twitter, du au , provenaient de 12 personnes, dites « influenceurs » ou célébrités d'internet[291],[292].
Fin est paru un document canadien, dans lequel ont été étudiés les données de dix-sept pays de l’hémisphère sud et de la région équatoriale. Ces données montrent que le vaccin covid est lié à une surmortalité et qu’il n’aurait pas sauvé de vie mais aurait augmenté la mortalité toutes causes dans dix-sept pays[293]. Plusieurs spécialistes de l’Agence France-Presse ont expliqués que « le "document" cité présente des biais méthodologiques et établit sans fondement un lien de causalité entre vaccination et décès, tirant ainsi une conclusion erronée »[294].
Notes et références
[modifier | modifier le code]- (en) Lauren Paremoer et Anne Pollock, « “A passion to change the landscape and drive a renaissance”: The mRNA Hub at Afrigen as decolonial aspiration », sur PubMed Central, (DOI 10.3389/fpubh.2022.1065993).
- Patricia Huon, « Le Cap en quête d’un vaccin 100% africain », sur Libération, .
- « Vaccins à ARN messager : l’Afrique du Sud et l’Allemagne passent la deuxième dans la lutte contre le Covid », sur Libération, .
- Rozenn Le Saint, « Le labo de Bonne-Espérance », XXI, no 63, , p. 36-55
- Gates, « Responding to Covid-19 — A Once-in-a-Century Pandemic? », New England Journal of Medicine, (ISSN 0028-4793, PMID 32109012, DOI 10.1056/nejmp2003762).
- Gates B, « The vaccine race explained: What you need to know about the COVID-19 vaccine » [archive du ], The Gates Notes, (consulté le ).
- Jiang, Lu et Du, « Development of SARS vaccines and therapeutics is still needed », Future Virology, vol. 8, no 1, , p. 1–2 (DOI 10.2217/fvl.12.126).
- « SARS (severe acute respiratory syndrome) » [archive du ], National Health Service, (consulté le ).
- (en) Mahmoud M. Shehata, Mokhtar R. Gomaa, Mohamed A. Ali et Ghazi Kayali, « Middle East respiratory syndrome coronavirus : a comprehensive review », Frontiers of Medicine, vol. 10, no 2, , p. 120–136 (ISSN 2095-0217, DOI 10.1007/s11684-016-0430-6).
- (en) « Porcine Epidemic Diarrhea Vaccine », sur zoetisus.com (consulté le ).
- Cavanagh, « Severe acute respiratory syndrome vaccine development : Experiences of vaccination against avian infectious bronchitis coronavirus », Avian Pathology, vol. 32, no 6, , p. 567–582 (PMID 14676007, DOI 10.1080/03079450310001621198).
- (en) Niels C. Pedersen, « An update on feline infectious peritonitis: Virology and immunopathogenesis », The Veterinary Journal, (lire en ligne, consulté le ).
- Gates B, « Responding to Covid-19: A once-in-a-century pandemic? », The New England Journal of Medicine, vol. 382, no 18, , p. 1677–79 (PMID 32109012, DOI 10.1056/nejmp2003762
 )
)
- Rebecca Weintraub, Prashant Yadav et Seth Berkley, « A COVID-19 vaccine will need equitable, global distribution », Harvard Business Review, (ISSN 0017-8012, lire en ligne [archive du ], consulté le )
- « COVID-19 pandemic reveals the risks of relying on private sector for life-saving vaccines, says expert », CBC Radio, (lire en ligne [archive du ], consulté le )
- Darius D. Ahmed, « Oxford, AstraZeneca COVID-19 deal reinforces 'vaccine sovereignty' » [archive du ], sur Stat, (consulté le ).
- Rob Grenfell et Trevor Drew, « Here's why the WHO says a coronavirus vaccine is 18 months away », sur Business Insider, (consulté le ).
- « Dispositif pour accélérer l'accès aux outils de lutte contre la COVID-19 », sur who.int (consulté le ).
- Corentin Pennarguear, « Vaccination contre le Covid-19 : les secrets de la spectaculaire réussite américaine », L'Express, (lire en ligne, consulté le ).
- « Coronavirus: un vaccin en cours d'élaboration en Russie », sur Le Figaro.fr, (consulté le ).
- (en) « Coronavirus 'may become global emergency' as 18 deaths confirmed », sur Sky News (consulté le ).
- (en) Haroon Siddique, Ben Quinn, Stephanie Convery et Libby Brooks, « China coronavirus: 14 test negative in UK as military doctors sent to Wuhan – as it happened », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- (en) James Gallagher, « Oxford vaccine: How did they make it so quickly? », BBC News, (lire en ligne).
- « Covid-19 : comment le cofondateur de BioNTech a conçu un vaccin en quelques heures », Le Point, (lire en ligne).
- (en) « Coronavirus: 'Significant breakthrough' in race for vaccine made by UK scientists », sur Sky News (consulté le ).
- (en) « Imperial researchers in race to develop a coronavirus vaccine », sur Imperial News (consulté le ).
- (en) Laura Spinney, « When will a coronavirus vaccine be ready? », sur theguardian.com, The Guardian, (consulté en ).
- (en-GB) Hannah Devlin et Ian Sample, « Hopes rise over experimental drug's effectiveness against coronavirus », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- Agence France-Presse, « Vaccin russe annoncé : l'OMS rappelle la nécessité de procédures « rigoureuses » », Sciences et Avenir, (consulté le ) : « Selon l'OMS, un total de 168 candidats vaccins sont en cours de développement dans le monde, dont 28 sont au stade des essais cliniques sur des humains. Parmi ceux-ci, six sont en phase 3, la plus avancée. ».
- Caroline Robin, « Covid-19 : où en sont les vaccins ? », Capital, (lire en ligne)
- « Vaccination contre la Covid-19 : la HAS précise ses recommandations sur la priorisation des publics cibles », sur Haute Autorité de Santé (consulté le ).
- avec agence, « Covid-19. Les anciens malades immunisés « pendant plusieurs années », selon une étude », sur Ouest-France.fr, (consulté le ).
- « Covid-19 - Une étude menée pendant 35 ans sur les coronavirus ne démontre l'acquisition d'aucune immunité de long terme », sur lindependant.fr (consulté le ).
- (en) Arthur W. D. Edridge, Joanna Kaczorowska, Alexis C. R. Hoste et Margreet Bakker, « Seasonal coronavirus protective immunity is short-lasting », Nature Medicine, vol. 26, no 11, , p. 1691–1693 (ISSN 1546-170X, DOI 10.1038/s41591-020-1083-1, lire en ligne, consulté le ).
- Jean-Daniel Lelièvre, « Aspects immunologiques et virologiques de l’infection par le SARS-CoV-2 », Haute Autorité de Santé (HAS) de la République française, (lire en ligne, consulté le ).
- Pascal Meylan, « Immunité cellulaire contre SARS-CoV-2 : substrat de l’immunité croisée entre coronavirus saisonniers et SARS-CoV-2 ? », Rev Med Suisse, (lire en ligne, consulté le ).
- (en) « Antibody-dependent enhancement of coronavirus », International Journal of Infectious Diseases, vol. 100, , p. 483–489 (ISSN 1201-9712, DOI 10.1016/j.ijid.2020.09.015, lire en ligne, consulté le )
- (en) Qidi Wang, « Immunodominant SARS Coronavirus Epitopes in Humans Elicited both Enhancing and Neutralizing Effects on Infection in Non-human Primates », ACS Infect Dis., (lire en ligne, consulté le ).
- (en) Jiong Wang, « The potential for antibody-dependent enhancement of SARS-CoV-2 infection: Translational implications for vaccine development », J Clin Transl Sci., (lire en ligne, consulté le ).
- (en) T. A. Zaichuk, « The Challenges of Vaccine Development against Betacoronaviruses: Antibody Dependent Enhancement and Sendai Virus as a Possible Vaccine Vector », Molecular Biology, (lire en ligne, consulté le ).
- Ann M. Arvin, Katja Fink, Michael A. Schmid et Andrea Cathcart, « A perspective on potential antibody-dependent enhancement of SARS-CoV-2 », Nature, vol. 584, no 7821, , p. 353–363 (ISSN 1476-4687, PMID 32659783, DOI 10.1038/s41586-020-2538-8, lire en ligne, consulté le ).
- « Vaccins contre la COVID19 : doit-on s'inquiéter du risque de maladie aggravée chez les personnes vaccinées ? », sur VIDAL (consulté le ).
- Walter Fierz et Brigitte Walz, « Antibody Dependent Enhancement Due to Original Antigenic Sin and the Development of SARS », Frontiers in Immunology, vol. 11, (ISSN 1664-3224, PMID 32582200, PMCID 7291596, DOI 10.3389/fimmu.2020.01120, lire en ligne, consulté le )
- Paul-Henri Lambert, Donna M. Ambrosino, Svein R. Andersen et Ralph S. Baric, « Consensus summary report for CEPI/BC March 12–13, 2020 meeting : Assessment of risk of disease enhancement with COVID-19 vaccines », Vaccine, (ISSN 0264-410X, PMID 32507409, PMCID 7247514, DOI 10.1016/j.vaccine.2020.05.064, lire en ligne, consulté le ).
- Sanger DE, Kirkpatrick DD, Zimmer C, Thomas K, Wee SL, « With Pressure Growing, Global Race for a Vaccine Intensifies », The New York Times, (ISSN 0362-4331, lire en ligne [archive du ], consulté le )
- Kajal Rawat, Puja Kumari et Lekha Saha, « COVID-19 vaccine : A recent update in pipeline vaccines, their design and development strategies », European Journal of Pharmacology, (ISSN 0014-2999, PMID 33245898, PMCID 7685956, DOI 10.1016/j.ejphar.2020.173751, lire en ligne, consulté le )
- Haque 2020, p. section 6.
- « The ACT-Accelerator: frequently asked questions (FAQ) », World Health Organization (WHO), (consulté le ).
- (en) « COVAX », sur who.int, (consulté le ).
- « Update on WHO Solidarity Trial – Accelerating a safe and effective COVID-19 vaccine » [archive du ], World Health Organization (WHO), (consulté le ) : « It is vital that we evaluate as many vaccines as possible as we cannot predict how many will turn out to be viable. To increase the chances of success (given the high level of attrition during vaccine development), we must test all candidate vaccines until they fail. [The] WHO is working to ensure that all of them have the chance of being tested at the initial stage of development. The results for the efficacy of each vaccine are expected within three to six months and this evidence, combined with data on safety, will inform decisions about whether it can be used on a wider scale. ».
- (en) « CEPI partners with University of Hong Kong to develop COVID-19 vaccine », CEPI, (lire en ligne, consulté le ).
- « Australie: un vaccin anti-Covid stoppé suite à un faux dépistage de VIH », Le Figaro, (lire en ligne, consulté le ).
- Étienne Grass, « Opinion : Vaccins contre le Covid : serons-nous prêts quand il sera prêt ? », Les Échos, (lire en ligne, consulté le ).
- Simpson S, Kaufmann MC, Glozman V, Chakrabarti A, « Disease X: accelerating the development of medical countermeasures for the next pandemic », The Lancet. Infectious Diseases, vol. 20, no 5, , e108–e115 (PMID 32197097, PMCID 7158580, DOI 10.1016/S1473-3099(20)30123-7
 )
)
- (en) « Pfizer, BioNTech report 'strong' immune response in animals to COVID-19 mRNA vaccine candidate », sur FierceBiotech (consulté le ).
- (en) « J&J COVID-19 vaccine candidate protects monkeys after single dose », sur FierceBiotech (consulté le ).
- « Vaccine Safety – Vaccines » [archive du ], sur vaccines.gov, US Department of Health and Human Services (consulté le ).
- « The drug development process » [archive du ], U.S. Food and Drug Administration (FDA), (consulté le ).
- (en-US) Lindsey Bever, « How long will the coronavirus vaccines protect you? Experts weigh in. », Washington Post, (ISSN 0190-8286, lire en ligne, consulté le )
- Ryan Cross, « The tiny tweak behind COVID-19 vaccines », Chemical & Engineering News, vol. 98, no 38, (lire en ligne)
- (en) Imre Berger, « The SARS-CoV-2 spike protein: balancing stability and infectivity », Cell Research, (lire en ligne, consulté le ).
- Jillian Kramer, « Sans ces chercheurs, les premiers vaccins contre la COVID-19 n'existeraient pas », National Geographic, (lire en ligne, consulté le ).
- (en) Jesper Pallesen, « Immunogenicity and structures of a rationally designed prefusion MERS-CoV spike antigen », PNAS, (lire en ligne, consulté le ).
- « Covid-19 : en Corse, Bastia et Porticcio ouvrent la vaccination aux plus de 18 ans », Le Parisien, (lire en ligne)
- Katalin Karikó, la chercheuse hongroise derrière la technologie de l'ARN messager, Euronews, 22 mai 2021
- « Vaccin Covid-19 à ARN messager tozinaméran (Comirnaty° des firmes Pfizer et BioNtech) et les personnes âgées : quelques données, beaucoup d'incertitudes », Prescrire, 23 décembre 2020 (lire en ligne).
- (en) Susie Neilson, « The co-founder of BioNTech designed the coronavirus vaccine it made with Pfizer in just a few hours over a single day », sur BusinessInsider.fr, (consulté le ).
- (en) Podcast, « The Creator of the Record-Setting Covid Vaccine », sur The Journal, (consulté le ).
- « Pfizer and BioNTech announce joint development of a potential COVID-19 vaccine », TechCrunch, (lire en ligne, consulté le ).
- (en) Ugur Sahin, « COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses », Nature, (lire en ligne, consulté le ).
- Philippe Cosentino, « Comprendre le vaccin à ARN BNT162B2 (contre le SARS CoV 2) à l’aide de Geniegen 2 », Académie de Nice, (lire en ligne, consulté le ).
- (en) « Moderna Inc. and the US National Institute of Allergy and Infectious Diseases (NIAID) has initiated clinical trial with an experimental vaccine for COVID19 », Euretina, (consulté le ).
- Mark J. Mulligan, Kirsten E. Lyke, Nicholas Kitchin, Judith Absalon, Alejandra Gurtman, Stephen P. Lockhart, Kathleen Neuzil, Vanessa Raabe, Ruth Bailey, Kena A. Swanson, Ping Li, Kenneth Koury, Warren Kalina, David Cooper, Camila Fonter-Garfias, Pei-Yong Shi, Ozlem Tuereci, Kristin R. Tompkins, Edward E. Walsh, Robert Frenck, Ann R. Falsey, Philip R. Dormitzer, William C. Gruber, Ugur Sahin et Kathrin U. Jansen, « Phase 1/2 Study to Describe the Safety and Immunogenicity of a COVID-19 RNA Vaccine Candidate (BNT162b1) in Adults 18 to 55 Years of Age: Interim Report », medrxiv, (DOI 10.1101/2020.06.30.20142570).
- (en) Rogier W. Sanders, « Virus vaccines: proteins prefer prolines », Cell Host Microbe., (lire en ligne, consulté le ).
- (en) Kirill V. Kalnin, « Immunogenicity and efficacy of mRNA COVID-19 vaccine MRT5500 in preclinical animal models », npj Vaccines, (lire en ligne, consulté le ).
- Zuzanna Szymanska et Ludwig Burger, « CureVac drops COVID-19 vaccine, pins hope on next-generation shots », Reuters, (lire en ligne, consulté le )
- https://www.sanofi.com/fr/nos-vaccins-contre-la-covid-19/vaccin-arn-messager
- https://www.lemonde.fr/planete/article/2022/08/26/covid-19-moderna-porte-plainte-contre-pfizer-biontech-pour-violation-de-brevet-concernant-leur-vaccin_6139119_3244.html
- Nobel de médecine : Katalin Kariko et Drew Weissman récompensés pour le vaccin à ARN messager, france24, 2 octobre 2023
- (en) « Sputnik V vs Sputnik Light, comparing the two Russian Covid-19 vaccines », India Today, (lire en ligne, consulté le ).
- (en) Satoshi Ikegame, « Qualitatively distinct modes of Sputnik V vaccine-neutralization escape by SARS-CoV-2 Spike variants », medRxiv, (lire en ligne, consulté le ).
- « Novel Coronavirus vaccine manufacturing contract signed ».
- Joe Shute, « The vaccine hunters racing to save the world from the coronavirus pandemic », The Telegraph, (lire en ligne, consulté le ).
- « A Study to Evaluate Safety and Immunogenicity of DelNS1-nCoV-RBD LAIV for COVID-19 », sur clinicaltrials.gov, United States National Library of Medicine (consulté le ).
- « Pourquoi l'Institut Pasteur abandonne son vaccin contre le Covid-19 ? », sur Sciences et Avenir (consulté le ).
- (en) Boris Lacarra, « Vaccines: Scientific update on COVID-19 », COREB-ANRS, (lire en ligne, consulté le )
- (en) Sara Reardon, « Cuba’s bet on home-grown COVID vaccines is paying off », Nature, (DOI 10.1038/d41586-021-03470-x, lire en ligne, consulté le )
- « Study of the Safety, Reactogenicity and Immunogenicity of "EpiVacCorona" Vaccine for the Prevention of COVID-19 (EpiVacCorona) », sur ClinicalTrials.gov, United States National Library of Medicine, (consulté le ).
- (ru) Olga Matveeva, « EpiVacCorona : ce que nous savons et ce que nous ne savons pas », trv-science.ru, (lire en ligne, consulté le )
- (en) Szu-Min Hsieh, « Safety and immunogenicity of a Recombinant Stabilized Prefusion SARS-CoV-2 Spike Protein Vaccine (MVC COV1901) Adjuvanted with CpG 1018 and Aluminum Hydroxide in healthy adults: A Phase 1, dose-escalation study », EClinicalMedicine, (lire en ligne, consulté le )
- (en) Jing-Hui Tian, « SARS-CoV-2 spike glycoprotein vaccine candidate NVX-CoV2373 immunogenicity in baboons and protection in mice », Nature Communications, (lire en ligne, consulté le )
- (en) « VAT00008 », Sanofi Pasteur, (lire en ligne, consulté le )
- L'Usine Nouvelle, « Le vaccin de Sanofi et GSK contre le Covid-19 approuvé en Europe pour le rappel », L'Usine nouvelle, (lire en ligne, consulté le )
- « Approved Vaccines », COVID 19 Vaccine Tracker, McGill University, .
- « Mon carnet de vaccination électronique, pour être mieux vacciné, sans défaut ni excès », sur Mon carnet de vaccination électronique, pour être mieux vacciné, sans défaut ni excès (consulté le ).
- « L’OMS valide le vaccin anti-COVID-19 Sinovac pour une utilisation d’urgence et publie des recommandations provisoires », sur who.int (consulté le ).
- « Mon carnet de vaccination électronique, pour être mieux vacciné, sans défaut ni excès », sur Mon carnet de vaccination électronique, pour être mieux vacciné, sans défaut ni excès (consulté le ).
- « Le vaccin COVAXIN (BBV152) de Bharat Biotech contre la COVID-19 : ce qu’il faut savoir », sur who.int (consulté le ).
- Alamy Limited, « CoviVac - vaccin russe COVID-19. Vaccin antiviral inactivé COVID-19 mis au point par le Centre de Chumakov de l'Académie russe des sciences Photo Stock - Alamy », sur alamyimages.fr (consulté le ).
- « Cuba et l'Iran en bonne place dans la course au vaccin anti-Covid », sur Les Echos, (consulté le ).
- « Mon carnet de vaccination électronique, pour être mieux vacciné, sans défaut ni excès », sur Mon carnet de vaccination électronique, pour être mieux vacciné, sans défaut ni excès (consulté le ).
- NICOLAS VIUDEZ, « Covid-19 : Valneva va-t-il finalement parvenir à un accord avec l’Europe pour son vaccin ? », Industrie Pharma, (lire en ligne, consulté le ).
- (en) JV Chamary, « What’s The Difference Between Covid-19 Coronavirus Vaccines? », Forbes, (lire en ligne, consulté le ).
- (en) Michael Gibney, « First in Human: Rising to COVID-19, Codagenix accelerates early-stage vaccine », S&P Global, .
- (en) Chelsea Weidman Burke, « Another COVID-19 Vaccine Joins the Race – This Time, it’s a Live, Weakened Virus », Biospace, (lire en ligne, consulté le ).
- (en) Lauren M. Meyers, « Highly conserved, non-human-like, and cross-reactive SARS-CoV-2 T cell epitopes for COVID-19 vaccine design and validation », NPJ Vaccines., (lire en ligne, consulté le ).
- Julie Kern, « Covid-19 : les variants ne semblent pas échapper aux lymphocytes T cytotoxiques », Futura Santé, (lire en ligne, consulté le ).
- (en) Darrell O. Ricke, « Two Different Antibody-Dependent Enhancement (ADE) Risks for SARS-CoV-2 Antibodies », Front Immunol., (lire en ligne, consulté le ).
- « OSE Immunotherapeutics est autorisé à lancer un essai clinique de Phase 1 avec CoVepiT en Belgique », Orange Actualités, (lire en ligne, consulté le ).
- Christophe Turgis, « Covid-19 : CoVepiT, mis au point à Nantes par Ose Immunotherapeutics sera-t-il le vaccin définitif ? », France3 Pays de la Loire, (lire en ligne, consulté le ).
- (en) V. Gauttier, A. Morello, I. Girault et C. Mary, « Tissue-resident memory CD8 T-cell responses elicited by a single injection of a multi-target COVID-19 vaccine », bioRxiv, , p. 2020.08.14.240093 (DOI 10.1101/2020.08.14.240093, lire en ligne, consulté le )
- « Covid-19 : un vaccin de deuxième génération, plus efficace sur le long terme, sera bientôt produit à Toulouse », sur ladepeche.fr (consulté le ).
- « Coronavirus : bientôt un vaccin français efficace sur tous les variants ? », sur RTL, (consulté le ).
- « Le Matin - Le Brésil lance la production de ButanVac », sur Le Matin (consulté le ).
- Stéphane KORSIA-MEFFRE, « COVID-19 : les promesses de la vaccination intranasale », sur vidal.fr, (consulté le ).
- (en) « AAAS », sur AAAS (consulté le ).
- Sylvie Logean, « Vaccination: un patch à la place d’une aiguille? », Le Temps, (lire en ligne, consulté le ).
- (en) Alice Klein, « Skin patch coated in covid-19 vaccine may work better than injections », sur newscientist.com, New Scientist, (consulté le ).
- « Coronavirus : des expérimentations en cours pour déterminer si le vaccin BCG peut prévenir du Covid-19 », Le Monde, (lire en ligne, consulté le ).
- BFM TV, « Coronavirus: le BCG, vaccin contre la tuberculose, est-il une piste prometteuse contre la pandémie ? », sur BFM TV (consulté le ).
- « COVID-19 : Oui le BCG protège aussi », Santé Log, (lire en ligne, consulté le ).
- Bénédicte Alaniou (avec Erwan Benezet), « Une vaccination tout au long de 2021 », Le Parisien, no 23716, , p. 2 et 3.
- Cassandre Jeannin, « Coronavirus : Pfizer, Moderna, AstraZeneca, Johnson & Johnson... Quelle efficacité ? », RTL, (lire en ligne)
- « Efficacité, effets secondaires : ce que révèle le rapport de l'Agence américaine des médicaments sur le vaccin de Pfizer/BioNTech », .
- « Covid-19 : le vaccin Pfizer-BioNTech déconseillé au Royaume-Uni en cas d’importantes allergies », Le Monde, (lire en ligne).
- (en) Andrew Dunn, « Here are the common side effects you should expect if you get Moderna's coronavirus shot », Business Insider, (lire en ligne).
- « Covid-19 : la Haute Autorité de santé déconseille le recours au vaccin de Moderna pour les moins de 30 ans en raison d'un risque accru de myocardites chez les plus jeunes ».
- Maggie Fox, Amanda Sealy et Michael Nedelman, « Johnson & Johnson Covid-19 vaccine is 66% effective in global trial, but 85% effective against severe disease, company says », CNN Health, (lire en ligne).
- Nicolas Berrod, « Covid-19 : ce qu’il faut savoir du vaccin Johnson & Johnson, autorisé aux États-Unis et bientôt en Europe », Le Parisien, (lire en ligne).
- « Vaccin d'AstraZeneca contre le Covid-19 : ce qu'il faut retenir de la première publication scientifique », Sciences et Avenir, (lire en ligne).
- « Covid-19 : pourquoi le vaccin d’Oxford-AstraZeneca pourrait devenir incontournable », Futura Santé, (lire en ligne).
- Mathilde Boussion, « Covid-19 : l’Afrique du Sud suspend son programme de vaccination avec AstraZeneca », Le Monde, (lire en ligne)
- « COVID-19 Vaccine AstraZeneca ».
- (en) « Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK », sur The Lancet, .
- « Les 65-75 ans avec comorbidités "peuvent se faire vacciner" avec AstraZeneca, annonce Olivier Véran », .
- « Covid-19 : Premiers résultats décevants pour le candidat vaccin de CureVac sur lequel l’UE misait », 20 Minutes, (lire en ligne)
- « Covid-19 : Sanofi France promet un vaccin pour le mois de décembre », sur francetvinfo.fr, (consulté le ).
- Julien Cottineau, « Pourquoi le retard de son vaccin anti-Covid est un contretemps certain pour Sanofi, pas forcément un échec », Usine Nouvelle, (lire en ligne).
- European Medicines Agency, « VidPrevtyn Beta », .
- « Covid-19 : la HAS recommande la vaccination des enfants fragiles », sur Haute Autorité de Santé (consulté le ).
- Conseil d’Orientation de la Stratégie Vaccinale – Avis du 6 décembre 2021 – Vaccination des enfants âgés de 5 à 11 ans
- Société canadienne de pédiatrie, « Le vaccin contre la COVID-19 chez les enfants de cinq à 11 ans | Société canadienne de pédiatrie », sur cps.ca (consulté le ).
- https://www.leparisien.fr/societe/sante/covid-19-le-regulateur-europeen-autorise-un-vaccin-pfizer-contre-les-sous-variants-ba4-et-ba5-domicron-12-09-2022-GE4W7B5ZBNGU7HIIK7ATFFFRUU.php
- (en) Zimmer C, « 2 Companies Say Their Vaccines Are 95% Effective. What Does That Mean? You might assume that 95 out of every 100 people vaccinated will be protected from Covid-19. But that's not how the math works. », The New York Times, (lire en ligne, consulté le )
- (en) Daniel P. Oran, « Prevalence of Asymptomatic SARS-CoV-2 Infection », Annals of Internal Medicine, (lire en ligne, consulté le ).
- Ferney, « Les mystères du Covid long », lacroix.fr, (consulté le ).
- (en) Aaron J. Wilk, « A single-cell atlas of the peripheral immune response in patients with severe COVID-19 », Nat Med., (lire en ligne, consulté le ).
- « Freiner la transmission: de bonnes nouvelles pour les vaccins anti-COVID », sur Le Soleil, (consulté le ).
- « The FDA's cutoff for Covid-19 vaccine effectiveness is 50 percent. What does that mean? », NBC News (consulté le ).
- « EMA sets 50% efficacy goal – with flexibility – for COVID vaccines », sur raps.org (consulté le ).
- Julian Ruiz-Saenz, « Review 2: "Safety and efficacy of the ChAdOx1 nCoV-19 (AZD1222) Covid-19 vaccine against the B.1.351 variant in South Africa" », Rapid Reviews COVID-19, (DOI 10.1162/2e3983f5.b070ec70, lire en ligne, consulté le )
- « South Africa halts AstraZeneca jab over new strain », BBC News, (lire en ligne, consulté le )
- Booth W, Johnson CY, « South Africa suspends Oxford-AstraZeneca vaccine rollout after researchers report 'minimal' protection against coronavirus variant », The Washington Post, London, (lire en ligne, consulté le ) :
« South Africa will suspend use of the coronavirus vaccine being developed by Oxford University and AstraZeneca after researchers found it provided "minimal protection" against mild to moderate coronavirus infections caused by the new variant first detected in that country. »
- « Covid: South Africa halts AstraZeneca vaccine rollout over new variant », BBC News, (lire en ligne, consulté le )
- Muik A, Wallisch AK, Sänger B, Swanson KA, Mühl J, Chen W, Cai H, Maurus D, Sarkar R, Türeci Ö, Dormitzer PR, Şahin U, « Neutralization of SARS-CoV-2 lineage B.1.1.7 pseudovirus by BNT162b2 vaccine-elicited human sera », Science, vol. 371, no 6534, , p. 1152–1153 (PMID 33514629, PMCID 7971771, DOI 10.1126/science.abg6105
 )
)
- Wang P, Nair MS, Liu L, Iketani S, Luo Y, Guo Y, Wang M, Yu J, Zhang B, Kwong PD, Graham BS, Mascola JR, Chang JY, Yin MT, Sobieszczyk M, Kyratsous CA, Shapiro L, Sheng Z, Huang Y, Ho DD, « Antibody Resistance of SARS-CoV-2 Variants B.1.351 and B.1.1.7 », Nature, (PMID 33684923, DOI 10.1038/s41586-021-03398-2
 )
)
- Hugo Jalinière, « Covid-19 : les vaccins empêchent-ils la transmission du virus ? », Sciences et Avenir, (lire en ligne, consulté le ).
- Liu Y, Liu J, Xia H, Zhang X, Fontes-Garfias CR, Swanson KA, Cai H, Sarkar R, Chen W, Cutler M, Cooper D, Weaver SC, Muik A, Sahin U, Jansen KU, Xie X, Dormitzer PR, Shi PY, « Neutralizing Activity of BNT162b2-Elicited Serum - Preliminary Report », The New England Journal of Medicine, (PMID 33596352, DOI 10.1056/nejmc2102017
 )
)
- « Étude ComCor : Analyse de l’efficacité des vaccins à ARN messager sur les variants alpha et bêta du SARS-CoV-2 en France », sur santepubliquefrance.fr (consulté le ).
- Hoffmann M, Arora P, Gross R, Seidel A, Hoernich BF, Hahn AS, Krueger N, Graichen L, Hofmann-Winkler H, Kempf A, Winkler MS, Schulz S, Jaeck HM, Jahrsdoerfer B, Schrezenmeier H, Mueller M, Kleger A, Muench J, Poehlmann S, « 1 SARS-CoV-2 variants B.1.351 and P.1 escape from neutralizing antibodies », Cell, (PMID 33794143, DOI 10.1016/j.cell.2021.03.036
 )
)
- « Variants de SARSCoV2 : quelle efficacité pour les vaccins en vie réelle ? », sur VIDAL (consulté le ).
- « Pfizer and BioNTech Confirm High Efficacy and No Serious Safety Concerns Through Up to Six Months Following Second Dose in Updated Topline Analysis of Landmark COVID-19 Vaccine Study », Pfizer, (consulté le ).
- « Coronavirus: le vaccin Pfizer efficace contre les formes graves mais n'empêche pas la propagation du variant Delta (étude) », i24news, (lire en ligne, consulté le )
- « Vaccins: en Israël, crainte d'une efficacité moindre face au variant Delta (expert) », L'Orient Le Jour, (lire en ligne, consulté le )
- « Johnson & Johnson Announces Single-Shot Janssen COVID-19 Vaccine Candidate Met Primary Endpoints in Interim Analysis of its Phase 3 ENSEMBLE Trial », Johnson & Johnson, (consulté le ).
- Mahase E, « Covid-19: Novavax vaccine efficacy is 86% against UK variant and 60% against South African variant », BMJ, vol. 372, , n296 (PMID 33526412, DOI 10.1136/bmj.n296
 , S2CID 231730012)
, S2CID 231730012)
- Office of the Commissioner, « Coronavirus (COVID-19) Update: FDA Issues Policies to Guide Medical Product Developers Addressing Virus Variants », sur FDA, (consulté le ).
- « Presque tous les décès liés au Covid-19 aux États-Unis touchent des personnes non vaccinées », sur fr.news.yahoo.com (consulté le ).
- « On va (enfin) savoir combien de personnes vaccinées sont hospitalisées », sur 20minutes.fr (consulté le ).
- « L’OMS appelle à une "interdiction mondiale" des vaccins de rappel contre le coronavirus », sur aa.com.tr (consulté le ).
- (en) « Sinopharm, Johnson & Johnson, Sputnik vaccines weaker against omicron – study », Gulf Business, (lire en ligne)
- (en) « Updates to the Evidence to Recommendation Framework: », cdc.gov/coronavirus, , p14/65 (lire en ligne)
- (en) Joel Achenbach, Carolyn Y. Johnson and Yasmeen Abutaleb (2021), Mass. COVID-19 outbreak mostly infected the vaccinated, CDC finds; few needed hospitalization, seattletimes.com, 30 juillet 2021.
- (en-US) Catherine M. Brown, « Outbreak of SARS-CoV-2 Infections, Including COVID-19 Vaccine Breakthrough Infections, Associated with Large Public Gatherings — Barnstable County, Massachusetts, July 2021 », MMWR. Morbidity and Mortality Weekly Report, vol. 70, (ISSN 0149-2195 et 1545-861X, DOI 10.15585/mmwr.mm7031e2, lire en ligne, consulté le )
- (en) « A grim warning from Israel: Vaccination blunts, but does not defeat Delta », sur science.org (consulté le ).
- Zone Santé- ICI.Radio-Canada.ca, « Premiers vaccinés, les Israéliens ont l’un des plus hauts taux d’infection du monde | Coronavirus », sur Radio-Canada.ca (consulté le ).
- (en) Subramanian, S.V., Kumar, A., Increases in COVID-19 are unrelated to levels of vaccination across 68 countries and 2947 counties in the United States, European Journal of Epidemiology, 30 September 2021, doi.org/10.1007/s10654-021-00808-7
- Michelle Roberts, Covid: Double vaccinated can still spread virus at home, bbc.com, 29 octobre 2021
- Nathalie Mayer, « Vers un vaccin universel efficace contre tous les variants de la Covid-19 ? », sur Futura-sciences, (consulté le ).
- (en) Taishi Onodera, « A SARS-CoV-2 Antibody Broadly Neutralizes SARS-related Coronaviruses andVariants by Coordinated Recognition of a Virus Vulnerable Site », Immunity, (DOI 10.1016/j.immuni.2021.08.025, lire en ligne, consulté le ).
- K. Faksova et al., « COVID-19 vaccines and adverse events of special interest: A multinational Global Vaccine Data Network (GVDN) cohort study of 99 million vaccinated individuals », Vaccine, 12 f&vrier 2024, en ligne.
- Kimberly G. Blumenthal, Esther E. Freeman, Rebecca R. Saff et Lacey B. Robinson, « Delayed Large Local Reactions to mRNA-1273 Vaccine against SARS-CoV-2 », The New England Journal of Medicine, , NEJMc2102131 (ISSN 0028-4793, PMID 33657292, PMCID 7944952, DOI 10.1056/NEJMc2102131, lire en ligne, consulté le ).
- Célia Cuordifede, « Allergies, maladies auto-immunes... Quels sont les effets indésirables du vaccin Covid-19 ? », sur marianne.net, (consulté le ).
- (en-US) CDC, « Selected Adverse Events Reported after COVID-19 Vaccination », sur Centers for Disease Control and Prevention, 2020-02-11 updated 2021-28-12 (consulté le ).
- (en) Arvind Nune, Karthikeyan P. Iyengar, Christopher Goddard et Ashar E. Ahmed, « Multisystem inflammatory syndrome in an adult following the SARS-CoV-2 vaccine (MIS-V) », BMJ Case Reports CP, vol. 14, no 7, , e243888 (ISSN 1757-790X, PMID 34326117, DOI 10.1136/bcr-2021-243888, lire en ligne, consulté le )
- « Selected Adverse Events Reported after COVID-19 Vaccination », CDC, .
- source AFP, « La pandémie a un an, le Danemark suspend le vaccin AstraZeneca », sur lalibre.be, (consulté le ).
- « AstraZeneca : comment le Danemark et la Norvège cherchent à écouler leurs doses », Le Monde.fr, (lire en ligne, consulté le )
- Vaccins COVID-19 : l’ANSM publie les synthèses du comité d’experts sur les effets thrombotiques
- (en) « Italian Woman Dies Of Blood Clot After Getting Astrazeneca Vaccine | TheHealthSite.com », sur TheHealthSite, (consulté le ).
- « Vaccin d’AstraZeneca et cas de thrombose : une troisième plainte d’une famille en France après la mort d’un proche », Le Monde.fr, (lire en ligne, consulté le )
- « Covid-19. Le syndrome de Guillain-Barré, effet secondaire « très rare » du vaccin Johnson & Johnson », sur ouest-france.fr, (consulté le ).
- (en) Office of the Commissioner, « Coronavirus (COVID-19) Update: July 13, 2021 », sur FDA, (consulté le ).
- Sapna Bamrah Morris, Noah G. Schwartz, Pragna Patel et Lilian Abbo, « Case Series of Multisystem Inflammatory Syndrome in Adults Associated with SARS-CoV-2 Infection — United Kingdom and United States, March–August 2020 », MMWR. Morbidity and Mortality Weekly Report, vol. 69, no 40, , p. 1450–1456 (ISSN 0149-2195 et 1545-861X, PMID 33031361, PMCID PMC7561225, DOI 10.15585/mmwr.mm6940e1, lire en ligne, consulté le )
- (en-US) « Clinical Considerations: Myocarditis after mRNA COVID-19 Vaccines | CDC », sur cdc.gov, (consulté le ).
- « Pfizer : doit-on s'inquiéter des cas de myocardite ? », sur passeportsante.net, (consulté le ).
- https://www.ouest-france.fr/sante/vaccin/covid-19-a-quoi-sont-dus-les-effets-secondaires-des-vaccins-08ad88d2-0a3d-11ec-89ba-4467016c04ea
- (en) Tegan K. Boehmer et al., « Association Between COVID-19 and Myocarditis Using Hospital-Based Administrative Data — United States, March 2020–January 2021 », sur Centers for Desease Control and Prevention, (consulté le ).
- « Coronavirus – L’Islande suspend l’utilisation du vaccin Moderna jusqu’à nouvel ordre », Le Matin, (ISSN 1018-3736, lire en ligne, consulté le )
- « Le vaccin de Moderna suspendu en Suède: un point sur la situation », Le Temps, (ISSN 1423-3967, lire en ligne, consulté le )
- Nicolas Berrod, « Vaccins Pfizer et Moderna : ce que dit l’étude française qui confirme le risque de myocardite et péricardite », Le Parisien, (lire en ligne, consulté le ).
- « Covid-19 : la HAS précise la place de Spikevax® dans la stratégie vaccinale », sur Haute Autorité de Santé (consulté le ).
- « Vaccination contre le Covid-19 : pourquoi le Conseil scientifique recommande-t-il de doubler le dosage de l'injection de rappel de Moderna ? », sur France Info, (consulté le ).
- (en) « Moderna Announces Preliminary Booster Data and Updates Strategy to Address Omicron Variant », sur investors.modernatx.com, (consulté le ).
- « Covid-19 : ce que l'on sait de l'effet du vaccin sur les cycles menstruels », sur LExpress.fr, (consulté le ).
- « Covid-19 : des troubles menstruels à attribuer à la vaccination ? », sur LCI (consulté le ).
- Madame Figaro, « Covid-19 : ce que l'on sait sur l'influence du vaccin sur les règles », sur Madame Figaro, (consulté le ).
- Lola Dhers, « Covid-19 : le vaccin, perturbateur «potentiel» du cycle menstruel », sur Libération (consulté le ).
- Takahiro Namiki, Shihoko Komine-Aizawa, Kazuhide Takada et Chika Takano, « The association of three doses of the BNT162b2 mRNA vaccine with abnormal bleeding and an irregular menstrual cycle among premenopausal females: A single institute observation study », The Journal of Obstetrics and Gynaecology Research, vol. 48, no 11, , p. 2903–2910 (ISSN 1447-0756, PMID 36319205, PMCID 9538126, DOI 10.1111/jog.15400, lire en ligne, consulté le )
- Borja Velasco-Regulez, Jose L. Fernandez-Marquez, Nerea Luqui et Jesus Cerquides, « Is the phase of the menstrual cycle relevant when getting the covid-19 vaccine? », American Journal of Obstetrics and Gynecology, vol. 227, no 6, , p. 913–915 (ISSN 1097-6868, PMID 35931128, PMCID 9344694, DOI 10.1016/j.ajog.2022.07.052, lire en ligne, consulté le )
- (en) Rickard Ljung, YiYi Xu, Anders Sundström et Susannah Leach, « Association between SARS-CoV-2 vaccination and healthcare contacts for menstrual disturbance and bleeding in women before and after menopause: nationwide, register based cohort study », BMJ, , e074778 (ISSN 1756-1833, DOI 10.1136/bmj-2023-074778, lire en ligne, consulté le )
- (en) Angela Taylor et Victoria Male, « Covid-19 vaccination and postmenopausal bleeding », BMJ, , p1122 (ISSN 1756-1833, DOI 10.1136/bmj.p1122, lire en ligne, consulté le )
- Wang J, Peng Y, Xu H, Cui Z, Williams RO, « The COVID-19 Vaccine Race: Challenges and Opportunities in Vaccine Formulation », AAPS PharmSciTech, vol. 21, no 6, , p. 225 (PMID 32761294, PMCID 7405756, DOI 10.1208/s12249-020-01744-7)
- Tregoning JS, Russell RF, Kinnear E, « Adjuvanted influenza vaccines », Human Vaccines & Immunotherapeutics, vol. 14, no 3, , p. 550–564 (PMID 29232151, PMCID 5861793, DOI 10.1080/21645515.2017.1415684)
- (en) Mariana C. Castells et Elizabeth J. Phillips, « Maintaining Safety with SARS-CoV-2 Vaccines », New England Journal of Medicine, vol. 384, no 7, , p. 643–649 (ISSN 0028-4793 et 1533-4406, PMID 33378605, PMCID PMC7787218, DOI 10.1056/NEJMra2035343, lire en ligne, consulté le ).
- (en-US) « Local Reactions, Systemic Reactions, Adverse Events, and Serious Adverse Events : Pfizer-BioNTech COVID-19 Vaccine », sur cdc.gov, (consulté le ).
- (en) « Notice of Declaration under the Public Readiness and Emergency Preparedness Act for medical countermeasures against COVID-19 », sur phe.gov (consulté le ).
- (en) Ludwig Burger, Pushkala Aripaka, « AstraZeneca to be exempt from coronavirus vaccine liability claims in most countries », Reuters, (lire en ligne, consulté le ).
- Azar A, « Notice of Declaration under the Public Readiness and Emergency Preparedness Act for medical countermeasures against COVID-19 » [archive du ], (consulté le ).
- (en) « How Pfizer tried to bully Argentina and Brazil in exchange for vaccines », sur WIONews.com, New Delhi, (consulté le ).
- (en) Madlen Davies, Ivan Ruiz, Jill Langlois, et Rosa Furneaux, « 'Held to ransom': Pfizer plays hardball in Covid-19 vaccine negotiations with Latin American countries », sur STATnews.com, (consulté le ).
- « Questions and Answers: Conditional Marketing Authorisation of COVID-19 Vaccines in the EU », European Commission, (consulté le ), Question: What is the difference in liability between EU Conditional Marketing Authorisation vs Emergency Use Authorisations?.
- Haahr T, « COVID-19: MEPs want safe vaccines, full transparency and liability for companies », sur European Parliament, (consulté le ), Ms. Gallina stressed negotiations with companies had been difficult but underlined that those companies developing and manufacturing COVID-19 vaccines would indeed be liable according to current laws and if something goes wrong they could be taken to court. This also goes for compensation for hidden defects..
- « La course aux vaccins contre le coronavirus s'intensifie, où en est-on ? », sur RTBF Info, (consulté le ).
- « Vaccins contre le Covid-19 : les labos déchargés de toute responsabilité en cas d'effets secondaires, vraiment ? », sur LCI (consulté le ).
- Lorraine Fournier, « Vaccins contre la Covid : l’UE indemnisera les laboratoires en cas d’effets secondaires inattendus », sur Capital.fr, (consulté le ).
- Clare Looker et Heath Kelly, « No-fault compensation following adverse events attributed to vaccination: a review of international programmes », Bulletin of the World Health Organization, vol. 89, , p. 371-378 (DOI 10.2471/BLT.10.081901, lire en ligne).
- « Accidents vaccinations obligatoires », sur oniam.fr (consulté le ).
- Jérôme Peigné, professeur à l’université Paris-Descartes et membre de l’Institut droit et santé cité dans Libération CheckNews, 2 février 2022, "Est-il vrai que Pfizer bénéficie d’une clause de non-responsabilité en cas d’effets secondaires après vaccination?"[1]
- https://www.midilibre.fr/2022/01/31/pfizer-ne-serait-pas-responsable-des-effets-indesirables-de-son-vaccin-un-avocat-porte-plainte-10079369.php
- https://france3-regions.francetvinfo.fr/provence-alpes-cote-d-azur/bouches-du-rhone/marseille/vaccin-anti-covid-l-avocat-qui-a-attaque-pfizer-attaque-cette-fois-le-fabricant-biontech-depuis-marseille-2628644.html
- « Covid-19 : 76% des effets indésirables des vaccins sont liés à "l'effet nocebo", d'après des chercheurs », sur Franceinfo, (consulté le ).
- DOI 10.1001/jamanetworkopen.2021.43955.
- (en) Natalia Mesa, « “Nocebo” Effect May Cause Majority of COVID-19 Vaccine Symptoms », sur The Scientist Magazine (consulté le ).
- Juliette Mansour, « "La vaccination anti-Covid augmente le risque d'infection" : attention à cette affirmation trompeuse », sur Factuel, (consulté le ).
- Appelée en anglais « booster shot ».
- (en) Chris Baraniuk, « Covid-19: How the UK vaccine rollout delivered success, so far », BMJ, vol. 372, , n421 (ISSN 1756-1833, PMID 33602672, DOI 10.1136/bmj.n421, lire en ligne, consulté le ).
- (en) « France plans rollout of Covid vaccine booster shots – but only for the vulnerable », sur France 24, (consulté le ).
- (en) CDC Advisory Board on Immunization Practices, « Additional Dose of mRNA COVID-19 Vaccine for Patients Who Are Immunocompromised. », (consulté le ).
- (en) « Israel to offer 3rd COVID booster shot to older citizens », sur AP NEWS, (consulté le ).
- (en) Patrick Hunziker, « Personalized-dose Covid-19 vaccination in a wave of virus Variants of Concern: Trading individual efficacy for societal benefit », Precision Nanomedicine, vol. 4, no 3, , p. 805–820 (DOI 10.33218/001c.26101, lire en ligne, consulté le )
- Corentin Pennarguear, « Reportage. En Israël, le pari (payant) de la troisième dose », L'Express, (lire en ligne
 , consulté le ).
, consulté le ).
- (en) Noam Barda et al., Effectiveness of a third dose of the BNT162b2 mRNA COVID-19 vaccine for preventing severe outcomes in Israel: an observational study, thelancet.com, .
- « COVID-19 Vaccine Tracker / European Centre for Disease Prevention and Control », sur europa.eu (consulté le ).
- Vincent Coste, « Covid-19 : le point sur la vaccination en Europe, pays par pays », sur euronews, (consulté le ).
- « Vaccin contre le Covid-19 : qui est concerné par la dose de rappel ? », sur service-public.fr (consulté le ).
- « 3ème dose de vaccin Covid : délais, effets secondaires... Les infos essentielles », sur linternaute.com, (consulté le ).
- Zone International- ICI.Radio-Canada.ca, « Vaccin anti-COVID : Israël commence à administrer une quatrième dose aux immunodéprimés | Coronavirus », sur Radio-Canada.ca (consulté le ).
- Zone Santé- ICI.Radio-Canada.ca, « Le Manitoba recommande une 4e dose de vaccin pour les personnes immunodéprimées | Coronavirus », sur Radio-Canada.ca (consulté le ).
- Agence QMI, « Ontario: 4e dose pour les résidents des établissements de soins de longue durée », sur Le Journal de Montréal (consulté le ).
- « La 4e dose de vaccin anti-Covid désormais ouverte aux plus de 60 ans », sur L'Obs, (consulté le ).
- (en) « Weekly operational update on COVID-19 - 4 August 2021 », sur who.int (consulté le ), p. 12.
- « Coronavirus (COVID-19) Vaccinations », sur ourworldindata.org.
- « Covid-19 : en Espagne, presque 100 % de vaccinés chez les plus de 70 ans », Le Monde.fr, (lire en ligne, consulté le )
- « Vaccination Covid : la France dans le top 10 de l'Union européenne », sur Les Echos, (consulté le ).
- « Coronavirus en Occitanie : En un mois, multiplication par dix des nouvelles hospitalisations », sur fr.news.yahoo.com (consulté le ).
- Santé publique France, « COVID-19 : point épidémiologique du 16 juillet 2021 », sur Santé publique France, (consulté le ).
- « Victimes du Covid en France : nombre, âge, profil, personnalités », sur sante.journaldesfemmes.fr (consulté le ).
- « Pays-Bas: Les derniers chiffres, graphiques et cartes sur l’évolution du coronavirus », sur graphics.reuters.com (consulté le ).
- « Covid-19 : l’Angleterre lève les dernières restrictions malgré la flambée de l’épidémie », Le Monde.fr, (lire en ligne, consulté le )
- Michèle Feuillet, « Dans les quartiers populaires, la vaccination des plus de 75 ans à la traîne », sur Expressions, (consulté le ).
- « Pour briser le plafond de verre vaccinal, Macron préfère convaincre que contraindre mais... », sur Le HuffPost, (consulté le ).
- « Bulletin hebdomadaire », Santé publique France, , p30/36 (lire en ligne).
- (en-US) Elian Peltier, « The European Union pulls ahead of the United States in vaccinations. », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le )
- Marie. A Dicom, « Le tableau de bord de la vaccination – Ministère des Solidarités et de la Santé », sur Ministère des Solidarités et de la Santé, (consulté le ).
- « Covid-19 : les vaccinés sont-ils plus souvent hospitalisés ? », sur Sciences et Avenir, (consulté le ).
- « Pourquoi les plus de 80 ans sont moins vaccinés en France », Les Échos, (consulté le ).
- Ministère des solidarités, « La vaccination des personnes âgées est un objectif collectif », Ministère des solidarités, (lire en ligne)
- « Covid-19. Quel est le ratio de personnes vaccinées à l’hôpital ? Ce que disent les derniers chiffres », Ouest France, (lire en ligne)
- « Covid-19. Combien de personnes âgées ne sont toujours pas vaccinées ? », sur ledauphine.com (consulté le ).
- Drees, « Statistiques issues des données appariées entre SI-VIC, SI-DEP, VAC-SI : amélioration de la méthode et révision des statistiques produites », dress, , p9/14 (lire en ligne)
- Luc Peillon, « Covid-19 : est-il vrai que 80 % des hospitalisations concernent des non-vaccinés, comme le dit Karine Lacombe ? », sur Libération (consulté le ).
- « Covid-19 : résultats par âge issus des appariements entre SI-VIC, SI-DEP et VAC-SI », sur data.drees.solidarites-sante.gouv.fr (consulté le ).
- Santé publique France, « Bulletin hebdo epidémio Covid », v, , p3/9
- Drees, « Le rappel vaccinal réduit fortement le risque de décès lié au Covid-19 », Drees, , graphique 6, p 10/20 (lire en ligne)
- drees, « Le rappel vaccinal réduit fortement le risque de décès lié au Covid-19 », drees, , graphique 5, p 10/20 (lire en ligne)
- « La dose de rappel protège fortement contre les formes symptomatiques et sévères du covid-19 », Drees, , Graphique 3 (lire en ligne)
- CHRU de Lille, « Isolement protecteur : 2017 quelles mesures pour maîtriser le risque infectieux chez la patients immunodéprimés ? », SF2H, , p6/20 (lire en ligne [PDF])
- « Immunodéprimé : c'est quoi, vaccin Covid, comment savoir ? », sur sante.journaldesfemmes.fr (consulté le ).
- « Covid-19 : la majorité des patients en réanimation sont bien non vaccinés », Le Monde.fr, (lire en ligne, consulté le )
- « Risque de COVID-19 sévère après schéma vaccinal complet », sur EPI-PHARE, (consulté le ).
- Caroline Robin, « Grippe : vers une deuxième vague épidémique ? Notre carte de France par département », sur Capital.fr, (consulté le ).
- Propos recueillis par Marie SASIN, « ENTRETIEN. « L’épidémie de Covid-19 n’est pas terminée, il faut rester vigilant » », sur Ouest-France.fr, (consulté le ).
- « Covid-19 en France: le variant recombinant XBB et ses descendants progressent », sur BFMTV (consulté le ).
- « Vaccins contre le Covid-19 : qui sera concerné par les nouvelles recommandations de la Haute Autorité de Santé ? », sur ladepeche.fr (consulté le ).
- « Vaccins contre le Covid-19 : voici les personnes qui pourraient être concernées prochainement », sur CNEWS, (consulté le ).
- « Covid-19 : vers une dose annuelle de vaccin obligatoire ? », sur Marie Claire, (consulté le ).
- « Grippe : ouvrir la vaccination à l’ensemble des enfants âgés de 2 à 17 ans », sur Haute Autorité de Santé (consulté le ).
- « Covid-19 : le grand gaspillage des vaccins périmés », Le Monde.fr, (lire en ligne, consulté le )
- « Santé : le gâchis des vaccins anti-Covid » (consulté le ).
- « La majorité des désinformations sur le Covid proviennent de 12 personnes seulement », sur Heidi.news, .
- (en) Jonathan Jarry, « A Dozen Misguided Influencers », sur mcgill.ca, .
- (en) Correlation Canada, « COVID-19 vaccine-associated mortality in the Southern Hemisphere », sur Correlation Canada, (consulté le ).
- Daniel FUNKE, « Non, un "document" canadien ne permet pas de conclure que la vaccination anti-Covid a provoqué 17 millions de décès », sur AFP, (consulté le ).
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- (en) Dave Cavanagh, « Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus », Avian Pathology, vol. 32, no 6, , p. 567–582 (ISSN 0307-9457 et 1465-3338, DOI 10.1080/03079450310001621198, lire en ligne, consulté le )
- (en) Ewen Callaway, « The race for coronavirus vaccines: a graphical guide », Nature, vol. 580, , p. 576–577 (DOI 10.1038/d41586-020-01221-y, lire en ligne, consulté le )
- Nicolas Martin, « Peut-on vraiment espérer un vaccin ? », sur France Culture (consulté le )
- Katie L. Flanagan, Emma Best, Nigel W. Crawford et Michelle Giles, « Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines », Frontiers in Immunology, vol. 11, (ISSN 1664-3224, PMID 33123165, PMCID 7566192, DOI 10.3389/fimmu.2020.579250, lire en ligne, consulté le )
- (en) Azizul Haque et Anudeep B. Pant, « Efforts at COVID-19 Vaccine Development: Challenges and Successes », Vaccines, vol. 8, no 4, (ISSN 2076-393X, PMID 33291245, DOI 10.3390/vaccines8040739, lire en ligne, consulté le )
Articles connexes
[modifier | modifier le code]- Maladie à coronavirus 2019
- Développement et recherche de médicaments contre la Covid-19
- Efficacité vaccinale
- Pandémie de Covid-19
- SARS-CoV-2
- Test diagnostique du SARS-CoV-2
- Coronavirus lié au syndrome respiratoire aigu sévère
- Vaccination contre la grippe A (H1N1) de 2009
- Maladie respiratoire
- Politique vaccinale contre la Covid-19
- CIGB-66
Liens externes
[modifier | modifier le code]- « European Chamber - COVID-19 Vaccines », sur eucham.info (consulté le )
- (en) « Conclusion on Covid-19 Vaccine AstraZeneca and blood clots », sur European Medicines Agency, (consulté le )
- Liste des vaccins en cours de développement, sur le site de l'OMS
Émissions de radio
[modifier | modifier le code]- Jacques Monin, Cellule investigation, « Commandes de vaccins : dans les coulisses des négociations entre l’Europe et les laboratoires », sur France Inter, Secrets d’info, (consulté le )
- Thomas Piketty, Dominique Seux, « Le vaccin contre la Covid-19 doit-il devenir un bien public mondial ? », sur France Inter, Le débat économique, (consulté le )
Vidéos
[modifier | modifier le code]- Philippe Escande, Marc Bettinelli, Solène Bureau, « Vaccins contre le Covid-19 : pourquoi la France accuse-t-elle un tel retard ? », sur Le Monde, (consulté le )
- Marc Bettinelli, Elsa Longueville, « Les vaccins à ARN messager contre le Covid-19 risquent-ils de modifier votre ADN ? », sur Le Monde, (consulté le )
- Catherine Gale, « Covid-19, la course aux vaccins », sur Arte.tv, (consulté le )
