Tuberculose
| Causes | Mycobacterium tuberculosis |
|---|---|
| Transmission | Transmission aéroportée (d) |
| Incubation min | 3 semaine |
| Incubation max | 8 semaine |
| Symptômes | Toux, hémoptysie, amaigrissement, fièvre, sueurs nocturnes, douleur thoracique, fatigue physiologique (d) et frissonnement (en) |
| Traitement | Médicament antituberculeux (d) |
|---|---|
| Médicament | Cyclosérine, éthionamide, acide para-aminosalycilique, éthambutol, capreomycin, pyrazinamide, isoniazide, isoniazide, viomycin (en), pyrazinamide, cyclosérine, éthionamide et rifampicine |
| Spécialité | Infectiologie et pneumologie |
| CISP-2 | A7O |
|---|---|
| CIM-10 | A15–A19 |
| CIM-9 | 010–018 |
| OMIM | 607948 |
| DiseasesDB | 8515 |
| MedlinePlus | 000077 |
| eMedicine |
230802 emerg/618radio/411 |
| MeSH | D014376 |
| Patient UK | Tuberculosis-pro |
La tuberculose est une maladie infectieuse causée par la bactérie Mycobacterium tuberculosis, qui se transmet par voie aérienne, avec des signes cliniques variables. Elle touche le plus souvent les poumons et peut parfois atteindre d'autres organes.
En 2023, après la pandémie de Covid-19, elle arrive en seconde place des causes de mortalité d'origine infectieuse à l’échelle mondiale, devant le sida[1]. L'Organisation mondiale de la santé (OMS) rapporte à travers son rapport annuel consacré à la tuberculose et sorti en 2015 que 1,5 million de personnes sont mortes de la tuberculose l’année précédente[2]. Parmi les nouveaux cas de tuberculose enregistrés en 2019, 87 % sont survenus dans les trente pays présentant la plus forte charge de la maladie. Deux tiers des cas sont concentrés dans huit pays, avec l’Inde en tête, suivie de l’Indonésie, de la Chine, des Philippines, du Pakistan, du Nigéria, du Bangladesh et de l’Afrique du Sud[3].
Le rapport 2015 de l’OMS rapporte également que la mortalité a baissé de 47 % depuis 1990 grâce en grande partie au développement des traitements ainsi que les modalités de dépistage et de prévention[2]. Cela représente un bon indicateur du progrès réalisé par les systèmes de soins, diagnostiques et thérapeutiques.
Bien que la maladie soit curable, la forte prévalence dans les pays les plus pauvres s’explique par la conjonction d’un ensemble de facteurs : précarité, promiscuité, dénutrition, analphabétisme, infrastructure médicale insuffisante, et surtout épidémie d’infection par le VIH. La prévalence s’accroît en cas de guerre ou de famine[4]. On constate également que l’accès au diagnostic et au traitement pose un problème dans les pays concernés.
Étymologie et abréviations[modifier | modifier le code]
La tuberculose est connue au XVIIe siècle sous le nom de « peste blanche », en écho à la peste noire qui ravage l'Europe à cette époque[5].
Le terme « tuberculose » est utilisé pour la première fois par Johann Lukas Schönlein en 1839[5]. Il est issu du nom de la lésion unitaire de la maladie, le « tubercule », utilisé depuis le XVIIe siècle et formé depuis le latin tuber signifiant « excroissance »[5]. La tuberculose « miliaire » (caractérisée par la dissémination de très nombreux nodules de petite taille dans les deux poumons) tire son nom de la ressemblance de ces nodules avec des grains de millet[5].
Dans les textes consacrés à la tuberculose, ce terme est souvent abrégé en TB[6],[7] ou TBC[8].
Histoire[modifier | modifier le code]
Découvertes de la maladie[modifier | modifier le code]


Maladie au long cours aux manifestations très diverses et affectant aussi bien humains et animaux, la tuberculose est une maladie très ancienne, mais dont l'unité nosologique et l'étiologie ne furent établies qu'au XXe siècle[9].
Une ancienne théorie du XXe siècle postulait que la tuberculose humaine à M. tuberculosis dérivait de la tuberculose bovine à M. bovis, en étant une conséquence de la domestication animale[10].
Les études génomiques indiquent que M. tuberculosis et bovis ont évolué à partir d'un ancêtre commun présent chez les mammifères et qui aurait infecté les hominidés d'Afrique de l'Est, il y a trois millions d'années. Cet ancêtre commun aurait coévolué avec ses hôtes pour aboutir aux mycobactéries humaines et animales actuelles. Les souches modernes pathogènes M. tuberculosis seraient issues d'un clone apparu il y a 15 000 à 20 000 ans, ou 11 000 ans, à partir d'une souche ancestrale de M. tuberculosis[11],[12].
Dès l’Antiquité gréco-romaine, plusieurs auteurs ont décrit une maladie amaigrissante au long cours, dénommée suivant les uns « phtisie » (pour dépérissement), suivant les autres « tabès ». Hippocrate (Ve – IVe siècle av. J.-C.) puis Galien (IIe siècle apr. J.-C.) et Caelius Aurelianus (Ve siècle) en ont dressé les symptômes, notamment pulmonaires[13]. Arétée de Cappadoce (fin du IIe siècle) en a cependant dressé la description la plus détaillée. Ces descriptions initiales n’ont guère subi de modifications notables jusqu’au début du XIXe siècle.
L'origine de la maladie a été débattue durant l'Antiquité, entre héréditaire ou contagieuse[14]. Plus tard, Avicenne (début du XIe siècle) décrit la tuberculose comme uniquement contagieuse[15].
En 1733, Pierre Desault (1675-1737)[16] publie un Essai sur la phtisie[17], de même que François-Emmanuel Fodéré en 1795[18], mais la présentation la plus claire est celle de Gaspard Laurent Bayle avec ses Recherches sur la phtisie pulmonaire publiées en 1810. Bayle la définit moins par son expression clinique que par ses lésions anatomiques dont le tubercule[19],[20].
L'invention du stéthoscope par René Laennec en 1817 facilite le diagnostic de la maladie.
En 1839, le médecin allemand Johann Lukas Schönlein rassemble en une description unifiée les manifestations cliniques disparates de la maladie. Jusqu'alors, « phtisie » et « tuberculose » étaient souvent considérées comme deux entités, voisines mais distinctes[21]. Si Schönlein forge en 1834 le terme de tuberculose (en allemand: Tuberkulose), composé d'un nom latin et d'une terminaison grecque[22], la littérature médicale, tout comme le langage commun, continuera d'utiliser indistinctement, jusqu'au début du XXe siècle, les termes de « phtisie », « consomption » et « tuberculose »[23].
De 1865 à 1868, le médecin Jean-Antoine Villemin reproduit chez les animaux (lapins, cobayes) les lésions de la tuberculose humaine, par inoculation de tissu altéré humain[24]. Il peut ainsi affirmer que cette maladie, de nature jusqu'alors inconnue, est due à un microbe invisible par les moyens techniques de l'époque. Il démontre en 1869 que la transmission se fait par voie aérienne. Ses conclusions se heurtent à une forte opposition, en France notamment. Elles inspirent cependant des travaux comme ceux d'Edwin Klebs[25], Julius Cohnheim, Carl Salomonsen et Tappeiner qui aboutissent à établir de façon indubitable la contagiosité de la maladie[26].
En 1882 enfin, à la suite des travaux de Louis Pasteur, Robert Koch met en évidence le bacille tuberculeux à partir de lésions humaines[24] : le , il communique d'abord à la Société de physiologie de Berlin une note sur la recherche et la culture du bacille de la tuberculose ; le , il publie dans le Berliner klinische Wochenschrift un mémoire sur l'étiologie de la tuberculose qu'il rapporte à un bacille décelé dans les crachats et les lésions tuberculeuses humaines.
Traitements[modifier | modifier le code]
En 1894, Carlo Forlanini met au point la première méthode thérapeutique invasive avec le pneumothorax artificiel intrapleural : par une injection d'air dans la cavité thoracique, entraînant la rétraction du poumon infecté, il obtient une amélioration de la maladie.
En 1940, Selman Waksman découvre l'action antituberculeuse de l'actinomycine puis, en 1942, de la streptothricine. Ces antibiotiques ne peuvent toutefois être utilisés en thérapeutique humaine ou vétérinaire du fait de leur trop grande toxicité.
En 1943, Waksman découvre enfin la streptomycine qui permet, un an plus tard, la première guérison par antibiotique d'un malade gravement atteint de tuberculose[27].
En 1948, a lieu le premier essai clinique randomisé de l'histoire de la médecine : l'épidémiologiste Austin Bradford Hill montre que la streptomycine[Note 1] est plus efficace que la collapsothérapie[28].
Épidémiologie[modifier | modifier le code]
Incidence, prévalence et mortalité[modifier | modifier le code]
Le nombre annuel de nouveaux cas dans le monde, incluant les cas de rechute, était en 2006 d'environ 5,4 millions[29]. Il était en 2018 estimé à dix millions par l'OMS[30]. Environ 58 % des nouveaux cas se trouvent dans la région sud-est de l’Asie et les régions du Pacifique ouest. L'OMS estime par ailleurs qu'environ un quart de la population mondiale est porteuse d’une tuberculose latente, c’est-à-dire est porteuse de la bactérie sans toutefois développer de symptômes et sans être contagieuse. L'organisme estime entre 5 et 15 % le risque pour les porteurs sains de développer la maladie à un moment de leur existence[30].

La prévalence de la tuberculose en 2015 a chuté de 42 % depuis 1990. Elle varie d'un pays à un autre en fonction de plusieurs facteurs dont le niveau socio-économique ; le rapport annuel de l'OMS nous apprend que les pays en développement sont les plus touchés (95 % des cas) et en particulier la région de l’Asie du Sud-Est, avec 44 % des nouveaux cas et l'Afrique (28 % des nouveaux cas mondiaux en 2018). La tuberculose est une cause majeure de mortalité chez les personnes infectées par le VIH. Elle serait responsable de 13 % environ des décès par sida dans le monde[31].
Environ 1,5 million de personnes sont mortes de la tuberculose en 2018, dont une personne sur six était porteuse du VIH.
La tuberculose, sans bénéficier de programmes de prévention et de cure aussi importants, tue ainsi à peu près deux fois plus[32] que le sida, soit environ 4 000 personnes par jour[33].
Paradoxalement cette augmentation du nombre de morts, rapportée à l'explosion démographique mondiale, représente un progrès dans la prévention. Par rapport à 1990, c'est-à-dire sur une période plus longue, la baisse est en effet de 47 %[33]. Autrement dit, une politique de santé efficace montre au terme de quinze années ses limites face à un certain nombre de freins à la prévention. Face aux formes résistantes et multirésistantes de la maladie, la bataille s'achemine en 2015 vers une défaite[33]. Il manque au programme mondial de recherche coopérative les deux tiers de son budget annuel, lequel reste limité à 700 millions de dollars, alors que la dépense mondiale totale consacrée à la prévention, assumée principalement par les États, atteint presque 6 milliards d'euros[33].
En 2014, on estime à 190 000 le nombre de morts par tuberculose résistante[33]. Ils ont été recensés dans 105 des 205 pays transmettant leurs informations à l'OMS[33].
Facteurs de risques[modifier | modifier le code]
La maladie comprend deux étapes : la tuberculose-infection qui peut rester latente et silencieuse, puis la tuberculose-maladie où les troubles se manifestent. Le risque de contracter une tuberculose dépend d'abord du risque d'exposition au bacille (infection), puis du risque de développer la maladie après infection.

- Un premier facteur de risque est le contact étroit avec un cas contagieux ; la promiscuité respiratoire (familles nombreuses sous un même toit, personnes ayant vécu ou vivant dans des pays de forte endémie tuberculeuse, conditions de logement, populations pénitentiaires, etc.) est généralement en cause.
- Un second risque est lié à l'état de santé du sujet infecté : malnutrition (carence en vitamines[34],[35] et en protéines), enfant de moins de 5 ans, personnes âgées, diabétique[36], personnes en situation de déficience immunitaire (par infection VIH ou sous traitement immunosuppresseur[37]), etc.
- Enfin la promiscuité et la pauvreté sont deux facteurs historiques connus : au cours du XVIIIe siècle, près d'une personne sur quatre était atteinte de tuberculose en Occident. L'épidémie atteint son apogée au XIXe siècle au cours duquel près de dix millions de personnes sont victimes de la tuberculose. Environ un tiers des décès enregistrés aux États-Unis et en Europe sont causés par cette « peste blanche »[38].
La révolution industrielle provoque en effet une augmentation de la population et, conséquemment une recrudescence des maladies contagieuses. De plus, les conditions de travail du XIXe siècle européen, qui subsistent encore dans plusieurs pays, ont été et sont des facteurs aggravants : les travaux pénibles, de longues journées de travail, des ateliers surpeuplés, l'atmosphère empoussiérée (poussières textiles, métalliques, minérales, organiques, etc.), ainsi que les conditions de logements (promiscuité, manque d'air et de soleil, maisons « meurtrières »)[Note 2], la malnutrition, le tabagisme et les mauvaises mœurs (crachats, saleté, manquement aux règles d'hygiène corporelle)[39] ; tous ces facteurs peuvent se combiner pour favoriser ou aggraver l'infection tuberculeuse[40].
Depuis René Dubos, et la parution de son ouvrage The White plague : tuberculosis, man and society (1952), il est reconnu que la tuberculose est le type même d'une maladie sociale, touchant d'abord des populations pauvres et vulnérables, en rapport direct avec des conditions socio-économiques (nutritionnelles, de logement et de travail). Enfin les populations à l'écart des structures de diagnostics et de soins, comme les sans domicile fixe ou les migrants clandestins, sont les premières victimes de la tuberculose. La tuberculose est un indicateur de la précarité sociale, et du niveau des systèmes de santé (dépistage, diagnostic et soin)[37]. - Le diabète semble être un facteur favorisant : alors que cette maladie est en voie de « pandémisation » dans les pays riches notamment, mais de plus en plus aussi dans les pays émergents et pauvres où d'après l’OMS en 2013, plus de 80 % des 3,4 millions de décès annuels par diabète sont survenus. Des études trouvent une incidence de tuberculose deux à huit fois plus élevée chez le diabétique par rapport à la population moyenne[41],[42],[43] ce qui ferait du diabète un facteur de risque. En outre, le diabète modifie la présentation clinique de la tuberculose (âge d’apparition et poids corporel plus élevés) ; il pourrait modifier la réponse aux médicaments antituberculeux (temps de « négativation » bactériologique plus long) et il pourrait aggraver la transmission et la mortalité par tuberculose[44].
- Le fait de vivre en Asie est un facteur prédisposant : la plupart des nouveaux cas (49 %) se situent dans les zones peuplées d'Asie : Bangladesh, Pakistan, Inde, Chine et Indonésie. Il existe une augmentation dans les pays de l'Europe de l'Est dont la Russie[45] et l'Ukraine[46]. La croissance reste très forte en Afrique, avec près de 13 % contre moins de 1 % dans les pays asiatiques.
- Dans le cadre de la prise de drogues, l'injection par voie intraveineuse et surtout chez les porteurs du virus de l'immunodéficience humaine (VIH), aggrave son incidence, qui atteint ici 12,5 %, soit environ 1,2 million de personnes en 2014[33].
Cette infection touche l'adulte jeune, et les hommes sont près de deux fois plus atteints que les femmes. La malnutrition et les intoxications médicamenteuses sont des causes reconnues de l'augmentation du nombre de cas.
Après l’âge de 60 ans, des personnes ayant été contaminées dans leur enfance ou leur adolescence (par M. tuberculosis, ou M. bovis), peuvent dans certains cas déclarer une tuberculose évolutive.
Clinique[modifier | modifier le code]
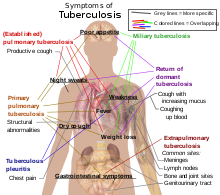
La tuberculose peut revêtir différentes formes selon la localisation du foyer infectieux. La tuberculose pulmonaire est la forme la plus fréquente et la source essentielle de la contagion. À partir du poumon, le bacille peut diffuser dans l'organisme et causer d'autres atteintes, ganglionnaires, ostéoarticulaires et urogénitales notamment. Les formes les plus létales sont les formes diffuses (miliaires) et méningées.
Primo-infection[modifier | modifier le code]
La primo-infection regroupe les manifestations cliniques, radiologiques et bactériologiques, survenant après un premier contact infectant avec le bacille de Koch (BK). Elle est souvent asymptomatique chez l’adulte[47] mais la littérature rapporte qu’elle peut être symptomatique chez les enfants à 90 % associant les signes généraux ; les symptômes sont dominés par la toux chez plus de la moitié des cas, les douleurs thoraciques chez 20 % des cas, et la dyspnée[48]. L’examen clinique met en évidence des adénopathies périphériques chez 37,5 % et la confirmation du diagnostic se fait à travers l’intradermoréaction à tuberculine (IDR)[48].
Tuberculose pulmonaire[modifier | modifier le code]

La tuberculose pulmonaire est la forme la plus fréquente et présente plus de 85 % des cas[49],[50]. Le tableau le plus classique et le plus fréquent chez les tuberculeux pulmonaires laisse définir le syndrome d’imprégnation tuberculeuse : fièvre, sueur nocturne, amaigrissement, anorexie[50].
Le dépistage de la tuberculose pulmonaire se fait généralement au cours de consultation habituelle par un interrogatoire auprès des malades qui présentent principalement des signes d’imprégnation ainsi que des symptômes respiratoires persistant pendant plus de deux semaines[51]. Cependant, le tableau symptomatique peut être polymorphe, représentatif dans son ensemble de toute la séméiologie bronchopulmonaire.
Clinique de la tuberculose :
| Symptômes | Primo infection | TBC pulmonaire |
| toux | +++ | |
| fatigue / malaise | + | ++ |
| perte pondérale | + | ++ |
| sudations nocturnes | ++ | |
| hémoptysies | + | |
| douleurs thoraciques | + | + |
| Signes cliniques | ||
| fièvre | + | ++ |
| râles à l’auscultation | + |
+++ = courant (> 50 %), ++ occasionnel, + rare
Le diagnostic repose sur les différents éléments allant de l’interrogatoire à l’examen physique et clinique. L’interrogatoire doit enquêter sur la notion de contagion en tenant compte de la physiopathologie de la maladie et les modalités du développement de la lésion. L’installation de la maladie peut se faire progressivement en s’étalant sur plusieurs semaines et l’examen clinique se révèle utile à la recherche des éléments d’orientation vers l’affirmation du diagnostic. Quant à l’examen clinique, les éléments qui peuvent faire suspecter la TBC sont nombreux[47] :
- signes généraux : signes d’imprégnation tuberculeuse, fébricule, sueurs nocturnes et aménorrhée chez la femme ;
- signes fonctionnels apparents au début de l’affection et sont durables à plus de 15 jours. ils sont marqués principalement par les signes suivants : toux productive, expectoration purulente, dyspnée ;
- l’examen physique relève à son tour à travers l’auscultation et la palpation de la poitrine des râles crépitants mais il se peut qu’il s’avère neutre et sans particularité[50].
En revanche quand il s’agit d’une installation brutale, l’hémoptysie et crachats sanguins sont plus observés chez les personnes atteintes ainsi que l’épanchement pleural est observé que ce soit aérien ou liquidien[52].
Le clinicien devant un contexte de symptomatologie pulmonaire qui persiste au-delà de 15 jours, et en tenant également compte de la prévalence dans la région en cause, est en mesure de suspecter la tuberculose et procède à la procédure de l’affirmation de diagnostic. Cela doit conduire vers des examens complémentaires : radiographie du thorax et l’examen cytobactériologique des crachats[53]. Le diagnostic définitif est fondé sur l’isolement ou la culture du bacille, habituellement à partir des crachats.
Les cavernes sont une complication fréquente de la tuberculose pulmonaire[54]. On appelle caverne une cavité creusée au sein du parenchyme pulmonaire[55]. Les bacilles tuberculeux se développent initialement dans le poumon sous forme de nodules, appelés granulomes, qui sont peu à peu entourés de lymphocytes et de macrophages destinés à contenir l'infection[54]. Un granulome peut évoluer soit vers la disparition sans cicatrice, soit vers la caverne, sans que les mécanismes sous-jacents soient compris en totalité[55]. Les vestiges de macrophages détruits occupent le centre du granulome et forment la majeure partie de la nécrose caséeuse[55]. Chez certains patients, cette nécrose caséeuse se liquéfie et devient un milieu de culture adapté aux bacilles, qui prolifèrent. Des enzymes protéolytiques érodent alors la capsule fibreuse située en périphérie du granulome, et son centre liquide peut alors se vider peu à peu[55]. Lorsqu'une caverne tuberculeuse arrive en communication avec l'arbre bronchique, la dissémination des bacilles dans l'air expiré augmente la contagiosité[54],[56]. Par ailleurs, la quantité importante de bacilles contenus dans les cavernes favorise le développement de résistances aux anti-tuberculeux[56].
Tuberculose ganglionnaire[modifier | modifier le code]


Elle est très fréquente au même titre que la tuberculose pulmonaire. Les adénopathies sont souvent médiastinales et hilaires[53]. Elles sont en général de taille modérée, mais peuvent parfois obstruer une bronche. En périphérie les adénopathies sont surtout cervicales, puis axillaires et inguinales. Initialement fermes et mobiles, les ganglions sont ensuite fixés par une péri-adénite avec peu de signes inflammatoires[57]. Les ganglions sont indolores à la palpation. Les fistules externes à bord irrégulier laissent ensuite sourdre (suinter) un pus caséeux qui se recouvre de croûtes. C'est cette maladie, nommée scrofule ou écrouelles que les rois de France et d'Angleterre étaient censés guérir par simple toucher. La croyance et les cérémonies qui y étaient attachées ont perduré jusqu'au XIXe siècle.
Le diagnostic repose sur l’examen bactériologique du liquide de ponction et l’examen anatomopathologique à la suite de la biopsie ganglionnaire[57]. L’apparition des signes généraux doivent encourager un traitement sans attendre le diagnostic microbiologique dans ces pays.
Selon la même étude[57] faite en Tunisie (une région endémique de la tuberculose) qui a porté sur cinquante patients atteints de la tuberculose ganglionnaire, il a été remarqué que les adénopathies étaient principalement cervicales (75 %), puis médiastinales (21 %), sus-claviculaires (9,4 %) et axillaires (6,3 %). Les tailles ont été retrouvées surtout entre 3 et 5 cm. Les adénopathies étaient inflammatoires ou fermes. Dans 21,9 % des cas, la tuberculose ganglionnaire était associée à d’autres types de tuberculose. La bactériologie a permis le diagnostic chez 65,6 % des cas.
Tuberculose urogénitale[modifier | modifier le code]
La tuberculose urogénitale est responsable de 14 à 41 % des atteintes extrapulmonaires[58]. Le rein est très souvent infecté lors d’une tuberculose miliaire le plus souvent au niveau du cortex rénal. Cliniquement, les lésions sont très souvent unilatérales. Au niveau du rein, elles sont préférentiellement situées dans la médullaire où elles vont produire des granulomes épithélioïdes avec une nécrose caséeuse (lésion spécifique à la tuberculose) aboutissant à une destruction tissulaire.
L’atteinte se manifeste par des symptômes liés à la distension rénale en cas d’atteinte urétérale. Elle peut se manifester cliniquement par une cystite banale. Or, le diagnostic est évoqué devant une pyurie sans germe. En cas de lésion génitale, les lésions touchent fréquemment l’épididyme se traduisant par une épididymite.
Le clinicien oriente vers l’examen d'urine (recherche de bacille de Koch) des urines afin de confirmer le diagnostic. L'examen cytobactériologique des urines permet d'évaluer une partie des conséquences. Environ 50 à 75 % des hommes avec une atteinte génitale ont des anomalies radiologiques au niveau de l’appareil urinaire. Un bilan radiologique de tout l’appareil urinaire (uroscanner, à défaut une urographie intraveineuse) est toujours indiqué ainsi qu’une radiographie du thorax à la recherche d’une localisation pulmonaire[59].
Tuberculose ostéoarticulaire[modifier | modifier le code]
La forme la plus fréquente et la plus redoutable est la tuberculose rachidienne dite mal de Pott. La localisation au niveau de l’espace intervertébral (mal de Pott) est la plus fréquente des localisations ostéoarticulaires et la plus grave car elle siège au voisinage des structures nerveuses importantes. Elle représente 10 % des cas de tuberculose[60].
Selon une étude tunisienne[61] qui a porté sur 180 cas de tuberculose rachidienne, il a été remarqué que l'état général a été altéré chez 80 patients (44 %). Une fièvre modérée allant de 37,8 °C à 38,5 °C a été notée chez 55 patients (30 %) et une adénopathie satellite dans 40 cas (27 %). Selon la même étude, l'intradermoréaction à la tuberculine pratiquée 120 fois a été positive dans 85 % des cas.

La phase initiale de l’infection est marquée par l’atteinte des espaces intervertébraux rachidiens, et l’atteinte de la synoviale, où se développe la lésion tuberculeuse laissant apparaître une symptomatologie plus ou moins spécifique marquée par : des douleurs au niveau du rachis de type mécanique ainsi qu’un syndrome infectieux modéré et des signes de déficit neurologique s’installant progressivement[62]. Si elle est dépistée et traitée à ce stade d’invasion, l’évolution se fait vers la guérison et sans destruction.
En revanche et en absence de traitement, l’évolution se fait lentement à partir d’un état stable vers la phase d’état où la destruction est irréversible. Sur le plan tissulaire, on remarque une lésion spécifique à la tuberculose : la nécrose caséeuse développée dans l’espace intravertébral et laissant des séquelles majeures et irréversibles. La symptomatologie est variée et marquée par des douleurs intenses avec une tuméfaction de la région affectée et adénopathie du site drainant la région ainsi que les troubles neurologiques.
Le clinicien oriente vers les examens complémentaires afin d’affirmer son diagnostic et cela à travers la radiologie qui fournit des images plus ou moins spécifiques et la mise en évidence du BK via l’examen bactériologique et anatomopathologique à la suite d'une ponction/biopsie réalisée sur le site de l’infection.
Méningite tuberculeuse[modifier | modifier le code]
Une forme extrêmement rare, mais très redoutable. Le tableau clinique et radiologique sont atypiques[63]. Elle touche les enfants et les adultes jeunes. Dans sa forme typique la méningite tuberculeuse associe un syndrome méningé et un syndrome infectieux progressif et peu intense : fièvre au long cours, otalgie, vomissement. Le syndrome méningé est caractérisé par les trois symptômes : la raideur de la nuque, les nausées et les vomissements.
À la suite de la pratique de la PL, le LCR est classiquement clair, avec une lymphocytose, une hyperalbuminorachie et une hypoglucorachie. Sa gravité nécessite la mise en route rapide du traitement.
Des séquelles fonctionnelles s’observent dans plus d’un tiers des cas : hémiplégie, paralysie des paires crâniennes, troubles sensoriels, calcifications intracrâniennes, etc.
Tuberculose cutanée[modifier | modifier le code]
Rare en Occident où elle ne représente que 1,5 à 2,1 % de l'ensemble des formes que peut prendre la tuberculose, la forme cutanée de la tuberculose est cependant endémique en région tropicale et au Maghreb[64]. Elle adopte alors des formes cliniques variées : chancre tuberculeux, tuberculose cutanée miliaire, lupus tuberculeux, scrofulodermes ou gommes tuberculeuses, ou encore tuberculose péri-orificielle[64].
La classification de Beyt de 1980[65], basée sur des critères physiopathologiques, est aujourd'hui la référence[66] pour distinguer les diverses formes :
- tuberculose d’inoculation (source exogène) : chancre tuberculeux, tuberculose verruqueuse, certains lupus vulgaris ;
- tuberculose secondaire (source endogène) : scrofuloderme (par contiguïté), tuberculose orificielle (auto-inoculation) ;
- tuberculose hématogène : certains lupus vulgaris, tuberculose miliaire aiguë, gomme tuberculeuse ;
- tuberculose éruptive (tuberculides) : lichen scrofulosorum, tuberculose papulonécrotiques, érythème induré de Bazin, vascularite nodulaire.
Modalités diagnostiques[modifier | modifier le code]
Intradermoréaction à tuberculine (IDR)[modifier | modifier le code]

La réaction cutanée tuberculinique met en évidence la présence d’une hypersensibilité retardée induite par les antigènes mycobactériens (Mycobacterium tuberculosis, BCG, certaines mycobactéries atypiques). La réaction cutanée à la tuberculine est explorée par IDR. Cette IDR est réalisée par une injection dans le derme à la face antérieure de l'avant-bras d'un volume exact de 0,1 ml de la solution liquide de tuberculine. La validité d'interprétation du test tuberculinique nécessite une technique parfaite[67].
La tuberculine provoque des indurations au niveau du site de l’injection. Une réaction est jugée positive lorsque le diamètre d'induration est >= à 5 mm[68]. En absence de vaccination, une induration supérieure à 8 mm doit témoigner et attester une primo-infection tuberculeuse. Si l'induration est supérieure à 25 mm, la tuberculose maladie doit être évoquée[68]. Cette pratique se révèle outil dans le diagnostic des TBC ganglionnaires (positive chez 100 %), et la phase de la primo-infection de la tuberculose[48].
Diagnostic bactériologique[modifier | modifier le code]
Après avoir extrait des expectorations ou du liquide de ponction auprès du malade, l’échantillon du prélèvement fait l’objet d’un examen cytobactériologique à travers les différentes techniques[50] :
- coloration de Ziehl-Neelsen (ZN) : La méthode de ZN, datant de 1880 est la méthode la plus fréquemment utilisée[69]. C’est un examen rapide, simple, et très spécifique (> 95 % dans les pays à haute prévalence). Elle permet de mettre en évidence le caractère acidoalcoolorésistant des bactéries. L'observation et l’identification des bactéries s'effectuent à l’aide du microscope optique, avec objectif à immersion. Les mycobactéries apparaissent alors comme des bacilles rouges sur fond bleu-gris ;
- microscopie à fluorescence (MF) : après coloration à l’auramine elle augmente de 10 % la sensibilité de la détection au microscope par rapport à la méthode classique de ZN[70]. Cet examen reposant sur le microscope à fluorescence, n’est pas utilisé dans tous les laboratoires des pays du sud en raison de son cout élevé[70] ;
- examen de culture : C’est l’examen de référence des TBC utilisant traditionnellement un milieu solide Löwenstein-Jensen riche en protéines et ressources énergétiques nécessaires à la prolifération de la bactérie[70]. En comparaison avec la méthode classique sur milieu solide, l’utilisation des milieux liquides augmente la sensibilité de plus de 10 % tout en réduisant le délai de la culture de six à deux semaines. Les performances se révèlent excellentes avec une sensibilité de 99 % et une spécificité de 100 %[71].
La spécificité des modalités de diagnostic a fait l’objet de plusieurs études d’évaluation d’efficacité. Une étude rapporte que la méthode de coloration Zde N et la MF bénéficient d’une spécificité élevée allant jusqu’à 98 % dans le cas de la MF. Une étude montre également que la concordance diagnostique entre la MF et la culture (souvent prise comme référence) est largement supérieure à celle qui existe entre la méthode de ZN et la culture (95,1 % contre 69,6 %)[70].
Les méthodes de ZN et l’examen de culture apportent une grande valeur diagnostique vu leur caractère économique en termes de cout. Ils sont des examens peu couteux et accessibles et fortement recommandés dans le diagnostic de la TBC. Ils se révèlent très pratiques et efficaces dans le diagnostic des tuberculoses ganglionnaire, pulmonaire, méningée et ostéoarticulaire[69].
Diagnostic anatomopathologique[modifier | modifier le code]
L’examen anatomopathologique se pratique sur l’échantillon résultant de la biopsie. Il met en évidence une lésion spécifique à la tuberculose dite : granulome épitheloide gigantocellulaire à centre caséeux nécrosé. Le terme de granulome désigne l’ensemble des éléments cellulaires présents dans un foyer inflammatoire. Le foyer tuberculeux est entouré d’une grande cellule polynucléaire résultant de la fusion des macrophages tel que mentionné dans la physiopathologie de la maladie[53].

Diagnostic moléculaire[modifier | modifier le code]
Met en évidence la présence de l’ADN du germe dans l’échantillon issu de la ponction ou des crachats en cas de TBC pulmonaire[53]. La technique de l’art et telle que recommandée par l’OMS est réalisée à l’aide d’un dispositif nommé GeneXpert et l’utilisation du test rapide Xpert MTB/RIF[72]. La technique s’appuie sur l’amplification de l’ADN germique[73] via la cartouche Xpert MTB/RIF riche en ADN polymérase (enzyme intervenant dans la réplication de l’ADN au cours du cycle cellulaire) et les ressources énergétiques et protéiques nécessaires à cette procédure. Son utilisation a largement augmenté depuis 2010, date à laquelle l’OMS a recommandé pour la première fois son utilisation. Cela comporte un avantage majeur portant sur son efficacité et son faible coût[74].
De nombreuses études[75] ont évalué l’efficacité de la cartouche dans la mise en évidence des BK et BK résistants à la Rifampicine ; il est rapporté par une méta-analyse compilant plusieurs études[75] que le test MTB/RIF est spécifique à plus de 90 % et présente un outil important facilitant l’accès à un diagnostic précis à faible cout. La mise en évidence des BK est établie dans 2 heures après le test[76].
Diagnostic radiologique[modifier | modifier le code]
La modalité de diagnostic radiologique se révèle très utile et indiquée comme étant un examen de première intention en cas de tuberculose pulmonaire et ostéoarticulaire[77]. Cela est justifié par les images radiologiques plus ou moins spécifiques à la tuberculose. La littérature rapporte que la spécificité varie de 27 à 81 % selon l’étude. Les imageries idéales et révélatrices de la tuberculose répondent à certains attributs dont le premier est lié au siège. En raison de l’affinité que les BK ont envers les régions aérées, la lésion radiologique est souvent observée dans les parties hautes des poumons. Néanmoins, l’image radiographique peut contenir différentes formes :
- infiltrat : traduisant des lésions débutantes de l’infection via une opacité peu dense, hétérogène et étendue ;
- nodule : granulome de taille variable, isolé ou groupé ;
- tuberculome : nodule isolé pseudotumoral ;
- caverne : excavation par perte de substance au sein d’un infiltrat, aux parois épaisses.

Prévention[modifier | modifier le code]
Vaccination par le BCG[modifier | modifier le code]

Un premier vaccin fut expérimenté en 1886 par Vittorio Cavagnis[78] tandis qu'à cette même époque Robert Koch tenta vainement de développer un sérum curatif basé sur la tuberculine[79]. En 1902, à partir d'un bacille d'origine humaine atténué, Behring essaya un vaccin contre la tuberculose bovine : le bovovaccin. Behring proposa également, sans succès, la tuberculase[80]. Toujours dans le domaine vétérinaire, Koch essaya le tauruman. Pour mémoire, il faut aussi citer le sérum de Marmorek (1904)[81], le sérum de Maragliano, les sérums de Richet et Héricourt, ainsi que les tentatives peu honnêtes de Friedmann (en) et de Spahlinger[82]. C'est en 1921, qu'Albert Calmette et Camille Guérin de l'Institut Pasteur de Lille essayent avec succès le premier vaccin contre la tuberculose sur lequel ils travaillaient depuis 1908 — qui était conçu pour être un vaccin vétérinaire. Baptisé BCG (pour « Bacille de Calmette et Guérin » ou « Bilié de Calmette et Guérin ») ce vaccin issu d'une souche vivante atténuée de Mycobacterium bovis deviendra obligatoire en France en 1950.
L’efficacité de la vaccination par BCG se limite à la protection contre l’évolution mortelle de la tuberculose, particulièrement la méningite tuberculeuse et la maladie disséminée (miliaire). Le vaccin est plus efficace chez le nouveau-né et l'enfant que chez l'adulte (protection estimée entre 75 et 85 % des formes graves du nourrisson et du jeune enfant et entre 50 et 75 % des formes de l'adulte[83]).
Il ne permet donc pas d'empêcher la transmission de la maladie et d'enrayer l'épidémie mondiale. L'avenir est dans la recherche des gènes de virulence du bacille.
Sur base d'études faites à grande échelle et organisées par l'Organisation mondiale de la santé (OMS), certains pensent que l'efficacité du BCG est faible : dans une étude faite sur 260 000 personnes dans un pays d'endémie tuberculeuse (en Inde), les auteurs n'ont pas trouvé de différence significative entre le groupe qui avait reçu le BCG et celui qui ne l'avait pas reçu[84]. Une autre étude faite également en Inde sur 366 625 personnes a montré que le BCG n'avait aucune action préventive sur les formes de tuberculose pulmonaire parmi les adultes[85].
En juillet 2007, la ministre française de la santé, Roselyne Bachelot, a annoncé la suspension de l'obligation de vacciner tous les enfants et les adolescents contre la tuberculose par le BCG, à l'occasion de la présentation du nouveau programme de lutte contre cette maladie[86].
Déclaration obligatoire[modifier | modifier le code]
En France (depuis 1964), en Belgique et en Suisse, cette maladie est sur la liste des maladies infectieuses à déclaration obligatoire.
En France, en particulier, c'est la mise sous traitement antituberculeux qui fait partie de la déclaration. Cela permet d'inclure les cas confirmés bactériologiquement et les cas probables reposant sur un faisceau d'arguments épidémiologiques, cliniques et d'imagerie en l'absence de preuve bactériologique formelle. En effet ces cas probables nécessitent les mêmes investigations d'enquête épidémiologique pour rechercher d'éventuels cas contact ou contaminant autour d'eux.
Dépistage des vaches porteuses du bacille[modifier | modifier le code]

Toutes les espèces de vertébrés peuvent être atteintes spontanément par différents types de bacilles tuberculeux. Ces tuberculoses animales peuvent être cause de zoonoses.
Les symptômes de la tuberculose animale n’ont été décrits et rapprochés de la forme humaine que très tardivement. Si Aristote décrivit déjà les scrofules chez les animaux, les lésions de la tuberculose bovine restèrent longtemps confondues avec celles de la péripneumonie contagieuse et de l’hydatidose bovine ou de la morve des chevaux. Le premier à rapprocher les tubercules humains de ceux du bœuf fut Ernst Friedrich Gurlt, en 1831. Auparavant la tuberculose bovine, surtout dans les cas de localisation pleurale, a pu être assimilée plutôt à la syphilis humaine[87].
Afin de prévenir la transmission du bacille chez l'humain, soit par voie aérienne directement par contact, soit par voie digestive après ingestion de viande ou de lait insuffisamment cuit ou pasteurisé, la plupart des pays développés ont entrepris d'assainir leur cheptel bovin[réf. souhaitée].
La détection des animaux porteurs se fait par voie clinique, allergique et par recherche des lésions évocatrices sur les carcasses à l'abattoir. En France, cette prophylaxie est obligatoire depuis 1963 sur tout le territoire national pour tous les bovins âgés de plus de six semaines. Pour que les animaux puissent se déplacer sans contrainte, le cheptel doit obtenir le statut « officiellement indemne de tuberculose ». Pour cela, tous les animaux sont testés régulièrement par intradermotuberculination. La fréquence est annuelle mais peut être allégée quand la prévalence de la maladie dans le département est faible. Les animaux réagissant peuvent être soit testés comparativement par une tuberculine aviaire (pour détecter les faux positifs), soit envoyés à l'abattoir (l'abattage est alors subventionné) où les lésions évocatrices seront recherchées par un vétérinaire inspecteur, et éventuellement confirmées par diagnostic de laboratoire. Les troupeaux où l'infection est confirmée peuvent faire l'objet d'un abattage total, également subventionné[réf. souhaitée].
Parallèlement, en France, un réseau de cinq mille vétérinaires sanitaires surveille l'apparition de signes cliniques évocateurs. Des visites sanitaires biennales de tous les troupeaux de bovins sont obligatoires. La vaccination au BCG positivant le test intradermique, elle est interdite sur le territoire français. Cette politique a permis de faire considérablement baisser la prévalence de la tuberculose bovine. En 2000, la commission européenne a reconnu à la France le statut de pays officiellement indemne. En 2006, le taux d'incidence était de 0,032 % de cheptels infectés alors qu'il était de près de 25 % en 1955. Il convient de distinguer la tuberculose bovine de la paratuberculose bovine, due également à une mycobactérie, mais qui n'est pas une zoonose[réf. nécessaire].
Pasteurisation du lait[modifier | modifier le code]
Avant l’obligation de pasteurisation du lait, la proportion des cas de tuberculose humaine d’origine bovine était estimée à 1,3 % des cas de tuberculose humaine. En France aujourd'hui, les rares cas de tuberculose humaine d'origine animale (0,5 % des cas) sont constatés dans leur majorité chez des sujets de plus de soixante ans, ce qui est le signe d’une infection ancienne.
Cas des carnivores domestiques[modifier | modifier le code]
La fréquence de la tuberculose chez les carnivores domestiques, essentiellement due à M. bovis ou M. tuberculosis, a baissé, en même temps que celles des tuberculoses humaine et bovine. Le vétérinaire doit cependant toujours veiller à ce que les carnivores ne servent pas de relais épidémiologique secondaire dans un foyer de tuberculose, qu’il soit animal ou humain. Le diagnostic de la tuberculose des carnivores est extrêmement difficile à poser.
Dépistage international[modifier | modifier le code]
Géorgie[modifier | modifier le code]
Afin de dépister la tuberculose auprès des populations géorgiennes, le Centre National pour le Contrôle des Maladies et de la Santé Publique de Géorgie utilise un camion autonome qui permet à l’équipe médicale de se stationner à n'importe quel endroit, pour procéder aux examens.
Traitement[modifier | modifier le code]
Antibiothérapie[modifier | modifier le code]

Le traitement est d'une durée de six mois pour une tuberculose pulmonaire à bacille de Koch sensible chez un patient immunocompétent, comprenant 2 mois de quadrithérapie antibiotique (isoniazide, rifampicine, pyrazinamide et éthambutol), puis 4 mois de bithérapie (isoniazide et rifampicine)[88]. Le traitement prolongé est indispensable afin de guérir de la maladie et éviter l'émergence de souches résistantes dont l'évolution est souvent beaucoup plus grave. Malheureusement, ce traitement étant long et complexe, il est difficile à faire respecter aux patients en particulier dans les pays dont le système de santé est lacunaire, où la thérapie sous observation directe est difficile à mettre en œuvre, ce qui favorise l'apparition d'antibiorésistance.
En plus et afin de prévenir ce risque de résistances, une association d’antibiotiques est utilisée. En effet, les mécanismes de résistance étant spécifiques, chaque antituberculeux de l’association va tuer les bacilles mutants résistants à l’autre antituberculeux. En suivant ce raisonnement, il parait logique de proposer une association de deux antibiotiques. L’isoniazide et la rifampicine sont cette association de base. Il faut toutefois prendre en compte l’historique de mise sur le marché des antituberculeux. L’isoniazide était, dans les années 50, un des rares antituberculeux disponible. Par conséquent des échecs de traitement ont déjà eu lieu avec sélection de mutants résistants (on parle de « résistance secondaire »). Ces patients ont pu transmettre ces souches résistantes à d’autres patients qui ont développé une tuberculose avec une résistance d’emblée (on parle alors de « résistance primaire »). Du fait de la circulation de ces souches résistantes il faut ajouter un troisième antituberculeux à la bithérapie associant rifampicine et isoniazide, l’éthambutol. Celui-ci permet d’être assuré d’avoir toujours une bithérapie en cas de résistance primaire à l’isoniazide (5% des cas en France). Cependant, cette trithérapie nécessite une durée de traitement d’au moins 9 mois pour éradiquer les bacilles persistants qui présentent un métabolisme ralenti et qui sont à l’origine des rechutes. Le pyrazinamide ajouté pendant les 2 premiers mois permet de réduire la durée du traitement de 9 à 6 mois.
La rifadine est un traitement qui peut être utilisé pour traiter la tuberculose osseuse.
L'isoniazide est utilisé généralement à la dose de 5 mg, en association avec trois autres antibiotiques. L’isoniazide inhibe la multiplication des bactéries responsables de la tuberculose. Ce médicament doit être administré à jeun. Antibiorésistance : une large épidémie de cas de tuberculose résistante à ce médicament s'est déclarée à Londres de 1995 à 2006[89].
La rifampicine est utilisée habituellement à la dose de 10 mg/kg et par jour, pendant une durée de six mois, pour le traitement de la tuberculose. Cet antibiotique est un fort inducteur enzymatique : il accélère la dégradation des autres médicaments, notamment les contraceptifs oraux. Les femmes sous contraceptifs sont donc invitées à revoir leur traitement à la hausse (après consultation du gynécologue), voire à passer à une contraception mécanique (préservatif…) pendant la durée du traitement. La rifampicine provoque une coloration orangée des urines. C'est un bon moyen d'objectiver l'observance du traitement.
La streptomycine (découverte par Selman Waksman vers 1946) fut le premier antibiotique actif contre le bacille de Koch. Il est contre-indiqué chez la femme enceinte et doit impérativement être associé à d'autres antituberculeux (INH et PAS). Par voie intramusculaire chez l'adulte : 15 à 25 mg/kg et par jour. Par voie intrarachidienne : pour l'adulte, 25 à 100 mg/j, pour un enfant, 20 à 40 mg/kg et par jour en deux ou quatre injections. Surveillance du traitement : les fonctions auditives et rénales devront être surveillées régulièrement.
L'éthambutol est utilisable chez la femme enceinte. Elle doit être utilisée le matin à jeun en une seule prise, quinze à vingt milligrammes par kilogramme. Ne pas dépasser vingt-cinq milligrammes par kilogramme par 24 heures sans dépasser soixante jours, puis réduire à quinze milligrammes par kilogramme et par jour. Surveillance par un fond d'œil et un examen de la vision des couleurs mensuels.
Le bédaquiline (R207910), une molécule de la famille des diarylquinolines, pourrait se révéler prometteuse contre Mycobacterium tuberculosis. Elle fait naître trois espoirs : raccourcissement de la durée du traitement ; envisager des prises une seule fois par semaine en association avec un autre antituberculeux ; être active sur des souches multi résistantes, avec une efficacité bactéricide bien supérieure à celle de l'isoniazide et de la rifampicine. Ce médicament est actuellement en phase très précoce de son développement. Seules des études approfondies chez l'humain permettront de vérifier que ces espoirs sont fondés.
Des corticoïdes sont ajoutés au traitement antituberculeux en cas de méningite tuberculeuse, de résistances ou de rechute de traitement. La corticothérapie doit être commencée après instauration de l'antibiothérapie, à la dose de 0,5 à 1 mg/kg et par jour pour une durée de un à deux mois.
Le traitement des infections latentes repose soit sur l’isoniazide en monothérapie pour une durée de 6 ou 9 mois, soit sur l’association isoniazide-rifampicine pendant 3 mois.
Résistance aux traitements[modifier | modifier le code]
La résistance aux traitements est due à des traitements insuffisants en doses ou en durée[90]. Elle pose des problèmes importants car la tuberculose est beaucoup plus délicate à soigner, surtout en cas de résistances à plusieurs anti-tuberculeux (multi résistance). Dans le pire des cas, elle est dite étendue lorsqu'elle concerne des antibiotiques de première intention (isoniazide, rifampicine) et un ou plusieurs antibiotiques de seconde intention.
Le dépistage de ces formes est difficile, la mise en culture du germe en présence des différents antibiotiques (antibiogramme) requérant plusieurs semaines pour avoir un résultat du fait de la lenteur de multiplication du mycobactérium. La recherche directe de mutations responsable de la résistance est faisable et donne de bons résultats[91]. Du fait de son coût, ces techniques sont difficilement applicables dans les pays pauvres. Une autre méthode consiste à observer la croissance de la souche de mycobacterium au microscope, en présence de différents antibiotiques. Elle donne des résultats fiables et assez rapide (une semaine)[92].
Le traitement des formes résistantes consiste en l'utilisation d'antituberculeux testés comme efficace sur la souche en question, complété par une fluoroquinolone et par des antibiotiques, dits de seconde ligne, comme la moxifloxacine, la bédaquiline, le delamanid[93]. La prise en charge a fait l'objet d'un document de recommandations publié par l'OMS en 2006[94]. (Voir aussi DOTS, DOTS-Plus). D'autres traitements comme le télacébec[95] sont également développés.
Un cocktail de médicaments fait de bédaquiline, de linézolide et de prétomanide[96], réparti en 5 comprimés par jour, permet de réduire la durée de traitement de la tuberculose résistante à 6 mois (plus 6 mois de suivi thérapeutique) avec un taux de guérison de 90 %[96] — contre des traitements de 18 à 24 mois avec la prise de 30 à 40 gélules quotidiennes et de nombreuses piqures jusque-là[96]. L'ajout de mixifloxacine à la combinaison bédaquiline-linézolide-prétomanide permet d'être, au moins, aussi efficace que le traitement habituel dans les formes résistantes à la rifampicine[97].
Pneumothorax (historique)[modifier | modifier le code]
Avant la découverte d'antibiotiques efficaces, on pratiquait la collapsothérapie. La collapsothérapie est un affaissement de la partie atteinte du poumon et d'une partie du thorax par insufflation d'air, le pneumothorax, ou par chirurgie mutilante.
L'écrivain François Abgrall (1906-1930), décédé très jeune à 23 ans de cette maladie à une époque où elle était très mal soignée a décrit dans son livre Et moi aussi, j'ai eu vingt ans ![98] qui est un témoignage précieux sur le statut du malade tuberculeux vers 1925, les symptômes de cette maladie et la manière dont elle était soignée en France dans les années 1920. À l'époque, la seule thérapeutique proposée est la collapsothérapie. La technique consiste à mettre le poumon « au repos » en laissant entrer l'air ou en injectant un produit huileux entre les feuillets de la plèvre, détachant ainsi le poumon des côtes. Cette manœuvre soulage provisoirement le patient mais s'accompagne de complications multiples parmi lesquelles la perte du poumon n'est pas exclue.
Ces méthodes ont disparu des pays occidentaux dans les années 1950.
Recherche et développement[modifier | modifier le code]
Selon une étude d'Olivier Neyrolles de l'Institut Pasteur, le bacille de Koch serait stocké dans les cellules adipeuses[99]. C'est ainsi qu'il résisterait aux antibiotiques les plus puissants et qu'il serait capable de réapparaître après de nombreuses années chez des personnes guéries.
Le traitement bactériophagique pourrait représenter à terme une solution de traitement dans les cas de résistance aux antibiotiques. En effet le bacille de Koch appartient au genre Mycobacterium dont les membres présentent des caractéristiques similaires. En mai 2019, une équipe internationale de l'Université de Pittsburgh a réussi à traiter avec succès par phagothérapie un patient hospitalisé à Londres victime d'une infection généralisée par Mycobacterium abscessus, en utilisant un cocktail de phages modifiés génétiquement administré par voie intraveineuse[100].
Notes et références[modifier | modifier le code]
Notes[modifier | modifier le code]
- Les pneumologues de l'époque préféraient la collapsothérapie à l'antibiotique, soupçonné de rendre sourds certains patients.
- Des sujets convenablement alimentés et logés lui résistent beaucoup mieux que ceux qui souffrent de malnutrition et d'une hygiène domestique insuffisante.
Références[modifier | modifier le code]
- « Tuberculose », sur who.int, Organisation mondiale de la santé, (consulté le )
- OMS 2015, p. 1.
- OMS, « Tuberculose : principaux faits », sur who.int, Organisation mondiale de la santé (consulté le )
- ANDIL, « Tuberculose », sur medecine.ups-tlse.fr (consulté le )
- (en) Ritu Lakhtakia, « Of Animalcula, Phthisis and Scrofula: Historical insights into tuberculosis in the pre-Koch era », sur ncbi.nlm.nih.gov, Sultan Qaboos University Medical Journal, .
- Dylan Tierney et Edward A. Nardell, « Tuberculose (TB) », sur Manuel MSD, (consulté le ).
- « Tuberculose active » [PDF], sur Haute Autorité de santé, (consulté le ).
- Fritz Grossenbacher et Doris Zumbühl, « Tuberculose (TBC) », sur santeweb.ch (consulté le ).
- Mirko D. Grmek, Les maladies à l'aube de la civilisation occidentale, Paris, Payot, coll. « Médecine et Sociétés », , 527 p. (ISBN 2-228-55030-2), chap. VII (« Une grande tueuse : la tuberculose »), p. 261-264.
- Mirko D. Grmek, Les maladies à l'aube de la civilisation occidentale, Paris, Payot, coll. « Médecine et Sociétés », , 527 p. (ISBN 2-228-55030-2), chap. VII (« Une grande tueuse : la tuberculose »), p. 304-306.
- « Le génome des mycobactéries : étude biologique et interprétation évolutive », sur ipubli.inserm.fr (consulté le )
- « La tuberculose humaine est antérieure à la domestication animale au Proche-Orient », sur inshs.cnrs.fr (consulté le )
- Diana Gasparon, « Petite histoire des grandes épidémies », sur ulb.ac.be, Société belge d’histoire de la médecine (consulté le ).
- Patrick Berche, Une histoire des microbes, Paris, John Libbey Eurotext, (lire en ligne), p. 68.
- El Ghradi Halima, « Les promoteurs de l'esprit scientifique dans la civilisation islamique », sur jeunessearabe.info, Organisation islamique pour l'éducation, les sciences et la culture, I.S.E.S.C.O., (consulté le ).
- Ne pas confondre avec Pierre Joseph Desault (1738-1795).
- [le titre exact est Dissertation sur la phtisie] « Pierre Desault (1675-1737) », sur data.bnf.fr (consulté le )
- François-Emmanuel (1764-1835) Auteur du texte Fodéré, Essai sur la phtisie pulmonaire... par F.-E. Fodéré,..., (lire en ligne)
- « Tuberculose », sur ambafrance-ma.org, ambassade de France au Maroc (consulté le )
- Charles Coury, Histoire de la Tuberculose, t. 18, Encyclopaedia Universalis, , p. 300-304
- (en) Kay Codell Carter, « The rise of causal concepts of disease: case histories », sur books.google.fr (consulté le ), p. 18.
- « “Sur les traces de la tuberculose” critères diagnostiques des atteintes tuberculeuses du squelette humain et leur application dans des séries anthropologiques hongroises et françaises » [PDF], sur phd.okm.gov.hu, gouvernement hongrois (consulté le ).
- (en) Catherine Moloney, « ‘inflaming Infirmity’: some medical-literary interfaces of 19th century tuberculosis* » [PDF], sur lmi.org.uk (consulté le ).
- Svetlana Kouznetsova, « Tuberculose : l'épidémie jamais éradiquée », Courrier international, no 1568, , traduction d'un article paru le dans Kommersant.
- (en) John F. Murray, « Mycobacterium tuberculosis and the cause of consumption » [« La tuberculose à mycobactérie et la cause de la consomption »], sur ajrccm.atsjournals.org (consulté le ).
- (en) Dr. Robert Koch, « The Aetiology of Tuberculosis » [« L’étiologie de la tuberculose »] [PDF], sur deltaomega.org (consulté le ).
- (en) Madelon Lubin Fink, « Truth, lies, and public health: how we are affected when science and … » [« Vérités, mensonges et santé publique : comment nous sommes affectés quand la science et… »], sur books.google.fr (consulté le ).
- (en) R. Doll, « Controlled Trials : The 1948 Watershed » [« Les essais contrôlés : la révolution de 1948 »], British Medical Journal, no 317, , p. 1217–1223.
- (en) Organisation mondiale de la santé, « Global tuberculosis control 2008 » [« Le contrôle mondial de la tuberculose en 2008 »], sur who.int, (consulté le ).
- « Tuberculose », sur who.int, Organisation mondiale de la santé (consulté le )
- « Co-infection tuberculose/VIH », sur who.int, Organisation mondiale de la santé (consulté le )
- (en) « Global HIV & AIDS statistics — 2020 fact sheet », sur unaids.org, Organisation des Nations unies (consulté le )
- P. Benkimoun, « Tuberculose : malgré les avancées, la maladie tue plus de 4 000 personnes pas jour », sur lemonde.fr, (consulté le ).
- Fei Xu, Baolan Ma, Dandan Wang et Jialin Lu, « Associating the blood vitamin A, C, D and E status with tuberculosis: a systematic review and meta-analysis of observational studies », Food & Function, vol. 13, no 9, , p. 4825–4838 (ISSN 2042-650X, PMID 35403633, DOI 10.1039/d1fo02827h, lire en ligne, consulté le )
- (en) Roberta Papagni, Carmen Pellegrino, Francesco Di Gennaro et Giulia Patti, « Impact of Vitamin D in Prophylaxis and Treatment in Tuberculosis Patients », International Journal of Molecular Sciences, vol. 23, no 7, , p. 3860 (ISSN 1422-0067, PMID 35409219, PMCID PMC8999210, DOI 10.3390/ijms23073860, lire en ligne, consulté le )
- Thanh, N. P., Khue, P. M., Sy, D. N. et Strobel, M., « Diabète chez les nouveaux cas de tuberculose pulmonaire à Hanoï, Vietnam »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur societe-mtsi.fr, Bulletin de la Société de pathologie exotique, 108(5), , p. 337-341
- D. Che, « Épidémiologie de la tuberculose », La Revue du praticien, no 4, , p. 473–478.
- Stéphane Henry, Vaincre la tuberculose (1879-1939) : la Normandie en proie à la peste blanche, Publication universitaire Rouen Havre, , p. 47.
- (en) Flurin Condrau et Michael Worboys, Tuberculosis Then and Now : Perspectives on the History of an Infectious Disease [« La Tuberculose d’aujourd’hui et d’antan : perspectives historiques sur une maladie infectieuse »], McGill-Queen's Press, , p. 131.
- (en) W.D. Johnston, Tuberculosis, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), p. 1059–1068dans The Cambridge World History of Human Disease, K.F. Kiple
- Banyai A.L. (1931), Diabetes and pulmonary tuberculosis, Am. Rev. Tuber., 24:17.
- Jeon CY, Murray MB (2008) Diabetes mellitus increases the risk of active tuberculosis: a systematic review of 13 observational studies. PLoS Med 5(7):e152
- Stevenson CR, Critchley JA, Forouhi NG et al. (2007), Diabetes and the risk of tuberculosis: a neglected threat to public health?, Chronic Illn, 3(3):228–45
- Alisjahbana B, Sahiratmadja E, Nelwan EJ et al. (2007), The effect of type 2 diabetes mellitus on the presentation and treat- ment response of pulmonary tuberculosis, Clin. Infect. Dis., 45 (4):428–35
- (en) Christopher Dye, « Global epidemiology of tuberculosis », The Lancet, Elsevier BV, vol. 367, no 9514, , p. 938–940 (ISSN 0140-6736, DOI 10.1016/s0140-6736(06)68384-0, lire en ligne).
- Sébastien Gobert, « L’Ukraine livrée aux maladies infectieuses », Le Monde diplomatique, vol. 63, no 746, (lire en ligne)
- L. Jeannin, « Tuberculose pulmonaire et primo-infection tuberculeuse : Épidémiologie, diagnostic, évolution, traitement, prévention », La Revue du praticien, vol. 47, no 1, , p. 97–106.
- S. Fikal, H. Sajiai, H. Serhane, S. Aitbatahar, H. Rachid, N. Moumen et L. Amro, « Primo-infection tuberculeuse », Revue des Maladies Respiratoires, Elsevier BV, vol. 33, , A158 (ISSN 0761-8425, DOI 10.1016/j.rmr.2015.10.311, lire en ligne).
- Ait-Khaled, N., D.A. Enarson et S.T. Initiative, Tuberculose : manuel pour les étudiants en médecine, 1999.
- Brändlia, O. et al., Clinique et diagnostic de la tuberculose, dans Forum Med Suisse, 2003.
- Cadranel, P., P. Chinet, and P. Marquette, Item 106.
- A. Tazi, « Hémoptysie : Orientation diagnostique », La Revue du praticien, vol. 48, no 11, , p. 1239–1242.
- P Hochedez, V Zeller, C Truffot, S Ansart, É Caumes, R Tubiana, C Katlama, F Bricaire et P Bossi, « Caractéristiques épidémiologiques, cliniques, biologiques et thérapeutiques de la tuberculose ganglionnaire observée chez des patients infectés ou non par le VIH », Pathologie Biologie, Elsevier BV, vol. 51, nos 8–9, , p. 496–502 (ISSN 0369-8114, DOI 10.1016/s0369-8114(03)00145-7, lire en ligne).
- (en) Catherine W. M. Ong, Paul T. Elkington et Jon S. Friedland, « Tuberculosis, Pulmonary Cavitation, and Matrix Metalloproteinases », Am J Respir Crit Care Med, American Thoracic Society, vol. 190, no 1, , p. 9–18 (ISSN 1073-449X, DOI 10.1164/rccm.201311-2106pp, lire en ligne).
- (en) Keertan Dheda, Helen Booth, Jim F. Huggett, Margaret A. Johnson, Alimuddin Zumla et Graham W. Rook, « Lung Remodeling in Pulmonary Tuberculosis », The Journal of Infectious Diseases, Oxford University Press (OUP), vol. 192, no 7, , p. 1201–1209 (ISSN 0022-1899, DOI 10.1086/444545, lire en ligne).
- (en) Waseem Saeed, « Cavitating pulmonary tuberculosis: a global challenge », Clinical Medicine, Royal College of Physicians, vol. 12, no 1, , p. 40–41 (ISSN 1470-2118, DOI 10.7861/clinmedicine.12-1-40, lire en ligne).
- C. Marrakchi, I. Maâloul, D. Lahiani, B. Hammami, T. Boudawara, M. Zribi et M. Ben Jemaâ, « Diagnostic de la tuberculose ganglionnaire périphérique en Tunisie », Médecine et Maladies Infectieuses, Elsevier BV, vol. 40, no 2, , p. 119-122 (ISSN 0399-077X, DOI 10.1016/j.medmal.2009.10.014, lire en ligne).
- Jad Watfa et Frédéric Michel, « Tuberculose uro-génitale », Progrès en Urologie, vol. 15, no 4, , p. 602–603 (lire en ligne, consulté le ).
- (en) Li-Jen Wang, Ching-Fang Wu, Yon-Cheong Wong, Cheng Keng Chuang, Sheng-Hsien Chu et Chi-Jen Chen, « Imaging Findings of Urinary Tuberculosis on Excretory Urography and Computerized Tomography », The Journal of Urology, Elsevier BV, vol. 169, no 2, , p. 524–528 (ISSN 0022-5347, DOI 10.1016/s0022-5347(05)63947-x, lire en ligne)
- L Boussel, B Marchand, N Blineau, C Pariset, M Hermier, G Picaud, M Emin, A Coulon, P Pagnon, A Rode, J Pin-Leveugle, A Boibieux et Y Berthezène, « Imagerie de la tuberculose ostéo-articulaire », Journal de radiologie, Elsevier Masson, vol. 83, no 9-C1, , p. 1025–1034 (lire en ligne).
- C Ben Taarit, S Turki et H.Ben Maïz, « La tuberculose ostéoarticulaire en Tunisie : étude rétrospective de 180 cas », Médecine et Maladies Infectieuses, Elsevier BV, vol. 33, no 4, , p. 210–214 (ISSN 0399-077X, DOI 10.1016/s0399-077x(03)00009-x, lire en ligne).
- Jean Roch Alliez, Corneliu Balan, Oumar Diallo et Bernard Alliez, « Mal de Pott et paraplégie pottique », African Journal of Neurological Science, Elsevier BV, vol. 25, no 2, , p. 51–58 (ISSN 1992-2647, lire en ligne).
- S. Hafaied, B. Hamdi, A. Berraies, H. Cherif, J. Ammar et A. Hamzaoui, « Localisations rares de tuberculose chez l’enfant : à propos de 8 cas », Revue des Maladies Respiratoires, Elsevier BV, vol. 32, , A231–A232 (ISSN 0761-8425, DOI 10.1016/j.rmr.2014.10.377, lire en ligne).
- H. Lakhdar, « Tuberculose cutanée », sur Thérapeutique dermatologique, (consulté le ).
- Beyt E, Ortbalds DW, Santa Cruz DJ. Cutaneous mycobacteriosis: analysis of 34 cases with a new classification of the disease. Medicine. 1980;60:95–109
- Formes cliniques de la tuberculose cutanée., F. Tigoulet, V. Fournier & E. Caume (2001)
- V. Gajdos et C. Delacourt, « L'intradermoréaction à la tuberculine dans le diagnostic de tuberculose chez l'enfant », Archives de Pédiatrie, Elsevier BV, vol. 6, no 4, , p. 461–464 (ISSN 0929-693X, DOI 10.1016/s0929-693x(99)80231-0, lire en ligne).
- Société de pneumologie de langue française, « L'intradermoréaction à la tuberculine (IDR) ou test à la tuberculine », Revue des Maladies Respiratoires, vol. 20, no 6-C2, , p. 733 (lire en ligne, consulté le ).
- Bonnet, M., [New diagnostic tests for tuberculosis in southern countries: from theory to practice in Southern countries]. Revue des maladies respiratoires, 2011.
- (en) L. Kivihya-Ndugga et al., « A comprehensive comparison of Ziehl-Neelsen and fluorescence microscopy for the diagnosis of tuberculosis in a resource-poor urban setting », The International Journal of Tuberculosis and Lung Disease, vol. 7, no 12, , p. 1163–1171. Accès direct.
- J Maugein et C Bébéar, « Diagnostic microbiologique de la tuberculose et intérêt de la PCR », Médecine et Maladies Infectieuses, Elsevier BV, vol. 33, , p. 153–158 (ISSN 0399-077X, DOI 10.1016/s0399-077x(03)00069-6, lire en ligne)
- (en) D. Alland, M. Rowneki, L. Smith, S. Chakravorty, J. Ryan et M. Chancellor « Xpert MTB/RIF Ultra: a new near-patient TB test with sensitivity equal to culture » () (lire en ligne)
—Conference on Retroviral and Opportunistic Infections, Seattle, WA. (lire en ligne) - (en) Matthew Bates et Alimuddin Zumla, « The development, evaluation and performance of molecular diagnostics for detection ofMycobacterium tuberculosis », Expert Review of Molecular Diagnostics, Informa Healthcare, vol. 16, no 3, , p. 307–322 (ISSN 1473-7159, DOI 10.1586/14737159.2016.1139457, lire en ligne).
- sections « Diagnostics and laboratory strengthening » et « Research and development », OMS 2015, p. 2–3
- (en) K. Chang et al., « Rapid and effective diagnosis of tuberculosis and rifampicin resistance with Xpert MTB/RIF assay : a meta-analysis », Journal of Infection, vol. 64, no 6, , p. 580–588 (DOI 10.1016/j.jinf.2012.02.012)
- (en) Catharina C Boehme, Mark P Nicol, Pamela Nabeta, Joy S Michael, Eduardo Gotuzzo, Rasim Tahirli, Ma Tarcela Gler, Robert Blakemore, William Worodria, Christen Gray, Laurence Huang, Tatiana Caceres, Rafail Mehdiyev, Lawrence Raymond, Andrew Whitelaw, Kalaiselvan Sagadevan, Heather Alexander, Heidi Albert, Frank Cobelens, Helen Cox, David Alland et Mark D Perkins, « Feasibility, diagnostic accuracy, and effectiveness of decentralised use of the Xpert MTB/RIF test for diagnosis of tuberculosis and multidrug resistance: a multicentre implementation study », The Lancet, Elsevier BV, vol. 377, no 9776, , p. 1495–1505 (ISSN 0140-6736, DOI 10.1016/s0140-6736(11)60438-8, lire en ligne).
- J. Andreu, J. Cáceres, E. Pallisa et M. Martinez-Rodriguez, « Manifestations radiologiques de la tuberculose pulmonaire », EMC - Radiologie, Elsevier BV, vol. 2, no 1, , p. 121–132 (ISSN 1762-4185, DOI 10.1016/j.emcrad.2004.11.005, lire en ligne).
- « Gazette hebdomadaire de médecine et de chirurgie. - 1887. - série 2, tome 24 », sur web2.bium.univ-paris5.fr (consulté le ).
- (en) Christoph Gradmann, « Robert Koch and the Pressures of Scientific Research: Tuberculosis and Tuberculin », Medical History, Cambridge University Press (CUP), vol. 45, no 01, , p. 1–32 (ISSN 0025-7273, DOI 10.1017/s0025727300000028, lire en ligne).
- « Médecine : Futur Antérieur Ou Les Perspectives D’avenir Inspirées Par Deux Grandes Découvertes Scientifiques Du XIXe siècle : La Théorie Microbienne Et Les Rayons X » [PDF], sur bium.univ-paris5.fr (consulté le ).
- sérum de Marmorek (1904).
- (en) « The Last of Spahlinger », American Journal of Public Health, vol. 17, no 6, , p. 617–618 (lire en ligne, consulté le ).
- « Tuberculose », sur Institut Pasteur, (consulté le ).
- (en) « Trial of BCG vaccines in south India for tuberculosis prevention : first report », Bulletin of the WHO, vol. 57, no 5, , p. 819–27 (PMID 396057, PMCID PMC2395884, lire en ligne).
- (en) « Fifteen year follow up trial of BCG vaccines in south India for tuberculosis prevention », Indian J. Med. Res., vol. 110, , p. 56–69 (PMID 10573656).
- « Le BCG ne sera plus obligatoire », L'Express, (lire en ligne, consulté le ).
- « Étude descriptive des disparités départementales des résultats de la lutte contre la tuberculose bovine en France : formulation d’hypothèses explicatives », sur theses.vet-alfort.fr (consulté le ).
- « Guide infection longue durée, tuberculose active », sur Haute Autorité de Santé (consulté le )
- (en) « Large outbreak of isoniazid-monoresistant tuberculosis in London, 1995 to 2006: case–control study and recommendations ».
- (en) M. A. Espinal, K. Laserson, M. Camacho et al., « Determinants of drug-resistant tuberculosis : analysis of 11 countries », Int J Tuberc Lung Dis, vol. 5, no 10, , p. 887–893 (PMID 11605880, lire en ligne).
- (en) I. C. Sam, F. Drobniewski, P. More, M. Kemp et T. Brown, « Mycobacterium tuberculosis and rifampin resistance, United Kingdom », Emerg Infect Dis, vol. 12, no 5, , p. 752–7599 (PMID 16704831, lire en ligne).
- (en) D.A. Moore, C. A. Evans, R. H. Gilman et al., « Microscopic-observation drug-susceptibility assay for the diagnosis of TB », N Engl J Med, no 355, , p. 1539–50 (PMID 17035648, lire en ligne).
- (en) M. L. Munang, M. K. O’Shea et M. Dedicoat, « Novel drugs and drug combinations for treating tuberculosis », BMJ, no 349, (PMID 25324128, DOI 10.1136/bmj.g5948, présentation en ligne).
- (en) Dennis Falzon et al., Guidelines for the programmatic management of drug-resistant tuberculosis : 2011 Update, Genève, OMS, (1re éd. 2006), 33 p., pdf lire en ligne = http://whqlibdoc.who.int/publications/2006/9241546956_eng.pdf (ISBN 978-92-4-150158-3).
- (en) de Jager VR, Dawson R, van Niekerk C et al., « Telacebec (Q203), a new antituberculosis agent », N Engl J Med, vol. 382, no 13, , p. 1280-1. (PMID 32212527, DOI 10.1056/NEJMc1913327, lire en ligne).
- « Tuberculose: un nouveau cocktail de médicaments réduit drastiquement le temps de traitement », sur sciencesetavenir.fr, Sciences et Avenir, (consulté le ).
- Nyang’wa B-T, Berry C, Kazounis E et al. A 24-week, all-oral regimen for rifampin-resistant tuberculosis, N Engl J Med, 2022;387:2331-2343
- François Abgrall. Et moi aussi, j'ai eu vingt ans!, 1935, réédité en 2000, Éditeur Terre de Brume, Rennes.
- « Communiqué de l'Institut Pasteur », sur pasteur.fr (consulté le ).
- (en) Alex Fox, « Engineered phages stymie drug-resistant infection », Science, vol. 364, no 6440, , p. 518–519 (ISSN 0036-8075 et 1095-9203, PMID 31073047, DOI 10.1126/science.364.6440.518, lire en ligne, consulté le )
Annexes[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- P. Delormas, Rapport sur l'organisation de la, lutte antituberculeux en Côte d'Ivoire et intérêt de l'association isoniazidie-éthionamide, Communication au Séminaire sur la tuberculose en Afrique (CMS), Nairobi, 1960.
- P. Essoh-Nomel, Les mesures préventives dans l'organisation de la lutte antituberculeuse en Côte d'Ivoire, thèse Faculté de médecine (no 15), Marseille, 1962, 52 p.
- « Le Centre Antituberculeux d'Adjamé », Afrique, no 20, s.l., 1963
- Delormas, Le Centre Antituberculeux d'Abidjan, Comité Antituberculeux de la Côte d'Ivoire, Abidjan, 1965, 5 p.
- L. Sentilhec, La lutte antituberculeuse en milieu rural de Côte d'Ivoire, Rapport final 5e conférence technique OCCGE, t. 2, Bobo-Dioulasso, , 3 p.
- N. Coulibaly, Point de la lutte antituberculeuse en Côte d'Ivoire, Rapport final 9e conférence technique OCCGE, t. 2, Bobo-Dioulasso, 21-25 avril 1969, 2 p.
- P. Delormas, « État de la lutte antituberculeux en Côte d'Ivoire », Rev. méd. Soc., 18, no 6-7, s.l., 1970, 10 p.
Articles connexes[modifier | modifier le code]
- Sanatorium
- Thiocarlide
- Vaccination
- BCG (vaccin)
- Nestor Postnikov
- Journée mondiale de lutte contre la tuberculose
- Mal de Pott
- Kanamycine A
Liens externes[modifier | modifier le code]
- Ressources relatives à la santé :
- Classification internationale des soins primaires
- Diseases Ontology
- DiseasesDB
- Genetic and Rare Diseases Information Center
- Héritage mendélien chez l'humain
- Héritage mendélien chez l'humain
- ICD-10 Version:2016
- ICD9Data.com
- Medical Subject Headings
- MedlinePlus
- NCI Thesaurus
- Orphanet
- PatientLikeMe
- Store medisinske leksikon
- WikiSkripta
- Ressource relative au vivant :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- [OMS 2015] (en) Laura Anderson et al., Global tuberculosis report 2015, Genève, Organisation mondiale de la santé, , 192 p. (ISBN 978-92-4-156505-9, lire en ligne).
- Dossier sur le site du Comité National contre les Maladies Respiratoires [PDF]
- Numéro thématique : Le point sur la tuberculose, Bulletin épidémiologique hebdomadaire (BEH), mai 2005, France.
- Huchon G., Tuberculose (livre en version électronique).
- Documentaire Tuberculose, une inquiétante résistance, réalisé par François Pomès pour Label News, Public Sénat, et Canal Savoir, 2014.
- Fabienne Lemarchand et Brigitte Gicquel, « La tuberculose », La Recherche, no 392, , p. 73 (lire en ligne).

