Proline
| Proline | |
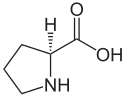 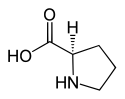 L ou S(–)-proline et D ou R(+)-proline |
|
| Identification | |
|---|---|
| Nom UICPA | acide pyrrolidine-2-carboxylique |
| Synonymes |
P, Pro |
| No CAS | (racémique) (L) ou S(–) (D) ou R(+) |
| No ECHA | 100.009.264 |
| No CE | 205-702-2 (L) |
| FEMA | 3319 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H9NO2 [Isomères] |
| Masse molaire[1] | 115,130 5 ± 0,005 4 g/mol C 52,16 %, H 7,88 %, N 12,17 %, O 27,79 %, |
| pKa | 1,95 - 10,64 |
| Propriétés biochimiques | |
| Codons | CCA, CCU, CCG, CCC |
| pH isoélectrique | 6,30[2] |
| Acide aminé essentiel | non |
| Occurrence chez les vertébrés | 5,0 %[3] |
| Précautions | |
| SIMDUT[4] | |
Produit non contrôlé |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La proline (abréviations IUPAC-IUBMB : Pro et P) est un acide α-aminé dont l'énantiomère L est l'un des 22 acides aminés protéinogènes, encodé sur les ARN messagers par les codons CCU, CCC, CCA et CCG. C'est le seul acide aminé protéinogène ayant une amine secondaire et non primaire, ce qui lui confère une géométrie particulière tendant à interrompre les structures secondaires des protéines telles que les hélices α et les feuillets β.
La proline forme des résidus apolaires qui en polymérisant peuvent former divers types de protéines dans une famille dite des polyprolines.
La présence de nombreux résidus de proline peut être à l'origine d'une hélice à proline; c'est notamment le cas du collagène. Le cycle de la proline est presque plan. Cela peut être montré en considérant les angles de liaison dans ce cycle[5].
Dans le monde animal
[modifier | modifier le code]La proline intervient notamment dans la synthèse du collagène, qui possède la séquence (Gly–Pro–Hyp)n et la cicatrisation.
Dans le monde végétal
[modifier | modifier le code]La proline est impliquée dans la bonne germination des graines, la floraison et d'autres phases de développement des plantes[6].
On a constaté des accumulations de proline chez de nombreuses d'espèces végétales quand elles étaient exposées à divers types de stress environnementaux, dont le stress hydrique chez la tomate et la betterave sucrière (sécheresse)[6],[7],[8].
Un nombre croisant de preuves plaident pour une corrélation positive entre ces accumulations et la gestion métabolique de ces stress par les plantes. Elle a un rôle d'osmolyte, mais elle est aussi un chélateur de métaux et a des propriétés antioxydantes: « Appliquée de manière exogène et à faibles doses, elle améliore la tolérance au stress chez les plantes », « la proline exogène atténue le stress salin en améliorant les activités antioxydantes, en réduisant l'absorption du sel tout en améliorant l'assimilation du potassium » chez la tomate, le concombre, les oignons[9],[10],[11].
Plusieurs auteurs ont aussi noté des effets indésirables à des doses plus élevées[6]. Une publication brésilienne (2019) a déterminé le juste dosage en proline des applications aux tomates cultivés en serre affectées par des températures élevées[12].
Données
[modifier | modifier le code]- Force de van der Waals : 90
- pK1 (α-COOH) : 1,95
- pK2 (αN-H) : 10,64
La proline contient dans sa molécule une fonction amine secondaire cyclique.
Un autre acide aminé, l'hydroxyproline, dérive de la proline par hydroxylation en 4.
Produits phytopharmaceutiques
[modifier | modifier le code]- Risque de confusion: Il existe chez Bayer un fongicide sous la marque Proline dont la substance active est le prothioconazole[13].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Francis A. Carey, « Table of pKa and pI values », sur Département de chimie de l'université de Calgary, (consulté le ).
- (en) M. Beals, L. Gross, S. Harrell, « Amino Acid Frequency », sur The Institute for Environmental Modeling (TIEM) à l'université du Tennessee (consulté le ).
- « Proline (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- J. Behre, R. Voigt, I. Althöfer, S. Schuster: On the evolutionary significance of the size and planarity of the proline ring. Naturwissenschaften 99 (2012) 789-799.
- (en) Mudasir Irfan Dar, Mohd Irfan Naikoo, Farha Rehman, Fauzia Naushin et Fareed Ahmad Khan, « Proline Accumulation in Plants: Roles in Stress Tolerance and Plant Development », dans Noushina Iqbal, Rahat Nazar et Nafees A. Khan, Osmolytes and Plants Acclimation to Changing Environment: Emerging Omics Technologies, New Delhi, Springer, (ISBN 978-81-322-2615-4 et 978-81-322-2616-1, DOI 10.1007/978-81-322-2616-1_9), p. 155-166.
- (en) « SlWRKY81 reduces drought tolerance by attenuating proline biosynthesis in tomato », Scientia Horticulturae, vol. 270, , p. 109444 (ISSN 0304-4238, DOI 10.1016/j.scienta.2020.109444, lire en ligne, consulté le )
- (en) « Investigation of the proline role in controlling traits related to sugar and root yield of sugar beet under water deficit conditions », Agricultural Water Management, vol. 243, , p. 106448 (ISSN 0378-3774, DOI 10.1016/j.agwat.2020.106448, lire en ligne, consulté le )
- (en) Ahmed El Moukhtari, Cécile Cabassa-Hourton, Mohamed Farissi et Arnould Savouré, « How Does Proline Treatment Promote Salt Stress Tolerance During Crop Plant Development? », Frontiers in Plant Science, vol. 0, (ISSN 1664-462X, DOI 10.3389/fpls.2020.01127, lire en ligne, consulté le )
- (en) « Silicon confers cucumber resistance to salinity stress through regulation of proline and cytokinins », Plant Physiology and Biochemistry, vol. 156, , p. 209–220 (ISSN 0981-9428, DOI 10.1016/j.plaphy.2020.09.014, lire en ligne, consulté le )
- (en) « Exogenously applied proline enhances growth and productivity of drought stressed onion by improving photosynthetic efficiency, water use efficiency and up-regulating osmoprotectants », Scientia Horticulturae, vol. 272, , p. 109580 (ISSN 0304-4238, DOI 10.1016/j.scienta.2020.109580, lire en ligne, consulté le )
- (en) « L-proline alleviates heat stress of tomato plants grown under protected environment », Scientia Horticulturae, vol. 268, , p. 109370 (ISSN 0304-4238, DOI 10.1016/j.scienta.2020.109370, lire en ligne, consulté le )
- Bayer Suisse AG, « Proline® », sur Bayer Suisse AG (consulté le ).
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- Ali Q, Ashraf M, Athar HUR (2007) Exogenously applied proline at different growth stages enhances growth of two maize cultivars grown under water deficit conditions. Pak J Bot 39:1133–1144
- (en) Patrick Armengaud, Laurent Thiery, Nathalie Buhot et Ghislaine Grenier-de March, « Transcriptional regulation of proline biosynthesis in Medicago truncatula reveals developmental and environmental specific features », Physiologia Plantarum, vol. 120, no 3, , p. 442–450 (ISSN 0031-9317 et 1399-3054, DOI 10.1111/j.0031-9317.2004.00251.x, lire en ligne, consulté le )
- (en) M. Ashraf et M.R. Foolad, « Roles of glycine betaine and proline in improving plant abiotic stress resistance », Environmental and Experimental Botany, vol. 59, no 2, , p. 206–216 (DOI 10.1016/j.envexpbot.2005.12.006, lire en ligne, consulté le )

