« Maladie à coronavirus 2019 » : différence entre les versions
mAucun résumé des modifications |
→Covid-19 et grossesse : 80 % des femmes enceintes RT-PCR positif n'avaient aucun signe clinique dans une maternité de NY |
||
| Ligne 294 : | Ligne 294 : | ||
* une étude sur 24 personnes sans signes cliniques mais hospitalisées car ayant un RT-PCR positif montre que seuls 20 % présenteront des signes cliniques, 50 % présenteront des anomalies pulmonaires au [[Tomodensitométrie|CT-SCAN]]. Les 30 % restants n'auront ni signe clinique ni anomalie pulmonaire. Ces sept cas étaient plus jeunes que les autres avec une médiane d'âge de 14 ans (âge médian des 24 : 32.5 ans). Pour les 24 personnes, la médiane de temps entre le premier test positif et la disparition du virus est de dix jours mais avec un maximum de 21 jours. Aucun n'eut de forme sévère. Les 7 porteurs asymptomatiques étaient contagieux pendant une durée médiane de 4 jours, mais avec une grande variabilité interindividuelle (IQR, 2.0-15.0). Il a été confirmé que certains d'entre eux avaient infecté des proches<ref name=":3">{{Article|langue=en|prénom1=Zhiliang|nom1=Hu|prénom2=Ci|nom2=Song|prénom3=Chuanjun|nom3=Xu|prénom4=Guangfu|nom4=Jin|titre=Clinical Characteristics of 24 Asymptomatic Infections with COVID-19 Screened among Close Contacts in Nanjing, China|périodique=medRxiv|date=2020-02-25|doi=10.1101/2020.02.20.20025619|lire en ligne=https://www.medrxiv.org/content/10.1101/2020.02.20.20025619v2|consulté le=2020-03-01|pages=2020.02.20.20025619 }}.</ref>. |
* une étude sur 24 personnes sans signes cliniques mais hospitalisées car ayant un RT-PCR positif montre que seuls 20 % présenteront des signes cliniques, 50 % présenteront des anomalies pulmonaires au [[Tomodensitométrie|CT-SCAN]]. Les 30 % restants n'auront ni signe clinique ni anomalie pulmonaire. Ces sept cas étaient plus jeunes que les autres avec une médiane d'âge de 14 ans (âge médian des 24 : 32.5 ans). Pour les 24 personnes, la médiane de temps entre le premier test positif et la disparition du virus est de dix jours mais avec un maximum de 21 jours. Aucun n'eut de forme sévère. Les 7 porteurs asymptomatiques étaient contagieux pendant une durée médiane de 4 jours, mais avec une grande variabilité interindividuelle (IQR, 2.0-15.0). Il a été confirmé que certains d'entre eux avaient infecté des proches<ref name=":3">{{Article|langue=en|prénom1=Zhiliang|nom1=Hu|prénom2=Ci|nom2=Song|prénom3=Chuanjun|nom3=Xu|prénom4=Guangfu|nom4=Jin|titre=Clinical Characteristics of 24 Asymptomatic Infections with COVID-19 Screened among Close Contacts in Nanjing, China|périodique=medRxiv|date=2020-02-25|doi=10.1101/2020.02.20.20025619|lire en ligne=https://www.medrxiv.org/content/10.1101/2020.02.20.20025619v2|consulté le=2020-03-01|pages=2020.02.20.20025619 }}.</ref>. |
||
* un article (5 mars 2020) parle de quatre personnes ayant été contaminées par deux porteurs avant que ces porteurs aient présenté les premiers symptômes . Une personne contaminée est restée positive au test RT-PCR avec une charge virale élevée dans les expectorations après réduction des symptômes<ref>{{Article|langue=en|prénom1=Camilla|nom1=Rothe|prénom2=Mirjam|nom2=Schunk|prénom3=Peter|nom3=Sothmann|prénom4=Gisela|nom4=Bretzel|titre=Transmission of 2019-nCoV Infection from an Asymptomatic Contact in Germany|périodique=New England Journal of Medicine|volume=382|numéro=10|date=2020-03-05|issn=0028-4793|issn2=1533-4406|doi=10.1056/NEJMc2001468|lire en ligne=http://www.nejm.org/doi/10.1056/NEJMc2001468|consulté le=2020-03-05|pages=970–971 }}.</ref>. |
* un article (5 mars 2020) parle de quatre personnes ayant été contaminées par deux porteurs avant que ces porteurs aient présenté les premiers symptômes . Une personne contaminée est restée positive au test RT-PCR avec une charge virale élevée dans les expectorations après réduction des symptômes<ref>{{Article|langue=en|prénom1=Camilla|nom1=Rothe|prénom2=Mirjam|nom2=Schunk|prénom3=Peter|nom3=Sothmann|prénom4=Gisela|nom4=Bretzel|titre=Transmission of 2019-nCoV Infection from an Asymptomatic Contact in Germany|périodique=New England Journal of Medicine|volume=382|numéro=10|date=2020-03-05|issn=0028-4793|issn2=1533-4406|doi=10.1056/NEJMc2001468|lire en ligne=http://www.nejm.org/doi/10.1056/NEJMc2001468|consulté le=2020-03-05|pages=970–971 }}.</ref>. |
||
*Une étude parut le 13 avril 2020 dans le NEJM sut les 215 femmes ayant accouché entre le 22 mars et 24 avril au New York–Presbyterian Allen Hospital and Columbia University Irving Medical Center et ayant bénéficié d'un test RT-PCR systématique montre que le virus était présent chez 33 femmes. Sur ces 33 femmes seul 4 femmes étaient symptomatiques à l'entrée soit 15,4% de femmes porteuses du virus dont 87% asymptomatique. Le suivi de ces patient ont montré que 4 femmes asymptomatiques sont devenus symptomatiques après leur accouchement. Un suivi à long terme n'était pas possible car les patientes quittait généralement la maternité 2 jours après l’accouchement<ref>{{Article |langue=en |prénom1=Desmond |nom1=Sutton |prénom2=Karin |nom2=Fuchs |prénom3=Mary |nom3=D’Alton |prénom4=Dena |nom4=Goffman |titre=Universal Screening for SARS-CoV-2 in Women Admitted for Delivery |périodique=New England Journal of Medicine |date=2020-04-13 |issn=0028-4793 |issn2=1533-4406 |doi=10.1056/NEJMc2009316 |lire en ligne=http://www.nejm.org/doi/10.1056/NEJMc2009316 |consulté le=2020-04-15 |pages=NEJMc2009316 }}</ref>. |
|||
== Incubation == |
|||
[[Fichier:James A. Backer et al. - Incubation period of 2019 novel coronavirus (2019-nCoV) infections among travellers from Wuhan, China, 20–28 January 2020 - 2000062-f3.gif|vignette|upright=1.5|Durée d'incubation, estimée, pour {{nombre|3|types}} de coronavirus, par différentes études ([[Boîte à moustaches|boîtes à moustaches]]) : <br>Bleu : [[Coronavirus 2 du syndrome respiratoire aigu sévère|SARS-CoV-2]] ; rose : [[SARS-CoV]] ; vert : [[coronavirus du syndrome respiratoire du Moyen-Orient|MERS-CoV]]<br> Médiane = point noir ; Intervalle interquartile = encadré ; la longueur des « moustaches » valant {{nombre|1,5|fois}} l’[[Indicateur de dispersion|écart interquartile]]. <br>D'après les 1{{res}} données disponibles pour le [[Coronavirus 2 du syndrome respiratoire aigu sévère|SARS-CoV-2]] (à confirmer donc...)]] |
[[Fichier:James A. Backer et al. - Incubation period of 2019 novel coronavirus (2019-nCoV) infections among travellers from Wuhan, China, 20–28 January 2020 - 2000062-f3.gif|vignette|upright=1.5|Durée d'incubation, estimée, pour {{nombre|3|types}} de coronavirus, par différentes études ([[Boîte à moustaches|boîtes à moustaches]]) : <br>Bleu : [[Coronavirus 2 du syndrome respiratoire aigu sévère|SARS-CoV-2]] ; rose : [[SARS-CoV]] ; vert : [[coronavirus du syndrome respiratoire du Moyen-Orient|MERS-CoV]]<br> Médiane = point noir ; Intervalle interquartile = encadré ; la longueur des « moustaches » valant {{nombre|1,5|fois}} l’[[Indicateur de dispersion|écart interquartile]]. <br>D'après les 1{{res}} données disponibles pour le [[Coronavirus 2 du syndrome respiratoire aigu sévère|SARS-CoV-2]] (à confirmer donc...)]] |
||
Version du 15 avril 2020 à 10:06
| Causes | Coronavirus 2 du syndrome respiratoire aigu sévère |
|---|---|
| Transmission | Transmission aéroportée (d), contamination par les sécrétions respiratoires (d), transmission par contact (d), transmission directe (d), transmission par surface contaminée (d) et infection de l’œil (d) (?) |
| Incubation min | 2 j |
| Incubation max | 14 j ou 27 j |
| Symptômes | Fièvre, toux sèche, dyspnée |
| Diagnostic | PCR sur prélèvement nasopharyngé ou bronchique et scanner des poumons |
|---|---|
| Différentiel | Infection virale à H5N1, H7N9, grippe et toutes infections pulmonaires bactériennes et virales y compris MERS, SRAS et tuberculose |
| Traitement | Traitement symptomatique, antiviral, oxygénothérapie normobare, immunothérapie, thérapie par immunoglobulines, immunosuppresseur, sérum immun et traitement de la Covid-19 |
| Spécialité | Infectiologie, pneumologie, virologie, épidémiologie et médecine d'urgence |
| Mortalité | 4,635 % des cas reportés par l’OMS (le 28 mars 2020) |
|---|
| CIM-10 | U07.1 et U07.2 |
|---|---|
| OMIM | 301051 |
| DiseasesDB | 60833 |
| MedlinePlus | 007768 |
| eMedicine | 2500114 |
| MeSH | D000086382 |
La maladie à coronavirus 2019 ou Covid-19 (acronyme anglais de coronavirus disease 2019) est une maladie infectieuse émergente de type zoonose virale causée par la souche de coronavirus SARS-CoV-2. Les symptômes les plus fréquents en sont la fièvre, la toux et la gêne respiratoire et, plus rarement, un syndrome de détresse respiratoire aiguë pouvant entraîner la mort, notamment chez les personnes rendues fragiles par l'âge ou des comorbidités. Une autre complication mortelle est une réponse exacerbée du système immunitaire (choc cytokinique).
La maladie apparaît en novembre 2019 à Wuhan, en Chine centrale avec des cas inhabituels de pneumopathie justifiant de sévères mesures de confinement en janvier 2020. En mars 2020 l'épidémie est requalifiée en pandémie par l'Organisation mondiale de la santé (OMS). La pandémie de Covid-19 se propage rapidement dans de nombreux autres pays qui prennent à leur tour des mesures similaires en mars, provoquant des fermetures de frontières, un brusque ralentissement de l'économie mondiale et un krach boursier le .
La Covid-19 est contagieuse avec transmission interhumaine via des gouttelettes respiratoires, surtout lorsque les gens toussent ou éternuent, ou via un contact manuel avec une surface contaminée suivi d'un toucher de la main sur le visage (bouche, nez, yeux, pas la peau). La période d'incubation se situe généralement entre deux et quatorze jours, avec une moyenne de cinq jours. Une proportion importante des personnes infectées ne présentent aucun symptôme mais peuvent transmettre la maladie. Son diagnostic repose surtout sur un test (RT-PCR) et/ou sur les images pulmonaires faites au scanner.
En termes de prévention, le lavage très fréquent des mains, la limitation des contacts inter-humains (distanciation sociale, mesures-barrières, confinement), ainsi que le port d'un masque médical par les personnes atteintes[1], permettent de limiter le taux de reproduction du virus et donc de faciliter la gestion de la crise par les services de santé. Malgré des recherches intenses, il n'y a encore[n 1] ni traitement (inhibiteur ou médicament spécifique reconnu) ni vaccin[2].
Historique de la maladie
Le premier cas rapporté serait un patient de 55 ans tombé malade le en Chine[3]. Le , le nombre de cas était de vingt-sept, et le de soixante, incluant plusieurs personnes qui, travaillant au marché de gros de fruits de mer de Huanan, sont hospitalisées à l'hôpital de Huanan, dans la région du Hubei, pour pneumopathie[4]. À ce stade, il n'est pas certain que les humains puissent se contaminer entre eux, les malades ayant pu être contaminés par une source animale commune bien que de nombreux observateurs soupçonnent les autorités chinoises d'avoir voulu étouffer la vérité[5].
Le , un kit diagnostic ciblant vingt-deux germes pathogènes respiratoires (dix-huit virus et quatre bactéries) donnant un résultat négatif, les médecins réalisent à ce stade qu'ils sont en présence d'un nouvel agent pathogène respiratoire[6]. Le , l'Organisation mondiale de la santé (OMS), est informée de l'existence de cas de pneumonie d'origine inconnue dans le Wuhan[7].
Le , les autorités chinoises signalent une soixantaine de victimes[8], et isolent un nouveau type de coronavirus : le SARS-CoV-2 (deuxième coronavirus lié au syndrome respiratoire aigu sévère). Le , les Centres pour le contrôle et la prévention des maladies (CDC) aux États-Unis communiquent sur les risques d’une épidémie ; l'OMS fait de même le [9].
Le , l'OMS émet son premier rapport journalier[7] sur ce qui allait devenir une pandémie. Le 23, l'OMS indique que la maladie est transmissible entre humains[10]. Le 24, l'OMS indique que les modes de transmissions de la maladie sont très probablement les mêmes que ceux des autres coronavirus : gouttelettes éjectées (par postillons, lors de toux ou d'éternuements), contacts directs ou via des objets contaminés.
Le 26 janvier, la Commission nationale de la Santé de Chine (CNS), indique que ce nouveau virus a une période d’incubation pouvant aller jusqu’à deux semaines, et surtout que la contagion est possible durant la période d’incubation[11]. De ce fait, s'il ne fait pas l'objet d'une politique de détection systématique et précoce, il est susceptible de se répandre avec une croissance exponentielle.
Le , l'OMS déclare que cette épidémie constitue une urgence de santé publique de portée internationale (USPPI)[12]. Certains évoquent la « maladie X » (nom donné en 2018 par l'OMS à une maladie susceptible de causer un danger international)[13],[14],[15].
Le , le directeur général de l'OMS, Tedros Adhanom Ghebreyesus, annonce que la maladie est désormais officiellement nommée « maladie à coronavirus 2019 (Covid-19) »[16],[17], Covid-19 étant l'acronyme anglais de coronavirus disease 2019. Le virus est lui finalement nommé « coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV-2) »[17].
Le , l'OMS publie un guide sur les mesures préventives destinées à freiner l'épidémie[18].
Le , le directeur général de l'OMS annonce qu'il s'agit d'une pandémie. C'est la première fois qu'une pandémie est causée par un coronavirus[19].
Des mesures nationales sévères de confinement sont prises dans de nombreux pays, dès en Chine, puis en (Italie, Espagne, France, Suisse, Belgique, Canada, etc.). Ces mesures provoquent des annulations en série de rassemblements et des fermetures de frontières[20], le brusque ralentissement de l'économie mondiale et le krach boursier du [21],[22].
Le coronavirus SARS-CoV-2 génère la maladie infectieuse Covid-19.
Pénétration dans l'organisme et physiopathologie
Les virus infectent généralement les cellules en y entrant via une endocytose médiée par un récepteur auquel chaque virus doit d'abord se lier. Le récepteur utilisé par le SARS-CoV-2 est une protéine de surface cellulaire : l'enzyme de conversion de l'angiotensine 2 (ACE2), la même que pour le SARS-CoV mais avec une affiné 10 à 20 plus importante que le SARS-Cov[23]. Le virus se lie avec le récepteur ACE-2 par ses protéines présentes dans les épines de sa couronne (protein spyke)[23]..
L'ACE2 est une enzyme de conversion des récepteurs cellulaires de l'angiotensine II[24]. Elle est présente sur les « cellules épithéliales alvéolaires AT2 » situées dans les alvéoles pulmonaires, mais aussi dans l'œsophage (dans les cellules épithéliales supérieures et stratifiées), dans les entérocytes absorbants de l'iléon et du côlon[24],[25] et dans le pancréas (de légères pancréatites sont d'ailleurs observées, via analyses d'amylase et de lipase et via l'imagerie médicale, chez les malades légèrement ou sévèrement atteints par la Covid-19[25]). Les « cellules à AT2 » sont connues pour être sujettes aux infections virales[26].
Il existe un deuxième récepteur de l'angiotensine au niveau des cellules pulmonaires nommé ACE1. Ce récepteur convertit la pro-hormone angiotensine I (peptide comprenant 10 acides aminés ) en angiotensine II ((peptide comprenant 8 acides aminés ) . L'angiotensine II entraîne une vasoconstriction des vaisseaux avec augmentation de la pression artérielle. L'ACE2 convertit l'angiotensine II en un peptide à 7 acides aminés agissant sur des récepteurs Mas entraînant une vaso-dilatation[26]..
Le virus en utilisant l' ACE2 empêche l'élimination naturelle de l'angiotensine II , Cette accumulation d'angiotensine II pourrait entraîner une stimulation des récepteurs AT1R présents sur les lymphocytes T[27] entraînant une libération de cytokine pouvant en l'absence de régulation entraîner un choc cytokinétique
L'implication du système rénine -angiotensine , régulant la pression artérielle, dans la réponse immunitaire innée a fait l'objet de nombreuses publications[27] (plus de 15) ainsi que ce système agit par l'intermédiaire du récepteur AT1R présents sur les lymphocytes T(12 publications)[27]
Le virus pourrait s'introduire dans le liquide cérébrospinal des personnes contaminées[28].
Répartition dans l'organisme
La répartition du virus dans l'organisme n'est pas encore précisément connue (mars 2020). Elle pourrait varier selon les souches virales.
Selon une synthèse basée sur 1 070 échantillons prélevés à l'hôpital en Chine en janvier-février 2020 et publiée le 11 mars 2020[29], les taux positifs les plus élevés ont été trouvés dans les lavages bronchoalvéolaires (14 cas sur 15 ; soit 93 %). Venaient ensuite les expectorations (72 cas sur 104 ; 72 %), les écouvillons nasaux (5 cas sur 8 ; 63 %), la biopsie par fibrobronchoscopie (6 cas sur 13 ; 46 %), le pharynx (126 cas sur 398 ; 32 %), les matières fécales (44 cas sur 153 ; 29 %) et enfin dans le sang (3 cas sur 307 ; 1 %). Dans aucun cas le virus n'a été retrouvé dans l'urine, mais les auteurs notent qu'un SARS-CoV-2 infectieux a été trouvé dans les selles de deux patients sans diarrhées[29].
Comme ceux du SARS et le MERS, ce virus semble pouvoir infecter le système nerveux central, comme l'a montré l'hôpital Ditan de Pékin chez un patient de 56 ans atteint du COVID-19 et qui présentait des troubles neurologiques (contractions de muscles du visage après quelques jours de traitement); des coronavirus ont été retrouvés dans son liquide cérébrospinal et il avait développé une encéphalite[30].
Le virus semble pouvoir également infecter ou affecter le foie et les reins. Ces infections peuvent impacter la métabolisation des médicaments reçus.[31]
En revanche le virus ne se retrouve pas dans les sécrétions vaginales et la voie vaginale ne semble pas être une voie d'infection[32].
Comparaison de dangerosités avec d'autres viroses
Le taux de reproduction de base est le nombre moyen d'individus qu'une personne infectieuse peut infecter, tant qu'elle est contagieuse.
Le temps de génération est le délai qui sépare l'apparition des signes cliniques d'une personne infectée et l'apparition des signes cliniques des ou de la personne qu'elle a infectée.
| Virus | Maladie | Transmission respiratoire | Taux de reproduction de base | Taux de létalité pour 1000 | Temps de génération (jours) | Contagion avant l'apparition des symptômes |
|---|---|---|---|---|---|---|
| SARS-CoV-2 | Covid-19 | Oui | Entre 3 et 4 | Entre 10 et 30 | > 3 | Oui[33],[34] |
| Alphainfluenzavirus Betainfluenzavirus Gammainfluenzavirus |
grippe | Oui | 1,4 | 1 | > 3 | Oui[35] |
| SARS-CoV | SRAS | Oui | Supérieure à 2 | 94 | > 3 | Non (trois jours après la toux) |
| MERS-CoV | SRMO | Oui | Inférieure à 1 | 344 | > 3 | |
| Morbillivirus (measles virus) | rougeole | Oui | 12 | 1 | > 3 | Non mais signes très légers |
Bien entendu, l'existence d'une vaccination efficace réduit considérablement l'impact d'un virus dangereux.
Transmission
La première étude (portant sur les 425 premiers cas) dans The New England Journal of Medicine, montre que la transmission inter-humaine date au moins de la mi-[36].
Pour éviter la contagion, une distance supérieure à un mètre semble généralement suffisante, par précaution 2 m, voire plus, sont parfois proposés ou imposés[37]. Une étude publiée le 26 mars dans le JAMA montre qu'en cas de toux ou d'éternuement, la diffusion du virus est possible lors de l’expiration jusqu'à une distance pouvant atteindre 8 mètres[38], très loin des deux mètres recommandées par le CDC[39]. En présence d'aérosols et non de gouttelettes, le masque FFP2 est efficace.[réf. souhaitée]
L’existence de patients totalement asymptomatique pouvant atteindre 25% des gens infectés et contagieux semble se confirmer et pourrait remettre en cause les recommandations de l'OMS de ne pas porter de masque[40].
Contagiosité
La contagiosité du SARS-Cov-2 serait notamment due à sa capacité à être clivé par la furine (protéine présente dans de nombreux tissus), ce qui n'était pas le cas des deux autres coronavirus hautement pathogènes pour l'humain[41],[42].
Le South China Morning Post fait état dans son édition du 11 Avril 2020 d'une étude post mortem de l’Université de Hong-Kong sur la multiplication du SARS-Cov-2 par rapport au SARS-Cov (responsable du SARS) dans le tissu pulmonaire. Le Sars-Cov-2 se multiplie entre 5 et 10 plus que le SAR-Cov dans la même unité de temps aboutissant à une production de virus 3 fois supérieures que le SARS-Cov. Cette multiplication importante s'accompagne dune réponse immunitaire plus faible de l'organisme[43].
Durée de la période d'excrétion virale
En général
Cette période correspond au temps durant lequel un malade est potentiellement contagieux.
Elle commence dans les heures qui suivent la contamination, donc avant toute manifestation de la maladie.
À la mi-mars 2020, on manque de données concernant les porteurs asymptomatiques et/ou non-hospitalisés, mais chez les patients hospitalisés, la durée médiane d'excrétion virale était de 20 jours environ chez les survivants, et le SARS-CoV-2 était détectable jusqu'à la mort chez tous les non-survivants[44]. Il est probable que ces patients sont ceux qui excrètent le plus de virus, et le plus longtemps. La durée la plus longue d'excrétion virale observée parmi près de 200 cas étudiés a été (parmi les survivants) de 37 jours[44].
Cette excrétion, plus précoce et plus longue qu'attendue, est à prendre en compte dans les modélisations épidémiologiques. Elle confirme la nécessité d'isoler les patients infectés et de rechercher des antiviraux plus efficaces[44]. La contagiosité disparaît lorsque l’excrétion du virus disparaît de la gorge[réf. nécessaire].
Chez les enfants
Ils ne présentent souvent que des symptômes bénins (ou aucun symptôme) mais excrètent le virus et peuvent être alors contagieux. De plus l'excrétion virale dans les selles persiste même après la disparition du virus dans les excrétions nasales ou dans les écouvillonages de la gorge, avec des écarts constatés de 8 à 20 jours. Ce fait évoque des mécanismes différents de ceux constatés chez les adultes[45],[46].
Taux de contagion
Selon de premiers travaux de recherche, le taux de reproduction de base (noté R0) qui est un indice de contagiosité se situerait entre 2,2 et 3,5[36],[47].
Il est de 2,2 (intervalle de confiance 95 %, de 1,4 à 3,9) sur les 425 premiers cas confirmés[36].
Une revue de la littérature publiée entre le et le indique une médiane du taux de reproduction de base à 2,79[48].
En avril 2020, le taux de contagiosité est réévalué fortement à la hausse, entre 3.8 et 8.9, avec une médiane à 5.7[49],[50].
Ce taux pourrait varier selon les souches émergentes du virus ou avec une baisse de virulence (classique chez le virus en cas de pandémie)
Taux d’attaque secondaire
Ce taux décrit le nombre de foyers secondaires apparaissant à partir d'un foyer primaire. Il indique la facilité d'une infection à se propager dans un lieu clos (foyer...). Une publication du 27 février dans le Lancet, estime ce taux d'attaque secondaire à 35 %[51].
Survie du virus hors de l'organisme
Elle a dans un premier temps été estimée comprise entre trois heures (en milieu sec) et trois jours (en milieu humide), mais comme pour la plupart des virus, elle varie beaucoup selon les conditions de température et d'humidité, de lumière (les UV solaires le détruisent), et selon le type de surface sur laquelle le virus ou le résidu sec des gouttelettes en contenant se sont déposées.
En février 2020, on estimait que le pouvoir infectieux du virus disparaissait en quelques heures[52]. On notait cependant que la Covid-19 se montrait bien plus contagieuse que le SRAS et encore bien plus que le MERS, surtout pour le personnel soignant, surexposé, et ce malgré les masques chirurgicaux souvent.
Une étude américaine récente (10 mars 2020, parue dans le NEJM[53]) a mesuré le temps de 'survie' des virus SARS-Cov-2 et du SARS-Cov ; 1) en aérosol (en suspension sèche dans l'air, c'est-à-dire hors de gouttelettes) et 2) sur 4 types de surfaces[54] :
| Virus | En suspension dans l'air |
Sur une surface de cuivre | Sur une surface de carton | Sur une surface d'inox |
Sur une surface de polypropylène |
|---|---|---|---|---|---|
| SARS | Encore très présent après 3 heures. | Les virus infectieux ont disparu en 8 heures. | Les virus infectieux ont disparu en 8 heures. | Encore détectable à faible concentration après 48 heures. | Encore détectable à faible concentration après 72 heures. |
| SARS-Cov-2 | Encore très présent après 3 heures. | Les virus infectieux ont disparu en 4 heures. | Les virus infectieux ont disparu en 24 heures. | Encore détectable à faible concentration après 72 heures. | Encore détectable à faible concentration après 72 heures. |
Important : trois heures est la durée maximale testée ci-dessus pour les aérosols (virus en suspension dans l'air) ;
3 heures après l'aérosolisation, le taux de SARS-CoV-2 viables était encore très significatif (le titre infectieux n'était passé que de 103,5 à 102,7 CID50/mL). Il en allait de même pour le SARS-CoV-1 qui en 3 heures passait de 104,3 à 103,5 TCID50/mL.
Cependant, il faut noter que ces deux études ont vocation d'abord à « prévenir le milieu hospitalier et les chercheurs qui manipulent le virus en laboratoire — qui sont en contact étroit avec les agents infectieux — sur différentes surfaces, pour minimiser les risques de contamination et d'infections nosocomiales »[55]. Les quantités de virus et leur charge virale utilisées pour ces tests en laboratoire sont très grandes et non représentatives de contaminations accidentelles en milieu ordinaire. L'étude américaine précise d'ailleurs que le virus résiste moins de 5 minutes en dessous de 10 000 particules (contre 100 millions de copies pour test)[55]. Toutefois, en cas de toux ou d'éternuement, les gouttelettes exhalées se diffusent dans l'air sous la forme d'un nuage chaud et humide dont la cinétique retarde l'évaporation de ces gouttelettes ; l'aérosol (résidu sec après leur évaporation) pourrait rester dans l'atmosphère ambiante pendant plusieurs heures, et dans des conditions propices se diffuser via les systèmes de ventilation, ce qui serait alors une source potentielle d'infections nosocomiales[38].
Saisonnalité
Une étude chinoise sur la température et le taux d'humidité dans la transmission du virus conclut que celle-ci semble peu influencée par ces paramètres[56].
Le chef du service de virologie du CHU de Caen, le Dr Astrid Vabret, rappelle que l'épidémie de SRAS s'est produite de à , puis de à . De l'automne au printemps, voire à l'été, donc. Et « on ne sait pas quel a été le rôle de la saisonnalité sur le SRAS ». Certes, « les virus sont tués par les hautes températures, mais on parle là de plus de 56 °C », insiste la virologue. « Si l'organisme d'un humain atteint cette température-là, s'il ne peut pas se refroidir, lui aussi meurt. C'est déjà compliqué de survivre à 43 °C »[57].
Le directeur de l'Institut de santé globale au sein de la faculté de médecine de l'université de Genève, Antoine Flahault, estime que, « sous les latitudes tempérées, les virus respiratoires, comme ceux de la grippe ou les coronavirus, sont sensibles aux saisons et l'hiver est leur saison de prédilection »[57].
Voies de transmission
Transmission interhumaine

Au les modalités précises de transmission sont encore mal cernées. Certaines personnes infectées n'ont pas transmis le virus, tandis que d'autres l'ont transmis à plusieurs personnes[58].
Plusieurs voies de transmission semblent coexister :
- la voie respiratoire directe : c'est la plus commune. Une étude publiée le 26 mars dans le Jama montre que la diffusion du virus est possible lors de l’expiration de jusqu'à une distance pouvant atteindre 8 mètres[38], très loin des deux mètres recommandées par le CDC[39].
- par contact avec une surface ou un objet infecté : les doigts qui se sont contaminés sur une surface, s'ils sont ensuite portés à la bouche, près des narines ou sur l'œil, peuvent être vecteurs du virus. Les virus du SRAS et du MERS pouvaient rester infectieux sur des surfaces lisses et certains objets (dits fomites)[59] : ceci est aussi démontré depuis février 2020 pour le SARS-CoV-2[60]. Mi-mars, on estime qu'à l'intérieur d'une pièce, un coronavirus reste infectieux 9 jours sur des substrats lisses non-poreux[61], sauf sur le cuivre ou les métaux à base de cuivre (laiton, bronze) qui sont naturellement biocides. La demi-vie du virus (temps nécessaire pour que la moitié des virus soient inactivés) est d'environ treize heures sur de l'inox et seize heures sur du polypropylène[62] ;
- par des virus aérosolisés : une transmission par aérosols a été suggérée par l'OMS[63] et confirmée[62] (le virus pouvant alors rester infectieux deux à trois heures dans l'air, sans doute plus si l'hygrométrie est très élevée) ;
- par des particules ou gouttelettes fécales ou des personnes se lavant mal les mains après être passées aux toilettes. Ceci a d'abord été suggéré en février par deux laboratoires d'État chinois[64] puis confirmé dans JAMA le 12 mars 2020[65], ce qui est cohérent avec le fait que le récepteur de surface utilisé par le virus pour pénétrer dans une cellule est aussi présent dans les entérocytes de l'iléon et dans les colonocytes du tube digestif[24],[66],[67] ;
- par des eaux usées (en cas de fuites…) : lors de la pandémie de SRAS 2002-2003, une flambée majeure de SARS-CoV a concerné 321 personnes infectées dans un même immeuble de grande hauteur, au même moment, à Hong Kong. La conduite d'eau usée qui descendait à l'extérieur à proximité d'une rangée verticale de climatiseurs et de fenêtres a été jugée responsable de cette brutale contagion[68].
- par les systèmes d'air conditionné[69].
Transmission humain-animal
Un cas de transmission de l'humain vers l'animal semble documenté à Hong Kong[70]. Il s'agit d'un spitz nain testé faiblement positif après que son propriétaire a développé une Covid-19. Selon le ministère de l'Agriculture, des Pêches et de la Conservation de Hong Kong, les experts pensaient unanimement que ce chien avait « un faible niveau d'infection et qu'il s'agirait probablement d'un cas de transmission d'humain à animal ». Des experts médicaux, dont de l'OMS, enquêtent pour déterminer si le chien a été directement infecté ou s'il s'agit d'une contamination acquise via un objet porteur du virus. Pour l'OMS, il n'y avait pas encore de preuve que des animaux, comme les chiens ou les chats, puissent être infectés par ce coronavirus. Les autorités locales recommandent cependant de ne plus embrasser les animaux de compagnie. Le chien est mort 7 jours après avoir été testé et le propriétaire a refusé l'autopsie[71].
Un deuxième cas de transmission de l'humain vers un animal a été recensé en Belgique, il s'agit d'un chat qui a été contaminé par son maître testé positif au Covid-19.
L'étude d'une équipe de scientifiques du laboratoire de recherche vétérinaire à Harbin dans le nord-est de la Chine montre que le chat peut être infecté par le virus mais sans présenter de symptôme, son rôle semble néanmoins très minime dans la propagation du virus[72], mais néanmoins les scientifiques chinois ont constaté que la transmission entre chats pouvait être possible par crachats et que les chatons étaient plus gravement atteints que les adultes, avec « des lésions massives dans la muqueuse nasale et trachéale, ainsi que les poumons »[73]. Par contre, le furet serait plus sensible au virus, puisque certains d'entre eux auraient perdu l’appétit et eu de la fièvre[73]. Les autres animaux étudiés dont le chien, le porc, le poulet ou le canard ne semblent pas être atteint par le virus[72],[73].
Phases de transmission
Transmission en phase d'incubation
Elle est prouvée par des tests faits systématiquement chez des sujets ayant eu un contact avec un cas « index »[34]. A été ainsi mis en évidence :
- la présence du SARS-CoV-2 dans des frottis nasopharyngés au moyen de la technique de PCR quantitative par transcriptase inverse (qRT-PCR) ;
Une étude de la charge virale des écouvillons nasaux et de la gorge obtenus auprès des 17 patients symptomatiques en fonction du jour d'apparition de tout symptôme est publiée le 19 février[74] ; - une charge virale élevée (environ 100 000 000 de copies (du virus) par millilitre de crachat).
Transmission durant la maladie
- Des charges virales plus élevées sont détectées peu après l'apparition des symptômes, avec des valeurs plus fortes dans le nez que dans la gorge. Le schéma d'excrétion virale par les malades symptomatiques semble plus proche de celui des sujets grippés[75] que de celui observé chez les patients infectés par le SARS-CoV[76].
Transmission par des sujets asymptomatiques
Elle existe, et leur charge virale est similaire à celle des patients symptomatiques. On le sait grâce au test RT-PCR (réaction en chaîne par polymérase en transcription inverse) qui peut détecter à la fois la Covid-19 symptomatique et asymptomatique[77],[78] et les autorités chinoises l'ont confirmé dès le [79],[80].
Cependant mi-mars 2020, la part réelle des asymptomatiques parmi les malades reste inconnue. On sait néanmoins que :
- des transmissions précoces ont été signalées[34] ;
- en Chine pour les cas avérés (testés par RT-PCR), 1 % environ étaient asymptomatiques (ni fièvre, ni toux sèche ni fatigue)[81], chiffre sous-estimé car n'ont été testés que des cas suspects ;
- en Allemagne, 2 malades asymptomatiques ont été détectés par RT-PCR parmi 114 voyageurs (1,8 %) venant de Wuhan, alors que tous avaient réussi le dépistage basé sur les symptômes[78] ;
- des Japonais évacués du foyer chinois initial ont été diagnostiqués infectés malgré un test RT-PCR initialement négatif. Un homme d’une cinquantaine d’années (qui avait pris le 1er vol d’évacuation de Wuhan le ) a même été testé négatif à deux reprises avant de finalement se montrer atteint au 3e test (12 jours plus tard), et ce après qu'il soit resté isolé depuis son retour ;
- parmi les passagers du bateau de croisière Diamond Princess testés par PCR, 18% étaient des porteurs asymptomatiques[82] ; et le nombre de passagers testés positifs a ensuite continué à augmenter[83]. Faute d’un nombre suffisant de lits d’isolement à terre, les malades peu symptomatiques ont été traités à bord. Selon Bwire & Paulo (2020), faute de plans de gestion transnationaux clairs pour le traitement, l'isolement, la quarantaine et l'évacuation des passagers de navires de croisière, ceux-ci « peuvent être le maillon faible » de la lutte contre une telle épidémie (l’Oasis of the Seas embarque jusqu'à 6 296 passagers dans 2 706 cabines) ;
- même très gravement atteints, quelques malades n’ont pas de fièvre (sur 138 patients hospitalisés à Wuhan 98,6 % avaient de la fièvre mais 2 patients (1,4 %), en unité de soins non intensifs, n’en avaient pas[84] ;
- les jeunes et les enfants semblent plus souvent asymptomatiques ou peu symptomatiques ; leur rôle dans la contagion pourrait avoir été sous-estimé, d'autant qu'il y a proportionnellement peu d'enfants en Chine (début mars 2020, dans le monde, 300 millions d'enfants ne se sont pas rendus dans les écoles, ce qui serait alors une mesure utile).
Ces éléments confèrent à la Covid-19 un potentiel pandémique élevé. La détection et l'isolement précoce des cas asymptomatiques pourrait donc être utile mais implique de modifier les stratégies de gestion de la pandémie[85] ;
- les sujets asymptomatiques capables de transmettre des virus sont courants dans les autres infections à coronavirus[86].
- une étude sur 24 personnes sans signes cliniques mais hospitalisées car ayant un RT-PCR positif montre que seuls 20 % présenteront des signes cliniques, 50 % présenteront des anomalies pulmonaires au CT-SCAN. Les 30 % restants n'auront ni signe clinique ni anomalie pulmonaire. Ces sept cas étaient plus jeunes que les autres avec une médiane d'âge de 14 ans (âge médian des 24 : 32.5 ans). Pour les 24 personnes, la médiane de temps entre le premier test positif et la disparition du virus est de dix jours mais avec un maximum de 21 jours. Aucun n'eut de forme sévère. Les 7 porteurs asymptomatiques étaient contagieux pendant une durée médiane de 4 jours, mais avec une grande variabilité interindividuelle (IQR, 2.0-15.0). Il a été confirmé que certains d'entre eux avaient infecté des proches[87].
- un article (5 mars 2020) parle de quatre personnes ayant été contaminées par deux porteurs avant que ces porteurs aient présenté les premiers symptômes . Une personne contaminée est restée positive au test RT-PCR avec une charge virale élevée dans les expectorations après réduction des symptômes[88].
- Une étude parut le 13 avril 2020 dans le NEJM sut les 215 femmes ayant accouché entre le 22 mars et 24 avril au New York–Presbyterian Allen Hospital and Columbia University Irving Medical Center et ayant bénéficié d'un test RT-PCR systématique montre que le virus était présent chez 33 femmes. Sur ces 33 femmes seul 4 femmes étaient symptomatiques à l'entrée soit 15,4% de femmes porteuses du virus dont 87% asymptomatique. Le suivi de ces patient ont montré que 4 femmes asymptomatiques sont devenus symptomatiques après leur accouchement. Un suivi à long terme n'était pas possible car les patientes quittait généralement la maternité 2 jours après l’accouchement[89].

Bleu : SARS-CoV-2 ; rose : SARS-CoV ; vert : MERS-CoV
Médiane = point noir ; Intervalle interquartile = encadré ; la longueur des « moustaches » valant 1,5 fois l’écart interquartile.
D'après les 1res données disponibles pour le SARS-CoV-2 (à confirmer donc...)
La période d'incubation de la Covid-19 serait d'environ cinq jours, le plus souvent comprise entre trois et sept jours. Exceptionnellement, pour un peu plus de 1 % des cas, le temps d'incubation dépasse quatorze jours[90] et très exceptionnellement pourrait durer jusqu'à 24 jours[91].
Quatorze jours est donc considéré comme un bon délai de sécurité pour savoir si une personne est symptomatiquement infectée, et pour éviter qu'elle ne contamine d'autres gens hors de sa zone de confinement.
Historiquement, fin janvier, l'OMS, en se basant notamment sur les observations anciennes faites sur le MERS[92], a estimé la durée d'incubation à en moyenne cinq jours (entre deux et dix jours)[93]. On savait aussi déjà qu'« on peut être contagieux avant que les signes cliniques soient là », voire sans symptômes, comme avec la grippe ; et « que les cas secondaires sont de plus en plus fréquents »[80].
Le , une étude chinoise supervisée par Zhong Nanshan (médecin ayant découvert le SRAS en 2003)[91], menée sur près de 1 100 patients conclut à une incubation de 0 à 24 jours, avec une durée médiane de trois jours[94],[95].
Le 10 mars, une étude internationale[96] estime la durée médiane d'incubation à 5,1 jours (5,5 jours en moyenne), et que 97,5 % des personnes seront malades 11,5 jours après le contact infectieux. Même si dans 101 cas sur 10 000 (99e percentile), les 14 jours sont dépassés, les auteurs principaux, le docteur Lauer et Ms. Grantz, jugent qu'il n'y a pas lieu de remettre en cause la durée de 14 jours de quarantaine[90].
Symptômes et manifestations cliniques

Une étude française publiée le 27 mars décrit trois types de malades[97] :
- Patients présentant peu de signes cliniques mais avec une charge virale nasale élevée et étant très contagieux ;
- Patients ayant des symptômes légers au départ mais subissant une aggravation vers le dixième jour avec apparition d'un syndrome respiratoire aigu sévère malgré une charge virale qui diminue. La réaction immunitaire au niveau pulmonaire ne serait plus régulée.
- Patients avec une aggravation rapide vers un syndrome respiratoire aigu avec persistance d'une charge virale élevée dans le nez et dans la gorge et apparition d'une virémie sanguine à SARS-Cov-2 provoquant une défaillance multi-viscérale conduisant au décès. Ce troisième type de malade concerne surtout les personnes âgées.
Forme clinique la plus fréquente : forme respiratoire
Signes cliniques
En , les signes cliniques sont, selon le British Medical Journal[98], en fonction de leur fréquence :
- signes cliniques principaux :
- signes secondaires :
- la fatigue chez 44 % à 69 % des patients,
- les douleurs musculaires chez 11 % à 44 % des patients,
- des maux de gorge chez 5 % à 17 % des patients,
- des crachats chez 26 % à 28 % des patients,
- une anosmie (perte totale de l'odorat) dans 30 % des cas selon des tests effectués en Corée du Sud[99] et à 68 % selon une étude récente sur 52 patients[100] ; l'anosmie est une manifestation fréquente dans les infections virales,
- une agueusie (perte du goût) a été rapportée par les patients de la Covid-19[101],[102],
- une perte d'appétit chez 40 % des patients ;
- des symptômes dermatologiques (exanthème, engelures) ont été rapportés[103],[104] ;
- autres signes (retrouvés dans moins de 10 % des cas) :
- céphalée chez 6 % à 8 % des patients,
- vertiges chez 9 % des patients,
- crachats sanglants chez 5 % des patients,
- douleurs de poitrine chez 2 % à 5 % des patients,
- écoulement nasal chez 4 % à 5 % des patients,
- troubles gastro-intestinaux (douleur ou diarrhée) chez 1 % à 10 % des patients.
Il peut ne pas y avoir toujours de fièvre et elle n'est pas toujours le premier signe de la maladie (elle peut apparaître après la toux). Sur une étude de 1 099 cas publiée le dans le NEJM, seules 44 % des personnes étaient fébriles à leur admission, d'autres sont devenues fébriles après leur admission, et 11 % des cas n'ont pas été fiévreux (ici une fièvre est définie comme une température supérieure à 37,5 °C à l'aisselle)[105]. Chez 52 personnes hospitalisées en unité de soins intensifs en Chine[106], la fièvre était le symptôme le plus fréquent, associée à la pneumonie à SARS-CoV-2, mais tous les patients n'avaient pas de fièvre. Chez six d'entre eux (11,5 %), la fièvre ne fut détectée que deux à huit jours plus tard, et non durant les débuts de la maladie.
Le retard de la manifestation fiévreuse empêche l'identification précoce des patients infectés par le SARS-CoV-2 — s'ils sont asymptomatiques, et complique l'identification des cas suspects[107].
La diarrhée ou des douleurs abdominales apparaissent un ou deux jours avant les troubles respiratoires dans 10 % des cas dans une étude sur 138 patients dans le JAMA publiée le [108].
Les critères de gravité sont : une fréquence respiratoire supérieure à 30 par minute, une saturation en oxygène au repos inférieure à 93 % (SaO2), un rapport pression en oxygène sur concentration en oxygène inférieur à 300 mm de mercure (PaO2/FiO2).
Formes extra-respiratoires
Quatre mois après l’apparition de la maladie plusieurs nouvelles descriptions de la maladie sont décrites
Manifestations neurologiques
Des recherches avaient montré que le virus du SARS ou du MERS pouvaient infecter les cerveaux des souris[109] notamment le thalamus et le tronc cérébral. Les cellules gliales du cerveau ont des récepteurs ACE2 qui est utilisé par le cerveau pour pénétrer dans les cellules respiratoires[110]. Des manifestations atteignants le système nerveux central (maux de tête, vertiges, troubles de la conscience, ataxie, maladie cérébrovasculaire aiguë et épilepsie) ou le système nerveux périphériques (anosmie , agueusie, névrite du nerf optique) sont décrites[111],[112]. Une encéphalite aiguë par pénétration directe du virus dans le cerveau est rapportée le 1 avril 2020[113].
Formes critiques
Les principales complications sont une détresse respiratoire aiguë dans 30 % des cas, une myocardite dans 10 % des cas et une surinfection bactérienne dans 10 % des cas[114] ou une libération importante de cytokine responsable d'une lymphohistiocytose hémophagocytaire secondaire qui est une forme particulière de choc cytokinique.
Ces complications peuvent entraîner la mort spécialement, mais pas exclusivement, chez les personnes rendues fragiles par l'âge ou par des comorbidités.
Risque thrombo-embolique
Le risque thrombo-embolique est une complication des formes critiques . Les formes critiques s'accompagnent d'un état d'hypercoagulabilté comme en témoigne la relation entre le taux de D-Dimère et la mortalité[115]. L'embolie massive est une cause de mortalité importante surtout chez les sujets jeunes[116]
Rhabdomyolyse
La rhabdomyolyse est une complication sous-estimée car se manifestant principalement par des douleurs musculaires mais qui persiste et se focalise. Le diagnostic de cette complication est facile car elle se fait par le dosage de la créatine-kinase et de la myoglobine. Mais ces examens ne font pas partie des examens biologique de routine[117].
Pronostic et létalité
Avertissements :
- Deux indicateurs sont à ne pas confondre : taux de létalité (ratio décès sur infections avérées, c'est-à-dire proportion de malades confirmés décédant de la maladie), et taux de mortalité (proportion de décès dans une population entière) ;
- Ces taux sont incertains, car mesurer le nombre total de malades et de morts par le virus est à ce jour impossible, faute de moyens de test suffisants. Le nombre de guérisons et de décès, et donc le vrai taux de létalité, ne seront connus qu'après la fin de l'épidémie[118],[119],[120],[121]. Si les cas pas et peu symptomatiques sont moins détectés, cela biaise les taux vers le haut. Si les morts sont attribuées au Covid-19 sur des critères restrictifs en ne comptant par exemple que les morts constatées à l'hôpital, cela biaise les taux vers le bas.
- Au , le taux de létalité provisoire calculé par l'OMS d'après les chiffres fournis par les différents pays, était de 3 % environ (80 décès sur 2 800 infections)[122]. Cette valeur provisoire est bien plus faible que ceux des épidémies de SARS-CoV en 2002-2003 (9,6 %) et de MERS-CoV en 2009 (34,4 %)[123] mais néanmoins beaucoup plus élevée que la plupart des virus grippaux touchant les humains.
- Au 11 février 2020, le taux de létalité recalculé par le CDC chinois (« Chinese Center for Disease Control and Prevention » ) sur près de 45 000 cas confirmés, était de 2,3 %[124], restant bien plus élevé que celui des grippes saisonnières typiques ; il est supérieur à celui de la pandémie grippale de 1957 (0,6 %) qui fit entre 1 et 4 millions de morts, et même à celui de la pandémie de grippe espagnole (1918) (2 %)[125],[126].
- Au 28 février 2020, sur la base du nombre de pneumonies hospitalisées confirmées, une étude chinoise portant sur les 421 premiers cas donne un taux de létalité d'environ 2 %, suggérant des conséquences proches de celles d'une épidémie de grippe saisonnière sévère, ou d'une grippe pandémique modérée (comme celles de 1957 et 1968), plutôt que de celles d'une épidémie type SARS ou MERS[127].
- Une étude du 30 mars parue dans le Lancet permet d'affiner la létalité de cette maladie : le taux de létalité en Chine serait de 1,38% chez les moins de 60 ans, de 6,4% chez les plus de 60 ans et jusqu'à 13,4% après 80 ans[128].

Taux de létalité en fonction des pathologies existantes
Source : Centre chinois pour le contrôle et la prévention des maladies. Données au 11 février[129].
| HTA | Diabète | Maladies cardiovasculaires | Maladies respiratoires | Cancer |
|---|---|---|---|---|
| 6 % | 7,3 % | 10,5 % | 6,3 % | 5,6 % |
L'hypertension artérielle (HTA) semble être le facteur de risque le plus important dans une étude du 24 mars[130]. Les coronavirus SARS et SARS-CoV-2 utilise le récepteur ACE2 pour pénétrer dans l'épithélium respiratoire. Plusieurs hypothèses sont avancées notamment la perturbation du fonctionnement des ACE2 par un traitement antagoniste des récepteurs de l'angiotensine II ou les enzymes impliquées dans le fonctionnement de ces récepteurs[131]. Un autre mécanisme évoqué est la surexpression des ACE2 chez les patients atteints d'hypertension ou de diabète[132]. Le Dr Karol Watson, éditeur associé du NEJM Journal Watch Cardiology indique qu'il n'y a aucune donnée actuelle qui laisse penser à un risque supplémentaire chez les patients prenant un antagoniste des récepteurs de l'angiotensine II ou un inhibiteur de l'enzyme de conversion[133],[134]. Au contraire, une étude rétrospective sur 511 patients montre que la prise d'antagoniste des récepteurs de l'angiotensine II pour HTA s’accompagne d'une mortalité diminuée par rapport aux hypertendus ne prenant pas ce traitement. L'effet est net après 65 ans. Ce caractère protecteur du traitement anti-HTA est spécifique des antagonistes des récepteurs de l'angiotensine II. Il n'est pas retrouvé dans les autres catégories d'anti-hypertenseurs (bêta-bloquant, inhibiteur calcique)[135].
Ce même mécanisme pourrait être à l'origine de l'effet délétère de l'ibuprofène sur la maladie.
Selon le sexe
La surmortalité de cette infection chez l'homme par rapport à la femme pourrait s'expliquer par des phénomènes hormonaux , les œstrogènes et progestérone stimulent l'immunité innée et acquise et de nombreux gènes régulant l’immunité se trouvent sur le chromosome X[136].
Mortalité
Au Royaume-Uni , 50 % des gens admis en USI décèdent[137]. Alors que dans une étude du Centre chinois de contrôle et de prévention sur 72 314 cas enregistrés jusqu'au 11 février[124], aucun enfant de moins de 10 ans n'était mort, un enfant de moins de 1 an est décédé aux États-Unis[138].
Une étude du 30 mars parue dans le Lancet estime la mortalité en Chine à 0,66%[128] .
Causes
- La détresse respiratoire aiguë (SDRA) est la cause principale de la mortalité de la Covid-19[139]. D'apparition particulièrement brutale et sévère, la mortalité induite par le SDRA se situe entre 30 à 50 % selon le site European Lung[140]. Le pronostic du SDRA dépend de l'état de santé initial du patient[141]. Il peut entraîner des séquelles à long terme dans la plupart des cas[141].
- Une réaction immunitaire trop importante connue responsable d'une lymphohistiocytose hémophagocytaire secondaire qui une forme particulière de choc cytokinique est aussi un facteur majeur de mortalité[142].
Facteurs de risque
Connaître les facteurs favorisant ou non l'infection, le développement des symptômes et le diagnostic aide les cliniciens à mieux identifier, et précocement trier les patients à risque[44]. Selon une mise à jour (9 mars 2020) rétrospective des facteurs de risques chez 191 patients[143] (dont 137 ont guéri et 54 sont morts à l'hôpital)[44], les facteurs de risques de mortalité sont :
| Facteur de risque | Précisions |
|---|---|
| Une comorbidité est présente dans 48 % des cas. Il s’agit d’hypertension le plus souvent (30 % des comorbidités), devant le diabète (19 %) et les maladies coronariennes (8 %)[44] | |
| Les plus de 65 ans risquent plus de développer une forme grave de la maladie, et risquent plus d'en mourir[44] | |
élevé |
Le score SOFA (Sequential Organ Failure Assessment) décrit un risque élevé de défaillances d'organes, s'il est élevé, il est associé à un mauvais pronostic[44] |
élevé |
Un taux de D-dimère supérieur à 1 μg/L au moment de l’admission dégrade également le pronostic[44]. |
Le paradoxe avec l'asthme et la maladie pulmonaire obstructive chronique
On a d'abord craint que l'asthme et la maladie pulmonaire obstructive chronique (MPOC), et d'autres maladies respiratoires chroniques, prédisposeraient à l'infection par le SRAS-CoV-2 et/ou à développer les formes les plus sévères de la COVID-19. Contre toute attente et au contraire, lors des 3 premiers mois de pandémie, ces deux maladies ont été sous-représentées dans les comorbidités signalées. Une même tendance, non expliquée, avait concerné le SRAS.
Pourquoi sont-elles sous-représentées ? plusieurs hypothèses d'explications sont[144] :
- Ces deux maladies pourraient avoir méconnues chez les premiers patients chinois atteints de COVID-19. C'est peu probable car en Italie au 23 mars 2020, par exemple pour 355 patients morts de la COVID-19 (à 79,5 ans en moyenne), l’un était diabétique et un diabète a été signalé chez 20,3% des patients ayant survécu, alors que aucune BPCO ne figurait parmi les comorbidités[145]. De même aux Etats-Unis (au 31 mars 2020) pour 7162 parmi 74 439 cas signalés documentés les maladies respiratoires chroniques et le diabète étaient respectivement signalés chez 8,5% et 10,2% de ces cas (à comparer aux taux mondiale de 11,3% pour les maladies respiratoires chroniques et de 10,2% pour le diabète)[146]
- avoir une maladie respiratoire chronique protègerait contre la COVID-19, peut-être en calmant la réponse immunitaire ; Si c’est le cas, ce n'est pas encore expliqué, et cette protection ne vaudrait pas pour les patients néanmoins entrés en phase aiguë de la maladie, car parmi ces derniers, avoir une BPCO comme comorbidité est associé à un risque accru de mourrir, comme cela était attendu[147].
- les médicaments pris pour ces deux maladies diminueraient le risque d’infection, et/ou d'émergence des symptômes permettant le diagnostic. Cependant seuls 50% des MPOC sont en Chine traités par les traitements standard européens et nord-américains[148] alors que près de 75% des asthmatiques chinois inhalent des corticostéroïdes[149]. in vitro, des corticostéroïdes non seulement suppriment la réplication des coronavirus, mais atténuent ou bloquent la production de cytokines (impliquées dans la « tempête de cytokines » qui tue de nombreux patients sévèrement atteint)[150],[151]. Par un mécanisme encore incompris, des corticostéroïdes inhalés semblent, chez ces patients, pouvoir empêcher ou freiner le développement d'une infection symptomatique ou diminuer la sévérité de la COVID-19. L’exemple suivant n'a pas valeur de preuve statistique (peu de cas, pas de groupe témoin), mais il est cité par la littérature médicale : l'état de trois malades de COVID-19 (nécessitant de l'oxygène, mais pas d'assistance ventilatoire) s'est amélioré après inhalation de ciclésonide[152].
Depuis le début de la pandémie les experts et l’OMS recommandent aux victimes de MPOC et d'asthme de ne pas changer leur traitement[144]. Une revue systématique faite après la pandémie de SRAS avait conclu que les corticostéroïdes systémiques ne présentaient aucun avantage et parfois un préjudice[153].
Début avril 2020, les chercheurs ayant fait ce constat invitent à documenter avec précision les comorbidités, et les traitements antérieurs des malades de COVID-19, pour préciser les facteurs favorisant ou non l'infection, le développement des symptômes et le diagnostic, et pour définir les avantages/inconvénients du traitement de l'asthme et de la MPOC lors de la pandémie de Covid-19[144].
Diagnostic
La méthode standard de diagnostic consiste à effectuer une réaction en chaîne par polymérase à transcription inverse (rRT-PCR) à partir d'un écouvillon nasopharyngé[154],[155]. Au début de l’épidémie, des critères avaient été définis[Par qui ?] pour réaliser les tests diagnostiques. Au 6 mars 2020, devant la diffusion mondiale du virus et l’apparition de plusieurs foyers importants, ces critères sont devenus de plus en plus obsolètes. Le fait de revenir d'un séjour dans une région infectée est suffisant pour justifier une recherche par RT-PCR[156] et/ou la réalisation d'un CT scan des poumons si un patient présente les signes décrits ci-dessus.
Les CDC définissent un « contact étroit » comme le fait d'être à moins de deux mètres d'un malade suspecté ou confirmé ou dans une pièce ou une zone de soins pendant une période prolongée sans équipement de protection individuelle ou exposé directement aux sécrétions d'une personne infectée par le SARS-CoV-2.
Le diagnostic repose sur la mise en évidence du virus par la technologie RT-PCR (amplification génique après transcription inverse) sur des frottis nasopharyngés[114]. Cependant, ce diagnostic n'est pas à la portée de tous les systèmes de santé, et il n'existe pas de diagnostic sérologique à l'heure actuelle[114].
La spécificité de ce test est de 100 % mais on ignore sa sensibilité[157]. L'existence de faux négatifs est connue[158]. La RT-PCR a été largement déployée en virologie diagnostique et a donné peu de résultats faussement positifs[159]. Les valeurs prédictives positive et négative ne sont pas actuellement connues avec précision, car, pour les calculer il faut avoir le chiffre exact de l'incidence et de la prévalence de la maladie. Le , le ministère français des Solidarités et de la Santé annonce qu'un test diagnostic développé par le centre national de référence des virus respiratoires, à savoir l'Institut Pasteur, est disponible en France[160].
En raison du temps nécessaire pour faire un RT-PCR et du nombre limité d'appareils ainsi que de la capacité de ces appareils, des scores de diagnostic rapide sont publiés en se basant sur l'âge, le sexe, la température, les images radiologiques, et le rapport neutrophile sur lymphocyte[161].
Biologie
Les signes biologiques les plus importants car semblant en rapport avec la gravité de la maladie sont[105] :
- lymphopénie (inférieure à 1 500 lymphocytes par ml) retrouvés dans 83 % des cas ; une lymphocytopénie est très souvent présente chez des patients en état critique. La lymphocytopénie est une caractéristique importante des patients gravement malades infectés par le SARS-CoV[162], car une invasion ciblée des lymphocytes par des particules virales du SARS-CoV endommage la composante cytoplasmique du lymphocyte et provoque sa destruction. La lymphocytopénie était également courante chez les patients gravement malades infectés par le MERS, qui est le résultat de l'apoptose des lymphocytes[163]. Il semblerait que la gravité de la lymphocytopénie reflète la gravité de l'infection par le SARS-CoV-2[164] ;
- thrombopénie (inférieure à 150 000 plaquettes par ml) dans 36 % des cas ;
- leucopénie (inférieure à 1 500 leucocytes par ml) retrouvés dans 33 % des cas.
Les autres anomalies évaluent le retentissement de l'infection virale sur les différents organes (cœur, rein, foie) : on peut retrouver une cytolyse hépatique modérée (transaminase légèrement augmentées) ; le taux de procalcitonine est normal ; les lactates déshydrogénases et la créatines kinases peuvent être augmentés[114].
Une aggravation de la maladie se traduit par l'aggravation de la lymphopénie avec aggravation de la leucocytose.
La présence d'une charge virale sanguine (assez fréquente lors de maladies à coronavirus) semblerait être un facteur de gravité[165]. Elle invite aussi à une bonne gestion des dons de sang faits pour les transfusions[166].
Réponse sérologique
Une première étude s'intéresse à la présence des anticorps IgG et IgM. La recherche des IgG et IgM est beaucoup plus simple et rapide que le RT-PCR. Elle permettrait de rattraper les faux positifs (par pollution d'ARN dans le laboratoire) et les faux négatifs (mauvais prélèvement) mais le faible nombre de cas ne permet pas de conclure définitivement[167].
Une autre étude sur 173 patients montre la réaction sérologique à l'infection à SARS-CoV-2 : le taux de séroconversion (passage de l'absence d'anticorps spécifique à la présence d'anticorps spécifiques) pour les anticorps IgG et IgM étaient de 93,1 % (161/173) 82,7 % (143/173) avaient des IgM sans IgG et 64,7 % (112/173) des IgG sans IgM; La séroconversion est apparue séquentiellement pour anticorps IgG et IgM, IgM puis IgG, avec un temps médian respectivement de onze, douze et quatorze jours. Moins de 40 % de patients avaient des anticorps les sept premiers jours de la maladie puis ce pourcentage a rapidement augmenté à 100,0 %, 94,3 % et 79,8 % pour IgG et IgM, IgM et IgG respectivement quinze jours après le début de la maladie. En revanche, le taux positif du RT-PCR est passé de 66,7 % (58/87) dans les échantillons prélevés avant le 7e jour à 45,5 % (25/55) entre J15 et J39. La combinaison de la détection d’ARN et d’anticorps a amélioré la sensibilité du diagnostic (p <0,001), même en phase précoce (première semaine)[168].
Une étude remarque que les IgG apparaissent un ou deux jours seulement après les IgM soit de façon beaucoup plus rapide qu’habituellement.
Un titre anticorps IgG et IgM élevé serait indépendamment associé à une gravité de la maladie[168].
Marqueurs biologiques pronostiques
Interleukine
Des indicateurs d'inflammation ont été recherchés chez des patients légers, graves et critiques, pour discriminer rapidement ceux dont la pneumopathie pourrait évoluer vers une forme sévère ou mortelle[169]. Les critères associés à la gravité de la maladie étaient l'âge, le récepteur de l'interleukine 2, de l'interleukine 6 (IL-6), de l'interleukine 8, de l'interleukine 10, le facteur de nécrose tumorale α, la protéine C réactive (CRP), la ferritine, la procalcitonine, la numération des globules blancs, la numération des lymphocytes, la numération des neutrophiles et la numération des éosinophiles[169], avec en conclusion un risque maximal pour les plus de 67 ans, avec un taux d'interleukine 2 supérieure à 793,5 U/mL, de CRP supérieure à 30,7 ng/mL, de ferroprotéine supérieure à 2 252 μg/L, une leucocytose supérieure à 95 × 108 L-1 ou un nombre de neutrophiles dépassant 7 305 × 106 L-1.
Un niveau élevé d'IL-6 à l'admission serait associé à une manifestation clinique sévère. La diminution de l'IL-6 semble indiquer l'efficacité du traitement, tandis que son augmentation indique une progression de la maladie. L'évolution du niveau d'IL-6 est donc un marqueur utile pour la surveillance de la maladie chez les patients atteints de Covid-19 sévère[170].
Une étude montre une présence de l'ARN viral dans le sang et que la charge virale est directement corrélée avec le taux sanguin d'interleukine 6, ce qui fait de cette molécule un marqueur pronostique important[165]. Cette augmentation associée à un taux de fer sanguin élevée doit faire rechercher une lymphohistiocytose hémophagocytaire secondaire[142].
Le taux de CRP semble être en rapport avec une réaction inflammatoire inappropriée du foie[171].
Lymphocyte
Une étude[172] semble montrer que le taux de lymphocytes est un moyen efficace et un indicateur fiable pour la classification et le pronostic de la maladie : durant le passage d'une forme bénigne vers une forme grave, le taux de lymphocyte sanguin diminue et reste bas. Au moment où l'état du malade s’améliore, le taux de lymphocyte sanguin remonte vers des taux normaux. Les patients ayant moins de 5 % de lymphocytes par rapport aux normes, avaient souvent un mauvais pronostic. Une autre étude confirme l'existence d'une corrélation élevée entre le taux des lymphocytes sanguins et la progression de la maladie. Pour les auteurs de cette étude, le lymphocyte est la cellule clé de la pathologie du SARS-Cov-2.
D-dimère
L'augmentation des D-dimères est un signe de gravité ainsi que l'augmentation de la créatinémie[108]. Ce marqueur est aussi retrouvé dans cette publication qui a été étudié les facteurs de risque chez les patients décédés de Covid-19 pour un taux supérieur à 1 microgramme par ml[115].
Charge virale
La persistance d'une excrétion virale par l'épithélium nasal est aussi un facteur de risque. Toutes les personnes dans une étude comprenant 171 personnes admises en USI avec 53 décès ont gardé une charge virale jusqu'à la fin[115]. Une lettre adressée à l’éditeur du Lancet rappelle que la charge virale dans le cas du SARS restait positif jusqu'à 1 mois après la guérison alors que la culture virale se négativait plus rapidement relativisant de la charge virale dans la contagiosité[173];
Imagerie médicale
-
Stade 2 (progressif)
-
Stade 3 (du pic)
Comme le fait remarquer le professeur Christine Jenkins, responsable de la Fondation australienne des maladies pulmonaires et expert en pneumologie, la particularité des pneumopathies virales est leur propension à atteindre tout le poumon alors que les pneumopathies bactériennes ont souvent localisées à un lobe pulmonaire. La Covid-19 atteint très rapidement ensemble des 2 poumons[174]
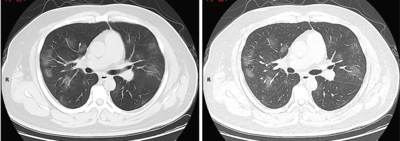
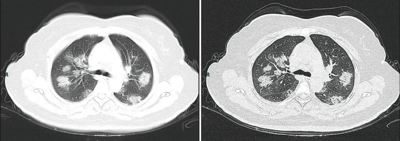
Une équipe chinoise décrit en février 2020 l’évolution de la pneumopathie chez des patients peu sévères en la divisant en quatre stades selon l’aspect au scanner[175] :
- stade 1, dit précoce (jusqu'aux quatre premiers jours) : les opacités en verre dépoli sont la principale anomalie pulmonaire, sont sous-pleurales et touchent les lobes inférieurs des poumons ;
- stade 2, dit progressif (cinq à huit jours) : les opacités en verre dépoli deviennent bilatérales et multilobaires, des plages de condensation et de crazy paving apparaissent ;
- stade 3, dit du pic (dix à treize jours) ; les anomalies s’intensifient, notamment la condensation alvéolaire ;
- stade 4, dit de résorption (après quatorze jours) : régression des anomalies, résorption de la condensation, disparition complète du crazy paving et persistance de verre dépoli.
Les mêmes auteurs concluent que les patients présentant une pneumonie modéré (sans détresse respiratoire sévère), les anomalies pulmonaires au scanner thoracique sont maximales environ dix jours après l'apparition initiale des symptômes, et régresse à partir de quatorze jours[175].
Généralement, plus la maladie avance, plus les opacités linéaires, un motif de pavage fou » et/ou un signe de « halo inversé sont présents sur l’image[176].
Chez les sujets asymptomatiques ou encore symptomatiques (c'est-à-dire à un stade infraclinique) le scanner (tomodensitométrie ou TDM) montre néanmoins des changements précoces dans les poumons[177] (opacités en verre dépoli unilatérales)[178]. Le scanner peut donc contribuer au diagnostic du covid-19, associé à un test RT-PCR concordant, voire en cas de faux-négatif de ce test[179].
Nouvelles technologies
Prise en charge et diagnostic par télémédecine
La télémédecine a montré son intérêt dans plusieurs situations de crises sanitaires[180]. Elle pourrait permettre de trier les cas nécessitant une hospitalisation et pour les autres une surveillance à domicile. Le recueil des données associées avec un programme d'intelligence artificielle permet de trier et d'évaluer le risque. En cas d'hospitalisation, l'équipe médicale peut isoler et prendre en charge le patient de façon plus rapide, protégeant aussi les autres patients attendant dans le service des urgences[181].
Diagnostic par intelligence artificielle
Une étude scientifique semble montrer l'intérêt d'utiliser des logiciels d'IA, qui en analysant les anomalies pulmonaires visibles au scanner initial permettent de prédire avec de bonnes performance la durée d'hospitalisation des patients[182].
Outil de diagnostic en ligne
L'Institut Pasteur met en ligne un outil de diagnostic tout public qui comprend 22 questions[183].
Diagnostic différentiel
L'utilisation d'un kit permettant de détecter plusieurs agents pathogènes responsables des maladies respiratoires a révélé un taux élevé d'infections par le virus de la grippe, représentant 28,5 % de tous les cas suspects d'infection par le SARS-CoV-2[184].
| Clinique | Examens |
|---|---|
| Syndrome respiratoire du Moyen-Orient (MERS) | |
| Absence de contact avec une personne atteinte de la Covid-19 ou absence de voyage dans une région à risque.
Les symptômes gastro-intestinaux et les symptômes des voies respiratoires supérieures semblent être moins fréquents pour la Covid-19. |
Réaction en chaîne par polymérase après transcription inverse positive (RT-PCR) à l'ARN viral du MERS-CoV. |
| Syndrome respiratoire aigu sévère (SRAS) | |
| Plus aucun cas depuis 2004.
Absence de contact avec une personne atteinte de la Covid-19 ou absence de voyage dans une région à risque. Les symptômes gastro-intestinaux et les symptômes des voies respiratoires supérieures semblent être moins fréquents pour la Covid-19.
|
RT-PCR positive à l'ARN viral du SARS-CoV. |
| Grippe | |
| Absence de contact avec une personne atteinte de la Covid-19 ou absence de voyage dans une région à risque.
Pas de différenciation clinique entre la COVID-19 et la grippe[185]. |
RT-PCR positive à l'ARN viral du virus de l'influenza A ou B. |
| Pneumonie communautaire | |
| Absence de contact avec une personne atteinte de la Covid-19 ou absence de voyage dans une région à risque.
Pas de différenciation clinique entre la Covid-19 et les infections des voies respiratoires d'origine communautaire. |
Test sanguin ou sur crachats de positive pour l'organisme responsable par PCR ou culture. |
| Rhume | |
| Absence de contact avec une personne atteinte de la Covid-19 ou absence de voyage dans une région à risque.
Pas de différenciation clinique entre la Covid-19 et les infections des voies respiratoires d'origine communautaire. Écoulement nasal et mal de gorge moins fréquent dans le rhume. |
RT-PCR : positive pour le virus causal ou négative pour l'ARN viral du SARS-CoV-2. |
| Grippe aviaire à H7N9 | |
| Maladie endémique en Chine.
Malade suspect vivant dans les régions où cette maladie est endémique. Contact avec des oiseaux infectés. |
RT-PCR : positive pour l'ARN du H7. |
| Grippe aviaire à H5N1 | |
| Malade suspect vivant dans les régions où cette maladie est endémique.
Contact avec des oiseaux infectés. |
RT-PCR : positive pour l'ARN du H5-N1. |
| Autres infections pulmonaires virales ou bactériennes | |
| Absence de contact avec une personne atteinte de la Covid-19 ou absence de voyage dans une région à risque.
Pas de différenciation clinique entre la Covid-19 et les infections des voies respiratoires d'origine communautaire. Penser à l'adénovirus ou au mycoplasme dans les sujets vivants en groupe (par exemple école ou camps militaires). |
Test sanguin ou sur crachats de positive pour l'organisme responsable par PCR ou culture. |
| Tuberculose pulmonaire | |
| Personne vivant en zone d'endémisme, en particulier chez les patients immunodéprimés.
L'histoire clinique est généralement plus longue. La présence de sueurs nocturnes et de perte de poids sont des éléments cliniques très discriminants. |
Opacités fibro nodulaires dans les lobes supérieurs avec ou sans cavitation à la radiographie pulmonaire.
Bactéries acido-résistantes sur culture ou à l'examen direct de crachat. Tests moléculaires : positifs pour Mycoplasma tuberculosis. |
Classification de la maladie
La classification de la gravité de la Covid-19 est très importante. Lors du déclenchement d'une épidémie les ressources médicales sont relativement rares. Une classification en optimise l’utilisation permettant de limiter le sur-traitement ou le sous-traitement. Le guide du Centre national de contrôle des maladies chinois classe la maladie principalement sur des critères radiologiques[172] en 4 types. Une étude suggère d'utiliser le taux de lymphocytes pour classer la maladie[172].
Anatomopathologie
Peu de données microscopiques sont disponibles sur la Covid-19[186],[187]. Les principales constations anatomopathologiques à l'autopsie sont :
- macroscopie : épanchement pleural, péricardite, pneumopathie et œdème pulmonaire ;
- quatre niveaux de sévérité de pneumonie virale peuvent être observés :
- pneumonie légère : exsudat de plasma ou de fibrine dans les alvéoles pulmonaires,
- pneumonie modérée : œdème pulmonaire modérée, hyperplasie des pneumocytes, présence de grands pneumocytes atypiques, inflammation interstitielle avec infiltrat lymphocytaire des septas interalvéolaires, formation de cellules géantes multinucléées (pneumonie à cellules géantes),
- pneumonie sévère : dommage alvéolaire diffus (DAD) avec membranes hyalines pulmonaires (membranes de fibrine, exsudat fibrineux), qui est à l 'origine du syndrome de détresse respiratoire aiguë (SDRA) et de l'hypoxémie observée dans 5 à 10 % des cas de cette maladie,
- pneumonie d'organisation : forme de cicatrisation pulmonaire après le stade inflammatoire, et fibrose pulmonaire ;
- coagulation intravasculaire disséminée (CIVD) ;
- plasmocytose au lavage bronchoalvéolairee[188] ;
- foie : stéatose microvésiculaire.
Traitement
Il n'y a pas de médicament curatif efficace contre le SARS-CoV-2 reconnu scientifiquement par l'OMS[189] à la fin mars 2020, malgré plus de 200 essais cliniques enregistrés rien qu'en Chine. Le traitement est donc jusqu’à présent purement symptomatique. Il vise à suppléer les défaillances viscérales (cardiaques, pulmonaires, rénales).
Les traitements sont essentiellement des soins de soutien : ventilation non invasive, ventilation mécanique ou oxygénation par membrane extracorporelle. La prescription d'antiviraux est très variable selon les équipes : elle est de 90 % dans une étude faite parmi les premiers patients chinois, alors que parmi les 68 premiers patients hospitalisés au Royaume-Uni, un seul a reçu des antiviraux (en raison de la présence du virus influenza A qui était recherché systématiquement dans le cadre du diagnostic différentiel). Aucun n'a reçu de corticoïdes.
La Société européenne de soins intensifs (ESCM) et la Society of Critical Care Medicine (SSCM - USA), afin d'aider les agents de santé, a publié un guide de meilleures pratiques, pour la prise en charge des patients gravement touchés en unités de soins intensifs (USI) ou de réanimation. Un groupe de 38 experts en médecine d’urgence de 12 pays a proposé 53 questions lui paraissant pertinentes pour la gestion de la Covid-19, et en s’appuyant sur la littérature disponible (preuves directes et indirectes), le groupe a produit des recommandations fortes et faibles de « meilleures pratiques », sur la base d’une analyse avantages /inconvénients, des implications en ressources et coûts, d'équité et de faisabilité[190].
Les agents putatifs comprennent des antiviraux comme la griffithsine, un inhibiteur de la protéine de pointe ; des analogues nucléosidiques comme le remdésivir et la ribavirine ; des inhibiteurs de protéase comme la combinaison lopinavir/ritonavir ; des agents immunomodulateurs et autres agents ciblés sur l'hôte tels que l'interféron, la chloroquine et les immunoglobulines[191].
Traitement préventif
En l’absence de traitement curatif, le traitement de la maladie est essentiellement préventif et symptomatique. Semblable à celui de la grippe, il consiste essentiellement en l’éviction du contage, en limitant la durée d'exposition et le risque d'exposition, pour cela lors de la pandémie de Covid-19 de 2020 l'OMS recommande des "gestes barrières"[1].
Antiviraux
Aucun traitement antiviral spécifique n'existe à ce jour. Les patients traités en Chine reçoivent comme antiviraux de l'oseltamivir, du ganciclovir, du lopinavir et du ritonavir[192].
Selon l'OMS, des tentatives de repositionnement d'antiviraux existants pourraient être effectuées[193].
En utilisant l'apprentissage automatique, une équipe scientifique publie le dans le Lancet[194] une étude sur les antiviraux possibles. L'un des six médicaments de liaison AAK1 de haute affinité est le baricitinib, inhibant la cycline G, un autre régulateur de l'endocytose. La concentration plasmatique de baricitinib à la dose thérapeutique (sous forme de 2 mg ou de 4 mg une fois par jour) est suffisante pour inhiber l'AAK1.
Le , des chercheurs australiens du Peter Doherty Institute for Infection and Immunity (Melbourne) réussissent pour la première fois, sous la responsabilité du Dr Julian Druce, à créer un nouveau coronavirus à partir d'un échantillon prélevé sur un patient infecté. C'est une étape majeure dans la mise au point d'un traitement. Ils partagent ce virus avec les laboratoires du monde entier, les autorités chinoises ne l'ayant pas fait[195].
Chloroquine et hydroxychloroquine
Un repositionnement constituant une première piste est celui d'une molécule initialement antipaludique, la chloroquine, dont l'effet anticoronaviral avait déjà été démontré in vitro (dans des éprouvettes) sur le SRAS[196],[197], ainsi que son dérivé l'hydroxychloroquine[198]. Le mode d'action du traitement s'expliquerait par une modification d'une protéine d'attachement sur la tête du virus, ce qui limiterait sa réplication[199] tout en contrôlant les lymphocytes NK (Natural Killer)[200].
Le corps médical est divisé sur ce traitement qui n'a pas été validé de manière rigoureuse in vivo (chez l’être humain). S'opposent d'un côté ceux qui veulent d'abord évaluer les traitements potentiels par des essais thérapeutiques, et de l'autre ceux qui, face à l'urgence sanitaire, veulent pouvoir utiliser immédiatement chez les malades l'association hydroxychloroquine-azithromycine, quitte à ce que ce traitement soit inefficace, mais de façon à en faire profiter les patients si son efficacité présumée était confirmée par la suite.
Le 19 février, une lettre parue dans la revue BioScience Trends indique qu'à l'issue des premières études cliniques la commission nationale Chinoise de la Santé recommande[201] l'utilisation du phosphate de chloroquine dans le traitement du virus[202]. Ces données sont cependant encore limitées notamment en raison de la petite taille de l'échantillon statistique (100 patients)[203]. Un consensus d'experts chinois recommande le 20 février d'inclure le phosphate de chloroquine dans les recommandations de prise en charge des patients sans contre-indication à la chloroquine, à raison de 500 mg deux fois par jour pendant 10 jours pour les patients diagnostiqués comme des cas légers, modérés et sévères de maladie[203],[204].
Néanmoins, une méta-analyse des études en cours[205] indique que les informations données par cette lettre (comparaison de traitement, nombre de patients, etc.) ne semble pas correspondre avec les études réellement menées et citées par la lettre en question. Elle pointe aussi la non-publication des données cliniques et l'absence d'information sur l'obtention du consensus annoncé. Cette méta-analyse conclut tout de même à la nécessité de poursuivre les recherche sur cette molécule, rappelant qu'au moment de sa parution, 23 études étaient en cours en Chine pour évaluer son efficacité.
Il est aussi à noter que la prise de chloroquine à haute dose peut provoquer des effets secondaires potentiellement sérieux, en particulier celui d'une intoxication aiguë susceptible de déclencher des problèmes cardiaques ou respiratoires, et que la dose thérapeutique est proche de la dose toxique[203].
Le 6 mars, une étude pilote réalisée en Chine dans le cadre d'un essai randomisé ne détecte pas d'effet d'un traitement à l'hydroxychloroquine sur la durée d'hospitalisation, la baisse de fièvre ou l'état radiologique des poumons[206].
Anticorps monoclonaux
Le tocilizumab, l'un des immunosuppresseurs déconseillés par la France, et principalement utilisé pour le traitement de la polyarthrite rhumatoïde, a été inclus dans les directives de traitement par la Commission nationale de la santé de la Chine après une étude positive de l'Université de sciences et technologie de Chine[207],[208],[209]. Il subit des tests dans cinq hôpitaux en Italie chez les personnes atteintes d'une forme grave de la maladie[210]. Il a pour objectif de prévenir une complication potentiellement mortelle de la maladie, le choc cytokinique pouvant conduire à un syndrome de défaillance multiviscérale[211] chez les patients présentant des taux sanguins élevés d'indicateurs de réaction inflammatoire[212].
Sérothérapie
L'essai clinique Coviplasm promu par l’AP-HP consiste à évaluer l'éventuelle efficacité d'une sérothérapie, c'est à dire de la transfusion de plasma sanguin de malades guéris. En effet ce plasma sanguin est riche en anticorps dirigés contre le virus et on espère qu'il permette de transférer cette immunité aux malades[213]. La première phase de l'essai commence le mardi avec le prélèvement par plasmaphérèse de malades français guéris de la Covid-19 dans les régions Île-de-France, Grand Est et Bourgogne-Franche-Comté. L'EFS, prélèvera ainsi 600 ml de plasma chez environ 200 patients volontaires, guéris depuis au moins 14 jours. L'essai porte sur 60 patients dont la moitié bénéficiera du traitement. Ils se verront injecter deux poches de plasma de 200 ml chacune au 6e jour (±1) des symptômes puis, en l'absence d'intolérance, deux autres doses le lendemain. Une évaluation de l'efficacité du traitement sera possible deux à trois semaines après le début de l’essai.
Corticothérapie dans le syndrome de détresse respiratoire aiguë (SDRA)
L'usage de la corticothérapie dans le SDRA est un sujet de controverse. Le SDRA est en partie causé par les réponses immunitaires de l'hôte. Les corticostéroïdes permettent de diminuer l'inflammation pulmonaire excessive et néfaste mais, par contre, ils inhibent également la réponse immunitaire bénéfique qui permet au patient d'éliminer les agents pathogènes.
Faisant suite à plusieurs publications traitant de l'utilisation des corticoïdes dans le syndrome de détresse respiratoire aiguë, une méta-analyse parue dans le Lancet le présente la synthèse de l'utilisation des corticostéroïdes dans le SRAS, le MERS, les infections respiratoires à virus syncytial et les SDRA quelle qu'en soit la cause. Elle conclut qu'aucune donnée clinique ne montre de bénéfice en faveur de l’utilisation des corticoïdes dans tout SDRA, dont celui consécutif au coronavirus[214]. Des médecins chinois critiquent la méthodologie de cette étude et rappellent que, dans des études prospectives sur l'usage des corticoïdes dans les SDRA à H1N1, les corticoïdes avaient réduit la mortalité. La corticothérapie est donc une arme à double tranchant et ils soulignent l'importance de bien évaluer le rapport bénéfice sur risque ; doivent être soigneusement pris en compte : utilisation chez des malades en situation critique, utilisation chez des malades déjà en hypoxie par une maladie chronique ; la posologie doit être faible à modérée (≤ 0,5 à 1 mg/kg par jour de méthylprednisolone ou équivalent) et la durée du traitement doit être courte (au plus sept jours)[215].
Vaccin
Dès le début de la pandémie, la recherche d'un vaccin contre le SARS-CoV-2, le virus responsable, a été très intense au niveau mondial. Fin février 2020, l'Organisation mondiale de la santé estime qu'un tel vaccin ne sera pas disponible avant mi-2021. Au début du mois de mars 2020, environ trente tentatives étaient en cours, mais aucun vaccin n'avait terminé les essais cliniques.
Typologie des malades
Distribution par âges et par formes cliniques
Le 24 février 2020, une étude du Centre chinois de contrôle et de prévention des maladies paraît dans le New England Journal of Medecine sur 72 314 cas enregistrés jusqu'au 11 février[124].
| Âge | Contamination | (en % de cas) | Décès | (en % de cas) |
|---|---|---|---|---|
| Supérieur ou égal à 80 ans | 1 408 cas | 3 % | 208 | 15 % |
| 70-79 ans | 3 918 cas | 9 % | 312 | 8 % |
| 30-69 ans | 34 762 cas | 78 % | 503 | 1,3 % |
| 20-29 ans | 3 619 cas | 8 % | ||
| 10-19 ans | 549 cas | 1 % | ||
| Inférieur à 10 ans | 416 cas | 1 % | 0 | 0 % |
| Nombre total | 44 672 | 100 % | 1 023 | 2,3 % |
| Nombre | (en ℅ de cas) | Décès | (en ℅ de cas) | |
|---|---|---|---|---|
| Moyenne | 36 160 cas | 81 % | 0 | 0 % |
| Grave | 6 168 cas | 14 % | 0 | 0 % |
| Critique | 2 087 cas | 5 % | 1 023 | 49 % |
Bien que la Covid-19 semble être plus transmissible que le SRAS et le MERS, et que de nombreuses estimations du taux de reproduction de base de la Covid-19 (R0) aient déjà été publiées, il est encore trop tôt pour développer une estimation précise de R0 ou pour évaluer la dynamique de la transmission, selon les auteurs de cette étude.
Typologie par groupe sanguin
Une étude récente[216] (preprint du 16 mars 2020) réalisée en Chine sur différents hôpitaux (Wuhan, Shenzhen) semble montrer que les personnes de groupe sanguin A présentent un risque plus élevé que les autres groupes, tandis que les personnes de groupe O présentent un risque moins élevé que les autres groupes. Dans cette étude la répartition des patients de groupe B et AB atteints de la Covid-19 est la même que dans un échantillon sain de population.
Cette étude a été mise en relation avec une autre sur le SARS-CoV de 2001-2002[217] par France Inter[218], ayant prouvé in vitro cette corrélation sur le virus cousin du SARS-CoV-2 à l'origine de la Covid-19. Une confirmation biologique et épidémiologique de cette information pourrait être utilisée pour les situations de crise médicale aigüe (conditions où les ressources manquent gravement) pour réduire la transmission du virus, par exemple de patient à soignant.
Covid-19 et grossesse
Le SRAS pendant la grossesse était associé à une incidence élevée de complications maternelles et fœtales telles que fausse couche spontanée, accouchement prématuré, retard de croissance intra-utérine, ventilation mécanique assistée, admission en USI, insuffisance rénale et coagulation intra-vasculaire disséminée[219],[220].
Une infection périnatale par le SARS-CoV-2 peut être acquise auprès de l'entourage, des soignants (éventuellement de manière nosocomiale) ou via la mère (transmission verticale in utero ? ou post-naissance)[221].
Comme pour le SARS-CoV et le MERS-CoV, la transmission materno-fœtale du SARS-CoV-2 n’a jamais pu à ce jour être démontrée : parmi les six coronavirus connus pour communément infecter l'humain (229E, OC43, NL63, HKU1, SARS-CoV et MERS-CoV) seuls quatre (229E, OC43, NL63 et HKU1) peuvent être transmis verticalement via le placenta et ils sont tous bénins (simples rhumes)[222],[223].
Deux études publiées le [224],[225] relancent le débat en s’appuyant sur la présence d'Ig M dans le sang fœtal pour un total de 7 nouveau-nés. Ces immunoglobulines ne traversant pas la barrière placentaire en raison de leur poids moléculaire. Ces immunoglobulines proviendraient donc d'une synthèse fœtal in utero. Le taux Ig M était parfois supérieur au taux maternel mais aucun enfant n'était positif au RT-PCR pour le prélèvement de gorge ou de sang fœtal. Cependant la recherche d'Ig G et Ig M par les techniques de laboratoire est rarement utilisée dans le diagnostic des infections congénitales virales (cytomégalovirus, rubéole, Zika), bactérienne (syphilis) ou parasitaire (toxoplasmose) en raison de leur spécificité et sensibilité inférieure à la PCR[226]. Pour les auteurs de l'éditorial du JAMA du , on ne peut éliminer formellement la possibilité d'une transmission in utero du SARS-CoV-2[226].
La chaîne publique CCTV a annoncé le qu'un nouveau-né de 30 heures avait été testé positif après l'accouchement d'une femme qui avait été testée positive[227], ce qui laisse envisager que le virus pourrait passer la barrière placentaire.
Une étude publiée le dans The Lancet sur neuf femmes enceintes présentant une pneumonie Covid-19 contractée au dernier trimestre de la grossesse est plutôt rassurante. Le tableau clinique de la pneumonie Covid-19 était identique chez les personnes non enceintes. Six patientes ont reçu des anti-viraux. Elles ont toutes accouché par césarienne d'indication obstétricale (pré-éclampsie, utérus cicatriciel, etc.)[228].
Une nouvelle étude du confirme cette impression sur 16 femmes enceintes confirmées et 18 cas suspects tout en soulignant qu'elles ont des signes radiologiques type de la maladie, les manifestations cliniques sont moins importantes que chez les femmes non enceintes[229].
Nouveau-né
Dans une étude chinoise du 12 février 2020 publiée dans The Lancet et réalisée sur 9 femmes enceintes contaminées, tous les enfants nés étaient en bonne santé. Le sang fœtal, le liquide amniotique, des prélèvements au niveau de la gorge du nouveau-né et du lait maternel ont été effectués sur six des neuf patientes. Tous les résultats d'analyse étaient négatifs pour le SARS-CoV-2. Deux cas n'ont pu être prélevés car la césarienne a été effectuée la nuit. Le dernier cas n'a pas été prélevé car le résultat (positif) du test maternel SARS-CoV-2 n'est parvenu qu'après la césarienne. Selon les chercheurs, le cas positif du serait dû à une contamination maternelle post-naissance[228].
Une autre publication de mars 2020 ne retrouve pas de transmission materno-fœtale[230].
Une autre étude chinoise, publiée en février 2020 dans la revue Translational Pediatrics, est moins rassurante et concerne dix nouveau-nés de Wuhan, issus de neuf mères infectées ayant présenté des symptômes avant l'accouchement dans quatre cas, le jour même dans deux cas et après l'accouchement dans trois cas[221]. Huit bébés étaient des garçons et deux des filles ; quatre sont nés à terme et six prématurément ; deux étaient petits pour leur l'âge gestationnel (SGA) et un était macrosome ; six avaient un score PCIS (Pediatric Critical Illness Score) inférieur à 90. Six ont présenté un essoufflement comme premier symptôme, mais deux ont d’abord eu de la fièvre. Deux ont présenté une thrombocytopénie avec fonction hépatique anormale ; un avait une fréquence cardiaque rapide, un vomissait et un a fait un pneumothorax ; cinq nouveau-nés ont guéri, un est mort et quatre sont restés hospitalisés dans un état stable[221]. Cette étude ne donne aucune explication sur le décès du nouveau-né. Seuls des prélèvements nasaux ont été faits. Ils étaient tous négatifs.
Dans l'étude du 13 mars citée plus haut[229], il n' y a pas de différence significatives chez les nouveau-nés des cas confirmés ou suspects par rapport à un groupe témoin de 121 cas notamment au niveau du score d'Apgar à la naissance.
Une autre étude chinoise datant du 24 mars, et effectuée sur 33 nouveau-nés, confirme le pronostic généralement bon des enfants nés de mère PCR positif. Mais 3 des 33 enfants, tous nés par césarienne, présentent une pneumopathie typique de la Covid-19 survenant entre 2 et 4 jours après la naissance. Les prélèvements anaux et de la gorge étaient positifs au SARS-CoV-2. Aucune recherche n'a été effectuée dans le sang de cordon ou le liquide amniotique. Le seul enfant ayant nécessité une prise en charge en soins intensifs avait une hémoculture positive à Enterobacter. Aucun enfant n'est décédé. Les auteurs de l'étude concluent que la transmission du virus s'est produite après la naissance[231].
Critères de guérison
Les critères de guérison selon la Commission chinoise de la santé sont[232] :
- température normale durant plus de trois jours ;
- disparition des symptômes respiratoires ;
- amélioration nette des images de tomodensitométrie thoracique ;
- deux résultats consécutifs du test RT-PCR négatifs, séparés par au moins un jour.
Immunisation
Au 28 mars 2020, il est acquis que les gens infectés développent une immunité à la COVID-19, mais il n'est pas établi s'il y a des exceptions à cette immunisation, et sa durée n'est pas connue[233].
Séquelles
Prévention
Le virus est sensible à tous les désinfectants habituels et au savon[234].
Mesures
La prévention vise essentiellement à éviter la contagion en suspendant tout contact proche avec une personne infectée confirmée et en limitant très fortement les autres contacts[235]. Ceci passe notamment par l'instauration de mesures-barrières comme la distanciation sociale, l'arrêt des embrassades et des échanges manuels, le lavage fréquent des mains, l'utilisation de mouchoirs jetables ou encore, la pratique de tousser dans son coude pour éviter la production d'aérosols, la désinfection des surfaces potentiellement contaminées telles que des poignées de portes, boutons d'ascenseurs, etc.
Il est vivement conseillé aux personnes présentant un état grippal de surveiller leur température. L'ingestion de viande ou d'œuf mal cuits est déconseillée[236],[237].
La London School of Hygiene and Tropical Medicine publie une étude le 6 février 2020 montrant que les détecteurs thermiques des aéroports détectent moins de 40 % des personnes infectées[238].
Port du masque
L'OMS ne recommande pas le port du masque systématiquement[239], craignant qu'il procure un faux sentiment de sécurité[240]. Le masque ne doit être porté que si on tousse ou éternue, ou si on s'occupe d’une personne présumée infectée par le SARs-Cov-2. L'OMS rappelle en outre que le port du masque est sans intérêt s'il ne s’accompagne pas d'un lavage régulier des mains et son utilisation exige des précautions particulières.
Les masques avec valve ne protègent que le porteur du masque, la valve permettant d 'extraire le souffle du porteur pour ne pas respirer son CO2. Les masques avec valves sont surtout utilisés dans les professions dont l'activité physique nécessite une bonne ventilation du porteur (métier du bâtiment par exemple )[241].
Masque chirurgical
Le masque chirurgical est conçu pour retenir les germes sortant des poumons de la personne qui le porte : il est porté par un chirurgien (d'où le qualificatif de ce masque) pour éviter surtout d'infecter son patient opéré[242]. Le port de ce masque peut apporter parfois un faux sentiment de sécurité[243].
Masque FFP2
Le masque de protection individuel (de type FFP2) est équipé d'un filtre qui empêche les germes de pénétrer dans l'organisme. Son efficacité dure de trois à huit heures[242]. Ce masque sert à protéger les personnels de santé lors de leurs soins aux personnes infectées.
Masques alternatifs
Début avril, les dirigeants de plusieurs pays changent de discours et recommandent de se couvrir le visage, avec un simple foulard ou un masque fait maison si besoin. En France, l’Académie nationale de médecine estime qu’un masque « grand public » devrait être rendu obligatoire pour toute sortie pendant et après le confinement. En effet, les scientifiques n'écartent pas que le virus puisse se transmettre par l'air expiré de personnes sans symptômes (sans tousser mais en parlant)[240].
Port de gants
Hormis si l'on est un soignant en contact avec un patient potentiellement infecté et avec que l'on a été au préalable formé aux bonnes pratiques, l'OMS précise que le port de gants est inutile et que "le fait de se laver les mains régulièrement protège mieux contre la COVID-19 que le port de gants en caoutchouc"[244].
Lavage des mains
Se laver régulièrement les mains avec du savon ou du gel hydroalcoolique est la plus importante des mesures de protection contre la COVID-19. Pour être efficace, le lavage au gel hydroalcoolique doit se faire en manches courtes, les ongles courts (1mm ou moins) sans vernis, sans aucun bijou (ni alliance ni montre…) et les mains sèches et macroscopiquement propres (on ne désinfecte que ce qui est propre)[245].
Eau potable
Face à la pandémie de COVID-19 qui sévit en France, de nombreux gestionnaires d'approvisionnement en eau potable ont répondu à l’appel des Agences régionales de santé, suivant en cela les recommandations de l’Organisation Mondiale de la Santé. Elles leur demandent de modifier la chloration de l'eau, avec une augmentation du taux de 0,3 mg/l à 0,5 mg/l en sortie de station de traitement, avec une exposition au chlore libre pendant au moins 30 minutes[246]. C'est le cas en particulier à Rennes, Strasbourg, Toulouse, dans la région parisienne, etc ...[247].
Désinformation
De nombreuses théories concernant les causes du virus, la propagation de celui-ci ou les traitements sont diffusées sur les médias sociaux, et s'avèrent être liées aux théories du complot, aux fake news ou d'être de la désinformation.
Notes et références
Notes
- Au début avril 2020
Références
- OMS, « Nouveau coronavirus (COVID-19): conseils au grand public », sur who.int/fr/ (consulté le )
- (en) European medicines agency, « Update on treatments and vaccines against COVID-19 under development », sur ema.europa.eu, (consulté le )
- (en) « China’s first confirmed Covid-19 case traced back to November 17 », sur South China Morning Post, (consulté le ).
- (zh) « 武汉市卫生健康委员会 », sur wjw.wuhan.gov.cn (consulté le ).
- Covid-19, la longue marche des mensonges chinois[1]
- Na Zhu, Dingyu Zhang, Wenling Wang et Xingwang Li, « A Novel Coronavirus from Patients with Pneumonia in China, 2019 », New England Journal of Medicine, vol. 382, no 8, , p. 727–733 (ISSN 0028-4793, DOI 10.1056/NEJMoa2001017, lire en ligne, consulté le ).
- (en) « Novel Coronavirus( 2019-nCoV), situation report-1 », sur WHO (=OMS), .
- Brice Louvet, « Plusieurs dizaines de personnes frappées par un virus non identifié en Chine », sur SciencePost, .
- Yohan Demeure, « Une IA a alerté sur le coronavirus bien avant les scientifiques ! », sur SciencePost.fr, .
- (en) « Novel Coronavirus(2019-nCoV) Situation report-3 », sur WHO (=OMS), .
- (en) « Novel Coronavirus (2019-nCoV) Situation Report-7 », sur WHO (=OMS),
- (en) OMS, « Novel Coronavirus (2019-nCoV) Situation Report-11 », sur www.who.int, Organisation mondiale de la santé, .
- (en) Peter Daszak, « We Knew Disease X Was Coming. It’s Here Now. », sur nytimes.com, .
- (en) Jason Gale, « Coronavirus May Be ‘Disease X’ Health Experts Warned About », sur bloomberg.com, .
- (en) David Mercer, « Coronavirus outbreak could be feared 'Disease X', says World Health Organisation adviser », sur news.sky.com,
- « Allocution liminaire du Directeur général de l’OMS lors du point presse sur le 2019-nCoV du 11 février 2020 », sur www.who.int, Organisation mondiale de la santé, (consulté le ).
- « Appellation de la maladie à coronavirus 2019 (COVID-19) et du virus qui la cause », sur www.who.int, Organisation mondiale de la santé, (consulté le )
- (en) « Rational use of personal protective equipment for coronavirus disease 2019 (COVID-19) », sur Interim guidance. WHO, (consulté le )
- « Allocution liminaire du Directeur général de l’OMS lors du point presse sur la COVID-19 - 11 mars 2020 », sur www.who.int (consulté le )
- Le Monde avec AFP, « Aéroports fermés, mesures de confinement… le monde s’organise face à la pandémie », sur https://www.lemonde.fr, (consulté le ).
- (en) CNN, « Stocks plunge into bear market territory: March 12, 2020 », sur https://edition.cnn.com, .
- Le Monde, « Coronavirus : krach boursier en Europe, pire journée de l’histoire pour la Bourse de Paris », sur https://www.lemonde.fr,
- (en) Markus Hoffmann, Hannah Kleine-Weber, Simon Schroeder et Nadine Krüger, « SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor », Cell, , S0092867420302294 (PMID 32142651, PMCID PMC7102627, DOI 10.1016/j.cell.2020.02.052, lire en ligne, consulté le )
- (en) Hao Zhang, Zijian Kang, Haiyi Gong et Da Xu, « The digestive system is a potential route of 2019-nCov infection: a bioinformatics analysis based on single-cell transcriptomes », bioRxiv, , p. 2020.01.30.927806 (DOI 10.1101/2020.01.30.927806, lire en ligne, consulté le ).
- (en) Liu F., Long X., Zou W., Fang M., Wu W., Li W. et Zhang Z., « Highly ACE2 Expression in Pancreas May Cause Pancreas Damage After SARS-CoV-2 Infection », medRxiv, .
- (en) Yu Zhao, Zixian Zhao, Yujia Wang et Yueqing Zhou, « Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov », bioRxiv, Bioinformatics, (DOI 10.1101/2020.01.26.919985, lire en ligne, consulté le ).
- Silva-Filho, J., Caruso-Neves, C. & Pinheiro, A. Angiotensin II type-1 receptor (AT1R) regulates expansion, differentiation, and functional capacity of antigen-specific CD8+ T cells. Sci Rep 6, 35997 (2016). https://doi.org/10.1038/srep35997
- « Chinese doctor discovers novel coronavirus in patient's cerebrospinal fluid - Global Times », sur www.globaltimes.cn (consulté le ).
- Wenling Wang, (2020) Detection of SARS-CoV-2 in Different Types of Clinical Specimens ; Research Letter ; 11 mars 2020 ; JAMA. Doi:10.1001/jama.2020.3786 (synthèse faite par des universitaires et chercheurs du CDC chinois à partir de 1 070 échantillons prélevés dans les trois jours suivant l’admission sur 205 patients hospitalisés (dont 19 % dans un état grave), dans 3 hôpitaux (du Hubei, du Shandong et de Pékin, en Chine), entre le et le 17 février 2020)).
- « Un médecin chinois découvre le COVID-19 dans le liquide céphalorachidien d'un patient », sur french.peopledaily.com.cn (consulté le )
- Ali Rismanbaf et Sara Zarei, « Liver and Kidney Injuries in COVID-19 and Their Effects on Drug Therapy; a Letter to Editor », Archives of Academic Emergency Medicine, vol. 8, no 1, (ISSN 2645-4904, PMID 32185369, PMCID 7075271, lire en ligne, consulté le )
- (en) Pengfei Cui et autres, « Clinical features and sexual transmission potential of SARS-CoV-2 infected female patients: a descriptive study in Wuhan, China », {{Article}} : paramètre «
périodique» manquant, , p. 19 (lire en ligne) - (en) Bai Y, Yao L, Wei T et al., « Presumed Asymptomatic Carrier Transmission of COVID-19. », JAMA, (DOI 10.1001/jama.2020.2565, lire en ligne).
- (en) Camilla Rothe, Mirjam Schunk, Peter Sothmann et Gisela Bretzel, « Transmission of 2019-nCoV Infection from an Asymptomatic Contact in Germany », New England Journal of Medicine, , NEJMc2001468 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMc2001468, lire en ligne, consulté le ).
- « La grippe, une épidémie saisonnière », sur www.santepubliquefrance.fr (consulté le ).
- (en) Qun Li, Xuhua Guan, Peng Wu et Xiaoye Wang, « Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus–Infected Pneumonia », New England Journal of Medicine, , NEJMoa2001316 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMoa2001316, lire en ligne, consulté le ).
- Coronavirus, des experts répondent à vos questions – conférence de l’UNIGE, Université de Genève, mis en ligne par le Gvt français, 27 février 2020.
- (en) Lydia Bourouiba, « Turbulent Gas Clouds and Respiratory Pathogen Emissions: Potential Implications for Reducing Transmission of COVID-19 », JAMA, (ISSN 0098-7484, DOI 10.1001/jama.2020.4756, lire en ligne, consulté le )
- (en-US) CDC, « Coronavirus Disease 2019 (COVID-19) – Prevention & Treatment », sur Centers for Disease Control and Prevention, (consulté le )
- (en-GB) Graham Russell et agencies, « China pivots to tackle 'silent' Covid-19 carriers as US says a quarter of cases may have no symptoms », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le )
- Jaimes, J. A., André, N. M., Millet, J. K. & Whittaker, G. R. Preprint at bioRxiv https://doi.org/10.1101/2020.02.10.942185 (2020).
- Coutard, B. et al. Antiviral Res. https://doi.org/10.1016/j.antiviral.2020.104742 (2020).
- (en) « Covid-19 virus can produce more than thrice as many pathogens than Sars strain », sur South China Morning Post, (consulté le )
- Fei Zhou & al. (2020) Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China : a retrospective cohort study ; The Lancet ; March 9, 2020.
- Prolonged presence of SARS-CoV-2 in feces of pediatric patients during the convalescent phase, Yuhan Xing, Wei Ni, Qin Wu, Wenjie Li, Guoju Li, Jianning Tong, Xiufeng Song, Quansheng Xing, document non revu par les pairs, 3 mars 2020, DOI 10.1101/2020.03.11.20033159.
- (en-US) An Tang, Zhen-dong Tong, Hong-ling Wang et Ya-xin Dai, « Early Release - Detection of Novel Coronavirus by RT-PCR in Stool Specimen from Asymptomatic Child, China », Emerging Infectious Diseases journal - CDC, vol. 26, (DOI 10.3201/eid2606.200301, lire en ligne, consulté le Date invalide (14 mars 2020 (prépublication))).
- (en) Shi Zao, « Preliminary estimation of the basic reproduction number of novel coronavirus (2019-nCoV) in China, », International Journal of Infectious Diseases, (lire en ligne).
- « Le taux de reproduction de COVID-19 est plus élevé que celui du SRAS ».
- https://www.futura-sciences.com/sante/actualites/coronavirus-contagiosite-coronavirus-revue-hausse-80498/?fbclid=IwAR3TBYpTZ0WA6Ukti4pzTYlLIBw6WbF4Q4flgEoPKNx0zyAuFYLg0nOuslA
- https://wwwnc.cdc.gov/eid/article/26/7/20-0282_article?fbclid=IwAR1TE6TfB75EC3UC1zZ02JhSqNDfODxsIg1yzQSf7W1NMyQQUrotl27slFA
- (en) Yang Liu, Rosalind M. Eggo et Adam J. Kucharski, « Secondary attack rate and superspreading events for SARS-CoV-2 », The Lancet, vol. 395, no 10227, , e47 (ISSN 0140-6736 et 1474-547X, PMID 32113505, DOI 10.1016/S0140-6736(20)30462-1, lire en ligne, consulté le ).
- Le Dr Manuel Schibler, infectiologue et virologue, au Centre Universitaire de Genève répond aux questions fréquentes concernant le Coronavirus de la maladie COVID-19, le 26 février 2020 : Combien de temps ce virus peut-il survivre sur les surfaces ? https://www.youtube.com/watch?v=aSFnboZLPGM.
- (en) Neeltje van Doremalen, Trenton Bushmaker, Dylan H. Morris et Myndi G. Holbrook, « Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1 », New England Journal of Medicine, , NEJMc2004973 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMc2004973, lire en ligne, consulté le )
- (en) Neeltje van Doremalen, Trenton Bushmaker, Dylan H. Morris, Myndi G. Holbrook, Amandine, Gamble, Brandi N. Williamson, Azaibi Tamin, Jennifer L. Harcourt, Natalie J. Thornburg, Susan Gerber, James O. Lloyd-Smith, Emmie de Wit, Vincent J. Munster (2020) [Aerosol and surface stability of HCoV-19 (SARS-CoV-6 2) compared to SARS-CoV-1] ; https://doi.org/10.1101/2020.03.09.20033217 ; Laboratory of Virology, National Institutes of Health, Hamilton, MT, États-Unis.
- Nicolas Martin, « Surfaces, aérosols : le coronavirus survit-il partout ? », sur France Culture, (consulté le ).
- (en) Wei Luo, Maimuna S. Majumder, Dianbo Liu et Canelle Poirier, « The role of absolute humidity on transmission rates of the COVID-19 outbreak », medRxiv, , p. 2020.02.12.20022467 (DOI 10.1101/2020.02.12.20022467, lire en ligne, consulté le ).
- « #VraiOuFake L'épidémie de coronavirus Covid-19 va-telle disparaître en avril grâce à la chaleur, comme l'assure Donald Trump ? », sur Franceinfo, (consulté le ).
- (en) Lisa Schnirring, « Doubts rise about China's ability to contain new coronavirus », sur CIDRAP - Center for Infectious Disease Research and Policy, News & Perspectives, (consulté le ).
- Kampf G, Todt D, Pfaender S, Steinmann E. Persistence of coronaviruses on inanimate surfaces and its inactivation with biocidal agents. J Hosp Infect. 2020. http://doi.org/10.1016/j.jhin.2020.01.022.
- China News (2010) The SARS-COV-2 nucleic acid detected for the first time on the surface of door handle in Guangzhou and cleaning taken attention. .
- Kampf G, Todt D, Pfaender S & Steinmann E (2020) Persistence of coronaviruses on inanimate surfaces and its inactivation with biocidal agents. Journal of Hospital Infection ; Mars 2020 , Vol.104, n°3, Pages 246–251.
- van Doremalen, N., Bushmaker, T., Morris, D., Holbrook, M., Gamble, A., Williamson, B., ... & Lloyd-Smith J (2020) Aerosol and surface stability of HCoV-19 (SARS-CoV-2) compared to SARS-CoV-1. medRxiv.
- OMS (2020) Question and answer on coronaviruses.
- The SARS-COV-2 isolated from the stool specimens of patients with novel coronavirus-infected pneumonia by teams of Nanshan Zhong Professor and Lanjuan Li Professor ; Chinanews.
- R.F Service (2020) Does disinfecting surfaces really prevent the spread of coronavirus? ; 12 mars 2020 Science News/HealthCoronavirus | doi:10.1126/science.abb7058
- Hamming I, Timens W, Bulthuis ML, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004;203(2):631-637.
- Christian MD, Poutanen SM, Loutfy MR, Muller MP, Low DE. Severe acute respiratory syndrome. Clin Infect Dis. 2004;38:1420-1427.
- Peiris JS, Chu CM, Cheng VC, et al. Clinical progression and viral load in a community outbreak of coronavirus-associated SARS pneumonia: a prospective study. Lancet. 2003;361(9371):1767-1772.
- (en-US) Jianyun Lu, Jieni Gu, Kuibiao Li et Conghui Xu, « Early Release - COVID-19 Outbreak Associated with Air Conditioning in Restaurant, Guangzhou, China, 2020 - Volume 26, Number 7—July 2020 - Emerging Infectious Diseases journal - CDC », {{Article}} : paramètre «
périodique» manquant, paramètre «date» manquant (DOI 10.3201/eid2607.200764, lire en ligne, consulté le ) - (en-GB) Helen Davidson, « Hong Kong warns residents not to kiss pets after dog contracts coronavirus », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- A dog has died after testing positive for coronavirus. Should pets of COVID-19 patients be quarantined? https://www.cbc.ca/news/health/coronavirus-dog-spread-humans-1.5487621
- (en) Smriti Mallapaty, « Coronavirus can infect cats — dogs, not so much », Nature, , d41586–020–00984-8 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-00984-8, lire en ligne, consulté le )
- Camille Gévaudan, « Le coronavirus pourrait se transmettre entre chats », sur Libération.fr, (consulté le )
- (en) Lirong Zou, Feng Ruan, Mingxing Huang et Lijun Liang, « SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients », New England Journal of Medicine, , NEJMc2001737 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMc2001737, lire en ligne, consulté le ).
- Tsang TK, Cowling BJ, Fang VJ, et al. Influenza A virus shedding and infectivity in households. J Infect Dis 2015;212:1420-1428.
- (en) Jsm Peiris, Cm Chu, Vcc Cheng et Ks Chan, « Clinical progression and viral load in a community outbreak of coronavirus-associated SARS pneumonia: a prospective study », The Lancet, vol. 361, no 9371, , p. 1767–1772 (DOI 10.1016/S0140-6736(03)13412-5, lire en ligne, consulté le ).
- Rothe, C., Schunk, M., Sothmann, P., Bretzel, G., Froeschl, G., Wallrauch, C., ... & Seilmaier, M. (2020). Transmission of 2019-nCoV infection from an asymptomatic contact in Germany. New England Journal of Medicine.
- Modular L. et al. (2020) Evidence of SARS-CoV-2 infection in returning travelers from Wuhan, China. N Engl J Med. 1–3
- (en-GB) « China virus 'spreads before symptoms show' », BBC News, (lire en ligne, consulté le ).
- Source : Une infectiologue de l'hôpital Cochin (Paris), Odile Launay, « Coronavirus : "les délais d'incubation sont beaucoup plus courts, à peu près 5 jours", estime un médecin infectiologue », sur Franceinfo, (consulté le ).
- CDC chinois (2020) Novel Coronavirus Pneumonia Emergency Response Epidemiology Team. Vital surveillances : the epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19)—China. China CDC Weekly.
- (en) Smriti Mallapaty, « What the cruise-ship outbreaks reveal about COVID-19 », Nature, , d41586–020–00885-w (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-00885-w, lire en ligne, consulté le ).
- AFP (2010), [2] ; Straits Times, 11 février 2020.
- Wang D. et al. (2020) Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel coronavirus-infected pneumonia in Wuhan, China JAMA; 1–9.
- Bwire G.M & Paulo L.S (2020) Coronavirus disease-2019: is fever an adequate screening for the returning travelers?. Tropical Medicine and Health, 48(1), 1-3.
- (en) Jasper Fuk-Woo Chan, Shuofeng Yuan, Kin-Hang Kok et Kelvin Kai-Wang To, « A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster », The Lancet, vol. 0, no 0, (ISSN 0140-6736 et 1474-547X, DOI 10.1016/S0140-6736(20)30154-9, lire en ligne, consulté le ).
- (en) Zhiliang Hu, Ci Song, Chuanjun Xu et Guangfu Jin, « Clinical Characteristics of 24 Asymptomatic Infections with COVID-19 Screened among Close Contacts in Nanjing, China », medRxiv, , p. 2020.02.20.20025619 (DOI 10.1101/2020.02.20.20025619, lire en ligne, consulté le ).
- (en) Camilla Rothe, Mirjam Schunk, Peter Sothmann et Gisela Bretzel, « Transmission of 2019-nCoV Infection from an Asymptomatic Contact in Germany », New England Journal of Medicine, vol. 382, no 10, , p. 970–971 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMc2001468, lire en ligne, consulté le ).
- (en) Desmond Sutton, Karin Fuchs, Mary D’Alton et Dena Goffman, « Universal Screening for SARS-CoV-2 in Women Admitted for Delivery », New England Journal of Medicine, , NEJMc2009316 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMc2009316, lire en ligne, consulté le )
- (en) Stephen A. Lauer, Kyra H. Grantz, Qifang Bi et Forrest K. Jones, « The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application », Annals of Internal Medicine, (ISSN 0003-4819, DOI 10.7326/M20-0504, lire en ligne, consulté le ).
- Coronavirus chinois : la période d’incubation pourrait atteindre 24 jours Céline Deluzarche, futura-sciences, 11 février 2020.
- (en-US) « Symptoms of Novel Coronavirus (2019-nCoV) | CDC », sur www.cdc.gov, (consulté le ).
- « Coronavirus : la période d'incubation moyenne se précise autour de cinq jours », sur www.lexpress.fr, (consulté le ).
- Temps d'incubation, modes de transmission, taux de mortalité... Une étude chinoise sur le coronavirus 2019-nCoV apporte de nouveaux éléments franceinfo – France Télévisions, 11 février 2020.
- Clinical characteristics of 2019 novel coronavirus infection in Chinadoi.org, 6 février 2020.
- Étude du Johns Hopkins Bloomberg School of Public Health, de Baltimore associée à School of Public Health and Health Sciences du Massachusetts, et à la Ludwig-Maximilians-Universität de Munich
- (en) Francois-Xavier Lescure, Lila Bouadma, Duc Nguyen et Marion Parisey, « Clinical and virological data of the first cases of COVID-19 in Europe: a case series », The Lancet Infectious Diseases, vol. 0, no 0, (ISSN 1473-3099 et 1474-4457, DOI 10.1016/S1473-3099(20)30200-0, lire en ligne, consulté le )
- « COVID-19 - History and exam | BMJ Best Practice », sur bestpractice.bmj.com (consulté le ).
- (en) Gareth Iacobucci, « Sixty seconds on . . . anosmia », BMJ, vol. 368, (ISSN 1756-1833, PMID 32209546, DOI 10.1136/bmj.m1202, lire en ligne, consulté le ).
- (en) Carol H. Yan, Farhoud Faraji, Divya P. Prajapati et Christine E. Boone, « Association of chemosensory dysfunction and Covid-19 in patients presenting with influenza-like symptoms », International Forum of Allergy & Rhinology, (DOI 10.1002/alr.22579, lire en ligne, consulté le )
- Jérôme Salomon, directeur de la Santé, « Perte de goût (agueusie) : causes et comment le retrouver ? », sur journaldesfemmes.fr, (consulté le ).
- Conseil National de l'ORL, « Diarrhées et perte de l’odorat et du goût peuvent être des symptômes du coronavirus », sur nouvelobs.com, Nouvel Obs, (consulté le ).
- Sciences et Avenir - Coronavirus : des engelures aux mains ou aux pieds pourraient être un nouveau symptôme du Covid-19
- Le Monde - Covid-19 : une maladie virale aux multiples visages
- (en) Wei-jie Guan, Zheng-yi Ni, Yu Hu et Wen-hua Liang, « Clinical Characteristics of Coronavirus Disease 2019 in China », N Engl J Med, , NEJMoa2002032 (ISSN 0028-4793 et 1533-4406, PMID 32109013, DOI 10.1056/NEJMoa2002032, lire en ligne, consulté le ).
- (en) Xiaobo Yang, Yuan Yu, Jiqian Xu et Huaqing Shu, « Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study », The Lancet Respiratory Medicine, vol. 0, no 0, (ISSN 2213-2600 et 2213-2619, PMID 32105632, DOI 10.1016/S2213-2600(20)30079-5, lire en ligne, consulté le )
- National Health Commission of the People's Republic of China.
- (en) Dawei Wang, Bo Hu, Chang Hu et Fangfang Zhu, « Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus–Infected Pneumonia in Wuhan, China », JAMA, (ISSN 0098-7484, DOI 10.1001/jama.2020.1585, lire en ligne, consulté le ).
- (en) Yan-Chao Li, Wan-Zhu Bai et Tsutomu Hashikawa, « The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID-19 patients », Journal of Medical Virology, vol. n/a, no n/a, {{Article}} : paramètre «
date» manquant (ISSN 1096-9071, DOI 10.1002/jmv.25728, lire en ligne, consulté le ) - Abdul Mannan Baig, Areeba Khaleeq, Usman Ali et Hira Syeda, « Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host–Virus Interaction, and Proposed Neurotropic Mechanisms », ACS Chemical Neuroscience, vol. 11, no 7, , p. 995–998 (ISSN 1948-7193 et 1948-7193, PMID 32167747, PMCID PMC7094171, DOI 10.1021/acschemneuro.0c00122, lire en ligne, consulté le )
- (en) Ling Mao, Mengdie Wang, Shanghai Chen et Quanwei He, « Neurological Manifestations of Hospitalized Patients with COVID-19 in Wuhan, China: a retrospective case series study », medRxiv, , p. 2020.02.22.20026500 (DOI 10.1101/2020.02.22.20026500, lire en ligne, consulté le )
- (en-US) Jamie Talan, « COVID-19: Neurologists in Italy to Colleagues in US: Look for Poorly-Defined Neurologic Conditions in Patients with the Coronavirus », Neurology Today, (lire en ligne, consulté le )
- (en-US) Roni Caryn Rabin, « Some Coronavirus Patients Show Signs of Brain Ailments », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le )
- « Nouveau coronavirus: réalité et incertitudes » (consulté le ).
- (en) Fei Zhou, Ting Yu, Ronghui Du et Guohui Fan, « Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study », The Lancet, vol. 0, no 0, (ISSN 0140-6736 et 1474-547X, DOI 10.1016/S0140-6736(20)30566-3, lire en ligne, consulté le ).
- « Quelle la gestion de la prophylaxie antithrombotique chez les patients Covid-19 ? » (consulté le )
- Min Jin et Qiaoxia Tong, « Rhabdomyolysis as Potential Late Complication Associated with COVID-19 », Emerging Infectious Diseases, vol. 26, no 7, (ISSN 1080-6040 et 1080-6059, DOI 10.3201/eid2607.200445, lire en ligne, consulté le )
- 2019-Novel Coronavirus (2019-nCoV): estimating the case fatality rate – a word of caution Battegay Manuela, Kuehl Richarda, Tschudin-Sutter Saraha, Hirsch Hans H., Widmer Andreas F., Neher Richard A., Céline Deluzarche, Swiss Medical Weekly, 07 février 2020.
- (en) Anna Fifield, « As families tell of pneumonia-like deaths in Wuhan, some wonder if China virus count is too low », The Washington Post, (lire en ligne).
- (en-GB) Lily Kuo et Lillian Yang, « Coronavirus: Chinese hospitals not testing patients, say relatives », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- (en-US) Wenxin Fan, « Relatives Wonder Why Pneumonia Deaths Not in Coronavirus Tally », The Wall Street Journal, (ISSN 0099-9660, lire en ligne, consulté le ).
- (en) « Novel Coronavirus (2019-nCoV) situation reports », sur www.who.int (consulté le ).
- Vincent J. Munster, Marion Koopmans, Neeltje van Doremalen et Debby van Riel, « A Novel Coronavirus Emerging in China — Key Questions for Impact Assessment », New England Journal of Medicine, vol. 382, no 8, , p. 692–694 (ISSN 0028-4793, DOI 10.1056/NEJMp2000929, lire en ligne, consulté le ).
- (en) Zunyou Wu et Jennifer M. McGoogan, « Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention », JAMA, (DOI 10.1001/jama.2020.2648, lire en ligne, consulté le ).
- The Novel Coronavirus Pneumonia Emergency Response Epidemiology Team. The epidemiological characteristics of an outbreak of 2019 novel coronavirus disease (COVID-19) — China, 2020 [lire en ligne=https://www.ncbi.nlm.nih.gov/pubmed/32064853].
- Bill Gates, « Responding to Covid-19 — A Once-in-a-Century Pandemic? », New England Journal of Medicine, vol. 0, no 0, , null (ISSN 0028-4793, DOI 10.1056/NEJMp2003762, lire en ligne, consulté le ).
- Anthony S. Fauci, H. Clifford Lane et Robert R. Redfield, « Covid-19 — Navigating the Uncharted », New England Journal of Medicine, (ISSN 0028-4793, DOI 10.1056/NEJMe2002387, lire en ligne, consulté le ).
- Robert Verity, Lucy C Okell, Ilaria Dorigatti et Peter Winskill, « Estimates of the severity of coronavirus disease 2019: a model-based analysis », The Lancet Infectious Diseases, (ISSN 1473-3099, DOI 10.1016/s1473-3099(20)30243-7, lire en ligne, consulté le )
- (en) Nicola Davis et Niamh McIntyre, « How many will die of coronavirus in the UK? A closer look at the numbers », The Guardian, .
- (en) Xiaoping Chen, Wenjia Hu, Jiaxin Ling et Pingzheng Mo, « Hypertension and Diabetes Delay the Viral Clearance in COVID-19 Patients », medRxiv, Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.03.22.20040774, lire en ligne, consulté le ).
- (en) Muthiah Vaduganathan, Orly Vardeny, Thomas Michel et John J.V. McMurray, « Renin–Angiotensin–Aldosterone System Inhibitors in Patients with Covid-19 », New England Journal of Medicine, , NEJMsr2005760 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMsr2005760, lire en ligne, consulté le )
- (en) Lei Fang, George Karakiulakis et Michael Roth, « Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? », The Lancet Respiratory Medicine, no 0, (ISSN 2213-2600 et 2213-2619, PMID 32171062, DOI 10.1016/S2213-2600(20)30116-8, lire en ligne, consulté le ).
- « NEJM Journal Watch: Summaries of and commentary on original medical and scientific articles from key medical journals », sur www.jwatch.org (consulté le )
- (en-US) « Patients taking ACE-i and ARBs who contract COVID-19 should continue treatment, unless otherwise advised by their physician », sur American Heart Association (consulté le )
- (en) Yingxia Liu, Fengming Huang, Jun Xu et Penghui Yang, « Anti-hypertensive Angiotensin II receptor blockers associated to mitigation of disease severity in elderly COVID-19 patients », {{Article}} : paramètre «
périodique» manquant, Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.03.20.20039586, lire en ligne, consulté le ) - (en) Soumitra Ghosh et Robyn S. Klein, « Sex Drives Dimorphic Immune Responses to Viral Infections », The Journal of Immunology, vol. 198, no 5, , p. 1782–1790 (ISSN 0022-1767 et 1550-6606, PMID 28223406, PMCID PMC5325721, DOI 10.4049/jimmunol.1601166, lire en ligne, consulté le ).
- « ICNARC – Latest news », sur www.icnarc.org (consulté le ).
- « Le coronavirus dans le monde : trois milliards de personnes confinées, Trump renonce à placer New York en quarantaine », Le Monde.fr, (lire en ligne, consulté le ).
- (en) Qiurong Ruan, Kun Yang, Wenxia Wang et Lingyu Jiang, « Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China », Intensive Care Medicine, (ISSN 0342-4642 et 1432-1238, PMID 32125452, PMCID PMC7080116, DOI 10.1007/s00134-020-05991-x, lire en ligne, consulté le ).
- Sylvie Riou-Milliot, « Le syndrome de détresse respiratoire aiguë, une urgence - Sciences et Avenir », sur Sciences et Avenir, (consulté le ).
- « Syndrome de détresse respiratoire aiguë : symptômes, causes, traitement », sur sante.journaldesfemmes.fr (consulté le ).
- (en) Puja Mehta, Daniel F. McAuley, Michael Brown et Emilie Sanchez, « COVID-19: consider cytokine storm syndromes and immunosuppression », The Lancet, vol. 395, no 10229, , p. 1033–1034 (ISSN 0140-6736 et 1474-547X, PMID 32192578, DOI 10.1016/S0140-6736(20)30628-0, lire en ligne, consulté le ).
- 135 patients de l'hôpital Jinyintan et 56 patient de l'hôpital de pneumologie de Wuhan
- (en) David M G Halpin, Rosa Faner, Oriol Sibila et Joan Ramon Badia, « Do chronic respiratory diseases or their treatment affect the risk of SARS-CoV-2 infection? », The Lancet Respiratory Medicine, , S2213260020301673 (DOI 10.1016/S2213-2600(20)30167-3, lire en ligne, consulté le )
- (en) Graziano Onder, Giovanni Rezza et Silvio Brusaferro, « Case-Fatality Rate and Characteristics of Patients Dying in Relation to COVID-19 in Italy », JAMA, (ISSN 0098-7484, DOI 10.1001/jama.2020.4683, lire en ligne, consulté le )
- (en-US) CDCMMWR, « Preliminary Estimates of the Prevalence of Selected Underlying Health Conditions Among Patients with Coronavirus Disease 2019 — United States, February 12–March 28, 2020 », sur MMWR. Morbidity and Mortality Weekly Report, (ISSN 0149-2195, DOI 10.15585/mmwr.mm6913e2, consulté le )
- Surveillances V (2020) The Epidemiological Characteristics of an Outbreak of 2019 Novel Coronavirus Diseases (COVID-19)—China, 2020. China CDC Weekly, 2(8), 113-122.
- (en) Yan Liu, Guofeng Liu, Hongjiang Wu et Weiyan Jian, « Sex differences in non-communicable disease prevalence in China: a cross-sectional analysis of the China Health and Retirement Longitudinal Study in 2011 », BMJ Open, vol. 7, no 12, , e017450 (ISSN 2044-6055 et 2044-6055, PMID 29247088, PMCID PMC5736028, DOI 10.1136/bmjopen-2017-017450, lire en ligne, consulté le )
- Nan Su, Jiangtao Lin, Ping Chen et Jing Li, « Evaluation of asthma control and patient’s perception of asthma: findings and analysis of a nationwide questionnaire-based survey in China », Journal of Asthma, vol. 50, no 8, , p. 861–870 (ISSN 0277-0903, DOI 10.3109/02770903.2013.808346, lire en ligne, consulté le )
- (en) Mutsuo Yamaya, Hidekazu Nishimura, Xue Deng et Mitsuru Sugawara, « Inhibitory effects of glycopyrronium, formoterol, and budesonide on coronavirus HCoV-229E replication and cytokine production by primary cultures of human nasal and tracheal epithelial cells », Respiratory Investigation, , S2212534520300058 (PMID 32094077, PMCID PMC7102607, DOI 10.1016/j.resinv.2019.12.005, lire en ligne, consulté le )
- (en) Shutoku Matsuyama, Miyuki Kawase, Naganori Nao et Kazuya Shirato, « The inhaled corticosteroid ciclesonide blocks coronavirus RNA replication by targeting viral NSP15 », Microbiology, (DOI 10.1101/2020.03.11.987016, lire en ligne, consulté le )
- Iwabuchi K, Yoshie K, Kurakami Y, Takahashi K, Kato Y & (2020) Morishima T COVID-19. Three cases improved with inhaled ciclesonide in the early to middle stages of pneumonia. Lire en ligne (en chinois)
- (en) Lauren J Stockman, Richard Bellamy et Paul Garner, « SARS: Systematic Review of Treatment Effects », PLoS Medicine, vol. 3, no 9, , e343 (ISSN 1549-1676, PMID 16968120, PMCID PMC1564166, DOI 10.1371/journal.pmed.0030343, lire en ligne, consulté le )
- OMS, « Surveillance mondiale de l’infection humaine par le nouveau coronavirus (2019-nCoV) », sur who.int/fr/, (consulté le )
- OMS, « Dépistage en laboratoire des cas suspects d’infection humaine par le nouveau coronavirus 2019 (2019-nCoV) », sur who.int/fr/, (consulté le )
- (en) Elsevier, « Novel Coronavirus Information Center », sur Elsevier Connect (consulté le ).
- « Coronavirus : comment la France a développé son propre test pour détecter le virus », sur Franceinfo, (consulté le ).
- China National Health Commission. Diagnosis and treatment of 2019-nCoV pneumonia in China. In Chinese. Published February 8, 2020.
- (en) Victor M Corman, Olfert Landt, Marco Kaiser et Richard Molenkamp, « Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR », Eurosurveillance, vol. 25, no 3, (ISSN 1560-7917, PMID 31992387, PMCID PMC6988269, DOI 10.2807/1560-7917.ES.2020.25.3.2000045, lire en ligne, consulté le ).
- « Coronavirus 2019 n-Cov », sur Ministère des Solidarités et de la Santé, .
- COVID-19 early warning score: a multi-parameter screening tool to identify highly suspected patients Cong-Ying Song, Jia Xu, Jian-Qin He, Yuan-Qiang Lu doi: https://doi.org/10.1101/2020.03.05.20031906
- (en) Jiang Gu, Encong Gong, Bo Zhang et Jie Zheng, « Multiple organ infection and the pathogenesis of SARS », Journal of Experimental Medicine, vol. 202, no 3, , p. 415–424 (ISSN 0022-1007, PMID 16043521, PMCID PMC2213088, DOI 10.1084/jem.20050828, lire en ligne, consulté le ).
- (en) Chu H., Zhou J., Wong B. H. et al., « Middle East respiratory syndrome coronavirus efficiently infects human primary T lymphocytes and activates the extrinsic and intrinsic apoptosis pathways. », The Journal of Infectious Diseases, no 213, , p. 904-914 (lire en ligne).
- (en) Xiaobo Yang, Yuan Yu, Jiqian Xu et Huaqing Shu, « Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study », The Lancet Respiratory Medicine, vol. 0, no 0, (ISSN 2213-2600 et 2213-2619, DOI 10.1016/S2213-2600(20)30079-5, lire en ligne, consulté le ).
- (en) Xiaohua Chen, Binghong Zhao, Yueming Qu et Yurou Chen, « Detectable serum SARS-CoV-2 viral load (RNAaemia) is closely associated with drastically elevated interleukin 6 (IL-6) level in critically ill COVID-19 patients », medRxiv, , p. 2020.02.29.20029520 (DOI 10.1101/2020.02.29.20029520, lire en ligne, consulté le ).
- Chang L, Yan Y et Wang L (2020) Coronavirus Disease 2019: Coronaviruses and Blood Safety ; Transfus Med Rev. 21 février ; . Epub 2020 Feb 21 (résumé).
- (en) Xingwang Jia, Pengjun Zhang, Yaping Tian et Junli Wang, « Clinical significance of IgM and IgG test for diagnosis of highly suspected COVID-19 infection », medRxiv, , p. 2020.02.28.20029025 (DOI 10.1101/2020.02.28.20029025, lire en ligne, consulté le ).
- Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019 Juanjuan Zhao Jr., Quan Yuan, Haiyan Wang, Wei Liu, Xuejiao Liao, Yingying Su, Xin Wang, Jing Yuan, Tingdong Li, Jinxiu Li, Shen Qian, Congming Hong, Fuxiang Wang, Yingxia Liu, Zhaoqin Wang, Qing He, Zhiyong Li, Bin He, Tianying Zhang, Shengxiang Ge, Lei Liu, Jun Zhang, Ningshao Xia, Zheng Zhang doi: https://doi.org/10.1101/2020.03.02.20030189.
- (en) Jing Gong, Hui Dong, Song Qing Xia et Yi Zhao Huang, « Correlation Analysis Between Disease Severity and Inflammation-related Parameters in Patients with COVID-19 Pneumonia », medRxiv, , p. 2020.02.25.20025643 (DOI 10.1101/2020.02.25.20025643, lire en ligne, consulté le ).
- Tao Liu, Jieying Zhang, Yuhui Yang, Liling Zhang, Hong Ma, Zhengyu Li, Jiaoyue Zhang, Ji Cheng, Xiaoyu Zhang, Gang Wu, Jianhua Yi ; The potential role of IL-6 in monitoring coronavirus disease 2019. Doi:https://doi.org/10.1101/2020.03.01.20029769.
- (en) Lu Li, Shuang Li, Manman Xu et Sujun Zheng, « The level of plasma C-reactive protein is closely related to the liver injury in patients with COVID-19 », medRxiv, , p. 2020.02.28.20028514 (DOI 10.1101/2020.02.28.20028514, lire en ligne, consulté le ).
- Lymphopenia predicts disease severity of COVID-19: a descriptive and predictive study Li Tan, Qi Wang, Duanyang Zhang, Jinya Ding, Qianchuan Huang, Yi-Quan Tang, Qiongshu Wang, Hongming Miao medRxiv 2020.03.01.20029074; doi: https://doi.org/10.1101/2020.03.01.20029074.
- (en) Gavin M. Joynt et William KK Wu, « Understanding COVID-19: what does viral RNA load really mean? », The Lancet Infectious Diseases, vol. 0, no 0, (ISSN 1473-3099 et 1474-4457, DOI 10.1016/S1473-3099(20)30237-1, lire en ligne, consulté le )
- (en-GB) Graham Readfearn, « Coronavirus: what happens to people's lungs when they get Covid-19? », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- Feng Pan, Tianhe Ye, Peng Sun et Shan Gui, « Time Course of Lung Changes On Chest CT During Recovery From 2019 Novel Coronavirus (COVID-19) Pneumonia », Radiology, , p. 200370 (ISSN 0033-8419, DOI 10.1148/radiol.2020200370, lire en ligne, consulté le ).
- Bruno Benque (avec RSNA) : Coronavirus au scanner : des images différentes selon le stade d’évolution, article de Thema Radiologie ; vend 21 février 2020 d’après Adam Bernheim & al. (2020) ‘'Chest CT Findings in Coronavirus Disease-19 (COVID-19): Relationship to Duration of Infection ; RSNA Radiology ; mis en linge le 02 février 2020 ; https://doi.org/10.1148/radiol.2020200463 (en).
- Chan JF, Yuan S, Kok KH et al. (2020) A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet; 395: 514–23.
- Shi H, Han X, Jiang N, et al. (2020) Radiological Findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis; published online Feb 24. https://doi.org/10.1016/ S1473-3099(20)30086-4.
- Lee E.Y, Ng M.Y & Khong P.L (2020) COVID-19 pneumonia: what has CT taught us?. The Lancet Infectious Diseases.
- (en) Nicole Lurie et Brendan G. Carr, « The Role of Telehealth in the Medical Response to Disasters », JAMA Internal Medicine, vol. 178, no 6, , p. 745 (ISSN 2168-6106, DOI 10.1001/jamainternmed.2018.1314, lire en ligne, consulté le ).
- (en) Judd E. Hollander et Brendan G. Carr, « Virtually Perfect? Telemedicine for Covid-19 », New England Journal of Medicine, , NEJMp2003539 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMp2003539, lire en ligne, consulté le ).
- (en) Xiaolong Qi, Zicheng Jiang, Qian Yu et Chuxiao Shao, « Machine learning-based CT radiomics model for predicting hospital stay in patients with pneumonia associated with SARS-CoV-2 infection: A multicenter study », medRxiv, , p. 2020.02.29.20029603 (DOI 10.1101/2020.02.29.20029603, lire en ligne, consulté le ).
- « MaladieCoronavirus.fr », sur www.maladiecoronavirus.fr (consulté le )
- (en) Licia Bordi, Emanuele Nicastri, Laura Scorzolini et Antonino Di Caro, « Differential diagnosis of illness in patients under investigation for the novel coronavirus (SARS-CoV-2), Italy, February 2020 », Eurosurveillance, vol. 25, no 8, , p. 2000170 (ISSN 1560-7917, DOI 10.2807/1560-7917.ES.2020.25.8.2000170, lire en ligne, consulté le ).
- « Maladie à coronavirus 2019 (COVID-19) : questions-réponses », OMS (consulté le ).
- Autopsy in suspected COVID-19 cases, Hanley B et al, J Clin Pathol,
- A pathological report of three COVID-19 cases by minimally invasive autopsies, Yao XH et al.,
- PMID [https://www.ncbi.nlm.nih.gov/pubmed/32194247 32194247]
- « Maladie à coronavirus 2019 (COVID-19) : questions-réponses », sur OMS (consulté le ).
- Alhazzani et al. 2020.
- Dale Fisher et David Heymann, « Q&A: The novel coronavirus outbreak causing COVID-19 », BMC Medicine, vol. 18, no 1, , p. 57 (ISSN 1741-7015, DOI 10.1186/s12916-020-01533-w, lire en ligne, consulté le ).
- (en) Nanshan Chen, Min Zhou, Xuan Dong et Jieming Qu, « Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study », The Lancet, vol. 0, no 0, (ISSN 0140-6736 et 1474-547X, DOI 10.1016/S0140-6736(20)30211-7, lire en ligne, consulté le ).
- (en) « WHO says new China coronavirus could spread, warns hospitals worldwide », Reuters, (lire en ligne, consulté le ).
- (en) Peter Richardson, Ivan Griffin, Catherine Tucker et Dan Smith, « Baricitinib as potential treatment for 2019-nCoV acute respiratory disease », The Lancet, vol. 0, no 0, (ISSN 0140-6736 et 1474-547X, DOI 10.1016/S0140-6736(20)30304-4, lire en ligne, consulté le ).
- « Coronavirus : le nombre d’infections en Chine a dépassé celui du SRAS », Le Monde.fr, (lire en ligne, consulté le ).
- (en) Els Keyaerts, Leen Vijgen, Piet Maes et Johan Neyts, « In vitro inhibition of severe acute respiratory syndrome coronavirus by chloroquine », Biochemical and Biophysical Research Communications, vol. 323, no 1, , p. 264–268 (PMID 15351731, PMCID PMC7092815, DOI 10.1016/j.bbrc.2004.08.085, lire en ligne, consulté le ).
- (en) Martin J Vincent, Eric Bergeron, Suzanne Benjannet et Bobbie R Erickson, « Chloroquine is a potent inhibitor of SARS coronavirus infection and spread », Virology Journal, vol. 2, no 1, , p. 69 (DOI 10.1186/1743-422X-2-69, lire en ligne, consulté le ).
- (en) Christophe Biot, Wassim Daher, Natascha Chavain et Thierry Fandeur, « Design and Synthesis of Hydroxyferroquine Derivatives with Antimalarial and Antiviral Activities », Journal of Medicinal Chemistry, vol. 49, no 9, , p. 2845–2849 (ISSN 0022-2623 et 1520-4804, DOI 10.1021/jm0601856, lire en ligne, consulté le ).
- (en) « Chloroquine is a potent inhibitor of SARS coronavirus infection and spread », SpingerLink, (lire en ligne).
- (en) Meijuan Zheng, Yong Gao, Gang Wang et Guobin Song, « Functional exhaustion of antiviral lymphocytes in COVID-19 patients », Cellular & Molecular Immunology, (ISSN 1672-7681 et 2042-0226, PMCID PMC7091858, DOI 10.1038/s41423-020-0402-2, lire en ligne, consulté le ).
- (en) « Diagnosis and Treatment Protocol for Novel Coronavirus Pneumonia, p8/17 », National Health Commission & State Administration of Traditional Chinese Medicine, (lire en ligne).
- « Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studie », BioScienceTrends, (lire en ligne).
- « La chloroquine est-elle un bon traitement contre le coronavirus ? », sur Sciences et Avenir (consulté le ).
- (en) Multicenter collaboration group of Department of Science and Technology of Guangdong Province and Health Commission of Guangdong Province for chloroquine in the treatment of novel coronavirus pneumonia, « [Expert consensus on chloroquine phosphate for the treatment of novel coronavirus pneumonia] », Zhonghua Jie He He Hu Xi Za Zhi = Zhonghua Jiehe He Huxi Zazhi = Chinese Journal of Tuberculosis and Respiratory Diseases, vol. 43, no 0, , E019 (ISSN 1001-0939, PMID 32075365, DOI 10.3760/cma.j.issn.1001-0939.2020.0019, lire en ligne, consulté le ).
- (en) « A systematic review on the efficacy and safety of chloroquine for the treatment of COVID-19 », ScienceDirect, (lire en ligne).
- (en + zh) Chen Jun, Liu Danping, Liu Li, lui Ping, Xu Qingnian, Xia Lu, Ling Yun, Huang Dan, Song Shuli, Zhang Dandan, Qian Zhiping, Li Tao, Shen Yinzhong & Lu Hongzhou, « A pilot study of hydroxychloroquine in treatment of patients with common coronavirus disease-19 (COVID-19) », Journal of ZheJiang University (Medical Sciences), (lire en ligne).
- (en) « Effective Treatment of Severe COVID-19 Patients with Tocilizumab », sur ChinaXiv.org (consulté le ).
- (en) « China approves use of Roche drug in battle against coronavirus complications », sur Reuters (consulté le ).
- (en) « How an Arthritis Drug Could Treat Coronavirus Infections », sur American Council on Science and Health (consulté le ).
- (it) « Coronavirus, via libera dell'Aifa al farmaco anti-artrite efficace su 3 pazienti e a un antivirale: test in 5 centri », sur www.ilmessaggero.it (consulté le ).
- (en) « How doctors can potentially significantly reduce the number of deaths from Covid-19 », sur Vox (consulté le ).
- Ruan Qiurong, « Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China », Intensive Care Medicine (w)Erreur : langue non reconnue par le modèle Lien : « w »., (DOI 10.1007/s00134-020-05991-x, lire en ligne, consulté le ).
- INSERM - Coviplasm : tester l’efficacité de la transfusion de plasma de patients convalescents du Covid-19 dans le traitement de la maladie
- (en) Clark D. Russell, Jonathan E. Millar et J. Kenneth Baillie, « Clinical evidence does not support corticosteroid treatment for 2019-nCoV lung injury », The Lancet, vol. 0, no 0, (ISSN 0140-6736 et 1474-547X, DOI 10.1016/S0140-6736(20)30317-2, lire en ligne, consulté le ).
- (en) « On the use of corticosteroids for 2019-nCoV pneumonia », sur Lancet, The Lancet, (consulté le ).
- (en) Jiao Zhao, Yan Yang, Han-Ping Huang et Dong Li, « Relationship between the ABO Blood Group and the COVID-19 Susceptibility », medRxiv, , p. 2020.03.11.20031096 (DOI 10.1101/2020.03.11.20031096, lire en ligne, consulté le ).
- (en) Patrice Guillon, Monique Clément, Véronique Sébille, Jean-Gérard Rivain, Chih-Fong Chou, Nathalie Ruvoën-Clouet, Jacques Le Pendu, « https://doi.org/10.1093/glycob/cwn093 », Oxford Academic, (lire en ligne).
- France Inter, « Groupe sanguin et coronavirus, un hasard génétique », sur franceinter.fr, Radio publique, (consulté le ).
- Wong SF, Chow KM, Leung TN, et al. Pregnancy and perinatal outcomes of women with severe acute respiratory syndrome. Am J Obstet Gynecol 2004; 191: 292–97.
- Lam CM, Wong SF, Leung TN, et al. A case-controlled study comparing clinical course and outcomes of pregnant and non-pregnant women with severe acute respiratory syndrome. BJOG 2004; 111: 771–74.
- Zhu H, Wang L, Fang C, et al. (2020) Clinical analysis of 10 neonates born to mothers with 2019‐nCoV pneumonia. Transl Pediatr.; 9: 51‐ 60.
- Gagneur A, Dirson E, Audebert S, et al. (2008) Materno-fetal transmission of human coronaviruses: a prospective pilot study. Eur J Clin Microbiol Infect Dis;27:863-6.
- Ng PC, Leung CW, Chiu WK, et al. (2004) SARS in newborns and children. Biol Neonate ;85:293-8 (résumé).
- (en) Lan Dong, Jinhua Tian, Songming He et Chuchao Zhu, « Possible Vertical Transmission of SARS-CoV-2 From an Infected Mother to Her Newborn », JAMA, (ISSN 0098-7484, DOI 10.1001/jama.2020.4621, lire en ligne, consulté le ).
- (en) Hui Zeng, Chen Xu, Junli Fan et Yueting Tang, « Antibodies in Infants Born to Mothers With COVID-19 Pneumonia », JAMA, (ISSN 0098-7484, DOI 10.1001/jama.2020.4861, lire en ligne, consulté le ).
- (en) David W. Kimberlin et Sergio Stagno, « Can SARS-CoV-2 Infection Be Acquired In Utero?: More Definitive Evidence Is Needed », JAMA, (ISSN 0098-7484, DOI 10.1001/jama.2020.4868, lire en ligne, consulté le ).
- (en) Yaron Steinbuch, « Chinese baby tests positive for coronavirus 30 hours after birth », sur New York Post, (consulté le ).
- (en) Huijun Chen, « Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records », Lancet, (consulté le ).
- Maternal and neonatal outcomes of pregnant women with COVID-19 pneumonia: a case-control study Na Li, View ORCID ProfileLefei Han, Min Peng, Yuxia Lv, Yin Ouyang, Kui Liu, Linli Yue, Qiannan Li, Guoqiang Sun, Lin Chen, Lin Yang doi: https://doi.org/10.1101/2020.03.10.20033605.
- (en-US) Yang Li, Ruihong Zhao, Shufa Zheng et Xu Chen, « Early Release - Lack of Vertical Transmission of Severe Acute Respiratory Syndrome Coronavirus 2, China, volume 26, number 6 juin 2020 - Emerging Infectious Diseases journal - CDC », {{Article}} : paramètre «
périodique» manquant, paramètre «date» manquant (DOI 10.3201/eid2606.200287, lire en ligne, consulté le ). - (en) Lingkong Zeng, Shiwen Xia, Wenhao Yuan et Kai Yan, « Neonatal Early-Onset Infection With SARS-CoV-2 in 33 Neonates Born to Mothers With COVID-19 in Wuhan, China », JAMA Pediatrics, (ISSN 2168-6203, DOI 10.1001/jamapediatrics.2020.0878, lire en ligne, consulté le ).
- China National Health Commission. Diagnosis and treatment of 2019-nCoV pneumonia in China. In Chinese. Published February 8, 2020. Accessed February 19, 2020http://www.nhc.gov.cn/yzygj/s7653p/202002/d4b895337e19445f8d728fcaf1e3e13a.shtml.
- https://www.lapresse.ca/covid-19/202003/27/01-5266860-peut-on-attraper-une-seconde-fois-la-covid-19.php
- Futura Sciences[3]
- OMS, « Soins à domicile pour les patients présumés infectés par le nouveau coronavirus (virus de la COVID-19) qui présentent des symptômes bénins, et prise en charge des contacts », sur who.int/fr/, (consulté le )
- (en) « Coronavirus », sur www.who.int (consulté le ).
- Pierre Sautreuil, « Coronavirus en France : que faire en cas de symptômes ? », sur Le Figaro.fr, (consulté le ).
- (en) Billy J. Quilty, Sam Clifford, Stefan Flasche et NCoV working group2 of the Centre for Mathematical Modelling of Infectious Diseases CMMID, « Effectiveness of airport screening at detecting travellers infected with novel coronavirus (2019-nCoV) », Eurosurveillance, vol. 25, no 5, , p. 2000080 (ISSN 1560-7917, PMID 32046816, PMCID PMC7014668, DOI 10.2807/1560-7917.ES.2020.25.5.2000080, lire en ligne, consulté le ).
- « Nouveau coronavirus (2019-nCov) : conseils au grand public – Quand et comment utiliser un masque ? », sur www.who.int (consulté le )
- « Faut-il généraliser le port du masque ? Le discours officiel commence à s’infléchir », Le Monde.fr, (lire en ligne, consulté le )
- Pandémie COVID-19 et masques de protection[4]
- Ministre de la Santé et de la Solidarité, « Les différents types de masques » (consulté le ).
- Amélie St-Yves, « Coronavirus : porter un masque, un faux sentiment de sécurité », sur Le Journal de Montréal (consulté le )
- OMS[5]
- Cpias, Désinfection des mains par friction[6]
- (en) Retta Race, « What’s Known About Chlorine’s Impact On Coronavirus : Que sait-on de l'impact du chlore sur le coronavirus », sur Swim Swam, (consulté le ).
- Maville.com, « Coronavirus. Davantage de chlore dans votre eau potable ? On vous explique pourquoi », sur rennes.maville.com, (consulté le ).
Voir aussi
Guide de bonnes pratiques
- Alhazzani, W. Møller, M. H. Arabi, M. Loeb et et al., Surviving sepsis campaign: guidelines on the management of critically ill adults with Coronavirus Disease 2019 (COVID-19) - Un-edited accepted proof, European Society of Intensive Care Medicine and the Society of Critical Care Medicine, (DOI 10.1007/s00134-020-06022-5, lire en ligne)
Bibliographie
- Philippe Sansonetti, « Covid-19, chronique d’une émergence annoncée », La Vie des idées, (lire en ligne, consulté le ).
- Pascal Marichalar, « Savoir et prévoir : Première chronologie de l’émergence du Covid-19 », La Vie des idées, (lire en ligne, consulté le ).
- Philippe Grandcolas et Jean-Lou Justine, « Covid-19 ou la pandémie d’une biodiversité maltraitée », The Conversation, (DOI https://doi.org/10.6084/m9.figshare.12040623.v1, lire en ligne, consulté le )

- Ressources pour le COVID-19, sur worldcat.org
Articles connexes
- Coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV-2)
- Pandémie de Covid-19
- Épidémie
- Maladie à déclaration obligatoire
- Maladie infectieuse émergente
- Betacoronavirus
- Pandémie
- Santé publique
- Lymphohistiocytose hémophagocytaire secondaire
- Syndrome inflammatoire de reconstitution immune
- Désinformation sur la pandémie de Covid-19
- Test diagnostique du SARS-CoV-2
- Développement et recherche de médicaments contre la Covid-19
Liens externes
- Ressources relatives à la santé :