Thrombopénie
| Médicament | Argatroban, desmopressine, lépirudine, Anagrélide, eltrombopag, ruxolitinib, romiplostim, rituximab et lépirudine |
|---|---|
| Spécialité | Hématologie |
| CIM-10 | D69.6, P61.0 |
|---|---|
| CIM-9 | 287.3, 287.4, 287.5 |
| OMIM | 188000 313900 |
| DiseasesDB | 27522 |
| MedlinePlus | 000586 |
| MeSH | D013921 |
| Patient UK | Thrombocytopenia |
Une thrombopénie (ou thrombocytopénie[1], ou hypoplaquettose[2]) est une anomalie de la quantité de thrombocytes (plaquettes) dans le sang, caractérisée par une diminution du nombre de thrombocytes en dessous du seuil de 150 giga thrombocytes par litre ou une diminution de 50 % par rapport au niveau de référence[3].
La quantité normale de thrombocytes dans le sang se situe entre 150 giga thrombocytes /litre et 450 giga thrombocytes /litre[4].
La thrombopénie peut être asymptomatique ou se révéler par un purpura ; on parle alors de purpura thrombopénique.
L'enquête étiologique doit être exhaustive devant une simple anomalie de l'hémogramme, mode de découverte le plus fréquent, et comporte obligatoirement une entrevue, un examen clinique complet et des investigations complémentaires qui permettront de poser rapidement le diagnostic.
Veuillez noter que 150 giga plaquettes par litre équivaut à 150 000 plaquettes par millimètre cube (ancienne unité parfois utilisée).
Intérêt[modifier | modifier le code]
Qu'elle soit symptomatique ou non, une thrombopénie ne doit jamais être négligée.
Schématiquement et selon son importance, elle peut orienter vers une pathologie maligne, témoigner de la gravité d'une maladie habituellement bénigne ou encore potentiellement provoquer le décès.
Le deuxième cas est le plus fréquent.
Devant le nombre de causes de cette anomalie fréquente en milieu hospitalier, il faut savoir orienter efficacement le diagnostic.
Physiopathologie[modifier | modifier le code]
Une thrombopénie ne peut être décrite qu'à partir d'une formule sanguine (hémogramme). De plus, elle n'est pas synonyme de purpura ou d'hémorragie, même si de nombreuses thrombopénies peuvent s'exprimer de ces manières.
Quelques remarques doivent être émises en préambule :
- le nombre de plaquettes ne subit aucune variation selon l'âge ou le sexe ;
- l'artéfact le plus fréquent est la formation d'agrégats plaquettaires au moment de la prise de sang (lié à l'EDTA utilisé pour le prélèvement), conduisant à la sous-estimation du nombre réel de plaquettes.
Le risque hémorragique est estimé comme suit :
- il n'y a aucun risque au-dessus de 100 000 /mm3 ;
- le risque existe entre 50 000 et 100 000 /mm3 seulement s'il existe une lésion associée comme une atteinte endothéliale ou une thrombopathie ;
- la thrombopénie peut être seule responsable d'hémorragie si elle est en dessous de 50 000 /mm3 ;
- le risque est majeur, c'est-à-dire justifiant la transfusion de plaquettes, en dessous de 20 000 /mm3 ; ceci uniquement en cas de thrombopénie centrale (les transfusions de plaquettes dans les thrombopénies périphériques sont exceptionnellement indiquées et à réserver aux situations d'urgence vitale).
Deux mécanismes principaux sont à l'origine d'une thrombopénie. Ils constituent une des données fondamentales du diagnostic :
- la thrombopénie centrale est la conséquence d'une production de plaquettes diminuée dans la moelle osseuse. Il peut s'agir entre autres d'une diminution du nombre de cellules-souches, des conséquences d'une leucémie ou d'autres troubles rares ;
- la thrombopénie périphérique est une diminution des plaquettes déjà formées, par destruction, séquestration, perte ou consommation.
Données cliniques d'orientation[modifier | modifier le code]
Âge[modifier | modifier le code]
L'origine d'une thrombopénie peut être :
- immunologique: par allo immunisation chez le nouveau-né et le petit nourrisson (jusqu'à 6 mois) ou par auto-immunisation chez le petit enfant, l'adolescent ou l'adulte jeune et plus rarement à d'autres âges de la vie :
- infectieuse chez l'enfant :
- maligne, incluant les dysmyélopoïèses, chez l'adulte âgé.
Antécédents[modifier | modifier le code]
- Familiaux : les maladies de la coagulation.
- Personnels : VIH ou autres infections, par exemple.
Dans les antécédents lointains, on s'enquerra des grossesses chez la femme, des éventuelles transfusions ou d'une toxicomanie. Les prises médicamenteuses et traitement en cours doivent être précisés ainsi que les vaccinations.
Circonstances de découverte[modifier | modifier le code]
Entre les symptômes cataclysmiques rares, faisant suspecter un mécanisme immunologique, et la découverte fortuite, beaucoup plus fréquente, il existe tout un éventail de situations.
Dans ces cas, un syndrome hémorragique constitue la principale plainte du patient et la durée de ces signes donne une idée de l'évolution de l'affection et peut parfois être un élément d'orientation diagnostic.
Signes généraux[modifier | modifier le code]
Ils sont liés non seulement à la maladie causale mais aussi aux conséquences d'un syndrome hémorragique responsable d'une anémie aiguë.
Signes hémorragiques surtout purpuriques[modifier | modifier le code]
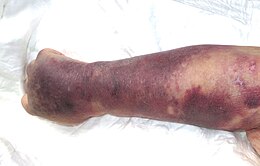
Ils sont de couleur rouge foncé ou bleutée, ne disparaissent pas à la pression et passent successivement par les couleurs de la biligénie avant de disparaître sans séquelle. Répétés et suffisamment prolongés, ils peuvent prendre une couleur brun ocre, à cause de l'hémosidérine qui s'y dépose.
- Pétéchies : ce sont de petites taches rouges et planes, de 2 à 3 mm de diamètre : les classiques têtes d'épingles. Elles peuvent apparaitre spontanément, après la mise en place d'un garrot ou après grattage.
- Ecchymoses : Contrairement aux bleus normaux, lorsqu'elles sont liées à une thrombopénie, les ecchymoses surviennent spontanément ou lors d'un choc minime. On ne peut pas différencier à l'œil les ecchymoses normales des pathologiques.
- Hémorragies muqueuses : elles se manifestent principalement par des saignements des gencives ou du nez. Les règles peuvent également être plus abondantes et les hémorragies digestives se développent à partir de lésions sous-jacentes.
- Bulles hémorragiques : forme particulière d'hémorragie muqueuse, leur siège préférentiel est la muqueuse buccale. En règle générale, elles ne sont pas isolées mais intégrées dans un tableau hémorragique cutané.
L'examen du fond d'œil doit être systématique en cas de signes purpuriques et/ou de thrombopénie profonde à la recherche d'une hémorragie rétinienne, ce qui constituerait un facteur de risque pour une hémorragie cérébroméningée.
Diagnostic différentiel : tout purpura n'est pas obligatoirement le témoin d'une thrombopénie.
- C'est le cas des purpuras vasculaires dont le purpura rhumatoïde.
- C'est aussi le cas des purpuras dermatologiques liés à une atrophie cutanée dans le purpura sénile des membres supérieurs ou à une insuffisance veineuse des membres inférieurs dans la dermite ocre.
- Le purpura dysglobulinémique nécessite un bilan immunologique à la recherche de cryoglobulines.
En présence d'une thrombopénie, il faut rechercher les différents signes de saignements cachés (génito-urinaires ou digestifs) et en évaluer leur conséquences, notamment l'anémie en recherchant une pâleur ou un temps de recoloration prolongé.
Le reste de l'examen doit comporter un examen cutané et articulaire à la recherche de signes de connectivite.
Examens complémentaires[modifier | modifier le code]
Hémogramme[modifier | modifier le code]
C'est l'élément majeur d'orientation du diagnostic.
- L'élément le plus important est bien sûr le nombre de plaquettes (voir physiopathologie : risque hémorragique). Leur forme et leur taille peut également jouer un rôle, comme dans le cas des macro-plaquettose par exemple.
- Au niveau des globules rouges, on peut observer une anémie dont il convient de déterminer les caractéristiques. Sur ce point, le caractère régénératif ou non est primordial.
- Les anomalies des globules blancs sont beaucoup plus nombreuses (lymphocytose monomorphe, syndrome mononucléosique, myélémie, blastose, cellules lymphomateuses…).
- Il est donc important d'étudier la formule sanguine dans son ensemble pour l'analyser.
Bilan d'hémostase[modifier | modifier le code]
Puisque les plaquettes ne sont pas les seuls éléments sanguins impliqués dans l'hémostase il faut d'autres informations pour évaluer la fonction de coagulation. Le bilan doit comporter au minimum un taux de prothrombine, un temps de céphaline activée (TCA), un dosage du fibrinogène et un temps de saignement (TS). Ce bilan sera éventuellement complété par le dosage des facteurs du complexe prothrombinique, des produits de dégradation de la fibrine (PDF) et des complexes solubles.
Autres examens[modifier | modifier le code]
Le reste de l'exploration est fonction des données cliniques et de l'hémogramme.
- La ponction de moelle voire la biopsie ostéo-médullaire ne doit pas être systématique. Une de ses indications est un syndrome hémorragique avec hémostase normale. Cet examen permet, en cas de doute de s'assurer du nombre de mégacaryocytes (les précurseurs des plaquettes) retrouvés. Cela permet de séparer les thrombopénies centrales et périphériques. L'étude des autres lignées peut apporter des signes d'orientation.
- Dans des cas plus rares, des examens du type de la scintigraphie (par exemple l'étude isotopique plaquettaire à l'indium 111), peuvent permettre de mesurer la durée de vie des plaquettes ou de mettre au jour une séquestration. Bien que rarement indiqués, ces examens peuvent s'avérer utiles dans un but de pronostic (ex. : indication de splénectomie dans le purpura thrombopénique idiopathique chronique).
- Des dosages d'enzymes hépatiques ou du taux de vitamine B12 et d'acide folique peuvent être pratiqués.
- Vérification de la fonction rénale.
- Détermination de la vitesse de sédimentation.
Diagnostic étiologique[modifier | modifier le code]
Thrombopénies centrales[modifier | modifier le code]
L'étude de la moelle est obligatoire.
Infiltration médullaire[modifier | modifier le code]
Les mégacaryocytes sont normaux mais leur développement est inhibé par la présence de cellules anormales qui prennent le peu d'espace disponible dans la moelle osseuse :
- leucémies aiguës, leucémies chroniques, lymphomes, myélomes, métastases de cancers viscéraux.
La leucémie aiguë doit être redoutée car la thrombopénie est précoce et parfois importante au moment de la découverte. Dans les autres affections citées, la thrombopénie est plus tardive et moins surprenante ;
- myélofibroses, ostéopétrose, tuberculose hématopoïétique, leishmaniose viscérale.
Dysfonctionnements des lignées médullaires[modifier | modifier le code]
Certains sont de diagnostic rapide. Dans certains cas, l'aspect des plaquettes est suffisant pour poser un diagnostic comme dans les mégaloblastoses par déficit vitaminique, les myélodysplasies primitives ou secondaires ou encore les aplasies médullaires, qui, elles, doivent être confirmées par une biopsie ostéo-médullaire.
Les autres exigent une exploration plus poussée pour être affirmée : Par exemple, l'hémoglobinurie paroxystique nocturne qui peut conduire à terme à une aplasie médullaire ou à une leucémie aiguë, thrombopénie cyclique plus rare que les neutropénies cycliques.
Affections constitutionnelles[modifier | modifier le code]
Parfois héréditaires et retrouvées à l'anamnèse, ces affections comportent une thrombopénie qui est ou non l'élément principal de la maladie.
Exemples : Le diagnostic d'aplasie médullaire de Fanconi est porté chez le petit enfant, l'amégacaryocytose avec ou sans aplasie radiale dès la naissance.
Dans les maladies ci-après, la thrombopénie par mégacaryocytopoïèse inefficace n'est qu'un des éléments de la symptomatologie.
- Le syndrome de Wiskott-Aldrich est marqué par un eczéma, une susceptibilité aux infections, des plaquettes de petite taille, un déficit de l'agrégation au collagène et à l'acide arachidonique. Il existe une thrombopathie.
- La dystrophie thrombocytaire hémorragipare de Bernard - Soulier, les plaquettes sont géantes et il existe un déficit d'agrégation à la ristocétine. La thrombopénie y est modérée.
- L'anomalie de May - Hegglin est caractérisée par des plaquettes géantes et des anomalies des polynucléaires qui présentent des corps de Döhle.
D'autres mutations génétiques peuvent entraîner une thrombopénie : mutation sur le gène de la filamine A[5], sur ACTN1[6] ou TPM4[7].
Atteinte de la lignée mégacaryocytaire d'origine médicamenteuse[modifier | modifier le code]
Citons les thrombopénies du nouveau-né de mère absorbant des thiazidiques, ayant subi une chimiothérapie, une irradiation ou ayant souffert d'alcoolisme aigu.
La plupart des agents antimitotiques sont susceptibles d'induire une thrombopénie par toxicité directe sur les précurseurs plaquettaires.
En dehors des agents antimitotiques, les œstrogènes, thiazidiques, tolbutamide et l'alcool ont une action plus spécifique sur les mégacaryocytes.
Résumé[modifier | modifier le code]
Devant le nombre de causes centrales, il est nécessaire de s'orienter par la fréquence respective des pathologies :
- pathologies fréquentes : leucémies aiguës, lymphomes, métastases, myélofibrose, dysplasies ;
- pathologies rares : tuberculose, mégaloblastose, alcoolisme aigu, irradiation, infections virales, thiazidiques, œstrogènes ;
- pathologies exceptionnelles : ostéopétrose, hémoglobinurie paroxystique nocturne (HPN), thrombopénie cyclique, aplasie de Fanconi, AAR[Quoi ?], Wiscott - Aldrich, Bernard - Soulier, May - Hegglin.
Thrombopénies périphériques[modifier | modifier le code]
Destruction immunologique des plaquettes[modifier | modifier le code]
- Purpura thrombopénique idiopathique : production d'anticorps antiplaquettes chez des sujets normalement sains et ne prenant aucun médicament. L'origine immunologique est affirmée par la présence d'une quantité importante d'immunoglobulines à la surface des plaquettes.
- Purpura thrombopénique infectieux : le mécanisme est similaire à celui du purpura thrombopénique idiopathique mais l'infection causale est parfaitement identifiée. L'évolution se fait vers la résolution parallèle à l'infection. Il est possible d'observer une thrombopénie au cours de septicémies. Le purpura fulminans est une variété particulière de purpura infectieux s'accompagnant d'un collapsus surtout dû au méningocoque.
- Purpura thrombopénique médicamenteux immunoallergique : la thrombopénie est brutale avec un syndrome hémorragique après un délai moyen de dix jours mais qui peut être beaucoup plus important. Il existe des tests in vitro permettant le diagnostic. Après suppression du médicament en cause, la guérison survient en cinq à dix jours.
- Pathologies auto-immunes : hémopathies lymphoïdes (leucémie lymphoïde chronique en particulier), collagénoses, dystrophies auto-immunes, anémies hémolytiques auto-immunes…
- Purpura thrombopénique post-transfusionnel (rare). Il survient brutalement huit jours après une transfusion chez un receveur qui a déjà reçu une transfusion par le passé. Le mécanisme par lequel le sujet détruit également ses propres plaquettes est discuté.
- Purpura thrombopénique néonatal : le mécanisme est soit un passage transplacentaire d'anticorps de purpura thrombopénique idiopathique chronique, soit une incompatibilité fœto-maternelle ayant conduit à la formation d'anticorps anti-HPA, dans 85 % des cas des anti HPA‑1a (ex. : PlA1) et parfois anti HPA-5b pour 10 % de ces allo-immunisations. La thrombopénie est transitoire.
Consommation qui dépasse les capacités de régénération[modifier | modifier le code]
- Coagulation intravasculaire disséminée (CIVD) : la CIVD est caractérisée par une diminution du fibrinogène et des facteurs II, V et VIII, une augmentation des produits de dégradation de la fibrine (PDF) et des complexes solubles. Les processus de déclenchement sont variés.
- Purpura thrombotique thrombocytopénique, ou syndrome de Moschcowitz, se caractérise par de la fièvre, une anémie hémolytique avec des schizocytes, une forme particulière de globules rouges. On retrouve également une insuffisance rénale aiguë et des manifestations neurologiques. Le point de départ est mystérieux (certainement une lésion endothéliale) mais les signes sont en rapport avec le dépôt de fibrine au niveau lésionnel.
Dans le syndrome hémolytique et urémique de l'enfant, la situation est voisine mais les signes neurologiques sont au second plan.
- Thrombopénie induite par l'héparine.
- Cause mécanique : citons les thrombopénies liées aux prothèses valvulaires.
- Dans certains pays tropicaux, une infection par la dengue s'avère une cause assez fréquente de thrombocytopénie associée à de la fièvre.
Séquestration par la rate : l'hypersplénisme[modifier | modifier le code]
Physiologiquement, la rate est un lieu de stockage plaquettaire, ce qui explique la thrombocytose (excès de plaquettes) des splénectomisés.
Une splénomégalie s'accompagne donc d'une augmentation du nombre de cellules emmagasinées. On retrouve une pancytopénie modérée avec des plaquettes aux alentours de 100 000 /mm3. Un signe en faveur est la leucopénie sans inversion de formule. La cause la plus fréquente est la cirrhose hépatique.
D'autres séquestrations sont possibles : brûlures étendues, hypothermie…
Cas particuliers[modifier | modifier le code]
La compensation du déficit de globules rouges induit une hypoplaquettose et une leucopénie modérées, en bonne partie parce que les matières transfusées ne contiennent pas de plaquettes, ce qui dilue le nombre de plaquettes présentes au départ.
Dans la circulation extracorporelle (CEC), les plaquettes sont consommées au niveau des surfaces artificielles.
Chez la femme enceinte, le nombre de plaquettes peut descendre jusqu'à 100 000 /mm3 sans que cela soit anormal[8].
Pronostic[modifier | modifier le code]
Il faut individualiser les facteurs aggravants :
- âge plus grand que 60 ans ;
- apparition brutale et récente ;
- fièvre majorant le risque ;
- intervention chirurgicale récente ;
- hypertension artérielle ;
- prise de médicaments susceptibles d'interférer sur l'hémostase ;
- insuffisance hépatocellulaire.
Il faut détecter les risques hémorragiques suivants qui correspondent à une gradation dans la gravité :
- diffusion du purpura à l'abdomen ;
- apparition de bulles hémorragiques ;
- épistaxis ;
- hématurie ;
- hémorragie rétinienne au fond d'œil ;
- céphalées annonciatrices.
Parfois, le tableau d'hémorragie méningée apparaît brutalement, à la faveur d'une lésion artérielle sous-jacente.
Traitement[modifier | modifier le code]
La transfusion de plaquettes n'est utile que dans les thrombopénies centrales profondes ou après les transfusions ou perfusions massives. Il faut vérifier au huitième jour l'absence d'allo-immunisation, c'est-à-dire que le corps du receveur ne finisse par reconnaître les plaquettes transfusées comme un ennemi, ce qui rendrait inefficace les transfusions ultérieures. Dans certains cas, on pratique des transfusions d'immunoglobulines. Les transfusions peuvent être « thérapeutiques » (le patient est en train de saigner) ou « prophylactiques » (le patient risque de saigner). Le seuil le plus communément admis est de 10 000 plaquettes par millimètre cube[9].
Dans tous les cas, il convient d'éviter tous les gestes qui pourraient être à l'origine d'hémorragies (injections intramusculaires, ponctions, médicaments interférant avec la coagulation…). Les règles peuvent être contrôlées par la contraception.
En cas de cause médicamenteuse immunoallergique, l'arrêt du médicament s'impose et amène la rétrocession de la thrombopénie.
Le traitement du purpura thrombopénique idiopathique est envisagé séparément.
Notes et références[modifier | modifier le code]
- « Thrombopénie », sur Futura (consulté le ).
- « Encyclopédie Larousse en ligne - thrombocytopénie ou hypoplaquettose », sur larousse.fr (consulté le ).
- (en) Skirvin JA. « Thrombocytopenia » In : Tisdale JE, Miller DA, éditeurs. Drug-induced diseases: prevention, detection, and management. Bethesda (Maryland, États-Unis). American Society of Health-System Pharmacists, Inc. ; 2005. p. 649-59.
- (en) « Platelet count: MedlinePlus Medical Encyclopedia », sur medlineplus.gov (consulté le )
- Nurden P, Debili N, Coupry I et al. Thrombocytopenia resulting from mutations in filamin A can be expressed as an isolated syndrome, Blood, 2011;118:5928–5937
- Bottega R, Marconi C, Faleschini M et al. ACTN1-related thrombocytopenia: identification of novel families for phenotypic characterization, Blood, 2015;125:869–872
- Pleines I, Woods J, Chappaz S et al. Mutations in tropomyosin 4 underlie a rare form of human macrothrombocytopenia, J Clin Invest, 2017;127:814-829
- Reese JA, Peck JD, Deschamps DR et al. Platelet counts during pregnancy, N Engl J Med, 2018;379:32-43
- (en) Estcourt L, Stanworth S, Doree C et al. « Prophylactic platelet transfusion for prevention of bleeding in patients with haematological disorders after chemotherapy and stem cell transplantation » Cochrane Database Syst Rev. 2012;5.CD004269