« Histoire évolutive de la lignée humaine » : différence entre les versions
Annulation de la modification de 198.52.54.52 (d) Balise : Annulation |
m v2.0 - Correction syntaxique (Modèle inexistant - Lien magique ISBN obsolète) / Homonymies : Il reste 1 lien à corriger - Michel Brunet |
||
| Ligne 79 : | Ligne 79 : | ||
[[Image:Human evolution scheme.svg|vignette|upright=1.25|Schéma caricatural et obsolète de la ''[[Marche du Progrès]]'' et de la « transition homme-singe »]] |
[[Image:Human evolution scheme.svg|vignette|upright=1.25|Schéma caricatural et obsolète de la ''[[Marche du Progrès]]'' et de la « transition homme-singe »]] |
||
À partir des années 1860, [[Thomas Henry Huxley|Huxley]], [[Paul Broca|Broca]] et [[Ernst Haeckel]] modélisent les principes de l'évolution du singe à l'homme. Nommé [[anthropopithèque]] par [[Gabriel de Mortillet]] (en reprenant le genre ''Anthropopithecus'' établi en 1839 par [[Henri-Marie Ducrotay de Blainville|De Blainville]]<ref name="Wiley-Blackwell-Encyclopedia-Human-Evolution">Bernard Wood ''et alii'', ''Wiley-Blackwell Encyclopedia of Human Evolution'', June 2013 (single-volume paperback version of the original 2011 2-volume edition), 1056 pp.; ISBN |
À partir des années 1860, [[Thomas Henry Huxley|Huxley]], [[Paul Broca|Broca]] et [[Ernst Haeckel]] modélisent les principes de l'évolution du singe à l'homme. Nommé [[anthropopithèque]] par [[Gabriel de Mortillet]] (en reprenant le genre ''Anthropopithecus'' établi en 1839 par [[Henri-Marie Ducrotay de Blainville|De Blainville]]<ref name="Wiley-Blackwell-Encyclopedia-Human-Evolution">Bernard Wood ''et alii'', ''Wiley-Blackwell Encyclopedia of Human Evolution'', June 2013 (single-volume paperback version of the original 2011 2-volume edition), 1056 pp.; {{ISBN|978-1-1186-5099-8}} {{en}}</ref>) et [[Pithécanthrope]] par Haeckel (''Pithecanthropus'' 1868<ref name="Wiley-Blackwell-Encyclopedia-Human-Evolution"/>), la recherche du « chaînon manquant », forme hybride entre l'homme moderne et les grands singes, commence<ref name="Picq53">[[#PP|Pascal Picq]], [2005], {{p.|53-55}}</ref>. |
||
Pour Haeckel, le gibbon est le singe le plus proche de l'homme. Pour lui, le chainon manquant est une forme intermédiaire entre les deux<ref name="Picq53"/>. |
Pour Haeckel, le gibbon est le singe le plus proche de l'homme. Pour lui, le chainon manquant est une forme intermédiaire entre les deux<ref name="Picq53"/>. |
||
| Ligne 360 : | Ligne 360 : | ||
L'encéphalisation a été mise en relation, selon l'{{lien|fr=hypothèse des tissus coûteux en énergie|lang=en|trad=Expensive Tissue Hypothesis}}{{note|texte=Selon cette hypothèse du tissu cher, les organes les plus coûteux en énergie chez les primates sont le cœur, le foie, les reins, l'estomac, l'intestin et le cerveau, ce dernier ne représentant chez l'homme que 2 % du poids du corps, mais est à lui seul responsable de 20 % de la dépense énergétique. Les trois premiers sont fortement contraints par la masse du corps, et donc l'ajustement de la dépense énergétique s'effectuerait par un compromis sur les deux derniers. Dans ce modèle, le coût du maintien de cerveaux volumineux est compensé par une augmentation de la qualité du [[régime alimentaire]] et une réduction correspondante de la taille du tractus intestinal. Cf {{en}} Aiello LC, Wheeler P. « The expensive-tissue hypothesis: the brain and the digestive-system in human and primate evolution », ''Curr Anthropol'', 36, 1995, p.199-221.|groupe=alpha}}, avec une augmentation de la part de la viande dans l'alimentation<ref>{{lien web|nom=McBroom |prénom=Patricia |date=14 juin 1999|titre=Meat-eating was essential for human evolution, says UC Berkeley anthropologist specializing in diet |url=http://www.berkeley.edu/news/media/releases/99legacy/6-14-1999a.html |lieu=Berkeley, CA |éditeur=[[University of California, Berkeley]] |consulté le=2015-04-25}}</ref>{{,}}<ref>{{article|nom=Mann |prénom=Neil |date=septembre 2007 |titre=Meat in the human diet: An anthropological perspective |url=http://www.thefreelibrary.com/Meat+in+the+human+diet:+an+anthropological+perspective-a0169311689 |périodique=Nutrition & Dietetics |lieu=Hoboken, NJ |éditeur=[[Wiley-Blackwell]] |volume=64 |numéro=Supplement s4 |pages=S102–S107 |doi=10.1111/j.1747-0080.2007.00194.x |issn=1747-0080 |consulté le=2012-01-31}}</ref> ou avec le développement de la cuisson<ref name="Organ_2011">{{article|nom1=Organ |prénom1=Chris |nom2=Nunn |prénom2=Charles L. |nom3=Machanda |prénom3=Zarin |nom4=Wrangham |prénom4=Richard W. |lien auteur4=Richard Wrangham |date=30 août 2011|titre=Phylogenetic rate shifts in feeding time during the evolution of ''Homo'' |périodique=Proc. Natl. Acad. Sci. U.S.A. |lieu=Washington, D.C. |éditeur=National Academy of Sciences |volume=108 |numéro=35 |pages=14555–14559 |doi=10.1073/pnas.1107806108 |issn=0027-8424 |pmc=3167533 |pmid=21873223}}</ref>. Mais l'augmentation de volume du cerveau pourrait être due à une [[mutation (génétique)|mutation]] accidentelle chez un unique individu ''Homo erectus'', le remplacement de la [[cytosine]] C par la [[guanine]] G à un certain endroit d'un [[gène]] : amputé de 55 [[nucléotide]]s par rapport à sa version originale<ref group=alpha>Le remplacement de C par G à cet endroit précis transforme un triplet CTA en GTA, lequel est interprété comme un signal de coupure : le reste du gène n'est pas transcrit dans l'ARN messager.</ref>, ce gène ne code plus pour une protéine régulant la croissance de filaments d'[[actine]] dans les [[neurone]]s, mais pour une autre qui stimule la division des neurones à partir des cellules progénitrices dans les [[système ventriculaire|ventricules]]<ref>{{article| titre=Une mutation génétique qui a profité au cerveau d'''Homo sapiens''| auteur=Sébastien Bohler| page=8| périodique=[[Pour la science]]| mois=mars| année=2017| numéro=473}}.</ref>{{,}}<ref>{{article| langue=en| titre=A single splice site mutation in human-specific ''ARHGAP11B'' causes basal progenitor amplification| auteur1=Marta Florio| auteur2=Takashi Namba| auteur3=Svante Pääbo| auteur4=Michael Hiller1| auteur5=Wieland B. Huttner| périodique=Science Advances| jour=7| mois=décembre| année=2016| volume=2| numéro=12| numéro article=1601941| doi=10.1126/sciadv.1601941}}.</ref>. |
L'encéphalisation a été mise en relation, selon l'{{lien|fr=hypothèse des tissus coûteux en énergie|lang=en|trad=Expensive Tissue Hypothesis}}{{note|texte=Selon cette hypothèse du tissu cher, les organes les plus coûteux en énergie chez les primates sont le cœur, le foie, les reins, l'estomac, l'intestin et le cerveau, ce dernier ne représentant chez l'homme que 2 % du poids du corps, mais est à lui seul responsable de 20 % de la dépense énergétique. Les trois premiers sont fortement contraints par la masse du corps, et donc l'ajustement de la dépense énergétique s'effectuerait par un compromis sur les deux derniers. Dans ce modèle, le coût du maintien de cerveaux volumineux est compensé par une augmentation de la qualité du [[régime alimentaire]] et une réduction correspondante de la taille du tractus intestinal. Cf {{en}} Aiello LC, Wheeler P. « The expensive-tissue hypothesis: the brain and the digestive-system in human and primate evolution », ''Curr Anthropol'', 36, 1995, p.199-221.|groupe=alpha}}, avec une augmentation de la part de la viande dans l'alimentation<ref>{{lien web|nom=McBroom |prénom=Patricia |date=14 juin 1999|titre=Meat-eating was essential for human evolution, says UC Berkeley anthropologist specializing in diet |url=http://www.berkeley.edu/news/media/releases/99legacy/6-14-1999a.html |lieu=Berkeley, CA |éditeur=[[University of California, Berkeley]] |consulté le=2015-04-25}}</ref>{{,}}<ref>{{article|nom=Mann |prénom=Neil |date=septembre 2007 |titre=Meat in the human diet: An anthropological perspective |url=http://www.thefreelibrary.com/Meat+in+the+human+diet:+an+anthropological+perspective-a0169311689 |périodique=Nutrition & Dietetics |lieu=Hoboken, NJ |éditeur=[[Wiley-Blackwell]] |volume=64 |numéro=Supplement s4 |pages=S102–S107 |doi=10.1111/j.1747-0080.2007.00194.x |issn=1747-0080 |consulté le=2012-01-31}}</ref> ou avec le développement de la cuisson<ref name="Organ_2011">{{article|nom1=Organ |prénom1=Chris |nom2=Nunn |prénom2=Charles L. |nom3=Machanda |prénom3=Zarin |nom4=Wrangham |prénom4=Richard W. |lien auteur4=Richard Wrangham |date=30 août 2011|titre=Phylogenetic rate shifts in feeding time during the evolution of ''Homo'' |périodique=Proc. Natl. Acad. Sci. U.S.A. |lieu=Washington, D.C. |éditeur=National Academy of Sciences |volume=108 |numéro=35 |pages=14555–14559 |doi=10.1073/pnas.1107806108 |issn=0027-8424 |pmc=3167533 |pmid=21873223}}</ref>. Mais l'augmentation de volume du cerveau pourrait être due à une [[mutation (génétique)|mutation]] accidentelle chez un unique individu ''Homo erectus'', le remplacement de la [[cytosine]] C par la [[guanine]] G à un certain endroit d'un [[gène]] : amputé de 55 [[nucléotide]]s par rapport à sa version originale<ref group=alpha>Le remplacement de C par G à cet endroit précis transforme un triplet CTA en GTA, lequel est interprété comme un signal de coupure : le reste du gène n'est pas transcrit dans l'ARN messager.</ref>, ce gène ne code plus pour une protéine régulant la croissance de filaments d'[[actine]] dans les [[neurone]]s, mais pour une autre qui stimule la division des neurones à partir des cellules progénitrices dans les [[système ventriculaire|ventricules]]<ref>{{article| titre=Une mutation génétique qui a profité au cerveau d'''Homo sapiens''| auteur=Sébastien Bohler| page=8| périodique=[[Pour la science]]| mois=mars| année=2017| numéro=473}}.</ref>{{,}}<ref>{{article| langue=en| titre=A single splice site mutation in human-specific ''ARHGAP11B'' causes basal progenitor amplification| auteur1=Marta Florio| auteur2=Takashi Namba| auteur3=Svante Pääbo| auteur4=Michael Hiller1| auteur5=Wieland B. Huttner| périodique=Science Advances| jour=7| mois=décembre| année=2016| volume=2| numéro=12| numéro article=1601941| doi=10.1126/sciadv.1601941}}.</ref>. |
||
Le modèle de [[neurodéveloppement]] postnatal du cerveau humain diffère de celui des autres grands singes ([[Hétérochronie]]) et permet de longues périodes de l'apprentissage social et l'acquisition du langage chez les enfants humains. Toutefois, les différences entre les structures du [[cerveau humain]] et ceux d'autres singes peuvent être encore plus importantes que les différences de volume<ref name="Park2007">{{article|nom1=Park |prénom1=Min S. |nom2=Nguyen |prénom2=Andrew D. |nom3=Aryan |prénom3=Henry E. |nom4=U |prénom4=Hoi Sang |nom5=Levy |prénom5=Michael L. |nom6=Semendeferi |prénom6=Katerina|date=mars 2007 |titre=Evolution of the human brain: changing brain size and the fossil record |périodique=[[Neurosurgery (journal)|Neurosurgery]] |lieu=Philadelphia, PA |éditeur=[[Lippincott Williams & Wilkins]] |volume=60 |numéro=3 |pages=555–562 |doi=10.1227/01.NEU.0000249284.54137.32 |issn=0148-396X |pmid=17327801}}</ref>{{,}}<ref name="Bruner2007">{{article|nom=Bruner |prénom=Emiliano |date=décembre 2007 |titre=Cranial shape and size variation in human evolution: structural and functional perspectives |id= |
Le modèle de [[neurodéveloppement]] postnatal du cerveau humain diffère de celui des autres grands singes ([[Hétérochronie]]) et permet de longues périodes de l'apprentissage social et l'acquisition du langage chez les enfants humains. Toutefois, les différences entre les structures du [[cerveau humain]] et ceux d'autres singes peuvent être encore plus importantes que les différences de volume<ref name="Park2007">{{article|nom1=Park |prénom1=Min S. |nom2=Nguyen |prénom2=Andrew D. |nom3=Aryan |prénom3=Henry E. |nom4=U |prénom4=Hoi Sang |nom5=Levy |prénom5=Michael L. |nom6=Semendeferi |prénom6=Katerina|date=mars 2007 |titre=Evolution of the human brain: changing brain size and the fossil record |périodique=[[Neurosurgery (journal)|Neurosurgery]] |lieu=Philadelphia, PA |éditeur=[[Lippincott Williams & Wilkins]] |volume=60 |numéro=3 |pages=555–562 |doi=10.1227/01.NEU.0000249284.54137.32 |issn=0148-396X |pmid=17327801}}</ref>{{,}}<ref name="Bruner2007">{{article|nom=Bruner |prénom=Emiliano |date=décembre 2007 |titre=Cranial shape and size variation in human evolution: structural and functional perspectives |id= |périodique=Child's Nervous System |lieu=Heidelberg |éditeur=[[Springer Science+Business Media|Springer-Verlag]] |volume=23 |numéro=12 |pages=1357–1365 |doi=10.1007/s00381-007-0434-2 |issn=0256-7040 |pmid=17680251 }}</ref>{{,}}<ref>{{article|nom=Potts |prénom=Richard |lien auteur=Rick Potts |date=octobre 2012 |titre=Evolution and Environmental Change in Early Human Prehistory |périodique=Annual Review of Anthropology |lieu=Palo Alto, CA |éditeur=Annual Reviews |volume=41 |pages=151–167 |doi=10.1146/annurev-anthro-092611-145754 |issn=0084-6570}}</ref>{{,}}<ref name="Leonard_2007">{{article|nom1=Leonard |prénom1=William R. |nom2=Snodgrass |prénom2=J. Josh |nom3=Robertson |prénom3=Marcia L. |date=août 2007 |titre=Effects of brain evolution on human nutrition and metabolism |périodique=[[Annual Review of Nutrition]] |lieu=Palo Alto, CA |éditeur=Annual Reviews |volume=27 |pages=311–327 |doi=10.1146/annurev.nutr.27.061406.093659 |issn=0199-9885 |pmid=17439362}}</ref>. |
||
L'augmentation du volume au fil du temps a affecté inégalement les zones du cerveau – les [[Lobe temporal|lobes temporaux]], qui contiennent des centres de traitement du langage, ont augmenté de manière disproportionnée, de même que le [[cortex préfrontal]] qui est lié à la prise de décision et modèlise le comportement social complexe<ref name="Schoeneman" />. |
L'augmentation du volume au fil du temps a affecté inégalement les zones du cerveau – les [[Lobe temporal|lobes temporaux]], qui contiennent des centres de traitement du langage, ont augmenté de manière disproportionnée, de même que le [[cortex préfrontal]] qui est lié à la prise de décision et modèlise le comportement social complexe<ref name="Schoeneman" />. |
||
Version du 31 décembre 2018 à 17:06
Histoire de l'Homme
L'histoire évolutive de la lignée humaine (Hominina) est le processus évolutif conduisant à l'apparition du genre Homo, puis d'Homo sapiens et de l'Homme moderne. Elle se greffe sur l'histoire évolutive des primates, qui commence avec l'extinction des dinosaures, lors de la césure Crétacé-Tertiaire, et débouche sur l'apparition des hominines, il y a 7 millions d'années, en passant par l'expansion des hominidés (grands singes sans queue) au cours du Miocène moyen.
La famille des hominidés aurait divergé de celle des hylobatidés (gibbons) il y a quelque 20 millions d'années, puis la sous-famille des homininés de celle des ponginés (orang-outans) il y a environ 15 millions d'années[1],[2].
La bipédie est le caractère le plus frappant de la sous-tribu des Hominina. Les deux plus anciens hominina connus sont Sahelanthropus tchadensis (7 Ma) et Orrorin tugenensis (6 Ma).
Le premier représentant documenté du genre Homo est Homo rudolfensis, qui apparait il y a environ 2,4 millions d'années en Afrique de l'Est[3]. Avec Homo habilis, on a longtemps pensé qu'il s'agissait des deux premières espèces à avoir utilisé des outils de pierre. Cependant une découverte de 2012 au Kenya montre que les outils lithiques existaient dès 3,3 millions d'années, et pourraient avoir été maniés par des Australopithèques[4].
L'étude de l'évolution humaine fait intervenir de nombreuses disciplines scientifiques : l'anthropologie physique, la primatologie comparée, l'archéologie, la paléontologie, l'éthologie, la linguistique, la psychologie évolutionniste, l'embryologie et la génétique[5].
Origine du mot Homo
Le mot Homo est le nom du genre biologique qui regroupe toutes les espèces humaines. Elles sont toutes éteintes à l'exception de l’Homo sapiens.
Le terme Homo, humain en latin, dérive d'une racine de l'Indo-européen commun *dʰǵʰm̥mō (« [chose / fils] de la terre »)[6].
Il a été choisi par Carl von Linné, dans sa méthode de classification de la nature, Systema naturae (édition de 1758). L'homme y est décrit sous le nom d’homo sapiens[7].
Histoire de la paléoanthropologie
« Ainsi, l'Homme descendrait du singe. Pourvu que cela ne soit pas vrai. Mais si cela devait être, prions pour que cela ne se sache pas. »
— Phrase attribuée à la femme de l'évêque de Worcester à la suite du débat entre Huxley et Wilberforce en 1861[8].
L'idée que l'espèce humaine est le fruit d'une longue évolution date du XIXe siècle, avec quelques racines dans l'antiquité. Elle émerge avec Lamarck et s'affirme avec le travail de Charles Darwin[9].
Avant Darwin

Le premier à comparer les espèces et à établir un classement est Aristote, au IVe siècle av. J.-C. Il en déduit une organisation du vivant tendant à s'élever vers l'homme selon une échelle, la Scala naturæ[9]. Hippocrate dans De natura hominis voit une relation entre l'anatomie et l'influence du milieu[9].
Galien (au IIe siècle) note la ressemblance entre l'anatomie des singes et des hommes[9]. Il incite les médecins à s'entraîner à la dissection sur des singes.
Les cabinets de curiosités qui prolifèrent au XVIIe siècle voient naître les premiers inventaires du vivant et leurs premières classifications dans le but de glorifier l’œuvre du créateur[7].
Dans la lignée de Noël-Antoine Pluche et son célèbre Spectacle de la nature, Carl von Linné établit une grande classification de la nature, Systema naturae. Dans l'édition de 1758, l'homme y est décrit sous le nom d’homo sapiens, membre du groupe des Anthropomorphes comprenant les chimpanzés (Homo troglodytes) et les paresseux[7]. Linné considère que les grands singes sont les plus proches parents de l'homme en fonction des similitudes morphologiques et anatomiques.
Georges-Louis Leclerc de Buffon critique le travail de Linné et ironise : « Dieu a créé, Linné a classé ». Pour sa part, son œuvre est organisée autour de l'homme, le classant en tant qu'espèce unique. Il introduit la notion de « dégradation des espèces », les espèces les plus nobles, sauf l'homme, pouvant subir des altérations au fil du temps[7].
Jean-Baptiste de Lamarck reprend la notion de dégradation en l'inversant : des espèces plus complexes émergent en fonction des changements d'environnement, selon un processus évolutif[10]. Il publie ses théories « positives » de l'évolution des espèces en 1802, dans Système des animaux puis dans Philosophie zoologique, en 1809. Il introduit les notions d'antériorité, de descendance, de généalogie des espèces et de transformisme[10].
Darwin

Le 1er juillet 1858, sont présentés à la Société linnéenne de Londres, un essai de Alfred Russel Wallace, « On the Tendency of Species to form Varieties », ainsi qu'un essai de Charles Darwin[11]. Ces deux essais présentent la théorie de l'évolution par la sélection naturelle[12].
En 1859, Darwin publie son livre, L'Origine des espèces, dans lequel il explique le mécanisme présidant à l'évolution graduelle des espèces vivantes dans la nature. Sa théorie propose que seuls les individus les mieux adaptés aux difficultés survivent et se reproduisent. C'est la sélection naturelle[12]. Le livre de Darwin n'aborde pas la question de l'évolution humaine, mais l'idée de la filiation entre les humains et les anciens singes est devenue évidente[12].
Wallace pense que seule la sélection naturelle préside à la transformation des espèces. Pour Darwin toutefois, elle ne peut tout expliquer. Il complète sa théorie avec celle de la sélection sexuelle quand il publie La Filiation de l'homme et la sélection liée au sexe, en 1871[13],[12]. Il y considère que les singes sont les animaux les plus proches de l'homme et conjecture que les origines de la lignée humaine se trouvent en Afrique[14],[15].
Toutefois, l'idée qu'une espèce d'homme distincte de la nôtre ait existé par le passé et ait disparu fut particulièrement difficile à admettre.
Les premiers débats sur la nature de l'évolution humaine ont surgi entre Thomas Henry Huxley et Richard Owen, en particulier, lors du Débat sur l'hippocampe. Huxley argumente pour l'évolution humaine à partir de singes, et aboutit à la déduction que les « différences entre les races humaines les plus élevées et les plus frustes sont du même ordre de grandeur que celles qui séparent le cerveau humain du cerveau simien »[16]. Il reprend ses conclusions dans son livre, publié en 1863, La Place de l'homme dans la nature.
Premiers fossiles

Un problème majeur à cette époque est le manque de fossiles humains. La plus ancienne découverte de restes fossiles est la Dame rouge de Paviland en 1823[17], identifiée lors de sa découverte à une femme de l'époque romaine[a].
En 1830, Philippe-Charles Schmerling exhume les restes de trois individus dans les Grottes Schmerling à Engis (Belgique). S'ils attirent l'attention de Charles Lyell, celui-ci n'est pas convaincu de leur ancienneté[17]. D'autres fossiles sont découverts dans la carrière de Forbes à Gibraltar en 1848[17], mais sont assimilés à des restes d'une créature souffrant de maladie[18]. Tous ces fossiles sont identifiés ultérieurement à des néandertaliens.
En 1856, des ossements humains sont découverts dans une carrière de calcaire de la vallée de Néander, près de Düsseldorf (Allemagne), trois ans avant la publication de l’Origine des espèces. Identifiés par Johann Carl Fuhlrott comme des ossements anciens et primitifs, ils font l'objet d'une vaste polémique, l'idée que d'autres types d'hommes aient pu exister n'étant pas admise[17].
La découverte d'une mandibule dans la Grotte de Naulette (Belgique) en 1866, fournit la preuve de l'existence d'autres espèces d'hommes. L'étude comparée de Paul Broca lui permet d'affirmer que cette mandibule « fournit un argument anatomique aux darwinistes. C'est le premier anneau d'une chaîne qui s'étend de l'homme aux singes »[17].
La présentation à la société d’archéologie de Namur de la découverte de fossiles humains en 1886, à la grotte de Spy (Belgique), a un grand retentissement dans la presse du monde entier. Cette découverte est en effet une preuve pour confirmer l'existence et l'ancienneté d'un type humain de morphologie différente de celle de l'homme actuel.
Le premier squelette de Néandertalien mis au jour en France est « le vieillard » de La Chapelle-aux-Saints en 1908[19]. Découvert par Amédée, Jean et Paul Bouyssonie, le corps repose dans une sépulture[19]. Marcellin Boule accentue les traits simiesques des néandertaliens, les décrivant comme une sorte d'homme des cavernes sauvage et brutal, se déplaçant en traînant les pieds et n'arrivant pas à marcher redressé[17].
Le chaînon manquant

À partir des années 1860, Huxley, Broca et Ernst Haeckel modélisent les principes de l'évolution du singe à l'homme. Nommé anthropopithèque par Gabriel de Mortillet (en reprenant le genre Anthropopithecus établi en 1839 par De Blainville[20]) et Pithécanthrope par Haeckel (Pithecanthropus 1868[20]), la recherche du « chaînon manquant », forme hybride entre l'homme moderne et les grands singes, commence[21].
Pour Haeckel, le gibbon est le singe le plus proche de l'homme. Pour lui, le chainon manquant est une forme intermédiaire entre les deux[21].
Premières découvertes hors d'Europe
Eugène Dubois décrit des fossiles découverts en 1891 à Trinil au bord du fleuve Solo (12 km à l'ouest de Ngawi, en Java oriental) qu'il nomme d'abord (en 1892-1893) Anthropopithecus javanensis : le singe-homme de Java. La découverte d'un fémur, démontrant que l'être devait se tenir debout et marcher, l'incite à considérer qu'il s'agissait du « chainon manquant » entre le singe et l'homme. Il le rebaptise (en 1893-1894) Pithecanthropus erectus, l'homme-singe debout[21].
Dans les années 1920, on découvre ce que l'on croit être au départ les premiers néandertaliens connus hors d'Europe :
- 1921 : l'Homme de Kabwe (Homo rhodesiensis), en Zambie
- 1925 : l'Homme de Galilée (Homo heidelbergensis ou Homo rhodesiensis), en Israël

En 1925, Raymond Dart, anthropologue de l'université de Witwatersrand, chercheur convaincu par la lecture de Darwin de l'unique berceau africain de l'espèce humaine, décrit son « chainon manquant » dans la revue Nature, l’Australopithecus africanus[22]. Le spécimen type ainsi décrit est l'enfant de Taung, un crâne et un endocrâne (en) bien conservés d'un individu juvénile, découverts en 1924 dans une carrière de la Northern Lime Company à Taung, près de Kimberley en Afrique du Sud. Bien que le cerveau soit petit (410 cm3), sa forme arrondie, contrairement à celui des chimpanzés et des gorilles, possède une organisation comparable à celle d'un cerveau humain moderne. En outre, le trou occipital, au centre du crâne et orienté vers le bas, atteste d'une locomotion bipède[23]. Tous ces traits ont convaincu Dart que l'enfant de Taung était « une race éteinte de singes, intermédiaires entre les anthropoïdes actuels et l'homme »[24],[25].
La fraude de Piltdown
En février 1912, Charles Dawson informe Arthur Smith Woodward, président de la Société de géologie de Londres et conservateur du département d'histoire naturelle au Muséum d'histoire naturelle de Grande-Bretagne, qu'il avait trouvé, entre 1908 et 1911, des fragments d'ossements et des outils. Le crâne, mi-homme, mi singe, correspond au chaînon manquant idéal qu'attendent les anthropologues[26].
Toutefois, cet Homme de Piltdown se révèle être une supercherie composée d'un crâne d'homme et d'une mandibule d'orang-outan. Cette supercherie est définitivement établie en 1953 grâce à des analyses physico-chimiques[26].
Les auteurs de la fraude n'ont jamais été découverts, mais seul un spécialiste en paléontologie pouvait donner aux os une patine comparable à celle des autres fossiles trouvés sur le même site[26].
Cap vers l'Asie
Découverte de fossiles d'Homo erectus à Zhoukoudian (Chine, 1921-1937), Ngandong (Java, 1931-1933), et Sangiran (Java, 1936-1941).
Afrique du Sud
Découverte de 1937 à 1949 de plusieurs sites karstiques au Gauteng, en Afrique du Sud, ayant livré des fossiles d'Australopithecus africanus (2,5 à 2,3 Ma) et de Paranthropus robustus (2 à 1,5 Ma). Après le genre Australopithèque en 1925, c'est le genre Paranthrope qui est créé par Robert Broom en 1938.
La ruée vers l'os (Afrique de l'Est)

| 1850 | 
|
| 1900 | 
|
| 1950 | 
|
| 2002 | 
|
Des années 1960 aux années 1980, des centaines de fossiles ont été trouvés en Afrique orientale, dans les régions des gorges d'Olduvai (Tanzanie), du lac Turkana (Kenya), et de la vallée de l'Awash (Éthiopie).
Les membres de la famille Leakey, Louis Leakey et son épouse Mary Leakey, et plus tard leur fils Richard et leur belle-fille Meave ont été parmi les plus actifs paléoanthropologues dans les recherches en Afrique orientale. Après plus de trente ans à fouiller et à découvrir des milliers d'outils préhistoriques, Mary et Louis découvrent, le 17 juillet 1959, leur « dear boy », appelé également Mister Zinj, un représentant de l'espèce Paranthropus boisei. Appliquant une technique de datation absolue, nouvelle pour l'époque, ils repoussent à 1,8 million d'années la naissance de la lignée humaine, estimée jusqu'alors à quelques centaines de milliers d'années[27]. Homo habilis est découvert l'année suivante, en 1960, et publié en 1964.
Dans les années 1970, l'Éthiopie apparait comme le lieu phare de la paléoanthropologie avec la découverte de Lucy, le 30 novembre 1974. C'est un fossile complet à 40 % de l'espèce Australopithecus afarensis, démontrant que l’acquisition de la marche bipède date d'au moins 3,2 millions d’années[28].
En 1976, Mary Leakey fouille la région de Laetoli en Tanzanie, qui livre des empreintes de pas d'hominines bipèdes, datées de 3,7 millions d'années, exceptionnellement conservées dans de la cendre volcanique indurée[29].
En 1984, Kamoya Kimeu, membre de l'équipe de Richard Leakey, découvre à l'ouest du lac Turkana, au Kenya, le squelette exceptionnellement complet du garçon de Turkana, daté de 1,55 million d'années, représentant juvénile de l'espèce Homo ergaster. Le squelette post-crânien apparait très proche de celui de l'Homme moderne, contrairement aux espèces précédentes Homo habilis et Homo rudolfensis. Le crâne conserve en revanche des caractères archaïques.
Ces découvertes et bien d'autres ont permis d'affirmer le rôle de l'Afrique comme berceau du genre Homo.
Les diagrammes ci-contre montrent l'augmentation du nombre d'espèces connues d'Hominina depuis 1850. Chaque rectangle représente la fourchette de dates et de volumes crâniens estimés pour chaque espèce connue à la date considérée. Le rythme de découverte de nouveaux taxons continue de s'accélérer au XXIe siècle.
East Side Story
La découverte de ces nombreux fossiles permet d'appuyer la théorie d'une origine est-africaine de la lignée humaine. Yves Coppens propose en 1982 le modèle de l'East Side Story lors d'une réunion scientifique organisée par l'Académie pontificale des sciences de Rome[30]. La formation de la vallée du grand rift, depuis plus de 20 millions d'années, aurait fini par créer une différenciation climatique et environnementale entre l'Afrique de l'Est et le reste du continent. La savane à l'est du grand Rift aurait favorisé la naissance de la bipédie. À partir d'une souche commune, la lignée des hominines s'est séparée de celle des chimpanzés il y a plus de 7 millions d'années, les hominines se développant à l'Est et les pré-chimpanzés à l'Ouest.
Toutefois, la locomotion encore partiellement arboricole des Australopithèques, ainsi que les découvertes au Tchad d’Australopithecus bahrelghazali en 1995 et de Sahelanthropus tchadensis en 2001 ont fragilisé ce modèle[31]. De plus, les découvertes d’Ardipithecus ramidus en 1994 et d’Orrorin tugenensis en 2000 suggèrent que la bipédie a pu naitre dans des environnements boisés au sein de paysages mosaïques, et pas nécessairement dans des paysages de savanes[32].
La première révolution génétique
L'étude de l'évolution humaine connait une révolution quand Vincent Sarich (en) et Allan Wilson comparent les réactions immunologiques de l'albumine sérique des humains à celles de singes africains (chimpanzés et gorilles)[33]. En 1967 dans un article fondamental publié par la revue Science, grâce à la biologie moléculaire, ils montrent que la lignée humaine et celle des grands singes se sont séparées il y a quatre à cinq millions d'années[33] et que le matériel génétique de ces deux lignées ne diffère pas de plus de 2 %[34].
Les progrès du séquençage de l'ADN, notamment du génome mitochondrial (ADNmt) et de l'ADN du chromosome Y (en) (Y-ADN), ont éclairé la compréhension des origines de l'homme[35],[36],[37].
L'anthropologie moléculaire permet de définir les parentés entre espèces modernes. Ainsi, l'orang-outan est le dernier représentant d'un groupe de grands singes asiatiques, tandis que le gorille, le chimpanzé et l'Homme appartiennent au groupe des grands singes africains[38]. Les assertions de Linné, Darwin et Huxley s'en trouvent confirmées : les singes sont les animaux les plus proches de l'homme et les origines de la lignée humaine se trouvent en Afrique[38].
« L'hypothèse de l'horloge moléculaire », basée sur la fréquence des mutations passées, a révolutionné l'étude de l'évolution moléculaire. La vitesse de l'horloge moléculaire est cependant inconnue ; son calibrage repose sur les découvertes de fossiles. Un premier calendrier de l'évolution des primates basé sur les modèles de biologie moléculaire a été publié en 1967[39], d'autres l'ont été en 2012, surtout concernant Homo sapiens. Ainsi, le plus faible taux de mutation proposé met l'ancêtre commun de l'homme et de l'orang-outan à 40 millions d'années[40],[41],[42].
Une évolution linéaire
Jusqu'au début des années 1990, l'état de la recherche permettait de penser que l'arbre évolutif des genres Australopithèque et Homo était linéaire et que les espèces se succédaient dans un processus continu et régulier, chaque espèce étant l'ancêtre de l'autre. Cette hypothèse a connu son apogée dans le dernier quart du XXe siècle, époque de forte influence de la Théorie synthétique de l'évolution dans différentes disciplines de la paléoanthropologie. La théorie de l'espèce unique envisageait également qu'à une époque donnée ne pouvait exister qu'une seule espèce d'Hominine, puis d'Homo. L'arbre évolutif de l'Homme était alors perçu comme « un gros tronc avec très peu de branches ».
Dans ce cadre, les recherches sur les origines de l'Homme moderne ont conduit certains chercheurs dans les années 1980 et 1990 à considérer l'Homme de Néandertal comme une variété d'Homo sapiens, tant sur le plan de son anatomie que de son comportement (Homo sapiens neanderthalensis)[43].

La quête du premier hominine
Dans les années 1990, plusieurs équipes de paléoanthropologues ont travaillé en Afrique à la recherche du point de divergence entre la lignée des hominines et celle des chimpanzés.
En 1992, Timothy White, Gen Suwa et Berhane Asfaw découvrent à Aramis, en Éthiopie, l’Ardipithecus ramidus (publié en 1994)[44],[45], daté de 4,4 millions d'années[46]. En 1994, Meave Leakey et Alan Walker découvrent l’Australopithecus anamensis (publié en 1995), daté de 3,9 à 4,2 millions d'années[47].
En 1997, Yohannes Haile-Selassie découvre dans la vallée de l'Awash, en Éthiopie, les fossiles de l'Ardipithecus kadabba, datés de 5,5 à 5,8 millions d'années. Très fragmentaires, ils ne sont publiés qu'en 2004 par Yohannes Haile-Selassie et Timothy White[48].
En 2000, Martin Pickford et Brigitte Senut découvrent dans les collines de Tugen, au Kenya, un fossile âgé de près de 6 millions d'années, Orrorin tugenensis, dont ils montrent la bipédie et qu'ils attribuent aux hominines (publié en 2001)[49].
En 2001, la Mission paléoanthropologique franco-tchadienne, dirigée par Michel Brunet, découvre au Tchad un fossile daté de 7 millions d'années (publié en 2002). Baptisé Sahelanthropus tchadensis, et surnommé Toumaï, le crâne présente les caractères faciaux et dentaires généralement associés aux hominines, et un trou occipital relativement avancé comme on en trouve chez des espèces bipèdes. Quelques scientifiques, comme Brigitte Senut et Martin Pickford, soulignent que la bipédie de Toumaï ne parait pas certaine[50],[51].
Les fluctuations climatiques faisaient périodiquement varier l'environnement est-africain et laissaient des mosaïques de paysages (rivières, lacs, marécages, zones boisées, ilots forestiers, savane arborée, prairies herbeuses et zones désertique) dans lesquels sont apparus nombre d'hominines bipèdes[52]. Cette diversité de formes « rappelle une règle trop souvent oubliée dans l'évolution des lignées : les grandes adaptations ne sont pas apparues en une seule fois et, chez des lignées proches, se font en mosaïque », avec des cas d'homoplasies (convergences, parallélismes)[53].
La seconde révolution génétique
En 2010, on commence à publier des éléments du patrimoine génétique néandertalien[54]. Pour mieux comprendre la période préhistorique récente, les généticiens recherchent aussi les restes de groupes de gènes (haplotypes) néandertaliens persistant dans le génome humain moderne[55],[56]. Ils en ont notamment détecté un peu plus chez les Eurasiens de l'Est[57],[58]. Ils recherchent aussi des groupes de gènes provenant d'hybridations entre Néandertaliens et Sapiens pré-modernes[59],[60] ou Dénisoviens[61],[62]).
En 2016 ont été publiés les premiers résultats d'une étude internationale fondée sur une nouvelle méthode de recherche de l'ADN hérité de plusieurs ancêtres humains archaïques. Cette méthode a été appliquée à des séquences du génome entier de 1523 personnes d'origine géographique diversifiée, incluant 35 nouveaux génomes identifiés dans les Îles mélanésiennes. Les auteurs de cette étude estiment avoir retrouvé 1,34 Gb de gènes d'origine néandertalienne et 303 Mb de gènes provenant de l'Homme de Denisova. Ils concluent de la cartographie de ces séquences « archaïques » que des populations néandertaliennes se sont sexuellement mélangées à celles de nos ancêtres directs, à plusieurs reprises et dans plusieurs populations non-africaines. On avait déjà trouvé des similarités entre génome contemporain et néandertalien[63], mais c'est la première fois qu'on trouve des gènes provenant a priori de l'Homme de Dénisova[64].
Un travail de caractérisation des régions génomiques contenant le plus ou le moins de séquences archaïques est en cours, qui permettra éventuellement de détecter les signatures d'introgressions adaptatives[65].
Un arbre buissonnant

Jusqu'à la fin du XXe siècle, l'arbre phylogénétique de la lignée humaine était souvent présenté de manière plus ou moins linéaire, avec un groupe préhumain précédant l'émergence du genre Homo. L’enrichissement du registre fossile et l'amélioration des techniques de datation ont remis en cause ce schéma[66]. Depuis les années 1980, les découvertes de fossiles se sont multipliées en Afrique et dans tout l'Ancien Monde, et, avec elles, le nombre d'espèces de la sous-tribu des hominines et du genre Homo. Du même coup, l'histoire évolutive de la lignée humaine est passée d'un schéma linéaire à un arbre buissonnant, et des espèces que nous pensions être nos ancêtres il y a encore peu sont devenues nos défunts cousins.
Les recherches récentes, par exemple celles menées par Lee Rogers Berger à l'université du Witwatersrand dans le Transvaal, sont bien plus compatibles avec une modélisation de structures buissonnantes et interpénétrées ou encore de rivières méandreuses dans une large vallée.
Chaque mise au jour de fossiles anciens, qu'ils appartiennent au genre homo ou australopithèque, accroit fortement le nombre d'informations anatomiques, techniques ou culturelles susceptibles d'être incompatibles avec le modèle linéaire des années 1970 et 1980.
Étapes de l'évolution humaine
Classification phylogénétique
La classification phylogénétique permet de classer les différentes familles de singes et les différents genres actuels d'hominidés selon des relations de parenté plus ou moins proche.
Phylogénie des familles de singes, d'après Perelman et al. (2011)[67] et Springer et al. (2012)[68] :
| Simiiformes |
| ||||||||||||||||||||||||||||||

Phylogénie des genres actuels d'hominidés, d'après Shoshani et al. (1996)[69] et Springer et al. (2012)[70] :
| Hominidae |
| ||||||||||||||||||
Apparition des primates
Les mammifères subissent une radiation évolutive dès le début du Cénozoïque : de nombreuses espèces différentes apparaissent et occupent des milieux variés. Des mammifères arboricoles apparaissent, les primates. Parmi eux, un grand nombre sont frugivores, ce qui favorise la vision en couleur, pour le repérage des fruits mûrs[b].
Les études génétiques montrent que les primates ont divergé des autres mammifères il y a 85 millions d'années environ, au Crétacé supérieur. Leurs premiers fossiles apparaissent au Paléocène, il y a environ 55 Ma[71].
L'histoire évolutive des primates peut être retracée depuis 65 millions d'années[72], à partir de l'extinction massive du Crétacé-Paléogène qui voit la disparition de nombreuses espèces dont les dinosaures non-aviens, et la multiplication lors du Paléocène de petits mammifères archaïques parmi lesquels se trouvent les premiers primates[73].
La plus ancienne espèce de primates[74] connue est le Plesiadapis, vivant dans le nord de l'Amérique, mais étant également très répandu en Europe et en Afrique pendant la période tropicale du Paléocène et de l'Éocène.
Lors de l'Éocène, les primates ont colonisé des espaces qui correspondant à l'Europe, l'Amérique du Nord, l'Asie et l'Afrique[73]. Toutefois, les changements climatiques liés à la Grande coupure Éocène-Oligocène entraînent la disparition de la majorité des primates de l'hémisphère Nord et des latitudes hors de la bande des tropiques[73].
Apparition des singes

En Afrique dans la zone des tropiques, apparaissent les premiers singes ou Simiiformes modernes comme Oligopithecus (en), le plus ancien d'entre eux, ou comme Aegyptopithecus zeuxis[73], retrouvé dans l'Oasis du Fayoum, qui est celui pour lequel on a le plus "d'informations". Vivant au début de l'oligocène, il y a 35 millions d'années, ils occupent toutes les niches écologiques des arbres et vivent en groupes sociaux se nourrissant de feuilles, de fruits et d'insectes[73].
Parmi eux, les singes (simiens) puis les grands singes se seraient diversifiés, ces derniers n'ayant pas de queue préhensile.
Après une période de 10 millions d'années qui n'a livré que peu de documentation, les vestiges datant du miocène vers 20 millions d'années, montrent que le micro-ordre des Catarrhini regroupe les deux familles des cercopithécoïdes ou singes à queue, attestés par 2 espèces et celle des hominoïdes avec plus de 20 espèces[75].
Hominoïdes
Apparus à la fin de l'Oligocène, il y a environ 25 millions d'années, les hominoïdes ou singes sans queue, se sont fortement diversifiés en Afrique. On trouve au Miocène inférieur des espèces fossiles de petite taille, tel les Micropithecus pesant quelques kilogrammes, et des espèces plus imposantes pouvant peser jusqu'à cinquante kilogrammes. Leurs crânes et leurs dents robustes sont adaptés à une alimentation composée de feuilles, de fruits et d'insectes. Leur locomotion est essentiellement quadrupède, même si certains des plus grands individus commencent à se déplacer en se suspendant aux branches des arbres, tel le Morotopithecus[75].
Les Hominoidea se subdivisèrent en plusieurs familles, notamment :
- les Hylobatidae (gibbons), qui se répandirent en Asie du Sud-Est et qui pratiquent la brachiation
- les Hominidae
Hominidés
Les hominidés africains comprennent notamment Kenyapithecus vers 14 millions d'années, et Samburupithecus vers 9 millions d'années[75].
Vers 17 millions d'années, à la faveur de la collision des plaques africaine et arabique, et de l'optimum climatique du Miocène, qui vit l'extension vers le Nord des forêts tropicales et tempérées chaudes, les hominidés commencèrent à se disperser hors d'Afrique. Le Griphopithèque est un hominidé d'Europe, attesté à partir de 16 millions d'années. Un hominidé européen tardif, l'Oréopithèque, pratiquait en Toscane vers 8 millions d'années une bipédie différente de celle qui verra le jour un peu plus tard en Afrique.
Il y a environ 15 millions d'années, les Hominidae se subdivisèrent en deux familles principales :
Les ponginés se développèrent en Asie méridionale, de la Turquie jusqu'à la Chine. Le Sivapithèque, découvert en Inde et au Pakistan, est peut-être l'ancêtre du plus grand singe ayant jamais existé, le Gigantopithèque, qui vivait en Chine du Sud et au Vietnam. Ce dernier disparut vers la fin du Pléistocène, ne laissant subsister que les orang-outans en Asie du Sud-Est[75].
Homininés
En Europe, les Dryopithèques se déplaçaient toujours à quatre pattes, mais se suspendaient aussi aux arbres et occasionnellement se dressaient sur deux pieds. Cette lignée disparut vers 8 millions d'années[75].
Dans une zone regroupant l'Anatolie et les Balkans (Turquie, Grèce, Bulgarie) se développèrent des genres de grands singes, comme l'Ouranopithèque, qui disparurent vers 7 millions d'années[75].
Après avoir prospéré pendant quelque 8 millions d'années, les homininés européens[75] ont disparu peu à peu à la suite du refroidissement et de l'assèchement climatiques de la fin du Miocène entrainant le recul des forêts.
Deux genres d'Homininae sont connus en Afrique de l'Est, Nakalipithecus et Chororapithecus, attestés entre 8 et 10 millions d'années. Le lien éventuel avec les homininés européens n'est pas connu.
Hominines
La lignée humaine regroupe le genre Homo et tous les genres fossiles ayant une parenté plus proche avec les humains qu'avec les chimpanzés, espèce actuelle la plus proche de l'Homme.

Au Miocène, entre 9 et 7 millions d'années, se produisuit la séparation entre la sous-tribu des Panina (lignée des chimpanzés) et la sous-tribu des Hominina (lignée humaine). Toutefois cette période a livré peu de fossiles et le statut de pré-humain ou de pré-chimpanzé est difficile à départager.
Sahelanthropus tchadensis, daté de 7 millions d'années, a été découvert au Tchad en 2001. Le crâne fossile présente les caractères faciaux et dentaires généralement associés aux hominines et le trou occipital avancé propre aux espèces bipèdes. Cette espèce est admise par la majeure partie de la communauté scientifique comme le plus ancien représentant connu des hominines.
Le genre Australopithèque apparait en Afrique il y a environ 4,2 millions d'années. Il forme de nombreuses espèces en Afrique orientale et australe jusqu'au début du Pléistocène. Huit espèces d'australopithèques ont déjà été décrites à ce jour. Ce genre semble céder ensuite la place aux Paranthropes, dont trois espèces sont connues, mais qui s'éteignent en Afrique avant 1 million d'années.
L'arbre de descendance jusqu'aux espèces récentes n'étant pas fixé à ce jour parmi les spécialistes, il est d'usage de présenter les différentes espèces fossiles connues sous la forme d'un tableau chronologique sans lien entre les espèces, tel que le tableau suivant :

Émergence du genre Homo
Le plus ancien représentant décrit du genre Homo, Homo rudolfensis, semble apparaitre en Afrique vers 2,5 Ma, alors que des changements climatiques importants ont lieu : la formation de la calotte glaciaire arctique entraine une sécheresse en Afrique, ce qui provoque le recul des forêts.
Le genre Homo se définit par une capacité crânienne plus forte (supérieure à 550 cm3) que celle des australopithèques, une réduction de l'appareil masticateur et du prognathisme, une réduction de la denture, une descente progressive du larynx, et une bipédie quasi exclusive.
D'après ses membres supérieurs, Homo habilis était encore partiellement adapté à la vie arboricole. Cependant, les empreintes visibles sur les os de sa boite crânienne prouvent qu'il existait déjà une asymétrie entre les cerveaux droit et gauche, ce qui suggère une plus grande capacité cognitive que chez les Australopithèques. Il est réputé être l'auteur de certains des premiers galets taillés découverts en Afrique de l'Est (industrie oldowayenne). Il disparait d'Afrique vers 1,4 Ma.
Homo rudolfensis était plus corpulent avec un plus gros cerveau et des mâchoires plus puissantes, peut-être liées à un régime alimentaire plus végétarien qu'Homo habilis. On n'en connait pas de fossiles postérieurs à 1,8 Ma.
Contemporain des Homo habilis et des Paranthropes, Homo ergaster apparait dès 1,95 Ma et possède des caractéristiques qui le rapprochent de l'Homme moderne : taille plus élevée, bipédie exclusive, plus forte capacité crânienne (supérieure à 750 cm3). Ses outils sont plus sophistiqués : bifaces, hachereaux, bolas, etc. (industrie acheuléenne).
Sa bonne adaptation à la marche bipède et à la course lui permet de parcourir de grandes distances à la poursuite de ses proies. Aidé de ses nouvelles armes et outils, il adopte un régime alimentaire contenant plus de viande obtenue par la chasse. Il va progressivement occuper une partie de l'ancien monde (Asie et Europe), dès 1,5 Ma, probablement par simple expansion démographique. Enfin, il est peut-être doté d'un premier langage articulé (qui serait déjà esquissé chez Homo habilis).
Formes humaines archaïques
Homo antecessor est attesté en Espagne vers 850 000 ans avant le présent. C'est la première espèce humaine identifiée en Europe. Peut-être descend-elle d'une population d'Homo ergaster sortie d'Afrique il y a plus d'un million d'années.
Homo heidelbergensis apparait en Europe à partir de 700 000 ans, doté de l'industrie acheuléenne. Il est peut-être l'ancêtre de l'Homme de Néandertal, dont les plus anciens représentants connus sont les fossiles de la Sima de los Huesos, en Espagne, datés de 430 000 ans. L'Homme de Néandertal est robuste, lourd et trapu, ce qui lui permet de mieux résister au froid des cycles glaciaires successifs.
En Asie, Homo erectus est connu à Java à partir de 1,2 Ma, et en Chine à partir de 1 Ma. Il descend peut-être d'une population d'Homo ergaster sortie d'Afrique dans la première moitié du Calabrien. Homo erectus a un squelette robuste, avec une capacité crânienne de 900 à 1 200 cm3 et une face réduite. Il produit une industrie lithique qui ne semble pas se démarquer du type oldowayen. La date d'extinction d'Homo erectus n'est pas vraiment éclaircie à ce jour, différentes études ayant livré des résultats fragiles et divergents sur les fossiles les plus tardifs actuellement connus, ceux de l'Homme de Solo, à Java.
L'Homme de Florès n'est attesté qu'à Florès, où il serait arrivé il y a au moins 800 000 ans, franchissant nécessairement un bras de mer depuis une terre proche. Ses derniers fossiles connus auraient environ 60 000 ans.
Origines de l'homme moderne
Homo rhodesiensis est connu en Afrique à partir de 700 000 ans. Il est peut-être l'ancêtre d'Homo sapiens, dont les plus anciens fossiles connus sont ceux de Djebel Irhoud, au Maroc, datés en 2017 de 300 000 ans[76]. Ces fossiles augmentent de plus de 100 000 ans l'ancienneté de l'espèce Homo sapiens, précédemment fondée sur deux crânes datés en 2005 de 195 000 ans ans, Omo 1 et Omo 2, trouvés en 1967 en Éthiopie.
Les plus anciens restes d'Homo sapiens connus hors d'Afrique ont été découverts en 2002 dans la grotte de Misliya, sur le mont Carmel, en Israël, et ont été datés en 2018 de 185 000 ans[77].
À partir d'au moins 120 000 ans, Homo neanderthalensis et Homo sapiens ont alterné au Proche-Orient, probablement en fonction des variations climatiques de la dernière période glaciaire. Homo sapiens arrive il y a environ 45 000 ans en Europe, où l'Homme de Néandertal s'éteint vers 30 000 ans, après plusieurs milliers d'années de cohabitation.
Changements anatomiques
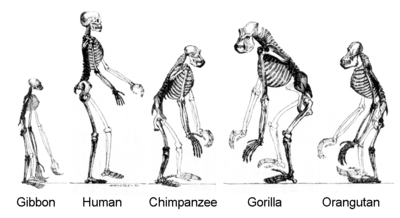
L'évolution humaine est caractérisée par un certain nombre de changements morphologiques, de développements physiologiques et comportementaux qui ont eu lieu depuis la scission entre le dernier ancêtre commun des humains et des chimpanzés.
Les plus importantes de ces adaptations sont la bipédie, l'augmentation de la taille du cerveau, l'ontogenèse allongée (gestation et petite enfance) et une diminution du dimorphisme sexuel. La relation entre ces changements fait l'objet de débats[78]. Les autres changements morphologiques importants comprennent la précision et la puissance de la préhension, changement survenu dès le premier Homo erectus[79].
Bipédie
La bipédie est l'adaptation première de la ligne d'Hominini. Le premier hominidé bipède semble être soit Sahelanthropus tchadensis[80], soit Orrorin tugenensis, vivant tous les deux il y a 6 ou 7 millions d'années. Le gorille et le chimpanzé, qui ne sont pas bipèdes, ont divergé de la lignée des Hominini à la même période, il est donc possible que Sahelanthropus ou Orrorin soient plutôt le dernier ancêtre commun entre les chimpanzés et les humains. Les premiers bipèdes se sont développés dans le genre Australopithecus et ultérieurement dans le genre Homo.
Il existe plusieurs théories concernant les avantages de la bipédie. Il est possible qu'elle a été favorisée car elle libère les mains pour atteindre et transporter la nourriture[81]. Elle permet la course de longue distance et la chasse, le champ de vision étant amélioré. Elle peut éviter l'hyperthermie en réduisant la surface exposée au soleil direct. Toutes ces théories se basent principalement sur une adaptation à un nouvel environnement de type prairie ou savane plutôt que le type de forêt précédent[36],[82]. Une nouvelle étude émet l'hypothèse que marcher sur deux jambes dépense moins d'énergie que la marche quadrupède[83],[84]
Anatomiquement, l'évolution vers la bipédie est la principale cause d'une série de changements du squelette partagée par tous les hominidés bipèdes, non seulement pour les jambes et le bassin, mais aussi pour la colonne vertébrale, les pieds, les chevilles et le crâne[85].
La bipédie entraine des changements dans le pied, la cheville, la jambe et l’articulation au bassin (pelvis). Le pied perd sa capacité préhensile, le gros orteil s’aligne avec les autres doigts, ce qui le conduit à supporter le poids du corps pendant la marche et aide à la locomotion. Les articulations de la cheville et du genou se renforcent pour supporter à présent en permanence tout le poids du corps. Le fémur prend une position légèrement plus angulaire, ce qui entraîne un déhanchement plus fluide lors de la marche et ramène les articulations du genou et de la cheville sous le centre de gravité du corps.
Plus haut, la bipédie et la station verticale entraînent également des changements tout au long de la colonne vertébrale. Avec la station verticale, les hommes acquièrent des fesses : en effet, le grand glutéal se développe et devient le plus puissant des muscles humains, permettant de maintenir en permanence le torse en position verticale et de garder un centre de gravité stable pendant la marche et la course. Conséquence de ce redressement du buste et de la tête, la colonne vertébrale acquiert deux courbures secondaires (concavité vers l'arrière), au niveau des vertèbres cervicales et des vertèbres lombaires. Les vertèbres lombaires, qui supportent à présent tout le poids du haut du corps, deviennent plus courtes et plus larges. L’attache du crâne se déplace, le trou occipital se positionnant sous le crâne, permettant une position horizontale de la tête[86].
Les changements les plus importants interviennent dans la ceinture pelvienne, qui assure l’articulation entre la colonne vertébrale et les membres inférieurs. Chez le grand singe, les os iliaques sont longs et dirigés vers le bas. Avec la station verticale, le bassin supérieur devient plus large et évasé, sa plus grande surface fournit la meilleure attache à présent nécessaire au grand glutéal. Le bassin ne s’évase cependant que dans sa partie supérieure ; l’articulation de la hanche devant au contraire rester sur un plan vertical, pour conserver une amplitude suffisante aux mouvements du fémur et ne pas gêner le mouvement de marche normal[81]. Entre ces deux régions apparaît une ligne arquée, marquant la transition entre la partie supérieure du bassin, en forme de coupe, et le « petit bassin » plus cylindrique.
Le petit bassin devient soumis à des exigences contradictoires : pour faciliter la marche, il doit être le plus étroit possible, afin de mettre l’articulation des fémurs à l’aplomb du centre de gravité du corps ; mais il doit en même temps rester suffisamment large pour permettre le passage du fœtus pendant l’accouchement. Ces contraintes ont eu des effets significatifs sur le processus de mise au monde, qui est beaucoup plus difficile chez l'homme moderne que chez les autres primates. Le petit diamètre du canal de naissance devient un obstacle à l’augmentation régulière de la taille du cerveau chez les premiers humains, provoquant un raccourcissement de la période de gestation, et une néoténie de l'homme donnant naissance à des enfants immatures[82]. Le petit bassin du mâle, qui n’est pas soumis à cette contrainte, prend une forme plus triangulaire et étroite que celui des femelles, plus arrondie. Les hanches plus larges donnent à la femelle une moins bonne adaptation à la marche et à la course de longue durée.
Les bras et avant-bras se raccourcissent par rapport aux jambes qui s’allongent, facilitant l'équilibre pendant la course à pied. La main n’est plus impliquée dans la locomotion et peut gagner en précision ce qu’elle va perdre en force.
Encéphalisation
L'espèce humaine a développé un cerveau beaucoup plus grand que celui des autres primates, généralement 1 330 cm3 chez les humains modernes, soit deux fois la taille de celui d'un chimpanzé ou d'un gorille[87]. Le modèle de l'encéphalisation commence avec Homo habilis qui, avec 600 cm3 environ, avait un cerveau légèrement plus grand que celui des chimpanzés. Elle continue avec l'Homo erectus (800 à 1 100 cm3), atteignant un maximum chez les Néandertaliens avec une taille moyenne de 1 200 à 1 900 cm3, plus grand encore que chez Homo sapiens.
L'encéphalisation a été mise en relation, selon l'hypothèse des tissus coûteux en énergie[c], avec une augmentation de la part de la viande dans l'alimentation[88],[89] ou avec le développement de la cuisson[90]. Mais l'augmentation de volume du cerveau pourrait être due à une mutation accidentelle chez un unique individu Homo erectus, le remplacement de la cytosine C par la guanine G à un certain endroit d'un gène : amputé de 55 nucléotides par rapport à sa version originale[d], ce gène ne code plus pour une protéine régulant la croissance de filaments d'actine dans les neurones, mais pour une autre qui stimule la division des neurones à partir des cellules progénitrices dans les ventricules[91],[92].
Le modèle de neurodéveloppement postnatal du cerveau humain diffère de celui des autres grands singes (Hétérochronie) et permet de longues périodes de l'apprentissage social et l'acquisition du langage chez les enfants humains. Toutefois, les différences entre les structures du cerveau humain et ceux d'autres singes peuvent être encore plus importantes que les différences de volume[93],[94],[95],[96].
L'augmentation du volume au fil du temps a affecté inégalement les zones du cerveau – les lobes temporaux, qui contiennent des centres de traitement du langage, ont augmenté de manière disproportionnée, de même que le cortex préfrontal qui est lié à la prise de décision et modèlise le comportement social complexe[87].
L'augmentation du volume du néocortex a également entraîné une augmentation de la taille du cervelet. Les grands singes, y compris les humains et ses ascendants, avaient un développement plus marqué du cervelet par rapport au néocortex que les autres primates.
Traditionnellement, le cervelet est associée à un paléocervelet, un archéocervelet ainsi qu'à un néocervelet. Sa fonction est généralement associée à l'équilibre, au contrôle de la motricité fine et, dans une moindre mesure, à la parole et la cognition. En raison de sa fonction de contrôle sensori-moteur et d'assistance à l'apprentissage des séquences d'actions musculaires complexes, le cervelet a peut-être favorisé l'évolution des adaptations technologiques de l'homme, y compris la préadaptation à la parole[97],[98],[99],[100].

- Grande capacité crânienne (entre 500 et 1 600 cm3). Par comparaison celle des chimpanzés est de l'ordre de 300 cm3 ;
- Croissance du crâne accentuée vers les côtés (légèrement) et le haut, redessinant la région occipitale de manière plus arrondie ;
- Aplatissement de la face et pas de prognathisme : l'angle facial augmente, le front devient plus haut, les bourrelet sus-orbitaires régressent et les arcades zygomatiques s'effacent ;
- le menton se dessine, la mandibule rétrécit et devient parabolique (en U et non en V).
Évolutions technique et sociale
Activités culturelles
- Production d'outils et maîtrise de la taille de la pierre, réalisation d'un outillage diversifié (bifaces, grattoirs...) ;
- Outils complexes, réutilisables, transmissibles avec industrialisation donc apprentissage et spécialisation, répartition des tâches ; [réf. nécessaire]
- Maîtrise du feu (Homo heidelbergensis ou Homo erectus) ;
- Rites funéraires (à partir de Homo neanderthalensis) ;
- Art (peintures, sculptures...) (à partir d'Homo sapiens) ;
- Langage articulé à base de phonèmes avec transferts de conceptualisation. [réf. nécessaire]
L'art préhistorique
Depuis les années 2000 et 2010, de nombreuses théories sur les origines de l'art préhistorique ont émergé et des découvertes sur la création artistique ancienne sur parois et dalles rocheuses ont eu lieu. Elles concernent notamment celles du continent australien où des parois des abris apparaissent quelques dix millénaires avant la grotte Chauvet[101], et en Afrique où les plus anciennes expressions artistiques pariétales apparaissent 50 000 ans avant les merveilles de la grotte ornée paléolithique française[102]. Il existe même, sur le continent africain, un art mobilier modeste, très sporadique depuis 75 000 ans[101].
Tableau récapitulatif de l'évolution humaine
Liste des fossiles d'hominines
Les nombreux fossiles d'hominines découverts à ce jour sur tous les continents sont listés dans l'article dédié :
.
Notes et références
Notes
- Il s'agit du squelette d'un homme datant de 33 000 ans.
- Les chiens ou les ruminants ont une perception des couleurs bien moindre que celle des primates.
- Selon cette hypothèse du tissu cher, les organes les plus coûteux en énergie chez les primates sont le cœur, le foie, les reins, l'estomac, l'intestin et le cerveau, ce dernier ne représentant chez l'homme que 2 % du poids du corps, mais est à lui seul responsable de 20 % de la dépense énergétique. Les trois premiers sont fortement contraints par la masse du corps, et donc l'ajustement de la dépense énergétique s'effectuerait par un compromis sur les deux derniers. Dans ce modèle, le coût du maintien de cerveaux volumineux est compensé par une augmentation de la qualité du régime alimentaire et une réduction correspondante de la taille du tractus intestinal. Cf (en) Aiello LC, Wheeler P. « The expensive-tissue hypothesis: the brain and the digestive-system in human and primate evolution », Curr Anthropol, 36, 1995, p.199-221.
- Le remplacement de C par G à cet endroit précis transforme un triplet CTA en GTA, lequel est interprété comme un signal de coupure : le reste du gène n'est pas transcrit dans l'ARN messager.
Références
- Dawkins 2004
- « Find Time of Divergence: Hominidae versus Hylobatidae », sur TimeTree (consulté le )
- Pallab Ghosh, « 'First human' discovered in Ethiopia », BBC News, London, BBC, (lire en ligne, consulté le )
- Thibault Panus, « Les outils précèdent l'homme », La Recherche hors-série dossier, no 17,
- Henry H. Q. Heng, « The genome-centric concept: resynthesis of evolutionary theory », BioEssays, Hoboken, NJ, John Wiley & Sons, vol. 31, no 5, , p. 512–525 (ISSN 0265-9247, PMID 19334004, DOI 10.1002/bies.200800182)
- American Heritage Dictionaries (editors) 2006
- Pascal Picq, [2005], p. 22-24
- Pascal Picq, Laurent Lemire, À la recherche de l'homme, Robert Laffont, , p. 33.
- Pascal Picq, [2005], p. 17-19
- Pascal Picq, [2005], p. 30-31
- Browne, p. 33-42
- Pascal Picq, [2005], p. 32-37
- Darwin 1871
- Pascal Picq, [2003]
- Pascal Picq, [2005], p. 48
- Rupke 2009, p. 195–196
- Pascal Picq, [2005], p. 50-52
- Montgomery 1988, p. 95–96
- L'homme de la Chapelle-aux-Saints, 1998
- Bernard Wood et alii, Wiley-Blackwell Encyclopedia of Human Evolution, June 2013 (single-volume paperback version of the original 2011 2-volume edition), 1056 pp.; (ISBN 978-1-1186-5099-8) (en)
- Pascal Picq, [2005], p. 53-55
- Raymond Dart, « Australopithecus africanus: The Man-Ape of South Africa », Nature, London, Nature Publishing Group, vol. 115, no 2884, , p. 195–199 (ISSN 0028-0836, DOI 10.1038/115195a0, lire en ligne [PDF], consulté le )
- Pascal Picq, [2005], p. 58-59
- Roger Lewin, Bones of Contention: Controversies in the Search for Human Origins, Chicago: The University of Chicago Press, (ISBN 0-226-47651-0), 1987
- Pascal Picq, [2005], p. 76-791
- Pascal Picq, [2005], p. 56-57
- Pascal Picq, [2005], p. 60-61
- Maurice Taieb, « L’Afrique, terre d’origine de l’humanité », Echosciences, janvier 2007 [lire en ligne]
- Academia Le Chemin de l' Humanité par René Puech
- Pascal Picq, [2005], p. 67-70
- Brunet, M. (1997), « Origine des hominidés : East Side Story... West Side Story... », Géobios, M.S. n ° 20, 79-83.
- Michel Brunet, Jean-Jacques Jaeger, « De l’origine des anthropoïdes à l’émergence de la famille humaine », Comptes Rendus Palevol, vol. 16, no 2, mars–avril 2017, p. 189-195 (DOI 10.1016/j.crpv.2016.04.007).
- V. M. Sarich et A. C. Wilson, « Immunological time scale for hominid evolution », Science, vol. 158, no 3805, , p. 1200–1203 (PMID 4964406, DOI 10.1126/science.158.3805.1200)
- (en) Sarich, V. M.; Wilson, A. C., « Immunological time scale for hominid evolution », Science, vol. 158, no 3805, , p. 1200–1203
- M'charek 2005, p. 96
- DeSalle et Tattersall 2008, p. 146
- Trent 2005, p. 6
- Pascal Picq, [2005], p. 65
- V. Sarich et A. Wilson, «Immunological Time Scale for Hominid Evolution», Science, vol. 158, 1967.
- Aylwyn Scally, Richard Durbin: Revising the human mutation rate: implications for understanding human evolution. In: Nature Reviews Genetics. Band 13, 2012, S. 745-753, doi:10.1038/nrg3295
- Studies slow the human DNA clock. In: Nature. Band 489, 2012, S. 343–344, doi:10.1038/489343a
- Kevin E. Langergraber et al.: Generation times in wild chimpanzees and gorillas suggest earlier divergence times in great ape and human evolution. In: PNAS. Band 109, Nr. 39, 2012, S. 15716–15721, doi:10.1073/pnas.1211740109
- Patrick Plumet, Peuples du Grand Nord. Des mythes à la Préhistoire, Errance, , p. 161.
- (en) Timothy White, Gen Suwa et Berhane Asfaw, « Australopithecus ramidus, a new species of early hominid from Aramis, Ethiopia », Nature (1994), 371, p. 306-312
- Timothy White, Gen Suwa et Berhane Asfaw, « Ardipithecus ramidus, a new species of early hominid from Aramis, Ethiopia », Nature (1995), 375, p. 88.
- Bernard A. Wood « The oldest hominid yet », Nature, (1994), 371, p. 280-1.
- (en) Warda C.V., « Morphology of Australopithecus anamensis from Kanapoi and Allia Bay, Kenya », Journal of Human Evolution, vol. 41, , p. 255–368 (DOI 10.1006/jhev.2001.0507, lire en ligne)
- Jamie Shreeve, « The Evolutionary Road », National Geographic, Washington, D.C., National Geographic Society, (ISSN 0027-9358, lire en ligne, consulté le )
- B. Senut, M. Pickford, D. Gommery, P. Mein, K. Cheboi et Y. Coppens, « First hominid from the Miocene (Lukeino Formation, Kenya) », Comptes Rendus de l'Académie de Sciences, vol. 332, p. 137-144, 2001.
- Wolpoff Milford H., Senut B., Pickford M. et Hawks J., 2002, Sahelanthropus or "Sahelpithecus" ? Nature, 419 (6907): 581-582.
- Cela-Conde C. J. et Ayala F. J., 2003. Genera of the human lineage. PNAS, 100 (13): 7684-7689.
- Michel Brunet, Jean-Jacques Jaeger, « De l’origine des anthropoïdes à l’émergence de la famille humaine », Comptes Rendus Palevol, vol. 16, no 2, , p. 189-195 (DOI 10.1016/j.crpv.2016.04.007).
- Pascal Picq, Premiers hommes, Flammarion, , p. 87.
- Richard Green, Johannes Krause, David Reich, Svante Pääbo et al. (2010) A draft sequence of the Neandertal genome, Science 328, p. 710–722, doi:10.1126/science.1188021
- N. Patterson, P. Moorjani, Y. Luo, S. Mallick, N. Rohland, Y. Zhan, T. Genschoreck, T. Webster, D. Reich (2012) Ancient admixture in human history, Genetics 192, p. 1065–1093, doi:10.1534/genetics.112.145037
- Kay Prüfer, Svante Pääbo et al. (2014) The complete genome sequence of a Neanderthal from the Altai Mountains, Nature 505, p. 43–49, doi:10.1038/nature12886
- J. D. Wall, M. A. Yang, F. Jay, S. K. Kim, E. Y. Durand, L. S. Stevison, C. Gignoux, A. Woerner, M. F. Hammer, M. Slatkin (2011-2013) Higher levels of Neanderthal ancestry in East Asians than in Europeans, Genetics 194, p. 199–209, doi:10.1534/genetics.112.148213
- P. Skoglund, M. Jakobsson (2011) Archaic human ancestry in East Asia, Proceedings of the National Academy of Sciences U.S.A. 108, p. 18301–18306, doi:10.1073/pnas.1108181108
- S. Sankararaman, N. Patterson, H. Li, S. Pääbo, D. Reich (2012) The date of interbreeding between Neandertals and modern humans, PLOS Genetics 8, e1002947, doi:10.1371/journal.pgen.1002947
- B. Vernot & J. M. Akey (2015) Complex history of admixture between modern humans and Neandertals, American Journal of Human Genetics 96, p. 448–453, doi:10.1016/j.ajhg.2015.01.006
- David Reich, Richard Green, Svante Pääbo et al. (2010) Genetic history of an archaic hominin group from Denisova Cave in Siberia, Nature 468, p. 1053–1060, doi:10.1038/nature09710
- Matthias Meyer, M. Kircher, Svante Pääbo et al. (2012) A high-coverage genome sequence from an archaic Denisovan individual, Science 338, p. 222–226,
- S. Vattathil, J. M. Akey (2015) Small amounts of archaic admixture provide big insights into human history, Cell 163, p. 281–284, doi:10.1016/j.cell.2015.09.042
- Voir schéma (Fig. 1C and fig. S3) de l'article déjà cité [1]
- Benjamin Vernot & al. (2016)) Excavating Neandertal and Denisovan DNA from the genomes of Melanesian individuals (résumé)
- Bernard Wood, « Le buissonnant rameau humain », Pour la Science, no 445, , p. 35.
- (en) P. Perelman, W. E. Johnson et al., « A molecular phylogeny of living primates », PLoS Genetics, vol. 7, no 3, , e1001342 (PMID 21436896, PMCID 3060065, DOI 10.1371/journal.pgen.1001342, lire en ligne).
- (en) Mark S. Springer, Robert W. Meredith et al., « Macroevolutionary Dynamics and Historical Biogeography of Primate Diversification Inferred from a Species Supermatrix », PLoS ONE, vol. 7, no 11, , e49521 (ISSN 1932-6203, PMID 23166696, PMCID 3500307, DOI 10.1371/journal.pone.0049521, lire en ligne).
- (en) J. Shoshani, C. P. Groves, E. L. Simons et G. F. Gunnell, « Primate phylogeny : morphological vs. molecular results », Molecular Phylogenetics and Evolution, vol. 5, no 1, , p. 102-54 (PMID 8673281, lire en ligne)
- (en) Mark S. Springer, Robert W. Meredith et al., « Macroevolutionary Dynamics and Historical Biogeography of Primate Diversification Inferred from a Species Supermatrix », PLoS ONE, vol. 7, no 11, , e49521 (ISSN 1932-6203, PMID 23166696, PMCID 3500307, DOI 10.1371/journal.pone.0049521, lire en ligne)
- Peter Tyson, « Meet Your Ancestors », NOVA scienceNOW, PBS; WGBH Educational Foundation, (consulté le )
- Maxwell 1984, p. 296
- Rui Zhang, Yin-Qiu Wang et Bing Su, « Molecular Evolution of a Primate-Specific microRNA Family », Molecular Biology and Evolution, Oxford, UK, Oxford University Press on behalf of the Society for Molecular Biology and Evolution, vol. 25, no 7, , p. 1493–1502 (ISSN 0737-4038, PMID 18417486, DOI 10.1093/molbev/msn094, lire en ligne [PDF], consulté le )
- Pamela R. Willoughby, « Palaeoanthropology and the Evolutionary Place of Humans in Nature », International Journal of Comparative Psychology, International Society for Comparative Psychology, vol. 18, no 1, , p. 60–91 (ISSN 0889-3667, lire en ligne, consulté le )
- Martin 2001, p. 12032–12038
- Simon Tavaré, Charles R. Marshall, Oliver Will, Christophe Soligo et Robert D. Martin, « Using the fossil record to estimate the age of the last common ancestor of extant primates », Nature, London, Nature Publishing Group, vol. 416, no 6882, , p. 726–729 (ISSN 0028-0836, PMID 11961552, DOI 10.1038/416726a)
- Pascal Picq, [2005], p. 81-86
- Kenneth D. Rose, « The earliest primates », Evolutionary Anthropology: Issues, News, and Reviews, Hoboken, NJ, John Wiley & Sons, vol. 3, no 5, , p. 159–173 (ISSN 1060-1538, DOI 10.1002/evan.1360030505)
- John Fleagle et Chris Gilbert, « Primate Evolution », sur All The World's Primates, Charlestown, RI, Primate Conservation, Inc., (consulté le )
- John Roach, « Oldest Primate Fossil in North America Discovered », National Geographic News, Washington, D.C., National Geographic Society, (lire en ligne, consulté le )
- Vanessa McMains, « Found in Wyoming: New fossils of oldest American primate », The Gazette, Baltimore, MD, Johns Hopkins University, (lire en ligne, consulté le )
- Sara B. Caldwell, « Missing link found, early primate fossil 47 million years old », Digital Journal, Toronto, Canada, digitaljournal.com, (lire en ligne, consulté le )
- Alex Watts, « Scientists Unveil Missing Link In Evolution », Sky News Online, London, BSkyB, (lire en ligne [archive], consulté le )
- Pascal Picq, [2005], p. 90-100
- (en) Jean-Jacques Hublin, Abdelouahed Ben-Ncer, et al., « New fossils from Jebel Irhoud, Morocco and the pan-African origin of Homo sapiens », Nature, vol. 546, no 289, , p. 289–292 (DOI 10.1038/nature22336)
- (en) Israel Hershkovitz et al., « The earliest modern humans outside Africa », Science, vol. 359, no 6374, , p. 456-459 (DOI 10.1126/science.aap8369)
- Boyd et Silk 2003
- Brues et Snow 1965, p. 1–39
- Michel Brunet, Franck Guy, David Pilbeam, H. Mackaye, A. Likius, D. Ahounta, A. Beauvilain, C. Blondel, H. Bocherens, J. Boisserie, L. De Bonis, Y. Coppens, J. Dejax, C. Denys, P. Duringer, V. Eisenmann, G. Fanone, P. Fronty, D. Geraads, T. Lehmann, F. Lihoreau, A. Louchart, A. Mahamat, G. Merceron, G. Mouchelin, O. Otero, P. Pelaez Campomanes, M. Ponce De Leon, J. Rage, M. Sapanet, M. Schuster, J. Sudre, P. Tassy, X. Valentin, P. Vignaud, L. Viriot, A. Zazzo et C. Zollikofer, « A new hominid from the Upper Miocene of Chad, Central Africa », Nature, London, Nature Publishing Group, vol. 418, no 6894, , p. 145–151 (ISSN 0028-0836, PMID 12110880, DOI 10.1038/nature00879, lire en ligne)
- Srivastava 2009, p. 87
- Curry 2008, p. 106–109
- « Study Identifies Energy Efficiency As Reason For Evolution Of Upright Walking », ScienceDaily, Rockville, MD, ScienceDaily, LLC, (lire en ligne, consulté le )
- « Study identifies energy efficiency as reason for evolution of upright walking », sur UANews, Tucson, AZ, The University of Arizona Office of University Communications, (consulté le )
- Michael D. Sockol, David A. Raichlen et Herman Pontzer, « Chimpanzee locomotor energetics and the origin of human bipedalism », Proc. Natl. Acad. Sci. U.S.A., Washington, D.C., National Academy of Sciences, vol. 104, no 30, , p. 12265–12269 (ISSN 0027-8424, PMID 17636134, PMCID 1941460, DOI 10.1073/pnas.0703267104)
- Aiello et Dean 1990
- Kondo 1985
- P. Thomas Schoenemann, « Evolution of the Size and Functional Areas of the Human Brain », Annual Review of Anthropology, Palo Alto, CA, Annual Reviews, vol. 35, , p. 379–406 (ISSN 0084-6570, DOI 10.1146/annurev.anthro.35.081705.123210)
- Patricia McBroom, « Meat-eating was essential for human evolution, says UC Berkeley anthropologist specializing in diet », Berkeley, CA, University of California, Berkeley, (consulté le )
- Neil Mann, « Meat in the human diet: An anthropological perspective », Nutrition & Dietetics, Hoboken, NJ, Wiley-Blackwell, vol. 64, no Supplement s4, , S102–S107 (ISSN 1747-0080, DOI 10.1111/j.1747-0080.2007.00194.x, lire en ligne, consulté le )
- Chris Organ, Charles L. Nunn, Zarin Machanda et Richard W. Wrangham, « Phylogenetic rate shifts in feeding time during the evolution of Homo », Proc. Natl. Acad. Sci. U.S.A., Washington, D.C., National Academy of Sciences, vol. 108, no 35, , p. 14555–14559 (ISSN 0027-8424, PMID 21873223, PMCID 3167533, DOI 10.1073/pnas.1107806108)
- Sébastien Bohler, « Une mutation génétique qui a profité au cerveau d'Homo sapiens », Pour la science, no 473, , p. 8.
- (en) Marta Florio, Takashi Namba, Svante Pääbo, Michael Hiller1 et Wieland B. Huttner, « A single splice site mutation in human-specific ARHGAP11B causes basal progenitor amplification », Science Advances, vol. 2, no 12, , article no 1601941 (DOI 10.1126/sciadv.1601941).
- Min S. Park, Andrew D. Nguyen, Henry E. Aryan, Hoi Sang U, Michael L. Levy et Katerina Semendeferi, « Evolution of the human brain: changing brain size and the fossil record », Neurosurgery, Philadelphia, PA, Lippincott Williams & Wilkins, vol. 60, no 3, , p. 555–562 (ISSN 0148-396X, PMID 17327801, DOI 10.1227/01.NEU.0000249284.54137.32)
- Emiliano Bruner, « Cranial shape and size variation in human evolution: structural and functional perspectives », Child's Nervous System, Heidelberg, Springer-Verlag, vol. 23, no 12, , p. 1357–1365 (ISSN 0256-7040, PMID 17680251, DOI 10.1007/s00381-007-0434-2)
- Richard Potts, « Evolution and Environmental Change in Early Human Prehistory », Annual Review of Anthropology, Palo Alto, CA, Annual Reviews, vol. 41, , p. 151–167 (ISSN 0084-6570, DOI 10.1146/annurev-anthro-092611-145754)
- William R. Leonard, J. Josh Snodgrass et Marcia L. Robertson, « Effects of brain evolution on human nutrition and metabolism », Annual Review of Nutrition, Palo Alto, CA, Annual Reviews, vol. 27, , p. 311–327 (ISSN 0199-9885, PMID 17439362, DOI 10.1146/annurev.nutr.27.061406.093659)
- Robert A. Barton et Chris Venditti, « Rapid Evolution of the Cerebellum in Humans and Other Great Apes », Current Biology, Cambridge, MA, Cell Press, vol. 24, no 20, , p. 2440–2444 (ISSN 0960-9822, DOI 10.1016/j.cub.2014.08.056)
- Anna Starowicz-Filip, Olga Milczarek, Stanisław Kwiatkowski, Barbara Bętkowska-Korpała et Katarzyna Prochwicz, « Cerebellar cognitive affective syndrome CCAS – a case report », Archives of Psychiatry and Psychotherapy, Kraków, Poland, Polish Psychiatric Association, vol. 3, , p. 57–64 (OCLC 220954272, lire en ligne [PDF])
- Feng Yu, Qing-jun Jiang, Xi-yan Sun et Rong-wei Zhang, « A new case of complete primary cerebellar agenesis: clinical and imaging findings in a living patient », Brain, Oxford, UK, Published by Oxford University Press on behalf of the Guarantors of Brain, (ISSN 1460-2156, PMID 25149410, DOI 10.1093/brain/awu239)
- Anne H. Weaver, « Reciprocal evolution of the cerebellum and neocortex in fossil humans », Proc. Natl. Acad. Sci. U.S.A., Washington, D.C., National Academy of Sciences, vol. 102, no 10, , p. 3576–3580 (ISSN 0027-8424, PMID 15731345, PMCID 553338, DOI 10.1073/pnas.0500692102)
- Michel Lorblanchet, « L’origine de l’art », Diogène, no 14, , p. 116-131.
- Manuel Gutierrez, Emmanuelle Honoré, L'Art rupestre d'Afrique. Actualité de la recherche, Editions L'Harmattan, , 326 p..
Bibliographie
- Yves Coppens, L’histoire de l'homme, Odile Jacob, , 256 p. (lire en ligne)
- Pascal Picq, Au commencement était l'homme. De Toumaï à Cro-Magnon, Odile Jacob, , p. 16
- Pascal Picq, Les Origines de l'homme : L'odyssée de l'espèce, Tallandier, 1999 [2005] [2014] (ISBN 978-2702826904)
- Robert Thomas Boyd et Joan Silk, L'aventure humaine, De Boeck, (ISBN 978-2804143336)
- Charles Darwin, La Filiation de l'homme et la sélection liée au sexe, London, John Murray (dir.), (ISBN 978-2-7453-2685-0, OCLC 7197127, lire en ligne)Traduction nouvelle réalisée sous la direction de Patrick Tort, Institut Charles Darwin International, Champion Classiques
- (en) Janet Browne, Charles Darwin : The Power of Place, Princeton University Press (ISBN 9780691114392)
- (en) Nicolaas Adrianus Rupke, Richard Owen : Biology without Darwin, University Of Chicago Press, (ISBN 978-0-226-73177-3), p. 182–253
- (en) Richard Dawkins, The Ancestor's Tale: A Pilgrimage to the Dawn of Evolution, Boston, Houghton Mifflin, (ISBN 0-618-00583-8, OCLC 56617123)
- (en) Amade M'charek, The Human Genome Diversity Project: An Ethnography of Scientific Practice, Cambridge; New York, Cambridge University Press, coll. « Cambridge Studies in Society and the Life Sciences », (ISBN 0-521-83222-5, OCLC 55600894)
- (en) Rob DeSalle et Ian Tattersall, Human Origins: What Bones and Genomes Tell Us About Ourselves, vol. 13, College Station, TX, Texas A&M University Press, coll. « Texas A&M University Anthropology Series », (ISBN 978-1-58544-567-7, OCLC 144520427)
- (en) Ronald J. Trent, Molecular Medicine: An Introductory Text, Burlington, MA, Elsevier Academic Press, (ISBN 0-12-699057-3, OCLC 162577235)
- (en) R. P. Srivastava, Morphology of the Primates and Human Evolution, New Delhi, PHI Learning Private Limited, (ISBN 978-81-203-3656-8, OCLC 423293609)
- (en) Robert Boyd et Joan B. Silk, How Humans Evolved, New York, Norton, (ISBN 0-393-97854-0, OCLC 49959461)
- (en) James R. Curry, Children of God : Children of Earth, Bloomington, IN, (ISBN 978-1-4389-1846-4, OCLC 421466369)
- (en) Wenda R. Trevathan, Human Birth : An Evolutionary Perspective, New Brunswick, NJ, Transaction Publishers, (1re éd. Originally published 1987; New York: Aldine De Gruyter) (ISBN 978-1-4128-1502-4, OCLC 669122326)
- (en) Robert D. Martin, « Evolution of Primates », dans Neil J. Smelser et Paul B. Baltes, International Encyclopedia of the Social & Behavioral Sciences, Amsterdam; New York, Elsevier, (ISBN 978-0-08-043076-8, OCLC 47869490, DOI 10.1016/B0-08-043076-7/03083-7)
- (en) Michael P. Muehlenbein, Basics in Human Evolution, Academic Press, , 584 p. (ISBN 0128026936, lire en ligne)
Voir aussi
Articles connexes
- Histoire évolutive des primates
- Paléoanthropologie
- Hominisation
- Homo
- Bipédie
- Évolution du cerveau
- Origine du langage
- Domestication du feu
Liens externes
- Hominidés – Préhistoire Chronologie
- « BBC - Science & Nature - The evolution of man », BBC (consulté le )
- « Evolution Figures : Chapter 25 », Cold Spring Harbor Laboratory Press (consulté le ) — Illustrations from the book Evolution (2007)
- « Human Evolution », Smithsonian Institution's Human Origins Program (consulté le )
- « Becoming Human », Arizona State University's Institute of Human Origins (consulté le )
- « Human Evolution Timeline », ArchaeologyInfo.com (consulté le )
- « Bones, Stones and Genes : The Origin of Modern Humans » [vidéo] lecture series, Howard Hughes Medical Institute (consulté le )
- June 24 2015 Public Broadcasting System "First Peoples"
