Glyphosate
| Glyphosate | |
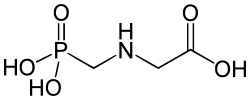
| |
  Structure chimique du glyphosate. |
|
| Identification | |
|---|---|
| Nom UICPA | N-(phosphonométhyl)glycine |
| Synonymes |
acide 2-[(phosphonométhyl)amino]acétique acide glyphosique |
| No CAS | |
| No ECHA | 100.012.726 |
| No CE | 213-997-4 |
| SMILES | |
| InChI | |
| Apparence | solide blanc, inodore[1] |
| Propriétés chimiques | |
| Formule | C3H8NO5P [Isomères] |
| Masse molaire[2] | 169,073 1 ± 0,004 7 g/mol C 21,31 %, H 4,77 %, N 8,28 %, O 47,32 %, P 18,32 %, |
| pKa | <2 ; 2.6 ; 5.6 ; 10.6 |
| Propriétés physiques | |
| T° fusion | (décomposition) : 230 °C[1] |
| T° ébullition | 230 °C décomposition |
| Solubilité | dans l'eau à 25 °C : 12 g l−1[1] Insoluble dans la plupart des solvants organiques |
| Masse volumique | 1,7 g cm−3[1] |
| Pression de vapeur saturante | à 20 °C : négligeable[1] |
| Précautions | |
| SGH[3] | |
| H318 et H411 |
|
| Transport | |
| Écotoxicologie | |
| DL50 | 1 568 mg kg−1 (souris, oral) 130 mg kg−1 (souris, i.p.) 7 940 mg kg−1 (lapin, peau)[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
| Sel d'isopropylamine de glyphosate | |
| Identification | |
|---|---|
| Synonymes |
sel d'isopropylamine de N(-phosphonométhyl)glycine |
| No CAS | |
| SMILES | |
| InChI | |
| Apparence | solide |
| Propriétés chimiques | |
| Formule | C6H17N2O5P [Isomères] |
| Masse molaire[5] | 228,183 3 ± 0,007 9 g/mol C 31,58 %, H 7,51 %, N 12,28 %, O 35,06 %, P 13,57 %, |
| Propriétés physiques | |
| Solubilité | très soluble dans l'eau |
| Masse volumique | 1,218 g ml−1 à 25 °C[réf. souhaitée] |
| Précautions | |
| Directive 67/548/EEC | |
| Écotoxicologie | |
| DL50 | 10 537 mg kg−1 (rat, oral) 7 500 mg kg−1 (rat, peau)[réf. souhaitée] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
| Glyphosate-trimésium | |
| Identification | |
|---|---|
| Synonymes |
triméthylsulfonium de l'ion N-(phosphonométhyl)glycine |
| No CAS | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C6H16NO5PS [Isomères] 245,235087 g∙mol-1 C12H32NO5PS3 [Isomères] 397,558731 g∙mol-1 |
| Propriétés physiques | |
| T° ébullition | 110 °C à 760 mmHg[réf. souhaitée] |
| Solubilité | 1 050 g l−1 dans l'eau à 20 °C ; ou 4 300 g l−1 eau à 25 °C[réf. souhaitée] |
| Masse volumique | 1,27 g cm−3[réf. souhaitée] |
| Précautions | |
| Directive 67/548/EEC | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le glyphosate (N-(phosphonométhyl)glycine, C3H8NO5P) est un herbicide total foliaire systémique, c’est-à-dire non sélectif, absorbé par les feuilles et à action généralisée. Exclusivement produit par Monsanto à partir de 1974 (sous la marque Roundup), il l'est aussi par d'autres firmes depuis que son brevet est entré dans le domaine public (en 2000). À la fois efficace contre les monocotylédones et dicotylédones, c'est le désherbant le plus vendu au monde ; pulvérisé chaque année sur des millions d'hectares[6], il a vu son utilisation augmenter considérablement dans le monde en 40 ans[7] (environ 720000 tonnes mises sur le marché en 2012)[8]. En 2014, dans le monde, près de 0,5 kg de pesticide à base de glyphosate aurait été pulvérisé par hectare[7]. Il nécessite des adjuvants (dont tensioactif) car seul, il n'adhère pas aux feuilles et les pénètre difficilement.
Le glyphosate est classé depuis le comme « probablement cancérogène » par le Centre international de recherche sur le cancer (CIRC)[9],[10],[11], agence de l'OMS qui précise que ce classement est une évaluation du niveau de preuves du danger engendré par l'exposition aux produits à base de glyphosate ; l'estimation du risque pour une population exposée au glyphosate n'est pas de son ressort.
En mai 2016, le panel permanent d'experts commun entre l'Organisation des Nations unies pour l'alimentation et l'agriculture (FAO) et de l'Organisation mondiale de la santé (OMS/WHO) a estimé qu'il est improbable que le glyphosate soit cancérigène par voie alimentaire[12]. Des appréciations similaires ont été rendues par l'Autorité européenne de sécurité des aliments (AESA/EFSA) ainsi que par les différentes agences nationales récemment chargées d'évaluer le risque sanitaire du glyphosate par voie alimentaire ou dans le cadre d'une exposition professionnelle.
En 2021, des chercheurs de l'INSERM considèrent que le « lien entre glyphosate et certaines pathologies ou problématiques est plus fort que ce que l'on pensait jusqu'ici »[13].
Propriétés chimiques[modifier | modifier le code]
Le glyphosate est une molécule de synthèse, découverte dans les années 1950 par le chimiste suisse Henri Martin (de)[14],[15].
C'est un acide organique faible, analogue structurel d'un acide aminé naturel, la glycine, doté d'un groupement phosphonate (son nom est la contraction de glycine, phospho- et -ate) ; de cette structure, il présente quatre pKa (<2 ; 2,6 ; 5,6 ; 10,6)[16]. Avec sa structure zwitterionique, il est aussi amphotère[17], très soluble dans l'eau et très polaire (logP < −3,2[17]), une somme de caractéristiques qui a longtemps, dans certains contextes (hospitalier notamment, en cas de suspicion d'empoisonnement par exemple), rendu son analyse chimique difficile, longue et coûteuse.
Le glyphosate est aujourd’hui connu du grand public et du monde agricole comme herbicide total (brevet déposé par Monsanto en 1974[18]) ; mais il avait d'abord été breveté 10 ans plus tôt, en 1964 par Toy et Uhing comme chélateur, agent mouillant, composé biologiquement actif et intermédiaire chimique pour la production d'acides aminométhylènephosphiniques dérivés[19]. Sa propriété chimique de chélateur pourrait expliquer certains de ses effets sur l'environnement[20]. Il a d'ailleurs été utilisé pour supprimer des dépôts minéraux dans les tuyauteries avant d'être un pesticide. Parce que chélateur d'oligoéléments minéraux et de métaux, il s'adsorbe facilement dans les sols (plus ou moins selon le pH), ce qui le rend théoriquement assez peu mobile dans le sol.
C'est enfin un antibiotique puissant (brevet déposé par Monsanto en 2010)[21],[22]. Il n'a cependant jamais reçu d'autorisation de mise sur le marché (AMM) pour cette dernière utilisation.
Pour accroître sa solubilité et permettre son passage dans la plante et la sève, les industriels le préparent souvent sous forme de sel d’isopropylamine (C6H17N2O5P, Roundup)[23]. Des additifs (tensioactifs, tels que le polyoxyéthylène amine) lui sont ajoutés pour le fixer sur les plantes[24],[25]. La toxicité de ce tensioactif a conduit au retrait en France en 2016 de tous les produits à base de glyphosate en contenant[26].
Utilisation et intérêt agronomique[modifier | modifier le code]

Ici : flore spontanée détruite dans cette monoculture de pomme du Limousin.

Autres ; Pâturages et foin ; Vergers et Vigne ; Riz ; Fruits & Légumes ; Blé ; Coton ; Soja ; Maïs.
(estimation USGS).
Herbicide, pour détruire les adventices[modifier | modifier le code]
Le glyphosate est l'herbicide le plus utilisé dans le monde[27]. En France, environ 8 000 t/an de matière active ont été utilisées en 2016[28]. Son succès repose sur un coût faible, une bonne efficacité et une très grande souplesse d'utilisation. Il est largement utilisé pour du désherbage agricole mais aussi pour l'entretien des espaces urbains et industriels. En agriculture, le glyphosate permet une destruction efficace des adventices ou des repousses avec un coût réduit, y compris en « agriculture de conservation » pour désherber sans retourner la terre[29].
Herbicide aussi utilisé comme dessicant (juste avant la récolte)[modifier | modifier le code]
Le glyphosate est de plus en plus utilisé en pré-récolte en Europe, dans les régions agronomiques tardives, sur de nombreuses cultures (blé, tournesol, colza, orge d'hiver, betterave sucrière) pour accélérer la maturité et détruire les adventices présentes dans la culture[30]. Ceci vise à avancer la date de récolte. En général, le délai du traitement avant récolte à respecter est de 7 jours.
En France, certains produits phytosanitaires à base de glyphosate sont homologués pour traiter un blé mûr (destruction de chardon) et le récolter entre 7 et 14 jours après[31].
Au Canada, cette méthode de dessiccation au glyphosate est pratiquée sur les lentilles, le canola, le blé, le lin, le pois, le haricot sec[32], le soja, l'orge, l'avoine et les cultures fourragères (destinées à l'alimentation animale)[33].
Ces traitements sur cultures proches de la maturité expliquent en partie pourquoi on retrouve le glyphosate dans l'alimentation[34],[35],[36],[37],[38],[39]. Par exemple, en 2012, la LMR du glyphosate dans les lentilles (dans l'Union européenne) a été multipliée par 100 en passant de 0,1 à 10 mg/kg. À la demande de Monsanto, l'Autorité européenne de sécurité des aliments (AESA) a augmenté la LMR afin de prendre en compte l'utilisation autorisée du glyphosate sur les lentilles (pré-récolte) aux États-Unis et au Canada[38] (cette pratique n'est pas autorisée en Europe). Selon la Commission : « la LMR a été modifiée compte tenu des informations sur une utilisation spécifique » (la dessiccation) « qui n'avait pas encore été évaluée ». Cette augmentation de la LMR permet l'exportation de lentilles du Canada et des États-Unis vers l'Europe.
Une étude réalisée en 2015 et 2016 par l'Agence canadienne d'inspection des aliments a montré que 47 % des échantillons de haricots, pois et lentilles contenaient du glyphosate[40]. La LMR canadienne du glyphosate et de l'acide aminométhylphosphonique (AMPA) pris ensemble est de 4 mg/kg dans les lentilles sèches, alors que la LMR européenne du glyphosate seul est de 10 mg/kg pour ce produit.
Le glyphosate, par son mode d'action systémique, peut, s'il est appliqué trop tôt en pré-récolte, s'accumuler dans le grain et entraîner un dépassement de la LMR[39].
Aux États-Unis, l'utilisation trop précoce du glyphosate (une partie des graines étant encore trop humides) ou trop tardive (délais avant récolte non respectés) sur les haricots secs peut entraîner une teneur en résidus illégale conduisant les acheteurs à rejeter les importations[36].
La dessiccation avant récolte des céréales blé et orge, s'est fortement développée en Angleterre. En 2008, l'agence de l'alimentation anglaise a mené une campagne d'information auprès des agriculteurs visant à limiter cette pratique en raison d'une présence récurrente de traces de glyphosate dans le pain[37].
En 2016, deux études ont montré la présence de glyphosate dans certaines bières suisses et allemandes. Une bière allemande contenait trois cents fois la dose autorisée dans l'eau potable[35]. Il provenait vraisemblablement du malt d'orge ou du houblon. Une étude en Suisse a testé l'impact de la dessiccation au glyphosate du blé et de l'orge brassicole (pratique interdite en Suisse) : les blés traités en pré-récolte et la farine qui en est issue contiennent des quantités non négligeables de glyphosate (49 à 280 µg/kg). Lors de cette expérimentation, l'orge traité avant récolte contenait trois cents fois plus de glyphosate que l'orge témoin et le malt d'orge cinquante fois plus que le seuil de quantification non atteint par le témoin[34].
Fin 2017, le syndicat agricole français Coordination rurale réclame la suppression de son usage pour la dessiccation dans l'Union européenne et la baisse de la LMR du glyphosate dans les produits agricoles avec un retour à 0,1 mg/kg (LMR actuelle glyphosate de 0,1 à 20 mg/kg)[41].
Autres usages[modifier | modifier le code]
Selon Rivoira et al. (2022), bien que le glyphosate soit généralement utilisé en projection sur les feuilles, son absorption par les racines a été clairement mesurée, et il a été rapporté des utilisations à des fins fongicides par application sur les sols[42].
Efficacité et résistances[modifier | modifier le code]

Le glyphosate s'est d'abord montré extrêmement efficace, puis des souches d'adventices résistantes sont peu à peu apparues. Les cultures d'OGM tolérants au glyphosate, surtout développées aux États-Unis à la fin des années 1990, ont contribué à une augmentation de l'usage du glyphosate dans les parcelles OGM (93 % des surfaces en soja aux États-Unis en 2006). En 2007, sept adventices avaient produit des souches résistantes à ce pesticide, dont Ambrosia trifida (l'ambroisie trifide ou grande herbe à poux) trouvée dans l'Ohio et l'Indiana, qui est une plante qui s'installe facilement dans le soja, occasionnant jusqu'à 70 % de diminution de rendement[43]. En France, l'INRA de Dijon confirmait en 2007 un premier cas de résistance au glyphosate d'une espèce végétale : l'ivraie raide (Lolium rigidum)[44].
Sur le terrain, de nombreux agriculteurs connaissent ce phénomène depuis plusieurs décennies et le gèrent par des rotations de culture ou en alternant les molécules herbicides qu'ils utilisent. L'utilisation exclusive de glyphosate générant une sélection des adventices de plus en plus tolérantes à cet herbicide au fil des générations. L'utilisation répétée d'une seule molécule phytosanitaire sans diversifier les méthodes d'actions entraine toujours tôt ou tard une certaine résistance de la part du nuisible (insecte, champignon ou bien mauvaise herbe) vis-à-vis de cette molécule[45][source insuffisante].
Certains craignent aussi que, par hybridation, des crucifères sauvages acquièrent le transgène de résistance au glyphosate et ne puissent plus être désherbées dans les champs ou bords de route par les désherbants totaux basés sur le glyphosate.
Un phénomène d'hormèse a été identifié par une étude qui a utilisé le haricot cultivé comme modèle : à faible dose, le glyphosate dope la croissance du haricot au lieu de le tuer[46].
Faibles coûts d'achat et de stockage[modifier | modifier le code]
L'une des raisons du succès mondial (déserbant le plus utilisé au monde depuis les années 1970, avec par exemple plus de 800 000 t vendues en 2014)[47], des pesticides à base de glyphosate est son bas coût d'achat et de stockage[48], notamment depuis que son brevet est tombé dans le domaine public en 2000.
Mais ce coût varie néanmoins significativement selon le pays, le fournisseur, la concurrence, et bien sûr selon la concentration et la formulation du produit (dans les années 1980, certains adjuvants ont fortement multiplié son efficacité comme désherbant : par exemple multipliée par 6,5 en bas volume avec l'Ethokem)[49], voire selon la spéculation[50].
À titre d'exemple :
- États-Unis : en 2016, son prix moyen au litre était de 3,38 $ US par litre (d'après une étude de l’Université de l’Illinois), prix qui avait baissé de 39 % par rapport à 2014, probablement à la suite de la mise sur le marché de génériques du Roundup et à la suite d'une baisse de la demande[51] ;
- Europe : en 2018, ce prix était de 2,64 € par litre, selon l’Association européenne des producteurs d’herbicides (ECPA), soit 9 % de plus que l'année précédente (2017), en raison de la hausse des coûts de production et de la réduction de l’offre[52] ;
- France : en 2019, ce prix était de 3,50 € par litre (enquête auprès de 1 500 agriculteurs), soit une hausse de 17 % en un an (par rapport à 2018), en raison notamment de spéculations sur une possible interdiction qui a encouragé certains à faire des stocks. En 2018, il s'en était vendu 9 723 tonnes en France.
Les coûts environnementaux et sanitaires, directs ou indirects, de l’usage du glyphosate sont quant à eux encore discutés[53][réf. nécessaire].
Mécanisme d'action de l'herbicide[modifier | modifier le code]
Le mécanisme d'action[54] de cet herbicide est une inhibition de l'enzyme 5-énolpyruvylshikimate-3-phosphate synthase (ou EPSPS), une enzyme de la voie de biosynthèse des acides aminés aromatiques dans les plantes.
Historiquement, et selon la littérature, depuis que les semenciers (qui sont aussi producteurs de désherbant) cherchent à produire des semences et plantes résistantes au glyphosate, ils auraient trouvé au moins trois voies pour atteindre ce but chez des végétaux cultivés, normalement vulnérables à cette molécule herbicide[54].
- Les premiers travaux ont été axés sur l'adaptation progressive (par simple sélection) des cellules végétales cultivées à une exposition lentement croissante au glyphosate. Les cellules ainsi obtenues étaient devenues résistantes au glyphosate, par exemple en raison de la surexpression du gène EPSPS, de l'amplification de ce gène (EPSPS), ou d'une plus grande stabilité enzymatique[54].
- D'autres travaux ont recherché à créer une résistance en transformant les plantes concernées avec des gènes permettant de dégrader et métaboliser le glyphosate sans dommages pour la plante :
- une enzyme dite « GOX » (pour glyphosate oxydoréductase) a été trouvée chez un micro-organisme du sol. Elle casse la liaison azote-carbone du glyphosate en produisant de l'acide aminométhylphosphonique,
- un autre gène dit « GAT » (pour glyphosate N-acétyl-transférase) s'est montré capable d'acétyler et désactive le glyphosate[54],
- un troisième mécanisme (celui qui a été utilisé pour mettre sur le marché diverses plantes transgéniques résistantes au glyphosate) a consisté à insérer par transgenèse un gène codant une forme d'enzyme EPSPS[54] plus résistante au glyphosate.
Plusieurs chercheurs ou équipes ont utilisé la mutagenèse dirigée, ou des substitutions d'acides aminés de l'EPSPS, mais la forme de l'enzyme EPSPS la plus résistante au glyphosate à ce jour serait celle qui a été isolée à partir de la souche CP4 d'Agrobacterium spp[54].
L'observation d'apparition dans les champs de « mauvaises herbes » devenues résistantes au glyphosate laissent penser que d'autres mécanismes physiologiques de résistance au glyphosate sont possibles. Un liseron des champs assez résistant présente une production élevée de l'enzyme 3-désoxy-d-arbino-heptulosonate 7-phosphate synthase, la première enzyme de la voie shikimique, ce qui suggère que le flux de carbone accru par la voie shikimique peut offrir une résistance au glyphosate[54].
Une autre adventice (Gaillet gratteron ou Galium aparine ; goosegrass pour les anglophones) se montre capable de réduire la translocation du glyphosate à partir de la surface foliaire traitée[54].
La voie la plus efficace semble être l'enzyme EPSPS, impliquée dans la voie métabolique de l'acide shikimique, laquelle est nécessaire pour la synthèse des acides aminés aromatiques tels que la phénylalanine, la tyrosine et le tryptophane ; ces acides aminés participent à la synthèse des vitamines et de beaucoup de métabolites secondaires, comme les molécules hormonales d'intérêt sur le développement de la plante telles que les folates, l'ubiquinone et des naphtoquinones[55]. La biosynthèse d'acides aminés par l'enzyme EPSPS est absente chez les animaux, si bien que cette voie n'a pas a priori d'effet sur eux.

Utilisations et polémiques[modifier | modifier le code]
Lutte contre la drogue[modifier | modifier le code]
Le glyphosate est notamment utilisé par le gouvernement colombien, aidé par le gouvernement des États-Unis dans son Plan Colombie pour détruire les champs de coca produisant de la drogue qui finance des actions de groupes rebelles.
L'Équateur voisin craint aussi des conséquences sanitaires et écologiques des pulvérisations colombiennes de glyphosate près de ses frontières, dans le Putumayo. Le refus colombien d'abandonner ces pulvérisations aériennes a provoqué en 2006-2007 une crise diplomatique entre les deux pays[56].
En , le Conseil national des stupéfiants de la Colombie a ordonné la suspension des épandages de glyphosate pour détruire les plantations illégales de coca, à la suite de l'avis du CIRC/IARC classant l'herbicide comme « probablement cancérogène », et à la demande de la Cour constitutionnelle de la Colombie, qui cite le principe de précaution. Pour mettre en œuvre cette décision, l'Agence nationale des permis environnementaux doit se prononcer immédiatement et annuler le permis accordé au programme de pulvérisation[57],[58],[59],[60]. Devant la hausse de la culture de coca, les épandages ont repris en 2018[61] et le glyphosate est réautorisé depuis 2020[62].
Cultures transgéniques[modifier | modifier le code]
L'augmentation massive de l'utilisation du glyphosate à travers le monde est très liée à la mise sur le marché de plantes génétiquement modifiées résistantes au glyphosate.
Certaines plantes ont été modifiées génétiquement par transgénèse pour résister au glyphosate. Le principe de cette résistance est d'utiliser une version mutée du gène du maïs codant la 5-enol pyruvylshikimate-3-phosphate synthase, enzyme normalement affectée par le glyphosate. La version mutante du gène code une version différente de l'enzyme, appelée 2mEPSPS, dont le fonctionnement est beaucoup moins inhibé par le glyphosate. Il existe plusieurs variétés de plantes cultivées transgéniques résistantes au glyphosate comme le soja et le coton. Il existe aussi d'autres résistances que celle sus citée[63].
La culture majoritaire d'OGM résistant au glyphosate a entraîné des résistances chez 261 espèces de plantes, dans 71 pays, ce qui nécessite d'utiliser plus d'herbicides[64].
Selon le gouvernement du Québec, les cultures tolérantes à un herbicide permettraient de réduire l'utilisation d'herbicides car elles nécessitent moins de traitement, néanmoins les résistances pourraient entraîner une augmentation de l'utilisation d'herbicides[65].
Agriculture de conservation comme le non labour[modifier | modifier le code]
L'usage du glyphosate a permis une adoption plus rapide de techniques d'agriculture de conservation comme le non labour[66]. Le non-travail du sol et le fait de laisser les résidus de la culture précédente au sol limite les effets négatifs du glyphosate (un pesticide est d'autant plus vite dégradé qu'il est exposé au soleil et à un milieu riche en micro-organismes) et permet d'améliorer le taux de matière organique du sol[67].
Évaluations environnementales et sanitaires[modifier | modifier le code]
Pour autoriser ou refuser la mise sur le marché d’une molécule, les autorités sanitaires se fondent sur un dossier fourni par les demandeurs, des rapports établis par d'autres agences comme le CIRC, ainsi, en théorie, que toutes les études disponibles sur le sujet[68].
Alors que l'utilisation du glyphosate a encore fortement augmenté (depuis le milieu des années 1990 et à nouveau dans les années 2000), les données scientifiques utilisées pour les évaluations des risques sanitaires et environnementaux datent encore d'une trentaine d'années. Ainsi, lors de la ré-homologation des produits à base de glyphosate, faite en 1993 par l'EPA[69], près de 73 % des presque 300 citations utilisées pour cette « mise à jour » avaient été publiées avant 1985 ; et parmi elles, 11 seulement avaient fait l'objet d'une évaluation par des pairs.
Plus récemment (2016) une recherche faite sur PubMed[70] a révélé plus de 1 500 études sur le glyphosate publiées rien que durant la dernière décennie[7].
En 2017, des experts jugent « incongru que les évaluations de la sécurité de l'herbicide le plus largement utilisé sur la planète fassent largement appel à moins de 300 études non publiées et/ou non revues par des pairs, tout en excluant la vaste littérature moderne sur les effets du glyphosate[7]. »
De plus, Monsanto est soupçonné d'avoir directement manipulé l'information pour influencer les agences d'évaluations : En 2017, le journal Le Monde a publié une série d'articles montrant que l'entreprise Monsanto avait rémunéré des scientifiques pour produire, sous leur nom, des études écrites partiellement par des employés de l'entreprise. Ces révélations se fondent sur des documents obtenus en marge d'un procès en cours aux États-Unis, documents que les journalistes ont nommés « Monsanto Papers ». Il s'agissait pour l'essentiel d'études en rapport avec le glyphosate. Les journalistes dénoncent une manœuvre menée dans le but d'influencer favorablement les agences d'évaluation[71],[72]. Face à la mise en cause de ses sources, l'Autorité européenne de sécurité des aliments répond que les articles en question sont des synthèses d'études qui sont elles-mêmes prises en compte dans l'expertise de l'agence. Par ailleurs, dans le cas des deux articles sur lesquels elle s'est appuyée, elle ne se prononce pas sur le fait qu'ils aient pu être écrits directement par Monsanto mais observe que l'absence de neutralité était claire à la lecture des déclarations d'intérêts et des remerciements, qui faisaient état explicitement d'un financement par le Glyphosate Task Force, un consortium d'entreprises œuvrant pour le renouvellement de l'autorisation du glyphosate par l'Union européenne[73].
Désherbant largement utilisé par l'agriculture mondiale, le glyphosate est soupçonné de provoquer des cancers. En 2023, il y a une possibilité de renouvellement pour dix ans de l'autorisation d'utilisation du glyphosate dans l'Union européenne. La Commission propose d'assortir l'autorisation de « mesures d'atténuation des risques » aux alentours des zones pulvérisées, avec des « bandes tampons » de cinq à dix mètres, des équipements permettant de réduire « les dérives de pulvérisation », ainsi que l'interdiction de l'utilisation pour la dessiccation (l'épandage pour sécher les cultures avant la récolte)[74]
Contamination des milieux[modifier | modifier le code]
Jusque dans les années 2000, la mobilité et cinétique environnementale du glyphosate est restée mal connue et l'est encore incomplètement[75]. Cette information devenait importante car cette molécule est l'herbicide le plus utilisé, et son utilisation a été fortement accrue dans les zones de cultures de plantes transgéniques rendues tolérante au glyphosate[76] et parce que d'autres herbicides étaient trouvés dans l'air et les pluies[77], sources potentielles d'exposition pour l'homme et les travailleurs agricoles (ou forestiers[78]) en particulier.
Persistance / Dégradation[modifier | modifier le code]

« La plupart des processus biologiques et d'oxydation peuvent détruire les molécules de glyphosate, conduisant alors à des sous-produits (les principaux étant l' acide aminométhylphosphonique (AMPA pour Aminomethylphosphonic acid, « son sous-produit le plus toxique et persistant ») et la Sarcosine) qui peuvent être ou non affectés par ces processus »[80].
Lorsque le glyphosate est utilisé sur des plantes génétiquement modifiées pour y être résistantes, ces plantes le dégradent fortement en AMPA et glyoxylate[80]. Sur ces cultures, les résidus du glyphosate sont négigeables, tandis que ceux de l'AMPA peuvent être très élevés[80].
La vitesse de dégradation environnementale du glyphosate dépend du type de sol et de sa composition microbienne[79]. Il peut persister, ainsi que l'AMPA, plus d'un an dans les sols à forte teneur en argile mais est beaucoup plus rapidement lessivé dans les sols sableux[80].
Dans l'eau, le glyphosate et l'AMPA peuvent également se déposer dans les sédiments où la dégradation est beaucoup plus lente[80]. En raison de son utilisation généralisée on retrouve maintenant couramment du glyphosate ou de l'AMPA dans la pluie, diverses sources d'eau et de nombreux sédiments[80].
En 2015, Monsanto été condamné en France pour publicité mensongère, ayant présenté le Roundup, premier désherbant au monde, comme biodégradable. Principale matière active du Round Up, le glyphosate a été classé en 1991 « dangereux pour l'environnement », notamment aquatique, par les autorités européennes[82].
Diverses méthodes de décontamination des eaux contenant du glyphosate ont été mises au point (et comparées par une revue d'études en 2020)[79] pour traiter le glyphosate présent dans l'eau ; il peut être adsorbé (sur charbon activé), mais il n'est alors pas détruit[83].
Une biodégradation seule ou une oxydation seule ne sont « généralement pas suffisamment efficace pour atteindre les normes requises », mais il est possible de combiner ces deux procédés[79]. Une méthode de dopage de la photodégradation dans l'eau a été proposée en 2023[84], ainsi qu'une méthode d'électrominéralisation catalysée par un film nanostructuré d'oxyde de plomb, à température ambiante et avec un très faible besoin en électricité (l'oxyde reteun est le « β-PbO2 pur, avec nanostructures d'aiguilles cubiques », susceptible de provenir d'une valorisation de déchets toxique de métaux lourds)[85].
Pour limiter la pollution par dispersion de l’air et l’exposition des travailleurs au glyphosate, il a été récemment (2022) proposé (comme pour quelques autres pesticides)[86] d'encapsuler le glyphosate dans des supports de type bille creuse d'agile ou silice afin de permettre une libération plus ponctuelle et prolongée[87]. Les auteurs n'ont pas étudié d'éventuels risques pour l'écologie des sols (vie bactérienne notamment)[88] et pour la résistance aux pesticides[87].
Détection de présence[modifier | modifier le code]
Les analyses permettant de doser par les moyens habituels le glyphosate dans les milieux naturels ou les organismes ont longtemps été difficiles, longues et coûteuses[89],[90],[91].
En outre, son caractère zwitterionique empêche de le rechercher lors d'analyses multi-résidus de surveillance de l'environnement[92].
Enfin, « fortement retenu par le sol et par conséquent peu lessivé, le glyphosate non absorbé par les plantes est dégradé par les microorganismes. Il s'agit donc d'un herbicide non rémanent[93] ». Ceci explique que, bien qu'il soit l'un des pesticides les plus utilisés dans le monde entier, les données sur la présence de glyphosate dans les milieux (eau, air, sol) restent en 2017 « encore rares ».
Cependant, des méthodes nouvelles semblent émerger[17], notamment avec un test coloré de test de dépistage rapide du glyphosate dans l'urine ou le sérum sanguin ou dans des boissons ou échantillons de sol ; sans faux positif et avec une limite de détection de 100 µg/mL pour les échantillons biologiques et de 800 µg/mL pour les échantillons de boissons (selon sa présentation faite en 2018 dans la revue Forensic Toxicology[94]).
Depuis que des progrès techniques ont amélioré la précision des analyses et en ont diminué les coûts, on prend conscience que, bien que dégradable, le glyphosate, comme de nombreux herbicides et insecticides (y compris interdits depuis des années) est très souvent présent dans l'air[95],[96], la pluie[97],[95], les eaux marines[98], de surface et de nappe[97] et les sols[97],[99], la nourriture et les boissons, l'urine[100] et le sang[101] humains et même dans des échantillons de marijuana[102] ou des médicaments.
Dans les sols[modifier | modifier le code]
La quantification du glyphosate est rendue difficile par le fait qu'il est adsorbé sur les particules du sol, et alors difficile à extraire sans le dénaturer.
Il est utilisé, en forêt (pour préparer et dégager les plants), en milieu rural, pour le désherbage en vue de l’ensemencement de nombreuses cultures et comme défoliant ou dessicant pour certaines autres cultures (blé, orge, légumes, colza ou moutarde sauvage, lin, cultures fourragères), ou dans les jardins par les particuliers et souvent pour la culture sans labour (technique permettant cependant la réduction des doses employées en semant sous couvert par exemple).
Dans l'eau[modifier | modifier le code]
Le glyphosate est soluble dans l'eau douce à raison de 12 g/L à 25 °C, mais il est aussi fortement adsorbé sur les particules du sol sec et alors peu mobilisable par l'eau[103].
Il était réputé peu mobile dans les sols et rapidement dégradable, et donc à faible risque de contamination des nappes, mais de nombreuses études montrent qu'il est pourtant de plus en plus présent dans les eaux de surface, voire souterraines et littorales. On a supposé qu'un usage intensif et mal contrôlé (dont en jardinage et désherbage de voirie) expliquerait sa présence dans de nombreux cours d'eau et nappes phréatiques, mais ceci n'est pas confirmé par les études qui révèlent une présence ubiquitaire. Une explication plus étayée est que dans certains contextes de pulvérisations, une partie importante du glyphosate dérive dans l'atmosphère ou le vent (avant d'atteindre sa cible), dérive et retombe plus loin (retombées sèches ou humides) ou qu'il est conservée sans se dégrader dans le sol quand ce dernier – au moment de la pulvérisation – est encore gorgé de l'eau de pluies récentes[103], selon qu'il pleut ou non après la pulvérisation[103]. Dans le contexte édaphique d'une étude récente (2018) de 0,06 à 1,0 % du glyphosate appliqué a été retrouvé dans l'eau lixiviant le sol ; cependant la teneur en glyphosate dans le lixiviat des sols ne dépendait pas des pluies tombées après l'épandage, « mais plutôt des conditions hydrologiques du sol au moment de la pulvérisation, reflétées par les précipitations cumulées des 7 jours précédent ; plus le sol était humide et engorgé au moment de la pulvérisation, plus il a ensuite libéré de glyphosate » (dans le contexte de cette étude, un cumul de 5 mm de pluie dans la semaine précédant l'épandage suffisait à fortement augmenter le relargage de glyphosate dans l'eau[103]), selon les auteurs. « Éviter la pulvérisation dans de telles conditions peut atténuer le relargage potentiel de glyphosate »[103], mais l'air ne doit pas être trop sec non plus au moment de la pulvérisation.
On sait en outre depuis 1985 que le glyphosate est plus mobile et soluble dans les sols alcalins (ou riches en phosphates, un minéral indispensable aux plantes, présent en quantité dans les sols riches ou bien amendés)[104].
Une étude a détecté des taux de 200 à 300 µg/L de glyphosate peu après une pulvérisation directe dans de l'eau stagnante. Ce taux n'a été réduit que de moitié après trois semaines environ. Le Roundup n'a jamais été autorisé dans l'UE pour désherber des mares et étangs de pêche en eau. La nature des bactéries présentes, la présence ou absence d'un biofilm important, la quantité d'ultraviolets, la température (saison) et le pH jouent probablement également un rôle dans la vitesse de dégradation du glyphosate dans l'eau[105].
En Suisse, du glyphosate est présent dans la grande majorité des ruisseaux de la région de Zurich à des taux médians de 0,11 à 0,20 μg/L (et de 2,1 à 2,6 μg/L pour le 95e centile)[92]. Les résidus trouvés dans les cours d'eau et les eaux usées traitées montrent que les utilisations non agricoles contribuent significativement aussi aux charges globales de glyphosate et d'AMPA dans les eaux de surface. L'AMPA a été trouvé dans deux aquifères karstiques, sur quatorze testés[92]. Dans les eaux souterraines, son métabolite, l'AMPA, a été détecté à des concentrations supérieurs à 0,1 μg/l, exigence de la Loi fédérale sur la protection des eaux (LOEaux), dans deux stations de mesure lors de relevés effectués avant 2014, publiés dans un rapport du gouvernement en 2019[106]. L'évolution de cette contamination n'a pas été documentée depuis.
Au Québec, après pulvérisation en sylviculture, on n'en a pas trouvé (seuil de détection de 1,0 µg/L) dans huit cours d'eau protégés par une zone tampon de 30 m. On en a trouvé en revanche dans deux échantillons provenant de fossés (16,9 µg/L au max.)[107]. Des zones tampons de 3 m sont inefficaces entre les champs et cours d'eau. Dans les étangs ayant reçu une pulvérisation directe, le taux était de 2 800 µg/L dans l'eau juste après la pulvérisation, mais chutait à 288 µg/L 24 h plus tard. Des études ont porté sur son adsorption dans la zone insaturée d'un aquifère sédimentaire[108] ou sur le continent[107], mais sa cinétique dans ces sédiments ou dans l'eau interstitielle des sédiments semble peu étudiée.
En 2005, du glyphosate ou ses produits de dégradation est (sont) retrouvé(s) dans certains sédiments marins[109].
En 2006, selon l'IFEN le glyphosate et l'AMPA étaient les substances les plus retrouvées dans les eaux en France[110], sans surprise car le glyphosate est l'herbicide le plus vendu en France ; par ailleurs, l’AMPA est aussi le résidu de dégradation d’autres substances présentes dans les formulations d'autres produits utilisés en milieux industriels ou domestiques[111],[112]. La distinction de la source de l'AMPA dans les eaux de surface et la nappe phréatique ne peut pas être faite directement[112]
Protection de captages ; Bandes enherbées ou boisées[modifier | modifier le code]
Alors que la teneur des eaux en glyphosate continuait rapidement à croître dans le monde, de nombreuses législations (nord-américaines et européennes notamment) ont cherché à protéger les eaux superficielles des pesticides et engrais en imposant des bandes enherbées sur les berges proches des cultures ; ces bandes peuvent aussi être des ripisylves artificielles en Amérique du Nord. Elles sont alors généralement constituées de saules choisis pour leur croissance rapide et leur aptitude à épurer l'eau (et leur facilité de valorisation en bois énergie). Autour des captages, les épandages sont en outre interdits en périmètre rapproché.
En 2017, les zones-tampons végétalisées doivent au Québec mesurer au moins 3 mètres de largeur[113].
Leur efficacité sur le glyphosate n'avait pas été mesurée[113]. Une étude récente l'a évaluée pour des bandes enherbées ou plantées de saules (Salix miyabeana) en matière d'atténuation du lessivage du glyphosate agricole (mais aussi de son principal produit de dégradation l'AMBA). Les bandes de saules ont été testées en faible et forte densité (avec 33 333 et 55 556 tiges par hectare) et dans deux contextes de trophie du sol (sol riche en matière organique comparé à un sol au contraire très minéral)[113]. L'eau de ruissellement et l'eau interstitielle ont été analysées (avec des lysimètres à 35 cm et 70 cm de profondeur). Alors que ces bandes ont montré par ailleurs des effets positifs pour d'autres polluants d'origine agricole (plus de 50 à 60 % des phosphates et nitrates[114]), cette étude a montré qu'elles n'ont pas d'effets significatifs sur le glyphosate ni sur les transferts d'AMPA vers les cours d'eau (peut être parce que les racines de saules ou des végétaux spontanés restaurent et décolmatent les anciens sols agricoles labourés en y restaurant les transferts horizontaux et verticaux). Le glyphosate persiste dans et sous ces bandes végétalisées, et paradoxalement, elles ont même accéléré son transfert (et celui d'AMPA) vers les eaux souterraines. Dans le sol superficiel, le glyphosate y est moins présent côté berge, mais seulement avec une réduction de 27 à 54 %[113]. La densité des tiges de saules n'a pas eu d'effet sur les transferts de glyphosate. Pour ce cas d'étude, après pulvérisation de l'herbicide de plein champ à base de glyphosate, ce dernier est retrouvé dans les 20 premiers centimètres du sol à une dose moyenne de 210 μg/kg de sol sec, allant de doses non détectables à 317 μg/kg de sol sec)[113].
Circulation via les aérosols, l'air et la pluie[modifier | modifier le code]
Sa faible pression de vapeur saturante (inférieure à 10−5 Pa à 25 °C)[115] le rend peu soluble dans l'air. Mais il peut y être présent sous forme d'aérosol ou fixé sur des poussières issues de sol poudreux et sec traité. Dans certaines conditions il peut aussi y être pour partie dégradée par photodécomposition sous l'effet des ultraviolets solaires.
Le glyphosate a donc d'abord été considéré très peu volatil dans l'air ; et son impact en termes de pollution atmosphérique et sa présence aérienne ont été longtemps supposés négligeables. Il ne concernait, pensait-on, que principalement et localement les aérosols provenant des dispositifs d'épandages. Les fiches de sécurité n'exigent d'ailleurs pas d'appareil de protection respiratoire, ce qui n'est pas le cas de tous les pesticides, y compris autorisés en agriculture biologique[116],[117].
En 2011, une étude[118] s'est pour la première fois intéressée à la présence et au devenir du glyphosate et de son premier produit de dégradation (l'AMPA) dans l'atmosphère et dans la pluie en Amérique du Nord. Elle a révélé que ces deux molécules étaient bien présentes dans l'air (et par suite dans les pluies). Les chercheurs ont échantillonné de l'air et des pluies, hebdomadairement durant deux saisons (2007-2008) de croissance des végétaux dans des zones agricoles du Mississippi et de l'Iowa. Ils avaient aussi échantillonné des pluies dans l'Indiana (en 2004 et uniquement durant la saison de croissance des plantes) lors d'une phase préliminaire de l'étude. Leurs analyses ont montré une fréquence de détection du glyphosate variant de 60 à 100 % (à la fois dans l'air et à la pluie). Le taux de glyphosate dans l'air variait de moins de 0,01 à 9,1 ng/m3 dans l'air, mais de 0,1 à 2,5 μg/L dans la pluie[118]. Dans l'air, la fréquence de détection et de concentrations médiane et maximale de ce produit (glyphosate) était comparable voire supérieure à celles des autres herbicides les plus utilisés dans le bassin du fleuve Mississippi, mais sa concentration dans l'eau de pluie était plus élevée que celle des autres herbicides (a priori en raison de sa forte solubilisation dans l'eau)[118]. Les auteurs ne disposaient pas du tonnage épandu (ni des quantités introduites dans l'air) dans les zones d'étude, mais ils ont estimé d'après leurs analyses que jusqu'à 0,7 % du tonnage appliqué sur les plantes est extrait de l'air via la pluie (avec des variations selon la pluviométrie)[118]. En moyenne 97 % du glyphosate dispersé dans l'air serait ainsi éliminé par une pluie hebdomadaire de 30 mm, par contre il est alors au moins en partie réintroduit dans les milieux aquatiques, cours d'eau et leurs sédiments (où des études antérieures l'avaient déjà retrouvé[119] alors qu'il était supposé fixé et rapidement inactivé dans les sols[120] et où il met plus de temps à se dégrader[121]).
Écotoxicologie[modifier | modifier le code]
Alors que les tonnages utilisés en agriculture ont fortement augmenté dans le monde depuis le milieu des années 1990 (avec les cultures transgéniques notamment), en tant que désherbant et aux doses où il est actif, le glyphosate affecte nécessairement des espèces de végétaux non ciblés qui en reçoivent accidentellement. Le mécanisme actif de ce désherbant mis en avant par ses fabricants le blocage d'un enzyme vital de la voie de l’acide shikimique (l'EPSPS), enzyme qui n'existe que chez les plantes (et de nombreux micro-organismes), mais pas chez les animaux ; ceci a conduit à supposer qu'il est peu toxique pour les animaux reptiles, amphibiens, mammifères, insectes. Mais des recherches de 2016 font craindre que, via d'autres mécanismes, il soit plus nocif qu'on le pensait pour la faune (et les humains)[122],[80].
- Le glyphosate ingéré par le bétail affecte leur microbiote en inhibant le développement de bonnes bactéries (productrice d'acide lactique), au profit d'un développement de Clostridium botulinum, responsable du botulisme ; une maladie en augmentation chez les vaches laitières depuis la fin des années 1990[123].
- Le glyphosate est un excellent agent chélateur. Or les chélateurs sont connus pour augmenter la biodisponibilité de métalloïdes tel que l'arsenic. Le mélange glyphosate-arsenic montre une toxicité synergique pour le nématode Caenorhabditis elegans[124], ou de métaux lourds tels que plomb, cadmium… ; ils contribuent à (re)mobiliser des ions toxiques antérieurement plus ou moins piégés dans le sol[125], et qu'ils peuvent alors transporter dans la plante (laquelle peut ensuite contaminer l'écosystème).
- les chélateurs peuvent aussi parfois faciliter la contamination d'animaux fouisseurs tels que les vers de terre et de leurs prédateurs, via le réseau trophique. Le glyphosate est un bon chélateur[126], et en 2018, on ignorait encore dans quelle mesure les racines des plantes peuvent ou non bloquer le passage des métaux toxiques qu'il peut transporter (il faut qu'un fractionnement complexe se fasse dans la rhizosphère (Neumann et Römheld 2007) avant que la racine ne puisse absorber le métal)[126]. On ignore encore aussi si ce chélateur pourrait ou non limiter l'accès à certains oligoéléments pour les organismes du sol et les plantes[126].
Par définition, tout désherbant utilisé à grande échelle a un impact local sur la flore qui y est exposée (au moins aux doses actives du produit). Quelques études laissent suspecter (ou ont confirmé) une écotoxicité significative, prégnante à large échelle géographique sur divers groupes d'espèces ou d'habitats, à diverses doses :
- Dans les zones de grandes cultures et de culture transgéniques, les taux de glyphosate mesurés dans les eaux de surface atteignent parfois des niveaux préoccupants, dans le midwest américain notamment[127], mais aussi au Canada (par exemple, pour cinq cents analyses faites dans les cours d'eau en deux ans dans le sud de l'Ontario, le taux de glyphosate a atteint 40,8 μg/L, sans dépasser la dose de 65 μg/L alors considérée comme nuisant à la vie aquatique[128]). En Europe, cette molécule est moins utilisée qu'en Amérique, mais néanmoins presque omniprésente. Ainsi, en 2010 en Espagne, après des traitements ciblant Arundo donax, de 20 à 60 μg/L de glyphosate était retrouvé dans la rivière la plus proche (Llobregat), avec des pics de 137 μg/L dans l'eau après trois jours, et des teneurs dans l'eau interstitielle des berges de 20 à 85 μg/L après douze jours[129] (teneurs non retrouvées dans la rivière, mais qui pourraient poser problème pour les espèces du compartiment sous-fluvial dans les nombreux cas où il existe). Dans ce contexte (rivière dégradée et en partie urbaine) aux communautés de macroinvertébrés dominées par des espèces polluo-tolérantes, l'application de l'herbicide n'a pas modifié l'abondance ni le nombre de taxons mais des effets toxiques spécifiques et significatifs ont été observés in situ sur le crustacé d'eau douce Daphnia magna et le trichoptère Hydropsyche exocellata (inhibition de l'alimentation de D. magna et signes de stress oxydant chez les deux espèces).
- La plupart des études sur les écosystèmes aquatiques et le sol ont porté sur la toxicité directe et aiguë de la seule matière active[130],[131], omettant les effets de long terme, ou des additifs de la formulation et d'éventuelles synergies avec d'autres pesticides, polluants ou éléments naturels.
De plus, avant l'an 2000, très peu d'études avaient concerné l'influence d'apports chroniques à des doses sub-léthales (hormis quelques travaux chez un crustacé d'eau douce (daphnie)[132],[133] et l'exposition de la mère et du fœtus chez le rat en 2001[134] mais toujours sans études approfondies concernant les invertébrés aquatiques selon Alistock et al. (2001) alors que le glyphosate est aussi utilisé contre les espèces invasives en bord de fossés, lacs, retenues et cours d'eau ou de zones humides[135]. Sur le modèle animal Danio rerio, le glyphosate a des effets cardiovasculaires négatifs[136].
De nombreux auteurs[Qui ?] estiment qu'en raison de la toxicité des surfactants ou des synergies possibles avec d'autres produits, une écotoxicité est envisageable à des doses plus faibles que celles retenues par les études antérieures, mais l'étude de tels phénomènes nécessite du temps et des budgets importants. Les évaluations indépendantes ou mises à jour sont rendues difficiles ou impossibles par le fait que la liste complète de ces additifs (adjuvants, surfactants, coformulants…) est inconnue des scientifiques, car classée comme secret commercial par les fabricants[réf. nécessaire]. - Le glyphosate pourrait notamment réagir avec les nitrites (présents dans certains aliments, mais aussi dans les sols agricoles) pour former le N-nitroso-phosphono méthylglycine, un cancérogène possible d'après les effets qu'il a chez le rat de laboratoire[137]).
- On cherche à mieux comprendre la cinétique du glyphosate dans l'organisme des plantes[138].
Une étude de 2008 s'appuyant sur du glyphosate radiomarqué au carbone 14 pulvérisé sur une culture expérimentale de Senna obtusifolia a montré qu'il ne se répartit pas de manière homogène dans la plante[139], ce qui peut être important pour le suivi de la cinétique de ce produit dans l'organisme ou dans l'environnement, et qui pourrait expliquer certaines résistances observées, dont chez des plantes invasives à rhizomes comme l'est devenue en Floride[140] et notamment dans les Everglades la fougère Lygodium microphyllum (en)[141]. - Beaucoup d'études ne portaient que sur le zooplancton, et non sur les effets chroniques de faibles doses sur le phytoplancton (base de la pyramide alimentaire des mers et zones humides[142]. Selon une étude de 2018, le glyphosate est en Amérique du Nord devenu omniprésent dans les eaux de surface des bassins agricoles. La structure et les fonctions des communautés phytoplanctoniques en sont affectées et des effets physiologiques apparaissent à des seuils bien inférieurs à ceux de la norme canadienne. Les auteurs ajoutent que la perturbation de la voie du shikimate pourrait être utilisé comme indicateur d'exposition du phytoplancton. Après 96 h d'exposition, même la plus faible concentration de cette étude (1 μg/L) a réduit la teneur du phytoplancton en chlorophylle et en caroténoïde[142].
De faibles doses (5 et 10 μg/L) génèrent des changements dans la structure de la communauté et réduisent la diversité des principales espèces de microalgues[142]. Des taux plus élevés (50 à 1 000 μg/L) modifient la composition de la communauté phytoplanctonique et se traduisent par de nouvelles espèces dominantes (sans doute plus résistantes)[142]. À des taux encore plus élevés (500 à 1 000 μg/L) la teneur en shikimate, la peroxydation des lipides et l'activité des enzymes antioxydantes (superoxyde dismutase, catalase et ascorbate peroxydase) sont perturbés. Les auteurs alertent sur le fait que des taux de 800 μg/L d'eau actuellement retenus par les lignes directrices canadiennes pour la protection de la vie aquatique ne sont pas suffisants[142]. Une autre étude (2017) a montré que la lixiviation d'un herbicide à base de glyphosate (Factor 540) diminue la croissance et la capacité photosynthétique d'algues mais aussi des cyanobactéries dès 50 à 500 μg/L durant 48 h, selon l'espèce considérée)[143]. Les auteurs notent que toutes les espèces testées perdaient en croissance lorsqu'exposées à des taux de glyphosate inférieures à la norme canadienne pour la protection de la vie aquatique (800 μg/L) et aux normes américaines pour la toxicité aiguë chez les plantes non vasculaires (12 100 μg/L)[143]. - En 2002, il apparaît que le glyphosate a paradoxalement un effet reprotoxique sur les cotonniers transgéniques (cotonniers Gossypium hirsutum L. ‘Delta Pine & Land 5415RR’, ‘Delta Pine & Land 50’, ‘Delta Pine & Land 90’, ‘SureGrow 125RR’), génétiquement modifiés pour résister au glyphosate. Deux phénomènes ont été conjointement observés en plein champ sur ces cotonniers, quand ils ont été traités au Roundup :
- une mauvaise pollinisation[144], sachant que, normalement, le cotonnier est autofécond[145] ;
- une augmentation du taux d'avortement des capsules de cotonnier transgénique[144], ce qui cause une perte de rendement.
- Des études anatomiques ont montré un effet différé des applications de glyphosate en post-levée (en période d'anthèse (période fonctionnelle pour la reproduction de la fleur), on observe un allongement de la colonne staminale, ce qui augmente très significativement la distance entre les anthères et la pointe de l'organe femelle (stigmate réceptif)[144]. Cette distance est augmentée de 4,9 à 5,7 mm au cours de la première semaine de floraison[144] ; ce qui diminue de 42 % la quantité de pollen se déposant sur le pistil des cotonniers transgéniques, comparativement à ceux qui n'ont pas été traités[144]. De plus, le microscope électronique montre que ce pollen présente « de nombreuses anomalies morphologiques » (par rapport au pollen des mêmes cotonniers transgénique mais non traités[144]. L'irrigation influe sur ces paramètres[146] en améliorant les rendements et la qualité de la fibre, mais indépendamment du traitement ou non au glyphosate. On étudie des pistes de solution[147] ainsi que la « translocation » de glyphosate radiomarqué dans le cotonnier pour mieux comprendre ces phénomènes[148].
- Des travaux de 2013 montrent que de très fortes doses de glyphosate (supérieures à 1 000 μg/l, soit dix mille fois la norme européenne dans l'eau potable pour n'importe quel pesticide) inhibent le développement embryo-larvaire et la métamorphose de l'huître du Pacifique Magallana gigas[149]. Des effets non mortels mais significatifs sur des moules existent à des doses « environnementalement réalistes » pour la moule commune Mytilus galloprovincialis ; à ces doses, son métabolisme énergétique et son homéostasie de l'ion Ca2+ sont perturbés[150]).
- Une étude publiée en dans les comptes rendus de l'Académie des sciences américaine (PNAS)[151] montre que le glyphosate attaquerait certains éléments de la flore intestinale des abeilles, les rendant ainsi vulnérables à des infections et aux modifications de leur environnement. Ce facteur pourrait aussi « contribuer à l'accroissement largement inexpliqué de la mortalité des colonies d'abeilles »[152]. Le glyphosate a aussi des effets neurotoxiques sur les larves de moustiques[153],[154].
En 2017, aux vues des données disponibles et d'un usage multiplié par 100 en 40 ans, une étude conclu que les moyens d'évaluation utilisés par les Agences (tel que l'agence gouvernementale des États-Unis pour l'environnement en 2009) et les normes de sécurité actuelles sont obsolètes, ce qui pourrait nuire à la protection de l'environnement et de la santé publique ; ses auteurs plaident pour un monitoring amélioré de ce produit dans l'environnement et l'organisme humain, et pour une réévaluation (éco)toxicologique approfondie[7].
En 2022, un rapport scientifique établit la dangerosité de l'utilisation du glyphosate pour les colonies de bourdons en affectant leur capacité collective à réguler leur température[155],[156].
Toxicologie[modifier | modifier le code]
Au-delà de certaines doses, la toxicité aiguë des produits à base de glyphosate est incontestable et elle semble pouvoir se transmettre au niveau cellulaire à la descendance, aux générations suivantes. Cela est démontré par les empoisonnements accidentels qui peuvent entraîner une acidose métabolique[17], une défaillance de multiples organes, et éventuellement la mort[157]. À titre d'exemple, en France, les centres antipoisons ont enregistré de 2008 à 2014, 1362 cas d'ingestion de pesticide à base de glyphosate, dont 429 avec symptômes d'intoxication aiguë (dont 170 ingestions suicidaires, dont 5 ont conduit à la mort du patient). La sévérité (estimée selon le poisoning Severity Score ou PSS) était élevée pour 25 de ces cas[7].
Le degré de toxicité du glyphosate seul est débattu depuis le milieu des années 1980, notamment pour sa toxicité chronique ou à faible dose. Or, il n'est que l'un des composants des désherbants mis sur le marché, et certains de ses additifs, surfactants notamment, sont eux-mêmes très toxiques[158] et aggravent les symptômes : le POEA qui l'accompagne souvent étant réputé plus toxique que les autres surfactants et « possiblement à l'origine d'un risque accru de pneumopathie d'inhalation, voire d'œdème laryngé, à l'origine d'une gravité accrue des cas d'ingestion de pesticide à base de glyphosate »[159],[160],[27]. En 2013, une expertise collective de l'Inserm a évalué qu'il existait une « présomption moyenne » de lien entre l'exposition professionnelle au glyphosate et le développement de lymphomes non hodgkiniens[161]. En 2015, le Centre international de recherche sur le cancer de l'OMS a classé le glyphosate comme « cancérogène probable ». À l'inverse, de nombreuses agences de sécurité sanitaire dans le monde continuent de le classer comme non cancérogène[162],[163],[164],[165],[166],[167],[168],[169],[170]. L'effet carcinogène ou non du glyphosate est encore débattu dans la communauté scientifique[171]. Beaucoup d'études récentes et poussées, dont en 2003, 2008 ont conclu à un lien avec un type de cancer (cancers non hodgkinien)[172],[173]. Une méta-analyse récente (2019) trouve que les agriculteurs les plus exposés au glyphosate ont un risque accru de développer un lymphome non hodgkinien[174],[175].
Une autre méta-analyse, la même année, a comparé les utilisateurs de glyphosate avec les non-utilisateurs. Elle conclut aussi à un risque accru certains types de lymphomes non hogkiniens : les lymphomes diffus à grandes cellules B[176]. Deux autres méta-analyses publiées en 2014 et 2016, la seconde étant financée par Monsanto, ont également trouvé un lien significatif entre l'exposition d'agriculteurs au glyphosate et le lymphome non hodgkinien[176],[177],[178]. Un syndrome parkinsonien semble possible à la suite d'une ingestion de quelques dizaines de millilitres[179].
Chez les travailleurs dans les usines de production du glyphosate, il y a plus de maladies cardio-vasculaires chez les travailleurs exposés au glyphosate[180], mais le lien de cause à effet ne reste qu'une hypothèse. Des possibles effets cardiovasculaires ont aussi été signalés chez d'autres mammifères que l'Homme[181]. Il semble aussi pouvoir induire une paralysie intestinale (de l'iléon)[182].
Avis du Centre international de recherche sur le cancer (CIRC) de l'OMS[modifier | modifier le code]
Le glyphosate est classé depuis le comme « probablement cancérogène » pour l'humain (groupe 2A) par le Centre international de recherche sur le cancer (CIRC)[183],[184],[160],[185],[186],[187], au même titre que diverses substances ou aliments[188]. Cette agence de l'Organisation mondiale de la santé précise que ce classement est uniquement une estimation du danger, et que l'estimation du risque pour la population générale est du ressort des agences de sécurité sanitaire[27],[189]. Le glyphosate a ainsi été classé comme pouvant endommager l'ADN. Ce classement est fondé sur des résultats d'études conduites in vitro et in vivo[184].
Le Centre international de recherche sur le cancer évalue que les preuves sont « limitées » concernant la cancérogénicité du glyphosate chez l'humain ; un lien avec les lymphomes non hodgkiniens a été trouvé par plusieurs études, sans qu'il soit possible de conclure à une causalité claire. Il estime également que les preuves sont « suffisantes » concernant la cancérogénicité chez les animaux. De plus il note qu'il existe des preuves importantes que le glyphosate possède deux caractéristiques d'un carcinogène, qui peuvent être opérantes chez l'humain : l'exposition au glyphosate ou aux produits à base de glyphosate est génotoxique et induit un stress oxydant[184].
Avis du Groupe de travail commun sur les résidus des pesticides (JMPR) de l'Organisation mondiale de la santé (OMS) et de l'Organisation des Nations unies pour l'alimentation et l'agriculture (FAO)[modifier | modifier le code]
Le Joint FAO/WHO Meeting on Pesticide Residues (JMPR) est un groupe d'experts internationaux administré conjointement par l'OMS/WHO et la FAO qui se réunit régulièrement depuis 1963 afin d'harmoniser l'évaluation des risques liés aux résidus des pesticides[190]. Le glyphosate ou ses métabolites avaient déjà été évalués par le JMPR en 1986, 1997, 2004 et 2011. Dans son rapport de [191], le JMPR s'est penché sur la génotoxicité, carcinogénicité, reprotoxicité et toxicité sur le développement, ainsi que sur les études épidémiologiques sur la survenue de cancers. Mais Le JMPR s'est concentré sur l'ingrédient actif. Concernant le risque de lymphome non hodgkinien (LNH), le journal souligne que l'étude Agricultural Health Study (AHS) publiée en 2004 constitue la seule étude prospective. Ce type d'étude est généralement moins biaisé que les études cas-témoins qui, elles, peuvent présenter des biais de rappel ou des biais de sélection. Le JMPR note qu'une méta-analyse associant l'AHS et plusieurs études cas-témoins trouve une augmentation significative du risque de LNH de 50 % chez les utilisateurs de glyphosate par rapport aux non-utilisateurs. Le JMPR indique qu'il existe des éléments entre exposition professionnelle au glyphosate et développement de LNH mais remarque que la seule étude prospective, de bonne qualité, ne trouve pas de tel lien.
Considérant l'absence de potentiel carcinogénique chez les rongeurs à des doses pertinentes pour l'homme, et l'absence de génotoxicité par la voie orale chez les mammifères, le JMPR a conclu qu'il est improbable que le glyphosate pose un problème de carcinogénicité par voie alimentaire chez les humains.
Avis des agences internationales, nationales et régionales de sécurité sanitaire ou alimentaire[modifier | modifier le code]
La question de la toxicité du glyphosate et des produits composés avec le glyphosate tels que le Roundup est débattue depuis les années 1980. De nombreuses agences chargées d'évaluer les effets sanitaires et environnementaux de ces produits estimaient avant 2015 que le glyphosate ne posait pas de problème pour la santé humaine[192],[193] :
- L'Agence européenne des produits chimiques ne le considère ni cancérogène, ni génotoxique, ni reprotoxique le [194]. Elle confirme cette évaluation dans un avis publié le [195],[196]. Elle renouvelle sa position en 2023, indiquant que « le glyphosate n’est pas dangereux au point de devoir être interdit » et empêcherait son renouvellement d'autorisation au sein de l'Union européenne[197].
- Le , l'Autorité européenne de sécurité des aliments (AESA) a estimé qu'il était improbable que le glyphosate présente un danger cancérogène pour l'homme[198],[199],[200], mais cette évaluation n'a porté que sur le glyphosate seul, alors qu'il est toujours utilisé avec des additifs dont certains ont une toxicité reconnue[7].
- Le , l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail considère le niveau de preuve de cancérogénicité chez l'animal et génotoxicité relativement limité[201]. Elle considère qu'il est peu probable que le glyphosate ait un effet de perturbateur endocrinien.
- L'Office fédéral suisse de la sécurité alimentaire et des affaires vétérinaires et l'Office fédéral de l'agriculture observent le que « le CIRC ne disposait pas de nouvelles études reconnues au plan international pour sa décision de reclassifier le glyphosate comme carcinogène », et réitèrent qu'ils « considèrent que les résidus de glyphosate provenant de l'utilisation de ce produit comme produit phytosanitaire sont inoffensifs pour la population », dans l'attente de l'examen du rapport complet du CIRC[202],[165]. Le , l'OFAG confirme cette position, s'appuyant notamment sur les conclusions de l'Autorité européenne de sécurité des aliments, de l'Agence européenne des produits chimiques et du comité joint FAO/OMS[166].
- Le rapport d’évaluation du glyphosate présenté le par l'Institut fédéral allemand d'évaluation des risques allemand (BfR) ne montre pas de cancérogénicité, ni de propriété mutagène, ni de toxicité quant à la fertilité, la reproduction ou le développement fœtal[203].
- L'Office californien d'évaluation des risques pour la santé environnementale (en) (OEHHA) a inscrit en le glyphosate comme substance causant des cancers chez l'homme[204] à la suite du classement du CIRC, compte tenu d'une loi de l'État de Californie qui demande que les substances identifiées comme cancérigènes par le CIRC soient listées comme telles après une période de consultation publique[205].
- Santé Canada considère le glyphosate comme non génotoxique et peu probablement cancérogène le [206] et le [207].
- L'Autorité australienne des pesticides et des médicaments à usage vétérinaire conclut que le glyphosate ne pose pas un risque cancérogène pour l'humain et qu'il n'y a pas de base scientifique pour reconsidérer le glyphosate et les produits qui en contiennent en [169].
- L'Autorité de protection environnementale néo-zélandaise considère qu'il est peu probable que le glyphosate soit cancérogène ou génotoxique chez l'humain[208] en . L'AESA renouvelle par ailleurs ses conclusions le [209].
- En 2015, le Sri Lanka interdit l'importation de glyphosate. Cette décision s'appuie sur une étude publiée en 2014 par des scientifiques srilankais[210]. Cette étude établissait un lien entre une maladie des reins et la consommation d'eau dans des puits abandonnés ainsi qu'à la pulvérisation dans les rizières de glyphosate et autres pesticides sans protection[211]. L'Académie des sciences du Sri Lanka indique qu'il n'y a pas de preuve scientifique d'un lien entre le glyphosate et la maladies des reins[212]. En , le gouvernement lève cette interdiction partiellement pour 36 mois, mais uniquement pour le thé et l'hévéa. Le bureau d'enregistrement des pesticides srilankais annule l'interdiction pour toutes les cultures le [213] mais, n'en ayant pas le pouvoir, la décision n'est pas actée[214]. Les pertes économiques annuelles liées à l'interdiction du glyphosate sont estimées à quinze à vingt milliards de roupies[213].
Documents internes de l'entreprise Monsanto[modifier | modifier le code]
Des documents déclassifiés par la justice américaine en mars 2017 montrent que, dès 1999, l'entreprise Monsanto « s'inquiétait sérieusement […] du potentiel mutagène du glyphosate », sans cependant modifier son discours officiel sur l'innocuité de la molécule[215]. Au-delà des effets du glyphosate, Monsanto évite de faire des études sur les effets de la formulation finale (le Roundup par exemple). En 2003, l'entreprise reconnaissait en interne ne pas avoir fait de test de cancérogénicité sur son produit phare[216]. En mars 2002, les autorités néerlandaises demandent à Monsanto de réaliser des tests de pénétration à travers la peau d'un produit à base de glyphosate. Monsanto la réalise mais décide de l'arrêter prématurément car les résultats risquaient de dépasser les seuils de l'autorité allemande[216].
Dose létale médiane[modifier | modifier le code]
La dose létale médiane (DL50) du glyphosate pur se situe à environ 1 % du poids corporel[217].
Absorption du glyphosate par les humains et autres mammifères[modifier | modifier le code]
Les études[218] sur des animaux de laboratoire ont montré[219] que le glyphosate ingéré se retrouvait dans les urines pour 15 à 40 % de la dose ingérée. Quant à son premier sous-produit de dégradation (l'acide aminométhylphosphonique ou AMPA), il est absorbé à environ 20 % de la dose ingérée. En revanche, chez les êtres humains, le taux retrouvé dans les urines est très inférieur, autour de 1%[220],[221].
Une autre étude[222] a montré chez des singes que l'absorption cutanée d'une préparation de glyphosate était faible (2 % après sept jours d'application locale). Mais le passage transcutané peut varier selon les espèces, les conditions (transpiration) et l'âge (chez l'humain, la peau des enfants est par exemple beaucoup plus perméable). Une dose ingérée (ou injectée par voie intrapéritonéale), unique ou répétée durant douze jours, est éliminée en grande partie via l'urine, essentiellement sous une forme non dégradée, bien que l'on trouve aussi de petites quantités d'AMPA. L'excrétion biliaire et la circulation entéro-hépatique sont quantitativement minimes après cent-vingt heures. Une dose unique de glyphosate était éliminée à 94 % dans les urines, chez les mâles et les femelles (0,1 % seulement d'une dose étant éliminée sous la forme de dioxyde de carbone marqué 22), en condition de laboratoire (animaux peu mobiles, non malades, non exposés aux aléas climatiques, etc.). L'ingestion quotidienne de glyphosate durant deux semaines se traduit par des concentrations tissulaires maximales au sixième jour d'administration. Les concentrations les plus fortes étant mesurées dans les reins (inférieures à 1 ppm), puis de manière décroissante dans la rate, les tissus adipeux, le foie, les ovaires, le cœur et les muscles, les résidus diminuant progressivement après que l'animal a cessé d'ingérer le produit, les concentrations rénales étant de 0,1 ppm après dix jours [réf. nécessaire].
Effet sur le fœtus (tératogénicité, avortement)[modifier | modifier le code]
Dans les années 2010 et sur le modèle animal l'exposition in utero au glyphosate (avec ou sans ses additifs) a été associée à des effets tératogènes (malformations congénitales) et à des pertes fœtales (chez des poulets, grenouilles et mammifères utilisés comme animaux de laboratoire[223],[224],[225]). Ces études ont suggéré de possibles effets tératogènes (cœurs dilatés et anomalies viscérales), de toxicité fœtale (pertes post-implantation chez les rates, mortalité embryonnaires tardive du fœtus de lapin, à des doses relativement faibles comme 20 mg/kg et par jour dans l'alimentation) et de perturbation hormonale (de la signalisation de l'acide rétinoïque et de la biosynthèse des œstrogènes[225]). Des lésions de l'ADN et cassures chromosomiques ont été signalées chez la souris (in vitro et in vivo) exposée à une formulation de glyphosate[226]. Les études exposaient généralement les fœtus animaux à des doses plus élevées que celles qui concernent habituellement le fœtus humain.
Des perturbations enzymatiques ont aussi été suspectées ou mises en évidence sur des cultures de cellules humaines (perturbation du cytochrome P450, de la structure de l'ADN dans les cellules épithéliales et placentaires mammaires humaines[227],[228],[229]).
En 2016-17, malgré ces indices, les éventuels effets sur la grossesse humaine et le développement fœtal humain n'avaient été que très peu étudiés. Une revue systématique (2016) n'a trouvé que 10 études ayant testé une éventuelle association entre des marqueurs indirects d'exposition au glyphosate et des effets adverses sur la grossesse[230], dont une seule avait mis en évidence un risque accru d'avortement spontané (lors des semaines 12 à 19) chez des femmes vivant dans des fermes de l'Ontario. Les marqueurs d'exposition étaient indirects, ou divers biais pouvaient entacher ces études.
Une étude récente[231] (2018) a porté sur un panel de 71 femmes enceintes américaines (âge moyen : 29 ans) de la région du Midwest où, à cause des cultures de maïs et de soja (souvent transgéniques), des taux élevés de glyphosate sont retrouvés dans les fossés, cours d'eau et lacs[232],[233],[234] et à dose plus faible jusque dans la nourriture[235],[234] et l'eau du robinet[233]. C'est la première étude basée sur les teneurs urinaires en glyphosate (qui reflètent l'exposition directe des femmes enceintes). L'étude n'a pas montré de corrélation entre les teneurs en glyphosate des urines pendant la grossesse et le poids de l'enfant à la naissance ou la circonférence de sa tête. En revanche les femmes dont l'urine contenait le plus de glyphosate avaient une durée de gestation plus courte[231]. Les auteurs signalent que leur cohorte était régionale et principalement constituée de femmes blanches de type europoïde (caucasien), ce qui peut être source de biais de sélection. Ils jugent néanmoins qu'elle a fourni des preuves directes de l'exposition de mères au glyphosate, et concluent à une corrélation significative avec une durée de grossesse raccourcie[231]. Ils encouragent des études plus poussées dans une cohorte plus importante en nombre, et plus diversifiée géographiquement et ethniquement[231].
Études concernant les effets cancérigènes ou mutagènes[modifier | modifier le code]
Une étude démontre que différents herbicides à base de glyphosate perturbent le cycle des divisions cellulaires chez l'embryon d'oursin. Selon les auteurs de cette étude, ce sont des effets qui peuvent provoquer des cancers ; ils concluent au caractère potentiellement cancérigène des herbicides testés[236].
Une étude de l'université Caen-Normandie, publiée dans Chemical Research in Toxicology fin , met en évidence l'impact de diverses formulations et constituants de ce pesticide sur des lignées cellulaires humaines (cellules néonatales issues de sang de cordon, des cellules placentaires et de rein d'embryon). Les auteurs signalent diverses atteintes de ces cellules (nécrose, asphyxie, dégradation de l'ADN, etc.), induites soit par le glyphosate, soit par un produit de sa dégradation (AMPA), soit par un adjuvant (POEA, toxique) qui facilite son incorporation par les plantes cibles, soit par des formulations commerciales de l'herbicide[237],[238].
Cette étude a été critiquée par la communauté scientifique. L'Agence française de sécurité sanitaire des aliments a notamment mis en évidence trois problèmes méthodologiques[239] :
- Les lignées de cellules cancéreuses ou transformées utilisées pour les essais sont peu représentatives d'une cellule normale. Il est facile d'obtenir des effets cytotoxiques et des apoptoses sur ce type de lignée, comme c'est le cas avec des extraits de stevia[240], de Melia azedarach[241] ou encore de Piéride de la rave[242] sans que cela ne soulève d'enjeux de sûreté.
- Les cellules ont été soumises à un pH 5,8 sans solution tampon pendant 24 heures, ce qui permet non pas d'observer l'effet du glyphosate, mais plus vraisemblablement l'effet d'une solution acide et hypotonique sur des cellules. Les cellules animales supportent un pH entre 7,4 et 6,8 et ont besoin d'un environnement ionique précis pour survivre. En l'absence de témoin, l'effet glyphosate ne peut être confirmé.
- Les observations de mortalité cellulaire ne peuvent pas être extrapolées sur le comportement de l'organisme entier. Des nombreuses substances provoquent des mortalités cellulaires locales sans être toxiques pour l'organisme entier, c'est notamment le cas de certains désinfectants (certains composants des collyres par exemple).
L'agence estime que « les auteurs [de l'étude] sur-interprètent leurs résultats en matière de conséquences sanitaires potentielles pour l’homme, notamment fondées sur une extrapolation in vitro-in vivo non étayée »[243]. En 2018, la même équipe mesure un effet toxique plus que modeste du Glyphosate sur des cellules de Sertoli, nécessaires à la spermatogenèse[244].
Des scientifiques argentins ont évalué les effets d'une exposition au glyphosate sur le développement d'embryons de vertébrés (les embryons étaient incubés dans une solution diluée de glyphosate). Selon les résultats de leur étude, les embryons traités présentaient de sévères anomalies[225]. Cette étude était motivée par l'observation d'une forte élévation du nombre de cancers et de malformations congénitales dans la région de Monte Maiz, en Argentine, à la suite de l'adoption de cultures OGM résistant au désherbant et à l'utilisation plus importante de celui-ci, notamment par épandage aérien[245]. Cette étude a été critiquée par le département fédéral pour la protection des consommateurs et la sécurité alimentaire allemand (BVL)[246].
Une autre étude a conclu à l'absence de « malformations dramatiques » à la suite de l'exposition d'amphibiens au glyphosate dans des conditions reproduisant une utilisation normale[247]. En revanche, d'après une synthèse de huit études sur des rongeurs, le glyphosate est toxique sur le système reproducteur des mâles : il induit une diminution de la concentration en spermatozoïdes[248].
Une étude de cohorte publiée en sur plus de 54 000 agriculteurs ne trouve pas d'association entre glyphosate et cancer d'une manière générale, mais « suggère un doublement du risque de leucémie myéloïde aiguë chez les plus gros utilisateurs »[249],[250] (le tiers des utilisateurs les plus exposés, avec un recul de vingt ans, présente un risque augmenté de +5 % à +297 %). Une première version de cette étude avait été prise en compte par le CIRC dans son avis de 2015. Selon Le Monde, les Monsanto papers font apparaître que les scientifiques de Monsanto considéraient cette étude comme « fortement biaisée »[250].
D'après une synthèse de la littérature scientifique, l'AMPA semble avoir un effet génotoxique[171]. D'autre part, d'après cette même synthèse, l'exposition au glyphosate peut affecter le microbiote humain, conduisant à des inflammations, qui peuvent être une autre manière de conduire à la carcinogénicité du produit[171].
Parue en avril 2021, une nouvelle étude confirme les dommages du glyphosate sur l'ADN[251].
Controverse sur les conditions d'élaboration de l'avis du CIRC[modifier | modifier le code]
Selon Reuters, la comparaison d'un brouillon auquel ils ont eu accès et du rapport final du CIRC montre que plusieurs passages qui entraient en contradiction avec la conclusion finale ont été modifiés ou supprimés au cours du processus de délibération, puis de rédaction. L'agence de presse estime aussi que contrairement à d'autres agences d'évaluation, le CIRC documente très peu son processus d'analyse[252]. Des données en faveur et en défaveur de l'hypothèse de la nature cancérigène du glyphosate, dont disposait Aaron Blair, qui présidait le comité d'évaluation du CIRC, n'ont pas été prises en compte car elles n'étaient pas publiées au moment de l'évaluation[253],[254]. Des accusations de conflit d'intérêts ont par ailleurs été portées à l'encontre de Christopher Portier, toxicologue invité par le CIRC à assister à la réunion qui a conduit au classement du glyphosate comme probablement cancérigène. Ce chercheur a en effet signé un contrat avec une société juridique qui défendait des personnes atteintes de cancer, peu après le classement du CIRC ; il conseillait déjà cette société au moment de l'évaluation du CIRC, mais selon lui sur une affaire différente[255],[256]. Le Monde estime que ces accusations s'intègrent dans le cadre d'une « campagne de dénigrement » contre ce chercheur[257]. Un observateur de Monsanto, également invité à assister à la réunion, écrit dans un mémo daté de que « La réunion s'est déroulée en conformité avec les procédures du CIRC. Le Dr Kurt Straif, le directeur des monographies, a une connaissance intime des règles en vigueur et a insisté pour qu'elles soient respectées »[257]. Le CIRC explique par ailleurs que le caractère possiblement non neutre du Dr Portier était connu par les membres du CIRC en raison de son engagement auprès d'une association luttant contre les pesticides, l'Environmental Defense Fund[257], si bien qu'il n'a pas pu « participer aux discussions ayant conduit à l'évaluation [du glyphosate] » et donc influencer la décision des experts[257]. Les accusateurs de Portier affirment qu'il s'était engagé à cacher ses liens avec l'entreprise juridique, mais, selon Le Monde, « la réalité est tout autre ». Il n'était pas supposé divulguer le contenu de son travail, mais pouvait faire mention de ses liens avec l'entreprise, ce qu'il a fait à plusieurs reprises, dans un article signé avec d'autres scientifiques[258], dans une lettre adressée à la Commission européenne[259], et en préambule d'une audition auprès du Parlement européen[257]. Le quotidien d'information économique Les Échos présente également Christopher Portier comme un « simple observateur » et accuse Monsanto de se livrer à « une véritable campagne de désinformation » depuis 1984 pour éviter que son produit soit classé comme cancérogène[260].
Depuis la classification du CIRC, Monsanto a dépensé 16 à 17 millions de dollars en relations publiques pour défendre le glyphosate, d'après un ancien responsable de la communication de la firme[261].
Le deux membres républicains du Comité sur la science, l'espace et la technologie de la Chambre des représentants des États-Unis, Lamar S. Smith (président du Comité) et Andy Biggs (membre du Comité et président du sous-comité à l'environnement[262],[263]), adressent une lettre au directeur du Centre international de recherche sur le cancer (CIRC). Dans ce courrier ils remettent en cause l'intégrité scientifique de l'évaluation du glyphosate[264],[265]. Parallèlement, le Comité envoie une lettre au département de la Santé et des Services sociaux des États-Unis pour savoir dans quelle mesure des membres de ce département sont impliqués dans le processus ayant conduit à la publication de la monographie du CIRC[266],[267].
Contrairement à ce qui se dit souvent, le CIRC s'est aussi basé sur des études faites par les fabricants dont un qui le considérait potentiellement cancérigène[268].
Controverse sur les conditions d'élaboration de l'avis de l'AESA[modifier | modifier le code]
L'AESA explique sa conclusion contraire à celle du CIRC par la prise en compte d'un certain nombre d'études non évaluées par ce dernier[198],[199]. En effet, l'AESA, à la différence du CIRC, a pris en compte des études confidentielles réalisées par les industriels. Cela explique en partie les différences d'interprétation[269],[270]. Ainsi, la décision de l'AESA est essentiellement basée sur les conclusions de l'entreprise qui le fabrique, Monsanto[71]. C'est aussi le cas pour le CIRC qui a considéré 7 études dont 6 des fabricants et seule une étude d'un industriel émettait des soupçons sur la cancérogénité du glyphosate[268]. En revanche l'AESA n'a pas pris en compte une étude académique montrant que le glyphosate était cancérigène chez des souris car celles-ci auraient été victimes d'une infection ayant causé leur cancer[71]. Cette hypothèse n'est pas mentionnée dans l'étude mais a été suggérée lors d'une réunion, par une personne de l'agence américaine de protection de l'environnement, ayant des liens avec Monsanto[71]. L'AESA a affirmé avoir vérifié les affirmations de cette personne, mais une ONG a fait une demande d'information qui n'a pas permis d'en retrouver trace[71]. L'AESA indique par ailleurs dans un communiqué de presse en réponse à ces accusations que l'hypothèse avait été formulée bien avant cette réunion[271]. L'Agence européenne des produits chimiques affirme qu'il n'y a pas lieu de suspecter une infection[71]. Par ailleurs, des soupçons de conflit d'intérêts existent sur la décision de l'AESA car 82 % des experts ayant participé à l'évaluation ne sont pas connus nommément. À l'inverse, tous les experts du CIRC sont connus[269].
Des passages importants du rapport de l'AESA réévaluant le glyphosate ont été directement copiés mot pour mot du dossier soumis par Monsanto[272]. Ces passages concernent principalement l'évaluation des études indépendantes portant sur le glyphosate. Si l'évaluation est négative, elle peut être écartée de l'analyse. Or la quasi-totalité des études montrant un effet délétère du glyphosate sont déclarées non fiables[272]. Les quarante pages du chapitre sur la génotoxicité du glyphosate sont presque entièrement copiées du dossier de Monsanto[272]. L'AESA affirme néanmoins qu'elle a évalué les études soumises par les industriels et les études indépendantes de manière indépendante[272].
Le rapport préliminaire européen (RAR, pour « Renewal Assessment Report ») rendu public en juin 2021 conclut que le glyphosate n'est ni cancérogène, ni mutagène, ni reprotoxique, ni perturbateur endocrinien, contrairement à l’expertise collective de l'Inserm. L'association Générations futures explique cette différence par l'exclusion par les experts européens de l'immense majorité de la littérature scientifique, jugée non fiable par le RAR, alors que les études fournies par les fabricants de pesticides sont évaluées plus favorablement[273].
Controverse sur les conditions d'élaboration de l'avis du Bundesinstitut für Risikobewerbung (BfR)[modifier | modifier le code]
Début 2019, un rapport commandité par des députés européens et révélé en France par le journaliste spécialisé Stéphane Foucart montre que le rapport du BfR, qui a principalement motivé la décision de l'Europe fin 2017 de renouveler pour cinq ans l'autorisation de l'herbicide, est très largement plagié de documents de la Glyphosate Task Force de Monsanto ; les auteurs du rapport expliquent ce qui distingue le copié-collé bénin du plagiat : selon eux une volonté délibérée de cacher l'origine des propos plagiés[274]. Dans un document de questions/réponses en date du [275], le BfR rejette l'ensemble des accusations qui lui ont été faites.
Programme de communication « Ne rien laisser passer »[modifier | modifier le code]
Le Monde décrit le programme « Ne rien laisser passer » (en anglais, « Let nothing go »), mis en œuvre en Europe par la société de relations publiques américaines Fleishman-Hillard en , peu après la classification du glyphosate comme cancérogène probable par le CIRC. Ce programme a pour objectif la publication dans la presse et sur les réseaux sociaux de contenus positifs sur le glyphosate. D'après Le Monde, Monsanto cherche à « organiser la confusion entre la défense de ses produits et la défense de l'esprit de la science », alors que l'un des toxicologues de Monsanto écrivait en 2001 :
« les données produites par les scientifiques du monde académique ont toujours été une source d’inquiétude majeure pour la défense de nos produits[276]. »
Bactéries et antibiorésistance[modifier | modifier le code]
D'après une synthèse de plusieurs études sur le sujet publiée en 2018, l'utilisation de glyphosate induit une modification du microbiote à la fois dans le sol mais aussi chez les animaux. En particulier, il tend à favoriser des bactéries pathogènes telles que les salmonelles ou Clostridium ce qui conduit à des impacts importants pour la santé des plantes, des animaux et des humains[277]. Ces effets indirects du glyphosate ne sont pas pris en compte par les agences réglementaires[277]. La voie métabolique de l'acide shikimique, inhibée par le glyphosate, est importante pour les bactéries probiotiques qui sont une source importante de l'acide folique. Or l'effet génotoxique ou carcinogène d'une déficience en acide folique chez les humains est connu[171].
Selon une étude publiée[278] en 2015 par la revue mBio, des herbicides chimiques, et notamment le glyphosate, en présence de certains antibiotiques peuvent favoriser des phénomènes d’antibiorésistances (dont éventuellement chez des pathogènes alimentaires)[279].
Alors que les phénomènes d'antibiorésistance deviennent préoccupants dans le monde[280], d'autant que l'antibiorésistance s'accompagne souvent d'une résistance accrue à d'autres produits chimiques toxiques, ce qui favorise la prolifération de souches résistantes dans les environnements pollués[281], un tel phénomène avait déjà été décrit lors de l'exposition expérimentale de bactéries à divers biocides[282],[283], et de manière plus surprenante à l’acide salicylique (or cet acide présente certaines similitudes avec certains herbicides)[284],[285],[286],[287],[288]. Escherichia coli et la salmonelle (Salmonella typhimurium) ont toutes deux été exposées à plusieurs dosages de cinq antibiotiques, en présence ou non de trois herbicides communément utilisés : du glyphosate ainsi que du dicamba et du 2,4-D. Dans les trois cas, la présence de l’herbicide a significativement modifié (soit en l’augmentant, soit en la diminuant) l’efficacité (concentration minimale d’inhibition) de ces antibiotiques. Dans deux cas l'étude a conclu à un risque de création d’une antibiorésistance (plus ou moins élevé selon la concentration de l’antibiotique). Selon les auteurs, ce risque reste faible dans l’alimentation où le taux maximal de résidus de pesticides autorisé est assez bas pour ne pas affecter la sensibilité de la flore intestinale aux antibiotiques, mais il est effectif aux taux d'applications utilisés lors des pulvérisations dans l'environnement (des insectes et des mammifères sauvages peuvent être exposés à des taux de pesticides suffisant pour favoriser l'antibiorésistance des bactéries qu'ils portent).
Les auteurs ont « également constaté que la concentration en herbicide nécessaire pour induire une réponse détectable aux antibiotiques était inférieure à la concentration spécifiée pour l'application de ces herbicides par les étiquettes »[278]. Ils soulignent aussi que « des expositions environnementales suffisantes se produisent donc dans les milieux urbains et agricoles, ainsi potentiellement que dans les voies navigables » ou les cours d'eau où des résidus d'antibiotiques[289] et des herbicides sont fréquemment détectés, ce qui pourrait créer des conditions permettant une réponse altérée des bactéries aux antibiotiques, induite par l'exposition à des herbicides[278]. Parmi les insectes, l'abeille domestique, dont les ruches sont prophylactiquement traitées par des antibiotiques[290], sont notamment et directement concernées[278].
L'étude a en outre révélé un effet synergique quand la bactérie est exposée à 2 différents facteurs promouvant son antibiorésistance (ex : acide salicylique + dicamba) ; les auteurs n’excluent donc pas un effet additif des diverses substances ingérées (effet que le protocole de cette étude ne prévoyait pas d’évaluer)[278]. Ils sont également préoccupés pour l’environnement dans le cas des épandages agricoles (« en présence de ces herbicides, une concentration donnée d’un antibiotique peut donc s’avérer assez élevée pour permettre l’émergence de résistances »[278], alors que les fumiers et lisiers contiennent de nombreux résidus d’antibiotiques et de manière déjà démontrée des pathogènes antibiorésistants[291] et que les taux d’herbicides qui se sont expérimentalement montrés suffisant pour modifient le MIC sont de l’ordre de celles retrouvées dans un tel environnement)[278].
Ils soulignent aussi que « les voies d'exposition sont un enjeu pour la santé humaine, des animaux domestiques, et des insectes d'intérêt »[278] (dont insectes utiles tels que les apidés pollinisateurs), et que l'effet d'antibiorésistance induit par ce type d'exposition simultanée « est plus rapide que l'effet létal des antibiotiques »[278] ajoutant que si l'antibiorésistance résulte avant tout d’un mésusage et d’un abus des antibiotiques (souvent dénoncé pour ce qui concerne l’élevage industriel notamment), cette étude confirme l’existence d’autres facteurs (des biocides utilisés pour la décontamination de la viande en abattoir avaient déjà été impliquées dans un tel phénomène mais c’est la première fois qu’il est démontré pour un désherbant très couramment et massivement utilisé dans le monde entier). Les auteurs rappellent que le glyphosate ou ses résidus sont fréquemment détectés dans le corps humain ou des organismes animaux[292], et ils alertent sur le fait que la conjonction d'une forte utilisation de certains herbicides et d'antibiotiques dans l'environnement d'animaux de ferme et d'insectes tels que les abeilles pourrait aussi compromettre leurs effets thérapeutiques et conduire à une utilisation croissante d'antibiotiques ; « Pour faire face à la crise de l'antibiorésistance, il nous faut élargir notre vision des facteurs environnementaux qui contribuent à l'évolution de la résistance »[278].
Réglementation[modifier | modifier le code]
Sur le plan de la réglementation des produits phytopharmaceutiques :
Union européenne[modifier | modifier le code]
Cette substance active est inscrite à l'annexe I de la Directive 91/414/CEE du Conseil, du 15 juillet 1991, concernant la mise sur le marché des produits phytopharmaceutiques par la directive 2001/99/CE de l'Union européenne.
Son innocuité sanitaire ou environnementale est cependant mise en doute (surtout en raison des agents de surface ou additifs qui la rendent efficace), et l'Agence européenne des produits chimiques (ECHA) devrait approfondir son étude des effets sanitaires du glyphosate mais avec des conclusions qui ne devraient pas être publiées avant la fin de l'année 2017[293]. Le renouvellement de l'autorisation de mise sur le marché par la Commission européenne (pour la période -2031) fait l'objet d'intenses discussions, avec en arrière-plan un désaccord entre l'AESA (dont l'étude a cependant exclu les additifs ou coformulants du pesticide mis sur le marché) et l'OMS quant au classement du glyphosate comme substance potentiellement cancérigène[293]. Deux jours de réunion d'experts de la commission (chef d'unité Pesticides de la DG Santé) ou envoyés par les 28 États membres n'ont en 2016 pas suffi pour parvenir à un consensus sur le sujet[293] ; ils ont souhaité un délai supplémentaire jusqu'à la prochaine réunion sur les pesticides (18-) ; l'Italie, la France, les Pays-Bas et la Suède s'opposent à la prolongation de l'autorisation, l'Allemagne s'abstenant. Si en mai, un vote à majorité qualifiée ne peut pas se faire, la commission pourrait convoquer un « comité d'appel » (qui devrait aussi trancher à la majorité qualifiée) et à défaut, c'est la Commission qui pourra directement décider[293]. La Commission a déjà suggéré l'interdiction du Polyoxyéthylène amine (POEA, un adjuvant du glyphosate) dont la toxicité et l'écotoxicité, notamment pour les poissons[294] et les anoures (crapauds, grenouilles, etc.)[295], est maintenant indiscutable[293]. Le , l'Agence européenne des produits chimiques décide de maintenir le statut du glyphosate comme substance non cancérigène, indiquant que les données scientifiques disponibles sont insuffisantes pour affirmer le caractère cancérigène de cette substance[296]. Mais l'étude ayant abouti à cette conclusion est controversée[297],[298],[299]. Le , la Commission européenne entérine la prolongation du pesticide pour cinq ans[300]. Fin mai 2022, l'Agence européenne des produits chimiques conclut une nouvelle fois que les preuves scientifiques disponibles ne permettent pas de classer le glyphosate comme cancérogène[301]. L’autorisation du glyphosate dans l’UE, a été renouvelée en 2017 pour cinq ans puis étendue d’une année supplémentaire jusqu'à fin 2023.
Par sa décision du 20 septembre 2023, la Commission européenne a proposé de renouveler pour dix ans l'autorisation d'utilisation du glyphosate dans l'Union européenne. Désherbant largement utilisé par l'agriculture mondiale, le glyphosate est fortement soupçonné de provoquer des cancers[74],[302]. La France a décidé de s’abstenir sur le vote d'un texte qui ne correspondait à la trajectoire qu'elle avait décidée. S’il n’y a pas de majorité qualifiée, à la suite des deux votes prévus, pour soutenir la proposition, la Commission européenne pourra décider seule de prolonger l’autorisation. A contrario, il faudrait une majorité qualifiée d’États opposés au texte pour le bloquer (la majorité qualifiée est de 15 États sur 27, représentant au moins 65 % de la population européenne)[303].
Le 16 novembre 2023, la Commission européenne (l'une des deux branches exécutives de l'Union européenne) a annoncé le renouvellement de l'autorisation du glyphosate au sein de l'Union européenne, allant jusqu'aux dix prochaines années[304],[305].
Allemagne[modifier | modifier le code]
En 2019, l’Allemagne s'engage à bannir le glyphosate en 2023, même si l’Union européenne prolongeait son autorisation. Le gouvernement fédéral prévoit dès 2020 des premières limitations, avec une interdiction dans les parcs et jardins particuliers, ainsi que de premières restrictions pour les agriculteurs[306]..
En 2023, l'Allemagne est en désaccord avec la proposition de la Commission européenne de reconduire pour dix ans l’autorisation du glyphosate, herbicide controversé au sein de l’Union européenne. Dans le contrat de coalition » signé en novembre 2021 par les sociaux-démocrates, les Verts et les libéraux allemands, les signataires s'engageaient : « Nous retirerons le glyphosate du marché d’ici à la fin 2023 »[307].
France[modifier | modifier le code]
Pour la France : début 2016 cette substance active est encore autorisée dans la composition de préparations bénéficiant d'une autorisation de mise sur le marché ; et utilisée à raison d'environ 9 100 tonnes/an, selon l'INRA d'après la « Base nationale des ventes des distributeurs »[308], mais l'ANSES a retiré l'autorisation de 132 produits associant le glyphosate à l'adjuvant POE-Tallowamine.
Plan de sortie du glyphosate[modifier | modifier le code]
2017 : Le , le gouvernement d'Édouard Philippe, par l'intermédiaire de Nicolas Hulot, via une annonce de Christophe Castaner, porte-parole du gouvernement, s'engage à ce que le glyphosate soit interdit en France avant 2022[réf. souhaitée]. En , 54 députés de la majorité LREM plaident dans une tribune pour l'interdiction la plus rapide possible du glyphosate[309]. Dans le même temps, le ministre de la Transition écologique Nicolas Hulot propose « un renouvellement limité à trois ans » de l'autorisation du glyphosate pour toute l'Europe[310]. Emmanuel Macron souhaite qu'on lui propose des alternatives avant trois ans ; le , l'Inra, saisi par plusieurs ministres[311] rend un rapport « Usages et alternatives au glyphosate dans l'agriculture française »[312] proposant des alternatives, dont les incidences économiques et organisationnelles ont été évaluées, suggérant des mesures d'accompagnement de l'abandon du glyphosate[308].
Ces propositions suscitent une polémique avec le principal syndicat agricole, la Fédération nationale des syndicats d'exploitants agricoles (FNSEA). Sa présidente Christiane Lambert demande depuis le début de la polémique sur le glyphosate que la France se conforme à la décision européenne. Elle veut une interdiction en 2022 plutôt qu'en 2020, estimant qu'une interdiction unilatérale réduirait la compétitivité des agriculteurs français face aux autres pays européens[313]. Elle appelle le politique à se conformer au scientifique et à donner du temps pour une clarification du classement toxicologique du glyphosate, les conditions d'utilisation et une solution équivalente du désherbage au glyphosate[314].
2018 : l'association ATMO Grand-Est dose le glyphosate dans l'air de la région, qui regroupe l'Alsace, la Lorraine et la Champagne-Ardenne[315].
Un premier « plan de sortie du glyphosate » visait –25 % en 2020, et –50 % en 2025, et fin des principaux usages du glyphosate avant 2021 ou 2025. Il est confié à une « Task Force » associant deux ministères (Agriculture, Environnement) à l'Inra et aux fabricants (ACTA, APCA), présidée par un préfet coordinateur (Pierre-Étienne Bisch, nommé le ). Un plan d'actions plus général, sur les produits phytopharmaceutiques et une agriculture moins dépendante aux pesticides, est publié le [316].
Le 22 juin 2018, Stéphane Travert et Nicolas Hulot, respectivement ministres de l'Agriculture et de l'écologie, lancent un groupe de travail devant piloter la suppression en trois ans, de l'usage du glyphosate en France[317].
2019 : le , Emmanuel Macron revient sur sa promesse d'interdiction du glyphosate avant 2021, mais encourage les viticulteurs français à faire de leur vignoble « le premier vignoble sans glyphosate du monde »[318]. L'INRAE publie 3 rapports évaluant économiquement les alternatives au glyphosate, respectivement en viticulture[319], en arboriculture[320], et en grandes cultures[321].
Le , le tribunal administratif de Lyon annule l'autorisation de mise sur le marché du Roundup Pro 360 estimant que l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (Anses) a « commis une erreur d'appréciation au regard du principe de précaution »[322]. En février, l'Anses annonce une nouvelle étude, « indépendante » visant à « trancher » la controverse sur la dangerosité du glyphosate (incluant son éventuel caractère cancérigène, ce produit étant classé « cancérogène probable » par le CIRC mais toujours pas par l'AESA)[318].
Après l'échec du plan Écophyto 2018, Didier Guillaume, ministre de l'Agriculture, signe le 2019 un « préambule » d'un « contrat de Solutions » associant la FNSEA, et quarante-deux partenaires s'y engageant à trouver des alternatives aux pesticides, plan jugé peu crédible par la Confédération paysanne (« Cette étude du contrat de solutions, elle est quand même financée par ceux qui vendent les pesticides, c'est comme si on confiait à Pernod Ricard la sortie de l'alcoolémie »)[318].
Le , la vente de glyphosate en France est interdite aux particuliers[323] mais autorisée aux professionnels (agriculteurs, maraîchers…) La demande des particuliers représentant 60 % des ventes mondiales (selon Planetoscope)[324], l'interdiction devrait fortement diminuer la consommation de glyphosate en France.
Le , l'Agence française de sécurité sanitaire (Anses) annonce le retrait, dès fin 2020, de 36 produits à base de glyphosate. Sur les 69 disponibles sur le marché français, ils représentaient (en 2018) « près des trois quarts des tonnages de produits à base de glyphosate vendus en France »[325].
Le Conseil d'État annule une partie de l'arrêté du 4 mai 2017 relatif à la mise sur le marché et à l'utilisation des produits phytopharmaceutiques et de leurs adjuvants, au motif qu'il ne protégeaient pas assez la santé publique et l'environnement (CE, 26 juin 2019 n° 415426, Association Générations futures). Le juge a notamment sanctionné le défaut de protection des riverains des zones traitées (auquel ont partiellement remédié la loi EGALIM et ses textes d'application).
2020 : Le , dans un contexte de suspicion, l'Anses, à la suite de critiques relayées par le journal Le Monde[326], choisit de renoncer à son étude du potentiel cancérogène du glyphosate, pour cause de conflit d'intérêts au sein du consortium sélectionné (coordonné par l'Institut Pasteur de Lille, et par le CIRC, pour les études génotoxicologiques complémentaires)[327], et financera donc uniquement l'étude originale proposée par le CIRC (lequel avait proposé une étude sur d'éventuels effets génotoxiques du glyphosate à la suite d'une exposition de longue durée de cultures cellulaires, avant de faire savoir, en octobre 2020, qu'il décidait de retirer son programme d'étude sur la toxicité du glyphosate, pour se recentrer sur de nouvelles priorités de recherche) ; les résultats sont « attendus pour le second semestre 2021 ».
En octobre, l'Anses confirme des restrictions dans les six mois en viticulture, arboriculture et sur céréales « pour aboutir en 2021 à supprimer entre 60 et 80 % des usages du glyphosate » selon Jean-Baptiste Moreau, co-rapporteur d'une mission d'information sur le sujet ; Jean-Luc Fugit (l'autre rapporteur), plus prudent, estime que ces restrictions « devraient nous amener à 50 % d'utilisations de moins de glyphosate en 2021 » (par rapport à 2017).
Depuis 2019, de nombreux maires ont pris des arrêtés d'interdiction du glyphosate, se fondant sur leur pouvoir de police, et la salubrité publique. Ces arrêtés ont généré un important contentieux administratif. Certains tribunaux les ont suspendus, considérant que seules les autorités étatiques pouvaient réglementer les produits phytosanitaires, en vertu de l'exclusivité de leur pouvoir de police spécial. D'autres juges (notamment du tribunal administratif de Cergy-Pontoise et de Montreuil) ont validé les arrêtés anti-glyphosate en considérant qu'eu « égard à la présomption suffisamment établie de dangerosité et de persistance dans le temps des effets néfastes pour la santé publique et l'environnement des produits que l'arrêté attaqué interdit sur le territoire de la commune(…) et en l'absence de mesures réglementaires suffisantes prises par les ministres titulaires de la police spéciale, le maire de cette commune a pu à bon droit considérer que les habitants de celle-ci étaient exposés à un danger grave ».
Changement de position[modifier | modifier le code]
En 2023, alors que la commission européenne propose de renouveler l'autorisation du Glyphosate pour 10 ans, la France ne s'oppose plus à ce renouvellement, elle a changé de position par rapport à 2017 et veut modifier le texte vers 7 ans d'autorisation de plus associé à des restrictions d'usage quand il y a d'autres options. La France, première puissance agricole de l'Union européenne et grande consommatrice de glyphosate, a selon l'exécutif, épandu 27 % de moins en 2022 que sur la période 2015-2017[328].
États-Unis[modifier | modifier le code]
Bayer rachète en 2018 Monsanto pour 63 milliards de dollars[329].
Le glyphosate n’est pas interdit aux États-Unis. Bayer retire l'herbicide du marché pour s’éviter les poursuites et les éventuels paiements d’indemnités aux victimes présumées du Roundup. Confronté à des milliers de plaintes au sujet des risques supposés de cancer liés à l'utilisation de désherbants de Monsanto, Bayer débourse 10 milliards de dollars pour solder des litiges avec 100 000 plaignants exposés au Roundup[329].
Luxembourg[modifier | modifier le code]
Le 3 avril 2023, le Luxembourg, premier pays de l’UE à bannir le glyphosate en 2020, annonce qu’il réautorise la commercialisation des produits à base de cet herbicide controversé, à la suite d'une décision de justice. La Cour administrative du Luxembourg a jugé que l'interdiction était en contradiction avec le régime juridique de l’UE, qui permettait la distribution des produits contenant du glyphosate[330].
Mexique[modifier | modifier le code]
Au Mexique, dans un décret entré en vigueur le 1er janvier 2021, le glyphosate, classé depuis mars 2015 comme « cancérigène probable » par le Centre national de recherche contre le cancer (CIRC), sera progressivement éradiqué avec une interdiction totale au 31 janvier 2024. Le décret dispose que les organismes gouvernementaux doivent s’abstenir d’acquérir ou d’utiliser le glyphosate et que des alternatives durables doivent être recherchées par l’industrie agroalimentaire[331].
Viêt Nam[modifier | modifier le code]
Le 10 avril 2019, le ministère de l’agriculture et du développement rural vietnamien annonce le retrait du pesticide de la liste de produits autorisés dans le pays. Cette décision a été prise à la suite de la condamnation par un juge californie de Monsanto, dont l’herbicide Roundup avait été un « facteur substantiel » dans le déclenchement du cancer d’Edwin Hardeman[332].
Alternatives[modifier | modifier le code]
La France vise une sortie de l'essentiel des usages du glyphosate en 2021 puis une interdiction totale en 2023, ce qui implique des alternatives (chimiques ou non chimiques).
Alternatives non chimiques[modifier | modifier le code]
Pour les zones urbaines ou d'infrastructures (berges, voies ferrées, bords de route), outre le Fauchage raisonné (mécanique et/ou manuel)[333], les alternatives non chimiques sont :
- des produits de biocontrôle (substances naturelles)[333] ;
- des technologies de type désherbage thermique (chaleur, vapeur d'eau, mousse à 80 °C…)[333] ;
- le désherbage électrique[333] ;
- certaines formes d'écopastoralisme (non recommandé en bordure de voies routières ou ferrées (cf. sols souvent pollués et risque de défaillance de la clôture électrifiée)
- des robots faucheurs[333] ;
- des pistes émergentes concernent l'application d'ondes électromagnétiques (micro-ondes par exemple)[333] ;
- une autre option, parfois déjà choisie en ville pour les lignes de tramways est l'ensemencement choisi (par des graines de plantes à racines courtes) et facile à maîtriser[333].
Pour l'INRAe, en 2018, les alternatives rendraient la nourriture plus couteuse pour le consomateur[334].
Alternatives chimiques[modifier | modifier le code]
Cas des voies ferrées[modifier | modifier le code]
En France, SNCF Réseau, chargé du désherbage (par « trains désherbeurs ») de 30 000 km de voies et pistes de lignes de voies ferrées de France pulvérisait dans les années 2010 35 à 38 t/an de glyphosate (0,4 % de la consommation nationale)[333]. L'entreprise, après 4 ans de recherche (2016-2020) a annoncé son choix d'alternative au glyphosate : une solution composée à 95 % d'acide pélargonique (un produit naturel de biocontrôle), renforcée par une molécule de synthèse de la famille des sulfonylurées[333]. La transition sera lancée fin 2021 et généralisée en 2022 avec 2 passages par an de train désherbeur au lieu d'un, et avec des pulvérisateurs « intelligents » (plus précis)[333]. Les abords (à plus de 3 m de la voie) ou les abords d'habitations resteront fauchés, comme l'impose la loi EGalim du 30 octobre 2018[335]. Selon Jean-Pierre Pujols (responsable de cette transition), l'investissement d'entretien des voies « lié à la sortie du glyphosate et à la loi EGalim » sera d'environ 110 millions/an, et non de 300 à 500 millions d'euros, sans solution chimique, somme à ajouter aux 150 millions de maîtrise de la végétation riveraine, soit un total d'environ 260 millions d'euros/an[333]. En 2020, l'État a attribué 1,5 milliard d'euros à SNCF Réseau pour « sortir du glyphosate » et entretenir les ponts. J.-P. Pujols précise que la recherche d'alternative totalement sans chimie de synthèse se poursuivra. Julien Denormandie, ministre français de l'Agriculture, a aussi annoncé 7 M€ pour accélérer la recherche sur les alternatives agricoles au glyphosate[333].
Fictions inspirées par la controverse[modifier | modifier le code]
- En 2022, le film Goliath de Frédéric Tellier avec Gilles Lellouche, Pierre Niney, Emmanuelle Bercot, sort en salles dans plusieurs pays[336]. Le réalisateur s'inspire de faits réels, en l'occurrence les polémiques sur le glyphosate[337].
- Jeux d'influence (saison 1), série réalisée par Jean-Xavier de Lestrade, 8 épisodes diffusés sur Arte du 13 au 27 juin 2019 ; et Jeux d’influence, les combattantes (saison 2), série de 6 épisodes diffusés sur Arte les 5 et 12 janvier 2023 : la série traite en particulier du pesticide « Limithrol », mais le réalisateur a reconnu que l'inspiration principale concerne le glyphosate de Monsanto[338].
Notes et références[modifier | modifier le code]
- GLYPHOSATE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Fiche TOXNET du Glyphosate publiée par le NIH sur [1] (15 janvier 2015)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- James C (2017) Brief 52: Global status of commercialized biotech/GM crops: 2016. ISAAA Briefs brief 52 Global Status of Commercialized Biotech/GM Crops: 2016 (pdf). Accessed 15 May 2017
- Vandenberg, L. N., Blumberg, B., Antoniou, M. N., Benbrook, C. M., Carroll, L., Colborn, T., … & Mesnage, R. (2017) Is it time to reassess current safety standards for glyphosate-based herbicides?. J Epidemiol Community Health, 71(6), 613-618.
- (en) L. Rivoira, S. Frassati, S. Cordola et M. Castiglioni, « Encapsulation of the glyphosate herbicide in mesoporous and soil-affine sorbents for its prolonged release », Chemical Engineering Journal, vol. 431, , p. 134225 (DOI 10.1016/j.cej.2021.134225, lire en ligne, consulté le )
- « Pourquoi le glyphosate pourrait être autorisé pour dix années supplémentaires en UE ? », sur Europe 1, (consulté le )
- « Pourquoi une agence européenne classe le glyphosate comme non cancérogène ? », sur 20minutes.fr, (consulté le )
- Lise Ouangari, « Glyphosate : que disent vraiment les études sur la dangerosité de cet herbicide si controversé ? », sur Ouest-France.fr, (consulté le )
- « OMS | Questions fréquentes sur les aliments génétiquement modifiés », sur Who.int (consulté le )
- « Après l’étude de l’Inserm sur le glyphosate, voilà ce que l’on sait vraiment de sa nocivité », L'Express, (lire en ligne, consulté le ).
- « Le Roundup face à ses juges, documentaire diffusé par Arte », sur Radio France,France Inter, Capture d'écrans, (consulté le ).
- Marie-Monique Robin, « Le Roundup face à ses juges », sur Educ.Arte.tv, (consulté le ), 90 min
- (en) Paul Sprankle, W. F. Meggitt et Donald Penner, « Adsorption, Mobility, and Microbial Degradation of Glyphosate in the Soil », Weed Science, vol. 23, no 3, , p. 229–234 (ISSN 0043-1745 et 1550-2759, DOI 10.1017/S0043174500052929, lire en ligne, consulté le ).
- Han, J., Moon, H., Hong, Y., Yang, S., Jeong, W. J., Lee, K. S., & Chung, H. (2016). Determination of glyphosate and its metabolite in emergency room in Korea. Forensic science international, 265, 41-46 (résumé).
- (en) Brevet US3799758, N-glycine phytotoxicant compositions, publié le 26 mars 1974, soumis le 9 août 1971, par John E. Franz, Monsanto Company.
- Toy ADF & Uhing EH (1964) « Aminomethylenephosphinic acids, salts thereof, and process for their production ». United States Patent Office, Patent 3:160,632.
- Mertens M, Höss S, Neumann G, Afzal J & Reichenbecher W (2018) « [https://link.springer.com/article/10.1007/s11356-017-1080-1 Glyphosate, a chelating agent—relevant for ecological risk assessment? ». Environmental Science and Pollution Research, 25(6), 5298-5317.
- (en-US) « Glyphsate », GMO Free USA (consulté le ).
- « The nutritional status of GMOs », sur actahort.org (consulté le ).
- Worthing, C.R. (dir. de publ.). The pesticide manual. A world compendium. 7e éd.. The British Crop Protection Council. Lavenham Press, Lavenham, R.-U. (1983).
- Organisation mondiale de la santé (OMS). Glyphosate. Critères de la qualité sanitaire de l’environnement, Programme international de sécurité des produits chimiques (IPCS), Genève (1994).
- N. Bonnard, D. Jargot, M. Falcy, F. Pillière, S. Robert, A. Fastier, S. Oudar, M.-O. Rambourg., « Glyphosate », INRS, (www.inrs.fr/dms/ficheTox/FicheFicheTox/FICHETOX_273-1/FicheTox_273.pdf).
- « Retrait des produits phytopharmaceutiques associant en coformulation glyphosate et POE-Tallowamine du marché français | Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail », sur anses.fr (consulté le ).
- « Glyphosate, un débat empoisonné », sur France Culture (consulté le )
- Nicolas Enault, « Carte. Quels sont les départements accros au glyphosate ? », sur France Info (chaine de télévision), (à partir de la base de donnés eaufrance).
- Lucas, V., de Tourdonnet, S., Barbier, J. M., Cittadini, R. A., & Gasselin, P. (2018, December). Le glyphosate en agriculture de conservation: un cas illustratif de la dépendance de l'agriculture française aux pesticides. In 12. Journées de recherches en sciences sociales (p. np) | url=https://hal.science/hal-01959644/
- « Applications en prérécolte pour le contrôle des mauvaises herbes et la dessiccation », sur glyphosateeu.fr (consulté le ).
- « Conseils d'arvalis pour la destruction des chardons et liseron dans le blé en précolte : certaines spécialités de glyphosate », sur arvalis-infos.fr/.
- « Caractéristiques des produits commerciaux », sur SAgE pesticides (consulté le ).
- « Guide pré récolte round up weather max », sur roundup.ca.
- « Analyse des résidus de glyphosate dans les produits issus de l'agriculture suisse », sur sbv-usp.ch.
- « Herbicide – Des résidus de glyphosate dans les bières allemandes et suisses », Union fédérale des consommateurs—Que choisir, (lire en ligne, consulté le ).
- (en) « Preharvest herbicide applications are an important part of direct-harvest dry bean production », MSU Extension, (lire en ligne, consulté le ).
- (en) « Pre-harvest glyphosate application to wheat and barley », sur cereals.ahdb.org.uk, (consulté le ).
- « réponse de la Commission en 2014 à la question de la pétition allemande 0901/2013 de 2012 portant sur la modification de la LMR des lentilles » [PDF], sur europarl.europa.eu, (consulté le ).
- (en-GB) Amy-Jean MacLean, « Desiccant vs. Glyphosate: know your goals », sur PortageOnline.com, (consulté le ).
- Direction des sciences de la salubrité des aliments, « Sauvegarder grâce à la science : Dépistage du glyphosate en 2015-2016 », sur Agence canadienne d'inspection des aliments, (consulté le ).
- « Le glyphosate contenu dans nos aliments provient majoritairement d'importations en provenance du continent américain », sur Coordination rurale (CR), (consulté le ).
- (en) L. Rivoira, S. Frassati, S. Cordola et M. Castiglioni, « Encapsulation of the glyphosate herbicide in mesoporous and soil-affine sorbents for its prolonged release », Chemical Engineering Journal, vol. 431, , p. 134225 (DOI 10.1016/j.cej.2021.134225, lire en ligne, consulté le ) — voir respectivement les reférences nos 15 et 16.
- « Les scientifiques de plus en plus inquiets des résistances des adventices au glyphosate », sur Mission pour la Science et la Technologie de l'Ambassade de France aux États-Unis, 11 mai 2007.
- « Glyphosate - Un premier cas de résistance détecté dans un vignoble en France », 23 août 2007, sur viti-net.fr.
- « Herbicide Resistance - an overview », sur ScienceDirect.com (consulté le )
- Silva, J., Arf, O., Gerlach G., Kuryiama C.S. et Rodrigues R.A.F. (2012), Hormesis effect of glyphosate on common bean cultivars, Pesquisa Agropecuária Tropical, 42(3), 295-302.
- « Produits phytosanitaires : Etat des lieux — Eduterre », sur web.archive.org, (consulté le ).
- « Le glyphosate, herbicide efficace, pas cher, facile à stocker et à acheter, notamment sur internet - Nevers (58000) », sur web.archive.org, (consulté le ).
- https://agritrop.cirad.fr/434927/.
- Inès Mahé, Christian Gauvrit, Frédérique Angevin et Bruno Chauvel, « Quels enseignements tirer du retrait de l’atrazine dans le cadre de l’interdiction prévue du glyphosate ? », Cahiers Agricultures, vol. 29, , p. 29 (ISSN 1166-7699 et 1777-5949, DOI 10.1051/cagri/2020026, lire en ligne, consulté le ).
- « Rapport sur le marché du glyphosate », sur web.archive.org, (consulté le ).
- « Europe : la controverse sur le glyphosate rebondit », sur web.archive.org, (consulté le ).
- Michel Lallement, « 1. Une expérience fouriériste de communauté de travail : le Familistère de Guise », La Découverte, , p. 37–51 (lire en ligne, consulté le )
- Wendy Pline-Srnic (2006), Physiological Mechanisms of Glyphosate Resistance. Weed Technology 20:2, 290-300, (Résumé)
- (en) Institute Of Sciences (consulté le 11 mars 2008)
- « El disgusto de Ecuador por las fumigaciones con glifosato », Semana, .
- AFP (10 mai, 2015) La Colombie suspend la fumigation des champs de drogue ; Le Monde.
- AFP (19 mai, 2015) Sans glyphosate, la Colombie doit trouver une alternative à la lutte anti-drogue ; Libération.
- (es) Ministerio de Salud y Protección Social de Colombia (15 mai 2015), Consejo Nacional de Estupefacientes aprueba suspensión de fumigaciones con glifosato, MinSalud (consulté le ).
- Marie Delcas (Bogota correspondante), « La Colombie bannit l’épandage de glyphosate », Le Monde, (ISSN 1950-6244, lire en ligne, consulté le )
- AFP, « Colombie: reprise des pulvérisations de glyphosate contre la drogue », sur Geo.fr, (consulté le )
- « Glyphosate : quels pays ont déjà interdit ce désherbant ? », La Croix, (ISSN 0242-6056, lire en ligne, consulté le )
- « Un nouvel OGM résistant aux herbicides », Industries et technologies, no 859, (lire en ligne, consulté le )
- (en) « How Superweeds Like Palmer Amaranth Are Changing Agriculture », sur The New York Times,
- « OGM : Moins de pesticides », sur www.ogm.gouv.qc.ca (consulté le )
- (en) Edward D. Perry, GianCarlo Moschini et David A. Hennessy, « Testing for Complementarity: Glyphosate Tolerant Soybeans and Conservation Tillage », American Journal of Agricultural Economics, , aaw001 (ISSN 0002-9092 et 1467-8276, DOI 10.1093/ajae/aaw001, lire en ligne, consulté le ).
- Voir sur ncbi.nlm.nih.gov.
- « L'évaluation des risques expliquée par l’EFSA », sur efsa.europa.eu, (consulté le ).
- US EPA (1993. Reregistration Eligibility Decision : Glyphosate. EPA 738-R-93-014.
- Faite le 6 novembre 2016.
- Stéphane Foucart et Stéphane Horel, « « Monsanto papers », les agences sous l'influence de la firme », Le Monde, (ISSN 1950-6244, lire en ligne, consulté le ).
- « Après la corruption des politiques, Monsanto achète les scientifiques pour falsifier leurs études », sur Radio France, France Inter, (consulté le ).
- (en) « EFSA Statement regarding the EU assessment of glyphosate and the so-called « Monsanto papers » », sur efsa.europa.eu, (consulté le ).
- Olivier Bénis, « Six questions sur le renouvellement de l'autorisation du glyphosate, proposé par la Commission européenne », sur Radio France, France Inter avec AFP, (consulté le ).
- Vereecken H (2005), Mobility and leaching of glyphosate: A review. Pest Manag Sci 61:1139–115
- Peruzzo PJ, Porta AA, Ronco AE. 2008. Levels of glyphosate in surface waters, sediments and soils associated with direct sowing soybean cultivation in north pampasic region of Argentina. Environ Pollut 156:61–66
- Vogel J.R., Majewski M.S. et Capel P.D. (2008), Pesticides in rain in four agricultural watersheds in the United States, J. Environ. Qual. 37:1101– 1115
- Jauhiainen A, Rasanen K, Sarantila R, Nuutinen J et Kangas J. (1991), Occupational exposure of forest workers to glyphosate during brushsaw spraying work, Am. Indust. Hyg. Assoc. J., 52:61–64
- Dan Feng, Audrey Soric et Olivier Boutin, « Treatment technologies and degradation pathways of glyphosate: A critical review », Science of The Total Environment, vol. 742, , p. 140559 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2020.140559, lire en ligne, consulté le )
- A. H. C. Van Bruggen, M. M. He, K. Shin et V. Mai, « Environmental and health effects of the herbicide glyphosate », Science of The Total Environment, vol. 616-617, , p. 255–268 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2017.10.309, lire en ligne, consulté le )
- (en) A. V. Sviridov, T. V. Shushkova, I. T. Ermakova et E. V. Ivanova, « Microbial degradation of glyphosate herbicides (Review) », Applied Biochemistry and Microbiology, vol. 51, no 2, , p. 188–195 (ISSN 1608-3024, DOI 10.1134/S0003683815020209, lire en ligne, consulté le )
- « Monsanto définitivement condamné pour "publicité mensongère" à propos du Round Up », sur LeMonde.fr avec AFP, (consulté le )
- Phuong Bich Trinh et Andrea Iris Schäfer, « Adsorption of glyphosate and metabolite aminomethylphosphonic acid (AMPA) from water by polymer-based spherical activated carbon (PBSAC) », Journal of Hazardous Materials, vol. 454, , p. 131211 (ISSN 0304-3894, DOI 10.1016/j.jhazmat.2023.131211, lire en ligne, consulté le )
- Jiaqi An, Yongcan Jiang, Huafen Cao et Ceng Yi, « Photodegradation of glyphosate in water and stimulation of by-products on algae growth », Ecotoxicology and Environmental Safety, vol. 263, , p. 115211 (ISSN 0147-6513, DOI 10.1016/j.ecoenv.2023.115211, lire en ligne, consulté le )
- R. Choumane et S. Peulon, « Valorisation of original nanostructured lead oxides thin films issued from an innovating electrochemical depollution process: Application to the total electro-mineralisation of glyphosate », Journal of Water Process Engineering, vol. 54, , p. 103900 (ISSN 2214-7144, DOI 10.1016/j.jwpe.2023.103900, lire en ligne, consulté le )
- Francisco J. Rodríguez-Mejías, Aurelio Scavo, Nuria Chinchilla et José M. G. Molinillo, « Perspectives and Advances in Organic Formulations for Agriculture: Encapsulation of Herbicides for Weed Control », Agronomy, vol. 13, no 7, , p. 1898 (ISSN 2073-4395, DOI 10.3390/agronomy13071898, lire en ligne, consulté le )
- (en) L. Rivoira, S. Frassati, S. Cordola et M. Castiglioni, « Encapsulation of the glyphosate herbicide in mesoporous and soil-affine sorbents for its prolonged release », Chemical Engineering Journal, vol. 431, , p. 134225 (DOI 10.1016/j.cej.2021.134225, lire en ligne, consulté le )
- Xuejuan Hou, Hui Nan, Xin Chen et Fei Ge, « Slow release of attapulgite based nano-enabled glyphosate improves soil phosphatase activity, organic P-pool and proliferation of dominant bacterial community », Environmental Pollution, vol. 336, , p. 122408 (ISSN 0269-7491, DOI 10.1016/j.envpol.2023.122408, lire en ligne, consulté le )
- Zhu, Y., Zhang, F., Tong, C. et Liu, W. (1999), Determination of glyphosate by ion chromatography, Journal of Chromatography A, 850(1), 297-301 (résumé).
- Börjesson, E. et Torstensson, L. (2000), New methods for determination of glyphosate and (aminomethyl) phosphonic acid in water and soil, Journal of Chromatography A, 886(1), 207-216 (résumé).
- Myer MT, Loftin KA, Lee EA, Hinshaw GH, Dietze JE, Scribner EA. (2009), Determination of Glyphosate, its Degradation Product Amino-methylphosphonic Acid, and Glufosinate, in Water by Isotope Dilution and Online Solid-Phase Extraction and Liquid Chromatography/ Tandem Mass Spectrometry. U.S. Geological Survey, Techniques and Methods, Book 5, chapter A10
- Thomas Poiger, Ignaz J. Buerge, Astrid Bächli et Markus D. Müller, « Occurrence of the herbicide glyphosate and its metabolite AMPA in surface waters in Switzerland determined with on-line solid phase extraction LC-MS/MS », Environmental Science and Pollution Research International, vol. 24, no 2, , p. 1588–1596 (ISSN 1614-7499, PMID 27787705, DOI 10.1007/s11356-016-7835-2, lire en ligne, consulté le )
- Catherine Regnault-Roger, Produits de Protection des Plantes, Lavoisier, (lire en ligne), p. 92.
- Watanabe D, Kazui Y & Ohta H (2018) A rapid screening color test for glyphosate using dabsyl derivatization. Forensic Toxicology, 1-6.|résumé (en)
- Majewski, M.S., Coupe, R.H., Foreman , W.T. and Capel , P.D. (2014) Pesticides in Mississippi Air and Rain: A Com- parison between 1995 and 2007. Envi ronmental Toxicology and Chemistry, 33, 1283 -12 93. http://dx.doi.org/10.1002/etc.2550
- Chang , F.C., Simcik , M.F. and Capel , P.D. (2011) Occurrence and Fate of the Herbicide Glyphosate and Its Degradate Aminomethylphosphonic Acid in the Atmosphere. Environmental Toxicology and Chemistry , 30 , 548-5 55.
- Scribner , E.A., Battaglin , W.A., Gilliom , R. J. and Meyer , M.T. (2007) Concentration s of Glyphosate, Its Degradation Product, Aminomethylphophonic Acid, and Glufosinate in Ground- and Surface- Water, Rainfall, and Soil Samples Collected in the United States, 2001 -06S. Geological Survey Scientific Investigations Report 2007 -5122.
- Mercurio , P., Flores , F., Mueller , J.F., Carter , S. and Negri , A.P. (2014) Glyphosate Persistence in Seawater. Marine Pollution Bulletin , 85 , 385 -390. http://dx.doi.org/10.1016/j.marpolbul.2014.01.021
- Coupe , R. H., Kalkhoff , S.J., Capel , P.D. and Gregoire , C. (2012) Fate and Transport of Glyphosate and Aminom e-thylphosphonic Acid in Surface Waters of Agricultural Basins. Pest. Management Science, 68 , 16- 30. http://dx.doi.org/10.1002/ps.2212
- Krüger , M., Schledorn , P., Schrödl , W., Hoppe , H.-W ., Lutz , W. and She hata, A.A. (2014) Detection of Glyphosate Residues in Animals and Humans. Journal of Environmental & Analytical Toxicology , 4 , 2.
- Aris , A. and Leblanc, S. (2011) Maternal and Fetal Exposure to Pesticides Associated to Genetically Modified Foods in Eastern Townships of Quebec, Canada. Reproductive Toxicology , 31 , 528-533. http://dx.doi.org/10.1016/j.reprotox.2011.02.004
- Lanaro , R. , Costa , J.L., Cazenave , S.O., Zanolli -Filho , L.A., Tavares , M.F. and Chasin , A.A. (2015) Determination of Herbicides Paraquat, Glyphosate and Aminomethylphosphonic Acid in Marijuana Samples by Capillary Electrophor e- sis. Journal of Forensic Sciences , 60 , S241 -S24 7. http ://dx.doi.org/10.1111/1556- 4029.12628
- Richards, B. K., Pacenka, S., Meyer, M. T., Dietze, J. E., Schatz, A. L., Teuffer, K. … et Steenhuis, T. S. (2018), Antecedent and Post-Application Rain Events Trigger Glyphosate Transport from Runoff-Prone Soils, Environmental Science & Technology Letters (résumé et graphique).
- Tortensson, L. Behaviour of glyphosate in soils and its degradation. in: The herbicide glyphosate. E. Grossbard et D. Atkinson (dir. de publ.). Butterworths, London, R.-U., p. 137 (1985).
- Monsanto Canada (1985), Renseignements appuyant l'établissement d'une concentration maximale acceptable du glyphosate dans l'eau potable, communiqués à M.P. Toft, Bureau des dangers des produits chimiques, Direction de l'hygiène du milieu, Santé nationale et Bien-être social Canada.
- Office fédéral de l'environnement OFEV, « État et évolution des eaux souterraines en Suisse », sur www.bafu.admin.ch (consulté le )
- Legris, J. et Couture, G., Résidus de glyphosate dans l’eau et les sédiments à la suite de pulvérisations terrestres en milieu forestier en 1986. Publication 3322, Gouvernement du Québec, ministère de l'Énergie et des Ressources, Service des études environnementales, Québec (1989)
- Sidoli, P., Baran, N. et Angulojamarillo, R. (juin 2014), Adsorption du glyphosate et de l'AMPA dans la zone non saturée d'un aquifère sédimentaire. In 44e Congrès du Groupe français des pesticides (p. XX) (résumé)
- Soletchnik, P., Bouchet, V., Malestroit, P., Seugnet, J. L., Blouin, F., Radford-Knoery, J., … et Sauriau, P. G. (2005), Mortalité de Crassostrea gigas dans le bassin de Marennes Oléron. Étude physico chimique du sédiment. Étude du modèle de mortalité « plat-table » de C. gigas dans le bassin de Marennes Oléron. Étude « Dynamo » du projet MOREST.
- Dossier sur la pollution des eaux en France par les pesticides (août 2006)
- « Glyphosate », sur ineris.fr, (consulté le ).
- « L’acide aminométhylphosphonique (AMPA) dans les eaux naturelles et les filières de traitement : origines, comportement et devenir - TSM », sur astee-tsm.fr (consulté le )
- Hénault-Ethier, L., Lucotte, M., Moingt, M., Paquet, S., Maccario, S., Smedbol, É. … et Labrecque, M. (2017), Herbaceous or Salix miyabeana ‘SX64’narrow buffer strips as a means to minimize glyphosate and aminomethylphosphonic acid leaching from row crop fields. Science of the Total Environment, 598, 1177-1186.
- Durham, Sharon. Riparian Buffers Effective. Southeast Farm Press. 4 février 2004. p. 26.
- Organisation mondiale de la santé. Glyphosate. Critères de la qualité sanitaire de l’environnement, Programme international de sécurité des produits chimiques (IPCS), Genève (1994)
- Voir sur cdc.gov.
- Voir sur svt.ac-aix-marseille.fr.
- Chang, F. C., Simcik, M. F. et Capel, P. D. (2011), Occurrence and fate of the herbicide glyphosate and its degradate aminomethylphosphonic acid in the atmosphere. Environmental Toxicology and Chemistry, 30(3), 548-555.
- Battaglin WA, Kolpin DW, Scribner EA, Kuivila KM, Sandstrom MW. (2005), Glyphosate, other herbicides, and transformation products in Midwestern streams, J. Am. Water Resour. Assoc. 41:323–332
- Sprankle P, Meggitt WF, Penner D. (1975), Rapid inactivation of glyphosate in soil. Weed Sci. 23:24–228
- Mallat E. et Barcelo D. (1998), Analysis and degradation study of glyphosate and of aminomethylphosphonic acid in natural waters by means of polymericandion-exchange solid-phase extraction columns followed by ion chromatography post-column derivatization with fluorescence detection, J. Chromatogr. A 823:129–136.
- Myers JP, Antoniou MN, Blumberg B, Carroll L, Colborn T, Everett LG, Hansen M, Landrigan PJ, Lanphear BP, Mesnage R, Vandenberg LN, Vom Saal FS, Welshons WV, Benbrook CM (2016) Concerns over use of glyphosate-based herbicides and risks associated with exposures : a consensus statement. Environ Health 15(1):19. https://doi.org/10.1186/s12940-016-0117-0
- (en) Monika Krüger, Awad Ali Shehata, Wieland Schrödl et Arne Rodloff, « Glyphosate suppresses the antagonistic effect of Enterococcus spp. on Clostridium botulinum », Anaerobe, vol. 20, , p. 74–78 (DOI 10.1016/j.anaerobe.2013.01.005, lire en ligne, consulté le )
- (en) Yunbiao Wang, Anastasia N. Ezemaduka, Zhuheng Li et Zhanyan Chen, « Joint Toxicity of Arsenic, Copper and Glyphosate on Behavior, Reproduction and Heat Shock Protein Response in Caenorhabditis elegans », Bulletin of Environmental Contamination and Toxicology, vol. 98, no 4, , p. 465–471 (ISSN 0007-4861 et 1432-0800, DOI 10.1007/s00128-017-2042-5)
- Oviedo C, Rodríguez J (2003) EDTA: the chelating agent under environmental scrutiny. Quim Nova 26:901–905
- voir notamment la Table 1 "Reported stability constants for various chelating agents and metals", dans l'article : Mertens, M., Höss, S., Neumann, G., Afzal, J., & Reichenbecher, W. (2018) Glyphosate, a chelating agent—relevant for ecological risk assessment ?. Environmental Science and Pollution Research, 25(6), 5298-5317.
- United States Geological Survey. Glyphosate herbicide found in many Midwestern streams. Antibiotics Not Common
- Struger J, Thompson D, Staznik B., Martin P., McDaniel T et Marvin C (2008), Occurrence of glyphosate in surface waters of southern Ontario. Bulletin of Environmental Contamination and Toxicology, 80(4), 378-384.
- Puértolas L, Damásio J, Barata C, Soares A. M et Prat N (2010), Evaluation of side-effects of glyphosate mediated control of giant reed (Arundo donax) on the structure and function of a nearby Mediterranean river ecosystem. Environmental research, 110(6), 556-564.
- Tsui M.T.K et Chu L.M (2003), Aquatic toxicity of glyphosate-based formulations: comparison between different organisms and the effects of environmental factors. Chemosphere 52, 1189–1197.
- Tsui M.T.K et Chu L.M (2004), Comparative toxicity of glyphosate-based herbicides: aqueous and sediment porewater exposures. Arch. Environ. Contam. Toxicol. 46, 316–323.
- Papchenkova G.A (2007), Study of chronic toxicity of the herbicide Roundup in series of generations of Daphnia magna. Toksikol. Vestn. 5, 14–17.
- Papchenkova G.A, Golovanova I.L, Ushankova N.V (2009), The parameters of reproduction, sizes and activities of hydrolases in Daphnia magna Straus of successive generations affected by Roundup herbicide, Inland Water Biol., 2 (3), 286–291
- Daurich, J., Zirulnik, F., Gimenez, M.S., (2001), Effect of herbicide glyphosate on enzymatic activity in pregnant rats and their fetuses, Environ. Res., 85, 226–231.
- Alistock, M.S., Norman, C.M. et Bushmann, P.J. (2001), Common reed Phragmites australis: control and effects upon biodiversity in freshwater nontidal wetlands, Restor. Ecol., 9, 49–59.
- Roy, N. M., Ochs, J., Zambrzycka, E., & Anderson, A. (2016). Glyphosate induces cardiovascular toxicity in Danio rerio. Environmental toxicology and pharmacology, 46, 292-300.
- Sutherland, M.L., « Metabolism of N-nitrosophosphono-methylglycine in the laboratory rat ». Rapport no MSL 0242 (inédit), Monsanto Environmental Health Laboratory, Saint-Louis, MO (1978), cité à la référence 21, cité par le gouvernement canadien.
- Andrew R. Kniss, Joseph D. Vassios, Scott J. Nissen et Christian Ritz (2011), Nonlinear Regression Analysis of Herbicide Absorption Studies, Weed Science 59:4, 601-610, 1er octobre 2011.
- Eric R. Walker et Lawrence R. Oliver (2008), Translocation and Absorption of Glyphosate in Flowering Sicklepod (Senna obtusifolia), Weed Science, mai 2008, vol. 56, no 3, p. 338-343, DOI https://dx.doi.org/10.1614/WS-07-069.1
- University of Florida ; Lygodium Research, IFAS, consulté 2012-11-03
- Jeffrey T. Hutchinson, Kenneth A. Langeland, Gregory E. MacDonald et Robert Querns, 2010, Absorption and Translocation of Glyphosate, Metsulfuron, and Triclopyr in Old World Climbing Fern (Lygodium microphyllum), Weed Science 58:2, 118-125, 1er avril 2010 (résumé)
- Smedbol, É., Gomes, M. P., Paquet, S., Labrecque, M., Lepage, L., Lucotte, M. et Juneau, P. (2018), Effects of low concentrations of glyphosate-based herbicide factor 540 on an agricultural stream freshwater phytoplankton community, Chemosphere, 192, 133-141 (résumé).
- Smedbol, É., Lucotte, M., Labrecque, M., Lepage, L. et Juneau, P. (2017), Phytoplankton growth and PSII efficiency sensitivity to a glyphosate-based herbicide (Factor 540), Aquatic Toxicology, 192, 265-273|résumé.
- Wendy A. Pline, Ryan Viator, John W. Wilcut, Keith L. Edmisten, Judith Thomas et Randy Wells (2002), Reproductive abnormalities in glyphosate-resistant cotton caused by lower CP4-EPSPS levels in the male reproductive tissue, Weed Science, juillet 2002, vol. 50, no 4, p. 438-447, DOI https://dx.doi.org/10.1614/0043-1745(2002)050[0438:RAIGRC]2.0.CO;2 (résumé)
- JN Jenkins, Le coton [PDF], OCDE, 63 p. (voir chap. mécanisme de reproduction) p. 3/63 de la version [PDF]
- C. Dale Monks, Glenn Wehtje, Charles Burmester, Andrew J. Price, Michael G. Patterson, Dennis P. Delaney, Wilson Faircloth et Marshall R. Woods (2007), Glyphosate-Resistant Cotton Response to Glyphosate Applied in Irrigated and Nonirrigated Conditions, Weed Technology 21:4, 915-921, (résumé).
- Wendy A. Pline, Keith L. Edmisten, John W. Wilcut, Randy Wells et Judith Thomas (2003), Glyphosate-induced reductions in pollen viability and seed set in glyphosate-resistant cotton and attempted remediation by gibberellic acid (GA3), Weed Science 51:1, 19-27,
- Walter E. Thomas, Wesley J. Everman, Ian C. Burke, Clifford H. Koger et John W. Wilcut (2007), Absorption and Translocation of Glyphosate and Sucrose in Glyphosate-resistant Cotton, Weed Technology 21:2, 459-464, (résumé)
- Antoine Mottier, Valérie Kientz-Bouchart, Antoine Serpentini, Jean Marc Lebel, Awadhesh N. Jha, Katherine Costil (2013), Effects of glyphosate-based herbicides on embryo-larval development and metamorphosis in the Pacific oyster, Crassostrea gigas, Aquatic Toxicology, vol. 128–129, 15 mars 2013, p. 67-78 (résumé)
- Milan, M., Dalla Rovere, G., Smits, M., Ferraresso, S., Pastore, P., Marin, M. G. … et Matozzo, V. (2018), Ecotoxicological effects of the herbicide glyphosate in non-target aquatic species: Transcriptional responses in the mussel Mytilus galloprovincialis, Environmental Pollution, 237, 442-451|résumé
- (en) Erick V. S. Motta, Kasie Raymann et Nancy A. Moran, « Glyphosate perturbs the gut microbiota of honey bees », Proceedings of the National Academy of Sciences, , p. 201803880 (ISSN 0027-8424 et 1091-6490, PMID 30249635, DOI 10.1073/pnas.1803880115, lire en ligne, consulté le )
- (en) Warren Cornwall, « Common weed killer—believed harmless to animals—may be harming bees worldwide », sur Science, (consulté le ).
- « Le glyphosate neurotoxique pour les larves de moustiques », sur lanouvellerepublique.fr, (consulté le )
- (en) Fernando J. Guerrieri, Claudio R. Lazzari et Hugo Baglan, « Glyphosate impairs learning in Aedes aegypti mosquito larvae at field-realistic doses », Journal of Experimental Biology, vol. 221, no 20, , jeb187518 (ISSN 0022-0949 et 1477-9145, PMID 30127074, DOI 10.1242/jeb.187518, lire en ligne, consulté le )
- (en) Anja Weidenmüller, Andrea Meltzer, Stefanie Neupert et Alica Schwarz, « Glyphosate impairs collective thermoregulation in bumblebees », Science, vol. 376, no 6597, , p. 1122–1126 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.abf7482, lire en ligne, consulté le )
- (en) « Glyphosate weedkiller damages wild bee colonies, study reveals », sur the Guardian, (consulté le )
- Picetti, E., Generali, M., Mensi, F., Neri, G., Damia, R., Lippi, G., & Cervellin, G. (2017). Glyphosate ingestion causing multiple organ failure: a near-fatal case report. Acta Bio Medica Atenei Parmensis, 88(4), 533-537.
- Kim, Y. H., Lee, J. H., Cho, K. W., Lee, D. W., Kang, M. J., Lee, K. Y., … & Lee, N. K. (2016). Prognostic Factors in Emergency Department Patients with Glyphosate Surfactant Intoxication: Point‐of‐Care Lactate Testing| Basic & clinical pharmacology & toxicology, 119(6), 604-610.
- Langrand, J., Blanc-Brisset, I., Boucaud-Maitre, D., Puskarczyk, E., Nisse, P., Garnier, R., & Pulce, C. (2019). Sévérité des intoxications aiguës par des herbicides à base de glyphosate contenant de la POEA| Toxicologie Analytique et Clinique, 31(2), S45.|résumé
- Fabien Goubet, « Glyphosate, l'embarras européen en 10 questions », Le Temps, (lire en ligne, consulté le ) :
« Présenté comme un produit biodégradable et sans danger pour la santé et l'environnement lors de son apparition, le glyphosate a commencé à susciter des interrogations dans les années 1980 quand l'agence de l'environnement des États-Unis (EPA) l'a pour la première fois considéré comme « probablement cancérigène pour l'homme ». S'est ensuivie une véritable partie de ping-pong qui le vit classé tantôt cancérigène, tantôt pas. Partie qui continue aujourd'hui, et divise les institutions scientifiques. »
- Pesticides : Effets sur la santé., Inserm, coll. « Expertise collective », (lire en ligne)
- (en) Dan Charles, « EPA Weighs In On Glyphosate, Says It Likely Doesn't Cause Cancer », NPR.org, (lire en ligne, consulté le ).
- « Glyphosate not classified as a carcinogen by ECHA - All news - ECHA », sur echa.europa.eu (consulté le )
- Office fédéral de la sécurité alimentaire et des affaires vétérinaires, « Glyphosate », sur blv.admin.ch, (consulté le ).
- Samuel Jaberg, « Le débat sur le glyphosate fait aussi rage en Suisse », sur Swissinfo, (consulté le ).
- « Position de l'OFAG au sujet du glyphosate », sur blw.admin.ch, (consulté le ).
- « Décision de réévaluation RVD2017-01, Glyphosate », sur www.canada.ca (consulté le ).
- « New Zealand EPA declares glyphosate as noncarcinogenic », sur Service international pour l'acquisition d'applications agricoles biotechnologiques – Crop Biotech Update, (consulté le ).
- (en) « Regulatory position: consideration of the evidence for a formal reconsideration of glyphosate », sur apvma.gov.au
- (ja) « Avis du FSC sur le glyphosate », sur fsc.go.jp, (consulté le ).
- (en) Michael J. Davoren et Robert H. Schiestl, « Glyphosate-based herbicides and cancer risk: a post-IARC decision review of potential mechanisms, policy and avenues of research », Carcinogenesis, (DOI 10.1093/carcin/bgy105)
- Eriksson M, Hardell L, Carlberg M, et al. (2008) Pesticide exposure as risk factor for non-Hodgkin lymphoma including histopathological subgroup analysis. Int J Cancer ; 123:1657–63. doi:10.1002/ijc.23589
- De Roos AJ, Zahm SH, Cantor KP, et al. (2003) Integrative assessment of multiple pesticides as risk factors for non-Hodgkin's lymphoma among men. Occup Environ Med ;60:E11. doi:10.1136/oem.60.9.e11
- (en) Luoping Zhang, Iemaan Rana, Rachel M. Shaffer et Emanuela Taioli, « Exposure to Glyphosate-Based Herbicides and Risk for Non-Hodgkin Lymphoma: A Meta-Analysis and Supporting Evidence », Mutation Research/Reviews in Mutation Research, (DOI 10.1016/j.mrrev.2019.02.001, lire en ligne, consulté le )
- Stéphane Horel, « Glyphosate : une étude montre une nette augmentation du risque de lymphome », Le Monde, (lire en ligne, consulté le )
- Maria E. Leon, Leah H. Schinasi, Pierre Lebailly, Laura E. Beane Freeman, Karl-Christian Nordby, Gilles Ferro, Alain Monnereau, Maartje Brouwer, Séverine Tual, Isabelle Baldi, Kristina Kjaerheim, Jonathan N. Hofmann, Petter Kristensen, Stella Koutros, Kurt Straif, Hans Kromhout et Joachim Schüz, « Pesticide use and risk of non-Hodgkin lymphoid malignancies in agricultural cohorts from France, Norway and the USA: a pooled analysis from the AGRICOH consortium », International Journal of Epidemiology, (DOI 10.1093/ije/dyz017, lire en ligne, consulté le )
- (en) Schinasi et Leon, « Non-Hodgkin lymphoma and occupational exposure to agricultural pesticide chemical groups and active ingredients: a systematic review and meta-analysis », Int J Environ Res Public Health, (lire en ligne)
- (en) Chang et Delzell, « Systematic review and meta-analysis of glyphosate exposure and risk of lymphohematopoietic cancers », J Environ Sci Health B, (lire en ligne)
- Eriguchi, M., Iida, K., Ikeda, S., Osoegawa, M., Nishioka, K., Hattori, N., … & Hara, H. (2019). Parkinsonism relating to intoxication with glyphosate: A case report. Internal Medicine, 2028-18.
- Pan, L., Xu, M., Yang, D., Wang, B., Zhao, Q., Ding, E. M., & Zhu, B. (2017). The association between coronary artery disease and glyphosate exposure found in pesticide factory workers. Journal of Public Health and Emergency, 1(1).
- Gress, S., Lemoine, S., Séralini, G. E., & Puddu, P. E. (2015). Glyphosate-based herbicides potently affect cardiovascular system in mammals: review of the literature. Cardiovascular toxicology, 15(2), 117-126.
- Nakae, H., Kusanagi, M., Okuyama, M., & Igarashi, T. (2015). Paralytic ileus induced by glyphosate intoxication successfully treated using Kampo medicine. Acute medicine & surgery, 2(3), 214.
- « Cinq pesticides classés cancérogènes « probables » ou « possibles » par l'IARC », Le Monde, (ISSN 1950-6244, lire en ligne)
- Centre international de recherche sur le cancer, « Glyphosate », (consulté le ).
- Service planète, « Glyphosate : les États européens doivent se prononcer sur une nouvelle autorisation », Le Monde.fr, (ISSN 1950-6244, lire en ligne, consulté le )
- (en) Daniel Cressey, « Widely used herbicide linked to cancer », Nature News, (DOI 10.1038/nature.2015.17181, lire en ligne)
- (en) Kurt Straif, Heidi Mattock, Chiara Scoccianti et Neela Guha, « Carcinogenicity of tetrachlorvinphos, parathion, malathion, diazinon, and glyphosate », The Lancet Oncology, vol. 16, no 5, , p. 490–491 (ISSN 1470-2045 et 1474-5488, PMID 25801782, DOI 10.1016/S1470-2045(15)70134-8, lire en ligne, consulté le )
- « « Toutes les agences sanitaires indiquent que le glyphosate ne présente pas de risque » », Le Point, (lire en ligne)
- Stéphane Foucart, « Le désherbant Roundup classé cancérogène », Le Monde, (ISSN 1950-6244, lire en ligne, consulté le ).
- « Plant Production and Protection Division: The Joint FAO/WHO Meeting on Pesticide Residues (JMPR) », sur www.fao.org (consulté le )
- (en) « Pesticides Residues in Food 2016 - Joint FAO/WHO Meeting on Pesticides Residues, Report of the special session of the Joint Meeting of the FAO Panel of Experts on Pesticide Residues in Food and the Environment and the WHO Core Assessment Group on Pesticide Residues Geneva, Switzerland, 9–13 May 2016 », sur who.int, FAO Plant Production and Protection Paper 227, (consulté le )
- (en) A.L. Williams, R.E. Watson et J.M DeSesso, « Developmental and reproductive outcomes in humans and animals after glyphosate exposure: a critical analysis », US National Library of Medicine, 2012
- (en) G.M Williams, R. Kroes et I.C. Munro, « Safety evaluation and risk assessment of the herbicide Roundup and its active ingredient, glyphosate, for humans », US National Library of Medicine, 31 avril 2000
- « Glyphosate not classified as a carcinogen by ECHA », sur echa.europa.eu, (consulté le ).
- (en) Committee for Risk Assessment (RAC), « Glyphosate: no change proposed to hazard classification », sur echa.europa.eu, (consulté le )
- « Le Journal des Sciences, La Méthode scientifique », sur radiofrance.fr, (consulté le )
- https://www.touteleurope.eu/agriculture-et-peche/glyphosate-l-autorite-europeenne-de-securite-des-aliments-soutient-un-renouvellement-de-son-autorisation/
- « Glyphosate : Mise à jour du profil toxicologique par l'EFSA », sur Autorité européenne de sécurité des aliments, (consulté le ) ; voir aussi : EFSA. Conclusion on the peer review of the pesticide risk assessment of the active substance glyphosate. EFSA J 2015;13:4302. doi:10.2903/j.efsa.2015.4302.
- « Roundup : le risque cancérogène du glyphosate jugé « improbable » par une autorité européenne », Le Monde, (consulté le ).
- (en) European Food Safety Authority, « Conclusion on the peer review of the pesticide risk assessment of the active substance glyphosate », sur www.efsa.europa.eu (consulté le )
- « Avis de l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail », sur anses.fr.
- « Position de l'OFAG concernant la reclassification du glyphosate comme substance cancérigène par le IARC », sur blw.admin.ch, (consulté le ).
- (en) « The BfR has finalised its draft report for the re-evaluation of glyphosate », sur www.bfr.bund.de.
- (en) Meng Sun, « Glyphosate Listed Effective July 7, 2017, as Known to the State of California to Cause Cancer », OEHHA, (lire en ligne, consulté le ).
- (en) « Glyphosate to be Listed under Proposition 65 as Known to the State to Cause Cancer », sur oehha.ca.gov, (consulté le ).
- « Décision de réévaluation RVD2017-01, Glyphosate », sur www.canada.ca.
- (en) « Proposed Re-evaluation Decision », sur publications.gc.ca
- (en) « Review of the Evidence Relating to Glyphosate and Carcinogenicity », sur www.epa.govt.nz.
- (en) « Peer review of the pesticide risk assessment of the potential endocrine disrupting properties of glyphosate », sur onlinelibrary.wiley.com.
- Channa Jayasumana, Priyani Paranagama, Suneth Agampodi et Chinthaka Wijewardane, « Drinking well water and occupational exposure to Herbicides is associated with chronic kidney disease, in Padavi-Sripura, Sri Lanka », Environmental Health, vol. 14, no 1, (DOI 10.1186/1476-069x-14-6, lire en ligne).
- « It's official: Glyphosate import is banned », The Sunday Times Sri Lanka, (consulté le ).
- (en) « NASSL Statement on the Banning of Glyphosate », sur nassl.org (consulté le )
- (en) « Glyphosate ban lifted finally », sur www.ft.lk,
- (en) « Glyhosate ban lifted only for tea and rubber says Registrar of Pesticides », sur www.hirunews.lk
- Stéphane Foucart, « Ce que les « Monsanto Papers » révèlent du Roundup », Le Monde, .
- Stéphane Horel et Stéphane Foucart, « Soupçons sur les substances ajoutées au glyphosate dans les « produits formulés » », Le Monde, .
- H. I. Maibach, « Irritation, sensitization, photoirritation and photosensitization assays with a glyphosate herbicide », Contact Dermatitis, vol. 15, no 3, , p. 152–156 (ISSN 0105-1873, PMID 3780216, DOI 10.1111/j.1600-0536.1986.tb01316.x, lire en ligne, consulté le )
- FAO/OMS, Résidus de pesticides dans les aliments -1986. Réunion mixte sur les résidus de pesticides (JMPR), Rome, Italie. Document 77/2 de la FAO sur la production et la protection des plantes. p. 63 (1987)
- (en) L.B. Colvin, S.J. Moran et J.S. Miller, The metabolism of aminomethylphosphonic acid-14C in the laboratory rat., rapport no 303 (inédit), Monsanto Environmental Health Laboratory, Saint-Louis (MO) (1973), cité à la référence 21
- (en) Otmar Zoller, Peter Rhyn, Jürg A. Zarn et Vincent Dudler, « Urine glyphosate level as a quantitative biomarker of oral exposure », International Journal of Hygiene and Environmental Health, vol. 228, , p. 113526 (DOI 10.1016/j.ijheh.2020.113526, lire en ligne)
- (en) Moosa H. Faniband, Erika Norén, Margareta Littorin et Christian H. Lindh, « Human experimental exposure to glyphosate and biomonitoring of young Swedish adults », International Journal of Hygiene and Environmental Health, vol. 231, , p. 113657 (DOI 10.1016/j.ijheh.2020.113657, lire en ligne)
- (en) H.I. Maibach, Roundup formulation: Elimination and dermal penetration in monkeys, rapport no 81/349 (inédit), université de Californie, soumis à Monsanto (1983), 21
- Antoniou M, Habib M, Howard C, Jennings R, Leifert C, Nodar R, Robinson C et Fagan J (2003), Teratogenic effects of glyphosate-based herbicides: divergence of regulatory decisions from scientific evidence, J. Environ. Anal. Toxicol., S4(006):1–13.
- Dallegrave E (2003), Teratogenic potential of the herbicide glyphosate-roundup in Wistar rats. Toxicol Lett., 142(1–2):45–52.
- (en) Alejandra Paganelli, Victoria Gnazzo, Helena Acosta, Silvia L. López et Andrés E. Carrasco, Glyphosate-Based Herbicides Produce Teratogenic Effects on Vertebrates by Impairing Retinoic Acid Signaling, American Chemical Society, 9 août 2010.
- Claudia Bolognesi SB, Degan P, Gallerani E, Peluso M, Roberta Rabboni PR et Abbondandolo A, Genotoxic activity of glyphosate and its technical formulation roundup, J. Agric. Food Chem., 1997 ;45(5):1957–62.
- Richard S, Moslemi S, Sipahutar H, Benachour N, Seralini G-E. Differential effects of glyphosate and roundup on human placental cells and aromatase. Environ Health Perspect. 2005;113(6):716–20.
- Gasnier C, Dumont C, Benachour N, Clair E, Chagnon M-C, Séralini G-E. Glyphosate-based herbicides are toxic and endocrine disruptors in human cell lines. Toxicology. 2009;262:184–91.
- Benachour N, Sipahutar H, Moslemi S, Gasnier C, Travert C, Seralini GE. Time- and dose-dependent effects of roundup on human embryonic and placental cells. Arch Environ Contam Toxicol. 2007;53(1):126–33.
- de Araujo J.S.A., Delgado I.F., Paumgartten F.J.R., Glyphosate and adverse pregnancy outcomes, a systematic review of observational studies. BMC Public Health. 2016;16:1–3.
- Parvez S, R. R. Gerona, C. Proctor, M. Friesen, J. L. Ashby, J. L. Reiter, Z. Lui, P. D. Winchester (2018), Glyphosate exposure in pregnancy and shortened gestational length: a prospective Indiana birth cohort study ; Environmental Health 2018 17 (1)
- United States Geological Survey. Glyphosate herbicide found in many Midwestern streams. Antibiotics Not Common
- (en) Coupe RH, Kalkhoff SJ, Capel PD et Gregoire C, « Fate and Transport of glyphosate and aminomethylphosphonic acid in surface waters of agricultural basins », Pest. Manag. Sci., vol. 68(1), , p. 16–30.
- Battaglin W, Kolpin D, Scribner E, Kuivila K et Sandstrom M (2005), Glyphosphate, Other Herbicides, and Transformation products in Midwestern streams, J. Am. Water Resour. Assoc., 41(2):323–32.
- World Health Organization: Pesticide residues in food. FAO Plant Production and Protection Paper 2005;(182/1):1–273.
- (en) Julie Marc, Odile Mulner-Lorillon, Robert Bellé, « Glyphosate-based pesticides affect cell cycle regulation », .
- Hervé Morin, « Le désherbant le plus vendu au monde mis en accusation », Le Monde, (lire en ligne, consulté le )
- Céline Gasnier, Claire Laurant, Cécile Decroix-Laporte et Robin Mesnage, « Defined plant extracts can protect human cells against combined xenobiotic effects », Journal of Occupational Medicine and Toxicology, vol. 6, no 1, , p. 3 (ISSN 1745-6673, PMID 21251308, PMCID PMC3041787, DOI 10.1186/1745-6673-6-3, lire en ligne, consulté le )
- Afssa – saisine no 2008-SA-0034 - Glyphosate [PDF], Afssa, 26 mars 2009
- Motohiko Ukiya, Shingo Sawada, Takashi Kikuchi et Yasunori Kushi, « Cytotoxic and apoptosis-inducing activities of steviol and isosteviol derivatives against human cancer cell lines », Chemistry & Biodiversity, vol. 10, , p. 177-188 (ISSN 1612-1880, PMID 23418165, DOI 10.1002/cbdv.201200406, lire en ligne, consulté le )
- Takashi Kikuchi, Xin Pan, Koichi Ishii et Yasuhiro Nakamura, « Cytotoxic and apoptosis-inducing activities of 12-O-Acetylazedarachin B from the fruits of Melia azedarach in human cancer cell lines », Biological & Pharmaceutical Bulletin, vol. 36, , p. 135-139 (ISSN 1347-5215, PMID 23302647, lire en ligne, consulté le )
- Y. Matsushima-Hibiya, M. Watanabe, T. Kono et T. Kanazawa, « Purification and cloning of pierisin-2, an apoptosis-inducing protein from the cabbage butterfly, Pieris brassicae », European Journal of Biochemistry / FEBS, vol. 267, , p. 5742-5750 (ISSN 0014-2956, PMID 10971585, lire en ligne, consulté le ).
- (en) Consumer Factsheet on: Glyphosate
- (en) Alison Vanlaeys, Florine Dubuisson, Gilles-Eric Seralini et Carine Travert, « Formulants of glyphosate-based herbicides have more deleterious impact than glyphosate on TM4 Sertoli cells », Toxicology in Vitro, vol. 52, , p. 14–22 (DOI 10.1016/j.tiv.2018.01.002, lire en ligne, consulté le )
- « L'Argentine dans la tourmente du Roundup », (consulté le ).
- « Glyphosate - Comments from Germany on the paper by Paganelli, A. et al. (2010) », (consulté le ).
- Jenny R. Lenkowski, Gabriela Sanchez-Bravo et Kelly A. McLaughlin, « Low concentrations of atrazine, glyphosate, 2,4-dichlorophenoxyacetic acid, and triadimefon exposures have diverse effects on Xenopus laevis organ morphogenesis », Journal of Environmental Sciences (China), vol. 22, no 9, , p. 1305–1308 (ISSN 1001-0742, PMID 21174958, DOI 10.1016/s1001-0742(09)60254-0, lire en ligne, consulté le )
- (en) Wenyan Cai, Ying Ji, Xianping Song, Haoran Guo, Lei Han, Feng Zhang, Xin Liu, Hengdong Zhang, Baoli Zhu et Ming Xu, « Effects of glyphosate exposure on sperm concentration in rodents: A systematic review and meta-analysis », Elsevier BV, vol. 55, , p. 148–155 (ISSN 1382-6689, DOI 10.1016/j.etap.2017.07.015)
- (en) Gabriella Andreotti, « Glyphosate Use and Cancer Incidence in the Agricultural Health Study », Journal of the National Cancer Institute, (lire en ligne).
- Stéphane Foucart et Stéphane Horel, « La France pourrait interdire sur son territoire toutes les formulations à base de glyphosate », Le Monde, (ISSN 1950-6244, lire en ligne, consulté le ).
- Editor2, « Proven: Glyphosate herbicides change gene function and cause DNA damage », sur www.gmwatch.org, (consulté le )
- (en) Kate Kelland, « In glyphosate review, WHO cancer agency edited out 'non-carcinogenic' findings », sur Reuters, (consulté le ).
- (en) Kate Kelland, « Cancer agency left in the dark over glyphosate evidence », sur Reuters, (consulté le ).
- (en) « Monsanto Spin Doctors Target Cancer Scientist In Flawed Reuters Story », sur HuffPost, (consulté le ).
- (en) « Weedkiller scientist was paid £120,000 by cancer lawyers », sur www.lankaweb.com, (consulté le ).
- « Herbizid: Der dramatische Kampf um die Deutungshoheit von Glyphosat », Frankfurter Allgemeine Zeitung, (consulté le ).
- Stéphane Foucart et Stéphane Horel, « Glyphosate : Monsanto tente une dernière manœuvre pour sauver le Roundup », lemonde.fr, (consulté le ).
- C. Portier et al., « Differences in the carcinogenic evaluation of glyphosate between the International Agency for Research on Cancer (IARC) and the European Food Safety Authority (EFSA) », Journal of Epidemiology and Community Health, vol. 70, no 8, (lire en ligne).
- « Open Letter: Review of the Carcinogenicity of Glyphosate by EChA, EFSA and BfR », sur EURACTIV, (consulté le ).
- Catherine Ducruet, « « Monsanto papers » : une plongée dans les méthodes de lobbying de l'agro-semencier », Les Échos, (consulté le ).
- Gaël Lombart, « Monsanto et ses « trolls » : aux racines du soupçon », leparisien.fr, (lire en ligne).
- « House Science Panel Adds Climate-Denying Members », (consulté le ).
- « Freshman Congressman Andy Biggs named chair of an environment panel », (consulté le ).
- « Exclusive: Congressional committee questions operation of WHO cancer agency », Reuters, wed nov 01 20:32:43 utc 2017 (lire en ligne, consulté le ).
- « Lettre du Comité sur la science, l'espace et la technologie de la Chambre des représentants des États-Unis au CIRC », (consulté le ).
- « Chairmen Smith and Biggs letters to IARC, HHS re: Glyhposate », sur Comité sur la science, l'espace et la technologie de la Chambre des représentants des États-Unis (consulté le ).
- « Lettre du Comité sur la science, l'espace et la technologie de la Chambre des représentants des États-Unis au département de la Santé et des Services sociaux des États-Unis », (consulté le ).
- « Vous reprendrez bien un peu de glyphosate ? », sur JIM.fr, (consulté le )
- Stéphane Foucart, « Roundup : le pesticide divise l'Union européenne et l'OMS », lemonde.fr,
- https://doi.org/10.1186/s12940-022-00926-z
- (en) « EFSA statement addressing stakeholder concerns related to the EU assessment of glyphosate and the « Monsanto papers » », sur efsa.europa.eu, (consulté le ).
- Stéphane Foucart, « Glyphosate : l’expertise européenne truffée de copiés-collés de documents de Monsanto », lemonde.fr,
- « Glyphosate : l’expertise européenne a exclu de son analyse l’essentiel de la littérature scientifique », Le Monde.fr, (lire en ligne, consulté le )
- Stéphane Foucart, « Glyphosate : les autorités sanitaires ont plagié Monsanto », Le Monde, (lire en ligne, consulté le )
- (en) « Independence and quality assurance of the European glyphosate assessment », sur www.bfr.bund.de, BfR Communication n° 002/2019, (consulté le )
- Stéphane Foucart et Stéphane Horel, « Glyphosate : comment Monsanto mène sa guerre médiatique », Le Monde, (lire en ligne, consulté le ).
- (en) Van Bruggen, He, Shin, Mai, Jeong, Finckh et Morris, « Environmental and health effects of the herbicide glyphosate », Science of the Total Environment, (DOI 10.1016/j.scitotenv.2017.10.309)
- Brigitta Kurenbacha, Delphine Marjoshia, Carlos F., Amábile-Cuevas, Gayle C. Ferguson, William Godsoe, Paddy Gibson et Jack A. Heinemann (2015) « Sublethal Exposure to Commercial Formulations of the Herbicides Dicamba, 2,4-Dichlorophenoxyacetic Acid, and Glyphosate Cause Changes in Antibiotic Susceptibility in Escherichia coli and Salmonella enterica serovar Typhimurium », DOI 10.1128/mBio.00009-15, 24 mars 2015, mBio, vol. 6, no 2 e00009-15
- Loury Romain (2015) « Glyphosate: après le cancer, l’antibiorésistance ; Un problème aggravé par certains pesticides », Journal de l'environnement, 26 mars 2015
- Levy SB, Marshall B (2004), Antibacterial resistance worldwide: causes, challenges and responses, Nat. Med. 10 (Suppl 12):S122–S129. https://dx.doi.org/10.1038/nm1145.
- Alekshun MN, Levy SB (1999), The mar regulon: multiple resistance to antibiotics and other toxic chemicals, Trends Microbiol. 7: 410–413. https://dx.doi.org/10.1016/S0966-842X(99)01589-9
- Molina-González D, Alonso-Calleja C, Alonso-Hernando A, Capita R (2014), Effect of sub-lethal concentrations of biocides on the susceptibility to antibiotics of multi-drug resistant Salmonella enterica strains, Food Control 40: 329–334. https://dx.doi.org/10.1016/j.foodcont.2013.11.046
- Capita R, Riesco-Peláez F, Alonso-Hernando A, Alonso-Calleja C (2014), Exposure of Escherichia coli ATCC 12806 to sublethal concentrations of food-grade biocides influences its ability to form biofilm, resistance to antimicrobials, and ultrastructure, Appl. Environ. Microbiol. 80: 1268–1280. https://dx.doi.org/10.1128/AEM.02283-13
- Rosner JL (1985), Nonheritable resistance to chloramphenicol and other antibiotics induced bysalicylates and other chemotactic repellents in Escherichia coli K-12. Proc Natl Acad Sc iUSA 82: 8771–8774. http:// dx.doi.org/10.1073/pnas.82.24.8771
- Cohen SP, Levy SB, Foulds J et Rosner JL (1993), Salicylate induction of antibiotic resistance in Escherichia coli: activation of the mar operon and a mar-independent pathway, J. Bacteriol., 175: 7856–7862.
- Price CT, Lee IR et Gustafson JE (2000), The effects of salicylate on bacteria, Int. J. Biochem. Cell. Biol., 32: 1029–1043. https://dx.doi.org/10.1016/S1357 -2725(00)00042-X
- Aumercier M, Murray DM et Rosner JL (1990), Potentiation of susceptibility to aminoglycosides by salicylate in Escherichia coli, Antimicrob Agents Chemother, 34: 786–791. https://dx.doi.org/10.1128/AAC.34.5.786
- Hartog E, Menashe O, Kler E et Yaron S (2010), Salicylate reduces the antimicrobial activity of ciprofloxacin against extracellular Salmonella enterica serovar typhimurium, but not against Salmonella in macrophages, J. Antimicrob. Chemother. 65: 888–896. https://dx.doi.org/10.1093/jac/ dkq077
- Yang Y, Li B, Zou S, Fang HH , Zhang T (2014), Fate of antibiotic resistance genes in sewage treatment plant revealed by metagenomic approach, Water Res. 62: 97–106. https://dx.doi.org/10.1016/j.watres.2014.05.019.
- Evans JD (2003), Diverse origins of tetracycline resistance in the honey bee bacterial pathogen Paenibacillus larvae, J. Invertebr. Pathol. 83: 46–50. https://dx.doi.org/10.1016/S0022-2011(03)00039-9
- Ahmad A, Ghosh A, Schal C, Zurek L (2011), Insects in confined swine operations carry a large antibiotic resistant and potentially virulent enterococcal community, BMC Microbiol. 11: 23. https://dx.doi.org/10.1186/ 1471-2180-11-23
- Krüger M, Schledorn P, Schrödl W, Hoppe H.-W, Lutz W, Shehata AA (2014), Detection of glyphosate residues in animals and humans, J. Environ. Anal. Toxicol. 4:1–5. https://dx.doi.org/10.4172/2161-0525.1000210.
- environnement-magazine (2016), Pesticides : report du vote sur le glyphosate ; le 09/03/2016 Aucune décision n'a finalement été prise, mardi 8 mars à Bruxelles, à propos du renouvellement de l'autorisation de commercialiser dans l'UE le très controversé glyphosate
- [PDF] http://www.fs.fed.us/foresthealth/pesticide/pdfs/Surfactants.pdf
- Edginton AN1, Sheridan PM, Stephenson GR, Thompson DG, Boermans HJ., Comparative effects of pH and Vision herbicide on two life stages of four anuran amphibian species, Environ. Toxicol. Chem., avril 2004, 23(4):815-22.
- (en-GB) « Glyphosate not classified as a carcinogen by ECHA - All news - ECHA », sur echa.europa.eu (consulté le )
- Stéphane Foucart, « Glyphosate : l'expertise européenne truffée de copiés-collés de documents de Monsanto », lemonde.fr,
- « Des experts chargés d'évaluer les effets du glyphosate ont copié-collé Monsanto », L'Express, .
- Aude Massiot, « Glyphosate : l'autorité européenne de sécurité des aliments sous influence de Monsanto ? », Libération, .
- Stéphane Horel, « Glyphosate : réponse minimale de la Commission européenne à la société civile », lemonde.fr, (ISSN 1950-6244, lire en ligne, consulté le )
- Le glyphosate ne peut être considéré comme cancérogène, selon l'Agence européenne des produits chimiques, lefigaro.fr, 31 mai 2022
- Gabrielle Trottmann, « Glyphosate : pourquoi la Commission européenne propose de prolonger son autorisation dix ans de plus », sur francetvinfo.fr, (consulté le ).
- « Glyphosate : la France va s’abstenir lors du vote sur la reconduction pour dix ans de l’autorisation de l’herbicide dans l’Union européenne », sur LeMonde.fr avec AFP, (consulté le ).
- « Le glyphosate autorisé pour dix années supplémentaires dans l’UE par la Commission européenne », Le Monde.fr, (consulté le )
- Stéphane Foucart, « Glyphosate : pourquoi la Commission européenne a-t-elle renouvelé l’autorisation de l’herbicide ? Les réponses de notre journaliste Stéphane Foucart », sur LeMonde.fr (consulté le )
- « L’Allemagne va bannir le glyphosate en 2023, même si l’UE prolonge son autorisation », sur LeMonde.fr avec AFP, (consulté le ).
- Thomas Wieder, « En Allemagne, sur le dossier du glyphosate, la coalition au pouvoir est mise à l’épreuve », sur LeMonde.fr, (consulté le ).
- Eva Gomez, « Glyphosate : L'INRA rend compte des alternatives possibles », sur Environnement magazine, , en précisant qu'étant donnés les délais de la commande, ce rapport ne mobilise que des données rapidement mobilisables, « fermes des réseaux DEPHY Écophyto, rapports nationaux et internationaux, publications scientifiques et techniques ».
- « Glyphosate : 54 députés LREM demandent une interdiction « le plus rapidement possible » », sur 20 minutes, (consulté le ).
- « Glyphosate : Hulot propose un renouvellement limité à trois ans au niveau européen », L'Expansion, (lire en ligne, consulté le ).
- Ministres de l'Agriculture et de l'Alimentation, de la Transition écologique et solidaire, de la Santé, et de l'Enseignement supérieur et de la Recherche.
- Reboud X. et al, (2017) Usages et alternatives au glyphosate dans l'agriculture française. Novembre, Rapport Inra à la saisine Ref TR507024, 85 pp. Version PDF en ligne
- « Glyphosate : la FNSEA dénonce le « nationalisme » de Macron », sur Le Figaro, (consulté le ).
- OLC avec l'AFP, « Montpellier : Christiane Lambert (FNSEA) critique la position de Macron sur le glyphosate », France 3 Occitanie, (lire en ligne, consulté le )
- « Vidéo. En 2018, le glyphosate sera mesuré dans l'air du Grand-Est », 20 minutes, .
- Plan de sortie du Glyphosate, ministère de l'Agriculture et de l'Alimentation, 17 janvier 2019 (consulté le 27 février 2019)
- « Sortie du glyphosate : Stéphane Travert et Nicolas Hulot veulent des « engagements » à la mi-juillet », sur lemonde.fr, (consulté le )
- [SEAActu17h-20190226 La dangerosité du glyphosate de nouveau à l'étude, annonce l'Anses], sciencesetavenir.fr, 26 février 2019
- « Alternatives au glyphosate en viticulture, une évaluation économique », sur INRAE Institutionnel (consulté le )
- « Alternatives au glyphosate en arboriculture : évaluation économique des pratiques de désherbage », sur INRAE Institutionnel (consulté le )
- « Alternatives au glyphosate en grandes cultures : évaluation économique », sur INRAE Institutionnel (consulté le )
- Futura Sciences - Le Roundup Pro 360 contenant du glyphosate est désormais interdit d'utilisation, futura-sciences.com
- Lise Loumé, « Les pesticides de synthèse, comme le glyphosate, désormais interdits à la vente aux particuliers », sur sciencesetavenir.fr, .
- « Planetoscope - Statistiques : Les ventes du pesticide Roundup de Monsanto dans le monde », sur planetoscope.com (consulté le )
- Glyphosate : 36 produits interdits à la vente en France, Les Échos, 9 décembre 2019.
- « Information de l'Anses suite à l'article du Monde du 16 juin 2020 », sur anses.fr (consulté le )
- Doctissimo — Glyphosate : l'Anses abandonne son étude pour conflits d'intérêt.
- Alexandra Bensaïd, « L'UE et le glyphosate" », sur Radio France, France Inter, La chronique éco, (consulté le )
- « Glyphosate : aux Etats-Unis, Bayer débourse 10 milliards de dollars pour solder des litiges avec 100 000 plaignants exposés au Roundup de Monsanto », sur francetvinfo.fr avec AFP et Reuter, (consulté le )
- « Glyphosate : le Luxembourg contraint par la justice de réautoriser l’herbicide », sur LeMonde.fr avec AFP, (consulté le )
- « Précurseur en Amérique latine, le Mexique bannit le maïs génétiquement modifié et le glyphosate », sur LeMonde.fr avec AFP, (consulté le )
- « Le Vietnam interdit le glyphosate, au grand dam des Etats-Unis », sur LeMonde.fr avec AFP, (consulté le )
- « Désherbage La SNCF tient son alternative au glyphosate », sur Terre-net.fr avec AFP, (consulté le )
- « Quelles sont les alternatives au glyphosate ? », sur Franceinfo, (consulté le )
- Loi pour l'équilibre des relations commerciales dans le secteur agricole et alimentaire et une alimentation saine, durable et accessible à tous.
- Olivier De Bruyn, « Goliath" : le scandale des pesticides est (aussi) une affaire de cinéma », sur marianne.net, (consulté le ).
- Olivier De Bruyn, « « Goliath » : Gilles Lellouche face au géant du glyphosate », sur LesEchos.fr, (consulté le ).
- « Jeux d'influence (Arte) : "Sur le plan juridique, il a fallu faire très attention" », sur Premiere.fr, (consulté le ).
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- X. Reboud, M. Blanck, J.N. Aubertot, M.H. Jeuffroy, N. Munier-Jolain et M. Thiollet-Scholtus, sous la supervision de C. Huyghe, Usage et alternatives au glyphosate dans l'agriculture française, Rapport de l'INRA, 85 p., .
- Avigliano, L., Alvarez, N., Mac Loughlin, C. et Rodríguez, E.M. (2014), Effects of glyphosate on egg incubation, larvae hatching and ovarian rematuration, in the estuarine crab Neohelice granulata, Environmental Toxicology and Chemistry (résumé).
- (en) J.E. Franz, M.K. Mao et J.A. Sikorski, Glyphosate: a unique global herbicide, ACS Monograph 189, American Chemical Society, Washington, DC, 653 p., 1997 (résumé).
- R. Mesnagea, B. Bernayc et G.-É. Séralini, « Ethoxylated adjuvants of glyphosate-based herbicides are active principles of human cell toxicity », Toxicology, 2013, .
- (en) R.W. Smiley, A.G. Ogg et R. James Cook, « Influence of glyphosate on Rhizoctonia root rot, growth, and yield of barley », Plant disease, vol. 76, no 9, p. 937-942, 1992 (résumé avec Cat.INIST/CNRS).
- (en) G.R. Weeds, Glyphosate-Resistant Weeds (mauvaise herbes résistantes au glyphosate) 2005.
- (en) G.M. Dill, « Glyphosate-resistant crops: history, status and future », Pest. Management Science, vol. 61, p. 219–224, 2005.
- (en) P.C.C. Feng, J.E. Pratley et J.A. Bohn, Resistance to glyphosate in Lolium rigidum, II. Uptake, translocation, and metabolism, Weed Science 47, 412–415, 1999.
- (en) M.D.K. Owen et I.A. Zelaya, « Herbicide-resistant crops and weed resistance to herbicides », Pest. Management Science, vol. 61, p. 301–311, 2005.
- Pelfrène A. (2003), « Glyphosate : toxicologie et évaluation du risque pour l‘homme », Environnement, Risques & Santé, vol. 2, no 6, p. 323-334.
- (en) S.B. Powles, D.F. Lorraine-Colwill, J.J. Dellow et C. Preston, « http://www.ask-force.org/web/HerbizideTol/Powles-Evolved-Glyphosate-2006.pdf Evolved resistance to glyphosate in rigid ryegrass (Lolium rigidum) in Australia] », Weed Science, vol. 46, p. 604–607, 1998 (résumé).
- (en) M. Simarmata, J.E. Kaufmann et D. Penner, « Potential basis of glyphosate resistance in California rigid ryegrass (Lolium rigidum) », Weed Science, vol. 51, p. 678–682, 2003 (résumé).
- (en) Simarmata, M. et Penner, D. (2008), The basis for glyphosate resistance in rigid ryegrass (Lolium rigidum) from California, Weed Science, 56(2), 181-188 (résumé).
- (en) CIRC (2016), Some Organophosphate Insecticides and Herbicides - Glyphosate, IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 112 ([2]).
- Marie-Monique_Robin, « Le Roundup face à ses juges », La Découverte, (ISBN 9782707197399, consulté le ).
Articles connexes[modifier | modifier le code]
- Roundup
- Pesticide
- Herbicide
- Résidu de pesticides
- Organisme génétiquement modifié
- Résistance au glyphosate
- Agnotologie
- Monsanto
- Bayer
- Monsanto Papers
Audio[modifier | modifier le code]
- Adélaïde Tenaglia, Jean-Guillaume Santi, Stéphane Foucart, « Glyphosate : un « cancérogène probable » bientôt réautorisé ? » [audio], sur LeMonde.fr, L’Heure du Monde, (consulté le ).
Vidéo[modifier | modifier le code]
- Héloïse Bauchet, Félix Pommier, Stéphane Foucart, « Pourquoi le glyphosate revient-il inlassablement dans le débat ? Comprendre en trois minutes » [vidéo], sur LeMonde.fr, (consulté le ).
Liens externes[modifier | modifier le code]
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- La pollution par les pesticides des eaux de France, sur actualites-news-environnement.com
- Quantités de substances pesticides achetées par des professionnels en 2017, sur mediapart.carto.com
- Le renouveau des maires en matière de réglementation des produits phytosanitaires (glyphosate)





