« Drépanocytose » : différence entre les versions
Rédaction. |
Rédaction. |
||
| Ligne 630 : | Ligne 630 : | ||
La chaîne β produite ne diffère donc d'une chaîne β normale que par un seul résidu d'[[Acide aminé protéinogène|acide aminé]], en position 6 selon la nomenclature historique, ou 7 selon la nomenclature actuelle{{Note|groupe=alpha|La littérature consacrée à la drépanocytose remonte jusqu'aux [[années 1940]], et on a longtemps ignoré le [[Résidu (biochimie)|résidu]] de [[méthionine]] initial dans la numérotation des [[Acide aminé protéinogène|acides aminés]] des [[Sous-unité protéique|sous-unités]] de l'[[hémoglobine]], de sorte qu'il est généralement fait mention d'une substitution E6V pour définir cette mutation ; la préconisation actuelle est cependant de commencer la numérotation en incluant la méthionine initiale, ce qui conduit à définir la mutation de l'hémoglobine S plutôt comme une substitution E7V.}}. L'hémoglobine résultante est dite S, initiale du mot anglais ''{{lang|en|sickle}}'' signifiant « faucille », et est notée HbS, de formule {{fchim|α|2|β{{exp|S}}|2}}. |
La chaîne β produite ne diffère donc d'une chaîne β normale que par un seul résidu d'[[Acide aminé protéinogène|acide aminé]], en position 6 selon la nomenclature historique, ou 7 selon la nomenclature actuelle{{Note|groupe=alpha|La littérature consacrée à la drépanocytose remonte jusqu'aux [[années 1940]], et on a longtemps ignoré le [[Résidu (biochimie)|résidu]] de [[méthionine]] initial dans la numérotation des [[Acide aminé protéinogène|acides aminés]] des [[Sous-unité protéique|sous-unités]] de l'[[hémoglobine]], de sorte qu'il est généralement fait mention d'une substitution E6V pour définir cette mutation ; la préconisation actuelle est cependant de commencer la numérotation en incluant la méthionine initiale, ce qui conduit à définir la mutation de l'hémoglobine S plutôt comme une substitution E7V.}}. L'hémoglobine résultante est dite S, initiale du mot anglais ''{{lang|en|sickle}}'' signifiant « faucille », et est notée HbS, de formule {{fchim|α|2|β{{exp|S}}|2}}. |
||
Cette [[Mutation (génétique)|mutation]] s'est probablement produite plusieurs fois de manière indépendante dans des zones géographiques distinctes, comme le suggèrent les études par [[Enzyme de restriction|enzymes de restriction]]. Ces [[haplotype]]s sont dits ''Sénégal'', ''Bénin'', ''Cameroun'', '' |
Cette [[Mutation (génétique)|mutation]] s'est probablement produite plusieurs fois de manière indépendante dans des zones géographiques distinctes, comme le suggèrent les études par [[Enzyme de restriction|enzymes de restriction]]. Ces [[haplotype]]s sont dits ''Sénégal'', ''Bénin'', ''Cameroun'', ''bantou'' (originaire d'[[Afrique centrale]]) et ''arabo-indien'' ([[péninsule arabique]] et [[sous-continent indien]]). Ils ont une certaines importance clinique, car certains sont associés à une production accrue d'[[hémoglobine fœtale]] HbF, notamment ''Sénégal'' et ''arabo-indien'', davantage que ''Bénin'' et ''Cameroun'', ce qui tend a atténuer les complications de la maladie<ref name="10.1002/ajh.2830440214"> |
||
{{Article |
{{Article |
||
| langue = en |
| langue = en |
||
| Ligne 779 : | Ligne 779 : | ||
La déformation des globules rouges d'un frottis en faucille ou en feuille de houx peut être induite par addition d'un [[Réducteur (chimie)|réducteur]] comme le [[métabisulfite de potassium]] {{fchim|K|2|S|2|O|5}}, le [[métabisulfite de sodium]] {{fchim|Na|2|S|2|O|5}} ou l'[[acide ascorbique]] . La présence {{nobr|d'hémoglobine S}} peut être établie à l'aide d'une [[Solution (chimie)|solution]] [[Réducteur (chimie)|réductrice]], par exemple de [[dithionite de sodium]] {{fchim|Na|2|S|2|O|4}}, qui se trouble en présence d'HbS mais demeure claire en présence d'hémoglobine normale. |
La déformation des globules rouges d'un frottis en faucille ou en feuille de houx peut être induite par addition d'un [[Réducteur (chimie)|réducteur]] comme le [[métabisulfite de potassium]] {{fchim|K|2|S|2|O|5}}, le [[métabisulfite de sodium]] {{fchim|Na|2|S|2|O|5}} ou l'[[acide ascorbique]] . La présence {{nobr|d'hémoglobine S}} peut être établie à l'aide d'une [[Solution (chimie)|solution]] [[Réducteur (chimie)|réductrice]], par exemple de [[dithionite de sodium]] {{fchim|Na|2|S|2|O|4}}, qui se trouble en présence d'HbS mais demeure claire en présence d'hémoglobine normale. |
||
La présence d'hémoglobine anormale peut être détectée par [[électrophorèse sur gel]], un mode d'[[électrophorèse]] dans lequel les différentes hémoglobines se déplacent à des vitesses différentes qui permettent de les caractériser. L'hémoglobine falciforme HbS et l'hémoglobine C falciforme HbSC, qui sont les deux principales formes d'hémoglobine drépanocytaire, peuvent être identifiées par cette technique. La [[chromatographie en phase liquide à haute performance]] (CLHP) permet de confirmer le diagnostic. Il est rare de devoir recourir à une [[analyse génétique]], car les autres méthodes d'investigation permettent d'identifier précisément l'{{nobr|hémoglobine S}} et l'{{nobr|[[hémoglobine C]]}}. |
La présence d'hémoglobine anormale peut être détectée par [[électrophorèse sur gel]], un mode d'[[électrophorèse]] dans lequel les différentes hémoglobines se déplacent à des vitesses différentes qui permettent de les caractériser. L'hémoglobine falciforme HbS et l'{{nobr|hémoglobine C}} falciforme HbSC, qui sont les deux principales formes d'hémoglobine drépanocytaire, peuvent être identifiées par cette technique. La [[chromatographie en phase liquide à haute performance]] (CLHP) permet de confirmer le diagnostic. Il est rare de devoir recourir à une [[analyse génétique]], car les autres méthodes d'investigation permettent d'identifier précisément l'{{nobr|hémoglobine S}} et l'{{nobr|[[hémoglobine C]]}}. |
||
Une crise drépanocytaire étant souvent induite par une infection, il est conseillé de rechercher une infection par test urinaire ou [[radiographie du thorax]]. |
Une crise drépanocytaire étant souvent induite par une infection, il est conseillé de rechercher une infection par test urinaire ou [[radiographie du thorax]]. |
||
Les personnes ayant le trait |
Les personnes ayant le [[trait drépanocytaire]] — [[hétérozygote]]s SA — peuvent avoir recours à un [[conseil génétique]] avant de concevoir un enfant. Le [[diagnostic prénatal]] est réalisé à partir d'un échantillon de sang [[Fœtus humain|fœtal]] ou de [[liquide amniotique]], cette dernière technique présentant moins de risques. |
||
Dans les [[pays |
Dans les [[pays développé]]s, le diagnostic se fait en période néonatale si les parents sont malades ou à risque. Dans les [[pays en voie de développement]], le diagnostic se fait souvent à la première manifestation ou complication drépanocytaire. Le dépistage néonatal pourrait se traduire par une amélioration du [[Pronostic (médecine)|pronostic]]<ref name="PMID 3368274"> |
||
{{Article |
{{Article |
||
| langue = en |
| langue = en |
||
| Ligne 806 : | Ligne 806 : | ||
== Traitements == |
== Traitements == |
||
Ils comportent un aspect préventif : éviction des facteurs déclenchant les crises (froid, altitude, infections, déshydratation) ; supplémentation en [[Vitamine B9|folates]], traitement préventif des infections à [[pneumocoque]] et [[méningocoque]] ([[vaccination]])<ref name="10.1002/14651858.CD003885.pub2"> |
Ils comportent un aspect préventif : éviction des facteurs déclenchant les crises (froid, altitude, infections, déshydratation) ; supplémentation en [[Vitamine B9|folates]] (dont l'intérêt réel est cependant aujourd'hui remis en cause), traitement préventif des infections à [[pneumocoque]] et [[méningocoque]] ([[vaccination]])<ref name="10.1002/14651858.CD003885.pub2"> |
||
{{Article |
{{Article |
||
| langue = en |
| langue = en |
||
| Ligne 913 : | Ligne 913 : | ||
| bibcode = |
| bibcode = |
||
}}</ref>. |
}}</ref>. |
||
Le traitement de l'[[ostéonécrose]] résultant des crises drépanocytaires a pour objectif de réduire les douleurs et de maintenir la mobilité des [[Articulation (anatomie)|articulations]]<ref name="10.1002/14651858.CD004344.pub6"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Arturo J. Martí‐Carvajal, Ivan Solà et Luis H Agreda‐Pérez |
|||
| titre = Treatment for avascular necrosis of bone in people with sickle cell disease |
|||
| périodique = The Cochrane Database of Systematic Reviews |
|||
| volume = |
|||
| numéro = 8 |
|||
| jour = 9 |
|||
| mois = août |
|||
| année = 2016 |
|||
| numéro article = CD004344 |
|||
| url texte = http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD004344.pub6/abstract |
|||
| consulté le = 28 décembre 2017 |
|||
| doi = 10.1002/14651858.CD004344.pub6 |
|||
| pmid = 27502327 |
|||
| bibcode = |
|||
}}</ref>. Les traitements actuels font appel à la [[physiothérapie]], les [[Traitement de la douleur|traitements de la douleur]], l'[[arthroplastie]] et la greffe osseuse. |
|||
[[Fichier:Hydroxyurea.png|vignette|redresse=.5|[[Hydroxyurée]].]] |
[[Fichier:Hydroxyurea.png|vignette|redresse=.5|[[Hydroxyurée]].]] |
||
| Ligne 1 050 : | Ligne 1 069 : | ||
| bibcode = |
| bibcode = |
||
}}</ref>, cette molécule a démontré son intérêt dans la réduction des crises vaso-occlusives et dans la diminution de la survenue du syndrome thoracique aigu. |
}}</ref>, cette molécule a démontré son intérêt dans la réduction des crises vaso-occlusives et dans la diminution de la survenue du syndrome thoracique aigu. |
||
''A contrario'', certains « médicaments miracles » à l'efficacité non démontrée ont pu être annoncés localement par des personnalités controversées. Ainsi, un remède appelé « VK500 » avait été proposé en 2007 au [[Bénin]] contre la drépanocytose ; aucune étude sérieuse n'a cependant jamais trouvé la moindre efficacité thérapeutique à cette préparation<ref>Noir&Blanc [http://www.noir-et-blanc.org/component/option,com_frontpage/Itemid,1/lang,fr/ ''Escroquerie : le VK500'']</ref>. |
|||
=== Greffe de moelle osseuse === |
=== Greffe de moelle osseuse === |
||
| Ligne 1 056 : | Ligne 1 077 : | ||
Les hématies sont produites à partir de [[Cellule souche|cellules souches]] dans la [[moelle osseuse]]. En détruisant la moelle osseuse du malade et en la remplaçant par celle d'un donneur, il y a possibilité d'obtenir une guérison totale. Environ {{unité|200|greffes}} ont été réalisées dans le monde chez des drépanocytaires, permettant d'obtenir la guérison dans 85 % des cas<ref>[http://www.chu-lyon.fr/internet/rech_exp/expertise/drepanocytose/drepanocytose.htm#3 ''Site des hôpitaux de Lyon''], consulté le 30 avril 2008]</ref>. Il faut cependant un donneur apparenté le plus possible : un frère ou une sœur. Il y a la possibilité pour les parents de recourir à une [[Fécondation in vitro|fécondation ''in vitro'']] avec sélection par [[Diagnostic préimplantatoire|DPI]] d'[[embryon]]s compatibles pour la greffe. Cette voie de traitement dite du « [[bébé médicament]] » est très encadrée par les lois de [[bioéthique]]. |
Les hématies sont produites à partir de [[Cellule souche|cellules souches]] dans la [[moelle osseuse]]. En détruisant la moelle osseuse du malade et en la remplaçant par celle d'un donneur, il y a possibilité d'obtenir une guérison totale. Environ {{unité|200|greffes}} ont été réalisées dans le monde chez des drépanocytaires, permettant d'obtenir la guérison dans 85 % des cas<ref>[http://www.chu-lyon.fr/internet/rech_exp/expertise/drepanocytose/drepanocytose.htm#3 ''Site des hôpitaux de Lyon''], consulté le 30 avril 2008]</ref>. Il faut cependant un donneur apparenté le plus possible : un frère ou une sœur. Il y a la possibilité pour les parents de recourir à une [[Fécondation in vitro|fécondation ''in vitro'']] avec sélection par [[Diagnostic préimplantatoire|DPI]] d'[[embryon]]s compatibles pour la greffe. Cette voie de traitement dite du « [[bébé médicament]] » est très encadrée par les lois de [[bioéthique]]. |
||
{{article connexe|Transplantation de moelle osseuse}} |
|||
=== Thérapies |
=== Thérapies géniques === |
||
Des souris drépanocytaires ont pu être guéries en introduisant chez ces animaux un gène produisant une hémoglobine |
Des souris drépanocytaires ont pu être guéries en introduisant chez ces animaux un gène produisant une hémoglobine « anti-drépanocytaire » en quantité élevée<ref name="10.1126/science.1065806"> |
||
{{Article |
|||
| langue = en |
|||
Un essai clinique de phase 1/2 est en cours, évaluant la sécurité et l'efficacité de la thérapie génique des β-hémoglobinopathies (drépanocytose et β-thalassémie majeure) par transplantation de cellules souches CD34+ autologues transduites ex vivo avec un vecteur lentiviral β A-T87Q-globine. |
|||
| nom1 = Robert Pawliuk, Karen A. Westerman, Mary E. Fabry, Emmanuel Payen, Robert Tighe, Eric E. Bouhassira, Seetharama A. Acharya, James Ellis, Irving M. London, Connie J. Eaves, R. Keith Humphries, Yves Beuzard, Ronald L. Nagel et Philippe Leboulch |
|||
| titre = Correction of Sickle Cell Disease in Transgenic Mouse Models by Gene Therapy |
|||
Le 2 mars 2017, l’équipe du professeur Marina Cavazzana, de l’Institut des maladies génétiques Imagine, annonce avoir soigné un patient drépanocytaire par thérapie génique<ref>{{Article|langue=fr|prénom1=Sandrine|nom1=Cabut|titre=Drépanocytose : succès d’une thérapie génique chez le premier patient traité|périodique=Le Monde.fr|date=2017-03-01|issn=1950-6244|lire en ligne=http://www.lemonde.fr/sante/article/2017/03/01/drepanocytose-succes-d-une-therapie-genique-chez-le-premier-patient-traite_5087805_1651302.html|consulté le=2017-03-09}}</ref>. |
|||
| périodique = Science |
|||
| volume = 294 |
|||
Il est peu probable que ces nouvelles thérapies deviennent, à court terme, d'utilisation courante, à cause des problèmes techniques (validation scientifique), économiques (coût élevé), et éthiques (inégalité d'accès aux soins dans le monde). L'extension aux pays en voie de développement des traitements employés dans les pays développés constituerait déjà un progrès significatif. De même, une meilleure compréhension des facteurs environnementaux permettrait de préciser les conseils aux patients atteints de drépanocytose et d'améliorer leur qualité de vie où qu'ils se trouvent<ref name="10.1056/NEJMra1510865"/>. |
|||
| numéro = 5550 |
|||
| jour = 14 |
|||
| mois = décembre |
|||
| année = 2001 |
|||
| pages = 2368-2371 |
|||
| url texte = http://science.sciencemag.org/content/294/5550/2368 |
|||
| consulté le = 28 décembre 2017 |
|||
| doi = 10.1126/science.1065806 |
|||
| pmid = 11743206 |
|||
| bibcode = 2001Sci...294.2368P |
|||
}}</ref>. Un essai clinique de phase 1/2 a été programmé à Paris au début du siècle pour évaluer la sécurité et l'efficacité de la [[thérapie génique]] des β-hémoglobinopathies (drépanocytose et [[Thalassémie bêta|thalassémie β]] majeure) par transplantation de [[Cellule souche|cellules souches]] CD34+ autologues transduites ''ex vivo'' avec un [[Vecteur viral|vecteur]] [[Lentivirus|lentiviral]] β A-T87Q-globine<ref name="10.1196/annals.1345.007"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Arthur Bank, Ronald Dorazio et Philippe Leboulch |
|||
| titre = A Phase {{I}}/{{II}} Clinical Trial of β-Globin Gene Therapy for β-Thalassemia |
|||
| périodique = Annals of the New York Academy of Science |
|||
| volume = 1054 |
|||
| numéro = 1 |
|||
| jour = |
|||
| mois = novembre |
|||
| année = 2005 |
|||
| pages = 308-316 |
|||
| url texte = http://onlinelibrary.wiley.com/doi/10.1196/annals.1345.007/full |
|||
| consulté le = 28 décembre 2017 |
|||
| doi = 10.1196/annals.1345.007 |
|||
| pmid = 16339679 |
|||
| bibcode = 2005NYASA1054..308B |
|||
}}</ref>. Un adolescent de {{unité|13|ans}} a ainsi été traité contre la drépanocytose par thérapie génique en octobre 2014<ref name="Le Monde 2017-03-01"> |
|||
{{Lien web |
|||
| langue = fr |
|||
| auteur1 = Sandrine Cabut |
|||
| url = http://www.lemonde.fr/sante/article/2017/03/01/drepanocytose-succes-d-une-therapie-genique-chez-le-premier-patient-traite_5087805_1651302.html |
|||
| titre = Drépanocytose : succès d’une thérapie génique chez le premier patient traité |
|||
En savoir plus sur http://www.lemonde.fr/sante/article/2017/03/01/drepanocytose-succes-d-une-therapie-genique-chez-le-premier-patient-traite_5087805_1651302.html |
|||
| jour = 1 |
|||
| mois = mars |
|||
| année = 2017 |
|||
| site = [[Le Monde.fr|www.lemonde.fr]] |
|||
| consulté le = 28 décembre 2017 |
|||
}}.</ref>, et les résultats publiés en mars 2017 se sont révélés très encourageants<ref name="10.1056/NEJMoa1609677"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Jean-Antoine Ribeil, Salima Hacein-Bey-Abina, Emmanuel Payen, Alessandra Magnani, Michaela Semeraro, Elisa Magrin, Laure Caccavelli, Benedicte Neven, Philippe Bourget, Wassim El Nemer, Pablo Bartolucci, Leslie Weber, Hervé Puy, Jean-François Meritet, David Grevent, Yves Beuzard, Stany Chrétien, Thibaud Lefebvre, Robert W. Ross, Olivier Negre, Gabor Veres, Laura Sandler, Sandeep Soni, Mariane de Montalembert, Stéphane Blanche, Philippe Leboulch et Marina Cavazzana |
|||
| titre = Gene Therapy in a Patient with Sickle Cell Disease |
|||
| périodique = The New England Journal of Medicine |
|||
| volume = 376 |
|||
| numéro = 9 |
|||
| jour = 2 |
|||
| mois = mars |
|||
| année = 2017 |
|||
| pages = 848-855 |
|||
| url texte = http://www.nejm.org/doi/full/10.1056/NEJMoa1609677 |
|||
| consulté le = 28 décembre 2017 |
|||
| doi = 10.1056/NEJMoa1609677 |
|||
| pmid = 28249145 |
|||
| bibcode = |
|||
}}</ref>. |
|||
Il est cependant peu probable que ces nouvelles thérapies puissent devenir d'utilisation courante à brève échéance en raison de difficultés techniques (validation scientifique), économiques (coût élevé) et éthiques (inégalité d'accès aux soins dans le monde). En attendant, l'extension aux pays en voie de développement des traitements actuellement disponibles dans les pays développés constituerait déjà un progrès significatif. De même, une meilleure compréhension des facteurs environnementaux permettrait de préciser les conseils aux patients atteints de drépanocytose et d'améliorer leur qualité de vie où qu'ils se trouvent<ref name="10.1056/NEJMra1510865"/>. |
|||
En [[2007]], le très controversé « VK500 » avait été proposé au [[Bénin]] comme traitement de la drépanocytose ; aucune étude clinique sérieuse n'a cependant jamais trouvé la moindre efficacité à cette préparation<ref>Noir&Blanc [http://www.noir-et-blanc.org/component/option,com_frontpage/Itemid,1/lang,fr/ ''Escroquerie : le VK500'']</ref>. |
|||
=== Bonnes pratiques aidant à prévenir les complications === |
=== Bonnes pratiques aidant à prévenir les complications === |
||
| Ligne 1 090 : | Ligne 1 167 : | ||
== Épidémiologie, écoépidémiologie == |
== Épidémiologie, écoépidémiologie == |
||
La drépanocytose est la [[maladie génétique]] monogénique (liée à un seul gène) la plus répandue dans le monde<ref name="10.1056/NEJMra1510865"/>. Selon l'[[Organisation mondiale de la santé|OMS]], {{unité|300000|enfants}} naissent dans le monde chaque année avec une anomalie majeure de l'hémoglobine dont la plus fréquente est celle de la drépanocytose<ref name="WHA59.9"> |
|||
[[Image:Sickle cell distribution.jpg|vignette|Distribution de la drépanocytose.]] |
|||
{{Lien web |
|||
[[Image:Malaria distribution.jpg|vignette|Distribution du [[paludisme]].]] |
|||
| langue = en |
|||
| url = http://apps.who.int/gb/archive/pdf_files/WHA59/A59_9-en.pdf |
|||
C'est la maladie génétique monogénique (liée à un seul gène) la plus répandue dans le monde<ref name="10.1056/NEJMra1510865"/>. Selon l'[[OMS]], {{formatnum:300000}} enfants naissent dans le monde chaque année avec une anomalie majeure de l'hémoglobine dont la plus fréquente est celle de la drépanocytose<ref>[http://apps.who.int/gb/ebwha/pdf_files/WHA59/A59_9-fr.pdf OMS 2006]</ref>. En 2015, la grande majorité de ces naissances ont lieu dans trois pays : Nigéria, République Démocratique du Congo, Inde<ref name="10.1056/NEJMra1510865"/>. |
|||
| titre = Sickle-cell anaemia |
|||
| jour = 24 |
|||
| mois = avril |
|||
| année = 2006 |
|||
| site = [[Organisation mondiale de la santé|www.who.int]] |
|||
| consulté le = 28 décembre 2017 |
|||
}}.</ref>. En 2015, la grande majorité de ces naissances ont eu lieu dans trois pays : [[Nigeria]], [[République démocratique du Congo]], [[Inde]]<ref name="10.1056/NEJMra1510865"/>. |
|||
L'[[allèle]] S, responsable de l'anomalie, est surtout répandu dans le continent africain (atteignant dans certaines populations la fréquence de 30 %) ; on le trouve également en [[Inde]], en [[Arabie saoudite]] et dans d'autres régions du bord de la [[Méditerranée]], en [[Italie]] (surtout en [[Sicile]]), en [[Grèce]] et en [[Anatolie]]. Les migrations ont accru la fréquence de cette maladie sur le continent [[Amérique|américain]]. |
L'[[allèle]] S, responsable de l'anomalie, est surtout répandu dans le continent africain (atteignant dans certaines populations la fréquence de 30 %) ; on le trouve également en [[Inde]], en [[Arabie saoudite]] et dans d'autres régions du bord de la [[Méditerranée]], en [[Italie]] (surtout en [[Sicile]]), en [[Grèce]] et en [[Anatolie]]. Les migrations ont accru la fréquence de cette maladie sur le continent [[Amérique|américain]]. |
||
Cette distribution se superpose assez bien avec celle d'une autre maladie d'origine infectieuse, le [[paludisme]] ou |
Cette distribution se superpose assez bien avec celle d'une autre maladie d'origine infectieuse, le [[paludisme]], ou ''malaria'', notamment la forme à ''[[Plasmodium falciparum]]'', la plus grave. La présence élevée de la drépanocytose en Afrique semble être un cas de [[polymorphisme génétique]] équilibré résultant d'une [[sélection naturelle]] par [[avantage hétérozygote]] : en effet, les [[Porteur sain|porteurs sains]] — [[hétérozygote]]s SA, ayant le [[trait drépanocytaire]] — sont relativement protégées contre ''{{nobr|P. falciparum}}''. La preuve épidémiologique de cette protection a été apportée par plusieurs études depuis 2002<ref name="Bartolucci 2014"/>. |
||
<br />L'apparition, puis la sélection, de cette mutation se sont faites en différents points du monde, coïncidant avec les zones d'endémie du paludisme. Ces évènements se seraient produits entre 70 000 et 150 000 ans. Parmi les différents [[haplotype]]s connus (ensembles de gènes liés), 5 seraient survenus de façon indépendante : haplotype Sénégal (côte atlantique de l'Afrique de l'Ouest), haplotype Bénin (golfe du Bénin), haplotype Cameroun, haplotype Bantou (Afrique équatoriale), haplotype Arabo-indien (Inde et péninsule arabique)<ref name="Bartolucci 2014"/>. |
|||
L'apparition, puis la sélection, de cette mutation se sont faites en différents points du monde, coïncidant avec les zones d'[[endémie]] du paludisme. Ces évènements se seraient produits entre {{unité|70000|et=150000|ans}}. Parmi les différents [[haplotype]]s connus (ensembles de gènes liés), cinq seraient apparus de façon indépendante : haplotype ''Sénégal'' (côte atlantique de l'Afrique de l'Ouest), haplotype ''Bénin'' ([[golfe du Bénin]]), haplotype ''Cameroun'', haplotype ''bantou'' ([[Afrique équatoriale]]), haplotype ''arabo-indien'' ([[sous-continent indien]] et [[péninsule arabique]])<ref name="Bartolucci 2014"/>. |
|||
Récemment, il a été montré que certains cervidés (plusieurs espèces de [[Muntjacs]]) sont également porteurs d'une mutation proche (connue depuis [[1840]], mais dont la cause génétique n'a été publiée qu'en 2017)<ref name=Science2017Leslie/>. Chez ces animaux la mutation concerne un [[acide aminé]] ([[acide glutamique]] remplacé par une [[valine]]) mais pas au même emplacement que chez l'Homme, et contrairement à ce que l'on observe chez les humains, les cerfs produisant des globules rouges falciformes semblent en parfaite santé<ref name=Science2017Leslie/>. De plus chez l'Homme l'anomalie de forme apparait ou est plus importante quand le taux d'oxygène sanguin est bas, alors que c'est l'inverse chez le muntjak<ref name=Science2017Leslie>Leslie M (2017) [http://www.sciencemag.org/news/2017/12/170-year-old-mystery-solved-why-deer-have-deformed-blood-cells-just-some-people ''170-year-old mystery solved: Why deer have deformed blood cells just like some people''], Science News publiée le 18 décembre 2017 </ref>. |
|||
Récemment, il a été montré que certains [[Cervidae|cervidés]] — plusieurs espèces de [[Muntiacus|muntjacs]] — sont également porteurs d'une [[Mutation (génétique)|mutation]] proche de celle de la drépanocytose, connue depuis [[1840]] mais dont la cause génétique n'a été publiée qu'en 2017<ref name="10.1126/science.aar7918"> |
|||
{{Lien web |
|||
| langue = en |
|||
| auteur1 = Mitch Leslie |
|||
| url = http://www.sciencemag.org/news/2017/12/170-year-old-mystery-solved-why-deer-have-deformed-blood-cells-just-some-people |
|||
| titre = 170-year-old mystery solved: Why deer have deformed blood cells just like some people |
|||
| jour = 18 |
|||
| mois = décembre |
|||
| année = 2017 |
|||
| site = [[Science (revue)|www.sciencemag.org]] |
|||
| consulté le = 28 décembre 2017 |
|||
| doi = 10.1126/science.aar7918 |
|||
}}.</ref>. Chez ces animaux, la mutation consiste, comme chez l'[[Homo sapiens|homme]], en la substitution de l'[[Acide aminé protéinogène|acide aminé]] [[Acide glutamique|glutamate]] par une [[valine]], mais pas au même emplacement que dans l'[[hémoglobine]] humaine. Contrairement à ce que l'on observe chez les humains, ces cerfs produisant des globules rouges falciformes semblent en parfaite santé<ref name="10.1126/science.aar7918"/>. De plus, la falciformation survient chez l'homme lorsque les [[Érythrocyte|globules rouges]] sont soumis à une faible [[pression partielle]] d'[[Dioxygène|oxygène]], alors qu'elle survient lorsque la pression partielle d'oxygène est élevée chez le muntjac<ref name="10.1126/science.aar7918"/>. |
|||
<gallery mode="packed" heights="220px"> |
|||
Sickle cell distribution.jpg | Distribution de la drépanocytose. |
|||
Malaria distribution.jpg | Distribution du [[paludisme]]. |
|||
</gallery> |
|||
=== Afrique === |
=== Afrique === |
||
Dans certaines parties de l'Afrique subsaharienne, la drépanocytose touche jusqu’à 2 % des nouveau- |
Dans certaines parties de l'[[Afrique subsaharienne]], la drépanocytose touche jusqu’à 2 % des [[nouveau-né]]s. La fréquence du [[trait drépanocytaire]], c'est-à-dire le pourcentage de [[Porteur sain|porteurs sains]] qui n’ont hérité du [[gène]] [[Mutation (génétique)|mutant]] que d’un seul des parents, atteint 10 à 40 % en [[Afrique équatoriale]], 1 à 2 % sur la côte de l’[[Afrique du Nord]] et moins de 1 % en [[Afrique du Sud]]. Dans les pays d’[[Afrique de l'Ouest]] ([[Ghana]] et [[Nigeria]]), la fréquence du trait drépanocytaire atteint 15 à 30 %. En [[Ouganda]], cette fréquence atteint 45 % chez les [[Amba (peuple)|Ambas]]<ref name="WHA59.9"/>. |
||
Dans ces pays africains, la mortalité des enfants de moins de {{unité|5|ans}} atteints de drépanocytose peut atteindre |
Dans ces pays africains, la mortalité des enfants de moins de {{unité|5|ans}} atteints de drépanocytose peut atteindre 90 % (malnutrition et pauvreté, manque de dépistage et de vaccinations), alors que la mortalité infantile toutes causes confondues a globalement été réduite dans l'ensemble des pays en voie de développement depuis les années 1990-2010<ref name="10.1056/NEJMra1510865"/>. |
||
=== Amériques === |
=== Amériques === |
||
[[Fichier:Triangular trade.png|vignette|[[Commerce triangulaire]].]] |
|||
Le commerce des esclaves et les migrations plus récentes ont accru la fréquence de cette maladie sur le continent [[Amérique|américain]]<ref name=":8">{{Article|langue=en|auteur1=F.B. Piel|titre=Global migration and the changing distribution of sickle haemoglobin|périodique=Lancet Global Health|date=Février 2014|issn=|lire en ligne=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3986033/|pages=|commentaire=Voir Introduction, fin du {{2e}} paragraphe}}</ref>. L'hémoglobine S est absente chez les amérindiens, les populations originaires d'Europe du nord et d'Océanie, alors qu'elle est relativement fréquente chez les afro-américains en particulier ceux des États-Unis, du Brésil et des Caraïbes<ref name=":8" />. |
|||
La [[Commerce triangulaire|traite des esclaves africains]] ont introduit la drépanocytose sur le [[Amérique|continent américain]], notamment aux [[États-Unis]], au [[Brésil]] et dans les [[Caraïbes]]<ref name="10.1016/S2214-109X(13)70150-5"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Frédéric B. Piel, Andrew J. Tatem, Zhuojie Huang, Sunetra Gupta, Thomas N. Williams et David J. Weatherall |
|||
| titre = Global migration and the changing distribution of sickle haemoglobin: a quantitative study of temporal trends between 1960 and 2000 |
|||
| périodique = The Lancet Global Health |
|||
| volume = 2 |
|||
| numéro = 2 |
|||
| jour = |
|||
| mois = février |
|||
| année = 2014 |
|||
| pages = e80-e89 |
|||
| url texte = http://www.thelancet.com/journals/langlo/article/PIIS2214-109X(13)70150-5/abstract |
|||
| consulté le = 28 décembre 2017 |
|||
| doi = 10.1016/S2214-109X(13)70150-5 |
|||
| pmid = 24748392 |
|||
| bibcode = 3986033 |
|||
}}</ref>. L'{{nobr|hémoglobine S}} est absente chez les [[Amérindiens]], les populations originaires d'[[Europe du Nord]] et d'[[Océanie]], alors qu'elle est relativement fréquente chez les [[Afro-Américains]]<ref name="10.1016/S2214-109X(13)70150-5"/>. |
|||
Aux États-Unis, le nombre de malades est estimé à {{unité|100000|personnes}}. Un taux analogue est retrouvé au Brésil. La maladie est absente en Alaska, et dans |
Aux États-Unis, le nombre de malades est estimé à {{unité|100000|personnes}}. Un taux analogue est retrouvé au Brésil. La maladie est absente en [[Alaska]], et dans certains pays d'[[Amérique du Sud]] le long de la façade de l'[[océan Pacifique]] ([[Équateur]], [[Pérou]], [[Bolivie]], [[Chili]]). La situation est intermédiaire dans le reste du continent ([[Canada]], [[Amérique centrale]], [[Argentine]])<ref name="10.1056/NEJMra1510865"/>. |
||
=== Europe === |
=== Europe === |
||
Dans plusieurs pays ou régions d'Europe ( |
Dans plusieurs pays ou régions d'[[Europe]] (sud de l'[[Italie]], [[Grèce]], [[Albanie]]), la drépanocytose est une maladie autochtone, avec des fréquences de porteurs du [[trait drépanocytaire]] entre 1 et 5 % de la population. |
||
Dans d’autres pays européens (Royaume-Uni, France, Belgique, Allemagne), les flux |
Dans d’autres pays européens ([[Royaume-Uni]], [[France métropolitaine]], [[Belgique]], [[Allemagne]]), les [[flux migratoire]]s, à partir des [[années 1960]], en provenance d'[[Afrique]], du [[Moyen-Orient]] et d'[[Asie du Sud]], ont été à l'origine d'un accroissement des cas diagnostiqués, variable selon les spécificités historiques de chaque pays<ref name="bardakjian2004">Bardakdjian, Josiane et Wajcman, Henri [http://lesouriredeselasse.free.fr/telechargement/Epidemiologie-de-la-drepanocytose.pdf « Épidémiologie de la drépanocytose »] ''La Revue du Praticien'' 2004</ref>. |
||
Dans la péninsule |
Dans la [[péninsule Ibérique ]], les cas de drépanocytose majeure étaient encore rares en [[Espagne]] dans les [[années 2000]], mais tendent à augmenter avec une immigration récente. Au [[Portugal]], dont l'histoire coloniale est plus ancienne, les études génétiques ont décelé deux vagues d'immigration apportant la mutation drépanocytaire : l'une entre les {{S-|VIII}} et {{S-|XIII}} venant de [[Méditerranée]], une autre à partir du {{S-|XV}} venant d'Afrique. La mutation s'est diluée dans l'ensemble de la population portugaise actuelle<ref name="bardakjian2004"/>. |
||
En Belgique, l’incidence moyenne de la drépanocytose est de 1/{{formatnum:1710}} sur l’ensemble des nouveau-nés à [[Bruxelles]] et de 1/943 à [[Liège]]. |
En Belgique, l’incidence moyenne de la drépanocytose est de 1/{{formatnum:1710}} sur l’ensemble des nouveau-nés à [[Bruxelles]] et de 1/943 à [[Liège]]. |
||
| Ligne 1 128 : | Ligne 1 249 : | ||
=== France === |
=== France === |
||
Les premiers cas de drépanocytose ont été rapportés en métropole dans les années 1940<ref name="lena-russo1992">Lena-Russo D, North ML. et Girot R. « Épidémiologie des maladies génétiques de l’hémoglobine en France Métropolitaine » ''Rev Prat''. 1992;42:1867-72.</ref> Jusqu'aux années 1950, ces cas concernaient presque uniquement des personnes d'origine antillaise<ref name="bardakjian2004" /> (la drépanocytose comme maladie du noir américain, voir la section historique). Le premier mouvement migratoire fin {{S-|XIX}} - début {{S-|XX}} en provenance d'Europe du sud n'a pu être dépisté. |
Les premiers cas de drépanocytose ont été rapportés en métropole dans les années 1940<ref name="lena-russo1992">Lena-Russo D, North ML. et Girot R. « Épidémiologie des maladies génétiques de l’hémoglobine en France Métropolitaine » ''Rev Prat''. 1992;42:1867-72.</ref> Jusqu'aux années 1950, ces cas concernaient presque uniquement des personnes d'origine [[Antilles françaises|antillaise]]<ref name="bardakjian2004" /> (la drépanocytose comme maladie du noir américain, voir la section historique). Le premier mouvement migratoire fin {{S-|XIX}} - début {{S-|XX}} en provenance d'Europe du sud n'a pu être dépisté. |
||
Après la [[décolonisation]] des années 1950-1960, survient un deuxième mouvement migratoire provenant d'Afrique et du Sud-Est asiatique. Des études ponctuelles de dépistage sont alors menées à partir des années 1970, dans plusieurs régions. Entre autres, en 1977, un dépistage systématique de la population scolaire de la région marseillaise sur plus de {{unité|35000|élèves}}, a permis d'établir que 0,22 % étaient porteurs du trait drépanocytaire, tous issus de familles originaires de pays à risques, parfois vivant en France depuis 5 générations (pour les italiens du sud)<ref name="lena-russo1992" />. |
Après la [[décolonisation]] des années 1950-1960, survient un deuxième mouvement migratoire provenant d'Afrique et du Sud-Est asiatique. Des études ponctuelles de dépistage sont alors menées à partir des années 1970, dans plusieurs régions. Entre autres, en 1977, un dépistage systématique de la population scolaire de la région marseillaise sur plus de {{unité|35000|élèves}}, a permis d'établir que 0,22 % étaient porteurs du trait drépanocytaire, tous issus de familles originaires de pays à risques, parfois vivant en France depuis 5 générations (pour les italiens du sud)<ref name="lena-russo1992" />. |
||
Version du 29 décembre 2017 à 01:00
| Drépanocytose Anémie falciforme | ||
 Globule rouge falciforme (pâle, à gauche), typique de la maladie | ||
| Référence MIM | 603903 | |
|---|---|---|
| Transmission | Autosomique récessive | |
| Chromosome | Chromosome 11 11p15.5 | |
| Gène | HBB (β-globine) | |
| Empreinte parentale | Non | |
| Mutation | Substitution E6V | |
| Nombre d'allèles pathologiques | S | |
| Porteur sain | Atteint en forme atténuée | |
| Incidence | 300 000 cas/an dans le monde. 300/an en France | |
| Nombre de cas | 4 400 000 homozygotes0,430 000 00 hétérozygotes0,100 00 cas en France | |
| Diagnostic prénatal | Possible | |
| Liste des maladies génétiques à gène identifié | ||
| modifier |
||
| Médicament | Phénylbutyrate de sodium (en) |
|---|---|
| Spécialité | Hématologie |
| CIM-10 | D57 |
|---|---|
| CIM-9 | 282.6 |
| OMIM | 603903 |
| DiseasesDB | 12069 |
| MedlinePlus | 000527 |
| eMedicine |
1918423 oph/490ped/2096emerg/26emerg/406 |
| MeSH | D000755 |
| MeSH | C15.378.071.141.150.150 |
La drépanocytose, du grec drepanon, faucille, également appelée hémoglobinose S, sicklémie ou anémie à cellules falciformes (drépanocytes), est une maladie génétique répandue touchant près de 50 millions de personnes dans le monde[1] avec de l'ordre de 300 000 naissances chaque année. Elle a été décrite pour la première fois dans la littérature médicale en 1910 par le médecin américain James B. Herrick. Sa transmission héréditaire a été établie en 1949 par E. A. Beet and J. V. Neel, tandis que l'effet protecteur du trait drépanocytaire contre le paludisme a été établie en 1954. On pense qu'environ 80 % des cas de drépanocytose se concentrent en Afrique subsaharienne[2]. La maladie est également assez fréquente dans certaines régions de l'Inde, de la péninsule arabique et parmi les populations d'origine africaine dispersées de par le monde. Elle a entraîné la mort de 114 000 personnes en 2015[3].
La drépanocytose est due à la substitution d'un seul résidu d'acide aminé sur la chaîne β de l'hémoglobine, protéine des globules rouges assurant le transport de l'oxygène dans le sang. Cette mutation génétique — remplacement du glutamate en position 6 par une valine ce qui donne de l'hémoglobine S — favorise, dans certaines conditions, l'apparition de globules rigides de forme allongée, dite en faucille ou en feuille de houx, susceptible d'induire un ensemble de problèmes de santé tels que douleurs, anémie, tuméfaction des mains et des pieds, infections bactériennes et accidents vasculaires cérébraux. Les symptômes apparaissent généralement dès l'âge de 5 à 6 mois et peuvent évoluer vers des douleurs chroniques avec l'âge. L'espérance de vie moyenne des patients varie entre 40 et 60 ans dans les pays développés.
La drépanocytose se manifeste chez les personnes porteuses de deux allèles anormaux du gène HBB — patients homozygotes — hérités chacun d'un des deux parents. Ce gène est situé sur le chromosome 11 humain. Il en existe plusieurs sous-types, identifiés chacun par leur séquence. Les personnes porteuses d'un seul allèle anormal du gène HBB — patients hétérozygotes — ne présentent généralement pas de symptômes et sont dites avoir le trait drépanocytaire ; on les qualifie également de porteurs sains. En 2015, on estimait à environ 4,4 millions le nombre total de personnes homozygotes (deux allèles S) et donc porteuses de la maladie, et à 43 millions le nombre de personnes hétérozygotes (un seul allèle S) et donc porteuses du trait drépanocytaire[4]. Le diagnostic est posé à l'aide d'un test sanguin, certains pays pratiquent le dépistage pour toutes les naissances. Le diagnostic prénatal est également possible.
Une crise aiguë peut être déclenchée par un changement de température, par un stress, par la déshydratation, ainsi qu'à une altitude élevée. La prise en charge de la drépanocytose consiste notamment à prévenir les infections à l'aide de vaccins et d'antibiotiques, à assurer une bonne hydratation de l'organisme, à traiter les douleurs induites par les crises, ainsi qu'en une supplémentation en vitamine B9 (acide folique). On peut également être amené à procéder à une transfusion sanguine ou à l'administration d'hydroxyurée (hydroxycarbamide). Une greffe de moelle osseuse peut permettre la guérison dans un petit nombre de cas.
Symptômes
L'affection se signale chez le nourrisson, mais n'est d'ordinaire pas manifeste à la naissance parce que les globules rouges du nouveau-né contiennent encore de 50 à 90 % d'hémoglobine fœtale. Les symptômes de cette maladie peuvent apparaître dès l'âge de deux à trois mois, date d'apparition de la chaîne bêta de l'hémoglobine. Le déclenchement des crises est favorisé par divers facteurs tels qu'une infection, une acidose et la déshydratation, mais il n'est bien souvent pas possible d'identifier le facteur déclenchant d'une crise particulière. Les crises peuvent être également favorisées par le froid ou un temps sec[5].
La drépanocytose peut conduire à diverses complications aiguës ou chroniques dont plusieurs présentent un taux de mortalité élevé[6].
Manifestations chroniques
Les manifestations chroniques de la drépanocytose associent un retard de taille et de poids, des carences alimentaires (en folates, car cette vitamine est indispensable à la création des hématies qui sont renouvelées très rapidement lors des crises d'anémie, épuisant ainsi le stock de folates), un retard pubertaire fréquent, des troubles cardio-pulmonaires (augmentation de la taille du cœur, insuffisance respiratoire), une rate augmentée de volume ou atrophiée, des anomalies rétiniennes (hémorragies), des douleurs chroniques parfois secondaires à des lésions (ulcère de jambe[7], parfois sans lésion visible, de type neuropathique[8], etc.).
Il peut exister une énurésie[9] probablement favorisée par une hyperfiltration glomérulaire[10].
Crise vaso-occlusive
Les globule rouges en forme de faucille tendent à bloquer la circulation sanguine au niveau des capillaires de nombreux organes — os, abdomen, reins, cerveau, rétine, etc. — provoquant douleurs, ischémie, voire nécrose. La fréquence, la durée et la sévérité des crises est extrêmement variable. Les crises douloureuses sont traitées par hydratation, à l'aide d'antalgiques, voire de transfusions sanguines.
La douleur provoquée par les crises légères peut être soulagée à l'aide d'anti-inflammatoires non stéroïdiens (AINS) tels que le diclofénac ou le naproxène. Chez la plupart des patients, les crises sévères requièrent l'injection intraveineuse d'opiacés à intervalles réguliers jusqu'à la fin de la crise. Les crises vaso-occlusives affectant des organes tels que le pénis (priapisme[11]) et les poumons sont prises en charge comme des urgences médicales et traitées par transfusion de globules rouges.
Syndrome thoracique aigu
Un syndrome thoracique aigu est caractérisé lorsqu'au moins deux des cinq manifestations suivantes sont observées : douleur thoracique, fièvre, infiltrat pulmonaire, atteinte respiratoire, ou hypoxémie[12]. Ces symptômes étant semblables à ceux d'une pneumonie, il est fréquent de traiter les deux affections en même temps[13]. C'est la deuxième complication la plus fréquente de la drépanocytose, et elle est responsable d'environ 25 % des décès de patients drépanocytaires, la majorité de ces cas présentant également une crise vaso-occlusive lorsqu'ils développent un syndrome thoracique aigu[14],[15]. Cependant, environ 80 % des patients développement une crise vaso-occlusive au cours d'un syndrome thoracique aigu.
Crise d'asplénie et infections
En raison de ses nombreux capillaires sanguins et de son rôle dans l'élimination des globules rouges défectueux, la rate est fréquemment lésée lors d'une crise drépanocytaire[16]. Elle est généralement atteinte de multiples infractus tissulaires avant la fin de l'enfance chez les patients homozygotes. L'atteinte de la rate favorise les risques d'infection par des bactéries encapsulées[17],[18], notamment par des pneumocoques[19] ou des méningocoques. Elles peuvent aussi aggraver l'anémie en cas d'infection par le parvovirus B19. Une vaccination préventive, voire la prise d'antibiotiques, peut être recommandée pour se prémunir contre certaines infections particulièrement redoutées chez les patients souffrant d'asplénie fonctionnelle.
Séquestration splénique
La séquestration splénique consiste en une augmentation brutale de la taille de la rate accompagnée d'une chute rapide du taux d'hémoglobine dans le sang. Elle est due à l'accumulation de globules rouges dans cet organe aux dépens de la circulation générale. Il s'agit d'une situation d'urgence. Les patients non traités décèdent en une ou deux heures des suites d'un choc hypovolémique. Ces crises sont transitoires, se prolongeant trois ou quatre heures, voire une journée entière[20].
Réticulocytopénie
Les globules rouges des personnes atteintes de drépanocytose ayant une forme anormale, ils sont rapidement éliminés par l'organisme au niveau de la rate, ce qui provoque une anémie hémolytique. Cette anémie peut s'aggraver lors des crises drépanocytaires, ce qui se manifeste par un teint pâle, une accélération de la fréquence cardiaque et un état de fatigue générale. Ces crises sont souvent déclenchées par le parvovirus B19, qui affecte directement la production de globules rouges en détruisant les réticulocytes, qui en sont les précurseurs immédiats. L'infection à parvovirus bloque presque complètement la production de globules rouges pendant deux à trois jours, ce qui est quasiment sans conséquence chez un individu sain, mais peut rapidement mettre la vie d'un patient drépanocytaire en danger. Il faut de quatre jours à une semaine pour se remettre d'une telle crise, certains patients ayant besoin d'une transfusion sanguine pour se rétablir[21].
Crise hémolytique
Une crise hémolytique est une chute brutale de la quantité d'hémoglobine dans le sang en raison de la lyse accélérée des globules rouges. Ce cas est particulièrement fréquent chez les patients atteints de favisme, ou déficit en G6PD[22]. La prise en charge est symptomatique, parfois avec transfusion sanguine.
Autres manifestations aiguës
L'une des manifestations cliniques les plus précoces de la maladie est la dactylite (en), pouvant apparaître chez le nouveau-né âgé d'à peine 6 mois, et susceptible d'être observée chez les enfants porteurs du trait drépanocytaire[23]. La crise peut se prolonger pendant un mois[24].

Complications
On distingue les complications aiguës, qui nécessitent une intervention rapide, et les complications chroniques, qui prennent une part croissante dans la prise en charge de la maladie. Elles débutent dès la petite enfance sous la forme des crises douloureuses vaso-occlusives touchant surtout l'os, puis le poumon, la rate et, plus rarement, d'autres organes. La fréquence et le type de ces crises varient selon l'âge, le génotype, et des facteurs environnementaux.
Les autres complications sont les complications infectieuses, celles liées à l'aggravation d'une anémie, et les complications vasculaires. La maladie peut se compliquer d'infarctus cérébraux, dont la prévalence atteint près de 10 % des patients âgés de moins de 20 ans[25]. L'hypertension artérielle pulmonaire est une complication fréquente et grave[26]. Elle est retrouvée en échocardiographie dans près d'un tiers des cas, mais cet examen s'avère peu spécifique, et la prévalence réelle (confirmée par la mesure directe de la pression artérielle pulmonaire par cathétérisme cardiaque) serait bien moindre[27].
L'atteinte rénale est fréquente, avec une hématurie, ou une protéinurie[28]. L'atteinte oculaire est plus fréquente et plus grave chez les patients SC, combinant l'hémoglobine S avec l'hémoglobine C, par rapport aux patients SS, homozygotes S. Un examen régulier est nécessaire afin de dépister précocement la rétinopathie drépanocytaire qui est de type proliférative, afin de pouvoir proposer un traitement[29].
Avant l'apparition de l'hydroxyurée près de la moitié des malades décédait avant l'âge de 50 ans, soit au cours d'une crise, ou d'un accident vasculaire cérébral[30].
Physiopathologie
Génétique

L'hémoglobine est la protéine des globules rouges assurant le transport de l'oxygène dans le sang. Il s'agit d'un hétérotétramère constitué de deux paires identiques de deux sous-unités de types différents. L'une de ces sous-unités est dite α (alpha) et est codée par un gène situé sur le chromosome 16 tandis que l'autre sous-unité est codée par un gène du chromosome 11 et est soit de type β (bêta), γ (gamma) ou δ (delta), donnant respectivement l'hémoglobine A de formule α2β2 et notée HbA, l'hémoglobine F de formule α2γ2 et notée HbF, et l'hémoglobine A2 de formule α2δ2 et notée HbA2. L'hémoglobine A est de loin la plus abondante des trois, constituant environ 95 % de l'hémoglobine totale d'un adulte sain.
La drépanocytose résulte de la substitution d'une seule base nucléique dans le gène HBB codant la chaîne β de l'hémoglobine A : une paire adénine–thymine est inversée dans la double hélice de l'ADN, ce qui conduit à remplacer un résidu d'adénine par une thymine dans le codon du brin d'ADN sens correspondant au glutamate en position 6, qui se trouve de ce fait remplacé par une valine dans le produit de transcription. On parle de polymorphisme nucléotidique.
Brin d'ADN normal antisens 3’ TAC CAC GTA GAC TGA GGA CTC CTC TTC AGA 5’ ||| ||| ||| ||| ||| ||| ||| ||| ||| ||| Brin d'ADN normal sens 5’ ATG GTG CAT CTG ACT CCT GAG GAG AAG TCT 3’ 0 1 2 3 4 5 6 7 8 9 ARN messager normal 5’ AUG GUG CAU CUG ACU CCU GAG GAG AAG UCU 3’ Met-Val-His-Leu-Thr-Pro-Glu-Glu-Lys-Ser-
Brin d'ADN muté antisens 3’ TAC CAC GTA GAC TGA GGA CAC CTC TTC AGA 5’ ||| ||| ||| ||| ||| ||| ||| ||| ||| ||| Brin d'ADN muté sens 5’ ATG GTG CAT CTG ACT CCT GTG GAG AAG TCT 3’ 0 1 2 3 4 5 6 7 8 9 ARN messager muté 5’ AUG GUG CAU CUG ACU CCU GUG GAG AAG UCU 3’ Met-Val-His-Leu-Thr-Pro-Val-Glu-Lys-Ser-
La chaîne β produite ne diffère donc d'une chaîne β normale que par un seul résidu d'acide aminé, en position 6 selon la nomenclature historique, ou 7 selon la nomenclature actuelle[a]. L'hémoglobine résultante est dite S, initiale du mot anglais sickle signifiant « faucille », et est notée HbS, de formule α2βS2.
Cette mutation s'est probablement produite plusieurs fois de manière indépendante dans des zones géographiques distinctes, comme le suggèrent les études par enzymes de restriction. Ces haplotypes sont dits Sénégal, Bénin, Cameroun, bantou (originaire d'Afrique centrale) et arabo-indien (péninsule arabique et sous-continent indien). Ils ont une certaines importance clinique, car certains sont associés à une production accrue d'hémoglobine fœtale HbF, notamment Sénégal et arabo-indien, davantage que Bénin et Cameroun, ce qui tend a atténuer les complications de la maladie[31].
Transmission héréditaire et formes composites

La drépanocytose est une maladie génétique à transmission autosomique récessive. Cela signifie que la mutation affecte un chromosome homologue non sexuel (autosome), et que seuls les homozygotes porteurs de deux allèles mutés (notés SS) sont affectés par la maladie. Les hétérozygotes porteurs d'un allèle muté S et d'un allèle normal A (notés SA) expriment ces deux allèles, car l'allèle S est codominant. On dit de ces personnes qu'elles ont le trait drépanocytaire : elles sont généralement dépourvues des symptômes de la drépanocytose, de sorte qu'on parle de porteurs sains, présentant simplement des hématies falciformes, ou plus ou moins sujettes à la falciformation, qui ne contiennent pas nécessairement un mélange en proportions égales d'HbA et d'HbS.
Compte tenu du caractère autosomique récessif de la transmission de cette maladie, la probabilité de mettre au monde un enfant drépanocytaire est de 100 % si les deux parents sont eux-mêmes atteints de drépanocytose, de 50 % si l'un des deux parents est drépanocytaire tandis que l'autre est porteur du trait drépanocytaire, de 25 % si les deux parents sont porteurs du trait drépanocytaire, et est nulle si l'un des deux parents est sain — et ce même si l'autre parent est drépanocytaire.
Il existe parallèlement des hétérozygotes dits composites, ou doubles, associant la drépanocytose (allèle S) avec une autre hémoglobinopathie, notamment l'hémoglobine C, voire l'hémoglobine E (thalassémie β). La forme SC est la plus courante d'entre elles, formant une hémoglobine HbSC de formule α2βSβC.
Impacts moléculaires et cellulaires
L'hémoglobine S se distingue de l'hémoglobine A par une mobilité électrophorétique plus faible, mais surtout par la solubilité plus faible de sa forme désoxygénée, qui tend à polymériser en chaîne en formant de longues fibres qui déforment le globule rouge. Cela provient de la substitution du résidu de glutamate en position 6 par une valine, c'est-à-dire d'un acide aminé à chaîne latérale chargé négativement par un acide aminé à chaîne latérale aliphatique, et donc apolaire, ce qui crée une zone d'adhérence hydrophobe à la surface de la protéine entre les hélices E et F dans sa forme désoxy, dite tendue.
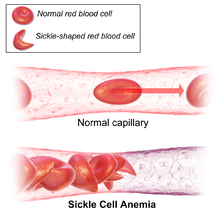
Ainsi, en situation d'hypoxie — baisse de pression partielle d'oxygène O2 — les molécules d'hémoglobine S tendent à s'agglomérer en longues fibres qui déforment les globules rouges en leur donnant un aspect en faucille ou en feuille de houx. Ce phénomène peut s'observer :
- in vivo, dans le sang veineux et des capillaires, d'où séquestration prolongée, formation de thromboses, et hémolyse facile des globules rouges dans les fins capillaires où les drépanocytes se frayent difficilement un passage, étant donné leur forme allongée, ainsi que dans la rate, où la lenteur de la circulation crée les conditions favorables à la falciformation des drépanocytes, et où ces derniers sont phagocytés par le système réticulo-endothélial.
- in vitro, lors de l'examen du sang frais entre lame et lamelle, avec addition d'un composé réducteur comme le métabisulfite de potassium K2S2O5 ou le métabisulfite de sodium Na2S2O5.
En revanche, le sujet sain présente des globules rouges en forme de disque biconcave quelles que soient les conditions environnementales.
Les globules rouges déformés, ou drépanocytes, sont plus fragiles, ont une durée de vie plus brève, et subissent une destruction anormalement élevée, ce qui conduit à une anémie hémolytique chez les personnes atteintes. La moelle osseuse accélère la production d'érythrocytes mais ne parvient pas à compenser leur destruction par lyse.
Pour fixer les idées, un globule rouge fonctionne normalement de trois à quatre mois chez une personne saine, mais les drépanocytes n'excèdent guère plus de 10 à 20 jours.
Les globules rouges falciformes sont en outre moins souples que les cellules normales, et les épisodes de falciformation répétés tendent à les rendre de plus en plus rigides, de sorte qu'ils conservent leur forme allongée rigide même en présence d'une pression partielle d'oxygène élevée. Ces globules rouges sont alors susceptibles de provoquer des ischémies en réduisant l'apport d'oxygène au niveau de différents territoires, d'où des crises douloureuses par infarctus osseux ou infarctus cérébraux, par exemple. Par leur rigidité, les globules rouges falciformes eux-mêmes sont susceptibles d'induire des lésions sur la paroi interne des vaisseaux (endothélium), d'où un risque d'obstruction de ces derniers.
Avantage hétérozygote

La drépanocytose est l'exemple type de maladie offrant un avantage hétérozygote par rapport aux formes les plus graves de paludisme, celles à Plasmodium falciparum : les hétérozygotes SA bénéficient d'une protection estimée entre 60 et 80 % contre ce paludisme, ce qui signifie qu'ils peuvent également être atteints[32], mais qu'ils présentent des symptômes moins graves lorsqu'ils sont touchés[33]. Les homozygotes drépanocytaires SS, en revanche, sont encore plus vulnérables au paludisme que les personnes saines (homozygotes AA), au point que cette maladie est le principal déclencheur de crises drépanocytaires chez ces patients dans les zones impaludées.
Le mécanisme protecteur de l'hémoglobine S chez les hétérozygotes n'est pas entièrement élucidé. De façon générale, cette protection est due à l'interruption du développement du parasite à l'intérieur des globules rouges dans cycle érythrocytaire du parasite (cf. paludisme), en raison de la durée de vie réduite des globules rouges et de leur plus grande fragilité[34]. Le parasite ne peut se reproduire dans ces cellules lorsqu'elles se lysent prématurément, et peuvent difficilement digérer l'hémoglobine S lorsqu'elle est polymérisée, ce qui contribue encore à freiner son développement.
Compte tenu de l'avantage sélectif conféré par l'allèle S du gène HBB dans les zones impaludées, la prévalence de cet allèle y demeure élevée malgré le fort désavantage de la forme homozygote. C'est la raison pour laquelle cette mutation reste fréquente chez les personnes ayant une ascendance récemment issue d'Afrique, du Bassin méditerranéen, d'Inde ou du Moyen-Orient[35] ; le paludisme était également endémique en Europe du Sud jusqu'au milieu du XXe siècle, et n'y est plus présent qu'exceptionnellement, comme en Camargue[36], dans le sud-est de la France.
Examens et diagnostic
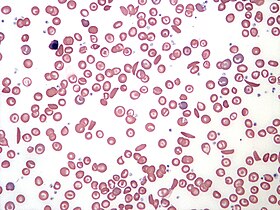
L'hémogramme des personnes atteintes de drépanocytose à hémoglobine S montre une concentration sanguine d'hémoglobine de l'ordre de 6 à 8 g/dL avec un nombre élevé de réticulocytes. Ceci s'explique par le fait que le renouvellement des globules rouges par la moelle osseuse s'accélère afin de compenser l'élimination des cellules falciformes. Le taux d'hémoglobine est plus élevé dans le cas des autres formes de drépanocytoses. Un frottis sanguin peut montrer des structures caractéristiques d'une asplénie, comme des codocytes et des corps de Howell-Jolly.
La déformation des globules rouges d'un frottis en faucille ou en feuille de houx peut être induite par addition d'un réducteur comme le métabisulfite de potassium K2S2O5, le métabisulfite de sodium Na2S2O5 ou l'acide ascorbique . La présence d'hémoglobine S peut être établie à l'aide d'une solution réductrice, par exemple de dithionite de sodium Na2S2O4, qui se trouble en présence d'HbS mais demeure claire en présence d'hémoglobine normale.
La présence d'hémoglobine anormale peut être détectée par électrophorèse sur gel, un mode d'électrophorèse dans lequel les différentes hémoglobines se déplacent à des vitesses différentes qui permettent de les caractériser. L'hémoglobine falciforme HbS et l'hémoglobine C falciforme HbSC, qui sont les deux principales formes d'hémoglobine drépanocytaire, peuvent être identifiées par cette technique. La chromatographie en phase liquide à haute performance (CLHP) permet de confirmer le diagnostic. Il est rare de devoir recourir à une analyse génétique, car les autres méthodes d'investigation permettent d'identifier précisément l'hémoglobine S et l'hémoglobine C.
Une crise drépanocytaire étant souvent induite par une infection, il est conseillé de rechercher une infection par test urinaire ou radiographie du thorax.
Les personnes ayant le trait drépanocytaire — hétérozygotes SA — peuvent avoir recours à un conseil génétique avant de concevoir un enfant. Le diagnostic prénatal est réalisé à partir d'un échantillon de sang fœtal ou de liquide amniotique, cette dernière technique présentant moins de risques.
Dans les pays développés, le diagnostic se fait en période néonatale si les parents sont malades ou à risque. Dans les pays en voie de développement, le diagnostic se fait souvent à la première manifestation ou complication drépanocytaire. Le dépistage néonatal pourrait se traduire par une amélioration du pronostic[37].
Traitements
Ils comportent un aspect préventif : éviction des facteurs déclenchant les crises (froid, altitude, infections, déshydratation) ; supplémentation en folates (dont l'intérêt réel est cependant aujourd'hui remis en cause), traitement préventif des infections à pneumocoque et méningocoque (vaccination)[38].
Traitements des complications
D'une manière générale, les crises vaso-occlusives d'intensité douloureuse modérée, sans fièvre et sans signe de gravité, peuvent être traitées à domicile par hydratation orale abondante (eau alcaline), repos, maintien au chaud et mise sous oxygène. Les antalgiques sont utilisés selon l'intensité de la douleur. La prescription d'opiacés et de morphiniques se fait au mieux en milieu hospitalier[39]. Il est à noter que le métabolisme de la morphine est accéléré chez les sujets porteurs de la maladie, avec une élimination de 3 à 10 fois plus rapide que chez les sujets sains[40].
Les infections sont traitées en milieu hospitalier selon une antibiothérapie couvrant principalement les pneumocoques. La transfusion sanguine est utilisée en cas d'anémie profonde ou d'infection grave, en l'absence de contre-indications. Elle peut être simple ou se combiner en exsanguino-transfusion permettant de réduire la proportion d'hémoglobine S. Ces transfusions sanguines pourraient diminuer sensiblement le risque d'accidents vasculaires cérébraux chez certains enfants particulièrement à risque, tels que ceux présentant une anomalie du Doppler transcrânien[41].
La supplémentation en acide folique a longtemps été recommandée par l'OMS mais son efficacité réelle est débattue depuis la fin du siècle dernier[42].
Les patients drépanocytaires ayant une sensibilité accrue au paludisme, on a pu leur recommander, s'ils résident dans une zone impaludée, de prendre une médication prophylactique antipaludéenne[43].
Le traitement de l'ostéonécrose résultant des crises drépanocytaires a pour objectif de réduire les douleurs et de maintenir la mobilité des articulations[44]. Les traitements actuels font appel à la physiothérapie, les traitements de la douleur, l'arthroplastie et la greffe osseuse.

Depuis les années 2000, l'hydroxyurée HONHCONH2, ou hydroxycarbamide, est devenue un traitement de fond. On a montré en 1995 que cette molécule réduit la fréquence et la gravité des crises[45], et en 2003 qu'elle est susceptible d'allonger l'espérance de vie des patients[46]. L'hydroxyurée permet de stimuler la production d'hémoglobine fœtale[47], formée habituellement en petite quantité et parfaitement fonctionnelle, en remplacement de l'hémoglobine S défectueuse. On a longtemps suspecté une toxicité à long terme, dont on n'a jamais pu montrer qu'elle induirait des risques supérieurs aux bénéfices apportés par son utilisation[6],[48]. Son mode d'action ne permet cependant pas de l'utiliser chez les patients anémiques, ce qui implique une surveillance très soigneuse des paramètres sanguins. L'autre obstacle à son utilisation a d'abord été son coût, qui peut toutefois générer des économies de prise en charge dans les pays développés[49]. Cependant cette molécule est de plus en plus utilisée dans tous les pays, les études montrant son efficacité et sa bonne tolérance. En 2017, elle est jugée encore sous-utilisée[50].
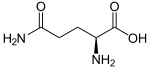
Le 7 juillet 2017, l'usage de la L-glutamine, un acide aminé protéinogène, a été validé aux États-Unis par la FDA[51] chez les patients âgés de 5 ans et plus afin de réduire les complications graves associées à la drépanocytose. Dans un essai clinique de phase 3[52], cette molécule a démontré son intérêt dans la réduction des crises vaso-occlusives et dans la diminution de la survenue du syndrome thoracique aigu.
A contrario, certains « médicaments miracles » à l'efficacité non démontrée ont pu être annoncés localement par des personnalités controversées. Ainsi, un remède appelé « VK500 » avait été proposé en 2007 au Bénin contre la drépanocytose ; aucune étude sérieuse n'a cependant jamais trouvé la moindre efficacité thérapeutique à cette préparation[53].
Greffe de moelle osseuse
La greffe de moelle osseuse est potentiellement curative, mais c'est une technique lourde, coûteuse, avec des risques toxiques, et limitée par le manque de donneurs compatibles[50]. En France, la décision est prise lors de réunions de concertation pluridisciplinaires nationales[54].
Les hématies sont produites à partir de cellules souches dans la moelle osseuse. En détruisant la moelle osseuse du malade et en la remplaçant par celle d'un donneur, il y a possibilité d'obtenir une guérison totale. Environ 200 greffes ont été réalisées dans le monde chez des drépanocytaires, permettant d'obtenir la guérison dans 85 % des cas[55]. Il faut cependant un donneur apparenté le plus possible : un frère ou une sœur. Il y a la possibilité pour les parents de recourir à une fécondation in vitro avec sélection par DPI d'embryons compatibles pour la greffe. Cette voie de traitement dite du « bébé médicament » est très encadrée par les lois de bioéthique.
Thérapies géniques
Des souris drépanocytaires ont pu être guéries en introduisant chez ces animaux un gène produisant une hémoglobine « anti-drépanocytaire » en quantité élevée[56]. Un essai clinique de phase 1/2 a été programmé à Paris au début du siècle pour évaluer la sécurité et l'efficacité de la thérapie génique des β-hémoglobinopathies (drépanocytose et thalassémie β majeure) par transplantation de cellules souches CD34+ autologues transduites ex vivo avec un vecteur lentiviral β A-T87Q-globine[57]. Un adolescent de 13 ans a ainsi été traité contre la drépanocytose par thérapie génique en octobre 2014[58], et les résultats publiés en mars 2017 se sont révélés très encourageants[59].
Il est cependant peu probable que ces nouvelles thérapies puissent devenir d'utilisation courante à brève échéance en raison de difficultés techniques (validation scientifique), économiques (coût élevé) et éthiques (inégalité d'accès aux soins dans le monde). En attendant, l'extension aux pays en voie de développement des traitements actuellement disponibles dans les pays développés constituerait déjà un progrès significatif. De même, une meilleure compréhension des facteurs environnementaux permettrait de préciser les conseils aux patients atteints de drépanocytose et d'améliorer leur qualité de vie où qu'ils se trouvent[50].
Bonnes pratiques aidant à prévenir les complications
La maladie se manifeste plus ou moins sévèrement selon l'environnement. Un temps froid, une variation de température ou un manque d'oxygène favorisent les complications aiguës, notamment les crises douloureuses. Les complications surviennent plus fréquemment en haute altitude. Dans les pays en voie de développement, les infections sont la principale cause de décès des enfants drépanocytaires, surtout en Afrique. Dans les pays développés, les infections peuvent survenir à tout âge[50].
Une bonne hygiène de vie et des réflexes simples[60] aident à prévenir la survenue des crises et de leurs complications :
- boire fréquemment de l'eau et rester à l'abri des fortes chaleurs (la déshydratation déclenche des crises par augmentation de la viscosité sanguine) ;
- ne pas s'enrhumer, et plus généralement éviter les infections respiratoires ;
- porter des vêtements amples qui ne gênent pas la circulation sanguine, éviter les positions contraignantes (jambes croisées) ;
- éviter l'essoufflement, les endroits mal aérés (voyages en avion, plongée sous-marine) et les altitudes élevées (supérieures à 1 500 m).
Épidémiologie, écoépidémiologie
La drépanocytose est la maladie génétique monogénique (liée à un seul gène) la plus répandue dans le monde[50]. Selon l'OMS, 300 000 enfants naissent dans le monde chaque année avec une anomalie majeure de l'hémoglobine dont la plus fréquente est celle de la drépanocytose[61]. En 2015, la grande majorité de ces naissances ont eu lieu dans trois pays : Nigeria, République démocratique du Congo, Inde[50].
L'allèle S, responsable de l'anomalie, est surtout répandu dans le continent africain (atteignant dans certaines populations la fréquence de 30 %) ; on le trouve également en Inde, en Arabie saoudite et dans d'autres régions du bord de la Méditerranée, en Italie (surtout en Sicile), en Grèce et en Anatolie. Les migrations ont accru la fréquence de cette maladie sur le continent américain.
Cette distribution se superpose assez bien avec celle d'une autre maladie d'origine infectieuse, le paludisme, ou malaria, notamment la forme à Plasmodium falciparum, la plus grave. La présence élevée de la drépanocytose en Afrique semble être un cas de polymorphisme génétique équilibré résultant d'une sélection naturelle par avantage hétérozygote : en effet, les porteurs sains — hétérozygotes SA, ayant le trait drépanocytaire — sont relativement protégées contre P. falciparum. La preuve épidémiologique de cette protection a été apportée par plusieurs études depuis 2002[34].
L'apparition, puis la sélection, de cette mutation se sont faites en différents points du monde, coïncidant avec les zones d'endémie du paludisme. Ces évènements se seraient produits entre 70 000 et 150 000 ans. Parmi les différents haplotypes connus (ensembles de gènes liés), cinq seraient apparus de façon indépendante : haplotype Sénégal (côte atlantique de l'Afrique de l'Ouest), haplotype Bénin (golfe du Bénin), haplotype Cameroun, haplotype bantou (Afrique équatoriale), haplotype arabo-indien (sous-continent indien et péninsule arabique)[34].
Récemment, il a été montré que certains cervidés — plusieurs espèces de muntjacs — sont également porteurs d'une mutation proche de celle de la drépanocytose, connue depuis 1840 mais dont la cause génétique n'a été publiée qu'en 2017[62]. Chez ces animaux, la mutation consiste, comme chez l'homme, en la substitution de l'acide aminé glutamate par une valine, mais pas au même emplacement que dans l'hémoglobine humaine. Contrairement à ce que l'on observe chez les humains, ces cerfs produisant des globules rouges falciformes semblent en parfaite santé[62]. De plus, la falciformation survient chez l'homme lorsque les globules rouges sont soumis à une faible pression partielle d'oxygène, alors qu'elle survient lorsque la pression partielle d'oxygène est élevée chez le muntjac[62].
-
Distribution de la drépanocytose.
-
Distribution du paludisme.
Afrique
Dans certaines parties de l'Afrique subsaharienne, la drépanocytose touche jusqu’à 2 % des nouveau-nés. La fréquence du trait drépanocytaire, c'est-à-dire le pourcentage de porteurs sains qui n’ont hérité du gène mutant que d’un seul des parents, atteint 10 à 40 % en Afrique équatoriale, 1 à 2 % sur la côte de l’Afrique du Nord et moins de 1 % en Afrique du Sud. Dans les pays d’Afrique de l'Ouest (Ghana et Nigeria), la fréquence du trait drépanocytaire atteint 15 à 30 %. En Ouganda, cette fréquence atteint 45 % chez les Ambas[61].
Dans ces pays africains, la mortalité des enfants de moins de 5 ans atteints de drépanocytose peut atteindre 90 % (malnutrition et pauvreté, manque de dépistage et de vaccinations), alors que la mortalité infantile toutes causes confondues a globalement été réduite dans l'ensemble des pays en voie de développement depuis les années 1990-2010[50].
Amériques

La traite des esclaves africains ont introduit la drépanocytose sur le continent américain, notamment aux États-Unis, au Brésil et dans les Caraïbes[63]. L'hémoglobine S est absente chez les Amérindiens, les populations originaires d'Europe du Nord et d'Océanie, alors qu'elle est relativement fréquente chez les Afro-Américains[63].
Aux États-Unis, le nombre de malades est estimé à 100 000 personnes. Un taux analogue est retrouvé au Brésil. La maladie est absente en Alaska, et dans certains pays d'Amérique du Sud le long de la façade de l'océan Pacifique (Équateur, Pérou, Bolivie, Chili). La situation est intermédiaire dans le reste du continent (Canada, Amérique centrale, Argentine)[50].
Europe
Dans plusieurs pays ou régions d'Europe (sud de l'Italie, Grèce, Albanie), la drépanocytose est une maladie autochtone, avec des fréquences de porteurs du trait drépanocytaire entre 1 et 5 % de la population.
Dans d’autres pays européens (Royaume-Uni, France métropolitaine, Belgique, Allemagne), les flux migratoires, à partir des années 1960, en provenance d'Afrique, du Moyen-Orient et d'Asie du Sud, ont été à l'origine d'un accroissement des cas diagnostiqués, variable selon les spécificités historiques de chaque pays[64].
Dans la péninsule Ibérique , les cas de drépanocytose majeure étaient encore rares en Espagne dans les années 2000, mais tendent à augmenter avec une immigration récente. Au Portugal, dont l'histoire coloniale est plus ancienne, les études génétiques ont décelé deux vagues d'immigration apportant la mutation drépanocytaire : l'une entre les VIIIe siècle et XIIIe siècle venant de Méditerranée, une autre à partir du XVe siècle venant d'Afrique. La mutation s'est diluée dans l'ensemble de la population portugaise actuelle[64].
En Belgique, l’incidence moyenne de la drépanocytose est de 1/1 710 sur l’ensemble des nouveau-nés à Bruxelles et de 1/943 à Liège.
En Allemagne, seuls 300 cas de syndromes drépanocytaires majeurs sont recensés[65].
France
Les premiers cas de drépanocytose ont été rapportés en métropole dans les années 1940[66] Jusqu'aux années 1950, ces cas concernaient presque uniquement des personnes d'origine antillaise[64] (la drépanocytose comme maladie du noir américain, voir la section historique). Le premier mouvement migratoire fin XIXe siècle - début XXe siècle en provenance d'Europe du sud n'a pu être dépisté.
Après la décolonisation des années 1950-1960, survient un deuxième mouvement migratoire provenant d'Afrique et du Sud-Est asiatique. Des études ponctuelles de dépistage sont alors menées à partir des années 1970, dans plusieurs régions. Entre autres, en 1977, un dépistage systématique de la population scolaire de la région marseillaise sur plus de 35 000 élèves, a permis d'établir que 0,22 % étaient porteurs du trait drépanocytaire, tous issus de familles originaires de pays à risques, parfois vivant en France depuis 5 générations (pour les italiens du sud)[66].
En France, la drépanocytose est, en 2010, la maladie génétique la plus fréquente (1/2 364), loin devant la mucoviscidose (1/5 989). On estime alors à 12 000 le nombre de sujets atteints de syndrome drépanocytaire majeur (SDM)[67], avec en France métropolitaine un nombre supérieur à celui de l’Outre-mer (2 000 en Martinique et 1 500 en Guadeloupe)[68]. Chaque année, naissent en France 300 à 350 enfants atteints de SDM dont la plupart en Île-de-France[69].
Projections
Le nombre mondial de cas de drépanocytose (forme homozygote) pourrait atteindre 400 000 vers les années 2050.
Dans les pays développés, cette augmentation est liée à celle de l'espérance de vie (qualité de la prise en charge médicale). En près de 40 ans (1970-2010), la mortalité infantile des cas de drépanocytose est devenue proche de la population générale, et la durée médiane de vie dépasse les 60 ans. Toutefois cette prise en charge est coûteuse, et il existe des inégalités d'accès aux soins selon les pays à haut-revenu[50].
Historique
Données médicales
En 1874, un médecin africain formé en Angleterre, J.B. Africanus Horton, décrit une rhumatic fever, équivalent clinique de la drépanocytose, correspondant aujourd'hui à une crise vaso-occlusive osseuse, mais ce travail reste inaperçu[70].
En 1904, James Herrick, médecin à Chicago, fait la première description médicale de la drépanocytose : il examine un étudiant noir âgé de 20 ans, hospitalisé pour toux et fièvre. Le sujet est faible, a des vertiges et souffre de maux de tête. Depuis un an, il ressent des palpitations et un essoufflement comme certains membres de sa famille. L’examen du sang montre que le malade est très anémique, le nombre de ses hématies n’atteignant que la moitié de la valeur normale. L’observation d’un frottis sanguin montre des hématies inhabituelles en forme de faucille (falciformes) ou feuille d'acanthe. Cette observation est publiée en 1910[71].
En 1917, V.E. Emmel reproduit in vitro la falciformation (déformation en faucille) chez des sujets cliniquement sains, il conclut à l'existence de deux formes de la maladie. Par la suite, des études familiales envisagent l'hypothèse d'une transmission héréditaire autosomique récessive avec des formes manifestes et des formes latentes ou silencieuses. Les facteurs de falciformation sont précisés, dont la tension en oxygène, ainsi que la durée de vie plus courte des globules rouges[72].
Il faut attendre 1949 pour que soit clairement formulée, par James Neel[73], la transmission mendélienne de la maladie et l'existence d'une forme homozygote héritée de parents hétérozygotes.
La même année Linus Pauling montre qu'elle est due à une structure anormale de l'hémoglobine, dite hémoglobine S caractérisée par une moindre solubilité, présente seule dans les formes anémiques (sujets homozygotes SS), ou associée à une hémoglobine normale A dans les formes latentes (sujets hétérozygotes AS). C'est ainsi la première fois qu'on découvre l'origine moléculaire d'une maladie génétique.
De 1956 à 1959, le Britannique Vernon Ingram montre qu'elle est due à une substitution d'un acide aminé par une autre dans la chaîne bêta de l'hémoglobine anormale[74]. Cela démontre pour la première fois que les gènes déterminent la nature de chaque acide aminé dans une protéine.
En 1978, Tom Maniatis isole le gène de la chaîne bêta de l'hémoglobine sur le chromosome 11.
En 1980, Yuet Wai Kan (en) met au point un test génétique prénatal de la drépanocytose[75].
En 2002, la démonstration épidémiologique de la protection de la drépanocytose contre le paludisme à P. falciparum est faite, confirmant ainsi l'hypothèse de Haldane en 1949 qui s'appuyait sur des superpositions de cartes géographiques (fréquence de la drépanocytose et du paludisme). La présence des gènes de la drépanocytose s'explique donc par une pression de sélection induite par le paludisme. C'est un avantage hétérozygote contre le paludisme, mais au risque de maladie sévère dans sa forme homozygote[34].
Données socio-politiques
La maladie aurait été connue de populations africaines locales, entre autres au Ghana. L'enfant atteint est perçu comme un être réincarné, bénéfique ou maléfique selon les régions : un être de passage qu'il faut essayer de retenir, ou comme revenant sans cesse pour tourmenter ses parents[70]. La maladie est perçue comme transmise par la mère, notamment dans les sociétés polygames : si l'homme est hétérozygote et qu'une de ses femmes l'est aussi, 1/4 de leurs enfants seront homozygotes donc malades (transmission autosomique récessive, voir Physiopathologie), ce qui peut aboutir à des répudiations[76].
Maladie raciale
Identifiée aux États-Unis (observation de 1904, publiée en 1910, en tout 4 cas sont décrits jusqu'en 1922), la maladie a été d'emblée qualifiée de maladie des Noirs, la cause restant inconnue. La recherche sur la maladie a été exclusivement américaine jusque dans les années 1940. Quand la maladie est détectée chez quelques Blancs, elle s'explique par une erreur de diagnostic ou un métissage lointain.
Quant aux médecins coloniaux européens, ils considèrent d'abord que la maladie est rare en Afrique, et que son importance en Amérique est due à l'environnement ou au métissage américain plus fréquent. Sa grande fréquence en Afrique n'est reconnue que progressivement[70].
Le trait drépanocytaire (forme hétérozygote de la maladie) est alors utilisé comme traceur de migration et moyen d'étude sur les origines de l'humanité[77]. Son existence indiquerait la présence d'une population originelle plus primitive. Ainsi sa découverte en Inde centrale dans des populations à peau noire, a conduit à l'hypothèse d'une origine indienne des populations africaines[70].
Après la Seconde guerre mondiale, le concept de race en biologie humaine commence à se désagréger. On trouve de plus en plus d'hémoglobine S dans des populations blanches, d'autant plus difficiles à expliquer. À partir des années 1960-1970, la recherche génétique montre que la maladie est due à des mutations indépendantes les unes des autres[70]. La présence de l'hémoglobine S est indépendante de la couleur de peau, il n'y a plus 4 ou 5 grandes races humaines, mais des milliers de gènes plus ou moins indépendants, dont ceux de la drépanocytose.
Prise en charge médico-sociale
Dans les années 1960, aux États-Unis, l'information des familles et la prise en charge médicale des enfants drépanocytaires sont quasi clandestins et le fait de sociétés de bienfaisance ou de mouvements politiques noirs, comme les Black Muslims de Malcom X ou le mouvement des droits civiques de Martin Luther King. Des extrémistes noirs prétendent que la maladie est une invention des Blancs pour promouvoir un génocide, tandis que Linus Pauling propose de tatouer les hétérozygotes pour mieux interdire leur union. Les hétérozygotes sains sont stigmatisés (refus d'emploi, de prêt bancaire, d'assurance...)[76].
En 1971, le président Richard Nixon promet des crédits pour la recherche et la prise en charge des malades. Dans les années qui suivent, on observe une corrélation directe entre les crédits alloués par le National Institutes of Health[78] et l'amélioration de la qualité et de la durée de vie des drépanocytaires américains[76]. Dans les années 1990, dans d'autres pays développés (Grande-Bretagne, France...) il se confirme aussi que la drépanocytose est une maladie génétique répondant au mieux à la qualité d'une prise en charge médico-sociale[79].
Dépistage
Le début
Les méthodes permettant un dépistage néo-natal systématique sont disponibles depuis les années 1970. Toutefois leur mise en œuvre ne s'est généralisée qu'une quinzaine d'années plus tard, d'abord aux États-Unis à partir de 1987, puis au Royaume-Uni. La raison principale de ce décalage est que, en l'absence de traitement efficace, on pensait qu'un diagnostic précoce ne servirait à rien pour les malades (aucun effet sur la morbidité et la mortalité)[80].
Cependant, dans quelques établissements où le dépistage est associé à une prise en charge médicale avec information des parents, des études finissent par montrer une réduction impressionnante des infections et de la mortalité des enfants drépanocytaires (antibiothérapie prophylactique avant l'âge de 4 mois). Une étude avec groupe placebo, prévue pour une surveillance de 2 ans, a été interrompu 8 mois avant son terme, les résultats étant déjà significatifs[80].
En 1987, à Bethesda, une conférence de consensus médicale conclut à la nécessité, aux États-Unis, d'un dépistage généralisé et systématique à tous les enfants (avec la liberté de refuser pour les parents). Ce dépistage doit s'effectuer sous le contrôle de centres spécialisés avec prise en charge médico-sociale (médecins, travailleurs sociaux, information optimale avec conseil génétique et conseil de prévention)[80].
Cette conception de la prise en charge est rapidement adoptée par le Royaume-Uni qui dispose, en 1992, de 16 centres, dont 4 dans la région de Londres. A cette date, la France métropolitaine présente quelques années de retard, bien qu'un programme systématique de dépistage et de prise en charge existe en Guadeloupe depuis 1990[81].
Un test de dépistage rapide, permettant un premier résultat en quelques minutes, est à l'essai depuis février 2017 au Togo, au Mali et en République Démocratique du Congo[82]. Ce dépistage n'est utile que dans les zones où sont possibles des interventions préventives et thérapeutiques prenant en charge les personnes dépistées[50].
En France
Contrairement à d'autres maladies génétiques telles la phénylcétonurie et la mucoviscidose, le dépistage de la drépanocytose en France métropolitaine n'est pas encore systématique (il est systématique en Guadeloupe, Martinique, Guyane, Réunion). Il est effectué chez les nouveau-nés dont les deux parents ont des origines dans une région « à risque » pour cette maladie (en pratique, essentiellement les parents originaires d’Afrique subsaharienne, des Antilles, du Maghreb[86],[87]), lorsqu'un seul des deux parents est « à risque » (si l’origine du second n’est pas connue), lorsqu'il y a des antécédents de la maladie dans la famille, lorsqu'il y a des porteurs sains dans la famille[88],[89].
En 2016, en métropole, 39,4 % des nouveau-nés sont nés de couples « à risque » (292 871 sur un total de 743 431) et ont fait l'objet de dépistages ; ce pourcentage variant selon les régions de 9,1 % en Bretagne à 73,6 % en Île-de-France en raison des différences d’origine dans la population parentale. Ce pourcentage est en forte progression (19 % en 2000, 25,6 % en 2005, 35,7 % en 2013) suite à la généralisation du dépistage depuis 2000. Parmi les nouveau-nés atteints de SDM recensés depuis le début du dépistage, mis en place à des dates différentes avant la généralisation à l’ensemble du territoire en 2000, la grande majorité est née en Île-de-France, les autres enfants drépanocytaires sont nés à proximité des grands centres urbains, principalement dans l’est et le sud du pays. En 2016, 356 syndromes drépanocytaires majeurs (SDM) ont été repérés en métropole ainsi que 8 172 transmetteurs sains. L’incidence moyenne de la drépanocytose en métropole était de 1/823 nouveau-nés testés et de 1/2 088 par rapport à l’ensemble des nouveau-nés. Les enfants atteints d’un SDM se trouvent essentiellement en Ile-de-France et représentent 61,2 % (218/356) des malades de métropole. En Ile-de-France, entre 1996 et 2016, 2 079 998 nouveau-nés sur un total de 3 696 950 naissances (56,3%) ont été on été ciblés[90],[91],[92],[93],[94],[95],[96].
Aspects socio-politiques
En France, le dépistage ciblé a été remis en question, notamment parce que l’interrogation sur l’origine géographique des parents pose des problèmes de discrimination dans un pays qui interdit par ailleurs les statistiques basées sur l’origine ethnique[97].
En 2012, la Haute Autorité de Santé (HAS) a été saisie par la Direction Générale de la Santé de la question de la généralisation de ce dépistage à la totalité de population. Malgré les remarques de la DGS sur le danger de stigmatisation d’une partie de la population avec les dérives politiques qu’elle peut susciter[98], la HAS a conclu dans son rapport d’orientation de décembre 2013 rendu public en mars 2014, qu’il n’y a pas d’éléments permettant de justifier la pertinence d’une stratégie de dépistage néonatal systématique de la drépanocytose en France métropolitaine[99].
La HAS a estimé qu'en France, le dépistage ciblé de la drépanocytose restait préférable pour des raisons d'analyses de coût-efficacité, et de contexte historique, culturel et social. Les différences de flux migratoires, leur ancienneté, taille et origine géographique ne permettent pas de transposer une stratégie de dépistage d'un pays à l'autre[99].
Par ailleurs, le dépistage néo-natal de la drépanocytose est utilisé par des militants identitaires, disciples de Renaud Camus, comme un argument « scientifique » de la thèse du « Grand remplacement »[100]. Selon le quotidien Le Monde, les chiffres utilisés confondent dépistage d'une maladie et recensement ethnique. Ainsi dans certaines maternités d'Ile-de-France, la drépanocytose est dépistée chez tous les nouveau-nés, quelle que soit l'origine des parents[101].
D'autre part, ce ne sont pas que les enfants dont les parents sont originaires d'Afrique et du Maghreb qui sont systématiquement testés, mais aussi ceux du pourtour méditerranéen (Italie du sud, Grèce...), ceux originaires de l'Océan Indien et des départements d'Outre-Mer. Toutefois, selon Valérie Gauthereau, directrice de la fédération parisienne de dépistage, dans la pratique, les maternités essaient de cibler les personnes d’origine maghrébine ou africaine[101].
Filmographie
- Le Doigt sur la plaie, film documentaire burkinabé d'Abdoulaye Dao (2008)
- Les lances de Sickle Cell ou chroniques d'une douleur annoncée (2009)
Malades célèbres
- Le rappeur Prodigy, du duo Mobb Deep avait été diagnostiqué à l'âge de trois mois[102].
- Adama Traoré[103]
Voir aussi
Articles connexes
Liens externes
- (en) NCBI (NIH): Bibliographie sur Medline (en anglais) ;
- (fr) Orphanet: Informations sur la drépanocytose (consultations, recherches, associations…) ;
- (fr) Rapport de l'OMS (2006).
Bibliographie
- K. Wailoo, Dying in the city of the blues : sickle cell anemia and the politics of race and death, The University of North Carolina Press, 2001.
- A. Lainé. La drépanocytose, regards croisés sur une maladie orpheline, Karthala, 2004.
Références
- La littérature consacrée à la drépanocytose remonte jusqu'aux années 1940, et on a longtemps ignoré le résidu de méthionine initial dans la numérotation des acides aminés des sous-unités de l'hémoglobine, de sorte qu'il est généralement fait mention d'une substitution E6V pour définir cette mutation ; la préconisation actuelle est cependant de commencer la numérotation en incluant la méthionine initiale, ce qui conduit à définir la mutation de l'hémoglobine S plutôt comme une substitution E7V.
- Arnal C. et Girot R. Drépanocytose chez l'adulte. Encycl Méd Chir (Éditions Scientifiques et Médicales Elsevier SAS, Paris), Hématologie, 13-006-D-16, 2002, 15 p.
- (en) David C. Rees, Thomas N. Williams et Mark T. Gladwin, « Sickle-cell disease », The Lancet, vol. 376, no 9757, , p. 2018-2031 (PMID 21131035, DOI 10.1016/S0140-6736(10)61029-X, lire en ligne)
- (en) GBD 2015 Mortality and Causes of Death Collaborators, « Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015 », The Lancet, vol. 388, no 10053, , p. 1459-1544 (PMID 27733281, PMCID 5388903, DOI 10.1016/S0140-6736(16)31012-1, lire en ligne)
- (en) GBD 2015 Disease and Injury Incidence and Prevalence Collaborators, « Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015 », The Lancet, vol. 388, no 10053, , p. 1545-1602 (PMCID 5055577, DOI 10.1016/S0140-6736(16)31678-6, lire en ligne)
- (en) Simon Jones, Edward R. Duncan, Nikki Thomas, Joan Walters, Moira C. Dick, Susan E. Height, Adrian D. Stephens, Swee Lay Thein et David C. Rees, « Windy weather and low humidity are associated with an increased number of hospital admissions for acute pain and sickle cell disease in an urban environment with a maritime temperate climate », British Journal of Haematology, vol. 131, no 4, , p. 530-533 (PMID 16281945, DOI 10.1111/j.1365-2141.2005.05799.x, lire en ligne)
- (en) Barbara P. Yawn, George R. Buchanan, Araba N. Afenyi-Annan, Samir K. Ballas, Kathryn L. Hassell, Andra H. James, Lanetta Jordan, Sophie M. Lanzkron, Richard Lottenberg, William J. Savage, Paula J. Tanabe, Russell E. Ware, M. Hassan Murad, Jonathan C. Goldsmith, Eduardo Ortiz, Robinson Fulwood, Ann Horton et Joylene John-Sowah, « Management of Sickle Cell Disease. Summary of the 2014 Evidence-Based Report by Expert Panel Members », JAMA, vol. 312, no 10, , p. 1033-1048 (PMID 25203083, DOI 10.1001/jama.2014.10517, lire en ligne)
- (en) Pasquale Niscola, Francesco Sorrentino, Laura Scaramucci, Paolo De Fabritiis et Paolo Cianciulli, « Pain Syndromes in Sickle Cell Disease: An Update », Pain Medicine, vol. 10, no 3, , p. 470-480 (PMID 19416438, DOI 10.1111/j.1526-4637.2009.00601.x, lire en ligne)
- (en) Valentine Brousse, Julie Makani et David C. Rees, « Management of sickle cell disease in the community », BMJ, vol. 348, , article no g1765 (PMID 24613806, DOI 10.1136/bmj.g1765, lire en ligne)
- (en) Joshua J. Field, Paul F. Austin, Ping An, Yan Yan et Michael R. DeBaun, « Enuresis Is a Common and Persistent Problem Among Children and Young Adults with Sickle Cell Anemia », Urology, vol. 72, no 1, , p. 81-84 (PMID 18384865, PMCID 3729268, DOI 10.1016/j.urology.2008.02.006, lire en ligne)
- (en) Russell E. Ware, Renee C. Rees, Sharada A. Sarnaik, Rathi V. Iyer, Ofelia A. Alvarez, James F. Casell, Barry L. Shulkin, Eglal Shalaby-Rana, C. Frederic Strife, John H. Miller, Peter A. Lane, Winfred C. Wang, Scott T. Miller et les investigateurs du BABY HUG, « Renal Function in Infants with Sickle Cell Anemia: Baseline Data from the BABY HUG Trial », The Journal of Pediatrics, vol. 156, no 1, , p. 66-70.e1 (PMID 19880138, PMCID 4755353, DOI 10.1016/j.jpeds.2009.06.060, lire en ligne)
- (en) Ade Olujohungbe et Arthur L. Burnett, « How I manage priapism due to sickle cell disease », British Journal of Haematology, vol. 160, no 6, , p. 754-765 (PMID 23293942, DOI 10.1111/bjh.12199, lire en ligne)
- (en) J. Glassberg, « Evidence-based management of sickle cell disease in the emergency department », Emergency Medicine Practice, vol. 13, no 8, , p. 1-20 (PMID 22164362)
- (en) Scott T. Miller, « How I treat acute chest syndrome in children with sickle cell disease », Blood, vol. 117, no 20, , p. 5297-5305 (PMID 21406723, DOI 10.1182/blood-2010-11-261834, lire en ligne)
- (en) Armand Mekontso Dessap, Rusel Leon, Anoosha Habibi, Ruben Nzouakou, Françoise Roudot-Thoraval, Serge Adnot, Bertrand Godeau, Frederic Galacteros, Christian Brun-Buisson, Laurent Brochard et Bernard Maître, « Pulmonary hypertension and cor pulmonale during severe acute chest syndrome in sickle cell disease », American Journal of Respiratory and Critical Care Medicine, vol. 177, no 6, (PMID 18174543, DOI 10.1164/rccm.200710-1606OC)
- (en) Rabindra N. Paul, Oswaldo L. Castro, Anita Aggarwal et Patricia A. Oneal, « Acute chest syndrome: sickle cell disease », European Journal of Haematology, vol. 87, no 3, , p. 191-207 (PMID 21615795, DOI 10.1111/j.1600-0609.2011.01647.x, lire en ligne)
- (en) Kofi A. Anie et John Green, « Psychological therapies for sickle cell disease and pain », Cochrane Database of Systematic Reviews, vol. 5, , article no CD001916 (PMID 25966336, DOI 10.1002/14651858.CD001916.pub3, lire en ligne)
- (en) Howard A. Pearson, « Sickle Cell Anemia and Severe Infections Due to Encapsulated Bacteria », The Journal of Infectious Diseases, vol. 136, no Supplement 1, , S25-S30 (PMID 330779, DOI 10.1093/infdis/136.Supplement.S25, lire en ligne)
- (en) Wing Yen Wong, Darleen R. Powars, Linda Chan, Alan Hiti, Cage Johnson et Gary Overturf, « Polysaccharide encapsulated bacterial infection in sickle cell anemia: A thirty year epidemiologic experience », American Journal of Hematology, vol. 39, no 3, , p. 176-182 (PMID 1546714, DOI 10.1002/ajh.2830390305, lire en ligne)
- (en) Mariane de Montalembert, « Management of sickle cell disease », BMJ, vol. 337, , article no a1397 (PMID 18779222, DOI 10.1136/bmj.a1397, JSTOR 20510824, lire en ligne)
- (en) Rana Khatib, Raja Rabah et Sharada A. Sarnaik, « The spleen in the sickling disorders: an update », Pediatric Radiology, vol. 39, no 1, , p. 17-22 (PMID 19002450, DOI 10.1007/s00247-008-1049-9, lire en ligne)
- (en) Svetoslav N. Slavov, Simone Kashima, Ana Cristina Silva Pinto et Dimas Tadeu Covas, « Human parvovirus B19: general considerations and impact on patients with sickle-cell disease and thalassemia and on blood transfusions », FEMS Immunology & Medical Microbiology, vol. 62, no 3, , p. 247-262 (PMID 21585562, DOI 10.1111/j.1574-695X.2011.00819.x, lire en ligne)
- (en) R. S. Balgir., « Community Expansion and Gene Geography of Sickle Cell Trait and G6PD Deficiency, and Natural Selection against Malaria: Experience from Tribal Land of India », Cardiovascular & Hematological Agents in Medicinal Chemistry, vol. 10, no 1, , p. 3-13 (PMID 22264009, DOI 10.2174/187152512799201190, lire en ligne)
- (en) T. Jadavji et C. G. Prober, « Dactylitis in a child with sickle cell trait », Canadian Medical Association Journal, vol. 132, no 7, , p. 814-815 (PMID 3978504, PMCID 1345873, lire en ligne)
- (en) V. T. Worrall et V. Butera, « Sickle-cell dactylitis », The Journal of Bones and Joints Surgery. American Volume., vol. 58, no 8, , p. 1161-1163 (PMID 1002763)
- (en) B. Balkaran, G. Char, J. S. Morris, P. W. Thomas, B. E. Serjeant et G. R. Serjeant, « Stroke in a cohort of patients with homozygous sickle cell disease », The Journal of Pediatrics, vol. 120, no 3, , p. 360-366 (PMID 1538280, DOI 10.1016/S0022-3476(05)80897-2, lire en ligne)
- (en) Mark T. Gladwin, Vandana Sachdev, Maria L. Jison, Yukitaka Shizukuda, Jonathan F. Plehn, Karin Minter, Bernice Brown, Wynona A. Coles, James S. Nichols, Inez Ernst, Lori A. Hunter, William C. Blackwelder, Alan N. Schechter, Griffin P. Rodgers, Oswaldo Castro et Frederick P. Ognibene, « Pulmonary Hypertension as a Risk Factor for Death in Patients with Sickle Cell Disease », The New England Journal of Medicine, vol. 350, no 9, , p. 886-895 (PMID 14985486, DOI 10.1056/NEJMoa035477, lire en ligne)
- (en) Florence Parent, Dora Bachir, Jocelyn Inamo, François Lionnet, Françoise Driss, Gylna Loko, Anoosha Habibi, Soumiya Bennani, Laurent Savale, Serge Adnot, Bernard Maitre, Azzedine Yaïci, Leila Hajji, Dermot S. O'Callaghan, Pierre Clerson, Robert Girot, Frederic Galacteros et Gerald Simonneau, « A Hemodynamic Study of Pulmonary Hypertension in Sickle Cell Disease », The New England Journal of Medicine, vol. 365, no 1, , p. 44-53 (PMID 21732836, DOI 10.1056/NEJMoa1005565, lire en ligne)
- (en) Jon I. Scheinman, « Sickle cell disease and the kidney », Nature Clinical Practice. Nephrology, vol. 5, no 2, , p. 78-88 (PMID 19048000, DOI 10.1038/ncpneph1008, lire en ligne)
- (en) Nicolas Leveziel, Sylvie Bastuji-Garin, Franck Lalloum, Giuseppe Querques, Pascale Benlian, Michel Binaghi, Gabriel Coscas, Gisèle Soubrane, Dora Bachir, Frédéric Galactéros et Eric Souied, « Clinical and Laboratory Factors Associated With the Severity of Proliferative Sickle Cell Retinopathy in Patients With Sickle Cell Hemoglobin C (SC) and Homozygous Sickle Cell (SS) Disease », Medicine, vol. 90, no 6, , p. 372-378 (PMID 22033449, DOI 10.1097/MD.0b013e3182364cba, lire en ligne)
- (en) Orah S. Platt, Donald J. Brambilla, Wendell F. Rosse, Paul F. Milner, Oswaldo Castro, Martin H. Steinberg et Panpit P. Klug, « Mortality In Sickle Cell Disease — Life Expectancy and Risk Factors for Early Death », The New England Journal of Medicine, vol. 330, no 23, , p. 1639-1644 (PMID 7993409, DOI 10.1056/NEJM199406093302303, lire en ligne)
- (en) Nancy S. Green, Mary E. Fabry, Lazar Kaptue‐Noche et Ronald L. Nagel, « Senegal haplotype is associated with higher HbF than benin and cameroon haplotypes in African children with sickle cell anemia », American Journal of Hematology, vol. 44, no 2, , p. 145-146 (PMID 7505527, DOI 10.1002/ajh.2830440214, lire en ligne)
- Emmanuelle Lesprit et Philippe Lesprit, « Infections bactériennes dans la drépanocytose : Drépanocytose », La Revue du praticien, vol. 54, no 14, , p. 1574-1577
- (en) Anthony C. Allison, « Genetic control of resistance to human malaria », Current Opinion in Immunology, vol. 21, no 5, , p. 499-505 (PMID 19442502, DOI 10.1016/j.coi.2009.04.001, lire en ligne)
- Pablo Bartolucci, « Hémoglobinopathies : un avantage contre le paludisme mais au risque de maladies sévères », La Revue du praticien, vol. 64, no 8, , p. 1110-1111 (lire en ligne)
- (en) Dominic P. Kwiatkowski, « How Malaria Has Affected the Human Genome and What Human Genetics Can Teach Us about Malaria », American Journal of Human Genetics, vol. 77, no 2, , p. 171-192 (PMID 16001361, DOI 10.1086/432519, Bibcode 1224522, lire en ligne)
- (en) Nicolas Ponçon, Céline Toty, Grégory L'Ambert, Gilbert Le Goff, Cécile Brengues, Francis Schaffner et Didier Fontenille, « Biology and dynamics of potential malaria vectors in Southern France », Malaria Journal, vol. 6, no 18, (PMID 17313664, DOI 10.1186/1475-2875-6-18, Bibcode 1808464, lire en ligne)
- (en) Elliott Vichinsky, Deborah Hurst, Ann Earles, Klara Kleman et Bertram Lubin, « Newborn Screening for Sickle Cell Disease: Effect on Mortality », Pediatrics, vol. 81, no 6, , p. 749-755 (PMID 3368274, lire en ligne)
- (en) E. G. Davies, C. Riddington, R. Lottenberg et N. Dower, « Pneumococcal vaccines for sickle cell disease », The Cochrane Database of Systematic Reviews, vol. 1, , article no CD003885 (PMID 14974042, DOI 10.1002/14651858.CD003885.pub2, lire en ligne)
- (en) Justine Gellen-Dautremer, Valentine Brousse et Jean-Benoît Arlet, « Complications aiguës de la drépanocytose », La Revue du praticien, vol. 64, no 8, , p. 1114-1119
- (en) « Higher Doses Of Morphine Justified For Sickle Cell Patients », sur [1], (consulté le ).
- (en) Robert J. Adams, Virgil C. McKie, Lewis Hsu, Beatrice Files, Elliott Vichinsky, Charles Pegelow, Miguel Abboud, Dianne Gallagher, Abdullah Kutlar, Fenwick T. Nichols, Duane R. Bonds, Donald Brambilla, Gerald Woods, Nancy Olivieri, Catherine Driscoll, Scott Miller, Winfred Wang, Anne Hurlett, Charles Scher, Brian Berman, Elizabeth Carl, Anne M. Jones, E. Steve Roach, Elizabeth Wright, Robert A. Zimmerman et Myron Waclawiw, « Prevention of a First Stroke by Transfusions in Children with Sickle Cell Anemia and Abnormal Results on Transcranial Doppler Ultrasonography », The New England Journal of Medicine, vol. 339, no 1, , p. 5-11 (PMID 9647873, DOI 10.1056/NEJM199807023390102, lire en ligne)
- (en) L. M. Rabb, Yvonne Grandison, Karlene Mason, R. J. Hayes, Beryl Serjeant et G. R. Serjeant, « A trial of folate supplementation in children with homozygous sickle cell disease », British Journal of Haematology, vol. 54, no 4, , p. 589-594 (PMID 6347243, DOI 10.1111/j.1365-2141.1983.tb02138.x, lire en ligne)
- (en) Oluseyi Oniyangi et Aika A. A. Omari, « Malaria chemoprophylaxis in sickle cell disease », The Cochrane Database of Systematic Reviews, vol. 18, no 4, , article no CD003489 (PMID 17054173, DOI 10.1002/14651858.CD003489.pub2, lire en ligne)
- (en) Arturo J. Martí‐Carvajal, Ivan Solà et Luis H Agreda‐Pérez, « Treatment for avascular necrosis of bone in people with sickle cell disease », The Cochrane Database of Systematic Reviews, no 8, , article no CD004344 (PMID 27502327, DOI 10.1002/14651858.CD004344.pub6, lire en ligne)
- (en) Samuel Charache, Michael L. Terrin, Richard D. Moore, George J. Dover, Franca B. Barton, Susan V. Eckert, Robert P. McMahon, Ph.D., Duane R. Bonds et les investigateurs du Multicenter Study of Hydroxyurea in Sickle Cell Anemia, « Effect of Hydroxyurea on the Frequency of Painful Crises in Sickle Cell Anemia », The New England Journal of Medicine, vol. 332, no 20, , p. 1317-1322 (PMID 7715639, DOI 10.1056/NEJM199505183322001, lire en ligne)
- (en) Martin H. Steinberg, Franca Barton, Oswaldo Castro, Charles H. Pegelow, Samir K. Ballas, Abdullah Kutlar, Eugene Orringer, Rita Bellevue, Nancy Olivieri, James Eckman, Mala Varma, Gloria Ramirez, Brian Adler, Wally Smith, Timothy Carlos, Kenneth Ataga, Laura DeCastro, Carolyn Bigelow, Yogen Saunthararajah, Margaret Telfer, Elliott Vichinsky, Susan Claster, Susan Shurin, Kenneth Bridges, Myron Waclawiw, Duane Bonds et Michael Terrin, « Effect of Hydroxyurea on Mortality and Morbidity in Adult Sickle Cell Anemia. Risks and Benefits Up to 9 Years of Treatment », JAMA, vol. 289, no 13, , p. 1645-1651 (PMID 12672732, DOI 10.1001/jama.289.13.1645, lire en ligne)
- (en) O. S. Platt, S. H. Orkin, G. Dover, G. P. Beardsley, B. Miller et D. G. Nathan, « Hydroxyurea enhances fetal hemoglobin production in sickle cell anemia », The Journal of Clinical Investigation, vol. 74, no 2, , p. 652-656 (PMID 6205021, DOI 10.1172/JCI111464, lire en ligne)
- (en) Orah S. Platt, « Hydroxyurea for the Treatment of Sickle Cell Anemia », The New England Journal of Medicine, vol. 358, no 13, , p. 1362-1369 (PMID 18367739, DOI 10.1056/NEJMct0708272, lire en ligne)
- (en) Richard D. Moore, Samuel Charache, Michael L. Terrin, Franca B. Barton, Samir K. Ballas, E. Orringer, S. Jones, D. Strayhorn, W. Rosse, G. Phillips, D. Peace, A. Johnson-Telfair, P. Milner, A. Kutlar, A. Tracy, S. K. Ballas, G. E. Allen, J. Moshang, B. Scott, M. Steinberg et al., « Cost-Effectiveness of Hydroxyurea in Sickle Cell Anemia », American Journal of Hematology, vol. 64, no 1, , p. 26-31 (PMID 10815784, DOI 10.1002/(SICI)1096-8652(200005)64:1<26::AID-AJH5>3.0.CO;2-F, lire en ligne)
- (en) Frédéric B. Piel, Martin H. Steinberg et David C. Rees, « Sickle Cell Disease », The New England Journal of Medicine, vol. 376, no 16, , p. 1561-1573 (PMID 28423290, DOI 10.1056/NEJMra1510865, lire en ligne)
- (en) « FDA approves new treatment for sickle cell disease », sur www.fda.gov, (consulté le ).
- (en) Yutaka Niihara, Han A. Koh, Lan Tran, Rafael Razon, Henry Macan, Charles Stark, Ted Wun et Patricia Adams-Graves, « A Phase 3 Study of L-Glutamine Therapy for Sickle Cell Anemia and Sickle ß0-Thalassemia », Blood, vol. 124, no 21, , p. 86 (lire en ligne)
- Noir&Blanc Escroquerie : le VK500
- Malika Benkerrou, « Indications des allogreffes de cellules souches hématopoïétiques dans la drépanocytose », La Revue du Praticien, , p. 1130-1131.
- Site des hôpitaux de Lyon, consulté le 30 avril 2008]
- (en) Robert Pawliuk, Karen A. Westerman, Mary E. Fabry, Emmanuel Payen, Robert Tighe, Eric E. Bouhassira, Seetharama A. Acharya, James Ellis, Irving M. London, Connie J. Eaves, R. Keith Humphries, Yves Beuzard, Ronald L. Nagel et Philippe Leboulch, « Correction of Sickle Cell Disease in Transgenic Mouse Models by Gene Therapy », Science, vol. 294, no 5550, , p. 2368-2371 (PMID 11743206, DOI 10.1126/science.1065806, Bibcode 2001Sci...294.2368P, lire en ligne)
- (en) Arthur Bank, Ronald Dorazio et Philippe Leboulch, « A Phase I/II Clinical Trial of β-Globin Gene Therapy for β-Thalassemia », Annals of the New York Academy of Science, vol. 1054, no 1, , p. 308-316 (PMID 16339679, DOI 10.1196/annals.1345.007, Bibcode 2005NYASA1054..308B, lire en ligne)
- Sandrine Cabut, « Drépanocytose : succès d’une thérapie génique chez le premier patient traité En savoir plus sur http://www.lemonde.fr/sante/article/2017/03/01/drepanocytose-succes-d-une-therapie-genique-chez-le-premier-patient-traite_5087805_1651302.html », sur www.lemonde.fr, (consulté le ).
- (en) Jean-Antoine Ribeil, Salima Hacein-Bey-Abina, Emmanuel Payen, Alessandra Magnani, Michaela Semeraro, Elisa Magrin, Laure Caccavelli, Benedicte Neven, Philippe Bourget, Wassim El Nemer, Pablo Bartolucci, Leslie Weber, Hervé Puy, Jean-François Meritet, David Grevent, Yves Beuzard, Stany Chrétien, Thibaud Lefebvre, Robert W. Ross, Olivier Negre, Gabor Veres, Laura Sandler, Sandeep Soni, Mariane de Montalembert, Stéphane Blanche, Philippe Leboulch et Marina Cavazzana, « Gene Therapy in a Patient with Sickle Cell Disease », The New England Journal of Medicine, vol. 376, no 9, , p. 848-855 (PMID 28249145, DOI 10.1056/NEJMoa1609677, lire en ligne)
- « La drépanocytose : traitements et bonnes pratiques », sur Association Pour l'Information et la Prévention de la Drépanocytose (APIDP), (consulté le ).
- (en) « Sickle-cell anaemia », sur www.who.int, (consulté le ).
- (en) Mitch Leslie, « 170-year-old mystery solved: Why deer have deformed blood cells just like some people », sur www.sciencemag.org, (DOI 10.1126/science.aar7918, consulté le ).
- (en) Frédéric B. Piel, Andrew J. Tatem, Zhuojie Huang, Sunetra Gupta, Thomas N. Williams et David J. Weatherall, « Global migration and the changing distribution of sickle haemoglobin: a quantitative study of temporal trends between 1960 and 2000 », The Lancet Global Health, vol. 2, no 2, , e80-e89 (PMID 24748392, DOI 10.1016/S2214-109X(13)70150-5, Bibcode 3986033, lire en ligne)
- Bardakdjian, Josiane et Wajcman, Henri « Épidémiologie de la drépanocytose » La Revue du Praticien 2004
- Dickerhoff R, von Ruecker A, « Manifestations of sickle cell disease in adolescents and young adults. Clinical aspects and therapy references », Klin Padiatr, vol. 210, , p. 10-6 (PMID 9522298)
- Lena-Russo D, North ML. et Girot R. « Épidémiologie des maladies génétiques de l’hémoglobine en France Métropolitaine » Rev Prat. 1992;42:1867-72.
- [2]
- www.drepaction.org
- M. Montalembert, « Échanges érythrocytaires chez les patients drépanocytaires », Hématologie, vol. 13, no 4, , p. 243-9 (lire en ligne)
- A. Lainé, « Entretien : " Il n'y a pas de maladie plus racialisée que la drépanocytose ". », La Revue du Praticien - Médecine Générale. « 26 », no 876, , p.138-139
- J.B. Herrick, « Peculiar elongated and sickle-sphaped red blood corpuscles in a case of severe anemia », Archives of Internal Medecine, vol. 25, , p. 553-561
- D. Labie, « Histoire génétique de la drépanocytose », La Revue du Praticien, vol. 42, no 15, , p. 1879-1884 (ISSN 0035-2640)
- James Neel, « The Inheritance of Sickle Cell Anemia », Science, vol. 110, , p. 64-66 (DOI 10.1126/science.110.2846.64)
- V.M. Ingram, « A Specific Chemical Difference between Globins of Normal and Sickle-cell Anemia Hemoglobins », Nature, vol. 178, , p. 792-794 (DOI 10.1038/178792a0, lire en ligne)
- Site de la Fondation Louis Jeantet
- G. Tchernia, « La longue histoire de la drépanocytose », La Revue du Praticien, vol. 54, no 14, , p. 1618-1621
- J. Bernard, Le sang et l'histoire, Buchet / Chastel, , p. 81-91
- équivalent de l'INSERM en France.
- F. Galactéros, « Drépanocytose », La Revue du Praticien, vol. 54, no 14, , p. 1529-1530
- National Institutes of Health, Consensus., « Newborn screening for sickle disease and other hemoglobinopathies. », Journal of American Medical Association, vol. 258, , p. 1205-1209
- L.S Zohoun, « Politiques de santé et drépanocytose », La Revue du Praticien, vol. 42, no 15, , p. 1873-1877
- « Drépanocytose : un test de dépistage rapide à l'essai sur le continent - JeuneAfrique.com », JeuneAfrique.com, (lire en ligne, consulté le )
-
« François », « Drépanocytose : la carte du grand remplacement mise à jour – Chiffres 2015 (Màj : projections pour les années à venir) », sur Fdesouche.com, (consulté le ) :
« L’interdiction des statistiques ethniques en France empêche de quantifier l’importance des changements de population en France. Mais d’autres données, médicales en particulier, permettent de mesurer par la bande les bouleversements démographiques actuellement en cours. »
- Jacques Chassaing, « La drépanocytose : la carte qui montre la réalité de l’invasion africaine », sur Riposte Laïque, (consulté le ).
- Alexandre Léchenet et Samuel Laurent, « Drépanocytose, la maladie génétique qui excite l’extrême droite », Les Décodeurs, sur Le Monde.fr, (consulté le ).
- « Le dépistage de la drépanocytose en métropole a pour particularité de n’être effectué que chez les nouveau-nés dont les parents appartiennent à un groupe à risque pour cette maladie, soit essentiellement les parents originaires d’Afrique subsaharienne, des Antilles et du Maghreb (dépistage ciblé). », Josiane Bardakdjian-Michau et Michel Roussey, Le dépistage néonatal de la drépanocytose en France, juillet 2012
- « Les «critères de ciblage» officiels des nouveau-nés retiennent les parents originaires de tous les pays d’Afrique du Nord, d’Afrique subsaharienne et du Cap Vert, du Brésil, d’Amérique du nord (les personnes noires), d’Inde, de l’Océan Indien, de Madagascar, de l’Ile Maurice, des Comores, d’Italie (du sud et de Sicile), de Grèce, de Turquie et du Moyen-Orient (Liban, Syrie, Arabie saoudite, Yémen, Oman) » dans Drépanocytose : une discrimination négative à la française
- Le dépistage, AFDHPE
- Jean-Yves Nau, « Drépanocytose: une discrimination négative à la française », Slate.fr, (lire en ligne)
- « En métropole, 35,7 % des nouveau-nés sont ciblés, ce pourcentage varie de 7,33 % en Bretagne à 67.9 % en Ile de France, en fonction des différentes origines géographiques représentées dans la population. », Association française pour le dépistage et la prévention des handicaps de l’enfant (AFDPHE), Bilan d’activité 2013.
- Drépanocytose sur le site de l'AFPDHE
- Josiane Bardakdjian-Michau et Michel Roussey, [3] Le dépistage néonatal de la drépanocytose en France, juillet 2012
- « En 2005, 236 998 nouveau-nés ont bénéficié du dépistage de la drépanocytose (198 065 nés en métropole et 38 933 nés dans les DOM)... En métropole, 25,6 % des nouveau-nés sont ciblés ; ce pourcentage varie de 3,5 à 54,1 % selon les régions, à raison des différences d’origine dans la population parentale. », Josiane Bardakdjian-Michau, Le dépistage néonatal de la drépanocytose en France, Médecine thérapeutique / Pédiatrie. Volume 11, Numéro 1, 5-8, janvier-février 2008, Dossier
- Josiane Bardakdjian-Michau et al., « Neonatal screening for sickle cell disease in France », J Clin Pathol, vol. 62, , p. 31-33 (DOI 10.1136/jcp.2008.058867, présentation en ligne)
- Association française pour le dépistage et la prévention des handicaps de l’enfant (AFDPHE), Bilan d’activité 2010.
- BILAN AFDPHE 2016, Afdphe 2016
- « Par ailleurs, le ciblage est depuis longtemps remis en question pour 3 raisons : l’interrogation sur l’origine géographique pose des problèmes de discrimination dans un pays qui interdit par ailleurs les statistiques basées sur l’origine ethnique, le mélange de groupes ethniques rendus non identifiables après plusieurs générations et la fréquence très élevée dans certaines régions (1/874 en Ile de France). », Association française pour le dépistage et la prévention des handicaps de l’enfant (AFDPHE), Bilan d’activité 2013
- « Malgré nos remarques sur le danger de stigmatisation d’une partie de la population avec les dérives politiques qu’elle peut susciter, la HAS a rejeté cet argument dans ses conclusions rendues en avril 2014 en faisant remarquer que le ciblage ethnique que nous pratiquions était correctement effectué et qu’il n’y avait donc pas d’argument scientifique. », Association française pour le dépistage et la prévention des handicaps de l’enfant (AFDPHE), Bilan d’activité 2013
- Haute Autorité de santé, Dépistage néonatal de la drépanocytose en France : pertinence d’une généralisation du dépistage à l’ensemble des nouveau-nés, Saint-Denis (Seine-Saint-Denis), 2013
- David Caviglioli, « Renaud Camus, le maître à tweeter du Printemps français », Le Nouvel Observateur.com, (lire en ligne, consulté le ).
- Alexandre Léchenet et Samuel Laurent, « Drépanocytose, la maladie génétique qui excite l’extrême droite », Le Monde.fr, (lire en ligne)
- Prodigy: The Truth About Sickle Cell, interview par Allhiphop.com, 4 février 2008.
- « Mort d'Adama Traoré : ce que conclut vraiment la nouvelle expertise médicale », Libération, (lire en ligne)



