Brucellose
| Causes | Brucella, Brucella melitensis (en), Brucella abortus, Brucella neotomae (d), Brucella suis (en) ou Brucella canis (en) |
|---|---|
| Incubation min | 5 j |
| Incubation max | 5 mois |
| Symptômes | Fièvre ondulante (d), fièvre continue (en), fatigue, myalgie, anorexie, hépatomégalie, splénomégalie, arthrite, orchite, adénopathie et névrite |
| Médicament | Streptomycine, doxycycline, minocycline et rifampicine |
|---|---|
| Spécialité | Infectiologie et médecine vétérinaire |
| CISP-2 | A78 |
|---|---|
| CIM-10 | A23 |
| CIM-9 | 023 |
| DiseasesDB | 1716 |
| MedlinePlus | 000597 |
| eMedicine | 213430 |
| MeSH | D002006 |
| Patient UK | Brucellosis |
La brucellose, anciennement appelée fièvre de Malte ou mélitococcie, est une anthropozoonose (maladie transmise par les animaux) due à des coccobacilles (bactéries) du genre Brucella, du nom de David Bruce (1855-1931).
La brucellose humaine est liée à celle du bétail domestique et aux produits laitiers crus provenant d'animaux infectés. Elle est devenue rare en France depuis la mise en place de mesures prophylactiques sévères prises à partir de 1975.
Elle reste une maladie d'actualité par sa fréquence et ses conséquences socio-économiques dans les pays en développement, et la découverte de nouvelles Brucella chez d'autres espèces animales, domestiques ou sauvages (y compris les mammifères marins, et les amphibiens). La brucellose animale apparaît comme en émergence continue, à partir de nouveaux foyers sauvages, principalement d'ongulés, sur tous les continents.
Chez l'animal, la maladie se manifeste surtout par des avortements, alors que chez l'humain, il s'agit d'une fièvre avec complications chroniques le plus souvent articulaires ou neurologiques.
La transmission inter-humaine est rarissime, la brucellose humaine restant directement en rapport avec la maladie animale. La prévention et l'éradication de la maladie chez le bétail et la surveillance de la vie sauvage restent les meilleurs moyens de lutte.
Synonymes
[modifier | modifier le code]Les dénominations historiques de la brucellose sont très nombreuses. Outre « fièvre de Malte » et « mélitoccocie », les plus connues sont[1],[2],[3] :
- fièvre de Chypre, fièvre de Gibraltar, fièvre du Rocher (Rock fever), fièvre de Crimée, fièvre napolitaine, fièvre méditerranéenne...
- fièvre sudorale, fièvre sudoro-algique, fièvre ondulante...
- maladie de Bang, maladie de Traum, septicémie de Bruce...
- fièvre folle (en Tunisie), febbricola (en Italie)...
Histoire
[modifier | modifier le code]Il existe deux histoires de la brucellose, celle-ci se manifestant différemment : avortements contagieux ou infectieux pour la maladie animale et fièvre ondulante chronique pour la maladie humaine. Ces deux histoires se réunissent à l'ère pastorienne, au début du XXe siècle[4].
Avortement contagieux des troupeaux
[modifier | modifier le code]L'avortement des troupeaux de brebis et de chèvres est mentionné dans la Genèse (XXXI, 38). Aristote dans son Histoire des animaux (VIII, 21) rapproche l'avortement des truies de celui des brebis, qu'il attribue à une même cause, une alimentation trop riche en glands pour les femelles en gestation[4].
Au début du XIXe siècle, en Angleterre, devant une nouvelle ampleur du phénomène qui touche aussi vaches et même juments, quelques médecins affirment la contagiosité des avortements des troupeaux. En France, le médecin Charles Flandin (1803-1887) rapporte une pratique traditionnelle chez les paysans qui consiste à sortir les veaux mort-nés de l'étable par la fenêtre ou un trou dans le mur, pour éviter que les vaches ne passent par le même chemin[4]. Aux États-Unis, une épizootie d'avortements est signalée en 1864, mais sans indication de contagiosité[4].
En 1878, le caractère contagieux de ces avortements est démontré, mettant fin à la discussion sur ce point[5]. En 1895, le médecin vétérinaire danois Bernhard Lauritz Frederik Bang isole et identifie l'agent causal dans les produits d'avortement des vaches. Il isole un petit bacille Gram négatif, difficilement cultivable mais qui, inoculé à une génisse primigeste saine, entraine un avortement. C'est le « bacille de Bang » (finalement Brucella abortus bovis) qui cause la « maladie de Bang » chez les bovins. En 1913, le bacille de Bang est isolé du lait de vache[4].
En 1897, Almroth Wright met en évidence la présence d’anticorps agglutinants spécifiques dans le sérum des animaux infectés en laboratoire, et des animaux récemment guéris. Cette réaction de Wright sera utilisée en pathologie humaine.
En 1914, Jacob Traum (1882-1966)[6] isole chez la truie, un bacille voisin finalement nommé Brucella suis[4], qui cause la « maladie de Traum », chez le porc[7].
Fièvre méditerranéenne ou fièvre de Malte
[modifier | modifier le code]Des origines au XVIIIe siècle
[modifier | modifier le code]
La brucellose humaine est probablement apparue avec la domestication des moutons (voir Ovis orientalis) et des chèvres qui font partie des animaux les plus anciennement domestiqués, après le chien et les bovidés. La maladie se serait introduite dans les sociétés sédentarisées du néolithique européen, à partir de 6000 av. J.C, en général du sud au nord, et de l'est à l'ouest[8].
La maladie est restée indistincte aux yeux des médecins jusqu'au début du XIXe siècle, probablement confondue dans un ensemble de fièvres discontinues et chroniques mentionnées par Hippocrate et Galien[5],[9].
Plusieurs cas paléopathologiques ont été attribués à la brucellose à partir de lésions osseuses caractéristiques (vertébrales et sacro-iliaques), mais qui ne dépassent pas le niveau du plausible : le premier en 1965, à Jéricho, de l'âge du bronze, d'autres en France, Espagne, Norvège, du chalcolithique au haut Moyen-Âge[10].
En 2012, l'ADN de Brucella est détectable dans des ossements anciens, mais cette recherche reste difficile et discutée[11]. Il apparait que la brucellose était présente à l'époque romaine : un cinquième des squelettes retrouvés à Herculanum, ensevelis à la suite de l'éruption du Vésuve de 79, en portaient des traces[12].
Au XVIIIe siècle, plusieurs auteurs riverains de la Méditerranée, comme Francesco Torti(1658-1741) à Modène en 1712, ou George Cleghorn (en)(1716-1789) en 1751 à Minorque, mentionnent la fréquence de fièvres discontinues. La situation reste confuse jusque vers 1860[4],[13].
Découvertes cliniques et bactériologiques
[modifier | modifier le code]
Après la guerre de Crimée, le chirurgien-général Jeffery Allen Marston (en) (1831-1911) des forces britanniques, est stationné à Malte. En 1863, il publie un rapport sur les fièvres[14] où il distingue une fièvre particulière, dont il est atteint lui-même[15], et qu'il décrit avec précision, en lui attribuant trois caractéristiques : cette fièvre est ondulante et sudoro-algique (sueurs et douleurs). Il la nomme « fièvre gastrique rémittente »[4].
En 1884, le médecin militaire David Bruce (1855-1931) est affecté à son tour à Malte. Il est accompagné de son épouse Mary Élisabeth Bruce née Steel (1849-1931), microbiologiste éminente. Ils reprennent les observations de Marston, et David Bruce aidé par sa femme[4], identifie un germe cocciforme minuscule à partir de la pulpe de rate à l'autopsie de malades. L'observation est publiée en 1887[16]. En 1893, après avoir démontré son rôle causal par inoculation au singe, Bruce nomme la bactérie Micrococcus melitensis[4],[5]. À partir de cette période, la maladie s'appelle aussi melitococcosis en anglais ou mélitococcie en français (du latin Melita designant Malte)[17].
En 1897, Matthew Louis Hugues, élève et collaborateur de Bruce, publie à Londres une description clinique définitive de la maladie Mediterranean, Malta or ondulant fever, un rapport qui fera référence jusqu'à la fin du XXe siècle[5].
Brucellose, 1900-1950
[modifier | modifier le code]
Unification
[modifier | modifier le code]Les recherches vétérinaires et médicales se rejoignent au début du XXe siècle. La Royal Society of Medicine crée une commission de recherches sur la « fièvre méditerranéenne » pour les troupes britanniques de Malte, dirigée par David Bruce.
En 1905, Themistocles Zammit (1864-1935), en voulant étudier la maladie humaine sur le modèle animal de la chèvre à Malte, découvre qu’elles sont toutes positives au test de Wright (issu de la recherche vétérinaire) et que la brucellose est donc une anthropozoonose. Il établit aussi que la contamination humaine s'effectue par ingestion de lait cru de chèvre. En 1906, cette consommation (lait de chèvre non bouilli) est interdite aux forces navales et militaires de l'île. En près d'un an la fièvre de Malte est éliminée des forces britanniques basées sur l'île (de 643 cas en 1905 à 7 cas en 1907)[5].
La maladie persiste dans la population civile maltaise en raison des difficultés sociales, économiques et techniques d'une prévention de masse dans les conditions de l'époque. La chèvre est la seule ressource laitière de l'île et la pasteurisation du lait n'y sera généralement acceptée qu'après la deuxième guerre mondiale[5].
L'unification bactériologique vétérinaire et médicale est faite par la bactériologiste américaine Alice Catherine Evans (1881-1975). En 1918, elle montre que bacillus abortus de Bang (issu de la maladie bovine) est similaire au micrococcus melitensis de Bruce (issu de la maladie humaine et caprine). Ces travaux sont confirmés : la maladie humaine peut se transmettre aussi par lait de vache, et la maladie des chèvres au gros bétail[4].
En 1920, le terme générique de Brucella est adopté en l'honneur de Bruce : Brucella abortus (le plus souvent bovins), B. melitensis (le plus souvent petits ruminants), auxquels on adjoint B. suis (le plus souvent porcins) à partir de 1922[5].
Pour la découverte ultérieure des autres espèces, voir :
Extension en France et dans le reste du monde
[modifier | modifier le code]En France, la maladie reste d'abord très mal connue. Les travaux britanniques sont confirmés par les frères Edmond et Étienne Sergent en Algérie et Charles Nicolle en Tunisie.
Les premières études en France métropolitaine sont le fait de médecins de campagne, comme Louis Cantaloube qui identifie près de 200 cas personnels lors d'une épidémie survenue à Saint Martial du Gard en 1908. Il reconnaît la fièvre de Malte, le montre par sérologie et en décrit les complications articulaires et neurologiques, il publie ses observations en 1911. Entre-temps, la maladie est reconnue à Marseille en 1909, à partir de brousse (fromage frais de chèvre) contaminée par micrococcus melitensis[4].
Un autre exemple est celui de Joseph Jullien[18], de Joyeuse (Ardèche), qui publie en 1933 dans la revue médicale Paris médical, un article intitulé « Brucelloses et tuberculoses » faisant le point sur les différences et les rapports entre les deux maladies[19].
Pour les contemporains de la première moitié du XXe siècle, la brucellose en France apparaît comme une « maladie tropicale d'importation », liée aux commerce des animaux, à la transhumance, ou encore à la mixité de troupeaux, comme la présence de chèvres dans des étables de bovins. Elle s'étend du sud-est au reste de la France : en 1938, seule la Bretagne est épargnée. Le nombre de cas humains annuels est alors estimé à plus de trois mille cas en France métropolitaine[20].
Dans le reste du monde, à partir des années 1920, la brucellose s'observe dans la plupart des régions d'élevage comme en Rhodésie, au Danemark (1929), ou aux États-Unis par importation de bétail mexicain ou argentin.
La maladie est aussi signalée en Asie : Inde, Chine[5], comme en Indochine française (1938)[21].
En Afrique subsaharienne, elle est retrouvée dans les colonies britanniques, françaises et belges, par exemple : Soudan anglo-égyptien (1904), Soudan français (1910), Congo belge (1914), Sénégal (1938), Djibouti (1938)[21].
Contrôle de la brucellose, 1950-2000
[modifier | modifier le code]Brucellose animale
[modifier | modifier le code]En 1968, en France, l'estimation de la prévalence annuelle des bovins, ovins et caprins infectés était de la moitié des cheptels, et du quart des animaux[22]. Cette situation a conduit, la même année, à des mesures prophylactiques, mais non obligatoires. Elles le deviennent en 1975, en ce qui concerne les bovins. Elles consistent en[23] :
- Déclaration obligatoire des avortements, quelle qu'en soit la cause ;
- Examen sérologique et bactériologique de l'animal ayant avorté ;
- Si diagnostic positif : dépistage sérologique dans le troupeau en cause, et abattage des animaux infectés dans un délai de 30 jours ;
- Indemnisation de l'éleveur ;
- Surveillance des mouvements d'animaux (ensemble des cheptels bovins).
Ces mesures sont généralisées aux caprins en 1977, et aux ovins en 1981. En 1989, le taux d'infection n'est plus que de 0,09 % des animaux pour les bovins, 0,10 % pour les caprins, et 0,23 % pour les ovins[22].
Brucellose humaine
[modifier | modifier le code]Au XXe siècle, la brucellose humaine était plus fréquente en milieu rural qu'en milieu urbain. L'épidémiologie humaine dépend de l'épidémiologie animale : en parallèle des cas animaux, les cas humains ont diminué en France, passant de plus de 800 cas déclarés en 1978 à 146 cas en 1989. La maladie humaine étant souvent méconnue, il existe une forte sous-déclaration (à corriger par un facteur 5 à 10 en France[24], et 26 aux États-Unis[25]).
En 1997, en France, 77 cas ont été signalés, localisés principalement dans le sud du pays (Landes, Pyrénées-Orientales), avec importance égale des modes de contamination (contact direct professionnel avec des animaux infectés, consommation de produits laitiers crus infectés)[26].
Agent pathogène
[modifier | modifier le code]Morphologie
[modifier | modifier le code]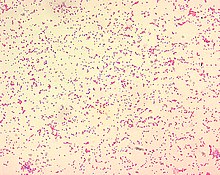
Brucella est un très petit coccobacille à Gram négatif de 0,5-0,7 x 0,6-1,5 µm (7,5 µm pour un globule rouge). La bactérie est immobile, non encapsulée, non sporulée, aérobie stricte et intra-cellulaire facultative.
Il en existe plusieurs espèces dont quatre sont pathogènes pour l’homme : principalement B. melitensis, B. abortus bovis, B. suis et accessoirement B. canis.
Survie à l’extérieur de l’hôte
[modifier | modifier le code]La bactérie Brucella est sensible à la chaleur et à l’action des rayons ultraviolets mais elle est très résistante dans le milieu extérieur. Dans les milieux secs, non organiques (locaux, matériel…)[27], Brucella peut vivre 32 jours. Dans les milieux organiques humides (lisier, fromage et lait crus, végétaux souillés), elle peut vivre plus de 125 jours. Dans les milieux organiques secs (souillures sèches dans une étable), elle peut vivre jusqu’à 135 jours. Enfin dans le sang conservé à +4 °C, elle peut vivre jusqu’à 180 jours.
Réservoirs bactériens
[modifier | modifier le code]La notion de lien entre espèce de Brucella et espèce animale reste vraie, mais pas de façon absolue. Les ruminants domestiques constituent la principale source de brucellose humaine.
Les petits ruminants (ovins et caprins) sont surtout contaminés par Brucella melitensis. C’est l’espèce de Brucella la plus courante, la plus pathogène et la plus invasive pour l’homme (80 % des brucelloses humaines). Chez les bovins, il s'agit de Brucella abortus, encore retrouvée en Afrique et en Amérique du Sud. Chez les porcins, il s'agit de Brucella suis, trouvée surtout en Amérique du Nord et au centre de l’Europe.
La bactérie responsable de la maladie chez les canidés est Brucella canis (rares cas humains signalés, infections minimes ou sans symptômes, malgré la fréquence des infections canines).
D'autres espèces domestiques ou sauvages peuvent être impliquées : camélidés, cervidés, rongeurs, mammifères marins, amphibiens[3],[28]. En France, il existe une infection persistante de sangliers et des lièvres par un sous-type de Brucella suis, alors que l'infection humaine par B. suis reste absente du sol français[29].
Transmission
[modifier | modifier le code]Chez les animaux, il existe une transmission directe qui est soit fœto-maternelle, soit génitale, soit digestive par absorption d’aliments contaminés (lait, placenta) et une transmission indirecte par l’environnement.
La transmission interhumaine est exceptionnelle. La brucellose humaine ne peut se maintenir par elle-même dans une population, elle est toujours dépendante d'une brucellose animale[30].
Chez les humains, la contamination directe représente près de 70 % des cas[29]. Elle s'effectue par contact direct avec des animaux malades, leurs produits d’avortement et sécrétions génitales, les litières. Il s'agit alors de sujets professionnellement exposés : éleveurs, vétérinaires, employés des abattoirs, bouchers... La transmission peut être accidentelle en laboratoire, chez les bactériologistes et techniciens.
La transmission se fait par voie cutanée (favorisée par des blessures ou des excoriations), ou muqueuse digestive haute (bouche, pharynx...) par contamination manuportée ou aéroportée à proximité de l'animal ou d'un produit contaminé[29].
Les contaminations non professionnelles sont généralement indirectes, le plus souvent alimentaires par produits laitiers crus (non pasteurisés) et abats insuffisamment cuits. C'est notamment le cas de produits laitiers ramenés de voyage et consommés en France[29].
Biosécurité
[modifier | modifier le code]En France, les Brucella sont classées au niveau 3 de danger biologique [31]. Leur dose infectieuse est très faible : de 10 à 100 micro-organismes en aérosol[32].
Aux États-Unis, elles sont inscrites sur la liste des agents potentiels de bioterrorisme (groupe B, agents de seconde priorité)[33], du fait de leur dissémination possible par aérosols (contamination aérienne par inhalation). La seconde priorité tient au fait que, dans les modèles théoriques, la mortalité induite serait relativement faible, mais avec une morbidité élevée avec de fortes conséquences socio-économiques[30],[34].
Physiopathologie
[modifier | modifier le code]Le mécanisme du pouvoir pathogène de Brucella reste encore mal connu. Après pénétration, la bactérie gagne le ganglion lymphatique le plus proche, s'y multiplie et se dissémine vers d’autres ganglions lymphatiques et vers les organes du système réticulo-endothélial (foie, rate, moelle osseuse, organes génitaux…).
Elle est phagocytée par les macrophages et se développe dans le phagosome en inhibant la fusion lysosome/phagosome. La bactérie, devenue intracellulaire, peut ainsi échapper au système immunitaire.
Cette persistance intracellulaire entraine une réaction granulomateuse à l'origine de futurs foyers. À plus long terme, il se produit des phénomènes immuno-allergiques (malaises trainants ou « patraqueries »), ou encore des foyers suppurés d'évolution chronique[29].
Chez l'animal, le tropisme particulier des Brucella pour le placenta serait lié à une production éventuelle d'érythritol par le placenta. L'érythrol est utilisé comme facteur de croissance par les Brucella, et préféré au glucose. Ces bactéries se multiplient dans les cellules placentaires à un niveau très élevé, perturbant les échanges fœto-placentaires jusqu'à la mort fœtale[3].
Épidémiologie
[modifier | modifier le code]Dans le monde
[modifier | modifier le code]
La brucellose a une répartition mondiale avec une prédominance dans le bassin méditerranéen, l’Asie de l’Ouest, le Moyen-Orient, l’Amérique du Sud, l’Amérique centrale et l’Afrique subsaharienne. En 2014, les pays rapportant le plus de foyers enzootiques (épidémies animales) sont le Mexique (5514 flambées de brucellose) suivis de la Chine (2138), Grèce (1268) et Brésil (1142)[3].
L’OMS indique l’incidence mondiale de la maladie humaine à 500 000 cas rapportés par an, mais du fait de la sous-déclaration (manque de surveillance dans les pays en développement), l'incidence réelle est estimée de 5 millions à 12,5 millions de cas par an[3]. Les pays qui rapportent le plus fort taux d'incidence sont la Syrie (près de 1600 cas par million de personnes et par an), la Mongolie (391 cas), l'Irak (268 cas). Depuis l'an 2000, la Turquie a connu une nette diminution (de plus de 200 à moins de 50)[3].
La brucellose humaine est pratiquement en voie d'élimination dans les pays d'Europe du Nord et d'Amérique du Nord (0,4 cas par million de personnes et par an, aux États-Unis)[3], mais des foyers de brucellose des animaux sauvages persistent (par exemple sanglier en Europe, bison et wapiti en Amérique du Nord)[30].
En France
[modifier | modifier le code]En France, la brucellose est une maladie à déclaration obligatoire. Elle est considérée comme maladie professionnelle chez les éleveurs, les vétérinaires, le personnel d’abattoir et de laboratoire, les bouchers et les bergers. En 2001, 23 cas ont été déclarés dont 4 cas par exposition professionnelle[35]. Les cas autochtones en France métropolitaine sont inférieurs à 1 cas sur 1 million de personnes et par an depuis les années 2000[29].
Les cas importés sont devenus majoritaires. En 2017, sur 32 cas déclarés, 30 sont importés par séjour en pays d'enzootie : Algérie (13 cas), Tunisie (7 cas), et Liban (2 cas). Les deux cas autochtones de 2017 sont une contamination professionnelle (technicien de laboratoire) et un éleveur d'ovins retraité, ayant des antécédents de brucellose et dont la maladie s'est réactivée[36].
Symptomatologie
[modifier | modifier le code]Chez l'animal
[modifier | modifier le code]Toutes les espèces de Brucella montrent une pathogénicité particulière pour l'appareil génital, l'utérus gravide et les glandes mammaires chez les femelles, où elles entrainent chez les gestantes un avortement. La maladie est souvent inapparente et dans ces formes latentes, les femelles excrètent la bactérie dans le lait (le lait cru est contaminant). Chez les mâles, l'infection génitale se manifeste par des lésions testiculaires (orchite)[3].
La maladie animale donne une immunité partielle : typiquement les femelles récemment infectées avortent lors de leur première gestation, et n'avortent qu'une fois, mais il existe un sous-groupe d'animaux qui continuent d'avorter par la suite, ou donnent naissance à des individus de faible qualité[3].
La vache gestante avorte entre le 5e et le 8e mois de gestation (dont la durée approximative est de 9 mois chez la vache). La semence du taureau infecté est contaminante lors d'insémination artificielle (introduction intra-utérine), mais pas en accouplement naturel, le milieu vaginal étant peu propice aux Brucella abortus. Ce n'est pas le cas chez les petits ruminants, où la brucellose (Brucella melitensis) peut être sexuellement transmise de mâle infecté à femelle saine[3].
Chez le porc, la brucellose (Brucella suis) se présente sous des formes plus diverses, selon l'âge et le sexe. En sus de l'avortement et des lésions génitales, il peut exister des infertilités, des troubles articulaires. La transmission sexuelle est fréquente, mais la fièvre est rarement présente[3].
Chez la chienne, la brucellose (Brucella canis) donne une fièvre modérée, un avortement tardif, ou une portée de faible qualité. Chez le mâle, l'infection se traduit par une orchite ou une prostatite. Les canidés peuvent éliminer leur infection en deux ou trois ans[3].
Chez l'humain
[modifier | modifier le code]Liée à la maladie animale, mais se manifestant de manière différente, la brucellose humaine apparait comme une fièvre, à complications surtout ostéo-articulaires et neurologiques. Son expression est très polymorphe (« maladie aux cent visages ») de longue durée et évoluant par poussées successives, en trois phases non obligatoires (chacune d'elles pouvant être inapparente, sans manifestations)[29].
L'incubation correspond à la multiplication du germe dans le premier ganglion lymphatique rencontré. Cette période peut varier de 1 à 4 semaines[29].
Primo invasion
[modifier | modifier le code]Cette phase est aussi appelée brucellose aiguë, infection généralisée avec état septicémique ou fièvre sudoro-algique. Elle correspond à la dissémination par voie sanguine du germe vers d’autres ganglions lymphatiques et vers les organes du système réticulo-endothélial (foie, rate, moelle osseuse, organes génitaux…).
Forme classique
[modifier | modifier le code]Le début est progressif : la température du malade augmente par paliers de 0,5 °C jusqu’à 39 °C où elle se maintient pendant 10 à 15 jours pour redescendre graduellement, en se normalisant pendant quelques jours, puis le cycle recommence. L'aspect de la courbe de température réalise une forme ondulante évoluant en trois ou quatre ondulations.
À cette fièvre s'associent malaise et fatigue, des douleurs musculaires et articulaires, et souvent des sueurs abondantes nocturnes avec odeur caractéristique de paille mouillée. C'est la « fièvre ondulante sudoro-algique ». Dans 2 à 3 % des cas, des foyers articulaires ou génitaux peuvent survenir au cours d'une primo-invasion[29].
L'examen clinique peut retrouver, dans 25 à 40 % des cas, un gros foie (hépatomégalie), une grosse rate (splénomégalie) ou des adénopathies[29].
Autres formes
[modifier | modifier le code]Il existe des formes discrètes, voire muettes, ou des formes à fièvre continue simulant une fièvre typhoïde.
Les formes graves d'emblée touchent plusieurs organes (atteintes polyviscérales), notamment chez les sujets déjà porteurs d'une pathologie sévère (cardiaque, hépatique, rénale...). La mortalité est alors élevée : les endocardites à brucella représentent 80 % des décès par brucellose[3],[29].
Chez les femmes enceintes, l'atteinte des sacro-iliaques est fréquente, mais l'avortement est rare (contrairement à l'animal) et le risque de transmission à l'enfant est rarissime au cours de la grossesse ou de l'accouchement[29].
Brucellose focalisée secondaire et tardive
[modifier | modifier le code]Cette phase survient quelques mois après la septicémie en l’absence de traitement ou lorsque celui-ci a été insuffisant. Il y a constitution de foyers infectieux isolés ou multiples. Ces foyers peuvent être ostéoarticulaires (20 à 40 %)[29]. Ils se manifestent par des douleurs, des raideurs avec altération possible de l'état général (légère fièvre mais persistante sur un mode subaigu).
Les localisations vertébrales sont prédominantes pouvant réaliser un pseudo-mal de Pott mélitoccocique (brucellose ressemblant à une tuberculose vertébrale). Les autres atteintes ostéoarticulaires sont sacro-iliaques, coxo-fémorales, acromioclaviculaire, ou encore ostéites localisées (tibia, sternum).
Les atteintes génitales (6 à 8 %), neurologiques (5 %), hépatiques ou cardiaques sont moins fréquentes[3].
Phase tertiaire ou chronique
[modifier | modifier le code]Elle n'est pas obligatoire, mais elle peut être aussi inaugurale si l'infection initiale est restée silencieuse. Les manifestations sont de deux sortes, en pouvant s'associer[29] :
- La « patraquerie brucellienne » avec asthénie persistante globale (physique, intellectuelle, sexuelle) pouvant évoluer vers une dépression et un état douloureux chronique. L'activité physique suffit à déclencher une fièvre légère (fébricule) et des sueurs. Cependant l'état général du patient parait bon et l'examen clinique normal.
- Les foyers suppurés d'évolution très lente et à manifestations discrètes, qui sont à rechercher pour être traités.
La mortalité reste faible (1 à 2 % des cas), mais la chronicité de la maladie représente une lourde charge sociale et économique[3],[13].
Diagnostic
[modifier | modifier le code]Diagnostic positif
[modifier | modifier le code]Biologie
[modifier | modifier le code]À la phase de primo-invasion, les examens biologiques habituels sont non ou peu spécifiques, la brucellose étant peu inflammatoire (CRP peu modifiée). La numération formule sanguine est normale : il peut exister une neutropénie (baisse du nombre de polynucléaire neutrophiles) et des transaminases modérément augmentées au cours de la primo-invasion. Au cours de l'évolution, la présence de foyers locaux suppurés donne des signes inflammatoires plus nets.
Bactériologie
[modifier | modifier le code]Le diagnostic biologique spécifique est bactériologique : hémoculture à la phase aiguë, prélèvement au niveau des foyers infectieux à la phase chronique. Le biologiste doit être averti de la suspicion diagnostique (biosécurité, et milieu de culture adéquat)[29].
Le diagnostic moléculaire se fait par un test de détection par amplification génique.
Sérologie
[modifier | modifier le code]Le diagnostic sérologique reste fréquemment réalisé. Il s'agit de différentes techniques de dosage des anticorps, ou immunoglobulines spécifiquement dirigées contre Brucella.
La séro-agglutination de Wright reste la méthode de référence de l'OMS, la réaction est positive à compter du 10e-12e jour, puis le taux anti-corps IGM décroît rapidement en 4 à 8 mois[37]. Mais des faux-positifs existent du fait de réactions croisés avec Francisella tularensis, Yersinia enterocolitica et Vibrio cholerae, ce qui rend cette méthode moins significative en zone non endémique.
Les autres méthodes sont le test de fixation du complément, l'épreuve du rose de Bengale (du fait de sa simplicité et de sa rapidité, elle est devenue la technique de base des enquêtes épidémiologiques). La méthode ELISA aide à éliminer les faux-négatifs et faux-positifs.
L’intradermoréaction (IDR) à la mélitine (filtrat de culture de Brucella) ou IDR de Burnet[38], n'est plus utilisée en France depuis les années 1990. Elle donnait autrefois une indication de brucellose chronique ancienne[24].
Diagnostic différentiel
[modifier | modifier le code]La phase de primo-invasion peut faire discuter une fièvre Q (mais atteinte pulmonaire préférentielle) ou une yersiniose (mais atteinte digestive préférentielle). Selon la présentation clinique, se discutent aussi une primo-infection à cytomégalovirus, une fièvre typhoïde.
Les phases subaiguës ou chroniques se discutent en fonction de la localisation : diagnostics d'une arthrite, d'une hépatite, d'une orchite, d'une méningite[29].
Traitement
[modifier | modifier le code]Les antibiotiques sont utilisés pour traiter la brucellose aiguë. La mise en place doit être rapide pour éviter une infection chronique. Comme Brucella est une bactérie aussi intracellulaire, il faut utiliser des antibiotiques à la fois actifs sur la bactérie, et dotés d'une bonne pénétration tissulaire et cellulaire.
Dans le cas d'une présentation avec foyers localisés chroniques ou suppurés, la ponction ou une chirurgie libératrice (évacuation des abcès) peuvent précéder l'antibiothérapie.
Les tétracyclines sont la base du traitement, souvent associées aux aminosides (actifs sur les bactéries circulantes, mais pas sur les intra-cellulaires). L’OMS recommande l'association rifampicine 600 mg/j et doxycycline 200 mg/j en bitherapie pour la forme septicémique. Les doses sont adaptées si le malade est une femme enceinte ou un jeune enfant, mais il n'y a pas de contre-indication.
La réalisation d'un antibiogramme n'est pas indispensable en raison d'un risque de contamination pour le personnel de laboratoire, nécessitant un niveau 3 de biosécurité ; et du fait que les souches de brucella sont très sensibles aux antibiotiques préconisés, à l'exception de la souche vaccinale RB51, absente en Europe, ce vaccin vivant vétérinaire utilisé aux États-Unis a causé des infections humaines résistantes à la rifampicine[29].
Le traitement dure environ 6 semaines pour la brucellose en phase septique. En phase focalisée, le traitement peut durer plusieurs mois car la majorité des bactéries sont alors intracellulaires et donc plus difficiles d’accès aux molécules. Enfin, pour la brucellose chronique, l’antibiothérapie est inutile car la bactérie est devenue inaccessible. Un traitement symptomatique de l’asthénie, des douleurs et éventuellement une exérèse des foyers infectieux.
La mise en place précoce du traitement antibiotique permet de faire disparaître rapidement la fièvre ondulante de la phase aiguë et aussi de diminuer la fréquence des atteintes viscérales et ostéo-articulaires. Il existe cependant 3 à 4 % de rechutes après traitement.
Prévention
[modifier | modifier le code]Animale
[modifier | modifier le code]Il existe en France une réglementation consistant en une surveillance régulière des troupeaux de bovins, ovins et caprins par dépistages sérologiques réguliers. Les animaux séropositifs sont abattus et en cas de troupeau très infecté, le directeur des services vétérinaires départementaux peut décider de l’abattage de la totalité du cheptel. La vaccination des animaux contre la brucellose est interdite en France car elle fausse le dépistage par sérodiagnostic (ce sont les anticorps vaccinaux qui sont décelés)[39]. Enfin, seule l’importation d’animaux issus de troupeaux reconnus indemnes est autorisée.
Dans le monde, il existe plusieurs vaccins vivants atténués dirigés contre B. abortus, ou contre B. melitensis, et qui sont utilisés, selon la situation, dans des pays d'endémie[40]. Ces vaccins vétérinaires ont un intérêt économique (réduction des avortements des troupeaux) mais ils ne sont guère immunisants. Ils ne permettent pas de réduire la maladie vétérinaire, et ils peuvent infecter l'homme[41].
Humaine
[modifier | modifier le code]Chez les humains, la prévention la plus importante est la pasteurisation du lait. Les autres mesures sont basées sur des règles d’hygiène et de sécurité :
- Port de gants et de masque pour les professionnels en contact avec des produits biologiques potentiellement infectés.
- Lavage des mains.
- Hygiène des étables.
- Hygiène des produits laitiers. Consommation de produits laitiers pasteurisés.
- Éviter la consommation de crudités en région endémique.
Le premier vaccin humain contre la brucellose, à partir de germes entiers tués, a été testé en 1906, à Malte, sur 51 soldats anglais[41]. Mais ce type de vaccin, avec d'autres du même genre, s'est avéré peu efficace. En 1931, Jos Jullien propose un vaccin non spécifique, la « Paronduline »[42].
Le premier vaccin homologué en France, celui de Jacques Roux[43], l'a été en 1985, il s'agissait d'un vaccin « sous-unité » (fait à partir d'une fraction antigénique de Brucella) paraissant prometteur, réservé aux professionnels à haut risque ; mais là aussi, l'efficacité n'a pas été confirmée (durée d'immunité de 18 mois environ)[25]. Ce vaccin a été abandonné en 1992[44], notamment à cause de la diminution considérable du risque humain par la réglementation animale et l'hygiène individuelle des professionnels exposés[29].
La déclaration des cas humains de brucellose, obligatoire en France et au Québec, permet d’apprécier l’impact des programmes de contrôle de la brucellose animale[22], l'épidémiologie humaine étant conditionnée par l'épidémiologie animale[25].
Notes et références
[modifier | modifier le code]- Alexandre Manuila, Dictionnaire français de médecine et de biologie, t. premier, Masson, , p. 442.
- Garnier Delamare, Dictionnaire illustré des termes de médecine, Paris, Maloine, , 1094 p. (ISBN 978-2-224-03434-4), p. 139.
- Noah C. Hull et Brant A. Schumaker, « Comparisons of brucellosis between human and veterinary medicine », Infection Ecology & Epidemiology, vol. 8, no 1, (ISSN 2000-8686, PMID 30083304, PMCID PMCPMC6063340, DOI 10.1080/20008686.2018.1500846, lire en ligne, consulté le ).

- François Blanc et Yvette Nosny, « Histoire », La Revue de Médecine, no 17, , p. 1015-1017.

- (en) Lise Wilkinson, « Brucellosis », dans Kiple, Kenneth F. (ed.), The Cambridge World History of Human Disease, Cambridge University Press, (ISBN 9780521332866 et 9781139053518, lire en ligne), p. 625-628.

- « Notice nécrologique University of California », sur texts.cdlib.org (consulté le )
- (en) « Traum Disease », sur ideals.illinois.edu,
- Jean-Noël Biraben, « Les maladies en Europe : équilibre et ruptures de la pathocénose », dans Mirko D. Grmek (dir.), Histoire de la pensée médicale en Occident, vol.1 « Antiquité et Moyen Âge », Seuil, 1995, (ISBN 2-02-022138-1), p. 285-286.
- Jean-Noël Biraben 1995, op. cit., p. 287.
- (en) Arthur C. Aufderheide, The Cambridge Encyclopedia of Human Paleopathology, Cambridge, Cambridge University Press, , 478 p. (ISBN 0-521-55203-6), p. 192-193.
- Gérard Aboudharam, « Sources of Materials for Paleomicrobiology », dans Michel Drancourt (dir.)et Didier Raoult (dir.), Paleomicrobiology of Humans, ASM press, 2016 (ISBN 978-1-55581-916-3), p. 43-44 et 49.
- Catherine Virlouvet (dir.), Nicolas Tran et Patrice Faure, Rome, cité universelle : De César à Caracalla 70 av J.-C.-212 apr. J.-C, Paris, Éditions Belin, coll. « Mondes anciens », , 880 p. (ISBN 978-2-7011-6496-0, présentation en ligne), chap. 9 (« Vivre dans l'empire des Césars »), p. 557.
- Matthew E. Smith et Mahmoud Shorman, « Brucellosis », dans StatPearls, StatPearls Publishing, (PMID 28722861, lire en ligne)
- Marston, Jeffery Allen, « Report on fever (Malta) », Army Medical Department Statistical Report, no 3, , p. 486-521.
- « Marston Jeffery Allen », sur www.maltaramc.com (consulté le )
- « Note on the discovery of a micro-organisme in Malta fever, par David Bruce. », sur www.biusante.parisdescartes.fr (consulté le )
- Garnier Delamare, Dictionnaire illustré des termes de médecine, Paris, Maloine, , 1094 p. (ISBN 978-2-224-03434-4), p. 593.
- Laurent Jullien, Le médecin ardéchois Jos Jullien (1877-1956), un savant à la carrière hors norme, Revue d’Histoire de la Pharmacie, n°403, p. 381-398, septembre 2019.
- J. Jullien, « Brucelloses et tuberculoses », Paris Médical, La Semaine du Clinicien, no 38, , p. 221-229 (lire en ligne)
- M. Lisbonne et M. Janbon, « Brucellose » (fascicule 8037 A), Encyclopédie médico-chirurgicale, maladies infectieuses, , p. 1-3.
- Jacques Voelckel et Jean-Claude Doury, « Epidémiologie », La Revue de Médecine, no 17, , p. 1021-1024.
- P. Rufat, « La Brucellose en France en 1988 et 1989 », Bulletin Epidémiologique Hebdomadaire, no 36, , p. 155-156. (lire en ligne)
- A. Heurtier-Hartemann, « La Brucellose en France en 1986 et 1987 », Bulletin Epidémiologique Hebdomadaire, no 41, , p. 161-163. (lire en ligne)
- F. Janbon, « Brucellose », Le Concours Médical, vol. 117, no 21, , p. 1644-1647.
- C. Vandekerckhove, « La brucellose, données épidémiologiques et thérapeutiques récentes », La Revue du Praticien - médecine générale, vol. 7, no 204, , p. 47-52.
- Réseau national de Santé Publique, Bulletin épidémiologique annuel, maladies infectieuses en France, 1997, INVS, (ISBN 2-11-091077-1), p. 101-103.
- « Claroline Connect - Université Lyon1 », sur univ-lyon1.fr (consulté le ).
- (en) Sascha Al Dahouk, Stephan Köhler, Alessandra Occhialini et María Pilar Jiménez de Bagüés, « Brucella spp. of amphibians comprise genomically diverse motile strains competent for replication in macrophages and survival in mammalian hosts », Scientific Reports, vol. 7, no 1, , p. 1–17 (ISSN 2045-2322, DOI 10.1038/srep44420, lire en ligne, consulté le )
- E. Pilly, Maladies Infectieuses et Tropicales, Paris, Alinéa Plus, , 720 p. (ISBN 978-2-916641-66-9), chap. 67 (« Brucellose, par A. Sotto »), p. 342-344.

- (en) Jacques Godfroid, « From the discovery of the Malta fever's agent to the discovery of a marine mammal reservoir », Veterinay Research, vol. 36, no 3, , p. 313-326 (lire en ligne)
- « Arrêté du 18 juillet 1994 fixant la liste des agents biologiques pathogènes », sur Legifrance, (consulté le )
- (en) « Brucellosis Reference Guide », sur cdc.gov, , p. 2.
- « Liste et classification des agents de bioterrorisme potentiels », sur Centres pour le contrôle et la prévention des maladies (consulté le )
- (en-US) P. Yagupsky and E. Baron, « Laboratory Exposures to Brucellae and Implications for Bioterrorism », Emerging Infectious Diseases journal, vol. 11, no 8, , p. 1180-1185. (DOI 10.3201/eid1108.041197, lire en ligne, consulté le )
- « Données épidémiologiques 2001 Brucellose », sur invs.santepubliquefrance.fr (consulté le )
- « Brucellose - Données épidémiologiques 2017 / Données épidémiologiques / Brucellose / Zoonoses / Maladies infectieuses / Dossiers thématiques / Accueil », sur invs.santepubliquefrance.fr (consulté le )
- lab cerba, « Brucellose » [PDF], sur www.lab-cerba.com,
- Étienne Burnet (1873-1960) médecin français, à ne pas confondre avec le médecin australien Frank Burnet (1899-1985) prix Nobel 1960. Voir « Etienne Burnet et la brucellose ».
- « Maladies animales : la brucellose | Alim'agri », sur agriculture.gouv.fr (consulté le )
- « Brucellose: OIE - World Organisation for Animal Health », sur oie.int (consulté le )
- Eric Daniel Avila-Calderón, Ahidé Lopez-Merino, Nammalwar Sriranganathan et Stephen M. Boyle, « A History of the Development of Brucella Vaccines », BioMed Research International, vol. 2013, (ISSN 2314-6133, PMID 23862154, PMCID PMCPMC3686056, DOI 10.1155/2013/743509, lire en ligne, consulté le )
- Jos Jullien, « Essai de traitement de la mélitococcie humaine par vaccinothérapie non spécifique. Premiers résultats favorables obtenus (avec projection) », Deuxième congrès international de pathologie comparée, Masson et cie, 1931, vol. 2, n°2, p.298-300.
- « Jacques Roux, ancien directeur général de la santé », Le Monde.fr, (lire en ligne, consulté le )
- S. Tchakamian, « La Brucellose en France de 1990 à 1994 », Bulletin épidémiologique hebdomadaire, , p. 147. (lire en ligne)

