Glucose
| Glucose | |
  β-D-Glucopyranose : représentations hexagonale et 3D.   α-D-Glucopyranose et β-D-glucopyranose.   Projection de Fischer et projection de Haworth. |
|
| Identification | |
|---|---|
| Nom UICPA | D-glucose et β-D-glucopyranose |
| Synonymes |
(2R,3S,4R,5R)-2,3,4,5,6-pentahydroxyhexanal et forme cyclique : (2R,3R,4S,5S,6R)-6-(hydroxyméthyl)oxane-2,3,4,5-tétrol |
| No CAS | (DL-Glucose) (D(+)-Glucose) |
| No CE | 200-075-1 (D-Glc) 213-068-3 (L-Glc) 218-914-5 (D-Glc) |
| No RTECS | LZ6600000 |
| Code ATC | V04 |
| PubChem | 107526 (D-Glc) 5793 (α/β-D-Glcp) 79025 (α-D-Glcp) |
| SMILES | |
| InChI | |
| Apparence | poudre blanche au goût sucré[1] |
| Propriétés chimiques | |
| Formule | C6H12O6 [Isomères] |
| Masse molaire[2] | 180,155 9 ± 0,007 4 g/mol C 40 %, H 6,71 %, O 53,29 %, |
| Propriétés physiques | |
| T° fusion | 146 °C (α,D), 150 °C (β,D)[réf. souhaitée] |
| Solubilité | Dans l'eau : 900 g L−1[3] |
| Masse volumique | 1,544 g mL−1 (25 °C)[4] |
| Thermochimie | |
| ΔfH0solide | −1 273,3 kJ/mol[réf. souhaitée] |
| Précautions | |
| SIMDUT[5] | |
Produit non contrôlé |
|
| Inhalation | Toux. |
| Yeux | Rougeur. |
| Écotoxicologie | |
| LogP | −3,3[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Les glucoses sont des sucres de formule brute C6H12O6. Le mot « glucose » provient du grec ancien τὸ γλεῦκος / gleukos qui désignait les vins doux ou liquoreux, voire le moût. Le suffixe -ose est un classificateur chimique précisant qu'il s'agit d'un glucide. Comme il ne peut être hydrolysé en glucides plus simples, il s'agit d'un ose, ou monosaccharide. La présence d'un groupe carbonyle de fonction aldéhyde dans sa forme linéaire en fait un aldose tandis que ses six atomes de carbone en font un hexose ; il s'agit par conséquent d'un aldohexose.
L'isomère D, également appelé « dextrose », est très répandu dans le milieu naturel, tandis que l'isomère L y est très rare. L-Glucose et D-glucose sont deux des seize stéréoisomères d'aldohexoses. Le D-glucose est notamment synthétisé par de nombreux organismes à partir d'eau et de dioxyde de carbone en présence d'énergie lumineuse grâce à la photosynthèse. À l'inverse, la dégradation du D-glucose, qui libère du dioxyde de carbone et de l'eau au cours de la respiration cellulaire, est une source d'énergie très importante pour les cellules vivantes.
Le D-glucose est stocké chez les plantes sous forme d'amidon et, chez les animaux, sous forme de glycogène, qui peuvent être hydrolysés à tout moment pour redonner des molécules de D-glucose prêtes à être dégradées en fournissant de l'énergie dès que la cellule en a besoin. Il joue également un rôle structurel sous forme de cellulose chez les plantes. Le D-glucose circule à travers l'organisme dans le sang, et la concentration en D-glucose dans le plasma sanguin s'appelle la glycémie.
Histoire et étymologie[modifier | modifier le code]
Le D-glucose a été isolé en 1747 à partir du raisin par le chimiste allemand Andreas Marggraf. En 1812, Constantin Kirchhoff parvient à transformer l'amidon en sucre (en sirop de maïs), par chauffage avec de l'acide sulfurique[6]. En 1838, un comité de l'Académie des sciences, composé des chimistes et physiciens français Thénard, Gay-Lussac, Biot et Dumas, décide d'appeler le sucre se trouvant dans le raisin, dans l'amidon et dans le miel du nom de « glucose », en fournissant comme étymologie le grec τὸ γλεῦκος / gleukos, vin doux[7]. Émile Littré ayant donné une autre étymologie, l'adjectif γλυκύς / glukus (« de saveur douce »), la racine habituelle est devenue glyc- (l'upsilon grec donnant un y), comme dans glycémie et glycogène.
Le rôle important du D-glucose dans la biochimie de la plupart des êtres vivants a fait que la compréhension de sa structure et de sa formation dans les cellules s'est accompagnée de grandes avancées en chimie organique. On doit l'essentiel de ces résultats au chimiste allemand Emil Fischer, qui obtint le prix Nobel de chimie en 1902 « en reconnaissance des services extraordinaires qu'il a rendus par son travail sur la synthèse des sucres et des purines »[8]. La synthèse du D-glucose permit de comprendre la structure des substances organiques et constitua la première validation définitive des théories du chimiste néerlandais Jacobus Henricus van 't Hoff relatives à la cinétique chimique et à l'arrangement des liaisons chimiques dans les composés organiques. Fischer établit la configuration stéréochimique de tous les sucres au cours d'une période de 4 ans, entre les années 1891 et 1894, et prédit correctement tous les isomères possibles en appliquant les théories de van 't Hoff des atomes de carbone asymétriques.
Structure et nomenclature[modifier | modifier le code]
Les glucoses sont des aldoses dont les groupes hydroxyle –OH sont disposés selon une configuration déterminée le long d'une chaîne formée de six atomes de carbone. La molécule de ces hexoses peut adopter une configuration à chaîne ouverte ou cyclique.
Forme linéaire[modifier | modifier le code]
Dans sa configuration à chaîne ouverte, les molécules de glucose possèdent une chaîne carbonée linéaire constituée de six atomes de carbone, numérotés de C-1 à C-6 : l'atome de carbone C-1 est impliqué dans le groupe aldéhyde –CHO, et les atomes de carbone C-2 à C-6 portent chacun un groupe hydroxyle –OH. La présence d'un groupe aldéhyde fait des glucose des aldoses, tandis que la présence de six atomes de carbone en fait des hexoses : il s'agit d'aldohexoses. Comme tous les aldoses, les glucoses sont des oses réducteurs, sensibles à la réaction de Fehling.
Chaque atome de carbone de C-2 à C-5 est un centre stéréogène, c'est-à-dire que ces atomes de carbone sont liés chacun à quatre substituants différents. Par exemple, un aldohexose qui, dans la projection de Fischer, a ses hydroxyles en C-2, C-4 et C-5 à droite et son hydroxyle en C-3 à gauche est du D-glucose ; si la position relative de ses hydroxyles est, toujours dans la projection de Fischer, inversée par rapport à celle du D-glucose, alors il s'agit de L-glucose. Ces deux stéréoisomères sont par conséquent des énantiomères :
-
Projection de Fischer des deux énantiomères du glucose.
Le glucose est l'un des huit aldohexoses, les sept autres étant l'allose, l'altrose, le galactose, le gulose, l'idose, le mannose et le talose, chacun avec deux énantiomères D- et L- qui forment quatorze diastéréoisomères du glucose.
Formes cycliques[modifier | modifier le code]


en projection de Haworth.

En solution aqueuse, les molécules de glucose à chaîne ouverte sont en équilibre avec plusieurs formes cycliques de glucose, chacune comprenant un hétérocycle contenant un atome d'oxygène. En fait, moins de 0,25 % des molécules de glucose en solution aqueuse sont à chaîne ouverte, tandis que plus de 99 % d'entre elles sont sous forme pyranose ; la forme furanose du glucose est présente en quantité négligeable. Les termes glucose et D-glucose s'emploient également pour désigner ces formes cycliques. Ces dernières résultent de l'addition nucléophile entre le groupe aldéhyde –CHO du carbone C-1 et le groupe hydroxyle –OH du carbone C-4 ou C-5, ce qui donne un groupe hémiacétal –CHOH–O– : l'addition sur l'hydroxyle du carbone C-4 donne la forme furanose, avec un hétérocycle à cinq atomes, tandis que l'addition sur l'hydroxyle du carbone C-5 donne la forme pyranose, avec un hétérocycle à six atomes. En solution aqueuse, la presque totalité des molécules de glucose en configuration cyclique sont sous forme pyranose.
La fermeture du cycle fait de l'atome de carbone C-1 un centre stéréogène supplémentaire donnant deux anomères pour le D-glucopyranose et deux autres anomères pour le D-glucofuranose. Ces anomères sont distingués par les préfixes α- et β- selon que l'hydroxyle –OH en C-1 et l'hydroxyméthyle –CH2OH en C-5 sont respectivement en position trans (de part et d'autre) ou en position cis (du même côté) par rapport au cycle pyranose dans la projection de Haworth. Ainsi, le D-glucose linéaire peut donner quatre molécules cycliques différentes : l'α-D-glucopyranose, le β-D-glucopyranose, l'α-D-glucofuranose et le β-D-glucofuranose, qui sont toutes les quatre des molécules chirales.
Le L-glucose donne de la même façon quatre molécules cycliques différentes, chacune étant énantiomère d'une forme cyclique de D-glucose.
Les cycles pyranose et furanose, plans en projection de Haworth, sont en réalité tordus pour former une structure tridimensionnelle non plane. Le glucopyranose adopte ainsi tantôt une configuration dite chaise, tantôt une configuration dite bateau, tandis que le glucofuranose adopte une structure dite enveloppe à l'instar du cyclopentane. Il existe toute une série de configurations intermédiaires (les configurations « gauche », « demi-chaise » et « enveloppe » ont perdu leur CH2OH en position 5 pour un OH) :
-
(en) Exemples de configurations du β-D-glucopyranose. De gauche à droite et de haut en bas : chaise 4C1, bateau, gauche, chaise 1C4, demi-chaise et enveloppe.
Le glucopyranose prédomine en solution aqueuse, et est la seule forme de glucose observée à l'état solide. Il cristallise sous forme d'un solide incolore très soluble dans l'eau et l'acide acétique, mais peu soluble dans le méthanol et l'éthanol. L'α-glucopyranose fond à 146 °C tandis que le β-glucopyranose fond à 150 °C.
Conformères[modifier | modifier le code]
Chaque isomère du glucose possède différents conformères. Des rotations peuvent par exemple survenir autour de l'angle de torsion O6-C6-C5-O5, appelé angle ω, pour donner successivement trois conformations dites gauche-gauche (gg), gauche-trans (gt) et trans-gauche (tg). Le ratio de conformères gg:gt:tg pour l'α-D-glucopyranose est 57:38:5 à l'équilibre[9]. La propension de l'angle ω à préférer une configuration gauche est attribuée à l'effet gauche.
Propriétés physiques[modifier | modifier le code]

En biochimie, la connaissance précise des propriétés physiques et chimiques du glucose permet de bâtir des modèles informatiques décrivant les sites de liaison protéine–glucose[10].
Solutions[modifier | modifier le code]
Toutes les formes de glucose sont incolores et très solubles dans l'eau H2O, l'acide acétique CH3COOH et divers autres solvants. Elles sont en revanche faiblement solubles dans le méthanol CH3OH et l'éthanol CH3CH2OH.
La forme à chaîne ouverte est thermodynamiquement instable et s'isomérise spontanément pour donner une forme cyclique. À température ambiante, une solution contenant les quatre formes cycliques du glucose voit ces espèces s'interconvertir en quelques heures à la faveur d'un processus appelé « mutarotation ». Ce processus est bien plus lent à 0 °C. Quelles que soient les proportions initiales entre les différentes formes de glucose cyclique, le ratio des anomères α:β dans le mélange tend vers 36:64. Ce ratio α:β serait en fait plutôt de 11:89 en l'absence de l'effet anomérique.
La mutarotation consiste en l'ouverture temporaire du cycle pour donner la forme à chaîne ouverte, qui se referme aussitôt pour redonner une forme cyclique du glucose. En se reformant, le glucose peut exceptionnellement changer de forme cyclique entre pyranose et furanose, ou typiquement changer d'anomère entre α et β. Ainsi, bien que la forme à chaîne ouverte soit très peu observable en solution, elle joue un rôle fondamental dans l'établissement de l'équilibre entre tous les isomères du glucose en solution.
-
Mutarotation du glucose en solution entre anomères α et β.
Il existe essentiellement trois formes de glucose susceptibles d'être cristallisées à partir d'une solution aqueuse de glucose en fonction des conditions : l'α-glucopyranose, le β-glucopyranose et l'hydrate de β-glucopyranose[11].
Propriétés optiques[modifier | modifier le code]
| Tautomères du D-glucose | ||
|---|---|---|
| Forme linéaire | Projection de Haworth | |
 D-Glucose < 0,25 % |
 α-D-Glucofuranose Traces |
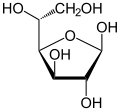 β-D-Glucofuranose Traces |
 α-D-Glucopyranose ~ 36 % |
 β-D-Glucopyranose ~ 64 % | |
Comme tous les oses, le glucose possède des atomes de carbone asymétriques. Ils sont au nombre de quatre : C-2, C-3, C-4 et C-5[12]. Ils lui confèrent un pouvoir rotatoire, de sorte que le glucose est dit optiquement actif, c'est-à-dire qu'il est capable de dévier le plan de polarisation d'une lumière polarisée incidente.
Le stéréoisomère naturel du glucose est le D-glucose (voir chiralité). Que ce soit en solution ou à l'état cristallisé, le D-glucose est dextrogyre, c'est-à-dire qu'il fait tourner le plan de polarisation dans le sens des aiguilles d'une montre. À l'inverse, le L-glucose est lévogyre, c'est-à-dire qu'il fait tourner le plan de polarisation dans le sens inverse de celui des aiguilles d'une montre. Les préfixes D- et L- sont ici sans rapport avec le sens dextrogyre ou lévogyre, qui résulte de l'effet combiné de tous les atomes de carbone asymétriques de la molécule : ces préfixes indiquent simplement la configuration de l'atome de carbone C-5, et certains D-aldohexoses sont lévogyres.
Les solutions pures d'α-D-glucopyrannose et de β-D-glucopyrannose en solution aqueuse à 20 °C ont un pouvoir rotatoire respectivement de 112,2° et de 18,7°. Toutefois, ces solutions ne sont pas stables et un équilibre tautomère se fait rapidement avec la composition suivante :
- ~ 36 % d'α-D-glucopyranose ;
- ~ 64 % de β-D-glucopyranose ;
- < 0,25 % de D-glucose linéaire.
Le pouvoir rotatoire vaut dès lors 52,7°. Ce dernier étant positif, le D-glucose est dextrogyre.
Propriétés chimiques[modifier | modifier le code]
Propriétés générales[modifier | modifier le code]
Les solutions concentrées de glucose (> 30 %) cristallisent spontanément à température ambiante. Le glucose sous forme cristallisée est vendu sous l'appellation dextrose pour éviter toute confusion avec les sirops de glucose et se trouve sous forme monohydratée. Les solutions de dextrose sont produites industriellement par hydrolyse totale d'empois d'amidon. L'hydrolyse est réalisée à chaud par des systèmes enzymatiques combinant α- et β-amylases.
En présence d'un acide dilué, le glucose ne réagit pas : il s'agit d'un ose, et il n'est donc pas hydrolysable. En milieu acide concentré et chaud, le glucose subit une déshydratation et une condensation avec l'α-naphtol (réaction de Molisch), ce qui le colore. Le glucose se cristallise.
L'ammoniaque NH4OH accélère la mutarotation.
En milieu alcalin dilué, par exemple en présence d'hydroxyde de sodium NaOH (soude), le glucose forme un ènediol, instable, qui produit :
- du fructose par isomérisation ;
- du mannose par épimérisation.
En milieu alcalin concentré, le glucose est oxydé. Ces réactions sont complexes et non stœchiométriques (dosage par la méthode de Bertrand).
Propriétés de la fonction aldéhyde[modifier | modifier le code]
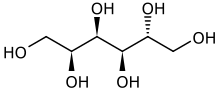

- La réduction du glucose donne du sorbitol.
- L'oxydation du glucose donne de l'acide gluconique.
Le glucose est un ose réducteur capable de réduire :
- des ions métalliques :
- l'ion mercure(II) (réaction de Baudoin-Lewin) : Hg2+ + glucose → Hg + produits d'oxydation ;
- l'ion fer(III) (réaction d'Hagedorn-Jensen) : Fe3+ + glucose → Fe2+ + produits d'oxydation ;
- l'ion argent (réaction de Tollens : glucose + 2 [Ag(NH3)2]+ + H2O → 2 Ag(s) ↓ + 4 NH3 + 2 H+ + acide gluconique) ;
- l'ion cuivre(II) (réaction de Fehling, réactif de Benedict, réaction de Barfoed) : Cu2+ + glucose → Cu2O + produits d'oxydation ;
- des composés organiques :
- le 3,5-dinitrosalicylate (composé jaune) est réduit en 3-amino-5-nitrosalicylate (composé rouge), ce qui permet le dosage du glucose et des autres glucides réducteurs.
La réaction de Fehling est utilisée dans la méthode de Bertrand. Le précipité d'oxyde de cuivre(II) est redissous puis dosé.
La réaction de Maillard est une réaction (liaison) des sucres réducteurs — dont le glucose — sur les acides aminés des protéines.
Propriétés de la fonction alcool primaire[modifier | modifier le code]
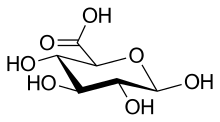
Cette fonction est portée par l'atome de carbone C-6, son oxydation donne de l'acide glucuronique si la fonction aldéhyde a été protégée en la combinant à autre chose.
L'acide nitrique HNO3 à chaud oxyde les deux fonctions terminales du glucose des atomes de carbone C-1 et C-6 et forme l'acide saccharique, un acide aldarique, c'est-à-dire un acide dicarboxylique dérivé d'un ose.
Méthodes de dosage[modifier | modifier le code]

Il existe plusieurs méthodes de dosage du glucose :
- polarimétrie. Le glucose ayant un pouvoir rotatoire, il peut être dosé par polarimétrie. Le pouvoir rotatoire d'une solution est proportionnel à la concentration en glucose. Cette méthode est utilisée en médecine : les diabétiques contrôlent leur glycémie par cette méthode ;
- réfractométrie. Cette méthode consiste à mesurer l'indice de réfraction d'une solution aqueuse sucrée à l'aide d'un réfractomètre, sachant que l'indice de la solution dépend de la concentration en sucre. Cette méthode est utilisée dans la fruiticulture et viticulture pour mesurer le taux de sucre des fruits ;
- dosage par la glucose oxydase. Cette méthode enzymatique utilise la glucose oxydase d'Aspergillus niger. Le glucose est oxydé par l'oxygène de l'air en δ-gluconolactone, puis en acide gluconique, avec production de peroxyde d'hydrogène H2O2. C'est en fait ce dernier qui est dosé par colorimétrie. En présence d'une peroxydase, le peroxyde oxyde un chromogène réduit dont l'absorbance est mesurée avec un spectrophotomètre. Le chromogène pourrait être du phénol et de la 4-aminophénazone oxydés en quinone-imine. Dans d'autres techniques, le peroxyde d'hydrogène est oxydé au niveau d'une électrode, le courant produit étant proportionnel à la concentration de glucose. Cette méthode est utilisée en biochimie médicale pour mesurer la glycémie du plasma sanguin.
Biochimie et rôles physiologiques[modifier | modifier le code]
Le glucose produit dans la biosphère provient essentiellement de la photosynthèse réalisée par les plantes, les algues et les bactéries photosynthétiques. Ce processus convertit l'eau H2O et le dioxyde de carbone CO2 en glucose sous l'effet de l'énergie lumineuse. Le glucose n'est généralement pas libre dans les cellules sous forme de monomères mais plutôt sous forme d'oligomères et de polymères, tels que le lactose (glucose–galactose) du lait de vache, le saccharose (glucose–fructose) de la canne à sucre et de la betterave sucrière, le raffinose (galactose–glucose–fructose) des légumes, ou encore l'amidon et la cellulose des plantes.
Lorsqu'ils sont absorbés par des animaux, des champignons et des bactéries, ces polymères sont hydrolysés pour en libérer le glucose par des enzymes. Chez l'humain, ce processus commence dès la mastication sous l'action de l'amylase contenue dans la salive.
Le glucose est métabolisé dans l'organisme en d'autres composés chimiques à l'origine de voies métaboliques variées. Il peut être phosphorylé en glucose-6-phosphate pour être dégradé par la glycolyse, voire oxydé en δ-gluconolactone. Il peut également être utilisé pour produire du tréhalose par des bactéries, ou encore pour produire du glycogène.
Le glucose est transporté à l'intérieur de la cellule entre compartiments cellulaires à travers des membranes à l'aide de plusieurs dizaines de protéines différentes appartenant essentiellement à la major facilitator superfamily de transporteurs membranaires.
-
-
Tréhalose.
Glc(α1↔α1)Glc
Glycosylation plutôt que glycation[modifier | modifier le code]
Le glucose est l'aldohexose le plus couramment utilisé par le métabolisme des êtres vivants. Ceci pourrait s'expliquer en partie par le fait qu'il a moins tendance que les autres aldohexoses à réagir spontanément avec les groupes amine des protéines[13]. Cette réaction, appelée « glycation », altère ou supprime les fonctions biologiques de nombreuses protéines. Le fait que le D-glucose soit moins sujet aux réactions de glycation spontanées que d'autres aldohexoses pourrait s'expliquer par des formes cycliques plus stables, ce qui réduirait la probabilité qu'il soit sous forme à chaîne ouverte, la plus réactive. Cette stabilité particulière lui vient du fait que tous ses groupes hydroxyle sont en position équatoriale, hormis celui de l'atome de carbone C-1 de l'anomère α. En revanche, l'addition de glucides aux protéines contrôlée par des enzymes, appelée « glycosylation », est un processus vital indispensable aux fonctions biologiques de nombreuses protéines.
Assimilation[modifier | modifier le code]
La plupart des glucides alimentaires consommés au XXIe siècle contiennent du glucose, que ce soit comme constituant unique, comme l'amidon ou le glycogène, ou avec d'autres oses, comme le saccharose ou le lactose.

Dans la lumière du duodénum et de l'intestin grêle, les oligosaccharides et polysaccharides de glucose sont hydrolysés en oses par des glycoside hydrolases pancréatiques. C'est notamment le cas du saccharose et du lactose. Les autres oligosaccharides et polysaccharides ne peuvent pas être complètement hydrolysés de cette façon et ne peuvent être assimilés sans l'assistance du microbiote intestinal. Le D-glucose ainsi libéré est transporté à travers la membrane apicale des entérocytes par le cotransporteur sodium-glucose 1 (SGLT1), puis à travers leur membrane basale par le transporteur de glucose GLUT2[14], il s'agit d'une assimilation essentiellement active[15]. Une partie du glucose est converti par les astrocytes en lactates, qui est ensuite utilisé comme source d'énergie par les cellules du cerveau. Une autre partie est utilisée par les cellules de l'intestin et les érythrocytes. Le reste atteint le foie, les tissus adipeux et les muscles, où il est absorbé et stocké sous forme de glycogène sous l'influence de l'insuline. Le glycogène des hépatocytes peut être à nouveau converti en glucose et repasser dans le sang lorsque le taux d'insuline est bas. Le glycogène des myocytes ne retourne pas dans le sang faute d'enzymes pour ce faire. Dans les adipocytes, le glucose est utilisé notamment pour produire des graisses. Le glycogène est un moyen de stockage du glucose efficace dans la mesure où cela le rend plus compact et moins réactif.
Métabolisme énergétique des cellules[modifier | modifier le code]
Le glucose est une molécule énergétique ubiquitaire en biochimie. Il est utilisé comme source d'énergie par la plupart des êtres vivants, des bactéries aux humains, au moyen de la respiration cellulaire. Chez l'humain et les mammifères, c'est une source d'énergie clé libérée par respiration aérobie à raison de 2 871 kJ/mol, soit environ 16 kJ/g. L'hydrolyse des glucides tels que l'amidon donne essentiellement du glucose. Celui-ci est alors entièrement oxydé en eau H2O et dioxyde de carbone CO2 à travers la glycolyse, la décarboxylation du pyruvate, le cycle de Krebs et la chaîne respiratoire ; l'énergie chimique du glucose libérée par ces réactions est récupérée sous forme d'ATP par l'ATP synthase.
Le glucose fournit presque toute l'énergie consommée par le cerveau, de sorte que sa disponibilité influence le psychisme : en cas de baisse du taux de glucose disponible pour le cerveau, les fonctions cérébrales qui requièrent un effort, comme le self-control ou la prise d'une décision difficile, sont altérées[16],[17],[18],[19].
Glycolyse[modifier | modifier le code]
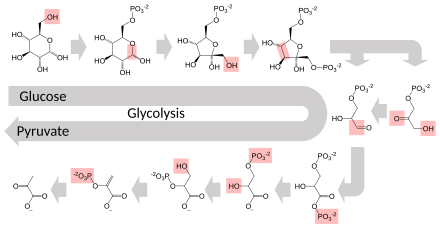
Le glucose peut être utilisé comme source d'énergie par les cellules aussi bien par respiration aérobie, respiration anaérobie et par fermentation. Tous ces processus commencent par une voie métabolique commune appelée « glycolyse ». La première étape de la glycolyse est la phosphorylation du glucose en glucose-6-phosphate par une hexokinase. Aux conditions physiologiques, cette réaction est irréversible. Elle a pour fonction première d'éviter que le glucose diffuse hors de la cellule car son groupe phosphate, électriquement chargé, l'empêche de franchir la membrane plasmique. Mais la phosphorylation du glucose a également pour effet de l'activer en vue des étapes de dégradation ultérieures par la glycolyse.
Par respiration anaérobie, chaque molécule de glucose permet à la cellule de produire deux molécules d'ATP, provenant toutes de la glycolyse. Par respiration aérobie, chaque molécule de glucose permet de produire jusqu'à 30 ou 32 molécules d'ATP selon les organismes.
Précurseur de biosynthèses[modifier | modifier le code]
Les êtres vivants utilisent le glucose comme précurseur de plusieurs substances importantes telles que l'amidon, la cellulose, la chitine et le glycogène : certains de ces polysaccharides (l'amidon chez les plantes, le glycogène chez les animaux) servent à emmagasiner de l'énergie, tandis que d'autres jouent un rôle structurel, comme la cellulose chez les plantes et la chitine chez un grand nombre d'êtres vivants, notamment de nombreux champignons et tous les arthropodes.
Certains oligosaccharides comprenant du glucose sont également d'importants réservoirs d'énergie. C'est par exemple le cas du lactose, qu'on trouve en abondance dans le lait de vache et qui est un diholoside glucose–galactose, et du saccharose, un diholoside glucose–fructose.
Du glucose est également lié à certaines protéines et certains lipides par un processus appelé « glycosylation ». Celle-ci est bien souvent essentielle à la fonction physiologique de ces protéines et lipides. Les enzymes qui lient le glucose à d'autres molécules le font généralement à partir de glucose phosphorylé afin d'utiliser l'énergie de la liaison glucose–phosphate pour créer la liaison glucose–molécule. Dans la nature, le glucose est souvent présent sous forme de composés où il est lié à d'autres molécules qui ne sont pas des sucres ; on appelle ces composés glucosides, qui font partie des hétérosides.
Le glucose peut également servir de précurseur à d'autres molécules à travers ses produits de dégradation. Il sert alors de source de carbone organique pour la biosynthèse des acides gras et celle de l'acide ascorbique (vitamine C), par exemple.
Glycémie et analyses médicales[modifier | modifier le code]

Le taux de glucose dans le plasma sanguin est une valeur couramment mesurée lors d'un bilan sanguin. Il est régulé par divers mécanismes physiologiques, notamment par l'insuline. La lecture du résultat dépend du fait d'être à jeun ou d'avoir mangé peu de temps avant une prise de sang a une influence sur le résultat ; une glycémie élevée observée à jeun peut être le signe d'un état pré-diabétique ou d'un diabète sucré. À l'inverse, une glycémie trop faible est appelée « hypoglycémie ».
Le diabète sucré est un trouble métabolique qui a pour effet de rendre l'organisme incapable de réguler convenablement sa glycémie en raison d'un manque d'insuline. Cette dernière est une hormone qui régule le taux de glucose dans le sang, permettant aux cellules de l'organisme d'absorber et d'utiliser le glucose. La glycémie peut également être mesurée à travers différentes méthodes, par exemple la glycémie à jeun (impaired fasting glucose en anglais) qui mesure le taux de glucose plasmatique après huit heures de jeûne, ou encore le test de tolérance au glucose (GTT) qui mesure la réaction de l'organisme après l'absorption de 75 g de glucose à la suite d'une période de jeûne à l'issue de laquelle la glycémie à jeun est mesurée.
Les techniques d'imagerie médicale permettent une appréciation de la topologie du métabolisme cellulaire en tirant parti du fait que le glucose est davantage consommé lorsque le métabolisme est actif. En tomographie par émission de positons, on utilise pour cela un composé dérivé du glucose, le fluorodésoxyglucose (18F), ou 18F-FDG qui, du point de vue structurel, est suffisamment proche du glucose pour être capté par les cellules mais inutilisable dans leur métabolisme. Ce composé étant radioactif, les rayonnements émis sont alors captés et, suivant leur répartition dans l'organisme, produisent une image d'hyperfixation dans les lieux de haut métabolisme tels que le cerveau, le cœur, ou encore les tumeurs.
Production industrielle[modifier | modifier le code]

Le glucose est produit industriellement par hydrolyse enzymatique de l'amidon, par exemple de maïs, de riz, de blé, de manioc, de son ou de sagou selon les régions du monde. On obtient de cette façon un « sirop de glucose » qui contient une proportion variable de glucose, le reste de la matière sèche étant composée de maltose, et de chaines comptant quelques molécules de glucose. Si l'hydrolyse est poussée, le sirop de glucose contient essentiellement du glucose (ou dextrose) et peut être déshydraté. On peut également obtenir du glucose en hydrolysant une solution de saccharose, on obtient du sucre inverti, c'est-à-dire d'un mélange 1:1 de glucose et de fructose utilisé en confiserie. La cellulose pourrait théoriquement être utilisée pour produire du glucose par hydrolyse, mais ce procédé n'est pas encore commercialement viable[11].
Le glucose possède, selon les estimations, environ 75 % du pouvoir sucrant du saccharose.
Citation[modifier | modifier le code]
« C'est une belle structure en anneau, un hexagone presque régulier, qui est cependant soumis à des échanges et équilibres difficiles avec l'eau dans laquelle il est dissous […] Et si quelqu'un voulait vraiment demander : pourquoi un anneau et pourquoi soluble dans l'eau, eh bien, qu'il se tranquillise, ce sont là de ces questions, pas très nombreuses, auxquelles notre science est capable de répondre. » Primo Levi, Le système périodique, 1975.
Notes et références[modifier | modifier le code]
- DEXTROSE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Avantor is setting science in motion for a better world », sur VWR (consulté le ).
- (en) J. G. Speight et Norbert Adolph Lange, Lange's Handbook of Chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289.
- « Dextrose » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009.
- Kirchhoff (1811), Mémoires de l'Académie impériale des sciences de St. Pétersbourg, 4:27 :
« Mr. l'Adjoint Kirchhoff présenta à la Conférence trois flacons, contenans: 1°) du Sirop produit par l'art dans quelques végétaux (la pomme de terre, le froment et le blé noir ou Sarazin), 2°) du sucre obtenu de ce syrop par dessiccation, 3°) du sucre dégagé du syrop au moyen de l'eau. »
- Louis Jacques Thénard, Louis Joseph Gay-Lussac, Jean-Baptiste Biot et Jean-Baptiste Dumas, « Rapport sur un mémoire de M. Péligiot, intitulé : Recherches sur la nature et les propriétés chimiques des sucres », Comptes rendus hebdomadaires des séances de l'Académie des sciences, , p. 106-113 (lire en ligne) :
« Il résulte des comparaisons faites par M. Péligot, que le sucre de raisin, celui d'amidon, celui de diabètes et celui de miel ont parfaitement la même composition et les mêmes propriétés, et constituent un seul corps que nous proposons d'appeler Glucose (γλευϰος, moût, vin doux). »
— p. 109.
- (en) « Hermann Emil Fischer – The Nobel Prize in Chemistry 1902 » (consulté le ) : « in recognition of the extraordinary services he has rendered by his work on sugar and purine syntheses ».
- (en) Karl N. Kirschner et Robert J. Woods, « Solvent interactions determine carbohydrate conformation », Proceeding of the National Academy of Sciences of the United States, vol. 98, no 19, , p. 10541-10545 (PMID 11526221, PMCID 58501, DOI 10.1073/pnas.191362798, JSTOR 3056574, Bibcode 2001PNAS...9810541K, lire en ligne).
- (en) Houssam Nassif, Hassan Al-Ali, Sawsan Khuri et Walid Keirouz, « Prediction of protein-glucose binding sites using support vector machines », Proteins, vol. 77, no 1, , p. 121-132 (PMID 19415755, DOI 10.1002/prot.22424, lire en ligne).
- (en) Fred W. Schenck, « Glucose and Glucose-Containing Syrups », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a12_457.pub2, lire en ligne).
- (en) Peter M. Collins, Dictionary of carbohydrates, Boca Raton, CRC Press, , 1282 p. (ISBN 0-8493-3829-8).
- (en) H. F. Bunn et P. J. Higgins, « Reaction of monosaccharides with proteins: possible evolutionary significance », Science, vol. 213, no 4504, , p. 222-224 (PMID 12192669, DOI 10.1126/science.12192669, Bibcode 1981Sci...213..222B, lire en ligne).
- (en) Ronaldo P. Ferraris, « Dietary and developmental regulation of intestinal sugar transport », Biochemical Journal, vol. 360, no 2, , p. 265-276 (PMID 11716754, PMCID 1222226, DOI 10.1042/bj3600265, lire en ligne).
- (en) George L. Kellett, « The facilitated component of intestinal glucose absorption », The Journal of Physiology, vol. 531, no 3, , p. 585-595 (PMID 11251042, PMCID 2278489, DOI 10.1111/j.1469-7793.2001.0585h.x, lire en ligne).
- (en) Stephen H. Fairclough et Kim Houston, « A metabolic measure of mental effort », Biological Psychology, vol. 66, no 2, , p. 177-190 (PMID 15041139, DOI 10.1016/j.biopsycho.2003.10.001, lire en ligne).
- (en) Matthew T. Gailliot, Roy F. Baumeister, C. Nathan DeWall, Jon K. Maner, Plant, E. Ashby ; Tice, Dianne M. ; Brewer, Lauren E. ; Schmeichel, Brandon J., « Self-control relies on glucose as a limited energy source: Willpower is more than a metaphor. », Journal of Personality and Social Psychology, vol. 92, no 2, , p. 325-336 (PMID 17279852, DOI 10.1037/0022-3514.92.2.325, lire en ligne).
- (en) Matthew T. Gailliot et Roy F. Baumeister, « The Physiology of Willpower: Linking Blood Glucose to Self-Control », Personality and Social Psychology Review, vol. 11, no 4, , p. 303-327 (PMID 18453466, DOI 10.1177/1088868307303030, lire en ligne).
- (en) E. J. Masicampo et Roy F. Baumeister, « Toward a Physiology of Dual-Process Reasoning and Judgment: Lemonade, Willpower, and Expensive Rule-Based Analysis », Psychological Science, vol. 19, no 3, , p. 255-260 (PMID 18315798, DOI 10.1111/j.1467-9280.2008.02077.x, lire en ligne).
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Fiches internationales de sécurité chimique : Dextrose (ICSC : 0865), sur training.itcilo.it
- (en) Compound: C00031 Database, sur genome.ad.jp