Pluie acide


L'expression « pluie acide » désigne toute forme de précipitations anormalement acides. On distingue les retombées humides (pluie, neige[1], brouillard, smog…) des retombées sèches (particules en suspension, gaz).
Cette expression a été utilisée pour la première fois par Robert Angus Smith en 1872[2] puis largement reprise dans les années 1960 à 1980 par les scientifiques qui ont alerté sur les effets délétères des combustibles fossiles pour l'environnement et la santé, via notamment une augmentation croissante des dépôts acides secs et surtout humides, provenant alors essentiellement des oxydes de soufre et d'azote, source d'anions essentiellement d'origine anthropique (SO2–
4 et NO–
3)[3]. L'expression « pluie acide » est parfois employée dans le langage courant pour désigner un ensemble plus vaste de phénomènes, les « dépôts acides » : ceux-ci incluent les précipitations acides (pluies et condensation), mais y ajoutent des poussières ou fumées ayant une action acidifiante sur leur environnement[4],[5],[6].
« Les pluies acides ont un pH d'environ 4,2 à 4,8, c'est-à-dire plus de dix fois plus acide (5,5 à 5,7) que le pH de l'eau de pluie dite pure » naturellement acide, notamment en raison du dioxyde de carbone de l'air[7] (lui-même en augmentation régulière). Ces pluies acides sont l'une des « marques » de l'anthropocène[8]. ont des effets délétères sur la flore, la faune (dont l'Humain) et les écosystèmes, à l'échelle de biomes entiers parfois, ainsi que sur le patrimoine bâti.
L'acidification des eaux météoriques contribue aussi à l'acidification des eaux de certaines sources, des eaux de ruissellement et des eaux de surface, ainsi qu'à l'acidification des océans. Les eaux acidifiées libèrent et dissolvent mieux certains produits toxiques (métaux lourds et métalloïdes notamment) qui sont alors plus mobiles et bioassimilables (ce qui peut notamment augmenter les risques de saturnisme quand elles circulent dans des tuyaux de plomb ou des réseaux de distribution contenant des soudures au plomb, dans les Vosges, par exemple, zone par ailleurs considérée comme écologiquement vulnérable à l'acidification, et qui a particulièrement souffert des pluies acides quand le fuel n'était pas encore désoufré[9] à l'acidification en France).
Origines
[modifier | modifier le code]Les pluies sont naturellement très légèrement acides.
Dans la nature, une forte acidification des pluies peut ponctuellement et momentanément être naturellement induite par des éruptions volcaniques (on en retrouve des preuves dans les carottes glaciaires)[10],[11]. Ces dernières contiennent les traces de retombées anciennes et parfois massives d'acides sulfurique, fluorhydrique d'origine volcanique. Ce fut le cas par exemple lors des éruptions islandaises du Laki et du Tambora où les quantités totales d'acide sulfurique déposées ont été respectivement évaluées à 281 et 222 × 106 tonnes. Ce sont des retombées acides parmi plus importantes enregistrées dans l'enregistrement continu d'acidité de Dye 3 (soit depuis environ 10 000 ans, et avec des indices retrouvés jusque dans les carottes de glace prélevées dans l'autre hémisphère, en Antarctique)[12].
Mais l'acidification contemporaine des pluies a une origine presque exclusivement anthropique. La pluie lessive en effet l'atmosphère au-dessus des villes, des zones rurales ou des zones industrielles, des zones de fort trafic routier, fluvial et maritime ou aérien, où elle se chargent notamment de gaz susceptibles de se dissoudre dans l'eau en formant des espèces acides. Des particules acides, soufrées notamment peuvent même être des noyaux de nucléation pour les gouttes de pluie.
Typologies chimiques et leurs évolutions
[modifier | modifier le code]Les ions acides les plus souvent retrouvés dans les pluies, et plus encore dans les brouillards souvent[13], ont comme origines principales :
- oxydes de soufre (SO2 et SO3), émis par les volcans, mais surtout par l'industrie pétrolière, l'industrie lourde et les transports, maritimes notamment. Ce type de pluies acides, très nocives pour les arbres et les lichens, est en diminution là où l'on utilise du fuel et des carburants désoufrés ;
- oxydes d'azote (NO et NO2).
Ces polluants réagissent dans l'atmosphère avec le dioxygène et l'eau pour former respectivement de l'acide sulfureux H2SO3 et de l'acide nitrique HNO3. Ce type de pluies acides est en augmentation et se substituent aux pluies acidifiées par les composés soufrés.
D'autres acides, plus ou moins présents et combinés, peuvent intervenir, souvent dans une moindre mesure, ou en étant très présent, mais sur des zones plutôt localisées (sous le vent de certaines industries et/ou de forte circulation) :
- acide chlorhydrique (issu de la combustion de combustibles fossiles et autres produits chlorés, par l'industrie et l'incinération de déchets) ;
- acide fluorhydrique et hydrofluorique (HF), ou le bifluorure d'ammonium perdu dans l'air par les fonderies d'aluminium (qui utilisent cet acide pour extraire l'aluminium de la bauxite lors de l'électrolyse de l'aluminium qui se fait en présence de fondants fluorés ; « selon leur importance, les usines d'aluminium peuvent évacuer dans l'atmosphère entre 10 et 1 000 kg de fluor par jour, soit sous forme gazeuse, soit sous forme particulaire »)[14]. L'acide fluorhydrique peut aussi provenir d'éruptions volcaniques (ex. : éruption du volcan Laki en Islande, cause de brouillards et pluies très acides (avec de dépôts de fluorures toxiques), durant 8 mois d'émissions continues de gaz sulfurique et fluorhydrique entre 1783 et 1784, qui ont « décimé la population humaine et animale »[15],[16]), ou être anthropique, avec par exemple les industries de l'acier et du traitement de surface qui l'utilisent pour décaper l'acier avant le traitement ultérieur) ; par l'industrie des semi-conducteurs (qui l'utilise pour graver les circuits dans le silicium), par les briquetteries, tuileries et fabricants de céramiques et de produits réfractaires (certaines argiles sont riches en fluor, perdu dans l'air lors de la cuisson de l'argile[14], s'il n'y a pas de traitement adéquat des fumées)[17], par les producteurs de phosphates bruts (lors de la préparation des engrais super-phosphatés)[14] ; par la combustion de certains charbons (contenant de 80 à 300 ppm de fluor), ou encore par les grandes verreries ou cristalleries industrielles qui utilisent l'acide fluorhydrique pour graver, décorer ou opacifier le verre). Des pesticides organofluorés, pour certains très solubles dans l'eau existent aussi (ex. : dichlofluanide, à base d'acide phénoxypropionique, et bien d'autres insecticides, acaricides, rodenticides et herbicides fluorés)[14].
- ammonium ;
- acide formique, issu de réactions chimiques et photochimiques impliquant la combustion du bois et la dégradation photochimique du formaldéhyde (qui peut lui-même se former par photo-oxydation de composés organiques volatil émis par la flore via des processus révélés par la revue Nature en 2021)[18] et qui est en partie transformé en méthanediol (CH2(OH)2) qui réagit photochimiquement avec les radicaux OH pour former de l'acide formique dans la pluie[7] ;
- acide acétique (utilisé dans la fabrication du verre[réf. nécessaire] et émis lors de la fermentation du vinaigre) ;
- acide bromhydrique (HBr) issus des échappements de véhicules et de certaines industries ;
- acide carbonique, issu du CO2 émis, de manière croissante par les activités humaines, et par les incendies de forêt (le plus souvent aussi d'origine humaine)
Depuis la fin du XXe siècle, dans le monde l'acidité de la pluie a globalement beaucoup diminué, grâce à l'obligation de désulfuration de la plupart des fuels et des fumées d'incinérateurs et de grandes industries (ex. : cimenteries). Mais il n'y a pas eu de retour à la normale, en raison de l'apparition d'un nouveau type de pluie dite mixte (associant un taux croissant d'acide nitrique qui compense en partie le taux décroissant d'acide sulfurique). En outre en chine, le taux de Ca2+ a dans le même temps diminué, alors que NH+
4 a légèrement augmenté (à la suite de la croissance des transports utilisant des carburants fossiles), et une étude récente a montré que la quantité de ces deux neutralisateurs (Ca2+ et NH+
4 sont des ions basiques) a diminué du nord au sud du pays[19],[20].
Acidité de l'eau de pluie
[modifier | modifier le code]Pour rappel, l'acidité d'une solution aqueuse est mesurée par son potentiel hydrogène (pH) :
- une solution de pH < 7 est dite acide ; plus le pH d'une solution est faible, plus elle est acide ;
- une solution de pH = 7 est dite neutre ;
- une solution de pH > 7 est dite basique, ou alcaline ; plus le pH d'une solution est élevé, plus elle est basique.
Pour rappel l'échelle de pH est une logarithmique. Ceci signifie que lorsque le pH diminue d'une unité (dans le domaine acide), l'acidité de la solution est multipliée par 10. Autrement dit : une solution de pH = 3 a une concentration en ions H+ 10 fois supérieure à une solution de pH = 4 et 100 fois supérieure à une solution de pH = 5. Ainsi, une solution de pH = 3 est 10 fois plus acide qu'une solution de pH = 4 ; 100 fois plus acide qu'une solution de pH = 5 ; et 1 000 fois plus acide qu'une solution de pH = 6.
- En conditions « normales », le pH de l'eau de pluie se situe autour de 5,6[21] : elle est donc naturellement légèrement acide, en raison essentiellement de la solvatation du dioxyde de carbone atmosphérique, qui forme de l'acide carbonique H2CO3 selon la réaction :
- CO2(aq) + H2O(l) H2CO3(aq)
- On parle généralement de pluie acide lorsque le pH de l'eau est inférieur à 4,5 ou 5.
Au XXe siècle, des études ont documenté des plus extrêmement acides et corrosives ; avec par exemple, des pluies dont le pH descendait à 4,5 en Italie (Pirretti, G., Agenzia Prevenzione Ambiente Energia Emilia-Romagna, cité par Nature), à 4,3 dans le New Hampshire aux États-Unis, étudiées par Buso et al. en 2000[22],[8]. En 2000, on a mesuré une pluie aux États-Unis dont le pH était de 4,33[23].
Comme le rapelle R.E Rothchild, nombre de ces polluants deviennent puissamment corrosifs s'ils sont mélangés entre eux (par exemple pour le mélange « sulfonitrique ») ou avec d'autres produits chimiques atmosphériques[24]. Très localement, dans certaines zones industrielles (dans une verreries par exemple), les dépôts de vapeur d'acide fluorhydrique (secs et humides) peuvent attaquer le verre, y compris celui d'isolateurs de lignes électriques[réf. souhaitée].
Origine des polluants acidifiants
[modifier | modifier le code]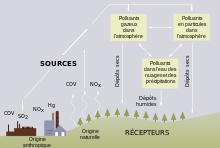

L'acidification peut être due à des émissions locales de polluants, mais aussi à des polluants transportés sur des centaines, voire des milliers de kilomètres. L'acidité de ces retombées a deux origines principales :
- des sources naturelles ou semi-naturelles : émissions volcaniques soufrées, oxydes d'azote produits par la foudre, gaz issus de certaines formes de décomposition biologique terrestres, ou émis par les océans, feux de forêts, etc. ;
- des sources anthropiques, dont l'industrie, les centrales électriques thermiques, le chauffage et les transports[25],[26].
Les pluies acides résultent essentiellement de la pollution de l'air par le dioxyde de soufre (SO2) produit par l'usage de combustibles fossiles riches en soufre, ainsi que des oxydes d'azote (NOx) qui se forment lors de toute combustion de l'atmosphère, produisant de l'acide nitrique.
En ce qui concerne l'action humaine sur l'environnement, les usines, le chauffage et la circulation routière sont les principales sources. L'acide chlorhydrique issu de l'incinération de certains déchets plastiques, et l'ammoniac généré par les activités agricoles contribuent également aux pluies acides[27].
Le composé azoté responsable de l'acidification des pluies est l'oxyde d'azote issu des combustions d'énergie fossile (charbon, pétrole et gaz) ou plus rarement de biomasse. Dans les sols, l'ammoniac est métabolisé par les bactéries du cycle de l'azote, ce qui le convertit en nitrite puis nitrate, qui forme le couple H+NO3− et contribue donc à acidifier le sol[28], mais n'est pas émis dans l'atmosphère.
D'autres produits, dont par exemple le dioxyde de carbone (CO2) (qui produit de l'acide carbonique lorsqu'il se dissout dans l'eau) et les acides fluorhydriques, sont en cause, mais dans une moindre mesure[réf. nécessaire].
Répartition géographique et tendances récentes
[modifier | modifier le code]Les pays industriels ont été les premiers touchés, et dans certains pays, le phénomène d'acidification induit par l'exploitation massive du charbon puis du pétrole, il y a plus d'un siècle se poursuit, plus ou moins selon la nature du sol, et le contexte environnemental, comme le montrent par exemple les analyses récentes faites à partir des cernes des arbres (dendrologie), en Suisse pour la période 1910-2017[29] ; les principales zones de production de polluants ont d'abord été les régions minières et industrielles de l'hémisphère nord, dont la Ruhr, la Lombardie, les anciens pays miniers français et anglais et ceux des États-Unis puis de la Chine.
Portés par les vents (dominants ou non), les acides circulent dans l'atmosphère et peuvent retomber loin de leurs sources ; ainsi, une bonne partie des pluies acides de Scandinavie (où le pH de certains lac est descendu jusqu'à 1,8 au début des années 1970[30]. Les taux de sulfates y augmentaient proportionnellement à l'augmentation observée des dépôts acides, qui décimaient la faune des lacs et de forêts dans ces années[30] résultaient de la retombée de polluants accumulés par les masses d'air venant de la mer et ayant survolé l'Angleterre, la France, la Belgique et l'Allemagne ou certains pays de l'est. En Europe, en 1995, les charges critiques pour l'acidification étaient dépassées sur 75 millions d'hectares de sols forestiers d'Europe, et l'acidification a localement contribué à exacerber l'érosion des sols touchant à cette époque environ 115 millions d'hectares, et entraînant une chute de la fertilité agricole et naturelle[31].
Dans le monde, si l'acidification par le soufre tend à nettement diminuer, l'acidification par l'azote augmente ; et tous les pays industrialisés sont touchés. Le risque d'acidification figure dans les guides de cartographie de la CEE-ONU relatifs la charge critique d'acidité, pour notamment produire des cartes et instruments d'évaluation globale des risques (CLRTAP, 2017). selon Fagerli et al. en 2020, le seuil de la charge critique d'acidification est encore dépassé dans une grande partie de l'Europe (où les dégâts forestiers, suivis avec attention[32], sont en augmentation, dont en France, exacerbés par la pollution à l'ozone, l'eutrophisation, le réchauffement climatique et l'introduction d'espèces invasives).
En Europe
[modifier | modifier le code]Dans l'UE, grâce à l'usage de fuels et gaz mieux désoufrés, et « grâce » aux délocalisations d'industries lourdes polluantes, les retombées de soufre ont localement fortement diminué des années 1980 à 2000[33] , mais en 2000, « les dépôts acides restaient encore supérieurs aux seuils jugés critiques dans certaines parties d'Europe occidentale, mais le pourcentage de forêts affectées dans l'UE des 25 devrait décroître, passant de 23 % en 2000 à 13 % en 2020. L'ammoniaque devrait représenter la principale source d'acidification à l'avenir »[34].
En Chine
[modifier | modifier le code]Avec la poursuite des délocalisations industrielles et l'accroissement de l'utilisation de pétrole et charbon en Asie, le phénomène de pluies acide s'est déplacé vers l'Asie du Sud-Est et surtout en Chine (où les pluies acides sont encore dans les années 2020 un sujet très préoccupant)[35],[36], avec environ 30 % des sols du nord de l'est et du sud du pays touchés au début des années 2000[37],[38],[39],[40], et une propagation du phénomène d'acidification des pluies, vers 2003-2006, en direction du nord de la Chine (à Taiyuan et Beijing notamment, dans la province du Liaoning et dans la province du Jilin[41],[42],[43].

Les émissions d'oxydes d'azote et de dioxyde de soufre étaient vers 2005/2007 devenues 8 à 9 fois plus élevées en Chine que dans les pays développés[45]. Les pluies acides touchent également le Japon[46]. Les émissions de SO2 ont fortement augmenté à partir des années 1980, atteignant plus de 33 millions de tonnes en 2006 ![47],[48], pour ensuit décliner grâce à une généralisation de la désulfuration des gaz de centrales électriques[49],[47]. Mais le pays en émettaient encore 28 millions de tonnes en 2010[50], une quantité restant très préoccupante selon Kurokawa et al. (2013)[49]. Depuis 2021, la réduction catalytique sélective (SCR) appliquée aux centrales au charbon a aussi réduite les émissions de NOx depuis 2012, mais le pays continue à brûler beaucoup de charbon soufré[51].
La Chine est devenue le premier émetteur d'oxyde d'azote et de dioxyde de soufre du monde, ainsi que de CO2, mais en grande partie pour produire des biens consommés dans le reste du monde. À partir de 2010, ce pays a réduit ses émissions de dioxyde de soufre[19], mais selon le Bulletin annuel sur l'état de l'environnement de Chine, en 2020 la « zone des pluies acides » (là où plus de 10 % des pluies sont acides) couvre encore environ 530 000 km2, soit 5,5 % du pays. Et environ 0,6 % du pays (dans le sud-est et dans villes côtières principalement) est encore soumis à des « pluies fortement acides » (pH < 4,5)[20].
Conséquences des pluies acides
[modifier | modifier le code]L'acidification des précipitations a des conséquences (variant selon le type d'acide, sulfurique, nitrique, principalement) sur les champignons, les lichens et les végétaux (dont certains sont considérés comme bioindicateurs) et sur de nombreux animaux.
Elle entraîne également l'acidification des sols, de certaines eaux douces de surface[52] (lacs d'Europe du Nord par exemple) et l'acidification des océans.
L'acidité des lacs ou d'autres grandes masses d'eau empêche le développement normal des espèces et des végétaux qu'ils abritent et peut en modifier les équilibres écologiques et par suite les services écosystémiques fournis par les zones humides et les milieux aquatiques. La flore aquatique et riveraine est affaiblie, résiste moins bien aux maladies et aux hivers rigoureux. Les eaux et sols acidifiés libèrent plus facilement les métaux lourds ou métalloïdes contenus dans les sédiments et les sols des berges, qui peuvent alors contaminer l'écosystème et/ou affaiblir les arbres, voire les tuer dans les cas graves. La chaîne alimentaire est alors également touchée, et tous les animaux qui y participent ou en dépendent. Les oiseaux et mammifères aquatiques sont en particulier touchés.
Des traitements par épandage de produits calcaires sont faits pour éviter la mort écologique de milliers de grands lacs d'Europe du Nord. La part respective des acides naturels (acides organiques essentiellement) et des acides d'origine anthropique pourrait jouer un rôle[53] ; par exemple en Nouvelle-Zélande on trouve des eaux brunes très acides (souvent pH de 4) en raison de teneurs élevées en acides organiques, avec alors plus de 90 % de l'aluminium dissous lié à de la matière organique, alors que dans des milieux acidifiés par l'Homme dans l'Hémisphère nord (où l'aluminium est présent sous une forme plus bioassimilable et toxique[54],[55]), les poissons ont déjà disparu à un pH inférieur à 5[53]. Dans le Westland de Nouvelle-Zélande 9 des 14 espèces natives de poissons sont trouvés dans les eaux brunes et acides présentant un pH inférieur à 5, et 7 espèces sont encore trouvées à un pH inférieur à 4,5[53]. De même chez les invertébrés : 34 des 37 taxons d'insectes aquatiques les plus communs sont trouvés dans les cours d'eau du Westland à un pH < 5, pour 24 encore trouvés à un pH de moins de 4,5[53]. Les espèces du Westland sont clairement adaptées aux milieux acides et il est possible que de telles souches acidorésitantes se substituent discrètement à d'autres espèces dans les milieux récemment acidifiés par l'Homme[53].
Conséquences sur la flore
[modifier | modifier le code]
Les conséquences sur la flore sont nombreuses, et comprennent à la fois les conséquences directes de l'acidité du sol, mais aussi un appauvrissement du sol en raison d'un lessivage accru en milieu acide.
Certains champignons phytopathogènes comme Rhytisma acerinum peuvent être favorisés[56].
Une autre conséquence des pluies acides sur la flore est le dépérissement important des forêts boréales et tempérées. Les lésions apparaissent d'abord sur les conifères, dont les aiguilles, exposées toute l'année, jaunissent et tombent. L'arbre, conifère ou feuillu, subit une défoliation progressive, se dessèche et meurt sur pied.
Effets sur la faune
[modifier | modifier le code]Dans les années 1980, des biologistes scandinaves montre que Les poissons, et notamment les salmonidés (saumon, omble chevalier, truites…), le gardon, le vairon ont une reproduction qui est affectée dès que le pH passe sous 5,5 (la perche et le brochet) se montrant un peu plus résistants)[30]. Les salmonidés sont particulièrement affectés par l'acidification des cours d'eau et ses effets sur la toxicité des métaux, y compris de l'aluminium environnemental[57],[58],[59],[60],[61],[62].
De nombreux effets (directs et souvent indirects ; immédiats et surtout différés) sur la faune sont démontrés, y compris chez des espèces réputées extrêmement résistantes comme les tardigrades[63].
Parmi le phytoplancton d'eau douce, presque toutes les espèces de diatomées et et d'algues vertes disparaissent en dessous d'un pH de 5,8 ; et dans le zooplancton, la plupart des espèces de daphnies disparaisse dès 6,0[30]. Certains lacs scandinaves étaient dans les années 1980-1990 devenus si acides, que tous les poissons et crustacés y avaient complètement disparu. Beaucoup ont fait l'objet de déversement de chaux pour tamponner leur pH[64]. De manière synergique avec d'autres pollutions (eutrophisation notamment) l'acidification des lacs et des cours d'eau peut fortement modifier la composition des populations de poissons et invertébrés[65].
Les effets peuvent être directs par attaque de la peau, des cuticules, muqueuses et organes respiratoires par les polluants acides de l'air, ou par contact externe ou interne avec l'eau polluée (comme on le voit dans le film Microcosmos : Le Peuple de l'herbe, de nombreux insectes boivent les gouttes de rosée). Des effets indirects, différés et en cascade sur les écosystèmes et le réseau trophique existent, évidents par exemple quand des populations entières d'arbres meurent.
Les chlorures, fluorures et métaux lourds peuvent mieux circuler et s'accumuler dans le sol ou le sédiment acidifié, à des niveaux toxiques pour les invertébrés. Les espèces sensibles ou plus vulnérables (filtreurs) aux métaux sont remplacées par celles qui sont plus tolérantes. Ainsi, les espèces aux corps mous telles que les vers de terre et les nématodes semblent être affectées plus facilement par les concentrations élevées en métaux (sauf les enchytraéidés qui y résistent mieux).
Par ailleurs, les invertébrés jouent un rôle important dans la décomposition des bois morts, feuilles mortes, cadavres animaux et excréments sur le sol des forêts. Or, quand que ces matériaux s'y accumulent sans être décomposés, la libération de leurs éléments minéraux est retardée, et la biodisponibilité des éléments nutritifs aux plantes et décomposeurs est réduite. Les herbivores sont finalement affectés quand la quantité ou la qualité de leur approvisionnement alimentaire diminue. Leurs prédateurs carnivores sont par suite également affectés.
En outre, bien que les oiseaux et les mammifères ne soient pas directement affectés par l'acidification de l'eau, ils le sont indirectement par des changements dans la qualité et la quantité de leurs ressources en nourriture. En Écosse, par exemple, les loutres sont plutôt rares autour des ruisseaux et des rivières acides parce que leurs approvisionnements principaux, les poissons, sont moins présents.
Depuis les années 2000 des chercheurs comme Jeziorski et al. (2008)[66] alertent sur le fait que l'acidification des milieux inhibe la bonne fixation du calcium chez de nombreuses espèces aquatiques, un minéral qui est un élément vital pour les animaux à coquilles (escargots, bivalves, etc. notamment au stade larvaire et jeune où ils sont très vulnérables), ou pour des animaux ayant au moins un organe vital constitués de carbonate de calcium, comme les tardigrades qui se nourrissent grâce à des stylets perforants en aragonite.
Pour les mammifères et les oiseaux, un approvisionnement diététique adéquat leur est crucial pendant la reproduction (les oiseaux ont besoin de calcium pour la bonne formation des coquilles d'œufs et pour la croissance squelettique de leurs progénitures). Les mammifères femelles en ont besoin pour le développement squelettique de leurs fœtus. Enfin, beaucoup d'espèces invertébrées, par exemple mollusques et crustacés, ont des besoins en calcium qui ne peuvent plus être satisfaits au-delà d'un certain seuil de pH. Elles sont parmi les premières à disparaître en cas d'acidification des terres marécageuses ou d'eaux douces ou marines.
Effets sur le patrimoine bâti et historique
[modifier | modifier le code]L'acidité des pluies peut accélérer l'érosion naturelle de nombreux matériaux, notamment calcaires, ainsi que la corrosion de certains métaux (le plomb qui tient les vitraux). Les pierres calcaires tendres, certains marbres et tuffeaux y sont les plus sensibles. Cela a d'abord été remarqué en Europe sur de nombreuses cathédrales dont la pierre s'est rapidement dégradée de la fin du XIXe siècle aux années 1990, par exemple en Angleterre pour les cathédrales telles que la cathédrale d'York et l'abbaye de Westminster. De nombreux autres bâtiments et éléments construits du patrimoine mondial ont été attaqués ces dernières années par l'acidité de l'air, dont le Taj Mahal en Inde et le Colisée à Rome, surtout dans les régions industrielles.
Réactions, évolutions législatives
[modifier | modifier le code]
Comme en témoignent des études publiées au Canada en 1939[67] puis en 1947[68] des scientifiques avaient déjà clairement montré que l'acidité induite par les émissions de soufre dans l'air pouvait gravement affecter la flore. Il faut cependant attendre les années 1970 et l'apparition des premiers ministères de l'environnement, pour que les émissions anthropiques soufrées[69], et les pluies acides commencent à être envisagées puis traitées en tant que problème transfrontalier, aux échelles régionales nationales et planétaire[70], tout comme le trou de la couche d'ozone.
Des stratégies écologiques et réglementaires, à la fois locales et globales, ont alors mobilisé, de manière historique et soutenue[71], de nombreuses instances académiques[72], associatives et territoriales (Union européenne et OCDE[73] y compris), ainsi que des entreprises, sous l'égide de l'Europe et de l'ONU notamment[74] et de nombreuses instances depuis plus d'un demi-siècle[75]. Les données scientifiques et modélisations prospectives[76] issues d'études de terrain à grande échelle, appuyées sur le concept de charges critiques, démontrant des effets parfois mortels sur la santé-environnementale et humaine[77],[78],[79], ont été relayées par les médias. Combinées à l'inquiétude du public face au dépérissements massifs des forêts nordiques et d'Europe centrale et de l'Est, ont conduit à des réactions politiques concertées et efficaces, d'abord en Europe et en Amérique du Nord avec des mesures et coopérations[80],[81] transfrontalières et transnationales notamment cadrées par la Convention de la CEE sur la pollution atmosphérique transfrontière à longue distance.
Ces mesures ont fait qu'en quelques décennies, les émissions atmosphériques soufrées ont été considérablement réduites, avec conséquemment une diminution de leurs impacts sur l'air, les pluies et les écosystèmes. Ces progrès ont été visibles de tous aux échelles paysagères, en Scandinavie et au Canada, via une meilleure santé des arbres et le retour de lichens[82] bioindicateurs d'un air moins acide[83] et en Europe du nord notamment[84], mais d'autres sources d'acidification de l'air et des pluies sont apparues.
L'étude des solutions aux pollutions acides a évolué, depuis les premiers essais de désacidification d'eaux douces visant à sauver certaines ressources piscicoles, dès les années 1920[85], suivis de l'étude des liens entre pluies acides et l'acidification des milieux, à la fin des années 1950, jusqu'aux grands concepts sur les causes et effets des pluies acides à la fin des années 1960[86].
Trois articles, respectivement en 1974, 1976 et 1988 ont élargi la compréhension du phénomène en mobilisant et combinant les apports de la chimie analytique, de la biochimie, de la limnologie, de l'écologie, de la physiologie et même de la génétique. Selon Bjørn Olav Rosseland, de l'Université norvégienne des sciences de la vie (NMBU) : « Peu de problèmes environnementaux, voire aucun, ont conduit à une telle prise de conscience du public, à des décisions politiques et à des limitations aussi contraignantes que l'histoire des pluies acides. Les précipitations acides et les problèmes d'acidification existent toujours, mais à une pression plus faible, et le chaulage a été réduit en conséquence. Cependant, les réponses biologiques dans le processus de rétablissement sont lentes et retardées. Le besoin de science fondamentale, d'études multidisciplinaires, de longues séries chronologiques de données de haute qualité, est un héritage de l'ère des pluies acides, et doit constituer la plate-forme de tous les futurs projets environnementaux[87]. »
La conférence internationale sur l'arbre et la forêt SILVA, à la Sorbonne, à Paris, en février 1986 a réuni autour du président français François Mitterrand et du chancelier ouest-allemand Helmut Kohl, dont les deux pays sont lourdement touchés par les pluies acides, une soixantaine de chefs d'État et de gouvernement pour débattre des actions à mener.
En 1988, le traité de la Convention sur la pollution atmosphérique transfrontalière à longue portée ; Convention on Long-Range Transboundary Pollution) entre en vigueur, 9 ans après signature de la convention, engageant les signataires à limiter les émissions d'oxydes d'azote à leur niveau de 1987.
La Commission européenne se préoccupe de la question, avec des normes européennes et nationales qui ont permis une forte diminution de la pollution acide de l'air des années 1980 aux années 2000. Diverses législations cherchent à limiter le niveau de polluants libérés pour l'adapter à la charge critique (niveau maximal de polluants pouvant être tolérés) du milieu, voire moins. Pour cela, la composition de certains carburants a été modifiée, et certains moteurs ont été adaptés. Des filtres ou des systèmes de purification des effluents gazeux sont installés en amont des cheminées d'usines polluantes. Les pots catalytiques sur les véhicules sont obligatoires dans un nombre croissant de pays.
Évocations dans la fiction
[modifier | modifier le code]Littérature
[modifier | modifier le code]Le roman de science-fiction La Cinquième Saison de N. K. Jemisin imagine le quotidien des habitants d'une planète où survient tous les quelques siècles une cinquième saison faite de pluies acides et d'autres catastrophes naturelles, et à laquelle les populations se préparent longuement.
Cinéma
[modifier | modifier le code]Le film de science-fiction français Acide, réalisé par Just Philippot en 2023, imagine des pluies acides dans le Nord de la France dans un futur proche[88].
Jeux de société
[modifier | modifier le code]Le jeu de rôle sur table Gamma World, conçu par James M. Ward et Gary Jaquet et publié par TSR en 1978, se déroule dans un futur lointain post-apocalyptique où le climat est devenu hostile et où les pluies acides sont fréquentes.
Notes et références
[modifier | modifier le code]- (en) Paul F. Schuster, Michael M. Reddy et S.I. Sherwood, « Effects of acid deposition on dissolution of carbonate stone during summer storms in the Adirondack Mountains, New York, 1987-89 », Water-Resources Investigations Report 93-4189, US Geological Survey, (lire en ligne, consulté le ).
- Air et pluies : les débuts de la climatologie chimique, R. A. Smith, employée à propos de ses impacts sur la ville industrielle de Manchester et alentours.
- (en) Peringe Grennfelt et Anna Engleryd, « Acid rain and air pollution: 50 years of progress in environmental science and policy », sur Ambio, (ISSN 0044-7447, DOI 10.1007/s13280-019-01244-4, consulté le ), p. 849–864.
- Les pluies acides, Environnement Canada.
- La mosaïque nord-américaine : Aperçu des principaux enjeux environnementaux, Dépôts acides, Commission de coopération environnementale d'Amérique du Nord.
- Pluie acide, Fondation de l'eau potable sûre.
- « Le mécanisme de formation des acides organiques atmosphériques est enfin décrypté », sur IASB (consulté le ).
- Rui Qu et Guilin Han, « A critical review of the variation in rainwater acidity in 24 Chinese cities during 1982–2018 », Elementa: Science of the Anthropocene, vol. 9, no 1, (ISSN 2325-1026, DOI 10.1525/elementa.2021.00142, lire en ligne, consulté le ).
- Felten, V. (2003). Effets de l'acidification des ruisseaux vosgiens sur la biologie, l'écologie et l'écophysiologie de Gammarus fossarum Koch, 1835 (Crustacea Amphipoda): Approche intégrée à différents niveaux d'organisation (Doctoral dissertation, Metz).
- C. U. Hammer, « Acidity of Polar Ice Cores in Relation to Absolute Dating, Past Volcanism, and Radio–Echoes », Journal of Glaciology, vol. 25, no 93, , p. 359–372 (ISSN 0022-1430 et 1727-5652, DOI 10.3189/s0022143000015227, lire en ligne, consulté le ).
- M. Legrand et R. J. Delmas, « A 220-year continuous record of volcanic H2SO4 in the Antarctic ice sheet », Nature, vol. 327, no 6124, , p. 671–676 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/327671a0, lire en ligne, consulté le ).
- (en) H. B. Clausen et C. U. Hammer, « The Laki and Tambora Eruptions as Revealed in Greenland Ice Cores from 11 Locations », Annals of Glaciology, vol. 10, , p. 16–22 (ISSN 0260-3055 et 1727-5644, DOI 10.3189/S0260305500004092, lire en ligne, consulté le ).
- K Ali, G. A Momin, S Tiwari et P. D Safai, « Fog and precipitation chemistry at Delhi, North India », Atmospheric Environment, vol. 38, no 25, , p. 4215–4222 (ISSN 1352-2310, DOI 10.1016/j.atmosenv.2004.02.055, lire en ligne, consulté le ).
- Bovay, E. (1969). Effets de l'anhydride sulfureux et des composés fluorés sur la végétation. In Air Pollution: Proceedings of the First European Congress on the Influence of Air Pollution of Plant and Animals (p. 111-135). Centre for Agricultural Publishing and Documentation Wageningen.
- (en) Claudia Elisabeth Wieners et Guðmundur Hálfdanarson, « "More poison than words can describe": What did people die of after the 1783 Laki eruption? », EGUsphere, , p. 1–36 (DOI 10.5194/egusphere-2023-2474, lire en ligne, consulté le ).
- Anouchka Vasak, « 1783, la fin du ciel ancien: », Romantisme, vol. n° 197, no 3, , p. 11–23 (ISSN 0048-8593, DOI 10.3917/rom.197.0011, lire en ligne, consulté le ).
- Tixier H (1996) Solutions pour le traitement des fumées en tuilerie-briqueterie : Dépollution des fumées de fours. L'Industrie céramique & verrière (Paris), (914), 248-251.
- (en) B. Franco et T. Blumenstock, « Ubiquitous atmospheric production of organic acids mediated by cloud droplets », sur Nature, (ISSN 0028-0836, PMID 33981052, PMCID PMC8116209, DOI 10.1038/s41586-021-03462-x, consulté le ), p. 233–237.
- (en-US) « China Takes First Steps In the Fight Against Acid Rain », sur Yale E360 (consulté le ).
- (en) Rui Qu et Guilin Han, « A critical review of the variation in rainwater acidity in 24 Chinese cities during 1982–2018 », Elementa: Science of the Anthropocene, vol. 9, no 1, (ISSN 2325-1026, DOI 10.1525/elementa.2021.00142, lire en ligne, consulté le ).
- La qualité de l'eau et l'assainissement en France (rapport du Sénat)
- Donald C. Buso, Gene E. Likens et John S. Eaton, Chemistry of precipitation, streamwater, and lakewater from the Hubbard Brook Ecosystem Study: a record of sampling protocols and analytical procedures, U.S. Department of Agriculture, Forest Service, Northeastern Research Station, (lire en ligne).
- (en-US) « Pluie acide », sur Safe Drinking Water Foundation, (consulté le ).
- Rachel Emma Rothschild, Poisonous Skies, University of Chicago Press, (ISBN 978-0-226-63471-5, lire en ligne).
- (en) Guozheng Zhang, Duanyang Liu, Xiaohong He et Deyue Yu, « Acid rain in Jiangsu province, eastern China: Tempo-spatial variations features and analysis », Atmospheric Pollution Research, vol. 8, no 6, , p. 1031–1043 (DOI 10.1016/j.apr.2017.02.001, lire en ligne, consulté le ).
- (en) Wen Xu, Zhang Wen, Bo Shang et Anthony J. Dore, « Precipitation chemistry and atmospheric nitrogen deposition at a rural site in Beijing, China », Atmospheric Environment, vol. 223, , p. 117253 (DOI 10.1016/j.atmosenv.2019.117253, lire en ligne, consulté le ).
- Source : Ademe : pluies acides et acidification.
- (en) « Acidification and Eutrophication », sur National Atmospheric Emission Inventory.
- (en) Sven-Eric Hopf, Simon Tresch, Salim Belyazid et Harald Sverdrup, « Dendrochemical indicators of tree rings reveal historical soil acidification in Swiss forest stands », Dendrochronologia, vol. 81, , p. 126099 (DOI 10.1016/j.dendro.2023.126099, lire en ligne, consulté le ).
- Almer, B., W. Dickson, C. Ekström, E. Hörnström, and U. Miller. 1974. Effects of acidification on Swedish lakes. Ambio 3: 30–36.
- évaluation DOBRIS Agence européenne pour l'environnement 1994.
- (en) W de Vries, E Vel, G.J Reinds et H Deelstra, « Intensive monitoring of forest ecosystems in Europe », Forest Ecology and Management, vol. 174, nos 1-3, , p. 77–95 (DOI 10.1016/S0378-1127(02)00029-4, lire en ligne, consulté le ).
- CHMI (2003). Air pollution in the Czech Republic in 2003. Czech Hydrometeorological Institute, Air Quality Protection Division http://www.chmi.cz/uoco/isko/groce/gr03e/ akap3.html (Consulté 2007/04/21)
- Rapport GEO-4 (Version française), PNUE, 2007, PDF, 574 pages
- (en) Hewen Niu, Yuanqing He, Xi Xi Lu et Jie Shen, « Chemical composition of rainwater in the Yulong Snow Mountain region, Southwestern China », Atmospheric Research, vol. 144, , p. 195–206 (DOI 10.1016/j.atmosres.2014.03.010, lire en ligne, consulté le ).
- (en) Xiaode Zhou, Zhifang Xu, Wenjing Liu et Yao Wu, « Chemical composition of precipitation in Shenzhen, a coastal mega-city in South China: Influence of urbanization and anthropogenic activities on acidity and ionic composition », Science of The Total Environment, vol. 662, , p. 218–226 (DOI 10.1016/j.scitotenv.2019.01.096, lire en ligne, consulté le ).
- (en) Zhifang Xu et Guilin Han, « Chemical and strontium isotope characterization of rainwater in Beijing, China », Atmospheric Environment, vol. 43, no 12, , p. 1954–1961 (DOI 10.1016/j.atmosenv.2009.01.010, lire en ligne, consulté le ).
- (en) Guilin Han, Yang Tang, Qixin Wu et Qiu Tan, « Chemical and strontium isotope characterization of rainwater in karst virgin forest, Southwest China », Atmospheric Environment, vol. 44, no 2, , p. 174–181 (DOI 10.1016/j.atmosenv.2009.10.019, lire en ligne, consulté le ).
- (en) Xinwei Lu, Loretta Y. Li, Nan Li et Guang Yang, « Chemical characteristics of spring rainwater of Xi'an city, NW China », Atmospheric Environment, vol. 45, no 28, , p. 5058–5063 (DOI 10.1016/j.atmosenv.2011.06.026, lire en ligne, consulté le ).
- (en) Ningning Zhang, Yuanqing He, Junji Cao et Kinfai Ho, « Long-term trends in chemical composition of precipitation at Lijiang, southeast Tibetan Plateau, southwestern China », Atmospheric Research, vol. 106, , p. 50–60 (DOI 10.1016/j.atmosres.2011.11.006, lire en ligne, consulté le ).
- (en) Jie Tang, XiaoBin Xu, Jin Ba et ShuFeng Wang, « Trends of the precipitation acidity over China during 1992–2006 », Chinese Science Bulletin, vol. 55, no 17, , p. 1800–1807 (ISSN 1001-6538 et 1861-9541, DOI 10.1007/s11434-009-3618-1, lire en ligne, consulté le ).
- Wang, X, Xu, K. 2011. Analysis on the space-time distribution characteristics of precipitation pH value in recent 15 years in Taiyuan area. Sci-Tech Information Development & Economy 21(3): 173–174 (en chinois). Available at https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CJFD&dbname=CJFD2011&filename=KJQB201103073&v=kyaXAWeVLIP1aJMRn0HGmWcWdT5ysfd2cdX0VyR2jTGFd9kXk18B2D9XwFNrn3IH. consulté 23 novembre 2020.
- Luo, X, Li, J, Zhang, P, Zhu, Z, Li, Y. 2013. Advances in research on the chemical composition of precipitation and its sources in China. Earth and Environment 41(5): 566–574 (en chinois).
- Rui Qu et Guilin Han, « A critical review of the variation in rainwater acidity in 24 Chinese cities during 1982–2018 (voir fig3, chapitre : 3.1.2. pH and acidic ions of rainwater in metropolises) », Elementa: Science of the Anthropocene, vol. 9, no 1, (ISSN 2325-1026, DOI 10.1525/elementa.2021.00142, lire en ligne, consulté le )|alt=Évolution sur 20 ans du degré d'acidité des pluies, et deux des principales sources d'acidification
- Liaowang Xinwen Zhoukan, « Ces milliards perdus à cause de la pollution », dans Courrier international no 853, du 8 au , p. 36 : extrait du « Rapport 2004 sur l'évaluation de l'économie nationale verte en Chine » écrit par l'Administration nationale pour la protection de l'environnement (SEPA)
- Michel Temman, « Victime de ses rejets, Tokyo aide Pékin à se mettre au vert », dans Libération du 16/04/2007, [lire en ligne].
- (en) Lei Duan, Qian Yu, Qiang Zhang et Zifa Wang, « Acid deposition in Asia: Emissions, deposition, and ecosystem effects », Atmospheric Environment, vol. 146, , p. 55–69 (DOI 10.1016/j.atmosenv.2016.07.018, lire en ligne, consulté le ).
- (en) Fangwen Zheng, Wenbo Rao, Xiaodong Chu et Hua Bai, « Chemical and sulfur isotopic characteristics of precipitation in a representative urban site, South China: implication for anthropogenic influences », Air Quality, Atmosphere & Health, vol. 13, no 3, , p. 349–359 (ISSN 1873-9318 et 1873-9326, DOI 10.1007/s11869-020-00798-7, lire en ligne, consulté le ).
- (en) J. Kurokawa, T. Ohara, T. Morikawa et S. Hanayama, « Emissions of air pollutants and greenhouse gases over Asian regions during 2000–2008: Regional Emission inventory in ASia (REAS) version 2 », Atmospheric Chemistry and Physics, vol. 13, no 21, , p. 11019–11058 (ISSN 1680-7324, DOI 10.5194/acp-13-11019-2013, lire en ligne, consulté le ).
- (en) Meng Li, Huan Liu, Guannan Geng et Chaopeng Hong, « Anthropogenic emission inventories in China: a review », National Science Review, vol. 4, no 6, , p. 834–866 (ISSN 2095-5138 et 2053-714X, DOI 10.1093/nsr/nwx150, lire en ligne, consulté le ).
- S. X. Wang, B. Zhao, S. Y. Cai et Z. Klimont, « Emission trends and mitigation options for air pollutants in East Asia », Atmospheric Chemistry and Physics, Gases/Atmospheric Modelling/Troposphere/Chemistry (chemical composition and reactions), (DOI 10.5194/acpd-14-2601-2014., lire en ligne, consulté le ).
- Schindler DW (1988) Effects of acid rain on freshwater ecosystems. Science(Washington), 239(4836), 149-157.
- Collier, K. J., Ball, O. J., Graesser, A. K., Main, M. R., & Winterbourn, M. J. (1990). Do organic and anthropogenic acidity have similar effects on aquatic fauna?. Oikos, 33-38 (résumé)
- Baker JP & Schofield CL (1982) Aluminum toxicity to fish in acidic waters. In Long-Range Transport of Airborne Pollutants (p. 289-309). Springer Netherlands.
- Driscoll, C.T., J.P. Baker, J.J. Bisogni Jr., and C.L. Scofield. 1980. Effects of aluminium speciation on fish in dilute acidified waters. Nature 284: 161–164
- Bevan, R. J., & Greenhalgh, G. N. (1976) Rhytisma acerinum as a biological indicator of pollution. Environmental Pollution (1970), 10(4), 271-285 (résumé)
- (en) B. O. Rosseland, « Ecological Effects of Acidification on Tertiary Consumers. Fish Population Responses », Conference paper, Springer Netherlands, , p. 451–460 (ISBN 978-94-010-8019-4, lire en ligne, consulté le ).
- (en) B. O. Rosseland, O. K. Skogheim, F. Kroglund et E. Hoell, « Mortality and physiological stress of year-classes of landlocked and migratory Atlantic salmon, brown trout and brook trout in acidic aluminium-rich soft water », Conference paper, Springer Netherlands, , p. 751–756 (ISBN 978-94-010-8019-4, lire en ligne, consulté le ).
- (en) B.O. Rosseland, I.A. Blakar, A. Bulger et F. Kroglund, « The mixing zone between limed and acidic river waters: complex aluminium chemistry and extreme toxicity for salmonids », Environmental Pollution, vol. 78, nos 1-3, , p. 3–8 (ISSN 0269-7491, DOI 10.1016/0269-7491(92)90003-s, lire en ligne, consulté le ).
- (en) Tom O. Nilsen, Lars O.E. Ebbesson, Ole G. Kverneland et Frode Kroglund, « Effects of acidic water and aluminum exposure on gill Na+, K+-ATPase α-subunit isoforms, enzyme activity, physiology and return rates in Atlantic salmon (Salmo salar L.) », Aquatic Toxicology, vol. 97, no 3, , p. 250–259 (DOI 10.1016/j.aquatox.2009.12.001, lire en ligne, consulté le ).
- (en) F. Kroglund, B. O. Rosseland, H.-C. Teien et B. Salbu, « Water quality limits for Atlantic salmon (<i>Salmo salar</i> L.) exposed to short term reductions in pH and increased aluminum simulating episodes », Hydrology and Earth System Sciences, vol. 12, no 2, , p. 491–507 (ISSN 1607-7938, DOI 10.5194/hess-12-491-2008, lire en ligne, consulté le ).
- (en) Josh Korman, David R. Marmorek, Gilles L. Lacroix et Peter G. Amiro, « Development and Evaluation of a Biological Model to Assess Regional-Scale Effects of Acidification on Atlantic Salmon (Salmo salar) », Canadian Journal of Fisheries and Aquatic Sciences, vol. 51, no 3, , p. 662–680 (ISSN 0706-652X et 1205-7533, DOI 10.1139/f94-067, lire en ligne, consulté le ).
- (en) Edoardo Massa et Lorena Rebecchi, « Effects of synthetic acid rain and organic and inorganic acids on survival and CaCO 3 piercing stylets in tardigrades », sur Journal of Experimental Zoology Part A: Ecological and Integrative Physiology, (ISSN 2471-5638, DOI 10.1002/jez.2701, consulté le ), p. 578–589.
- Henrikson, L., and Y.W. Brodin, eds. 1995. Liming of acidification surface waters. A Swedish synthesis, 457. Berlin: Springer (ISBN 978-3-642-79311-0).
- Tammi J., Appelberg M., Beier U., Hesthagen T., Lappalainen A., Rask M. (2003), Fish status survey of Nordic lakes: effects of acidification, eutrophication and stocking activity on present fish species composition Ambio. Mar; 32(2):98-105.
- (en) Adam Jeziorski, Norman D. Yan, Andrew M. Paterson et Anna M. DeSellas, « The Widespread Threat of Calcium Decline in Fresh Waters », Science, vol. 322, no 5906, , p. 1374–1377 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1164949, lire en ligne, consulté le ).
- (en) « Effeut of sulphur dioxide on vegetation. Publication no 815 of the National research council Canada, 1939. Pp. 447. Ottawa. $15 », Journal of the Society of Chemical Industry, vol. 59, no 34, , p. 610–611 (ISSN 0368-4075 et 1934-9971, DOI 10.1002/jctb.5000593405
 , lire en ligne, consulté le ).
, lire en ligne, consulté le ).
- (en) Morris Katz, « Sulfur. Dioxide in Atmosphere and Its Relation to Plant Life », Industrial & Engineering Chemistry, vol. 41, no 11, , p. 2450–2465 (ISSN 0019-7866 et 1541-5724, DOI 10.1021/ie50479a025
 , lire en ligne, consulté le ).
, lire en ligne, consulté le ).
- (en) D.J. Spedding, « The fate of sulphur-35/sulphur dioxide released in a laboratory », Atmospheric Environment (1967), vol. 3, no 3, , p. 341–346 (ISSN 0004-6981, DOI 10.1016/0004-6981(69)90107-3
 , lire en ligne, consulté le ).
, lire en ligne, consulté le ).
- (en) Gene E. Likens et F. Herbert Bormann, « Acid Rain: A Serious Regional Environmental Problem », Science, vol. 184, no 4142, , p. 1176–1179 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.184.4142.1176
 , lire en ligne, consulté le ).
, lire en ligne, consulté le ).
- (en) Ann McMillan et G. Foley, « A History of Air Quality Management », dans Air Quality Management, Springer Netherlands, , 19–42 p. (ISBN 978-94-007-7556-5, DOI 10.1007/978-94-007-7557-2_2, lire en ligne).
- Environment Canada (2004) Canadian acid deposition science assessment. Environment Canada, Ottawa
- Organization for Economic Co-operation and Development (OECD) (1981) The costs and benefits of sulphur dioxide control: a methodological study. Paris
- Maas, R., and P. Grennfelt, eds. 2016. Towards Cleaner Air. Scientific Assessment Report 2016. Oslo: EMEP Steering Body and Working Group on Effects of the Convention on Long-Range Transboundary Air Pollution. https://www.unece.org/fileadmin/DAM/env/lrtap/ExecutiveBody/35th_session/CLRTAP_Scientific_Assessment_Report_-_Final_20-5-2016.pdf.
- (en) Peringe Grennfelt, Anna Engleryd, Martin Forsius et Øystein Hov, « Acid rain and air pollution: 50 years of progress in environmental science and policy », Ambio, vol. 49, no 4, , p. 849–864 (ISSN 0044-7447 et 1654-7209, DOI 10.1007/s13280-019-01244-4, lire en ligne, consulté le ).
- (en) Terry L. Clark, Eva C. Voldner, Robin L. Dennis et Steven K. Seilkop, « The evaluation of long-term sulfur deposition models », Atmospheric Environment (1967), vol. 23, no 10, , p. 2267–2288 (ISSN 0004-6981, DOI 10.1016/0004-6981(89)90189-3, lire en ligne, consulté le ).
- (en) R.T. Burnett, R.E. Dales, M.E. Raizenne et D. Krewski, « Effects of Low Ambient Levels of Ozone and Sulfates on the Frequency of Respiratory Admissions to Ontario Hospitals », Environmental Research, vol. 65, no 2, , p. 172–194 (ISSN 0013-9351, DOI 10.1006/enrs.1994.1030, lire en ligne, consulté le ).
- (en) Richard T. Burnett, Robert Dales, Daniel Krewski et Renaud Vincent, « Associations between Ambient Particulate Sulfate and Admissions to Ontario Hospitals for Cardiac and Respiratory Diseases », American Journal of Epidemiology, vol. 142, no 1, , p. 15–22 (ISSN 1476-6256 et 0002-9262, DOI 10.1093/oxfordjournals.aje.a117540, lire en ligne, consulté le ).
- David V. Bates et Ronnie Sizto, « Air pollution and hospital admissions in Southern Ontario: The acid summer haze effect », Environmental Research, vol. 43, no 2, , p. 317–331 (ISSN 0013-9351, DOI 10.1016/s0013-9351(87)80032-4, lire en ligne, consulté le ).
- (en) Miranda A. Schreurs, « Transboundary Cooperation to Address Acid Rain: Europe, North America, and East Asia Compared », dans Beyond Resource Wars, The MIT Press, , 89–116 p. (lire en ligne).
- Schreurs, M. (2011). Transboundary Cooperation to Address Acid Rain. In S. Dinar (Ed.), Beyond resource wars: Scarcity, Environmental degradation, and international cooperation (pp. 90–116). Boston: MIT Press.
- (en) Columbus H. Brown, Proceedings of the 1979 U.S. Fish and Wildlife Service Pollution Response Workshop, 8-10 May 1979, St. Petersburg, Florida, Environmental Contaminant Evaluation Program, Fish and Wildlife Service, U.S. Dept. of the Interior : for sale by the Supt. of Docs., U.S. Govt. Print. Off.,, (lire en ligne).
- Keller, W., Heneberry, J., & Edwards, B. A. (2019). Recovery of acidified Sudbury, Ontario, Canada, lakes: a multi-decade synthesis and update. Environmental Reviews, 27(1), 1-16. url=https://cdnsciencepub.com/doi/abs/10.1139/er-2018-0018
- (en) Trygve Hesthagen, Arne Fjellheim, Ann K. Schartau et Richard F. Wright, « Chemical and biological recovery of Lake Saudlandsvatn, a formerly highly acidified lake in southernmost Norway, in response to decreased acid deposition », Science of The Total Environment, vol. 409, no 15, , p. 2908–2916 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2011.04.026, lire en ligne, consulté le ).
- Dahl, K. (1927). The effects of acid water on trout fry. Salmon and trout magazine, 46, 35-43.
- (no) A. Dannevig, « Influence of precipitation on river acidity and fish populations », Jeger og Fisker, no 3, , p. 116-118.
- (en) Bjørn Olav Rosseland, « The legacy from the 50 years of acid rain research, forming present and future research and monitoring of ecosystem impact (CC-BY-SA 4.0) », Ambio, vol. 50, no 2, , p. 273–277 (ISSN 0044-7447 et 1654-7209, PMID 33294955, PMCID PMC7782634, DOI 10.1007/s13280-020-01408-7, lire en ligne, consulté le ).
- Sandra Onana, « «Acide», Just Philippot averses et contre tout », sur Libération (consulté le ).
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- (en) Olivier Dangles, Björn Malmqvist et Hjalmar Laudon, « Naturally Acid Freshwater Ecosystems Are Diverse and Functional: Evidence from Boreal Streams », Oikos, vol. 104, no 1, , p. 149-155 (ISSN 0030-1299, e-ISSN 1600-0706, DOI 10.1111/j.0030-1299.2004.12360.x
 , JSTOR 3548325, Bibcode 2004Oikos.104..149D, S2CID 85096953, lire en ligne [PDF]).
, JSTOR 3548325, Bibcode 2004Oikos.104..149D, S2CID 85096953, lire en ligne [PDF]). - (en) Joseph Freda et William A. Dunson, « Effects of Low pH and Other Chemical Variables on the Local Distribution of Amphibians », Copeia, vol. 1986, no 2, , p. 454-466 (ISSN 0045-8511, e-ISSN 1938-5110, OCLC 5550267555, DOI 10.2307/1445003
 , JSTOR 1445003, S2CID 88243170).
, JSTOR 1445003, S2CID 88243170). - (en) R. Harriman et B. R. S. Morrison, « Ecology of streams draining forested and non-forested catchments in an area of central Scotland subject to acid precipitation », Hydrobiologia, vol. 88, no 3, , p. 251–263 (ISSN 0018-8158, e-ISSN 1573-5117, OCLC 5655150129, DOI 10.1007/BF00008505
 , S2CID 1300773).
, S2CID 1300773). - (en) George R. Hendrey, Kjell Baalsrud, Tor S. Traaen, Morten Laake et Gunnar Raddum, « Acid Precipitation: Some Hydrobiological Changes », Ambio, vol. 5, nos 5-6, , p. 224-227 (ISSN 0044-7447, e-ISSN 1654-7209, OCLC 9987221068, JSTOR 4312221).
- Magnuson, J. J., Baker, J. P., Rahel, E. J., & Kramer, J. R. (1984) A Critical Assessment of Effects of Acidification on Fisheries in North America (and Discussion). Philosophical Transactions of the Royal Society of London. B, Biological Sciences, 305(1124), 501-516.
- McDonald, D. G., Freda, J., Cavdek, V., Gonzalez, R., & Zia, S. (1991) Interspecific differences in gill morphology of freshwater fish in relation to tolerance of low-pH environments. Physiological zoology, 124-144 (résumé).
- McNeill JR : Something New Under the Sun - An Environmental History of the Twentieth-Century World (New York: Norton, 2000), chap. 4. Trad. fr. Du nouveau sous le soleil: Une histoire de l'environnement mondial au XXe siècle (Seyssel: Champ Vallon, 2010).
- P. Roqueplo, Pluies Acides : menaces pour l'Europe, Economica, 2001.
- (en) Bjørn Olav Rosseland, « The legacy from the 50 years of acid rain research, forming present and future research and monitoring of ecosystem impact », Ambio, vol. 50, no 2, , p. 273–277 (ISSN 0044-7447 et 1654-7209, PMID 33294955, PMCID PMC7782634, DOI 10.1007/s13280-020-01408-7, lire en ligne, consulté le ).
- Schindler DW (1988) Effects of acid rain on freshwater ecosystems. Science (Washington), 239(4836), 149-157.
Filmographie
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- (en) Portail internet d'Airclim (ONG spécialisée dans le domaine des pollutions acides de l'air)
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :

