Tuberculose
| Causes | Mycobacterium tuberculosis |
|---|---|
| Transmission | Transmission aéroportée (d) |
| Incubation min | 3 semaine |
| Incubation max | 8 semaine |
| Symptômes | Toux, hémoptysie, amaigrissement, fièvre, sueurs nocturnes, douleur thoracique, fatigue physiologique (d) et frissonnement (en) |
| Traitement | Médicament antituberculeux (d) |
|---|---|
| Médicament | Cyclosérine, éthionamide, acide para-aminosalycilique, éthambutol, capreomycin, pyrazinamide, isoniazide, isoniazide, viomycin (en), pyrazinamide, cyclosérine, éthionamide et rifampicine |
| Spécialité | Infectiologie et pneumologie |
| CISP-2 | A70 |
|---|---|
| CIM-10 | A15–A19 |
| CIM-9 | 010–018 |
| OMIM | 607948 |
| DiseasesDB | 8515 |
| MedlinePlus | 000077 |
| eMedicine |
230802 emerg/618radio/411 |
| MeSH | D014376 |
| Patient UK | Tuberculosis-pro |
La tuberculose est une maladie infectieuse contagieuse et non immunisante, avec des signes cliniques variables. Elle est provoquée par une mycobactérie du complexe tuberculosis correspondant à différents germes et principalement à Mycobacterium tuberculosis (ou bacille de Koch ou BK). Autrefois soignée dans les sanatoriums, par des cures de soleil et de plein air, elle a été réduite par les antibiotiques dans les années 1950, mais elle connaît un regain expliqué par l'apparition de souches multi-résistantes. La maladie tue encore près de deux millions de personnes chaque année dans le monde (1,4 million de victimes en 2010 contre 1,7 million en 2004 selon l'Organisation mondiale de la santé (OMS)). En 2010, 8,8 millions de nouveaux cas ont été recensés par l'Organisation mondiale de la santé, contre 9,27 millions en 2004[réf. nécessaire].
La tuberculose pulmonaire (autrefois appelée phtisie) est de loin la plus fréquente et la plus répandue, mais il existe des atteintes osseuses (mal de Pott, tumeur blanche du genou, etc.), rénales, intestinales, génitales, méningées, surrénaliennes[1] et cutanées (tuberculomes).
Sémiologie
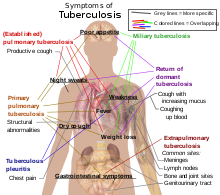
La tuberculose peut revêtir différentes formes selon la localisation du foyer infectieux. La tuberculose pulmonaire est la forme la plus fréquente et la source essentielle de la contagion. À partir du poumon, le bacille peut diffuser dans l'organisme et causer d'autres atteintes, ganglionnaires, ostéo-articulaires et génito-urinaires notamment. Les formes les plus létales sont les formes diffuses (miliaires) et méningées.
Tuberculose pulmonaire

La réalisation d'une intradermoréaction permet de dépister les personnes dont l'organisme héberge le bacille de Koch avant les manifestations cliniques de la maladie en l'absence de vaccination par le BCG. En effet ce dernier positive le test, le rendant non interprétable en ce sens. L'interprétation d'une intradermoréaction est purement fondée sur la taille de l'induration (l'IDR se lit au toucher) et non pas sur la présence d'un érythème. L'intradermoréaction pour la tuberculose porte aussi le nom de test Mantoux. Une radiographie des poumons recherchera des signes radiologiques. Une recherche de contamination dans l'entourage familial et professionnel est indispensable.
Les symptômes sont une fébricule (38–38,5 °C) durable, une toux quelquefois accompagnée d'hémoptysie, un amaigrissement de 5 à 10 kg survenant en quelques mois et des sueurs nocturnes. Une intradermoréaction (IDR) positive à la tuberculine. Les facteurs de risque sont la malnutrition, l'immunodépression, la toxicomanie intraveineuse, l'absence de domicile fixe [réf. nécessaire], le contact direct avec des personnes infectées et certaines professions de santé.
Lors d'une radio du thorax, une atteinte classique des apex (extrémité supérieure des poumons) avec, dans une tuberculose évoluée, des cavernes (cavités dans le tissu pulmonaire, contenant de l'air et de nombreux bacilles de Koch, cette bactérie étant en effet aérobie) est diagnostiquée. Ces cavernes ne disparaissent pas à la guérison ; elles se calcifient et produisent des séquelles radiologiques autrefois appelées « taches au poumon ».
Tuberculose extra pulmonaire

La tuberculose extra pulmonaire est le plus souvent le résultat d'une dissémination hématogène. Dans les pays occidentaux, la tuberculose urinaire est la quatrième forme de tuberculose extra pulmonaire. Le diagnostic est habituellement tardif. Une cystite rebelle associée à une hématurie microscopique et à une leucocyturie aseptique peuvent évoquer le diagnostic. D’installation subaiguë, l’épanchement péricardique sérohématique peut évoluer vers la constriction. Cultures et biopsie confirment le diagnostic.
Formes génitales : épidydimite chez l’homme, salpingite subaiguë ou péritonite chez la femme sont parfois les manifestations révélatrices d’une tuberculose extra pulmonaire.
Tuberculose osseuse
- spondylodiscite tuberculeuse ou mal de Pott
- tumeur blanche du genou
- spina ventosa
La tuberculose osseuse est la troisième manifestation de tuberculose extra pulmonaire. Elle touche préférentiellement la colonne vertébrale (50 %), les hanches et les genoux (15 %). En France, le mal de Pott et les sacro-iléites se révèlent avant tout chez les sujets âgés originaires d’Afrique ou d’Asie. Les signes cliniques d’un mal de Pott, douleurs rachidiennes plus ou moins fébriles, ne sont pas spécifiques et ce sont les clichés de la colonne vertébrale qui, en révélant des images destructrices des corps vertébraux avec tassement cunéiforme associé éventuellement à un processus condensant, orientent le diagnostic. Un abcès du psoas peut être le révélateur d’une sacro-iléite. Scanner ou imagerie par résonance magnétique permettent actuellement un diagnostic plus précoce. Face à une localisation ostéoarticulaire inhabituelle (poignet, cheville, coude…), la notion de traumatisme ou d’injection intra-articulaire de corticoïdes peut orienter le diagnostic vers une infection à mycobactéries.
Tuberculose ganglionnaire
- Ganglion lymphatique
Organe ovalaire entouré par une capsule fibreuse sous laquelle on peut identifier le sinus lymphatique sous capsulaire. Deux zones distinctes sont présentes :
- la corticale où se différencient les follicules lymphoïdes,
- la médullaire, peu visible ici[Où ?], renfermant le réseau vasculaire.
- Lésion
Sur le plan de coupe, ce ganglion renferme de multiples lésions nodulaires correspondant aux follicules tuberculeux. Au sein d'un même ganglion, plusieurs lésions tuberculeuses peuvent s'observer : - Lésion folliculaire : foyer arrondi formé de cellules géantes et de cellules épithélioïdes, entouré d'une couronne de lymphocytes. Les cellules géantes sont des cellules plurinucléées, au cytoplasme abondant faiblement éosinophile. Les cellules épithélioïdes sont des cellules allongées, aux limites cytoplasmiques mal visibles et au noyau allongé en semelle de chaussure.
- Lésion caséofibreuse : nécrose centrale éosinophile anhiste : nécrose caséeuse cernée par une coque fibreuse.
- Lésion caséofolliculaire : foyer centré par une plage de nécrose caséeuse, entourée par des cellules épithélioïdes, des cellules géantes et une couronne de lymphocytes.
La présence de bacilles de Koch peut être révélée sur la coloration de Ziehl Neelsen.
- Diagnostic
Tuberculose ganglionnaire.
Méningite tuberculeuse
Elle survient surtout chez les patients immigrés, les immunodéprimés, et peut se rencontrer aussi chez les patients éthyliques chroniques et les personnes âgées. Le début est plus progressif qu'une méningite bactérienne.
La ponction lombaire retrouve un liquide céphalo-rachidien (LCR) lymphocytaire hypoglycorachique. Une recherche du génome bactérien par une réaction en chaîne par polymérase (PCR) sur le liquide céphalo-rachidien peut parfois rapidement confirmer le diagnostic, sinon la culture (au minimum 3 semaines) peut retrouver le bacille de Koch[2]. La quantité des cas de méningite tuberculeuse apparus chez des enfants de moins de 5 ans d'une population sert à connaitre la couverture par le vaccin BCG.
Tuberculose cutanée
Rare en Occident où elle ne représente que 1,5 à 2,1 % de l'ensemble des formes que peut prendre la tuberculose, la forme cutanée de la tuberculose est cependant endémique en région tropicale et au Maghreb[3]. Elle adopte alors des formes cliniques variées : chancre tuberculeux, tuberculose cutanée miliaire, lupus tuberculeux, scrofulodermes et gommes tuberculeuses ou encore tuberculose péri-orificielle[3].
Diagnostic


Il repose principalement, soit sur l'examen direct d'un échantillon (expectoration) au microscope après coloration de Ziehl-Neelsen, à l'auramine, etc. soit après mise en culture de ce même échantillon sur les milieux de culture solide comme le Lowenstein-Jensen ou le milieu d'Ogawa. Cette dernière procédure est cependant longue (huit semaines) ce qui retarde d'autant le diagnostic. La culture dans un milieu liquide est relativement rapide (deux semaines). Après la culture, il est possible de procéder à l'identification des espèces et d'effectuer un antibiogramme. Le test de sensibilité aux antibiotiques de première ligne par la méthode des proportions de Canetti est le plus couramment utilisé et reste le test de référence (les antibiotiques testeurs sont l'isoniazide, la rifampicine, la dihydrostreptomycine et l'éthambutol). Les souches qui résistent à la fois à la rifampicine et à l'isoniazide sont dites multirésistantes[4].
La détection de certains gènes de la mycobactérie après une réaction en chaîne par polymérase semble être prometteuse malgré son coût plus élevé[5].
La tuberculose peut être causée par différents germes :
- Mycobacterium tuberculosis (bacille de Koch, le plus fréquent) ;
- Mycobacterium bovis ;
- Mycobacterium africanum ;
- Mycobacterium canetti (se trouve essentiellement à Djibouti) ;
- Mycobacterium microti (infections supposées très rares)[6],[7].
Le test à la tuberculine (intradermoréaction) consiste à injecter sous la peau une dose de cette dernière et à visualiser la présence ou l'absence de réaction allergique (taille de la papule) après 48 à 72 h. Ce test est cependant peu sensible, surtout chez le patient immunodéprimé, et peu spécifique (patient vacciné ou ayant été au contact d'autres mycobactéries).
En novembre 2013, le Conseil Supérieur de la Santé de Belgique a publié une actualisation de son avis scientifique sur la prévention, le dépistage, le diagnostic et le traitement de la tuberculose dans les institutions de soins et les maisons de repos. Dans cet avis, le Conseil clarifie notamment la place actuelle des nouveaux tests sanguins IGRA qui mesurent la production d’interféron gamma (IFN-γ) après stimulation par des antigènes spécifiques du bacille tuberculeux. Ces test ont les avantages suivants par rapport à l’intradermoréaction ou TCT : plus grande spécificité car pas de réaction croisée avec le vaccin BCG et avec les mycobactéries de l’environnement (sauf M. flavescens, M. marinum, M. kansassi et M. szulgai), une seule visite médicale nécessaire au lieu de deux, procédure et réactifs standardisés avec réponse claire et des contrôles possibles, pas d’effet « booster » lorsqu’ils sont répétés, résultats rapides (24 heures, à opposer à 3 à 5 jours). Néanmoins, au vu du prix et des données scientifiques actuelles trop limitées, le Conseil recommande de préserver la stratégie actuelle de dépistage. Le test tuberculinique reste donc l’examen de choix pour mettre en évidence l’infection tuberculeuse latente à l’embauche et lors du dépistage périodique dans les populations exposées au bacille tuberculeux comme les travailleurs de la santé. À l’embauche, les tests IGRA pourraient toutefois être utilisés pour confirmer le résultat d’un test tuberculinique positif chez un travailleur de la santé immunocompétent lorsque celui-ci a été vacciné enfant par le BCG (après l’âge d’un an) ou de manière répétée par la suite. Cette stratégie en deux temps permettrait de réduire le nombre de faux positifs liés au TCT. Si le test IGRA est négatif à l’embauche, il pourrait être utilisé ultérieurement si le travailleur est exposé à un cas de tuberculose contagieuse (dépistage des contacts)[8].
La détermination des souches résistantes aux antituberculeux habituels est importante pour adapter le traitement. La mise en culture du germe identifié dans différents milieux enrichis en antibiotiques (antibiogramme) reste la méthode de référence mais peut demander plusieurs semaines avant de fournir une réponse. Des sondes génétiques permettant d'identifier directement les souches résistantes dans un délai très bref ont été mises au point avec une bonne sensibilité et une bonne spécificité[9].
Prévention
Vaccination par le BCG
Un premier vaccin fut expérimenté en 1886 par Vittorio Cavagnis[10] tandis qu'à cette même époque Robert Koch tenta vainement de développer un sérum curatif basé sur la tuberculine[11]. En 1902, à partir d'un bacille d'origine humaine atténué, Behring essaya un vaccin contre la tuberculose bovine : le bovovaccin. Behring proposa également, sans succès, la tuberculase[12]. Toujours dans le domaine vétérinaire, Koch essaya le tauruman. Pour mémoire, il faut aussi citer le sérum de Marmorek (1904)[13], le sérum de Maragliano, les sérums de Richet et Héricourt, ainsi que les tentatives peu honnêtes de Friedmann (en) et de Spahlinger[14]. C'est en 1921, qu'Albert Calmette et Camille Guérin de l'Institut Pasteur de Lille essayent avec succès le premier vaccin contre la tuberculose sur lequel ils travaillaient depuis 1908 — qui était conçu pour être un vaccin vétérinaire. Baptisé BCG (pour « Bacille de Calmette et Guérin » ou « Bilié de Calmette et Guérin ») ce vaccin issu d'une souche vivante atténuée de Mycobacterium bovis deviendra obligatoire en France en 1950.
L’efficacité de la vaccination par BCG se limite à la protection contre l’évolution mortelle de la tuberculose, particulièrement la méningite tuberculeuse et la maladie disséminée (miliaire). Le vaccin est plus efficace chez le nouveau-né et l'enfant que chez l'adulte (protection estimée entre 75 et 85 % des formes graves du nourrisson et du jeune enfant et entre 50 et 75 % des formes de l'adulte[15]).
Il ne permet donc pas d'empêcher la transmission de la maladie et d'enrayer l'épidémie mondiale. L'avenir est dans la recherche des gènes de virulence du bacille.
Signalons au passage qu'en regardant attentivement l'évolution de la régression de la tuberculose depuis le XIXe siècle (fait constaté dans de nombreux pays), elle a régressé objectivement avant la découverte des antituberculeux, ou de la vaccination. Les épidémiologistes l'interprètent essentiellement[16],[17],[18] par l'amélioration des conditions d'hygiène, des conditions nutritionnelles, etc.
Sur base d'études faites à grande échelle et organisées par l'Organisation mondiale de la santé (OMS), certains pensent que l'efficacité du BCG est faible : dans une étude faite sur 260 000 personnes dans un pays d'endémie tuberculeuse (en Inde), les auteurs n'ont pas trouvé de différence significative entre le groupe qui avait reçu le BCG et celui qui ne l'avait pas reçu[19]. Une autre étude faite également en Inde sur 366 625 personnes a montré que le BCG n'avait aucune action préventive sur les formes de tuberculose pulmonaire parmi les adultes[20].
En juillet 2007, la ministre français de la santé, Roselyne Bachelot, a annoncé la suspension de l'obligation de vacciner tous les enfants et les adolescents contre la tuberculose par le BCG, à l'occasion de la présentation du nouveau programme de lutte contre cette maladie.
Après plus de deux ans de débats, et conformément aux recommandations du Conseil supérieur d'hygiène publique français et du Comité technique des vaccinations, la France, à l'image d'autres pays européens, veut optimiser sa stratégie de vaccination en la ciblant vers les enfants dits « à risque » et en renforçant le dépistage. Le vaccin contre la tuberculose n'est plus obligatoire depuis 2006.
Déclaration obligatoire
En France (depuis 1964), en Belgique et en Suisse, cette maladie est sur la liste des Maladies infectieuses à déclaration obligatoire.
En France, en particulier, c'est la mise sous traitement antituberculeux qui fait partie de la déclaration. Cela permet d'inclure les cas confirmés bactériologiquement et les cas probables reposant sur un faisceau d'arguments épidémiologiques, cliniques et d'imagerie en l'absence de preuve bactériologique formelle. En effet ces cas probables nécessitent les mêmes investigations d'enquête épidémiologique pour rechercher d'éventuels cas contact ou contaminant autour d'eux.
Dépistage des vaches porteuses du bacille

Toutes les espèces de vertébrés peuvent être atteintes spontanément par différents types de bacilles tuberculeux. Ces tuberculoses animales peuvent être cause de zoonoses.
Les symptômes de la tuberculose animale n’ont été décrits et rapprochés de ceux de l’homme que très tardivement. Si Aristote décrivit déjà les scrofules chez les animaux, les lésions de la tuberculose bovine restèrent longtemps confondues avec celles de la péripneumonie contagieuse et de l’hydatidose bovine ou de la morve des chevaux. Le premier à rapprocher les tubercules humains de ceux du bœuf fut Ernst Friedrich Gurlt, en 1831. Auparavant la tuberculose bovine, surtout dans les cas de localisation pleurale, a pu être assimilée plutôt à la syphilis humaine[21]. Après les découvertes de Koch, la question des rapports entre tuberculose humaine et tuberculose bovine, se reposant en des termes nouveaux, ne fut résolue que tardivement.
Afin de prévenir la transmission du bacille à l'homme, soit par voie aérienne directement par contact, soit par voie digestive après ingestion de viande ou de lait insuffisamment cuit ou pasteurisé, la plupart des pays développés ont entrepris d'assainir leur cheptel bovin.
La détection des animaux porteurs se fait par voie clinique, allergique et par recherche des lésions évocatrices sur les carcasses à l'abattoir. En France, cette prophylaxie est obligatoire depuis 1963 sur tout le territoire national pour tous les bovins âgés de plus de 6 semaines. Pour que les animaux puissent se déplacer sans contrainte, le cheptel doit obtenir le statut « officiellement indemne de tuberculose ». Pour cela, tous les animaux sont testés régulièrement par intradermotuberculination. La fréquence est annuelle mais peut être allégée quand la prévalence de la maladie dans le département est faible. Les animaux réagissant peuvent être soit testés comparativement par une tuberculine aviaire (pour détecter les faux positifs), soit envoyés à l'abattoir (l'abattage est alors subventionné) où les lésions évocatrices seront recherchées par un vétérinaire inspecteur, et éventuellement confirmées par diagnostic de laboratoire. Les troupeaux où l'infection est confirmée peuvent faire l'objet d'un abattage total, également subventionné.
Parallèlement, en France, un réseau de 5 000 vétérinaires sanitaires surveille l'apparition de signes cliniques évocateurs. Des visites sanitaires biennales de tous les troupeaux de bovins sont obligatoires. La vaccination au BCG positivant le test intradermique, elle est interdite sur le territoire français. Cette politique a permis de faire considérablement baisser la prévalence de la tuberculose bovine. En 2000, la commission européenne a reconnu à la France le statut de pays officiellement indemne. En 2006 le taux d'incidence était de 0,032 % de cheptels infectés alors qu'il était de près de 25 % en 1955. Il convient de distinguer la tuberculose bovine de la paratuberculose bovine, due également à une mycobactérie, mais qui n'est pas une zoonose.
Pasteurisation du lait
Avant l’obligation de pasteurisation du lait, la proportion des cas de tuberculose humaine d’origine bovine était estimée à 1,3 % des cas de tuberculose humaine. En France aujourd'hui, les rares cas de tuberculose humaine d'origine animale (0,5 % des cas) sont constatés dans leur majorité chez des sujets de plus de 60 ans, ce qui est le signe d’une infection ancienne[22].
Cas des carnivores domestiques
La fréquence de la tuberculose chez les carnivores domestiques, essentiellement due à M. bovis ou M. tuberculosis, a baissé, en même temps que celles des tuberculoses humaine et bovine. Le vétérinaire doit cependant toujours veiller à ce que les carnivores ne servent pas de relais épidémiologique secondaire dans un foyer de tuberculose, qu’il soit animal ou humain. Le diagnostic de la tuberculose des carnivores est extrêmement difficile à poser[22] .
Traitement

Le traitement est d'une durée de six mois pour une tuberculose pulmonaire à bacille de Koch sensible chez un patient immunocompétent, comprenant 2 mois de quadrithérapie antibiotique (isoniazide, rifampicine, pyrazinamide et éthambutol), puis 4 mois de bithérapie (isoniazide et rifampicine). Le traitement prolongé est indispensable afin de guérir la maladie et éviter l'émergence de souches résistantes dont l'évolution est souvent beaucoup plus grave.
La rifadine est un traitement qui peut être utilisé pour traiter la tuberculose osseuse.
L'isoniazide est utilisé généralement à la dose de 5 mg, en association avec trois autres antibiotiques. Isoniazide inhibe la multiplication des bactéries responsables de la tuberculose. Ce médicament doit être administré à jeun. Antibiorésistance : une large épidémie de cas de tuberculose résistante à ce médicament s'est déclarée à Londres de 1995 à 2006[23].
La rifampicine est utilisée habituellement à la dose de 10 mg/kg/jour, pendant une durée de 6 mois, pour le traitement de la tuberculose. Cet antibiotique est un fort inducteur enzymatique : il accélère la dégradation des autres médicaments, notamment les contraceptifs oraux. Les femmes sous contraceptifs sont donc invitées à revoir leur traitement à la hausse (après consultation du gynécologue), voire à passer à une contraception mécanique (préservatif…) pendant la durée du traitement. La rifampicine provoque une coloration orangée des urines. C'est un bon moyen d'objectiver l'observance du traitement.
La streptomycine (découverte par Selman Waksman vers 1946) fut le premier antibiotique actif contre le bacille de Koch. Il est contre-indiqué chez la femme enceinte et doit impérativement être associé à d'autres antituberculeux (INH et PAS). Par voie intramusculaire chez l'adulte : 15 à 25 mg par kilogramme et par jour. Par voie intrarachidienne : Pour l'adulte, vingt-cinq à cent milligrammes par jour, pour un enfant, vingt à quarante milligrammes par kilogramme et par jour en 2 ou 4 injections. Surveillance du traitement : Les fonctions auditives et rénales devront être surveillées régulièrement.
L'éthambutol est utilisable chez la femme enceinte. Elle doit être utilisée le matin à jeun en une seule prise, quinze à vingt milligrammes par kilogramme. Ne pas dépasser vingt-cinq milligrammes par kilogramme par 24 heures sans dépasser 60 jours, puis réduire à quinze milligrammes par kilogramme et par jour. Surveillance par un fond d'œil et un examen de la vision des couleurs mensuels.
Le R207910, une molécule de la famille des diarylquinolines, pourrait se révéler prometteuse contre Mycobacterium tuberculosis. Elle fait naître trois espoirs : raccourcissement de la durée du traitement ; envisager des prises une seule fois par semaine en association avec un autre antituberculeux ; être active sur des souches multi résistantes, avec une efficacité bactéricide bien supérieure à celle de l'isoniazide et de la rifampicine. Ce médicament est actuellement en phase très précoce de son développement. Seules des études approfondies chez l'homme permettront de vérifier que ces espoirs sont fondés.
Des corticoïdes sont ajoutées au traitement antituberculeux en cas de méningite tuberculeuse, de résistances ou de rechute de traitement. La corticothérapie doit être commencée après instauration de l'antibiothérapie, à la dose de 0,5 à 1 mg/kg/j pour une durée de 1 à 2 mois.
Résistance aux traitements
La résistance aux traitements est due à des traitements insuffisants en doses ou en durée[24]. Elle pose des problèmes importants car la tuberculose est beaucoup plus délicate à soigner, surtout en cas de résistances à plusieurs anti-tuberculeux (multi résistance). Dans le pire des cas, elle est dite étendue lorsqu'elle concerne des antibiotiques de première intention (isoniazide, rifampicine) et un ou plusieurs antibiotiques de seconde intention. Son incidence est d'environ 10 % des nouveaux cas (pour un seul antibiotique) et de 1 % (pour plusieurs antibiotiques). Dans certains pays, ces chiffres peuvent atteindre plus de 50 % des cas (notamment en Russie)[25].
Le dépistage de ces formes est difficile, la mise en culture du germe en présence des différents antibiotiques (antibiogramme) requérant plusieurs semaines pour avoir un résultat du fait de la lenteur de multiplication du mycobactérium. La recherche directe de mutations responsable de la résistance est faisable et donne de bons résultats[26]. Du fait de son coût, ces techniques sont difficilement applicables dans les pays pauvres. Une autre méthode consiste à observer la croissance de la souche de mycobacterium au microscope, en présence de différents antibiotiques. Elle donne des résultats fiables et assez rapide (une semaine)[27].
Le traitement des formes résistantes consiste en l'utilisation d'antituberculeux testés comme efficace sur la souche en question, complété par une fluoroquinolone et par des antibiotiques, dits de seconde ligne, comme la moxifloxacine, la bédaquiline, le delamanid[28]. La prise en charge a fait l'objet d'un document de recommandations publié par l'OMS en 2006[29] (Voir aussi DOTS, DOTS-Plus).
Pneumothorax (historique)
Avant la découverte d'antibiotiques efficaces, on pratiquait la collapsothérapie. La collapsothérapie est un affaissement de la partie atteinte du poumon et d'une partie du thorax par insufflation d'air, le pneumothorax, ou par chirurgie mutilante.
L'écrivain François Abgrall (1906-1930), décédé très jeune à 23 ans de cette maladie à une époque où elle était très mal soignée a décrit dans son livre Et moi aussi, j'ai eu vingt ans ![30] qui est un témoignage précieux sur le statut du malade tuberculeux vers 1925, les symptômes de cette maladie et la manière dont elle était soignée en France dans les années 1920. À l'époque, la seule thérapeutique proposée est la collapsothérapie. La technique consiste à mettre le poumon “au repos” en laissant entrer l'air ou en injectant un produit huileux entre les feuillets de la plèvre, détachant ainsi le poumon des côtes. Cette manœuvre barbare soulage provisoirement le patient mais s'accompagne de complications multiples parmi lesquelles la perte du poumon n'est pas exclue.
Ces méthodes ont disparu des pays occidentaux dans les années 1950.
Recherche et développement
Selon une étude d'Olivier Neyrolles de l'Institut Pasteur, le bacille de Koch se cacherait dans les cellules adipeuses[31]. C'est ainsi qu'il résisterait aux antibiotiques les plus puissants et qu'il serait capable de réapparaître après de nombreuses années chez des personnes guéries.
Ecoépidémiologie
La tuberculose est une zoonose qui peut affecter diverses espèces d'animaux domestiques ou sauvages, détectée pour la première fois en France chez des ongulés sauvage en 2004[32].
Épidémiologie

Légende : Taux pour 100 000 habitants
Le nombre annuel de nouveaux cas dans le monde, incluant les cas de rechute, est d'environ 5,4 millions (2006), occasionnant environ un million de décès[33]. Selon l'Organisation mondiale de la santé (OMS) : de 5 à 10 % des sujets infectés développent la maladie ou deviennent contagieux au cours de leur existence. La plupart des nouveaux cas (49 %) se situent dans les zones peuplées d'Asie : Bangladesh, Pakistan, Inde, Chine et Indonésie. Il existe une augmentation dans les pays de l'Europe de l'Est (incluant la Russie)[34]. La croissance reste très forte en Afrique, avec près de 13 % contre moins de 1 % dans les pays asiatiques.
Elle est fréquente chez les utilisateurs de drogues par voie intraveineuse et porteurs du virus de l'immunodéficience humaine (VIH), son incidence pouvant atteindre alors près de 10 %[35]. Il s'agit essentiellement d'une infection touchant l'adulte jeune, et les hommes sont près de deux fois plus atteints que les femmes. La malnutrition et les intoxications médicamenteuses sont des causes reconnues de l'augmentation du nombre de cas. La résistance aux médicaments anti-tuberculeux classiques reste rare (environ 4 % des nouveaux cas) mais atteint 10 % dans certains pays de l'Europe de l'Est[36]. Ce taux augmente très sensiblement en cas d'antécédent de tuberculose précédemment traité. La résistance aux médicaments anti-tuberculeux de seconde ligne reste rare mais a une très forte mortalité dans un délai court[37]. Le nombre de cette dernière forme tend cependant à augmenter (notamment assez fortement en Russie) et à s'étendre géographiquement. Il tend, au contraire, à se stabiliser dans les pays baltiques et à diminuer aux États-Unis[38].
La tuberculose mérite triplement son qualificatif de « maladie sociale » :
- sa fréquence dans une communauté est un bon indice du degré d'évolution sociale de celle-ci. Les facteurs principaux de diminution de la tuberculose sont les conditions de nutrition, d'habitat, d'hygiène et d'éducation sanitaire ;
- la prévention de la tuberculose nécessite, pour être efficace, un équipement médical et une organisation sociale bien développés ;
- les principales victimes sont des adultes jeunes subissant une longue invalidité, vu l'évolution lente et la nécessité d'un traitement efficace.
En 2003, le nombre de malades de la tuberculose a diminué de 30 % en Chine (la Chine est encore le deuxième pays le plus touché au monde après l'Inde) grâce au traitement de brève durée sous surveillance directe (DOTS) de l'Organisation mondiale de la santé, le seul réellement efficace à ce jour, mais qui avait peine à s'imposer dans le monde. À la fin de 2006, le nombre de cas dans tout le Congo était estimé à 80 000, contre 60 000 en 2002. Malgré le soutien des organisations internationales, la situation s'aggrave de par la pauvreté, mais aussi de l'insécurité et des combats, qui poussent les gens à se déplacer, d'où plus de contamination. Le traitement repose sur des mesures de prévention individuelle et collective, ainsi que sur un traitement rigoureux et complet des sujets malades :
- engagement des pouvoirs publics à prévenir la tuberculose en améliorant la disponibilité des commodités de base : eau, nourriture, hygiène, habitat ;
- dépistage de la tuberculose par examen microscopique des frottis chez les sujets qui présentent des symptômes ;
- approvisionnement régulier en médicaments antituberculeux ;
- traitement antibiotique sous surveillance pendant une durée suffisante (plusieurs mois) ;
- systèmes de notification pour vérifier l'action du traitement et les résultats du programme.
En 2013, deux articles de revue systématique et de meta-analyse arrivent aux conclusions suivantes:
- Les migrants et "hard-to-reach groups" sont 20 fois plus concernés que la population des pays industrialisés.
- Les mesures classiques de dépistage et de traitement sont peu efficaces et il faut des modèles psychosociaux adaptés aux groupes à risque.
- Envisager de payer les groupes à risque ou de proposer un autre incitant en échange du dépistage ou de la prise en charge pour les convaincre de l'utilité à court terme de la démarche.
- Il faut augmenter l'offre médicale, faire intervenir les acteurs sociaux et déplacer les soins et programmes de dépistage là où les personnes se trouvent[39],[40].
Dans les prisons
Les maladies infectieuses, notamment le VIH/sida et la tuberculose, frappent plus particulièrement les détenus, surtout dans les pays les plus pauvres[41]. Les prisons offrent le terrain idéal pour que la tuberculose se développe et se propage en raison de la surpopulation, d’une mauvaise alimentation et de services de soins inappropriés. La prévalence de la tuberculose en prison est beaucoup plus élevée que dans la population générale, jusqu'à 40 fois plus dans certains pays. La plupart des pays où la tuberculose représente un problème de santé publique sont des pays pauvres où les ressources et les infrastructures sont insuffisantes pour lutter efficacement contre cette maladie. Dans les prisons, les moyens sont encore plus restreints.
La maladie ne peut être enrayée en dehors des prisons qu'en s'attaquant également de l'intérieur. Dans une douzaine de pays, dont l'Azerbaïdjan et la Géorgie, le Comité international de la Croix-Rouge travaille avec les autorités carcérales pour lutter contre la tuberculose en prison. L’amélioration des conditions de vie, en particulier, un accès accru à l’air libre et à un régime alimentaire plus sain et le fait que les patients soient davantage conscients des lourds effets secondaires liés au traitement, peuvent avoir des effets réellement positifs. Le CICR recommande aussi que les autorités appliquent la stratégie mise en place par l'Organisation mondiale de la santé pour combattre la tuberculose (DOTS), qui suppose un approvisionnement régulier en médicaments et une surveillance directe du traitement[42].
Autres
Au-delà d’environ 60 ans, des personnes ayant été contaminées dans leur enfance ou leur adolescence (par M. tuberculosis, ou M. bovis), peuvent dans certains cas déclarer une tuberculose évolutive[22].
Histoire

Maladie au long cours aux manifestations très diverses et affectant aussi bien, quoique diversement, hommes et animaux, la tuberculose, dont les origines semblent remonter à celle du genre humain, mais dont l'unité nosologique et l'étiologie ne furent établies qu'au XIXe siècle, se prête difficilement à un exposé historique synthétique.
Épidémiologie historique
Les bacilles de la tuberculose existaient il y a trois millions d'années, alors que les précédentes estimations tablaient sur une apparition datant seulement de 35 000 ans. La souche originelle serait apparue en Afrique de l'Est, considérée comme le berceau de l'humanité. La maladie serait donc aussi vieille que l'humanité et son expansion à travers le monde serait intimement liée à celle de l'homme. Ce serait l'homme qui aurait transmis la maladie à ses animaux domestiques ou commensaux et non l'inverse[réf. nécessaire]. Des ganglions lymphatiques tuberculeux provenant de sépultures collectives du chalcolithique ont ainsi mis en évidence l'influence de la domestication animale qui a mis au contact l'homme et les animaux lors de la révolution néolithique[43].
Le complexe tuberculosis serait constitué de deux lignées évolutives différentes[44],[45], la première n'infectant que l'Homo sapiens, la seconde qui serait d'origine animale pouvant aussi infecter l'être humain, mais affectant surtout d'autres mammifères (bovins, caprins, rongeurs…)[46].
Des modèles statistiques bayésiens appuyés sur l'étude de marqueurs génétiques hypervariables (MIRU) laissent penser que le complexe tuberculosis actuel aurait 40 000 ans, c'est-à-dire qu'il serait apparu lors des migrations humaines hors d'Afrique, mais ce n'est qu'il y a environ 10 000 ans, probablement en Mésopotamie lors du processus de domestication animale qu'il se serait diversifié.
Jusqu'au XVIIIe siècle
Dès l’Antiquité gréco-latine, plusieurs auteurs ont décrit une maladie amaigrissante au long cours, dénommée suivant les uns « phtisie » (pour dépérissement), suivant les autres « tabès ». Ainsi Hippocrate (Ve-IVe siècle av. J.-C.) fait-il mention d’infections bronchopulmonaires et pleurales à évolution très lente, parmi lesquelles les consomptions d’origine thoracique occupent une place très importante. Il en dresse les symptômes, tels que l'amaigrissement progressif, la langueur, la toux et la présence de sang dans les crachats. Il décrit aussi les autres formes de tuberculose, comme la forme osseuse et la forme ganglionnaire[47]. Par la suite, Galien (IIe siècle apr. J.-C.) et Caelius Aurelianus (Ve siècle) distinguent également plusieurs des aspects cliniques de la maladie. Les lignes qu'Arétée de Cappadoce (fin du IIe siècle) consacre à la pathologie pleuropulmonaire le font considérer comme le premier des pneumo-phtisiologues.
Ces descriptions initiales n’ont guère subi de modifications notables jusqu’au début du XIXe siècle. Dès l'antiquité également, s'opposent deux théories sur l'origine de la maladie, considérée comme héréditaire par les uns, alors que pour d'autres, comme Aristote, elle est d'origine contagieuse[48]. Avicenne décrira la tuberculose comme contagieuse[49]. Au milieu du XVIe siècle, Girolamo Fracastoro se fait le précurseur d'une théorie moderne de la contagion. Dans son poème De Contagione et Contagiosis Morbis paru à Venise en 1546 et qui traite de la grande vérole et d’autres maladies infectieuses, tout en admettant que certaines formes puissent être héréditaires[50], il exprime l'opinion que la phtisie est une maladie contagieuse, générée de surcroît par des germes invisibles qu'il appelle seminaria contigionis. En outre, il admet une sorte de génération spontanée de ces semences contagieuses[51]. Cette hypothèse du caractère contagieux de la maladie n'a que peu d'écho immédiat ; seuls Giovanni Ingrassia et Prospero Alpini l'adoptent. En Europe du Sud cependant, et ce dès 1621, des mesures réglementaires et prophylactiques seront prises par différentes cités pour contrôler la contagion[48].
En 1679 parait l'ouvrage Opera Medica, de Franciscus de le Boë Sylvius. L'auteur y établit un lien direct, chez les patients tuberculeux, entre les nodules pulmonaires et la maladie elle-même (alors appelée « consomption »). Sylvius nomme ces nodosités « tubercules », vocable déjà en cours dans le lexique médical depuis Celse pour désigner toutes les productions morbides se présentant sous l'apparence de nodosités ou de petites tumeurs circonscrites (du latin : tuber, tumeur)[52].
En 1689, Richard Morton publie Phthisiologia, seu exercitationes de Phthisi, tribus libris comprehensae ; la version en langue anglaise paraîtra en 1720[53].
En 1720, Benjamin Marten publie A New Theory of Consumptions: More Especially of a Phthisis or Consumption of the Lungs. En s'appuyant sur Morton, il y suggère le caractère contagieux de la tuberculose, générée, suppose-t-il encore, par un animalcule. Bien que l'ouvrage connaisse une deuxième édition en 1722, il ne semble pas être pris en considération par les contemporains. Aucune référence, tout au moins directe, n'est trouvée à ses travaux dans la littérature médicale de l'époque[54],[55].
En 1733, Pierre Desault, chirurgien à Bordeaux, fait paraître un Essai sur la phtisie où il affirme notamment que la lésion fondamentale de la phtisie est le tubercule, s'opposant ainsi à Morton qui définit la maladie par l'existence de l'ulcère. Mais il est encore un des premiers à signaler la parenté entre la phtisie pulmonaire et les formes extra-pulmonaires qui portent sur les ganglions cervicaux (« Les causes de la phtisie et des écrouelles ont une parfaite ressemblance, soit dans leur naissance, soit dans leurs progrès, de manière qui peut être nommée la phtisie l’écrouelle du poumon. »)[56]. Desault ne manque pas de proposer un remède prétendument infaillible, à base d'extraits hépatiques[57].
En 1761, Jean-Baptiste Morgagni publie à Venise son traité d’anatomie pathologique clinique.
En 1790 jean Baptiste Huzard pressent le caractère contagieux de (ce qui ne s’appelle pas encore)la tuberculose et émet l'hypothèse d'une identité entre la maladie humaine et la maladie animale[58].
XIXe siècle
En 1808, Jean-Nicolas Corvisart (1755-1821) fait connaître en France par sa traduction, Inventum Novum, les travaux de Leopold Auenbrugger (1722-1809) sur l’exploration du thorax par la percussion, travaux qui n'avaient eu que peu d'écho depuis leur première publication, en 1761. Bayle et Laennec vont être élèves de Corvisart.
En 1810, Gaspard Laurent Bayle publie son ouvrage intitulé Recherches sur la Phtisie Pulmonaire, résultat de l'observation minutieuse de neuf cents autopsies, chacune comparée aux observations cliniques consignées du vivant du malade[59]. Son apport est de considérer les tubercules, non pas comme le résultat, mais comme la cause de la maladie[60]. Il ne réussit pas à englober dans une seule catégorie nosologique les diverses formes qu'il observe : il en distingue six, dont une seule mérite à ses yeux d'être considérée comme véritablement tuberculeuse[61].
En 1818, Laennec invente le stéthoscope qui va grandement faciliter le diagnostic de la tuberculose. En 1819, il distingue cette maladie des autres affections pulmonaires. Laennec reconnaît le caractère infectieux de la phtisie. Il en décrit la matière grise et semi-transparente qui devient jaune-opaque et ensuite purulente, mais il en ignore toujours le caractère contagieux[62].
En 1827 (ou postérieurement à 1832), Karl von Reichenbach préconise le recours à la créosote, traitement qui connaît alors une certaine popularité[63].
En 1839, le médecin allemand Schönlein rassemble en une description unifiée les manifestations cliniques disparates de la maladie. Jusqu'alors, « phtisie » et « tuberculose » étaient souvent considérées comme deux entités, voisines mais distinctes[64]. Si Schönlein forge en 1834 le terme de tuberculose, composé d'un nom latin et d'une terminaison grecque[60], la littérature médicale, tout comme le langage commun, continuera d'utiliser indistinctement, jusqu'au début du XXe siècle, les termes de « phtisie », « consomption » et « tuberculose[65] ».
En 1846, H. P. F. Klencke démontre expérimentalement la contagiosité de la tuberculose. Sa découverte passe inaperçue à l'époque, mais c'est elle qui inspirera Koch.
En 1854, le naturaliste et médecin allemand, élève de Schönlein[66], Hermann Brehmer, guéri d'une tuberculose après un séjour dans l'Himalaya, publie une thèse intitulée La tuberculose est un mal curable. Il s'y fait l'avocat de cures dans des établissements tels que celui qu'il crée, dès la même année 1854, à Gorbersdorf, où les malades doivent bénéficier du bon air, d'exercices physiques et d'une alimentation équilibrée. Rejetées au début par l'élite médicale, ces idées finissent par s'imposer partiellement, et s'ensuit le développement des sanatoriums (où le repos se substituera à l'exercice physique préconisé par Brehmer)[67],[68]. Il faut rappeler que, dès 1820, Sir James Clark prônait les cures d'air, notamment dans des contrées méridionales, tandis que George Bodington avait proposé dès 1840 de mettre ces cures à la portée des moins fortunés en construisant les hôpitaux, à proximité des villes certes, mais à la campagne[69].
De 1865 à 1868, le médecin Jean-Antoine Villemin reproduit chez les animaux (lapins, cobayes) les lésions de la tuberculose humaine, par inoculation de tissu altéré humain. Il peut ainsi affirmer que cette maladie, de nature jusqu'alors inconnue, est due à un microbe invisible par les moyens techniques de l'époque. Il en conclut que les individus peuvent s'en protéger par des mesures visant à éviter la contagion[70]. En 1869, en soumettant des animaux de laboratoire à des expectorations desséchées et pulvérisées, Villemin montre encore que la transmission se fait par la voie aérienne. Ses conclusions se heurtent à une forte opposition, en France notamment. Elles inspirent cependant des travaux comme ceux d'Edwin Klebs[71], Julius Cohnheim, Carl Salomonsen et Tappeiner qui, avant la mise en évidence du Bacille en 1882, comme en témoignera Koch lui-même, aboutissent à établir de façon indubitable la contagiosité de la maladie[72]. Ainsi, en 1867 déjà, la tuberculose peut être qualifiée de maladie contagieuse lors du premier congrès international de spécialistes médicaux organisé à Paris[73]. En 1868 Auguste Chauveau transmet la tuberculose bovine d'une génisse à une autre par ingestion ; il transmet la tuberculose humaine à un veau par ingestion également.
En 1882 enfin, à la suite des travaux de Pasteur, Robert Koch met en évidence le bacille tuberculeux à partir de lésions humaines : le 24 mars 1882, il communique d'abord à la Société de Physiologie de Berlin une note sur la recherche et la culture du Bacille de la tuberculose ; le 10 avril, il publie dans le Berliner klinische Wochenschrift un mémoire sur l'étiologie de la tuberculose qu'il rapporte à un bacille décelé dans les crachats et les lésions tuberculeuses humaines d'après une méthode spéciale. Presque immédiatement, Paul Ehrlich, un de ses élèves, propose une autre méthode de teinture plus rapide et plus sûre. Le micro-organisme décelé par les méthodes de coloration appropriées a une forme invariable en bâtonnet [d'où la dénomination de bacille, « petit bâton » ]. Dès leur apparition, les communications de Koch soulevèrent des objections qui n'en contredisent pas les faits essentiels mais tendent à en limiter les conclusions trop rigoureuses. Koch y répond d'abord en 1883 dans le n° 10 du Deutsche medic. Wochenschrift. En 1884, dans « les Communications de l'Office de Santé impérial » , Koch fait une présentation plus complète des résultats de ses recherches dans un mémoire intitulé « l'étiologie de la tuberculose ». Les difficultés de l'obtention d'une première culture, la lenteur et l'insuffisance du développement font alors dire à Koch « qu'il n'y a pas à espérer que la culture du Bacille de la tuberculose joue un très grand rôle » dans l'étude de cette maladie[74].(Baumgarten conteste à Koch la priorité de sa découverte).
À l'époque, la tuberculose est la cause d'un décès sur sept en Europe.
Plusieurs années après cette découverte, le mode de transmission de la tuberculose demeure pour beaucoup un grand mystère[75], et si l'existence même du bacille est très vite largement acceptée, certaines oppositions persistent, comme celle de Virchow qui, au soir de sa vie en 1902, parle encore de « ce soi-disant germe tuberculeux[71] ». Les relations entre tuberculose bovine et tuberculose humaine seront par exemple un sujet de débat. L'opinion de Koch lui-même connaît sur ce point une évolution : professant d'abord que la tuberculose de l’homme, des bovins, du singe, du cobaye, du lapin et de la poule est causée par une même bactérie[22], il fait finalement état de différences entre le bacille humain et le bacille bovin, en 1901, à l'occasion du Congrès de Londres sur la tuberculose, et ce d'après des observations qui lui ont été rapportées par Theobald Smith[76].
La recherche se heurte à la difficulté qu'il y a à déceler des Bacilles dans les lésions.
Le 4 août 1890, à Berlin, à l'occasion du Dixième Congrès international de médecine, Koch annonce, sur la base d'expériences effectuées sur le cobaye, la découverte d'un traitement à la fois prophylactique et thérapeutique contre la tuberculose. D'abord appelé « lymphe de Koch », ce traitement, dont la composition est d'abord tenue secrète, suscite d'immenses espoirs. Des guérisons spectaculaires sont d'abord rapportées, notamment par des médecins allemands ; bientôt toutefois, des complications sont reconnues et des guérisons réévaluées. Le 15 janvier 1891, Koch dévoile la composition de sa lymphe : « un extrait glycériné tiré des cultures pures du bacille de la tuberculose ». Abandonnée en thérapeutique, cette lymphe, rebaptisée tuberculine, servira sous d'autres modalités à des fins diagnostiques[77]. Aux États-Unis, Karl et Silvio Von Ruck tenteront malgré tout de promouvoir un vaccin préventif à base de tuberculine ; les autorités sanitaires s'y opposeront.
En 1891, le Dr Arthur Armaingaud fonde la Ligue antituberculeuse française, ou Ligue contre la tuberculose, mouvement d'éducation populaire insistant sur les moyens d’éviter la propagation de la maladie. D'abord créé à Bordeaux, ce mouvement gagne toute la France[78] et inspirera des réalisations à l'étranger[79].
En 1894, Carlo Forlanini met au point la première méthode thérapeutique invasive avec le pneumothorax artificiel intra-pleural : par une injection d'air dans la cavité thoracique, entraînant la rétraction du poumon infecté, il obtient une amélioration de la maladie. Cette technique, expérimentée sans succès dès 1819 par James Carson et que Forlanini avait déjà envisagée dans une publication de 1882, rencontre d'abord l'incrédulité de la communauté scientifique, sans doute du fait de premiers résultats peu satisfaisants[80]. La publication de ses recherches en 1906 par Forlanini dans le Deutsche Medizinische Wochenschrift conduit toutefois à l'adoption de cette technique, entretemps préconisée aux États-Unis par John Benjamin Murphy[81].
En 1895, Wilhelm Röntgen découvre les rayons-X qui deviennent quasi immédiatement l'outil de base de la détection de la tuberculose. En Italie par exemple, Carlo Forlanini réalise les premières radiographies pulmonaires dès 1896. En France, Antoine Béclère, immédiatement convaincu de l'utilité de cette technique, installe à ses frais un appareil de radioscopie dans son service de l'hôpital Tenon en 1897[82]. Dès 1897 encore, Kelsch conduit le premier examen radiologique systématique pulmonaire à l'hôpital militaire Desgenettes de Lyon[83].
XXe siècle

En 1903, Jacques-Joseph Grancher crée L'Œuvre de préservation de l'enfance contre la tuberculose, qui se propose de placer les enfants à la campagne afin de les préserver de la maladie qui affecte leur famille. Avec le soutien des pouvoirs publics, L'Œuvre Grancher, comme cette association est communément appelée, est étendue à tous les départements de France sous la forme de filiales autonomes animées par des médecins[84]. Cette même année 1903, Niels Ryberg Finsen reçoit le prix Nobel de physiologie ou médecine en reconnaissance de ses contributions au traitement des maladies par la lumière et, notamment, au traitement par cette méthode de la tuberculose cutanée (Lupus vulgaris).
Au congrès de Paris de 1905, MM. Moeller, Lôwenstein et Ostrowsky proposent une nouvelle méthode de diagnostic de la tuberculose pulmonaire par la tuberculine de Koch[85].
En 1908, Charles Mantoux présente sa première étude sur les injections intradermales devant l'Académie des sciences. Dans les années qui suivent, ce test de dépistage sérologique de la tuberculose, dès lors appelé test Mantoux, remplace le test sous-cutané.
La loi du 15 avril 1916 marque le début de l'intervention de l'État français en matière de prévention : sous la pression de l’épidémie de tuberculose sévissant dans les troupes engagées sur le front, cette loi, dite « loi Léon Bourgeois », impose la création, sur l’ensemble du territoire, de dispensaires semblables à celui créée par Albert Calmette à Lille ; en outre, elle favorise le développement d’une éducation sanitaire, structurée avec l’aide de la Mission américaine Rockefeller[86]. En 1919, la loi Honnorat oblige chaque département à édifier un sanatorium public ou à passer un accord avec un autre département[87].
En 1919, Alfred Boquet et Léopold Nègre démontrent que l'extrait méthylique du bacille tuberculeux peut ralentir la marche de l'infection tuberculeuse. Connu sous le nom d'antigène méthylique, cet extrait sera utilisé dans les laboratoires pour déceler et titrer les anticorps tuberculeux ; il sera aussi utilisé dans le traitement de certaines formes de tuberculose humaine[88]. Cette méthode a été adaptée au traitement de la Tuberculose chez l’homme par le service d'Henri Nouvion du sanatorium de Champrosay (Hôpital Joffre-Dupuytren).
En 1920, création de L’Union internationale contre la tuberculose et les maladies respiratoires[73].
L'année 1921 est celle de la première vaccination d'un être humain par le BCG.
En 1925 est lancée en France la première campagne nationale du timbre antituberculeux, qui connaît immédiatement un grand succès populaire. En 1930 a lieu le désastre de Lübeck. En 1935 est introduite l'exérèse chirurgicale (lobectomie, pneumonectomie). En 1939, Noël Rist et ses collaborateurs du laboratoire de chimie thérapeutique d'Ernest Fourneau, à l'Institut Pasteur, mettent en évidence une certaine action inhibitrice de la sulfone-mère, in vitro sur le bacille tuberculeux et in vivo sur la tuberculose du lapin, du cobaye et des oiseaux[89]. En 1940, Gerhard Domagk découvre l'action antituberculeuse des thiosemicarbazones.
En 1941, H. Corwin Hinshaw et William Feldman annoncent avoir trouvé une substance, la promine, qui pourrait affaiblir in vivo le bacille tuberculeux. L'arrivée des antibiotiques – et en premier lieu de la streptomycine que Feldman contribua d'ailleurs à développer[90] – mit un terme aux essais cliniques du Promin et d'un de ses dérivés, le Promizol[91].
En 1940, Selman Waksman découvre l'action antituberculeuse de l'actinomycine puis, en 1942, de la streptothricine. Ces antibiotiques ne peuvent toutefois être utilisés en thérapeutique humaine ou vétérinaire du fait de leur trop grande toxicité. En 1943, Waksman découvre enfin la streptomycine qui permet, un an plus tard, la première guérison par antibiotique d'un malade gravement atteint de tuberculose[92]. En 1946, la streptomycine est mise à disposition des Français. Très tôt – si ce n'est immédiatement – les scientifiques se rendent compte de certaines limites des antibiotiques en général et de la streptomycine en particulier, le taux élevé de mutation de M. Tuberculosis provoquant l'apparition de souches résistantes[90]. En 1948, a lieu le premier essai clinique randomisé de l'histoire de la médecine : l'épidémiologiste Austin Bradford Hill montre la plus grande efficacité de la streptomycine[93] sur la collapsothérapie[94].
En 1993, l’OMS déclare que la tuberculose est une urgence mondiale.
XXIe siècle
En 2010, pour la première fois, une baisse du nombre de nouveaux malades a été enregistrée (avec 8,8 millions en 2010 contre 9 millions de cas en 2005, près de 400 000 morts de moins en 2010 par rapport à 2003, selon les prospectivistes de la santé, la mortalité pourrait encore diminuer de 50 % d’ici 2015 notamment grâce à un nouveau test de diagnostic rapide de la tuberculose reconnu fin 2010 par l'OMS. De plus, près de 9 patients sur 10 guérissent (50 millions de succès thérapeutiques et 7 millions de vies sauvées en 15 ans), mais Ban Ki-Moon, Secrétaire général de l'ONU invite la communauté internationale à rester vigilante, car des formes résistantes de tuberculose sont apparues et car les plus démunis restent encore très vulnérables à cette maladie, notamment en Afrique où la tendance est encore à la hausse[95]. En 2010, de nombreux cas ont été constatés dans le département français de la Seine-Saint-Denis par les services sanitaires[96]. La tuberculose a tué, selon les estimations, 1,7 million de personnes en 2009 et 9,4 millions de personnes développent une tuberculose évolutive chaque année rappelle l'OMS en 2010[97].
Notes et références
- (en) Tajdine MT, Ait Taleb K, Amahzoune M, Chefchaouni M, Belkouchi A, Balafrej S. « Pseudotumeur tuberculeuse surrénalienne » Prog Urol. 2002;12:462-4.
- Pilly de 2002
- H. Lakhdar, « Tuberculose cutanée », sur www.therapeutique-dermatologique.org, (consulté le )
- (en) G. Canetti, W. Fox, A. Khomenko, N. Rist, N. A. Smeley. « Advances in techniques of testing mycobacterial drug sensitivity, and the use of sensitivity test in tuberculosis control programmes » Bull World Health Organ. 1969;41(1):21-43. PMID 5309084
- (en) C. Piersimoni, C. Scarparo. « Relevance of commercial amplification methods for direct detection of Mycobacterium tuberculosis complex in clinical samples » J Clin Microbiol. 2003;41:5355–65. PMID 14662911
- (en) van Soolingen et al. « Diagnosis of Mycobacterium microti Infections among Humans by Using Novel Genetic Markers » J Clin Microbiol. 1998;36:1840-5. PMID 9650922
- (en) Panteix G, Gutierrez MC, Boschiroli ML, Rouviere M, Godreuil S. et al. « Pulmonary tuberculosis due to Mycobacterium microti: a study of six recent cases in France » J Med Microbiol. 2010;59(Pt 8):984-9. DOI 10.1099/jmm.0.019372-0
- « Recommandations relatives à la prévention de la tuberculose dans les institutions de soins », Publication du Conseil Supérieur de la Santé no 8579, sur www.health.belgium.be, Conseil Supérieur de la Santé, (consulté le ).
- (en) M. Morgan, S. Kalantri, L. Flores, M. Pai. « A commercial line probe assay for the rapid detection of rifampicin resistance in Mycobacterium tuberculosis: a systematic review and meta-analysis » BMC Infect Dis. 2005.5:62. PMID 16050959
- « Gazette hebdomadaire de médecine et de chirurgie. - 1887. - série 2, tome 24 », sur web2.bium.univ-paris5.fr (consulté le )
- « Robert Koch and the pressures of scientific research: tuberculosis and tuberculin. C Gradmann, page 2 », sur www.ncbi.nlm.nih.gov (consulté le )
- « Médecine : Futur Antérieur Ou Les Perspectives D’avenir Inspirées Par Deux Grandes Découvertes Scientifiques Du XIXe siècle : La Théorie Microbienne Et Les Rayons X » [PDF], sur www.bium.univ-paris5.fr (consulté le )
- sérum de Marmorek (1904)
- (en) « Editorial Section page 617 » [PDF], sur ajph.aphapublications.org (consulté le )
- Vaccinations par le BCG : recommandations actuelles sur le site santé du Ministère des Affaires sociales et de la Santé (18 septembre 2008) lire en ligne
- R. Beaglehole, R. Bonita, T. Kjellström. Éléments d'épidémiologie éd. OMS 1994, p. 85.
- (en)[PDF] Environmental Justice, Science, and Public Health, Steve Wing
- Michel Georget, Vaccinations, éd. Dangles, p. 237
- (en)[PDF] « Trial of BCG vaccines in south India for tuberculosis prevention : first report » Bull of WHO 1979;57(5):819-27. PMID 396057
- (en)[PDF] « Fifteen year follow up trial of BCG vaccines in south India for tuberculosis prevention », Tuberculosis research center, Indian J Med Res. 1999;110;56-69. PMID 10573656
- « Étude descriptive des disparités départementales des résultats de la lutte contre la tuberculose bovine en France : formulation d’hypothèses explicatives », sur theses.vet-alfort.fr (consulté le )
- (en) « Écoles Nationales Vétérinaires Françaises Maladies Contagieuses - La tuberculose animale », sur cours.vet-alfort.fr (consulté le )
- (en) « Large outbreak of isoniazid-monoresistant tuberculosis in London, 1995 to 2006: case–control study and recommendations »
- (en) Espinal MA, Laserson K, Camacho M. et al. « Determinants of drug-resistant tuberculosis: analysis of 11 countries » Int J Tuberc Lung Dis. 2001;5:887-93. PMID 11605880
- (en)} Mohamed Abdel Aziz, Abigail Wright, Adalbert Laszlo, Aimé De Muynck, Françoise Portaels, Armand Van Deun, Charles Wells, Paul Nunn, Leopold Blanc, Mario Raviglione. « Epidemiology of antituberculosis drug resistance (the Global Project on Anti-tuberculosis Drug Resistance Surveillance) » Lancet 2006; 368:2142-54. PMID 17174706
- (en) Sam IC, Drobniewski F, More P, Kemp M, Brown T. « Mycobacterium tuberculosis and rifampin resistance, United Kingdom » Emerg Infect Dis. 2006;12:752-9. PMID 16704831
- (en) Moore DA, Evans CA, Gilman RH et al. « Microscopic-observation drug-susceptibility assay for the diagnosis of TB » N Engl J Med. 2006;355:1539-50. PMID 17035648
- (en) Munang ML, O’Shea MK, Dedicoat M, « Novel drugs and drug combinations for treating tuberculosis » BMJ 2014;349:g5948
- (en)[PDF]World Health Organization, Guidelines for the programmatic management of drug-resistant tuberculosis, Geneva: WHO, 2006
- François Abgrall. Et moi aussi, j'ai eu vingt ans!, 1935, réédité en 2000, Éditeur Terre de Brume, Rennes
- « Communiqué de l'Institut Pasteur », sur www.pasteur.fr (consulté le )
- Hars J, Boschiroli M-L, Belli P, Var- don J, Coquatrix E, Garin-Bastuji B. et Thorel M-F. « Découverte du premier foyer de tuberculose sur les ongulés sauvages en France » Revue Faune sauvage (ONCFS) 2004;261:29-34
- (en)WHO, Global tuberculosis control 2008
- (en) C Dye. « Global epidemiology of tuberculosis » Lancet 2006;367:938-40. PMID 16546542
- (en) Selwyn PA, Hartel D, Lewis VA. et al. « A prospective study of the risk of tuberculosis among intravenous drug users with human immunodeficiency virus infection » N Engl J Med. 1989:320;545–550
- (en) Zignol M, Hosseini MS, Wright A et al. « Global incidence of multidrug-resistant tuberculosis » J Infect Dis. 2006;194:479–485
- (en) Gandhi NR, Moll A, Sturm AW et al. « Extensively drug-resistant tuberculosis as a cause of death in patients co-infected with tuberculosis and HIV in a rural area of South Africa » Lancet 2006:368;1575–1580
- (en)[PDF] Anti-tuberculosis drugs resistance in the world, 4e rapport de l'OMS, 2008
- Tankimovich M., 2013. J. Community Health Nurs. 30: 83-95. cf http://www.ncbi.nlm.nih.gov/pubmed/23659221/
- Li Y. et al., 2013. BMC Med. Jul 2;11:156. doi: 10.1186/1741-7015-11-156. cf Jul 2;11:156. doi: 10.1186/1741-7015-11-156/
- « La tuberculose dans les prisons » sur le site de l'OMS lire en ligne
- La tuberculose, une tueuse qu’on ne peut garder derrière les barreaux, CICR
- Christiane Kramar, Charles-Albert Baud, « Les calcifications biologiques en archéologie », Bulletins et Mémoires de la Société d'anthropologie de Paris, vol. 2, , p. 165
- (en) Thierry Wirth, Falk Hildebrand, Caroline Allix-Beguec, Florian Wölbeling, Tanja Kubica, Kristin Kremer, Dick van Soolingen, Sabine Rüsch-Gerdes, Camille Locht, Sylvain Brisse, Axel Meyer, Philip Supply, Stefan Niemann. « Origin, Spread and Demography of the Mycobacterium tuberculosis Complex » Plos Pathogens septembre 2008. PMID 18802459
- Communiqué CNRS
- C'est dans les années 1960 que l'on isole une souche particulière du bacille tuberculeux en Afrique, à mi-chemin entre le bacille humain et le bacille bovin (Mycobacterium africanum)
- Diana Gasparon, « Petite histoire des grandes épidémies », Société belge d’histoire de la médecine.
- Patrick Berche, Une histoire des microbes, John Libbey Eurotext, Paris, 2007.
- [PDF] El Ghradi Halima, Les promoteurs de l'esprit scientifique dans la civilisation islamique, Publications de l'Organisation islamique pour l'éducation, les sciences et la culture, I.S.E.S.C.O., 2003.
- Maurice Bariéty, Charles Coury, Histoire de la médecine, Fayard, 1963.
- Patrice Pinet, Pasteur et la philosophie, L'Harmattan, 2004 (ISBN 2-7475-7266-8).
- « De la tuberculose: ou de la phthisie pulmonaire et des autres maladies dites ...Par Louis Villemin », sur books.google.fr (consulté le )
- (en) « Richard Morton (1637-1698) by R.R. Trail » [PDF], sur www.ncbi.nlm.nih.gov (consulté le )
- (en) « Benjamin Marten and his "New Theory of Consumptions". R N Doetsch », sur www.ncbi.nlm.nih.gov (consulté le )
- (en) « Benjamin Marten and his “New Theory of Consumptions” » [PDF], sur mmbr.asm.org (consulté le )
- « Tuberculose », sur www.ambafrance-ma.org (consulté le )
- « La Chronique médicale, Volume 12 (page 802, page 805) », sur books.google.fr (consulté le )
- Ronald Hubscher, Les Maîtres des bêtes. Les vétérinaires dans la société française, XVIIe siècle-XXe siècle, Odile Jacob ,19 mai 1999, p. 91
- (en) « Recherches sur la Phtisie Pulmonaire de Gaspard Laurent Bayle » [PDF], sur www.cbmh.ca (consulté le )
- [PDF]« « Sur les traces de la tuberculose » critères diagnostiques des atteintes tuberculeuses du squelette humain et leur application dans des séries anthropologiques hongroises et françaises », sur phd.okm.gov.hu (consulté le )
- (en) « The white plague: tuberculosis, man, and society Par René Jules Dubos,Jean Dubos (page 153) », sur books.google.fr (consulté le )
- « Petite histoire des Grandes Épidémies de Diana Gasparon (Société Belge d’Histoire de la Médecine) », sur www.ulb.ac.be (consulté le )
- « Premières utilisations dentaires de la Créosote, par Marguerite ZIMMER », sur www.bium.univ-paris5.fr (consulté le )
- (en) « The rise of causal concepts of disease: case histories, Par Kay Codell Carter (page 18) », sur books.google.fr (consulté le )
- (en) « ‘inflaming Infirmity’: Some Medical-Literary Interfaces of 19Th Century Tuberculosis*, by Catherine Moloney » [PDF], sur /www.lmi.org.uk (consulté le )
- (en) « The Decline of Tuberculosis despite "Protective" Vaccination, Par Gerhard Buchwald (page 32) », sur books.google.fr (consulté le )
- (en) « The Evolution of the Sanatorium: The First Half-Century, 1854-1904, by Peter Warren », sur www.cbmh.ca (consulté le )
- (en) « The Evolution of the Sanatorium : The First Half-Century, 1854-1904 by Peter Warren », sur www.cbmh.ca (consulté le )
- (en) « Esmond R. Long, A History of the Therapy of Tuberculosis and the Case of Frederic Chopin... », sur www.persee.fr (consulté le )
- Cette conclusion doit être appréciée au regard de cette autre, rapportée en 1906 dans les archives de parasitologie : « Mais cet expérimentateur ne concluait pas, de l'inoculabilité de la tuberculose par les modes artificiels et peu ménagés de l'infection expérimentale, à la contagiosité naturelle de la maladie. » http://www.archive.org/stream/archivesdeparasi11pari/archivesdeparasi11pari_djvu.txt
- (en) « Mycobacterium tuberculosis and the Cause of Consumption, by John F. Murray », sur ajrccm.atsjournals.org (consulté le )
- (en) « The Aetiology of Tuberculosis By Dr. Robert Koch » [PDF], sur www.deltaomega.org (consulté le )
- « Histoire de l’Union Internationale contre la Tuberculose et les Maladies Respiratoires », sur www.theunion.org (consulté le )
- http://www.archive.org/stream/archivesdeparasi11pari/archivesdeparasi11pari_djvu.txt
- [PDF]« Thèse De Doctorat En Médecine (Diplôme d’état) par Stéphane BALCEROWIAK », sur these.nuxit.net (consulté le )
- (en) « Theabald Smith, 18594934 : A Fiftieth Anniversury Tribute, C.E. Dolman » [PDF], sur www.asm.org (consulté le )
- (en) « Robert Koch’s highs and lows in the search for a remedy for tuberculosis by Stefan H.E. Kaufmann », sur www.nature.com (consulté le )
- « Hôpitaux et hospices de Bordeaux à la Belle époque, Par Jean-Pierre Nérin », sur books.google.fr (consulté le )
- (en) « Studies in Immunization Against Tuberculosis, Par Karl And Silvio Von Ruck Von Ruck », sur books.google.fr (consulté le )
- (en) « The white plague: tuberculosis, man, and society, Par René Jules Dubos,Jean Dubos », sur books.google.fr (consulté le )
- (en) « A Hundred Years of Medicine, Par C. D. Haagensen,Wyndham E. B. Lloyd », sur books.google.fr (consulté le )
- « Les rayons de Röntgen et le diagnostic de la tuberculose, d’Antoine Béclère, 1899 », sur www.bium.univ-paris5.fr (consulté le )
- (en) « Beginning of Military Radiology by R. Van Tiggelen » [PDF], sur www.radiology-museum.be (consulté le )
- « Protection de l'enfance et placement familial. La Fondation Grancher. De l'hygié », sur www.editionspetra.fr (consulté le )
- http://www.archive.org/stream/revuedelatuberc00fragoog/revuedelatuberc00fragoog_djvu.txt
- [PDF]« La communauté pneumologique française face à la prévention des maladies respiratoires par C. Voisin », sur www.ffpneumologie.org (consulté le )
- « Comité national et comités départementaux », sur www.lesouffle.org (consulté le )
- http://www.pasteur.fr/infosci/archives/boq0.html
- N. Rist, F. Bloch et al., « Action du p.aminophénylsulfamide et de la p.diaminodiphénylsulfone sur les cultures des bacilles tuberculeux des mammifères et des oiseaux », C. R. Soc. Biol., 1939
- (en) « H. Corwin Hinshaw Papers, 1925-1994 », sur www.amphilsoc.org (consulté le )
- (en) « REFERENCES », sur ajrccm.atsjournals.org (consulté le )
- (en) « Truth, lies, and public health: how we are affected when science and ... Par Madelon Lubin Fink », sur books.google.fr (consulté le )
- Les pneumologues de l'époque lui préfèrent la collapsothérapie à l'antibiotique supposé rendre sourd.
- (en) R. Doll, « Controlled Trials : The 1948 Watershed », British Medical Journal, no 317, , p. 1217-1223
- Tuberculose : : Il ne faut pas crier victoire trop vite
- "Dans le 9-3, le retour en force de la tuberculose", Jean-Pierre Thiollet, Guillaume Rameaux, France-Soir, 9 mars 2010
- SantéLog TUBERCULOSE : L'OMS adopte un nouveau test de diagnostic ultra-rapide 09-12-2010
Annexes
Articles connexes
Liens externes
- Toute l'information sur la tuberculose en Île-de-France
- [PDF] Dossier sur le site du Comité National contre les Maladies Respiratoires
- Numéro thématique : Le point sur la tuberculose, Bulletin épidémiologique hebdomadaire (BEH), mai 2005, France
- Huchon G, Tuberculose (livre en version électronique)
- Documentaire Tuberculose, une inquiétante résistance, réalisé par Fançois Pomès pour Label News, Public Sénat, et Canal Savoir, 2014


