« Lipide » : différence entre les versions
→Voir aussi : interwiki |
Complément. |
||
| Ligne 533 : | Ligne 533 : | ||
}} {{DOI|10.1016/j.plipres.2005.05.002}}</ref>. |
}} {{DOI|10.1016/j.plipres.2005.05.002}}</ref>. |
||
== Fonctions biologiques == |
|||
== Rôles des lipides dans l'organisme == |
|||
=== Membranes biologiques === |
|||
* Stockage de l'énergie : <br> La molécule fournissant l'énergie permettant les réactions cellulaires de l'organisme est l'[[Adénosine triphosphate | ATP]]. L'[[Adénosine triphosphate | ATP]] est formé directement dans l'organisme. Chez les animaux l'énergie qu'il transporte provient au départ soit des [[glucides]] ([[glycolyse]]) soit des [[lipides]] ([[bêta-oxydation]]) qui après plusieurs réactions chimiques permettent la formation de l'[[acétyl-CoA]] et enfin de l'[[Adénosine triphosphate | ATP]] via le [[cycle de Krebs]]. Les lipides et les glucides sont donc les deux principales sources d'énergie de l'organisme. Les lipides présentent l'avantage de pouvoir être stockés. Les glucides doivent être consommés tout de suite, ou bien l'organisme a la possibilité de synthétiser des lipides afin de stocker l'énergie des glucides non consommés<ref>http://www.snv.jussieu.fr/vie/dossiers/glucose-lipides/gluclip.htm#glulip</ref>. |
|||
* Constitution des [[Membrane (biologie)|membranes]] cellulaires |
|||
{{Article détaillé|membrane (biologie)}} |
|||
* Messager intercellulaire et intracellulaire |
|||
* [[Substrat]] [[métabolique]] |
|||
Les [[Cellule (biologie)|cellules]] d'[[eucaryote]]s sont [[Compartiment cellulaire|compartimentées]] en [[organite]]s délimités par des [[Membrane (biologie)|membranes]] et qui réalisent différentes fonctions biologiques. Les principaux constituants de ces membranes sont les [[phosphoglycéride]]s : c'est le cas par exemple dans les [[Membrane plasmique|membranes plasmiques]] et le [[système endomembranaire]]. Ce sont des [[molécule]]s [[amphiphile]]s, c'est-à-dire qu'elles possèdent à la fois une région [[hydrophile]] — un [[Résidu (biochimie)|résidu]] de [[glycérol-3-phosphate]] souvent appelé « tête hydrophile » — et une région [[hydrophobe]] souvent appelée « queue hydrophobe » constituée d'[[Acide gras|acides gras]]. Les membranes contiennent également des lipides autres que les phosphoglycérides, notamment les [[sphingomyéline]]s et les [[stérol]]s, ces derniers étant surtout représentés par le [[cholestérol]] chez les [[Animal|animaux]]. |
|||
* Procurent des éléments nutritifs essentiels au fonctionnement du corps. |
|||
* Etc. |
|||
Les membranes biologiques s'organisent autour d'une [[bicouche lipidique]], constituée de deux feuillets parallèles dans lesquels les phosphoglycérides s'orientent pour présenter leur tête hydrophile au contact de l'eau et leurs queues hydrophobes au contact de l'autre feuillet. La formation d'une telle bicouche est [[thermodynamique]]ment favorable lorsque des phosphoglycérides se trouvent en [[milieu aqueux]] : c'est l'{{Lien|lang=en|trad=Hydrophobic effect|fr=effet hydrophobe}}<ref name="PMID 2087221"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = P. M. Wiggins |
|||
| titre = Role of water in some biological processes |
|||
| périodique = Microbiology and Molecular Biology Reviews |
|||
| volume = 54 |
|||
| numéro = 4 |
|||
| jour = |
|||
| mois = décembre |
|||
| année = 1990 |
|||
| pages = 432-449 |
|||
| url texte = http://mmbr.asm.org/content/54/4/432.full.pdf+html |
|||
| consulté le = 26 juin 2016 |
|||
| doi = |
|||
| pmid = 2087221 |
|||
| pmc = 372788 |
|||
}}</ref> ; l'orientation et la distribution spatiale des [[Molécule d'eau|molécules d'eau]] autour d'une telle bicouche est étroitement conditionnée par la configuration des molécules amphiphiles qui la composent, de sorte que ces molécules d'eau forment des sortes de « [[clathrate]]s » autour des lipides solvatés<ref name="10.1073/pnas.0500225102"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = |
|||
| titre = Nonpolar solutes enhance water structure within hydration shells while reducing interactions between them |
|||
| périodique = Proceedings of the National Academy of Sciences of the United States of America |
|||
| volume = 102 |
|||
| numéro = 19 |
|||
| jour = 10 |
|||
| mois = mai |
|||
| année = 2005 |
|||
| pages = 6777-6782 |
|||
| url texte = http://www.pnas.org/content/102/19/6777 |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1073/pnas.0500225102 |
|||
| pmid = 15867152 |
|||
| pmc = 1100774 |
|||
}}</ref>. De telles bicouches tendent également à se refermer sur elles mêmes, formant des [[Vésicule (biologie)|vésicules]]. Selon la concentration en lipides, leur interaction biophysique peut conduire à la formation de [[micelle]]s, de [[liposome]]s ou de surfaces membranaires. D'autres modes d'agrégation sont également observés et relèvent du polymorphisme des molécules amphiphiles. Le comportement des phases lipidiques est un domaine d'étude en biophysique et fait l'objet de recherches académiques<ref name="10.1038/nrm2330"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Gerrit van Meer, Dennis R. Voelker et Gerald W. Feigenson |
|||
| titre = Membrane lipids: where they are and how they behave |
|||
| périodique = Nature Reviews Molecular Cell Biology |
|||
| volume = 9 |
|||
| numéro = 2 |
|||
| jour = |
|||
| mois = février |
|||
| année = 2008 |
|||
| pages = 112-124 |
|||
| url texte = http://www.nature.com/nrm/journal/v9/n2/full/nrm2330.html |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1038/nrm2330 |
|||
| pmid = 18216768 |
|||
| pmc = 2642958 |
|||
}}</ref>{{,}}<ref name="10.1038/nchembio1106-560"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Gerald W. Feigenson |
|||
| titre = Phase behavior of lipid mixtures |
|||
| périodique = Nature Chemical Biology |
|||
| volume = 2 |
|||
| numéro = 11 |
|||
| jour = |
|||
| mois = novembre |
|||
| année = 2006 |
|||
| pages = 560-563 |
|||
| url texte = http://www.nature.com/nchembio/journal/v2/n11/full/nchembio1106-560.html |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1038/nchembio1106-560 |
|||
| pmid = 17051225 |
|||
| pmc = 2685072 |
|||
}}</ref>. Selon certaines théories, la formation de {{Lien|trad=Protocell|lang=en|fr=Protocellule|texte=protocellules}} délimitées par une membrane lipidique serait une étape de l'[[abiogenèse]]<ref name="10.1023/A:1006746807104"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Daniel Segré, Dafna Ben-Eli, David W. Deamer et Doron Lancet |
|||
| titre = The Lipid World |
|||
| périodique = Origins of life and evolution of the biosphere |
|||
| volume = 31 |
|||
| numéro = 1 |
|||
| jour = |
|||
| mois = février |
|||
| année = 2001 |
|||
| pages = 119-145 |
|||
| url texte = http://link.springer.com/article/10.1023%2FA%3A1006746807104 |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1023/A:1006746807104 |
|||
| pmid = 11296516 |
|||
| pmc = |
|||
}}</ref>. |
|||
Chez les [[plante]]s, les membranes de [[thylakoïde]]s sont particulièrement riches en monogalactosyl diglycérides (MGDG), qui ne forment pas spontanément de [[bicouche lipidique]] mais entrent néanmoins dans de telles structures en interagissant avec les [[caroténoïde]]s et les [[chlorophylle]]s des membranes de thylakoïdes<ref name="10.1007/BF02703373"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = R. C. Yashroy |
|||
| titre = Lamellar dispersion and phase separation of chloroplast membrane lipids by negative staining electron microscopy |
|||
| périodique = Journal of Biosciences |
|||
| volume = 15 |
|||
| numéro = 2 |
|||
| jour = |
|||
| mois = juin |
|||
| année = 1990 |
|||
| pages = 93-98 |
|||
| url texte = https://www.researchgate.net/publication/230820037_Lamellar_dispersion_and_phase_separation_of_chloroplast_membrane_lipids_by_negative_staining_electron_microscopy |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1007/BF02703373 |
|||
| pmid = |
|||
| pmc = |
|||
}}</ref>, de sorte que les membranes des thylakoïdes s'organisent en bicouche lipidique dynamique<ref name="10.1007/BF02702669"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = R. C. Yashroy |
|||
| titre = Magnetic resonance studies of dynamic organisation of lipids in chloroplast membranes |
|||
| périodique = Journal of Biosciences |
|||
| volume = 15 |
|||
| numéro = 1990 |
|||
| jour = |
|||
| mois = décembre |
|||
| année = 1990 |
|||
| pages = 281-288 |
|||
| url texte = http://link.springer.com/article/10.1007/BF02702669 |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1007/BF02702669 |
|||
| pmid = |
|||
| pmc = |
|||
}}</ref> ; elles contiennent en revanche peu de [[phospholipide]]s. |
|||
=== Stockage d'énergie métabolique === |
|||
Les [[triglycéride]]s stockés dans le [[tissu adipeux]] est la principale forme de stockage de l'énergie chez les [[Animal|animaux]] et les [[plante]]s. Les [[adipocyte]]s sont les [[Cellule (biologie)|cellules]] chargées de la [[Anabolisme|synthèse]] et de la [[Catabolisme|dégradation]] des triglycérides chez les animaux, dont la dégradation est essentiellement contrôlée par la [[lipase hormonosensible]]<ref name="10.1194/jlr.R700014-JLR200"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Dawn L. Brasaemle |
|||
| titre = ''Thematic review series: Adipocyte Biology''. The perilipin family of structural lipid droplet proteins: stabilization of lipid droplets and control of lipolysis |
|||
| périodique = Journal of Lipid Research |
|||
| volume = 48 |
|||
| numéro = 12 |
|||
| jour = |
|||
| mois = décembre |
|||
| année = 2007 |
|||
| pages = 2547-2559 |
|||
| url texte = http://www.jlr.org/content/48/12/2547.full.pdf+html |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1194/jlr.R700014-JLR200 |
|||
| pmid = 17878492 |
|||
| pmc = |
|||
}}</ref>. L'[[oxydation]] complète des [[Acide gras|acides gras]], essentiellement par [[Bêta-oxydation|β-oxydation]], fournit davantage d'énergie — sous forme d'[[Adénosine triphosphate|ATP]] — que celle des [[glucide]]s et des [[protéine]]s : environ {{unité/2|37|[[Kilojoule|kJ]]||g|-1}} contre {{unité/2|17|[[Kilojoule|kJ]]||g|-1}} respectivement<ref>http://www.snv.jussieu.fr/vie/dossiers/glucose-lipides/gluclip.htm#glulip</ref>. Les triglycérides sont par exemple le carburant utilisé par les [[Oiseau migrateur|oiseaux migrateurs]] pour assurer leurs vols à longue distance. |
|||
=== Signalisation cellulaire === |
|||
{{Article détaillé|signalisation lipidique}} |
|||
Ce n'est qu'assez récemment qu'a été établi le rôle déterminant de la [[signalisation lipidique]] comme composante de la [[signalisation cellulaire]]<ref name="10.1016/j.pbi.2004.03.012"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Xuemin Wang |
|||
| titre = Lipid signaling |
|||
| périodique = Current Opinion in Plant Biology |
|||
| volume = 7 |
|||
| numéro = 3 |
|||
| jour = |
|||
| mois = juin |
|||
| année = 2004 |
|||
| pages = 329-336 |
|||
| url texte = http://www.sciencedirect.com/science/article/pii/S1369526604000445 |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1016/j.pbi.2004.03.012 |
|||
| pmid = 15134755 |
|||
| pmc = |
|||
}}</ref>{{,}}<ref name="10.1093/bioinformatics/btr190"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Ashok Reddy Dinasarapu, Brian Saunders, Iley Ozerlat3 Kenan Azam et Shankar Subramaniam |
|||
| titre = Signaling gateway molecule pages—a data model perspective |
|||
| périodique = Bioinformatics |
|||
| volume = 27 |
|||
| numéro = 12 |
|||
| jour = 15 |
|||
| mois = juin |
|||
| année = 2011 |
|||
| pages = 1736-1738 |
|||
| url texte = http://bioinformatics.oxfordjournals.org/content/27/12/1736.full.pdf+html |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1093/bioinformatics/btr190 |
|||
| pmid = 21505029 |
|||
| pmc = 3106186 |
|||
}}</ref>. La signalisation lipidique peut faire intervenir des [[Récepteur couplé aux protéines G|récepteurs couplés aux protéines G]] ou des [[Récepteur nucléaire|récepteurs nucléaires]], et différents types de lipides ont été identifiés comme molécules de signalisation cellulaire et comme [[Messager secondaire|messagers secondaires]]<ref name="10.1152/advan.00088.2006"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Kathleen M. Eyster |
|||
| titre = The membrane and lipids as integral participants in signal transduction: lipid signal transduction for the non-lipid biochemist |
|||
| périodique = Advances in Physiology Education |
|||
| volume = 31 |
|||
| numéro = 1 |
|||
| jour = |
|||
| mois = mars |
|||
| année = 2007 |
|||
| pages = 5-16 |
|||
| url texte = http://advan.physiology.org/content/31/1/5 |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1152/advan.00088.2006 |
|||
| pmid = 17327576 |
|||
| pmc = |
|||
}}</ref>. On compte parmi eux la [[sphingosine-1-phosphate]], un [[sphingolipide]] issu d'un [[céramide]] et agissant comme un puissant messager intervenant dans la régulation de la mobilisation du [[calcium]]<ref name="PMID 18951299"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = V. Hinkovska-Galcheva, S. M. VanWay, T. P. Shanley et R. G. Kunkel |
|||
| titre = The role of sphingosine-1-phosphate and ceramide-1-phosphate in calcium homeostasis |
|||
| périodique = Current Opinion in Investigational Drugs |
|||
| volume = 9 |
|||
| numéro = 11 |
|||
| jour = |
|||
| mois = |
|||
| année = 2008 |
|||
| pages = 1192-1205 |
|||
| url texte = |
|||
| consulté le = 26 juin 2016 |
|||
| doi = |
|||
| pmid = 18951299 |
|||
| pmc = |
|||
}}</ref>, dans la croissance des [[Cellule (biologie)|cellules]] et dans l'[[apoptose]]<ref name="10.1007/978-1-4020-8831-5_16"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Sahar A. Saddoughi, Pengfei Song et Besim Ogretmen |
|||
| titre = Roles of Bioactive Sphingolipids in Cancer Biology and Therapeutics |
|||
| périodique = Lipids in Health and Disease |
|||
| volume = 49 |
|||
| numéro = |
|||
| jour = |
|||
| mois = |
|||
| année = 2008 |
|||
| pages = 413-440 |
|||
| url texte = |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1007/978-1-4020-8831-5_16 |
|||
| pmid = 18751921 |
|||
| pmc = 2636716 |
|||
}}</ref> ; les [[diglycéride]]s et les [[phosphatidylinositol]] phosphates (PIP), qui interviennent dans l'activation de la {{Lien|lang=en|trad=Protein kinase C|fr=protéine kinase C}}<ref name="10.2741/2756"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Christian Klein et Anant N. Malviya |
|||
| titre = Mechanism of nuclear calcium signaling by inositol 1,4,5-trisphosphate produced in the nucleus, nuclear located protein kinase C and cyclic AMP-dependent protein kinase |
|||
| périodique = Frontiers in Bioscience |
|||
| volume = 13 |
|||
| numéro = |
|||
| jour = |
|||
| mois = janvier |
|||
| année = 2008 |
|||
| pages = 1206-1226 |
|||
| url texte = https://www.bioscience.org/2008/v13/af/2756/list.htm |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.2741/2756 |
|||
| pmid = 17981624 |
|||
| pmc = |
|||
}}</ref> ; les [[prostaglandine]]s, qui sont des [[eicosanoïde]]s impliqués dans les processus [[Inflammation|inflammatoires]] et [[Immunité|immunitaires]]<ref name="10.2174/156652408785160989"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Joshua A. Boyce |
|||
| titre = Eicosanoids in asthma, allergic inflammation, and host defense |
|||
| périodique = Current Molecular Medicine |
|||
| volume = 8 |
|||
| numéro = 5 |
|||
| jour = |
|||
| mois = août |
|||
| année = 2008 |
|||
| pages = 335-349 |
|||
| url texte = http://www.eurekaselect.com/openurl/content.php?genre=article&issn=1566-5240&volume=8&issue=5&spage=335 |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.2174/156652408785160989 |
|||
| pmid = 18691060 |
|||
| pmc = |
|||
}}</ref> ; les [[Hormone stéroïdienne|hormones stéroïdiennes]] telles que l'[[œstrogène]], la [[testostérone]] et le [[cortisol]], qui régulent les diverses fonction du [[métabolisme]], la [[Reproduction (biologie)|reproduction]] et la [[pression artérielle]] ; les {{Lien|lang=en|trad=Oxysterol|fr=Oxystérol|texte=oxystérols}} tels que le 25-hydroxycholestérol, qui sont des [[Agoniste (biochimie)|agonistes]] des [[Récepteur nucléaire des oxystérols|récepteurs nucléaires des oxystérols]]<ref name="10.1111/j.1755-5922.2008.00062.x"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Jerzy Bełtowski |
|||
| titre = Liver X Receptors (LXR) as Therapeutic Targets in Dyslipidemia |
|||
| périodique = Cardiovascular Therapeutics |
|||
| volume = 26 |
|||
| numéro = 4 |
|||
| jour = |
|||
| mois = |
|||
| année = 2008 |
|||
| pages = 297-316 |
|||
| url texte = http://onlinelibrary.wiley.com/doi/10.1111/j.1755-5922.2008.00062.x/abstract |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1111/j.1755-5922.2008.00062.x |
|||
| pmid = 19035881 |
|||
| pmc = |
|||
}}</ref>. |
|||
Les lipides de type [[phosphatidylsérine]] sont connus pour intervenir dans la signalisation de la [[phagocytose]] de cellules apoptotiques. Ils assurent cette fonction en se retrouvant dans le feuillet externe de la [[Membrane plasmique|membrane plasmique]] après inactivation des [[flippase]]s qui positionnent exclusivement dans le feuillet [[cytosol]]ique et activation des [[scramblase]]s qui les font passer d'un feuillet à l'autre : la présence de phosphatidylsérines dans le feuillet externe de la membrane plasmique est reconnue par certaines cellules, qui les phagocytent, de même qu'elles phagocytent d'éventuels fragment cellulaires exposant le feuillet interne de la membrane plasmique<ref name="10.1088/1478-3975/10/6/065007"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Mona Biermann, Christian Maueröder, Jan M Brauner, Ricardo Chaurio, Christina Janko, Martin Herrmann et Luis E Muñoz |
|||
| titre = Surface code—biophysical signals for apoptotic cell clearance |
|||
| périodique = Physical Biology |
|||
| volume = 10 |
|||
| numéro = 6 |
|||
| jour = |
|||
| mois = décembre |
|||
| année = 2013 |
|||
| pages = 065007 |
|||
| url texte = http://iopscience.iop.org/article/10.1088/1478-3975/10/6/065007/meta |
|||
| consulté le = 26 juin 2016 |
|||
| doi = 10.1088/1478-3975/10/6/065007 |
|||
| pmid = 24305041 |
|||
| pmc = |
|||
}}</ref>. |
|||
== Les lipides dans l'[[alimentation humaine]] == |
== Les lipides dans l'[[alimentation humaine]] == |
||
Version du 26 juin 2016 à 19:50



Les lipides constituent la matière grasse des êtres vivants. Ce sont des molécules hydrophobes ou amphiphiles — molécules hydrophobes possédant un domaine hydrophile — très diversifiées, comprenant entre autres les graisses, les cires, les stérols, les vitamines liposolubles, les mono-, di- et triglycérides, ou encore les phospholipides.
Les lipides peuvent se présenter à l'état solide, comme les cires, ou bien liquide, comme les huiles. Leur nature amphiphile conduit les molécules de certains lipides à s'organiser en vésicules, liposomes et micelles lorsqu'elles se trouvent en milieu aqueux. Cette propriété est à la base du vivant, permettant la formation de structures biologiques — cellules, organites — délimitées par des membranes constituées principalement de lipides. Les lipides assurent par ailleurs diverses autres fonctions biologiques[1],[2], notamment de signalisation cellulaire (signalisation lipidique) et de stockage de l'énergie métabolique par lipogenèse, énergie ensuite libérée notamment par β-oxydation.
Les lipides biologiques dérivent essentiellement de deux types de composés jouant le rôle de briques élémentaires, les groupes cétoacyle d'une part et les unités isoprène d'autre part. De ce point de vue, ils peuvent être classés en huit catégories différentes : les acides gras, les acylglycérols, les phosphoglycérides, les sphingolipides, les glycolipides et les polycétides, qui résultent de la condensation de groupes cétoacyle, auxquels s'ajoutent les stérols et les prénols, qui sont produits à partir d'unités isoprène[1].
Bien que le terme lipide soit souvent utilisé comme synonyme de graisse, ces deux termes ne sont pas équivalents car tous les lipides ne sont pas des graisses, lesquelles correspondent stricto sensu aux seuls triglycérides. Les lipides englobent à la fois les acides gras et leurs dérivés — y compris les mono-, di- et triglycérides ainsi que les phospholipides — mais aussi les métabolites comprenant des stérols, comme le cholestérol.
Classification
La classification des lipides est un sujet complexe qui se heurte à la difficulté de définir des critères objectifs permettant de distinguer les lipides des autres classes de molécules organiques. L'IUPAC, par exemple, a publié en 1994[3] une classification des lipides excluant le cholestérol, classé comme terpénoïde[4], bien que le cholestérol soit indiscutablement de nature lipidique pour une très large majorité de biochimistes[5]. La classification des lipides actuellement généralement acceptée[1] établit huit classes, fondées en partie sur les définitions de l'IUPAC.
Acides gras




Les acides gras sont des acides carboxyliques à chaîne aliphatique. Les acides gras naturels possèdent une chaîne carbonée de 4 à 36 atomes de carbone (rarement au-delà de 28) et typiquement en nombre pair. C'est cette chaîne carbonée qui confère aux acides gras leur caractère hydrophobe. Cette classe de molécules biologiques est présente en abondance chez les eucaryotes et les bactéries mais pas chez les archées, ce qui distingue ces dernières des bactéries parmi les procaryotes. La biosynthèse des acides gras est catalysée essentiellement par l'acide gras synthase et repose sur des condensations de Claisen successives d'unités malonyl-CoA ou méthylmalonyl-CoA sur une amorce d'acétyl-CoA.
Divers groupes fonctionnels contenant de l'oxygène, de l'azote, des halogènes ou du soufre peuvent être ajoutés à la chaîne hydrocarbonée des acides gras, qui peut être saturée ou insaturée et présenter dans ce cas une isomérie cis/trans affectant sensiblement la conformation générale des molécules. Les acides gras insaturés naturels adoptent généralement une configuration cis qui tend à courber la chaîne hydrocarbonée et ainsi à fluidifier les bicouches lipidiques en abaissant leur température de fusion ; il existe cependant des acides gras trans naturels, bien qu'ils résultent souvent d'un processus d'hydrogénation industrielle[6].
Certains acides gras ne peuvent être synthétisés en quantité suffisante par l'organisme et doivent alors être apportés entièrement ou partiellement par le régime alimentaire. C'est le cas notamment des acides gras dits « oméga-3 » et « oméga-6 », qui sont dits « essentiels ». Plus précisément, les mammifères sont incapables de synthétiser l'acide α-linolénique (ω-3) et l'acide linoléique (ω-6), mais peuvent en revanche convertir par exemple l'acide α-linolénique en acide docosahexaénoïque (DHA), un ω-3. Ces acides gras agissent de manière complexe dans l'organisme : les métabolites issus des oméga-6 sont pro-inflammatoires, prothrombotiques et hypertenseurs tandis que ceux issus des oméga-3 ont globalement un effet inverse.
Les eicosanoïdes sont un autre exemple d'acides gras qui jouent un rôle physiologique important, cette fois comme vecteurs de signalisation cellulaire (on parle dans ce cas de signalisation lipidique). Issus principalement de l'acide arachidonique et de l'acide eicosapentaénoïque, ils regroupent les prostaglandines, les leucotriènes, la prostacycline et les thromboxanes.
-
Acide palmitique, saturé
-
Acide oléique, insaturé
-
Acide arachidonique, un des précurseurs d'eicosanoïdes
Acylglycérols ou glycérides
Les glycérides sont constitués d'un résidu de glycérol estérifié par un, deux ou trois acides gras, ce qu'on appelle respectivement monoglycérides, diglycérides et triglycérides[7]. Les acides gras d'une même molécule de glycéride sont généralement différents les uns des autres. Ces lipides servent avant tout à stocker de l'énergie métabolique et constituent l'essentiel de la graisse animale. L'hydrolyse des liaisons ester pour libérer le glycérol et les acides gras constitue la première étape de la lipolyse, poursuivie notamment par la β-oxydation.
Certains glycolipides, organisés autour d'un résidu de glycérol lié par une liaison osidique à un ou plusieurs oses, sont considérés comme des glycérides, notamment les digalactosyldiacylglycérols membranaires des plantes[8], qu'on trouve également dans les séminolipides des spermatozoïdes chez les mammifères[9].
Phosphoacylglycérols ou phosphoglycérides

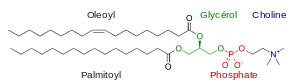
Les phosphoglycérides représentent, avec les sphingolipides, les principaux phospholipides, qui sont les principaux constituants des membranes biologiques — hormis chez les archées — et participent au métabolisme et à la signalisation cellulaire[10]. Les tissus nerveux et le cerveau en contiennent de grandes quantités, et des changements dans leur composition ont été impliqués dans divers troubles neurologiques[11].
Les phosphoglycérides bactériens diffèrent des phosphoglycérides d'eucaryotes par la position stéréochimique du groupe polaire sur le résidu de glycérol, les premiers étant sn-1 tandis que les seconds sont sn-3[12].
Parmi les phosphoglycérides des membranes biologiques se trouvent les phosphatidylcholines (lécithine), les phosphatidyléthanolamines et les phosphatidylsérines. Chez les eucaryotes, les phosphatidylinositols et les acides phosphatidiques jouent un rôle de messager secondaire (ou peuvent être précurseurs de messagers secondaires) en plus de leur rôle structurel dans les membranes. Des étherlipides dérivant structurellement de ces phosphoglycérides jouent également un rôle en signalisation cellulaire chez les eucaryotes, tels que les plasmalogènes, et sont les constituants essentiels des membranes plasmiques chez les archées[13].
Sphingolipides


Les sphingolipides forment un ensemble complexe de composés[14] constitués d'un alcool aliphatique aminé, produit de novo à partir de la sérine et d'une acyl-CoA à longue chaîne, et convertie en céramides, phosphosphingolipides, glycosphingolipides et d'autres composés. Le principal alcool aminé des mammifères est la sphingosine. Les céramides — N-acylsphingoïdes — forment un sous-ensemble important des dérivés sphingoïdes, avec un acide gras lié par une liaison amide. Ces acides gras sont généralement saturés ou mono-insaturés avec une chaîne hydrocarbonée de 16 à 26 atomes de carbone.
Les sphingolipides les plus importants sont les sphingomyélines, des phosphosphingolipides constitués d'un céramide lié à un phosphocholine chez les mammifères[15] ou à une phosphoéthanolamine chez les insectes[16], tandis que les mycètes ont des phytocéramides liés à des groupes inositol phosphate et contenant du mannose[17]. Les glycosphingolipides forment une famille de molécules diversifiée constituées d'un ou plusieurs résidus osidiques liés à la base sphingoïde par une liaison osidique, comme les cérébrosides et les gangliosides.

Saccharolipides ou glycolipides

Les glycolipides résultent de l'estérification d'oses ou de l'amidification d'osamines par des acides gras, formant des structures moléculaires compatibles avec les bicouches lipidiques des membranes biologiques. Dans ces composés, un ose joue le rôle du glycérol pour les glycérides et les phosphoglycérides. Les glycolipides les plus courants sont les acyles de glucosamine précurseurs du lipide A du lipopolysaccharide des bactéries à Gram négatif. Les molécules de lipide A sont généralement des disaccharides de glucosamine, qui peuvent porter jusqu'à sept résidus d'acides gras. Le lipopolysaccharide minimal requis pour le développement d'E. coli est le Kdo2-lipide A, un disaccharide hexa-acétylé de glucosamine glycosylé avec deux molécules d'acide céto-3-désoxy-D-manno-octulosonique (KDO)[18].
Polycétides

Les polycétides sont une famille de molécules naturelles très diversifiées et pourvues de diverses activités biologiques et propriétés pharmacologiques produites par les animaux, les plantes, les bactéries, et les mycètes[19],[20]. Ils comprennent des macrolides, des ansamycines, des polyènes, des polyéthers, des tétracyclines, des acétogénines, ainsi que divers composés tels que l'acide usnique, le discodermolide ou le radicicol. On distingue les polycétides :
- de type I, souvent produits par des mégasynthases multimodulaires, c'est-à-dire de grosses enzymes pourvues de plusieurs sites actifs assurant des réactions différentes et complémentaires ;
- de type II, de nature souvent aromatique et produits par un processus itératif réalisé par un ensemble d'enzymes dissociées ;
- de type III, souvent de petites molécules aromatiques produites par des espèces fongiques.
Ils sont généralement produits par condensation de Claisen d'acétyl-CoA, de propionyl-CoA et d'unités moléculaires dérivées de la malonyl-CoA, selon un processus semblable à celui de la biosynthèse des acides gras[21]. De nombreux polycétides sont des molécules cycliques dont la structure est modifiée par glycosylation, méthylation, hydroxylation, oxydation, voire d'autres réactions. De nombreux composés couramment utilisés comme antimicrobiens, antiparasitaires et anticancéreux sont des polycétides ou leurs dérivés, tels que l'érythromycine, les tétracyclines, les avermectines et les épothilones[22].
Stérols

Les stérols, comme le cholestérol et ses dérivés, sont des constituants importants des membranes biologiques[23], à côté des phosphoglycérides et des sphingomyélines. Les stéroïdes, qui partagent tous le même noyau stérane à quatre cycles fusionnés, sont susceptibles d'agir biologiquement comme hormones et comme vecteurs de signalisation cellulaire (signalisation lipidique). Les stéroïdes à 18 atomes de carbone (C18) comprennent les œstrogènes tandis que les stéroïdes en C19 comprennent les androgènes tels que la testostérone et l'androstérone. Les stéroïdes en C21 comprennent les progestatifs ainsi que les glucocorticoïdes et les minéralocorticoïdes. Les sécostéroïdes, qui comprennent diverses formes de vitamine D (ergocalciférol et cholécalciférol notamment), sont caractérisés par le clivage du cycle B du noyau cyclopentanophénanthrène (stérane)[24]. Les acides biliaires et leurs conjugués sont d'autres exemples de stérols[25] ; chez les mammifères, ce sont des dérivés oxydés du cholestérol produits dans le foie. Chez les plantes, on trouve des phytostérols tels que le β-sitostérol, le stigmastérol, le brassicastérol, ce dernier étant également utilisé comme biomarqueur pour la croissance des algues[26]. L'ergostérol est le principal stérol membranaire chez les mycètes.
-
Nomenclature du stérane
Prénols




Les prénols sont synthétisés à partir de précurseurs à cinq atomes de carbones, l'isopentényl-pyrophosphate (IPP) et le diméthylallyl-pyrophosphate (DMAPP), issus de la voie du mévalonate[27] chez tous les eucaryotes supérieurs et la plupart des bactéries ; chez les plantes, certains protozoaires et la plupart des bactéries (dans ce cas, parallèlement à la voie du mévalonate), ces précurseurs sont issus de la voie du méthylérythritol phosphate.
Les isoprénoïdes simples sont formés par l'addition successive d'unités en C5 et sont classés selon le nombre de ces unités terpène. Les composés contenant plus de 40 atomes de carbone sont appelés polyterpènes.
Les caroténoïdes sont des isoprénoïdes simples importants qui agissent comme des antioxydants et comme précurseurs de la vitamine A[28].
Les quinones et les hydroquinones sont une autre classe de molécules, qui contiennent une chaîne latérale isoprénique attachée à un noyau quinonoïde d'origine non isoprénique[29]. La vitamine E et les vitamines K, ainsi que les ubiquinones, sont des exemples de cette classe.
Les bactéries produisent des polyprénols appelés bactoprénols dans lesquels l'unité isoprénique terminale liée à l'hydroxyle reste insaturée, tandis que les animaux produisent des dolichols dans lequel l'unité isoprénique terminale est réduite[30].
Fonctions biologiques
Membranes biologiques
Les cellules d'eucaryotes sont compartimentées en organites délimités par des membranes et qui réalisent différentes fonctions biologiques. Les principaux constituants de ces membranes sont les phosphoglycérides : c'est le cas par exemple dans les membranes plasmiques et le système endomembranaire. Ce sont des molécules amphiphiles, c'est-à-dire qu'elles possèdent à la fois une région hydrophile — un résidu de glycérol-3-phosphate souvent appelé « tête hydrophile » — et une région hydrophobe souvent appelée « queue hydrophobe » constituée d'acides gras. Les membranes contiennent également des lipides autres que les phosphoglycérides, notamment les sphingomyélines et les stérols, ces derniers étant surtout représentés par le cholestérol chez les animaux.
Les membranes biologiques s'organisent autour d'une bicouche lipidique, constituée de deux feuillets parallèles dans lesquels les phosphoglycérides s'orientent pour présenter leur tête hydrophile au contact de l'eau et leurs queues hydrophobes au contact de l'autre feuillet. La formation d'une telle bicouche est thermodynamiquement favorable lorsque des phosphoglycérides se trouvent en milieu aqueux : c'est l'effet hydrophobe[31] ; l'orientation et la distribution spatiale des molécules d'eau autour d'une telle bicouche est étroitement conditionnée par la configuration des molécules amphiphiles qui la composent, de sorte que ces molécules d'eau forment des sortes de « clathrates » autour des lipides solvatés[32]. De telles bicouches tendent également à se refermer sur elles mêmes, formant des vésicules. Selon la concentration en lipides, leur interaction biophysique peut conduire à la formation de micelles, de liposomes ou de surfaces membranaires. D'autres modes d'agrégation sont également observés et relèvent du polymorphisme des molécules amphiphiles. Le comportement des phases lipidiques est un domaine d'étude en biophysique et fait l'objet de recherches académiques[33],[34]. Selon certaines théories, la formation de protocellules délimitées par une membrane lipidique serait une étape de l'abiogenèse[35].
Chez les plantes, les membranes de thylakoïdes sont particulièrement riches en monogalactosyl diglycérides (MGDG), qui ne forment pas spontanément de bicouche lipidique mais entrent néanmoins dans de telles structures en interagissant avec les caroténoïdes et les chlorophylles des membranes de thylakoïdes[36], de sorte que les membranes des thylakoïdes s'organisent en bicouche lipidique dynamique[37] ; elles contiennent en revanche peu de phospholipides.
Stockage d'énergie métabolique
Les triglycérides stockés dans le tissu adipeux est la principale forme de stockage de l'énergie chez les animaux et les plantes. Les adipocytes sont les cellules chargées de la synthèse et de la dégradation des triglycérides chez les animaux, dont la dégradation est essentiellement contrôlée par la lipase hormonosensible[38]. L'oxydation complète des acides gras, essentiellement par β-oxydation, fournit davantage d'énergie — sous forme d'ATP — que celle des glucides et des protéines : environ 37 kJ·g-1 contre 17 kJ·g-1 respectivement[39]. Les triglycérides sont par exemple le carburant utilisé par les oiseaux migrateurs pour assurer leurs vols à longue distance.
Signalisation cellulaire
Ce n'est qu'assez récemment qu'a été établi le rôle déterminant de la signalisation lipidique comme composante de la signalisation cellulaire[40],[41]. La signalisation lipidique peut faire intervenir des récepteurs couplés aux protéines G ou des récepteurs nucléaires, et différents types de lipides ont été identifiés comme molécules de signalisation cellulaire et comme messagers secondaires[42]. On compte parmi eux la sphingosine-1-phosphate, un sphingolipide issu d'un céramide et agissant comme un puissant messager intervenant dans la régulation de la mobilisation du calcium[43], dans la croissance des cellules et dans l'apoptose[44] ; les diglycérides et les phosphatidylinositol phosphates (PIP), qui interviennent dans l'activation de la protéine kinase C[45] ; les prostaglandines, qui sont des eicosanoïdes impliqués dans les processus inflammatoires et immunitaires[46] ; les hormones stéroïdiennes telles que l'œstrogène, la testostérone et le cortisol, qui régulent les diverses fonction du métabolisme, la reproduction et la pression artérielle ; les oxystérols tels que le 25-hydroxycholestérol, qui sont des agonistes des récepteurs nucléaires des oxystérols[47].
Les lipides de type phosphatidylsérine sont connus pour intervenir dans la signalisation de la phagocytose de cellules apoptotiques. Ils assurent cette fonction en se retrouvant dans le feuillet externe de la membrane plasmique après inactivation des flippases qui positionnent exclusivement dans le feuillet cytosolique et activation des scramblases qui les font passer d'un feuillet à l'autre : la présence de phosphatidylsérines dans le feuillet externe de la membrane plasmique est reconnue par certaines cellules, qui les phagocytent, de même qu'elles phagocytent d'éventuels fragment cellulaires exposant le feuillet interne de la membrane plasmique[48].
Les lipides dans l'alimentation humaine
Les lipides sont consommés après les sucres au niveau de l'intestin. L'alimentation apporte en moyenne 80 g de lipides par jour.
Les lipides sont présents dans l'huile, le beurre, le gras, quelques viandes, poissons, fromages, etc.
- La plupart des lipides alimentaires sont constitués de triglycérides (85 à 95 % des lipides).
- Les lipides sont très énergétiques : ils apportent beaucoup de calories (1 g de lipide apporte 9 kcal soit 38 kJ).
Les lipides sont donc une forme privilégiée de mise en réserve d'énergie, surtout chez les animaux où les lipides sont stockés dans les tissus adipeux. Les lipides sont indispensables au bon fonctionnement de l'organisme mais une nourriture trop riche en graisses favorise les maladies cardio-vasculaires[réf. nécessaire].
Les lipides donnent aux aliments une texture moelleuse et onctueuse. Ils ont de plus un rôle prépondérant dans la perception du goût des aliments.
Les lipides ne se mélangeant pas à l'eau, ils flottent à sa surface.
Digestion des lipides
- La digestion des lipides commence dès l'absorption au niveau de la bouche avec un effet limité, il n'y a pas d'action enzymatique, c'est un rôle mécanique des protéines présentes dans la salive qui sont les mucines (édifices macromoléculaires protéiques). Elles comportent de nombreux résidus glucidiques et par leur viscosité vont permettre de dissocier le bol alimentaire.
- Au niveau de l'estomac on a à la fois un rôle mécanique par brassage, un effet chimique du suc gastrique par son pH acide et une petite activité enzymatique portée par la lipase gastrique qui est une enzyme peu active qui va cliver les TAG en libérant l'acide gras en position 1 (il s'agit d'une enzyme active à pH acide).
- L'essentiel de la digestion des lipides va se produire au niveau de l'intestin (on parle essentiellement des TAG puisqu'on a dit qu'il s'agissait de plus de 90 % des lipides du bol alimentaire). Ces TAG subissent un chemin complexe en aller et retour : dégradation puis re-synthèse de TAG en fonction de leur possibilité de transport.
Tout d’abord ces TAG vont être décomposés donc on a une libération d'acide gras grâce à la présence de sels biliaires et de lipases. C'est sous forme élémentaire que les acides gras et les produits de dégradation seront captés par les cellules intestinales pour être recomposés en TAG. Ils seront ensuite exportés dans des particules associées à des protéines qui sont des lipoprotéines particulières de faible densité qu'on appelle chylomicrons.
Les chylomicrons rejoignent alors les tissus périphériques pour se libérer de leur contenu au niveau du tissu adipeux (mise en réserve) ou au niveau musculaire pour une création d'énergie (par bêta-oxydation puis via le Cycle de Krebs).
Notes et références
- (en) Eoin Fahy, Shankar Subramaniam, Robert C. Murphy, Masahiro Nishijima, Christian R. H. Raetz, Takao Shimizu, Friedrich Spener, Gerrit van Meer, Michael J. O. Wakelam et Edward A. Dennis, « Update of the LIPID MAPS comprehensive classification system for lipids », Journal of Lipid Research, vol. 50, , S9-S14 (lire en ligne) DOI 10.1194/jlr.R800095-JLR200
- (en) Shankar Subramaniam, Eoin Fahy, Shakti Gupta, Manish Sud, Robert W. Byrnes, Dawn Cotter, Ashok Reddy Dinasarapu et Mano Ram Maurya, « Bioinformatics and Systems Biology of the Lipidome », Chemical Reviews, vol. 111, no 10, , p. 6452-6490 (lire en ligne) DOI 10.1021/cr200295k
- (en) Glossary of names of organic comounds and reactive intermediates based on structure, International Union of Pure and Applied Chemistry, Orgnanic Division - Commission on Nomenclature of Organic Chemistry, and Commission on Physical Organic Chemistry, 1994
- (en) Voir l'entrée des terpènoïdes sur le site de l'IUPAC
- (en) Konrad Bloch, « discours du 11 décembre 1964 » en recevant le prix Nobel de physiologie ou médecine.
- (en) J. Edward Hunter, « Dietary trans fatty acids: Review of recent human studies and food industry responses », Lipids, vol. 41, no 11, , p. 967-992 (lire en ligne) DOI 10.1007/s11745-006-5049-y
- (en) Rosalind A. Coleman et Douglas P. Lee, « Enzymes of triacylglycerol synthesis and their regulation », Progress in Lipid Research, vol. 43, no 2, , p. 134-176 (lire en ligne) DOI 10.1016/S0163-7827(03)00051-1
- (en) Georg Hölzl, « Structure and function of glycoglycerolipids in plants and bacteria », Progress in Lipid Research, vol. 46, no 5, , p. 225-243 (lire en ligne) DOI 10.1016/j.plipres.2007.05.001
- (en) Koichi Honke, Yanglong Zhang, Xinyao Cheng, Norihiro Kotani et Naoyuki Taniguchi, « Biological roles of sulfoglycolipids and pathophysiology of their deficiency », Glycoconjugate Journal, vol. 21, nos 1-2, , p. 59-62 (lire en ligne) DOI 10.1023/B:GLYC.0000043749.06556.3d
- (en) Michael J. Berridge et Robin F. Irvine, « Inositol phosphates and cell signalling », Nature, vol. 341, , p. 197-205 (lire en ligne) DOI 10.1038/341197a0
- (en) Akhlaq A Farooqui, Lloyd A Horrocks et Tahira Farooqui, « Glycerophospholipids in brain: their metabolism, incorporation into membranes, functions, and involvement in neurological disorders », Chemistry and Physics of Lipids, vol. 106, no 1, , p. 1-29 (lire en ligne) DOI 10.1016/S0009-3084(00)00128-6
- (en) Pavlina T. Ivanova, Stephen B. Milne, Mark O. Byrne, Yun Xiang et H. Alex Brown, « Glycerophospholipid Identification and Quantitation by Electrospray Ionization Mass Spectrometry », Methods in Enzymology, vol. 432, , p. 21–57 (lire en ligne) DOI 10.1016/S0076-6879(07)32002-8
- (en) Fritz Paltauf, « Ether lipids in biomembranes », Chemistry and Physics of Lipids, vol. 74, no 2, , p. 101-139 (lire en ligne) DOI 10.1016/0009-3084(94)90054-X
- (en) Alfred H. Merrill Jr. et Konrad Sandhoff, « Chapter 14 Sphingolipids: metabolism and cell signaling », New Comprehensive Biochemistry, Biochemistry of Lipids, Lipoproteins and Membranes, 4e édition, vol. 36, , p. 373–407 (lire en ligne) DOI 10.1016/S0167-7306(02)36016-2
- (en) Taro Hori et Mutsumi Sugita, « Sphingolipids in lower animals », Progress in Lipid Research, vol. 32, no 1, , p. 25-45 (lire en ligne) DOI 10.1016/0163-7827(93)90003-F
- (en) Herbert Wiegandt, « Insect glycolipids », Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism, vol. 1123, no 2, , p. 117-126 (lire en ligne) DOI 10.1016/0005-2760(92)90101-Z
- (en) Xueli Guan, Markus R. Wenk, « Biochemistry of inositol lipids », Frontiers in Bioscience, vol. 13, , p. 3239-3251 (lire en ligne) DOI 10.2741/2923
- (en) Christian R. H. Raetz, Teresa A. Garrett, C. Michael Reynolds, Walter A. Shaw, Jeff D. Moore, Dale C. Smith Jr., Anthony A. Ribeiro, Robert C. Murphy, Richard J. Ulevitch, Colleen Fearns, Donna Reichart, Christopher K. Glass, Chris Benner, Shankar Subramaniam, Richard Harkewicz, Rebecca C. Bowers-Gentry, Matthew W. Buczynski, Jennifer A. Cooper, Raymond A. Deems et Edward A. Dennis, « Kdo2-Lipid A of Escherichia coli, a defined endotoxin that activates macrophages via TLR-4 », Journal of Lipid Research, vol. 47, , p. 1097-1111 (lire en ligne) DOI 10.1194/jlr.M600027-JLR200
- (en) Christopher T. Walsh, « Polyketide and Nonribosomal Peptide Antibiotics: Modularity and Versatility », Science, vol. 303, no 5665, , p. 1805-1810 (lire en ligne) DOI 10.1126/science.1094318
- (en) Patrick Caffrey, Jesus F. Aparicio, Francisco Malpartida et Sergey B. Zotchev, « Biosynthetic Engineering of Polyene Macrolides Towards Generation of Improved Antifungal and Antiparasitic Agents », Current Topics in Medicinal Chemistry, vol. 8, no 8, , p. 639-653 (lire en ligne) DOI 10.2174/156802608784221479
- (en) John A. Robinson, « Polyketide Synthase Complexes: Their Structure and Function in Antibiotic Biosynthesis », Philosophical Transactions of the Royal Society Biological Sciences, vol. 332, no 1263, , p. 107-114 (lire en ligne) DOI 10.1098/rstb.1991.0038
- (en) Robert E. Minto et Brenda J. Blacklock, « Biosynthesis and function of polyacetylenes and allied natural products », Progress in Lipid Research, vol. 47, no 4, , p. 233-306 (lire en ligne) DOI 10.1016/j.plipres.2008.02.002
- (en) Diana Bach et Ellen Wachtel, « Phospholipid/cholesterol model membranes: formation of cholesterol crystallites », Biochimica et Biophysica Acta (BBA) - Biomembranes, vol. 1610, no 2, , p. 187-197 (lire en ligne) DOI 10.1016/S0005-2736(03)00017-8
- (en) Roger Bouillon, Annemieke Verstuyf, Chantal Mathieu, Sophie Van Cromphaut, Ritsuko Masuyama, Petra Dehaes et Geert Carmeliet, « Vitamin D resistance », Best Practice & Research Clinical Endocrinology & Metabolism, vol. 20, no 4, , p. 627-645 (lire en ligne) DOI 10.1016/j.beem.2006.09.008
- (en) David W. Russell, « THE ENZYMES, REGULATION, AND GENETICS OF BILE ACID SYNTHESIS », Annual Review of Biochemistry, vol. 72, , p. 137-174 (lire en ligne) DOI 10.1146/annurev.biochem.72.121801.161712
- (en) Jennifer C. Villinski, John M. Hayes, Simon C. Brassella, Virginia L. Riggert et Robert B. Dunbar, « Sedimentary sterols as biogeochemical indicators in the Southern Ocean », Organic Geochemistry, vol. 39, no 5, , p. 567–588 (lire en ligne) DOI 10.1016/j.orggeochem.2008.01.009
- (en) Tomohisa Kuzuyama et Haruo Seto, « Diversity of the biosynthesis of the isoprene units », Natural Product Reports, vol. 20, no 2, , p. 171-183 (lire en ligne) DOI 10.1039/B109860H
- (en) A.V. Rao et L.G. Rao, « Carotenoids and human health », Pharmacological Research, vol. 55, no 3, , p. 207-216 (lire en ligne) DOI 10.1016/j.phrs.2007.01.012
- (en) Anders Brunmark et Enrique Cadenas, « Redox and addition chemistry of quinoid compounds and its biological implications », Free Radical Biology and Medicine, vol. 7, no 4, , p. 435-477 (lire en ligne) DOI 10.1016/0891-5849(89)90126-3
- (en) Ewa Swiezewska et Witold Danikiewicz, « Polyisoprenoids: Structure, biosynthesis and function », Progress in Lipid Research, vol. 44, no 4, , p. 235-258 (lire en ligne) DOI 10.1016/j.plipres.2005.05.002
- (en) P. M. Wiggins, « Role of water in some biological processes », Microbiology and Molecular Biology Reviews, vol. 54, no 4, , p. 432-449 (PMID 2087221, PMCID 372788, lire en ligne)
- (en) « Nonpolar solutes enhance water structure within hydration shells while reducing interactions between them », Proceedings of the National Academy of Sciences of the United States of America, vol. 102, no 19, , p. 6777-6782 (PMID 15867152, PMCID 1100774, DOI 10.1073/pnas.0500225102, lire en ligne)
- (en) Gerrit van Meer, Dennis R. Voelker et Gerald W. Feigenson, « Membrane lipids: where they are and how they behave », Nature Reviews Molecular Cell Biology, vol. 9, no 2, , p. 112-124 (PMID 18216768, PMCID 2642958, DOI 10.1038/nrm2330, lire en ligne)
- (en) Gerald W. Feigenson, « Phase behavior of lipid mixtures », Nature Chemical Biology, vol. 2, no 11, , p. 560-563 (PMID 17051225, PMCID 2685072, DOI 10.1038/nchembio1106-560, lire en ligne)
- (en) Daniel Segré, Dafna Ben-Eli, David W. Deamer et Doron Lancet, « The Lipid World », Origins of life and evolution of the biosphere, vol. 31, no 1, , p. 119-145 (PMID 11296516, DOI 10.1023/A:1006746807104, lire en ligne)
- (en) R. C. Yashroy, « Lamellar dispersion and phase separation of chloroplast membrane lipids by negative staining electron microscopy », Journal of Biosciences, vol. 15, no 2, , p. 93-98 (DOI 10.1007/BF02703373, lire en ligne)
- (en) R. C. Yashroy, « Magnetic resonance studies of dynamic organisation of lipids in chloroplast membranes », Journal of Biosciences, vol. 15, no 1990, , p. 281-288 (DOI 10.1007/BF02702669, lire en ligne)
- (en) Dawn L. Brasaemle, « Thematic review series: Adipocyte Biology. The perilipin family of structural lipid droplet proteins: stabilization of lipid droplets and control of lipolysis », Journal of Lipid Research, vol. 48, no 12, , p. 2547-2559 (PMID 17878492, DOI 10.1194/jlr.R700014-JLR200, lire en ligne)
- http://www.snv.jussieu.fr/vie/dossiers/glucose-lipides/gluclip.htm#glulip
- (en) Xuemin Wang, « Lipid signaling », Current Opinion in Plant Biology, vol. 7, no 3, , p. 329-336 (PMID 15134755, DOI 10.1016/j.pbi.2004.03.012, lire en ligne)
- (en) Ashok Reddy Dinasarapu, Brian Saunders, Iley Ozerlat3 Kenan Azam et Shankar Subramaniam, « Signaling gateway molecule pages—a data model perspective », Bioinformatics, vol. 27, no 12, , p. 1736-1738 (PMID 21505029, PMCID 3106186, DOI 10.1093/bioinformatics/btr190, lire en ligne)
- (en) Kathleen M. Eyster, « The membrane and lipids as integral participants in signal transduction: lipid signal transduction for the non-lipid biochemist », Advances in Physiology Education, vol. 31, no 1, , p. 5-16 (PMID 17327576, DOI 10.1152/advan.00088.2006, lire en ligne)
- (en) V. Hinkovska-Galcheva, S. M. VanWay, T. P. Shanley et R. G. Kunkel, « The role of sphingosine-1-phosphate and ceramide-1-phosphate in calcium homeostasis », Current Opinion in Investigational Drugs, vol. 9, no 11, , p. 1192-1205 (PMID 18951299)
- (en) Sahar A. Saddoughi, Pengfei Song et Besim Ogretmen, « Roles of Bioactive Sphingolipids in Cancer Biology and Therapeutics », Lipids in Health and Disease, vol. 49, , p. 413-440 (PMID 18751921, PMCID 2636716, DOI 10.1007/978-1-4020-8831-5_16)
- (en) Christian Klein et Anant N. Malviya, « Mechanism of nuclear calcium signaling by inositol 1,4,5-trisphosphate produced in the nucleus, nuclear located protein kinase C and cyclic AMP-dependent protein kinase », Frontiers in Bioscience, vol. 13, , p. 1206-1226 (PMID 17981624, DOI 10.2741/2756, lire en ligne)
- (en) Joshua A. Boyce, « Eicosanoids in asthma, allergic inflammation, and host defense », Current Molecular Medicine, vol. 8, no 5, , p. 335-349 (PMID 18691060, DOI 10.2174/156652408785160989, lire en ligne)
- (en) Jerzy Bełtowski, « Liver X Receptors (LXR) as Therapeutic Targets in Dyslipidemia », Cardiovascular Therapeutics, vol. 26, no 4, , p. 297-316 (PMID 19035881, DOI 10.1111/j.1755-5922.2008.00062.x, lire en ligne)
- (en) Mona Biermann, Christian Maueröder, Jan M Brauner, Ricardo Chaurio, Christina Janko, Martin Herrmann et Luis E Muñoz, « Surface code—biophysical signals for apoptotic cell clearance », Physical Biology, vol. 10, no 6, , p. 065007 (PMID 24305041, DOI 10.1088/1478-3975/10/6/065007, lire en ligne)
Voir aussi
Articles connexes
- Lipogenèse
- Biosynthèse des acides gras
- β-oxydation
- Classification des lipides
- Indice chimique
- Test d'émulsion






