« Développement et recherche de médicaments contre la Covid-19 » : différence entre les versions
→Mai 2020 : Une étude mondiale publiée dans le journal médical ''The Lancet'' sur des malades en covid19 qui ont consommé de l'hydroxicloroquine suggèrent également que le produit augmente le risque de mourir |
|||
| Ligne 341 : | Ligne 341 : | ||
Le 14 mai, le ''[[British Medical Journal]]'' (''BMJ'') publie deux études, l'une menée par des chercheurs français<ref>{{Article |langue=anglais |auteur1= |titre=Clinical efficacy of hydroxychloroquine in patients with covid-19 pneumonia who require oxygen: observational comparative study using routine care data |périodique=British Medical Journal (BMJ) |date=14 mai 2020 |issn= |lire en ligne=https://www.bmj.com/content/369/bmj.m1844 |pages= }}</ref> et l'autre menée par une équipe chinoise<ref>{{Article |langue=anglais |auteur1= |titre=Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial |périodique=British Medical Journal (BMJ) |date=14 mai 2020 |issn= |lire en ligne=https://www.bmj.com/content/369/bmj.m1849 |pages= }}</ref>, qui concluent à l'inefficacité de l'hydroxychloroquine contre le Covid-19<ref>{{Article |langue=français |auteur1= |titre=Coronavirus : deux études concluent à l'inefficacité de l'hydroxychloroquine contre le Covid-19 |périodique=France Info |date=15 mai 2020 |issn= |lire en ligne=https://www.francetvinfo.fr/sante/maladie/coronavirus/coronavirus-l-hydroxychloroquine-n-est-pas-efficace-selon-deux-etudes_3965293.html |pages= }}</ref>. |
Le 14 mai, le ''[[British Medical Journal]]'' (''BMJ'') publie deux études, l'une menée par des chercheurs français<ref>{{Article |langue=anglais |auteur1= |titre=Clinical efficacy of hydroxychloroquine in patients with covid-19 pneumonia who require oxygen: observational comparative study using routine care data |périodique=British Medical Journal (BMJ) |date=14 mai 2020 |issn= |lire en ligne=https://www.bmj.com/content/369/bmj.m1844 |pages= }}</ref> et l'autre menée par une équipe chinoise<ref>{{Article |langue=anglais |auteur1= |titre=Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial |périodique=British Medical Journal (BMJ) |date=14 mai 2020 |issn= |lire en ligne=https://www.bmj.com/content/369/bmj.m1849 |pages= }}</ref>, qui concluent à l'inefficacité de l'hydroxychloroquine contre le Covid-19<ref>{{Article |langue=français |auteur1= |titre=Coronavirus : deux études concluent à l'inefficacité de l'hydroxychloroquine contre le Covid-19 |périodique=France Info |date=15 mai 2020 |issn= |lire en ligne=https://www.francetvinfo.fr/sante/maladie/coronavirus/coronavirus-l-hydroxychloroquine-n-est-pas-efficace-selon-deux-etudes_3965293.html |pages= }}</ref>. |
||
Une étude mondiale publiée dans le journal médical ''The Lancet'' sur des malades en covid19 qui ont consommé de l'hydroxicloroquine suggère également que le produit augmente le risque de mourir<ref name="cure-increases-deaths">https://www.theguardian.com/science/2020/may/22/hydroxychloroquine-trumps-covid-19-cure-increases-deaths-global-study-finds</ref>. |
Une étude mondiale publiée dans le journal médical ''[[The Lancet]]''<ref>{{Article |langue=English |prénom1=Mandeep R. |nom1=Mehra |prénom2=Sapan S. |nom2=Desai |prénom3=Frank |nom3=Ruschitzka |prénom4=Amit N. |nom4=Patel |titre=Hydroxychloroquine or chloroquine with or without a macrolide for treatment of COVID-19: a multinational registry analysis |périodique=The Lancet |volume=0 |numéro=0 |date=2020-05-22 |issn=0140-6736 |issn2=1474-547X |doi=10.1016/S0140-6736(20)31180-6 |lire en ligne=https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31180-6/abstract |consulté le=2020-05-22 }}</ref> sur des malades en covid19 qui ont consommé de l'hydroxicloroquine suggère également que le produit augmente le risque de mourir<ref name="cure-increases-deaths">https://www.theguardian.com/science/2020/may/22/hydroxychloroquine-trumps-covid-19-cure-increases-deaths-global-study-finds</ref>. Cette étude s'intéresse au sort de 96000 malades de covid 19 dans 671 hôpitaux qui ont consommé un produit |
||
| ⚫ | avec ou sans antibiotique tel que l'azithromycine, entre le 20 Décembre et le 14 Avril<ref name="cure-increases-deaths" />. Elle suggère deux inconvénients à la prise de ce produit par des personnes malades de covid 19: un risque accru de décéder d'une part, et un risque accru d'arythmie d'autre part: |
||
Cette étude s'intéresse au sort de 96000 malades de covid 19 dans 671 hôpitaux qui ont consommé un produit |
|||
avec ou sans antibiotique tel que l'azithromycine, entre le 20 Décembre et le 14 Avril<ref name="cure-increases-deaths" />. |
|||
| ⚫ | |||
{| class="wikitable sortable" |
{| class="wikitable sortable" |
||
Version du 22 mai 2020 à 23:19

Le développement et la recherche de médicaments contre la Covid-19 sont les processus visant à développer un vaccin préventif ou un médicament sous ordonnance thérapeutique qui atténuerait la gravité de la maladie à coronavirus 2019 (Covid-19).
Dans le monde, au 21 avril 2020, plus de 500 essais cliniques étaient déjà enregistrés (internationaux ou nationaux)[1], et en mars une soixantaine de sociétés pharmaceutiques et de biotechnologie, de groupes de recherche universitaires et d'organismes de santé étaient impliqués dans le développement d'un vaccin ou d'un médicament[2],[3],[4],[5]. La Coalition for Epidemic Preparedness Innovations (CEPI) a pour cela lancé un fonds ayant comme but de lever 2 milliards de dollars américains[6], s'engageant à investir 100 millions de dollars américains dans des vaccins[réf. nécessaire]. Plusieurs composés antiviraux sont en cours de réutilisation ou font l'objet de nouveaux efforts de recherche clinique pour soulager la Covid-19 en mars 2020[7],[8],[9],[10].
L'Organisation mondiale de la santé (OMS)[11], l'Agence européenne des médicaments (AEM)[12], la Food and Drug Administration (FDA) des États-Unis[13], le gouvernement chinois et les fabricants de médicaments[14] se coordonnent avec les universitaires et des chercheurs de l'industrie pour accélérer le développement de vaccins, de médicaments antiviraux et de thérapies par anticorps monoclonaux[15],[16].
Créer des vaccins et médicaments passe par plusieurs étapes (avec généralement plus de cinq ans pour garantir l'innocuité et l'efficacité du nouveau composé)[17],[18]. En février 2020, l'OMS n'attend pas de vaccin contre le SARS-CoV-2 (le virus responsable de la Covid-19) avant en moins de dix-huit mois[19]. Plusieurs agences nationales de réglementation, telles que l'AEM et la FDA, approuvent des procédures pour accélérer les tests cliniques[20],[21].
En mars 2020, trois traitements antiviraux potentiels (le favipiravir, le remdésivir et le ritonavir) sont au stade final des tests sur l'homme[7],[9] (phase III des essais cliniques) et plusieurs vaccins possibles sont entrés dans la première étape des évaluations de sécurité (phase I[8],[22]). Le , les Centres pour le contrôle et la prévention des maladies (CDC) des États-Unis émettent un avis médical concernant le remdésivir pour les personnes hospitalisées pour une pneumonie aiguë causée par la Covid-19 : « alors que les essais cliniques sont essentiels pour établir la sécurité et l'efficacité de ce médicament, les cliniciens n'ayant pas accès à un essai clinique peuvent demander le remdésivir pour une autorisation temporaire d'utilisation auprès du fabricant pour les patients atteints de pneumonie clinique[23] ».
Fin avril 2020, les experts américains du NIH concluent des données cliniques disponibles qu'à part les soins de soutien, « rien ne marche très bien »[24].
Recherche pré-clinique sur les médicaments contre la Covid-19
Le terme « recherche pré-clinique » est défini par des études en laboratoire in vitro et in vivo, indiquant une étape initiale pour le développement d'un vaccin, d'une thérapie par anticorps monoclonaux[22], comme des expériences pour déterminer les doses efficaces et la toxicité, avant qu'un composé candidat soit mis en avant pour l'évaluation de l'innocuité et de l'efficacité chez l'homme[25],[26]. Compléter le stade pré-clinique du développement du médicament (puis être testé pour l'innocuité et l'efficacité chez un nombre adéquat de personnes infectées par la Covid-19 (des centaines à des milliers dans différents pays) est un processus qui nécessitera probablement 1-2 ans pour des vaccins et thérapies contre la Covid-19, selon plusieurs rapports au début de 2020[15],[19],[27],[28]. Malgré ces efforts, le taux de réussite des candidats-médicaments à une éventuelle approbation réglementaire par le biais du processus de développement de médicaments pour le traitement des maladies infectieuses est de 19 % et, pour les candidats-vaccins en particulier, de seulement 11,5 %[29].
Rationalisation du développement du médicament
Au cours de la période 2018-2020, de nouvelles initiatives visant à stimuler le développement de vaccins et de médicaments antiviraux ont inclus des partenariats entre des organisations gouvernementales et l'industrie, telles que l'Initiative européenne en matière de médicaments innovants[30], la Critical Path Initiative des États-Unis pour améliorer l'innovation dans le développement de médicaments[31] et la désignation « traitement révolutionnaire » pour accélérer le développement et l'examen réglementaire des médicaments candidats prometteurs[32]. D'ici , la Coalition internationale pour les innovations en matière de préparation aux épidémies (CEPI) s'est engagée à investir 100 millions de dollars dans le développement de vaccins dans plusieurs pays[réf. nécessaire].
Criblage à haut débit
Pour trouver des candidats-médicaments parmi des millions de molécules et composés possibles, une approche qui se développe avec le progrès de la bio informatique et de la Protéomique est celle du criblage virtuel (ou criblage in silico).
Un criblage virtuel phytochimique a été lancé pour deux « cibles moléculaires » (Protéase principale (Mpro) et enzyme de conversion de l'angiotensine 2 dite ACE2 dont les caractéristiques sont disponibles dans la Chimiothèque/banque de données de protéine RCBS[33]. Huit scientifiques italiens ont recherché quels composés pourraient le mieux se lier chimiquement à l'une ou l'autre des deux cibles dans un pool de 318 composés végétaux de 11 plantes connues pour leurs propriétés antivirales, antibactérienne et/ou antifongique. Les 10 meilleurs composés ont été sélectionnés pour chacune des deux cibles au vu de leur score énergétique de liaison (une énergie de liaison plus faible entre la molécule et le composé criblé indique une affinité plus élevée, et donc un potentiel médicamenteux, sous réserve que les éventuels effets secondaires soient acceptables)[34]. Ces composés sont à la fois potentiellement biologiquement actifs sur les cibles et solubles dans le sang et capables de passer la barrière intestinale et la barrière hémato-encéphalique[34]. Les auteurs suggèrent de tester ces composés contre le SARS-CoV-2[34]. Les molécules candidates et leurs plantes-mères sont :
- Poivrier long (Piper longum), une liane cousine de la plante qui fournit le poivre noir) : Piperolactam A[34] ;
- Haricot commun (Phaseolus vulgaris) : uercétine 3-glucuronide-7-glucoside, Quercétine 3-vicia-noside, Schaftoside, Chrysoeriol 8-C-glucoside, Isosakuranetine 7-O-neohesperidoside, Delphinine din 3-O- glucoside, Pétunidine 3-O-glucoside[34] ;
- Curcuma (Curcuma longa) : Ribo avine[34] ;
- Faux basilic (Ocimum gratissimum ; une herbacée terrestre pérenne pouvant atteindre 2 mètres de haut et dégageant une odeur de clou de girofle) : Acide oléanolique[34] ;
- Giroflier (Syzygium aromaticum) : 3-0-caffeoylquinique[34] ;
- Absinthe (Artemisia absinthium) : Absinthine, Anabsinthine et Acide dicafféoylquinique ;
- Grande Aunée (Inula helenium) : Quercétine-7-O-galactoside, acide 3,5-dicafféoylquinique et acide 3,4,5-tricafféoylquinique[34].
Essais cliniques
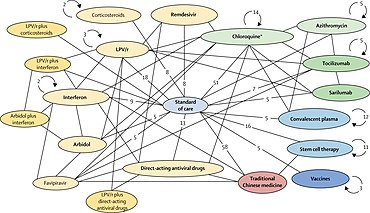
Les ovales (nœud) sont les interventions ou des groupes/types d'intervention (catégories). Les lignes entre deux ovales indiquent des comparaisons entre essais cliniques. Les chiffres sur les lignes désignent le nombre d'essais cliniques faisant la comparaison spécifique. Les flèches circulaires et les chiffres indiquent le nombre d'essais cliniques non comparatifs dans lesquels cette intervention est incluse[1].
* Quelques essais de thérapies combinées ne figurent pas sur la figure par manque de place.
* LPV/r = lopinivir–ritonavir
* inclus les essais sur l'hydroxychloroquine et la chloroquine
Vue générale
En moins de 5 mois, de nombreux essais cliniques (internationaux ou nationaux) ont été lancés (plus de 500 au [1]), dont certains concernent la réutilisation de médicaments préexistants. Parmi les essais, on trouve notamment l'essai mondial Solidarity, l'essai européen Discovery, l'essai français Covidoc, ou l'essai britannique Recovery.
Au 21 avril 2020 fard essais cliniques randomisés ont apportés de premiers résultats sur le lopinavir–ritonavir (norme de soins)[35], l'hydroxychloroquine (soins de soutien)[36], favipiravir par rapport à arbidol[37], et lopinavir – ritonavir par rapport avec l'arbidol[38].
D'autres essais, non randomisés cette fois, ont porté sur l'hydroxychloroquine par rapport à l'hydroxychloroquine combinée à l'azithromycine[39].
Plus de 300 essais vont tester des médicaments et thérapies par exemple à base de remdésivir, d'inhibiteurs de l'interleukine (IL-6) (tocilizumab et sarilumab), la plasmothérapie (à base de plasma ou de sérum de personnes guéries), la transfusion de cellules souches, des vaccins candidats et d'autres antiviraux connus ou la médecine traditionnelle chinoise[1].
Essais chinois
Dès février 2020, au moins deux essais chinois sont publiés, tous deux recommandant la chloroquine en début d'infection : dans le journal Cell Research, recommandant aussi le remdésivir[40] et le en advence publication dans BioScience Trends[41].
Antérieurement, lors de l'épidémie de SRAS de 2003-2004, le Virology Journal avait publié un article des CDC d'Atlanta concluant que la chloroquine est efficace pour empêcher la propagation du SARS CoV, lorsqu'elle est administrée juste après voire avant l'infection[42].
Essai Recovery
L'essai clinique Recovery est enregistré dans l'EU Clinical Trials Register, en tant que EudraCT 2020-001113-21[43].
- un essai britannique a recruté 5 000 malades sur le territoire britannique dans 165 hôpitaux du système de santé national (dénommé NHS). Plus de personnes seront traitées que lors des essais américains et européens[44]. Au , l'essai compte entre 500 et 900 malades dans chaque groupe et 2 000 dans le groupe de contrôle. Il teste diverses molécules, en commençant par les quatre suivants[45] :
- hydroxychloroquine
- azithromycine
- bithérapie lopinavir-ritonavir, marqueté Kaletra,
- dexamethasone en faible dose
Autres molécules :
- Antagonistes de l'interleukine 6 : ils sont cité comme d'autres produits à tester lors de cet essai, comme le tocilizumab, les anticorps de personnes guérie par l'intermédiaire du plasma de convalescents, le remdésivir... Mais le remdésivir est peu disponible pour l'essai britannique en raison de son utilisation dans les essais américains et chinois, et en raison de son utilisation compassionnelle. Alors que ces médicaments restent modestes, des espoirs résident dans la disponibilité d'anticorps[44][pas clair]. Selon Peter Horby, le professeur à l'Université d'Oxford qui pilote l'essai, les résultats déjà disponibles sur l'effet de l'hydroxychloroquine « ne prouvent rien »[44].
- Chlorpromazine (CPZ) : en France, en mai 2020, un « essai thérapeutique pilote de phase III multicentrique, randomisé, contrôlé (traitement standard vs. CPZ + traitement standard) et en simple insu » démarre sur 40 malades, pour tester l'éventuelle capacité de la CPZ à enrayer l’évolution défavorable de l’infection « chez des patients oxygénorequérants sans nécessité de soins en réanimation », et aussi tester un éventuel effet de réduction de la contagiosité du SARS-CoV-2[46]. Ce travail, qui est coordonné par le docteur Marion Plaze[47], teste les propriétés antivirales de la chlorpromazine contre le virus de la COVID-19[46]. On a dans le passé (2007) montré que cette molécule en inhibant l'endocytose dépendante des clathrines pouvait freiner l'introduction du virus dans les cellules[48]. Et deux équipes scientifiques (en 2014 et 2018) avaient déjà montré (sur cultures cellulaires in vitro) des effets de cette molécule contre la duplication des coronavirus du SRAS (maladie émergente apparue en 2002) puis du MERS (apparu en 2012)[46].
En 2020, dans plusieurs pays, les unités psyCOVID ont constaté que leurs patients semblaient développer des formes moins symptomatiques de la COVID que ce qui était statistiquement attendu.
Cette molécule qui est largement distribuée dans l'organisme (salive, poumons et cerveau) est assez bien tolérée, s'est, en 2020, avérée, lors de travaux conduits par l'Institut Pasteur, aussi freiner in vitro la duplication du SARS-CoV-2, tant en cultures de cellules animales qu'humaines ; elle a semblé, dans un service hospitalier de psychiatrie, nettement diminuer la sévérité des symptômes chez certains patients « à risque » (obésité, troubles cardiovasculaires) qui prenaient ce médicament, tant aux stades précoces que tardifs de l'infection[49],[50].
Les premiers résultats de Recovery sont attendus en juin[44].
Essai discovery
Le 22 mars, sous la responsabilité de l'INSERM débute en Europe un essai thérapeutique nommé Discovery. Il est piloté par Florence Ader, infectiologue dans le service des maladies infectieuses et tropicales à l’hôpital de la Croix-Rousse au CHU de Lyon et chercheuse au Centre international de recherche en infectiologie CIRI (Inserm/CNRS /Université Claude-Bernard-Lyon-I). Cet essai va comporter 5 groupes de 800 malades pour tester les traitements suivants[51] :
- soins standards (branche de référence) ;
- soins standards plus Remdésivir ;
- soins standards plus lopinavir et ritonavir;
- soins standards plus lopinavir, ritonavir et interféron bêta ;
- soins standards plus hydroxychloroquine.
Christian Perronne reproche à cet essai de ne pas répondre à la question de l'efficacité du traitement proposé par Didier Raoult, de risquer de retarder une utilisation plus large de la combinaison hydroxychloroquine et azithromycine en France, et d'être incompatible avec l'éthique médicale[52]. Le 6 avril, Olivier Véran déclare sur BFM TV qu'à ce jour aucune étude clinique, y compris Discovery, n'a mis en évidence d'effet statistiquement significatif sur la maladie, y compris l'hydroxychloroquine[53].
Point étape
Le 7 avril, le Dr Ader précise que les premiers résultats seront connus fin avril et que l’analyse des données sera faite par des experts indépendants des médecins[54].
Autres essais, en France
En France, l'essai randomisé Covidoc (impliquant les CHU de Montpellier, Perpignan, Narbonne, Béziers, Sète, Rodez et Nîmes) teste l’efficacité de la bithérapie « hydroxychloroquine + azithromycine »[55]. L'essai Hycovid est piloté par le CHU d'Angers et mené dans 33 hôpitaux français pour mesurer l'efficacité de l'hydroxychloroquine sur patients atteints de formes peu sévères de Covid-19[56],[57].
Essai solidarity
Solidarity Trial est un autre essai clinique, international, initié en 2020 par l'Organisation mondiale de la santé et ses partenaires pour comparer les traitements non testés contre la Covid-19[58]. Les médicaments choisis pour les tests sont le remdesivir, la chloroquine et l'hydroxychloroquine (initialement écartés de l'étude, puis inclus après la médiatisation de ce prétendu traitement dans de nombreux pays), le ritonavir/lopinavir, et l'interféron bêta[59].
Autres essais
- Probiotiques : en Chine, 58 à 71 % des malades avaient reçu une antibiothérapie ; 2 à 36 % des patients ont déclaré des diarrhées, induites par la maladie et/ou les antibiotiques[60],[61],[62]. Pour diminuer les conséquences de ces diarrhées (risque d'infections ultérieures), la prescription de probiotiques a été fréquente, mais une étude rétrospective a montré que 21 jours de Lactobacilli et de Bifidobacteria combinés n'ont pas réduit les diarrhées induites par les antibiotiques[63].
Médicaments et thérapeutiques
Les médicaments contre ce virus se divise en deux groupes : les médicaments ciblant le virus et les médicaments ciblant l’hôte viral. Certains peuvent cibler les deux en même temps.
Au 18 avril 2020, il existait 618 essais en cours concernant le traitement de cette maladie dans la base de donnée de ClinicalTrials.
Prévention post-exposition
La prophylaxie pré-exposition et la prévention post-exposition (PPE) avec des médicaments antiviraux sont des procédures efficaces pour minimiser les infections virologiques, et pourraient l'être pour la Covid-19[64]. La PPE utilisant la rifampicine est recommandée par l'OMS pour les personnes à haut risque d'infection avant ou après une exposition à méningocoque et l'oseltamivir en cas de grippe pandémique[64]. Mais pour l'instant il n’existe aucun médicament pour le SARS-Cov-2.
Thérapeutiques ciblant le virus
Quatre cibles potentiels des médicaments chez le virus : les épines virales (spyke) par lesquelles le virus s'accroche au récepteur membranaire de la cellule respiratoire, l'enveloppe, la membrane et la nucléocapside. Trois types de protéines sont étudiées : les protéines non structurales essentielles (nsp) essentielles au cycle de réplication virale, les protéines structurelles et les protéines accessoires[65]. Le virus ayant une forte affinité avec l'enzyme de conversion de l'angiotensine 2 (ACE2) les inhibiteurs du système de l'angiotensine pourraient avoir un rôle médicamenteux[66],[67].
Protéines non structurales essentielles
À la mi-mars 2020, l'umifénovir était en cours de développement au stade précoce de la recherche en tant qu'agent antiviral post-infectieux[16],[9].
Chez les adultes atteints de Covid-19 sévère hospitalisés à Wuhan, en Chine, le traitement utilisant une combinaison de médicaments antiviraux lopinavir-ritonavir (thérapies contre le VIH / sida) n'a démontré aucun avantage[68],[69]).
Antiviraux en phase III
- Favipiravir : chez les personnes atteintes de Covid-19, le favipiravir (commercialisé sous le nom d'Avigan et approuvé pour une utilisation au Japon en 2014 pour plusieurs maladies virales) s'est révélé sûr et avait une efficacité préliminaire dans un essai de stade précoce à Shenzhen, en Chine[16],[70]. L'Avigan, une version du Favipiravir produite par la société japonaise Toyama Chemical, filiale du conglomérat Fujifilm, est en cours d'approbation pour le traitement du Coronavirus par le Japon, dans certaines conditions et à titre d'essai, ainsi que par la Chine. Sur la base de ces approbations, le gouvernement indonésien a décidé également de faire appel à l'Avigan en mars 2020[71],[72].
- Remdésivir, un antiviral du laboratoire Gilead auparavant testé (sans succès) contre Ebola[73],[74] donne des résultats contadictoires[75]. Le candidat-médicament antivirus de Gilead Sciences fait l'objet de plusieurs essais cliniques, les résultats préliminaires étant attendus en mai 2020[23], et a été lancé dans deux essais d'efficacité de phase III à Hong Kong, Singapour, en Corée du Sud et aux États-Unis en mars 2020[76],[77]. Le , les Centers for Disease Control and Prevention (CDC) des États-Unis ont publié un avis médical concernant le remdésivir pour les personnes atteintes de pneumonie aiguë causée par la Covid-19 : « alors que les essais cliniques sont essentiels pour établir l'innocuité et l'efficacité de ce médicament, les cliniciens sans accès à un essai clinique peuvent demander le remdésivir à des fins compassionnelles auprès du fabricant pour les patients atteints de pneumonie clinique[23] ». Le , des résultats positifs non-publiés sont annoncés aux États-Unis, où une étude non-publiée constate une guérison plus rapide (11 jours au lieu de 15) pour des patients présentant des symptômes graves et traités au remdésivir[78],[75], et la FDA accorde une autorisation d’utilisation pour le remdésivir, permettant aux hôpitaux américains de le prescrire aux malades en réanimation[79]. Pourtant le même jour, The Lancet publie les résultats du premier[80] multicentrique randomisé fait en Chine, en double aveugle et contrôlé par placebo[75]. Des résultats préliminaires décevants de cette étude avaient été annoncés le 24 avril[81]. Selon cet essai (sur 237 adultes volontaires) le temps d'intubation a été légèrement réduit mais pas de manière statistiquement significative, et chez les patients traités dans les 10 jours suivant les premiers symptômes, l'amélioration clinique a été un peu plus rapide, mais pas de manière statistiquement significative ; et au vu des effets secondaires observés (12 % des malades ont arrêté le remdésivir précocement en raison d'événements indésirables, contre 5 % dans le groupe traité par placebo)[82]. L'étude conclut qu'« aucun avantage statistiquement significatif n'a été observé pour le traitement par remdésivir par rapport au traitement standard »[82].
- ASC-09 + ritonavir (comprimé oral) : ASC-09 (produit de la société chinoise Ascletis Pharma Inc.), un inhibiteur de protéase du VIH-1 en combinaison avec le ritonavir, a été lancé dans un essai de phase III en Chine en pour évaluer l'efficacité contre Covid-19[7].
Protéines structurales et protéines accessoires
Anticorps monoclonal
- BDB-1 : c'est un anticorps monoclonal anti-C5a, produit par Staidson Pharmaceuticals, (Pékin) ; il fait l'objet d'un essai clinique de phase II en Chine[7]. D'autres anticorps sont en cours de recherche[83] ;
- Méplazumab : c'est un anticorps anti-CD147 humanisé. Selon un article pré-publié par 30 chercheurs chinois (6 membres de l'Institut de Biotechnologies de Pékin et 24 de la Quatrième université de médecine militaire de Xi'an) cet anticorps peut inhiber la réplication du SRAS-CoV-2, car la « protéine de pointe » de ce virus ne se fixe pas que sur l'ACE2, mais doit aussi reconnaitre la basigine pour se répliquer, une protéine transmembranaire (aussi dite CD147) présente en surface de ses cellules hôtes. Le Méplazumab a été testé in vitro à cet effet contre des virus SARS-CoV-2 infectant des cultures cellulaires[84]. (cultures de cellules Vero E6) et le méplazumab a significativement inhibé l'infection des cellules hôtes en par le virus (avec une CE50 de 24,86 μg/mL et une CI50 de 15,16 μg/mL) ; et la microscopie immunoélectronique, et plusieurs tests (co-immunoprécipitation, test Elisa) ont confirmé que les deux protéines se lient, avec une constante d'affinité évaluée à 1,85 × 10-7M 12.
Selon les auteurs, empêcher cette liaison pourrait être une cible pour des antiviraux spécifiques[85] ;
- Tocilizumab : c'est un anticorps monoclonal humanisé qui bloque l’action des récepteurs de l’interleukine 6, principalement utilisé pour le traitement de la polyarthrite rhumatoïde, mais qui a aussi une indication dans le « syndrome de relargage des cytokines sévère » depuis 2019 quoique avec une amélioration du service médical rendu (ASMR) V[86]. Il a été inclus dans les directives de traitement par la Commission nationale de la santé de la Chine après une étude positive de l'Université de sciences et technologie de Chine[87],[88],[89]. Il subit des tests dans cinq hôpitaux en Italie chez les personnes atteintes d'une forme grave de la maladie[90]. Il a pour objectif de prévenir une complication potentiellement mortelle de la maladie, le choc cytokinique pouvant conduire à un syndrome de défaillance multiviscérale[91] chez les patients présentant des taux sanguins élevés d'indicateurs de réaction inflammatoire[92]. Le , la direction des Hôpitaux de Paris annonce avoir mené un essai clinique de quatorze jours avec des résultats encourageants concernant le traitement des cas graves du Covid-19 avec le tocilizumab[93]. Mais les résultats officiels sont encore en attente de publication[94], et le Canard Enchaîné annonce le 6 mai que le comité de surveillance de cet essai clinique a démissionné en manifestant « sa profonde réserve sur les résultats communiqués » et regrettant « de nombreux dysfonctionnements » dans la conduite de l'étude[95].
Immunothérapie
L'immunothérapie via divers composés d'anticorps obtenus auprès de malades guéris a fait l'objet de plusieurs tests en Chine, aux États-Unis et en France selon différents protocoles[8],[15],[22],[96],[97].
À partir de fin mars-début avril 2020 l’immunothérapie sous forme de sérothérapie a pu être testée aux États-Unis, et elle est assez largement utilisée par les médecins[98], dans la mesure où la FDA a donné son accord pour cet usage thérapeutique du plasma dans le contexte du Covid-19[99]. Néanmoins, si la contagion reste importante, les chercheurs notent que des dizaines de milliers de donneurs humains encore convalescents devraient être mobilisés pour faire face aux besoins. Une campagne de collecte de grande ampleur est lancée aux Etats-Unis par la FDA. Après que plus de 5 000 patients aient été traités avec du plasma, l'équipe de la Clinique Mayo qui coordonne le protocole d'usage clinique conclut que les risques associés à cet usages sont faibles[100],[101]. Un article du journaliste scientifique Cormac Sheridan publié dans Nature début mai synthétise les travaux sur les usages du plasma sanguin dans le contexte du Covid-19[101].
Trois essais américains son en cours, le premier prévoit de perfuser les patients à un stade précoce du développement de la maladie pour voir si cela réduit les risques de devoir passer à des soins intensifs, un second porte sur des cas aigus et le troisième vise à évaluer l'intérêt du plasma des personnes guéries comme outil préventif pour les personnes amenées à être en contact étroit avec des malades confirmés du Covid-19[97].
Essai français
En France, l'essai clinique Coviplasm promu par l’AP-HP consiste à évaluer l'éventuelle efficacité de la transfusion de plasma sanguin de malades guéris[102].
La première phase de l'essai commence le avec le prélèvement par plasmaphérèse de malades français guéris de la Covid-19 dans les régions Île-de-France, Grand Est et Bourgogne-Franche-Comté. L'EFS, prélèvera ainsi 600 ml de plasma chez environ 200 patients volontaires, guéris depuis au moins 14 jours. L'essai porte sur 60 patients dont la moitié bénéficiera du traitement. Ils se verront injecter deux poches de plasma au 6e jour (±1) des symptômes puis, en l'absence d'intolérance, deux autres doses le lendemain. Une évaluation de l'efficacité du traitement sera possible deux à trois semaines après le début de l’essai.
Vaccin contre la Covid-19
Au 9 avril 2020, il existait 115 projets de vaccin. Sur ces 115 projets 78 sont des projets actifs. 73 sont en phase de développement pré clinique et cinq sont à la phase I de développement clinique[103].
| Candidat | Cible du vaccin | Début étude humaine | Développeur principal | Phase | Référence ClinicalTrials |
|---|---|---|---|---|---|
| ARNm-1273 | Vaccin à ARN correspondant aux pics de la surface (couronne) du coronavirus | 03/03/2020 | Moderna Therapeutics | Phase I | NCT04283461 |
| Ad5-nCoV | Vaccin recombinant utilisant comme vecteur adénovirus type 5 et comme antigène la protéine S du SARS-Cov-2 | 16/03/2020 | CanSino Biologicals | Phase I | NCT04313127 |
| INO-4800 | 03/04/2020 | Inovio Pharmaceuticals | Phase I | NCT04336410 | |
| LV-SMENP-DC | Vecteur lentivirus efficace pour stimuler les cellules dendritiques et les lymphocytes T | 24/03/2020 | Shenzhen Geno-Immune Medical Institute | Phase I | NCT04276896 |
| Pathogen-specific aAPC | Vecteur lentivirus | 15/02/2020 | Shenzhen Geno-Immune Medical Institute | Phase I | NCT04299724 |
Début étude humaine : Date à laquelle le premier participant a reçu la première injection
Antagonistes des récepteurs cellulaires σ
Certaines substances antagonistes des récepteurs cellulaires σ[104] ont montré, in vitro, une activité antivirale contre le SRAS-CoV-2[105] et pourraient servir au développement de médicaments. Parmi les molécules étudiées, le PB-28[106] a une forte activité anti-virales comparée aux autres molécules et ce à des doses éloignées de la dose létale médiane pour les cellules.
Phagothérapie
Bien que les virus bactériophages soient des virus qui attaquent spécifiquement les bactéries et sont donc à priori inutiles contre des virus, les bactériophages sont aussi nouvellement étudiés pour combattre le virus de la grippe et maintenant aussi celui du Covid-19, le virus SARS-CoV-2. L'idée est simple: il suffit d'avoir des bactériophages qui s'attachent au virus sur les pointes d'ancrage du virus qu'il utilise normalement pour se fixer aux cellules qu'il va infecter. Ainsi le virus ne peut plus se fixer à une cellule.
L'étude a d'abord été menée sur le virus de la grippe par une équipe de chercheurs de l'Institut de Recherche de Pharmacologie Moléculaire de Leibniz et de l'Université Humboldt de Berlin. Ils ont développé un phage modifié chimiquement pour se lier parfaitement aux pointes d'ancrage (hémagglutinines) du virus grippal. Le virus se trouve alors enveloppé par des capside de phages qui lui rendent impossible de se fixer sur les sucres (acide sialique) des cellules pour les infecter. Le phénomène a été démontré lors d'études pré-cliniques sur du tissu de poumons humains.
La méthode a été étendue à la grippe aviaire avec succès. Elle ouvre la voie à un nouveau type de phagothérapie.
Lorsque le tissu pulmonaire infecté par le virus de la grippe était traité avec des phages, le virus ne pouvait quasiment plus infecter de nouvelles cellules et donc se reproduire. De plus le microscope électronique a montré que les phages enrobaient complètement le virus.
Le phage utilisé est un parasite des bactéries Eschericchia Coli dénommé phage Q-beta.
Les chercheurs appliquent maintenant au SARS-CoV-2[réf. nécessaire] cette découverte qui concernait initialement le virus de la grippe, et qu'ils ont publiée dans le journal Nature[107],[108].
Thérapeutiques ciblant l’hôte
Récepteurs cellulaires
Modulation de l'immunité
Interféron
À la mi-mars 2020, l'Interféron de type I est en cours de développement au stade précoce de la recherche en tant qu'agent antiviral post-infectieux[16],[9].
Lactoferrine
Naturellement présente dans le lait maternel la lactoferrine est disponible comme médicament (sirop, gouttes ou spray nasal, encapsulation glycérosomique ou liposome, sans alcool pour les enfants et la femme enceinte) ou complément alimentaire sous forme de dérivé du lait de vache (LLF pou liposomal bovine lactoferrin).
En raison de ses propriétés antivirales (démontrée pour plusieurs types de virus à ARN ou à ADN), mais aussi en raison de ses propriétés immunomodulatrices et anti-inflammatoires, la lactoferrine a été en 2020 proposée et testée (avec de la vitamine C et du zinc) pour préventivement réduire l'incidence de la COVID-19 mais aussi pour réduire la gravité des symptomes[109],[110],[111],[112].
Lors de l'expérience faite en 2020, la dose était de 64-96 mg (20-30 ml) toutes les 6 h/jour contre la COVID-19 (256-384 mg/j), pouvant être augmentées à 128 mg toutes les 6 h (512 mg) si nécessaire ; alors que préventivement, chez les personnes ayant côtoyé de près un malade de la COVID la dose était de 64 mg (deux à trois fois par jour, soit 128-192 mg/j). Chez la femme enceinte la posologie était de 64 mg (soit 20 ml) deux fois par jour (soit 128 mg/j) réduite à 32 mg (soit 10 ml) deux fois par jour chez le nourrisson (0 à 2 ans). Ce traitement était accompagné de zinc (Sirop) 10-30 mg/j (soit 10-30 ml). Les gouttes nasales (nano LF) à raison de deux gouttes par narine toutes les 4 à 6 heures pour les cas aigus semblent rapidement soulager la sinusite aiguë et les altérations de l'odorat et du goût tout en aidant à contenir la toux sèche.
Vitamine C
D'autres coronavirus sont responsables de rhumes et d'infections respiratoires pour lesquels une supplémentation en vitamine C ne réduit pas le risque de contracter l'infection, mais semble pouvoir en réduire la durée et la gravité, y compris en cas d'évolution vers une pneumonie[113],[114]. Des études d'éventuels effets de la vitamine C sur la Covid-19 ont donc été encouragées[115],[116].
Un essai clinique randomisé sur 167 patients d'une unité de soins intensifs, a conclu que la perfusion intraveineuse de vitamine C à haute dose vs placebo pendant 96 heures n'a eu aucun effet significatif dans le score d'évaluation de défaillance d'organes à 96 heures ou dans les niveaux de biomarqueurs tels que la protéine C réactive et la thrombomoduline après 168 heures. Chez les patients atteints de septicémie et de SDRA, ce traitement, par rapport au placebo, n'a pas significativement réduit les scores de défaillance multiorganique à 96 heures, ni amélioré les taux de biomarqueurs à 168 heures[117].
Vitamine D
Le déficit en vitamine D est fortement corrélé à l'augmentation de l’incidence de différentes maladies[118] mais souvent sans que l'on sache si la carence est une cause ou un effet. Ce déficit peut être induit, entre autres, par le manque d’exposition de la peau au soleil[118]. Il a été observé que la supplémentation en vitamine D réduit le risque de développer certaines maladies respiratoires et la forme grave de la maladie Covid-19[119],[120],[121],[122] ; elle semble atténuer la réponse inflammatoire excessive (tempête de cytokine) induite par le système immunitaire inné face au SRAS-CoV-2[123]. Son importance expliquerait la morbidité et la mortalité plus élevées en hiver, dans les pays nordiques et chez les personnes à peau foncée vivant dans les régions tempérées et nordiques[121]. La disponibilité de cette vitamine dans l’organisme diminuant avec l'âge, sa carence pourrait contribuer à la grande vulnérabilité des personnes âgées face à la COVID[118].
Zinc
Le manque de zinc conduit à un mauvais fonctionnement du système immunitaire[124],[125],[126], en particulier du système immunitaire inné[127]. La maladie Covid-19 induite par le coronavirus SARS-CoV-2 pourrait être aggravée par le manque de zinc[128],[129]. Différents médecins[130],[131] ont préconisé l'ajout de zinc pour soit pallier le déficit de zinc[132], soit améliorer l’efficacité des médicaments utilisés[133],[134]. Il est à noter que les personnes qui risquent le plus de développer une forme grave[135]de la maladie Covid-19 sont plus sujettes à avoir un déficit en zinc[136],[137],[138],[139].
Azithromycine et zinc
Le service CheckNews du journal Libération a expliqué le 15 avril qu'aucune étude scientifique n'étayait les affirmations virales selon lesquelles l’azithromycine (utilisée seule) ou d'autres antibiotiques de la famille des macrolides ont « un intérêt pour un patient Covid, un effet sur le virus, ou que ça permet d’éviter des formes graves de la maladie. [...] c’est de la rumeur, voire de la fausse information »[140].
Trois médecins (Jean-Jacques Erbstein, Denis Gastaldi et Olivia Van Steen Berghe) proposent un traitement basé sur l'azithromycine, un antibiotique de la famille des macrolides, donc l'action est renforcée par un apport de zinc pour prévenir les formes graves de la maladie[141], en particulier pour prévenir les co-infection bactériennes[142],[143]. Erbstein et Gastaldi sont menacés de procédures disciplinaires par le conseil national de l’Ordre des médecins pour avoir expérimenté ces protocoles en dehors de la législation en vigueur[144] ; de même que leur consœur le docteur Sabine Paliard-Franco[145] qui a été amenée à retirer ses communications publiques[146].
Le , selon L'Est républicain, trois médecins concluent à partir d'une étude sans groupe contrôle qu'il est possible de traiter les patients Covid-19 en administrant au début de la maladie l'azithromycine seule, sans association avec l'hydroxychloroquine : « Coïncidence, fruits du hasard, je ne sais pas… En tout cas, ça a l’air de bien se passer ». Sur environ 160 patients, l'azithromycine (antibiotique de la famille des macrolides) associée à du zinc leur a permis d'éviter les hospitalisations[130],[147]. Cette observation de bons résultats obtenus avec un macrolide avait déjà été mise en avant par une généraliste, qui avait publié, fin mars, son retour d'expérience sur le site de la Société Française de Gériatrie et Gérontologie (SFGG) : « Les patients ont tous reçu au moins un Macrolide (Zithromax, Zeclar, Rulid ou Josacine) et dans les cas présentant une pneumopathie mal tolérée, une association avec une C3G (Ceftriaxone) ou Cefpodoxime »[148],[147],[149].
Le 12 mai, deux études américaines successives dont une publiée dans le New England Journal of Medicine et l'autre dans le JAMA établissent que le traitement à l'hydroxychloroquine, à l'azithromycine, ou aux deux combinés, « n'était pas significativement associé à des différences de mortalité » par rapport aux malades qui n'avaient pas reçu ces médicaments[150].
Dans les années 2010, dans le cadre de la recherche de contre-mesures thérapeutiques et prophylactiques contre les virus du SARS puis du MERS, il a été proposé de cibler deux protéases coronavirales essentielles pour la réplication coronavirale : la « protéase de type papaïne » (PLpro) et la « protéase de type 3C » (3CLpro)[151]. Quand le virus se fait répliquer dans une cellule, ces deux petites molécules protéases (PLpro et 3CLpro) traitent la polyprotéine virale de manière coordonnée, mais on a découvert que la « protéase de type papaïne » (PLpro) a une autre fonction : supprimer l'ubiquitine et l'ISG15 des protéines de la cellule hôte pour aider le coronavirus à échapper à l'immunité innée de l'hôte. Un antiviral (encore à découvrir) ciblant PLpro pourrait donc à la fois inhiber la réplication virale, et la dérégulation des cascades de signalisation au sein des cellules infectées (phénomène entraînant la mort cellulaire de cellules voisines pas encore infectées)[151].
Contrôle de l'autophagie
L'autophagie est l'une des réponses cellulaires normales aux anomalies qui apparaissent dans une cellule.
Des autophagosomes sont chargés de transporter des organites cellulaires et notamment des protéines devenus inutiles ou dégradées ou mal conformées vers les lysosomes pour la dégradation et le recyclage ou élimination des acides aminés ou autres molécules qu'ils contiennent[152]. La dégradation par autophagie est aussi l'une des formes de défense innée contre les virus qui sont alors emprisonnés et digérés dans la cellule même[152].
Mais au cours de l'évolution, certains virus ont intégré un gène (ex. : nsp6 chez certains coronavirus) leur permettant de reprogrammer à leur profit la machinerie (intracellulaire) de l'autophagie : il utilisent les autophagosomes pour acheminer et produire les protéines de réplicase[152]. C'est le cas pour certains coronavirus tels que le virus de la bronchite infectieuse aviaire (IBV) qui est un coronavirus aviaire ; le virus de l'hépatite de la souris qui infecte des mammifère ou le virus du syndrome respiratoire aigu sévère ou SARS-CoV-1 qui infecte l'Homme[152].
Empêcher le virus d'utiliser de détourner à son profit la machinerie de l'autophagie est une piste médicamenteuse qui avait été envisagée à la suite de la pandémie de SRAS[152], à nouveau soulevée en 2020 dans le cadre de la pandémie de COVID-19[153],[154].
Inhibiteurs du récepteur des androgènes
Des indices, (notamment un sex-ratio défavorables aux hommes par rapport aux femmes en termes de gravité de la maladie) laissent penser que le récepteur des androgènes doit être activé pour que le virus puisse correctement pénétrer la cellule et s'y faire dupliquer. Début avril 2020, Goren & al. ont proposé[155] qu'une étude épidémiologique s'intéresse aux personnes prédisposées (ethniquement, génétiquement ou pathologiquement) à une surexpression ou à une sous-expression du récepteur des androgènes (ex : hommes souffrant d'alopécie d'origine androgénique, d'hyperplasie bénigne de la prostate ; femmes souffrant du syndrome des ovaires polykystiques). En effet, si le récepteur des androgènes est bien en cause, on dispose déjà de plusieurs classes de médicaments le ciblant (antagonistes du récepteur des androgènes, inhibiteurs de la synthèse des androgènes et antigonadotrophines)[155]. Par exemple, le finastéride inhibiteur de la 5-alpha réductase (approuvé par la FDA) inhibe l'activation de ce récepteur dans plusieurs tissus[156], et d'autres molécules potentiellement actives pourraient être l'acétate de cyprotérone,l'acétate de mégestrol, l'acétate de chlormadinone, la spironolactone, la médrogestone, l'oxendolone, l'osatérone, lacétate de bifluranol, le flutamide, le bicalutamide, l' nilutamide, le topilutamide, l'enzalutamide, l'apalutamide, le diénogest, la drospirénone, la médrogestone, l'acétate de nomegestrol, la promégestone, la trimegestone, le kétoconazole, l'acétate d'abiratérone, le sévitéronel, l'aminoglutéthimide, l'isotéride, notamment[155] et sous réserve que leurs éventuels effets positifs dépassent leurs effets négatifs.
Autres molécules
- Brilacidine : un antibiotique d'Innovation Pharmaceuticals Inc., fait l'objet d'un essai clinique de phase II[2] ;
- Kevzara : Sanofi et Regeneron ont commencé un essai de sécurité de phase I pour tester si cet anti-inflammatoire déjà approuvé, peut réduire les symptômes de la Covid-19[157].
Chloroquine et hydroxychloroquine
La pandémie de Covid-19, début 2020, a relancé l’intérêt pour la chloroquine et l'hydroxychloroquine comme antiviraux potentiels, alors que des études sur le SRAS de 2002 ont semblé montrer leur efficacité, mais uniquement in vitro[158]. La mesure de leur efficacité contre le virus SARS-CoV-2 in vivo est encore discutée[159],[160]. L'hydroxychloroquine a bénéficié d'une large promotion sur les média-sociaux[161], et cet emballement médiatique a entravé la réalisation des essais cliniques[162],[163].
Février 2020
Le 4 février, une lettre, publiée par le journal Nature, écrite par quatre chercheurs du Laboratoire d'État de virologie de Wuhan (abrité par l'Académie chinoise des sciences), relate l'efficacité in vitro de la chloroquine pour inhiber le virus (au moment de sa fixation sur la cellule et après son entrée). Mais seul un essai in vitro est présenté, et il a été réalisé sur une culture de cellules humaines cancéreuses (qui ne sont pas la cible normale du virus dans l'organisme)[164]. Les auteurs postulent que les activités antivirale et immunomodulatrice de la chloroquine pourraient in vivo agir synergiquement (ce qui ne s'est pas produit jusqu'alors lors d'essais contre d'autres virus, au contraire même dans un cas où l'effet a été inverse (in vivo, mais sur le modèle animal) commenteront plus tard les CDC américains[23].
Le 19 février, dans une courte lettre publiée par la revue BioScience Trends (avant une publication[165] qui sera faite le 29 février), trois pharmacologues chinois expliquent que le phosphate de chloroquine a « montré une efficacité apparente et une innocuité acceptable contre la pneumonie associée au Covid-19 dans des essais cliniques multicentriques menés en Chine »[165]. Ils recommandent de l'inclure dans la prochaine version des « Lignes directrices pour la prévention, le diagnostic et le traitement de la pneumonie causée par Covid-19 » publiées par la Commission nationale de la santé[165].
Le lendemain (le 20 février 2020) un rapport du Ministère provincial des sciences et de la technologie et de la Commission de la santé et de santé de la province du Guangdong explique que le phosphate de chloroquine « améliore le taux de réussite du traitement et raccourcit la durée du séjour à l'hôpital du patient » ; le rapport la recommande pour les formes légères, modérées et graves de Covid-19[166],[167] Dans les semaines suivantes la chloroquine ou l'hydroxychloroquine seront testées, utilisées ou recommandées par les autorités sanitaires chinoises, sud-coréennes et italiennes contre la Covid-19[168].
Le 25 février, en France le professeur Didier Raoult prédit une « fin de partie » pour le virus dans une vidéo intitulée « Coronavirus : fin de partie ! » ainsi que la Covid-19 « est probablement l’infection respiratoire la plus facile à traiter »[169], puis recommandant l'association chloroquine-azithromycine[170],[171],[172]. Sa déclaration est vivement critiquée par des médecins et scientifiques français sur les réseaux sociaux pour son manque de pondération[173] vis-à-vis de la limitation des données cliniques et des effets secondaires de la chloroquine. L'Inserm tempère également et rappelle qu'aucune prise de médicament, quel qu'il soit n'est anodine, et qu'il ne faut pas se faire prescrire la molécule pour l’utiliser en automédication[174],[175].
Mars 2020
Début mars 2020, il y a consensus sur l'efficacité des deux médicaments in vitro mais pas encore in vivo, faute de preuves claires et statistiquement convaincantes. Le 3 mars 2020, le Journal of Zhejiang University (Medical Science) publie une étude randomisée en double aveugle sur un petit nombre de patients (quinze témoins plus quinze testés) pour évaluer l'efficacité et la sécurité de l'hydroxychloroquine dans le traitement des patients atteints de la Covid-19. Les résultats montrent que la dose standard de traitement par sulfate d'hydroxychloroquine (400 mg, une fois par jour) n'a pas montré d'effets cliniques dans l'amélioration des symptômes des patients et l'accélération de la suppression virologique[176],[177]. Selon, une étude publiée le 9 mars dans Clinical Infection Disease, l'hydroxychloroquine se montre plus puissante que la chloroquine in vitro, sur culture de cellules cancéreuses humaines, avec un « profil de sécurité plus tolérable »[178], Yao & al. posant l'hypothèse qu'en tant qu'immunomodulateurs, ces deux substances actives pourraient combattre la tempête de cytokines qui, dans les cas graves, induit une défaillance multiviscérale souvent mortelle[179]. Le 10 mars, une analyse de la littérature conclut que « la chloroquine semble être efficace pour limiter la réplication du SRAS-CoV-2 in vitro ». Les auteurs estiment que « des justifications, des preuves précliniques d'efficacité, et des preuves d'innocuité provenant d'une utilisation clinique de longue durée pour d'autres indications » justifient une recherche clinique pour des patients atteints de Covid-19. Cependant précisent-ils « l'utilisation clinique doit soit adhérer au cadre d'utilisation surveillée des interventions non enregistrées (MEURI), soit être éthiquement approuvée comme essai, comme indiqué par l'Organisation mondiale de la santé. Il est urgent de disposer de données de sécurité et de données issues d'essais cliniques de haute qualité »[180].
Mi-mars un essai surmédiatisé conduit à l'IHU de Marseille par Didier Raoult, rapporte un effet bénéfique de l'hydroxychloroquine et de l'azithromycine en termes de réduction de la charge virale[181],[182]. Selon le Pr Raoult, l'hydroxychloroquine semble la plus efficace quand elle est prise tôt (comme le Tamiflu dans le cas de la grippe) ou associée à l'azithromycine pour éviter les risques de surinfection[182]. Son efficacité, si elle est prescrite après la déclaration de la pneumonie, n'est pas clairement établie. Et aux doses prescrites, ce médicament peut générer des effets secondaires problématiques et mal connus car il n'a pas — jusqu’ici — cliniquement été utilisé contre des virus[183]. Le , Didier Raoult diffuse sur les réseaux sociaux une vidéo dans laquelle il annonce à ses étudiants les résultats positifs de son étude[184],[185]. Le , le journal Les Échos titre : « Exclusif - Coronavirus : On sait guérir la maladie »[186]. L'étude est publiée le [187],[188] et provoque un emballement médiatique.
La communauté scientifique exprime très rapidement de fortes réserves sur la qualité de ce travail[189],[190],[191],[192]. En effet, compte tenu de l'urgence, il n'a concerné qu'un petit nombre de patients (26), dont 6 (soit 23 %) ont été exclus de l'essai et ont arrêté précocement leur traitement (l'un a quitté l'hôpital parce qu'il était testé négatif, un autre a dû interrompre le traitement pour cause d'effets secondaires, trois ont dû être transférés en soins intensifs, et enfin un patient est décédé[193]). L'étude n'est pas randomisée, sans double aveugle ni groupe placebo (les cas contrôles et les cas traités ne sont pas dans le même état initial) ce qui fausse ses résultats[194],[195]. Il y manque la description de l'état clinique des patients, le processus de validation éditoriale est raccourci[196] et potentiellement biaisé par un conflit d'intérêts, l'un de ses auteurs, J. M. Rolain, étant également éditeur en chef[197] de la revue International Journal of Antimicrobial Agents où l'étude est publiée. La société savante propriétaire du journal réfute l'accusation de conflit d'intérêts mais estime que l'article ne satisfait pas aux exigences de qualité scientifique[198] ; un nouveau communiqué le , joint avec l'éditeur du journal annonce qu'un examen indépendant déterminera si les préoccupations concernant le contenu de la recherche de l'article sont fondées, et qu'en fonction de l'évolution de cette procédure, une correction de l'article pourra être envisagée[199]. Xavier Lescure, infectiologue à l'hôpital Bichat, juge cette étude « méthodologiquement délirante », mettant en cause le mode de sélection de patients, l'exclusion de l'étude de certains d'entre eux ayant évolué vers la réanimation ou étant décédés, et la « communication débridée » qui entraîne les patients à réclamer leur Plaquénil et ralentit les essais cliniques[200]. Le , CNN rapporte les propos d'autorités médicales de l'État de New York qui qualifient l'étude en question d'« échec complet » et de « pathétique »[201].
Selon Renaud Piarroux, une étude chinoise randomisée, réalisée sur deux groupes de 15 patients présentant des formes bénignes (avec ou sans hydroxychloroquine) n'a montré absolument aucun bénéfice de l'hydroxychloroquine[202].
Le 18 mars , sur la chaîne américaine Fox News, un avocat se présentant faussement comme un conseiller de la Stanford University School of Medicine déclare que la chloroquine guérit 100 % des malades[203]. Le lendemain, le président des États-Unis présente cette substance active comme un remède miracle[204] entraînant un premier mort dû à une automédication avec un produit de nettoyage pour aquarium contenant de la chloroquine[205].
Le 19 mars 2020, convaincu par l'étude de Didier Raoult, Donald Trump annonce avoir « approuvé » le recours à la chloroquine et à l'hydroxychloroquine qui, selon lui, ont « montré des résultats préliminaires très encourageants » contre la Covid-19[206] et déclare « je suis un malin ; je le sens bien »[207]. Il est immédiatement contredit par la FDA, qui promet néanmoins de lancer « un essai clinique étendu »[208],[209]. La substance active, après avoir été initialement écartée[210], est ajoutée par l’OMS dans les recherches prioritaires contre le nouveau coronavirus, et un essai randomisé débute dans plusieurs centres français[194].
Le 21 mars, le site internet des CDC note que « sur la base de données in vitro et anecdotiques limitées, la chloroquine ou l'hydroxychloroquine sont actuellement recommandées pour le traitement des patients hospitalisés Covid-19 dans plusieurs pays »[23], ajoutant que le profil d'innocuité de ces médicaments sont connus, tout en rappelant les risques de cardiotoxicité (syndrome du QT prolongé) et liés aux problèmes de foie, de rein ou d'immunosuppression, et notant que ces médicaments « auraient été bien tolérés chez les patients Covid-19 ». Les CDC ajoutent qu'en raison d'une efficacité in vitro contre le SRAS-CoV-2 et parce que plus disponible aux États-Unis que la chloroquine, l'hydroxychloroquine a été administrée à des patients hospitalisés pour Covid-19 « sans contrôle dans plusieurs pays, y compris aux États-Unis. Une petite étude a rapporté que l'hydroxychloroquine seule ou en association avec l'azithromycine réduisait la détection de l'ARN du SRAS-CoV-2 dans les échantillons des voies respiratoires supérieures par rapport à un groupe témoin non randomisé, mais n'a pas évalué le bénéfice clinique […] L'hydroxychloroquine est actuellement à l'étude dans des essais cliniques pour la prophylaxie pré-exposition ou post-exposition de l'infection par le SRAS-CoV-2 et le traitement des patients atteints de Covid-19 léger, modéré et sévère. Aux États-Unis, plusieurs essais cliniques d'hydroxychloroquine pour la prophylaxie ou le traitement de l'infection par le SRAS-CoV-2 sont prévus ou seront bientôt inscrits »[187].
En Amérique du Nord, les autorités sanitaires mettent plus en avant les contre-indications pour les personnes souffrant de maladies cardiaques ou de diabète[23],[211].
Le CDC américain note que la chloroquine ou l'hydroxychloroquine est recommandée pour le traitement des personnes hospitalisées infectées par la Covid-19 dans plusieurs pays, bien qu'il n'y ait pas une telle recommandation aux États-Unis, en mars 2020[23], ajoutant que des essais cliniques préliminaires pour évaluer l'innocuité et l'efficacité de l'hydroxychloroquine pour le traitement de l'infection à la Covid-19 sont prévus aux États-Unis, mais le CDC a déclaré que « l'utilisation, le dosage ou la durée de l'hydroxychloroquine pour la prophylaxie ou le traitement de l'infection par le SRAS-CoV-2 n'ont pas été établis à ce moment[23] ».
L'étude faite en Chine sur cent patients[165] aurait montré une efficacité supérieure de la chloroquine sur d'autres médicaments, à la fois sur la réduction de l'augmentation[Quoi ?] de pneumonie, la durée des symptômes et le temps de guérison du virus, et ce sans effets secondaires notables. Ces déclarations ont entraîné l'ajout de la chloroquine dans les recommandations chinoises[212]. Mais fin mars 2020, l'essai clinique chinois n'a toujours pas livré ses données, empêchant un examen par les pairs de ses résultats et une évaluation indépendante des avantages/inconvénients du traitement[213],[214].
Le 23 mars 2020, en Arizona, un habitant meurt après avoir ingéré du phosphate de chloroquine surdosé (et sa femme est en état critique). Ils avaient absorbé ce produit utilisé pour nettoyer les aquariums, après avoir entendu le président américain vanter les vertus de la chloroquine[215],[216]. Et le Nigeria déplore plusieurs cas d'intoxication à la chloroquine à la suite d'une médication non encadrée[217]. Le même jour, à la question s'il considérait la chloroquine comme un traitement , le docteur Anthony Fauci, qui apparaît souvent lors de la conférence de presse quotidienne du président Donald Trump, a répondu non[218].
Le même jour, le ministre de la Santé français annonce qu'il va autoriser l'usage de l'hydroxychloroquine hors AMM pour la Covid-19 dans ses « formes graves, hospitalières, sur décision collégiale des médecins et sous surveillance stricte » (autorisation effective le 26 mars 2020[219],[220]). Elle reste déconseillée dans les autres cas, dans l'attente de preuves de son efficacité et de son innocuité sur les patients atteints de la maladie[221].
Le 24 mars 2020, le ministère de la Santé, le Collège des médecins et l’Ordre des pharmaciens du Québec déplorent l’émission d’ordonnances de chloroquine ou d’hydroxychloroquine contre la Covid-19 et les jugent inappropriées et non indiquées, à la lumière de l’état de la situation au Québec et des données scientifiques actuellement disponibles[222],[223].
Le 27 mars 2020, l'équipe de Didier Raoult met en ligne une nouvelle étude portant sur 80 patients, dont 65 (81 %) ont connu « une évolution favorable » et sont sortis de l’hôpital au bout de moins de cinq jours en moyenne. Un patient de 74 ans était toujours en soins intensifs au terme de l’étude et un autre de 86 ans était mort. Selon ses auteurs, elle démontre une réduction plus rapide de la charge virale comparée aux valeurs constatées lors d'études précédentes, et sur des populations sans traitement. Les auteurs préconisent alors un usage de l'hydroxychloroquine associée à un antibiotique (azithromycine) chez des patients au stade précoce de la maladie et ne présentant pas de contre-indication à l'usage de la chloroquine, capables de supporter l'apparition possible d'effets secondaires, et soumis à un suivi (électrocardiogramme) de l'absence d'effet secondaire cardiaque. Ceci afin de diminuer rapidement leur infectiosité et de favoriser une sortie d'hôpital plus rapide[224]. L'étude est critiquée principalement parce qu'elle ne porte que sur des patients dont les symptômes sont légers (qui se remettent de la maladie avec ou sans traitement) et qu'elle ne comporte pas de comparaison avec un groupe de contrôle[225]. Le médecin généticien Axel Kahn fait remarquer que l'évolution constatée n'est pas meilleure que celle des 600 000 cas connus[225].
Fin mars 2020 36 experts urgentistes (de 12 pays) ont publié un guide de bonnes/meilleurs pratiques, basé sur 53 enjeux pertinents pour gérer les cas graves de Covid-19 en soins intensifs[226]. Dans l'attente des résultats d'essais en cours, ces experts ont refusé de se prononcer sur le sujet de ces deux médicaments[226] mais ils mettront le guide à jour après publication des résultats d'essais, ou au rythme de l'évolution des connaissances et d'autres retours d’expérience. La première version de la « recommandation no 49 » indique : « There is insufficient evidence to issue a recommendation on the use of chloroquine or hydroxychloroquine in critically ill adults with COVID-19 » (« Les preuves sont insuffisantes pour émettre une recommandation sur l'utilisation de la chloroquine ou l’hydroxychloroquine chez les adultes gravement malades atteints de COVID-19 ») » prend acte acte de l’activité de la chloroquine et de l’hydroxychloroquine in vitro[227],[164],[179] contre plusieurs virus à ARN (dont SARS-CoV, SARS-CoV-2 et d'autres coronavirus), en faisant cependant remarquer que ces deux médicaments n’ont pas eu d’effets in vivo contre la dengue et le chikungunya ni pour la prophylaxie de la grippe[159], ajoutant que dans un modèle primate non-humain d'infection au chikungunya, la chloroquine a eu des effets immunomodulateurs qui ont paradoxalement au contraire retardé la réponse immunitaire, et conduit à aggraver la réplication virale et la maladie[228]. Ce guide prend acte qu’un point presse « a suggéré que son utilisation chez plus de 100 patients a montré « qu'il était supérieur au contrôle en inhibant l'exacerbation de la pneumonie, en améliorant les résultats de l'imagerie pulmonaire, en favorisant une conversion négative du virus et en raccourcissant l'évolution de la maladie », mais que les données le prouvant ne sont toujours pas publiées[165],[226]. Il note qu'un récent document de consensus recommandait 500 mg de phosphate de chloroquine deux fois par jour pendant au moins 5 jours, avec des modifications de dose en cas d'effets secondaires gastro-intestinaux graves[166],[226] et qu'une étude chinoise a exploré plusieurs schémas posologiques via des modèles pharmacocinétiques basés sur la physiologie[179],[226], concluant que l'hydroxychloroquine est plus puissante que la chloroquine pour inhiber le SRAS-CoV-2, in vitro. Sur la base de ces modèles, une dose de charge d'hydroxychloroquine de 400 mg deux fois par jour suivie de 200 mg deux fois par jour pendant 4 jours a été recommandée[179]. Une revue systématique récente n'a trouvé aucune étude publiée chez les patients Covid-19[180],[226]. Les urgentistes, dans l'attente de résultats d'essais en cours, ont dit ne pas être en mesure d'émettre une recommandation pour ou contre la chloroquine[226]. Les auteurs notent que dans les pays où la chloroquine est indisponible, l'hydroxychloroquine est une alternative[226].
Le 30 mars, une étude randomisée non encore publiée en Chine mais déjà disponible en preprint[229],[230] et menée par une équipe de médecins à l'Hôpital universitaire RenMin de Wuhan laisse apparaître de premiers résultats cliniques « modérés », mais se révèle surtout prometteuse « en termes de prévention de la progression vers des formes graves : les 4 patients ayant progressé vers une forme clinique sévère étaient tous dans le groupe contrôle ». Sur 62 patients infectés, 31 ont reçu de l'hydroxychloroquine (400 mg/jour) et un groupe contrôle de 31 patients n'en ont pas reçue. Bilan : l'équipe a constaté une amélioration chez 80,6 % (et même une « amélioration notable » chez 61,3 %) des patients traités avec le médicament contre 54,8 % pour le groupe contrôle. L'étude conclut prudemment que « le potentiel de l’hydroxychloroquine pour le traitement du Covid-19 a été partiellement confirmé » et qu'en l’absence « d’autre option actuellement, il paraît prometteur d’utiliser l’hydroxychloroquine sous surveillance » en attendant « une étude clinique plus large »[231],[232],[233].
Le même jour, une équipe française de l’hôpital Saint -Louis publie une étude dans le journal de Médecine et Maladies Infectieuses réfutant la première publication du Pr Raoult en ne montrant pas de disparition accélérée du virus sous hydroxychloroquine[234].
Avril 2020
Dans la pétition #NePerdonsPlusDeTemps datée du , une douzaine de personnalités médicales françaises appellent le Premier ministre Édouard Philippe à autoriser sans plus attendre la prescription d'hydroxychloroquine face à la pandémie de Covid-19. Signé notamment par Philippe Douste-Blazy, Christian Perronne, Michèle Barzach, Isabelle Bourgault Villada, François Bricaire, Marc Gentilini, Olivier Goulet, Jacques Marescaux, Catherine Neuwirth, Patrick Pelloux, Paul Trouillas et Martine Wonner, ce manifeste fait le constat des résultats efficaces du médicament prescrit par le Dr Raoult et de son utilisation dans de nombreux pays. Il demande à l'État de mettre l'hydroxychloroquine, ou à défaut la chloroquine, à disposition immédiate dans tous les hôpitaux et d'effectuer des commandes et des réserves[235].
Le , dans une tribune publiée dans Le Figaro, l'ancien directeur scientifique de l'Institut national du cancer (INCa) Fabien Calvo, l'ancien président de la Haute Autorité de santé Jean-Luc Harousseau et l'ancien directeur général de l'ANSM, Dominique Maraninchi recommandent d'appliquer le traitement du Pr Raoult dès l'apparition des premiers symptômes du coronavirus[236],[237].
Le 8 avril, l'association américaine de cardiologie met en garde les docteurs devant les dangers de l'association chloroquine/azithromycine[238],[239].
Le , lors d'une visite du président de la République Emmanuel Macron au IHU Méditerranée Infection à Marseille[240], le Pr Raoult lui présente sa dernière étude sur une population de 43,8 ans d'âge médian : 973 des 1 061 patients (91 %) ayant reçu son traitement (hydroxychloroquine + azithromycine) ont guéri en 10 jours. De mauvais résultats ont été observés sur 46 patients : 10 ont été placés en soins intensifs, 5 âgés entre 74 et 95 ans sont décédés et 31 ont dû être hospitalisés pendant une dizaine de jours ou plus[241],[242]. Malgré un effectif important (plus de 1 000 personnes), le caractère scientifique de cette étude est immédiatement remis en cause par de nombreux scientifiques[243] pour les mêmes raisons que les études exploratoires précédentes (absence de groupe contrôle et pas de publication dans une revue scientifique). Le Monde conclut que cette nouvelle étude « ne permet toujours pas de conclure que l’association permet de guérir plus vite que l’évolution spontanée »[244], alors même que de nombreux effets indésirables du traitement sont déjà reportés, en particulier 54 cas de troubles cardiaques, dont 4 mortels[244]. Cette nouvelle étude fait en outre état de 38 617 patients venus spontanément se faire dépister à l'IHU dont 3 165 ont été testés positifs (soit un taux de prévalence de la maladie de 8 % chez la population étudiée)[245], chiffre qui corrobore peu ou prou une étude anglaise qui estime le nombre de Français infectés entre 730 000 à 4,9 millions[246]. Si ces chiffres de prévalence estimatifs se révélaient exacts (ce qui ne pourra être vérifié qu'en fin de l'épidémie ou après un vaste contrôle sérologique de la population) le taux de létalité de la maladie serait alors situé entre 0,5 % et 0,6 %, le taux de cas graves hospitalisés entre 1 et 3 %, et le taux de guérison spontanée (c'est-à-dire sans aucun traitement autre que symptomatique) entre 96 et 98 %. Pour rappel, l'étude du Pr Raoult effectuée sur plus de 1 000 patients revendique, au , 98,7 % de guérison pour le traitement hydroxychloroquine-azithromycine sur des patients entrés du 3 au [247].
Le même jour, Magnus Gisslén, professeur de maladies infectieuses et médecin à l’hôpital de Sahlgrenska, le plus grand hôpital pour les maladies infectieuses de Suède déclare : « Nous nous sommes rendu compte que les preuves d’efficacité étaient faibles, mis à part une étude chinoise, cependant réalisée sans groupe témoin, et l’étude française où l’hydroxychloroquine est combinée à l’azithromycine, étude dont nous estimons qu’elle n’est pas suffisamment bien faite pour démontrer l’efficacité » ; il souligne qu'aucun hôpital en Suède n'utilise plus ce médicament[248].
Le , le Quotidien du médecin informe que l'ANSM a interrogé Didier Raoult et son équipe sur le possible non-respect d'un certain nombre d'étapes réglementaires et déontologiques concernant ses études sur l'hydroxychloroquine et l'azithromycine, qualifiées d'études observationnelles portant sur des patients, alors que tout laisserait penser qu'il s'agit en réalité d'essais cliniques, alors soumis à diverses autorisations dont il se serait affranchi[249].
Le , l'éditorialiste du Monde résume les différents épisodes et conclut en estimant que même s'il n'existe toujours aucune preuve tangible de l'efficacité du traitement proposé par Didier Raoult, « l’enthousiasme pour la chloroquine [est tel que] même si elle s’avère inutile ou dangereuse, aucune réfutation ne parviendra probablement à en entamer le crédit »[250].
Fin avril, les alertes concernant l'utilisation de la chloroquine deviennent plus nombreuses[251]. En date du , 54 cas de troubles cardiaques liés à la prise d'hydroxychloroquine, dont huit décès, ont été répertoriés en France[252], et le nombre d'alertes double entre le 9 et le 21 avril[253] ; selon la responsable d'un Centre Régional de pharmacovigilance, ces chiffres pourraient être « la partie visible d'un iceberg », 95 % des anomalies liées à la prise d'un traitement n'étant jamais déclarées[252],[254]. Le 14 avril un petit essai clinique en double aveugle de la combinaison chloroquine/azithromycine au Brésil est interrompu après l'observation de complications cardiaques fatales chez les patients traités ; le dosage est de 1 200 mg de chloroquine par jour[255],[256],[238],[257]. Après de nouveaux essais cliniques ne démontrant pas d'efficacité de l'hydroxychloroquine mais au contraire des effets secondaires graves, la revue Prescrire conclut le : « on ne connaît pas encore de traitement qui réduit le risque d'évolution vers un Covid-19 grave. Exposer les patients à l'hydroxychloroquine et à l'azithromycine augmente le risque d'effets indésirables cardiaques graves »[258]. La revue Science compile les données disponibles sur la toxicité de l'hydrocychloroquine, et relève qu'une étude de dossiers médicaux de 900 000 patients, « pré-publiée » sur le site MedRxiv[259], conclut que la combinaison hydroxychloroquine azithromycine augmente les risques cardiaques[260]. Le 21 avril aux États-Unis, le NIH déconseille l'utilisation de la combinaison hydroxychloroquine/azithromycine du fait de sa toxicité, et conclut aussi de l'analyse des données cliniques disponibles qu'à part les soins de soutien, « rien ne marche très bien »[24]. Le 26 avril le Canada met à son tour en garde contre l'utilisation de la chloroquine et de l'hydroxychloroquine[261].
Le journal Nature analyse que la ferveur mondiale du public pour l'hydroxychloroquine, non justifiée scientifiquement mais néanmoins encouragée par des politiciens tels que Trump et Macron[240], a de nombreuses conséquences négatives: pénurie de ces médicaments (résultant de leur prescription massive) qui pénalise les personnes qui en ont réellement besoin, décès dus à leurs effets secondaires, et menaces sur les tests cliniques[262]. En effet, certains patients retardent les essais en refusant de participer à ceux qui leurs feraient renoncer à la chloroquine[263] ; de plus, l'exclusion des patients qui prennent de la chloroquine fait que ceux qui ont des problèmes cardiaques risque d'être sous-représentés, mais leur inclusion pourrait biaiser les résultats[262]. Nature compte plus de 100 essais en cours pour tester diverses prescriptions d'hydroxychloroquine sur la Covid-19[262]. Le journal Science en dénombre 18 seulement aux États-Unis, enrôlant plus de 75 000 patients[264], et regrette que cette concentration de toutes les recherches sur une hypothèse unique crée de la compétition pour le recrutement des patients, empêche de tester d'autres hypothèses, et augmente les biais statistiques[264]. L'urgence fait que les critères de qualité scientifique baissent, et la production de connaissances erronées entraîne une perte de temps et un gaspillage des ressources[264],[265].
Le 24 avril le Professeur Mathieu Molimard s'appuie sur la pharmacocinétique pour démontrer que l'hydroxychloroquine ne peut pas être efficace contre la Covid-19, au risque de tuer le patient[266].
Mai 2020
Le , une étude chinoise rétrospective rapporte sous forme d'une « pré-publication » non validée par les pairs sur le site MedRxiv une baisse significative de mortalité chez des patients souffrant de détresse respiratoire critique traités à l'hydroxychloroquine[267],[268].[pertinence contestée]. Une revue critique de cette étude est disponible ici[pertinence contestée][269]. Une lecture critique de l'étude est publiée le 6 mai par l'IHU de Marseille[270],[271].
Le 3 mai le chef du service de pharmacologie médicale du CHU de Bordeaux, Mathieu Molimard, affirme « qu'aucune des recherches menées sur l'hydroxychloroquine n'a pu prouver son efficacité contre le coronavirus. Il est donc nécessaire de se concentrer sur d'autres molécules, au risque de perdre trop de temps »[272]. Le 7 mai, la saga continue et un médecin ancien collaborateur de Didier Raoult prétend que la molécule fonctionnerait en phase 2 de la maladie et non en prévention où elle serait délétère[273], mais toujours sans aucune étude publiée.
Le 12 mai, deux études américaines successives dont une publiée dans le New England Journal of Medicine[274] et l'autre dans le JAMA[275] établissent que le traitement à l'hydroxychloroquine, à l'azithromycine, ou aux deux combinés, « n'était pas significativement associé à des différences de mortalité » par rapport aux malades qui n'avaient pas reçu ces médicaments[150],[276].
Le 14 mai, le British Medical Journal (BMJ) publie deux études, l'une menée par des chercheurs français[277] et l'autre menée par une équipe chinoise[278], qui concluent à l'inefficacité de l'hydroxychloroquine contre le Covid-19[279].
Une étude mondiale publiée dans le journal médical The Lancet[280] sur des malades en covid19 qui ont consommé de l'hydroxicloroquine suggère également que le produit augmente le risque de mourir[281]. Cette étude s'intéresse au sort de 96000 malades de covid 19 dans 671 hôpitaux qui ont consommé un produit avec ou sans antibiotique tel que l'azithromycine, entre le 20 Décembre et le 14 Avril[281]. Elle suggère deux inconvénients à la prise de ce produit par des personnes malades de covid 19: un risque accru de décéder d'une part, et un risque accru d'arythmie d'autre part:
| Régime | Pronostic mortel | |
|---|---|---|
| Prise d'un médicament | 1/6 | |
| Cloroquine avec antibiotique | 1/5 | |
| Hydroxicloroquine avec antibiotique | 1/4 | |
| Aucun produit | 1/11 |
En dehors du risque mortel, l'hydroxycloroquine augmente les arythmies dans 8% des cas, contre 0,3% des cas pour les patients qui ne prennent pas de médicament[281].
Ivermectine
Le , le laboratoire pharmaceutique « MedinCell »[282] annonce une solution abordable utilisant le médicament antiparasitaire (qui est aussi un acaricide et insecticide) : ivermectine, fondée sur les travaux des chercheurs de l'université Monash à Melbourne (Australie)[283]. Sans avoir passé le stade des études cliniques, cette molécule inhibe fortement (multiplication virale réduire d'environ 5 000 fois en 48 h de culture cellulaire traitée) le virus SARS-CoV-2 en moins de 24 heures[284], comme on l'avait déjà montré pour d'autres virus[285],[286],[287],[288].
Le 3 avril 2020, le laboratoire pharmaceutique « MedinCell » annonce le lancement d'un projet COVID-19 en capitalisant sur son expérience dans la formulation d'ivermectine en injection à action prolongée
Le 19 avril 2020, un essai clinique international portant sur 1 408 patients répartis sur 169 hôpitaux du monde entier semble suggérer l'efficacité de l'ivermectine dans le traitement du Covid-19 : le taux de mortalité des patients ayant eu besoin d'une ventilation mécanique dans le groupe traité à l'ivermectine a été de 7,3 % contre 21,3 % dans le groupe contrôle et le taux global de mortalité de 1,4 % contre 8,5 %[289].
Cellules souches
Ces cellules permettraient de contrôler l’inflammation associée au SDRA[290].
L'essai Stroma-Cov2 engagé début avril par l'AP-HP a pour objet d'évaluer le traitement de patients intubés-ventilés présentant un syndrome respiratoire aigu sévère causé par le SARS-CoV-2, en leur administrant des cellules stromales mésenchymateuses de cordon ombilical, dont les propriétés anti-inflammatoires, anti-fibrotiques et immunomodulatrices sont connues pour agir sur l'inflammation aigüe du tissu pulmonaire à l'origine du SDRA.
Sang de vers marins
Une transfusion d'extrait de sang de vers marins (Arenicola marina), dont les capacités de transport d'oxygène sont 40 fois plus développées que l'hémoglobine humaine a été envisagée pour aider les patients lors de la maladie[291], mais le , l'essai clinique mis en place avec l’Assistance publique-Hôpitaux de Paris (AP-HP) est précipitamment interrompu après que le 8 avril, l'Agence du médicament a décidé de le « suspendre en urgence » à la suite des résultats négatifs d'une étude précédente sur des porcs, étude qui ne figurait pas dans le dossier de demande d’autorisation de l’essai clinique ; 100 % des porcs étaient morts dans le cadre de cette expérience[292],[293],[294].
Colchicine
La colchicine, anti-inflammatoire puissant mais à marge thérapeutique étroite car hautement toxique et mutagène[295], empêcherait la libération de cytokines lors de l'orage cytokinique de la maladie à coronavirus. Trois essais cliniques sont en cours au Canada, en Italie et en Grèce pour évaluer l’efficacité de cette molécule[296].
Nicotine
L’observation de la population des personnes atteintes du Covid-19 a montré que les fumeurs sont sous représentés parmi les malades[297]. Il est suggéré que, parmi tous les produits inhalés par les fumeurs, l'effet protecteur serait dû à la nicotine[298]. La Nicotine aurait un effet protecteur contre le virus SARS-CoV-2 en modulant indirectement l'affinité du virus avec le récepteur cellulaire ACE2[299],[300], mais aussi en limitant les réactions inflammatoires[301]. RFI rapporte qu'une étude à base de patch serait lancée à court terme, tout en soulignant qu'à ce jour le tabac provoque 7 millions de morts par an dans le monde, largement plus que la Covid-19[302].
Références
- Kristian Thorlund, Louis Dron, Jay Park et Grace Hsu, « A real-time dashboard of clinical trials for COVID-19 », The Lancet Digital Health, (ISSN 2589-7500, DOI 10.1016/s2589-7500(20)30086-8, lire en ligne, consulté le )
- Karen Carey, « Increasing number of biopharma drugs target COVID-19 as virus spreads », BioWorld, (consulté le ).
- Damian Garde, « An updated guide to the coronavirus drugs and vaccines in development », STAT, (consulté le ).
- « Draft landscape of COVID-19 candidate vaccine », World Health Organization, (consulté le ).
- Alex Knapp, « Coronavirus Drug Update: The Latest Info On Pharmaceutical Treatments And Vaccines », Forbes, (consulté le ).
- « CEPI welcomes UK Government's funding and highlights need for $2 billion to develop a vaccine against COVID-19 », Coalition for Epidemic Preparedness Innovations, Oslo, Norway, (consulté le )
- Karen Carey, « Increasing number of biopharma drugs target COVID-19 as virus spreads », BioWorld, (consulté le )
- « Draft landscape of COVID-19 candidate vaccine », World Health Organization, (consulté le )
- Dong, Hu et Gao, « Discovering drugs to treat coronavirus disease 2019 (COVID-19) », Drug Discoveries and Therapeutics, vol. 14, no 1, , p. 58–60 (ISSN 1881-7831, PMID 32147628, DOI 10.5582/ddt.2020.01012, lire en ligne)
- Harrison, « Coronavirus puts drug repurposing on the fast track », Nature Biotechnology, (ISSN 1087-0156, DOI 10.1038/d41587-020-00003-1, lire en ligne)
- Helen Branswell, « WHO to launch multinational trial to jumpstart search for coronavirus drugs », STAT, (consulté le )
- « First regulatory workshop on COVID-19 facilitates global collaboration on vaccine development », European Medicines Agency, (consulté le )
- « Coronavirus (COVID-19) Update: FDA Continues to Facilitate Development of Treatments », US Food and Drug Administration, (consulté le ).
- « China approves first anti-viral drug against coronavirus Covid-19 », Clinical Trials Arena, (consulté le ).
- Maggie Fox, « Drug makers are racing to develop immune therapies for Covid-19. Will they be ready in time? », STAT, (consulté le )
- Zhang et Liu, « Potential interventions for novel coronavirus in China: A systematic review », Journal of Medical Virology, vol. 92, no 5, , p. 479–490 (ISSN 0146-6615, DOI 10.1002/jmv.25707)
- Alex Knapp, « Coronavirus Drug Update: The Latest Info On Pharmaceutical Treatments And Vaccines », Forbes, (consulté le )
- « The Drug Development Process », US Food and Drug Development, (consulté le )
- Grenfell et Drew, « Here's Why It's Taking So Long to Develop a Vaccine for the New Coronavirus » [archive du ], ScienceAlert, (consulté le )
- « Coronavirus (COVID-19) Update: FDA Continues to Facilitate Development of Treatments », US Food and Drug Administration, (consulté le )
- « Call to pool research resources into large multi-centre, multi-arm clinical trials to generate sound evidence on COVID-19 treatments », European Medicines Agency, (consulté le )
- Dhama, Sharun, Tiwari et Dadar, « COVID-19, an emerging coronavirus infection: advances and prospects in designing and developing vaccines, immunotherapeutics, and therapeutics », Human Vaccines and Immunotherapeutics, , p. 1–7 (ISSN 2164-5515, PMID 32186952, DOI 10.1080/21645515.2020.1735227, lire en ligne)
- « Information for clinicians on therapeutic options for COVID-19 patients », US Centers for Disease Control and Prevention, (consulté le )
- (en) « NIH Panel Recommends Against Drug Combination Promoted By Trump For COVID-19 », sur NPR.org (consulté le ) : « We just plowed through everything that was, and apart from supportive care, there wasn't anything that was working terribly well. The panel also concluded that there was insufficient evidence to recommend any kind of treatment either to prevent infection with the coronavirus or to prevent the progression of symptoms in those who are already infectious. »
- « Vaccine Testing and the Approval Process », US Centers for Disease Control and Prevention, (consulté le )
- « Step 2: Preclinical Research », US Food and Drug Administration, (consulté le )
- Bill Gates, « Responding to Covid-19 — A Once-in-a-Century Pandemic? », New England Journal of Medicine, (ISSN 0028-4793, PMID 32109012, DOI 10.1056/nejmp2003762)
- Kaelan Deese, « Health official says coronavirus vaccine will take 'at least a year to a year and a half' to develop », The Hill, (consulté le )
- « Clinical Development Success Rates 2006-2015 », BIO Industry Analysis,
- « About the Innovative Medicines Initiative », European Innovative Medicines Initiative, (consulté le )
- « Critical Path Initiative », US Food and Drug Administration, (consulté le )
- « Breakthrough Therapy », US Food and Drug Administration, (consulté le )
- (en-US) RCSB Protein Data Bank, « RCSB PDB: Homepage », sur www.rcsb.org (consulté le )
- JOSHI, T., JOSHI, T., SHARMA, P., MATHPAL, S., PUNDIR, H., BHATT, V., & CHANDRA, S. (2020). In silico screening of natural compounds against COVID-19 by targeting Mpro and ACE2 using molecular docking. European Review for Medical and Pharmacological Sciences | publié le 21 avril 2020 | 24, 4529-4536.
- (en) Bin Cao, Yeming Wang, Danning Wen et Wen Liu, « A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19 », New England Journal of Medicine, (PMID 32187464, PMCID PMC7121492, DOI 10.1056/NEJMoa2001282, lire en ligne, consulté le )
- (langue non reconnue : cn) 刘丹萍 陈军 et LIU Danping CHEN Jun, « 硫酸羟氯喹治疗普通型2019冠状病毒病(COVID-19)患者初步研究 », 浙江大学学报(医学版), vol. 49, no 1, , p. 0–0 (ISSN 1008-9292, DOI 10.3785/j.issn.1008-9292.2020.03.03, lire en ligne, consulté le )
- (en) Chang Chen, Yi Zhang, Jianying Huang et Ping Yin, « Favipiravir versus Arbidol for COVID-19: A Randomized Clinical Trial », medRxiv, , p. 2020.03.17.20037432 (DOI 10.1101/2020.03.17.20037432, lire en ligne, consulté le )
- (en) Xueting Yao, Fei Ye, Miao Zhang et Cheng Cui, « In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) », Clinical Infectious Diseases, {{Article}} : paramètre «
date» manquant (PMID 32150618, PMCID PMC7108130, DOI 10.1093/cid/ciaa237, lire en ligne, consulté le ) - (en) Philippe Gautret, Jean-Christophe Lagier, Philippe Parola et Van Thuan Hoang, « Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial », International Journal of Antimicrobial Agents, , p. 105949 (ISSN 0924-8579, PMID 32205204, PMCID PMC7102549, DOI 10.1016/j.ijantimicag.2020.105949, lire en ligne, consulté le )
- Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro).
- (Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies).
- 2005 : Chloroquine is a potent inhibitor of SARS coronavirus infection and spread.
- https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001113-21/GB
- (en-GB) Sarah Boseley Health editor, « Coronavirus: world's biggest trial of drug to treat Covid-19 begins in UK », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le )
- « Welcome — RECOVERY Trial », sur www.recoverytrial.net (consulté le )
- Mario Plaze, David Attali, Anne-Cécile Petit et Michael Blatzer, « Repositionnement de la chlorpromazine dans le traitement du COVID-19: étude reCoVery », L'Encéphale, , S0013700620300798 (PMCID PMC7188634, DOI 10.1016/j.encep.2020.04.010, lire en ligne, consulté le )
- psychiatre et cheffe de service à l'hôpital Sainte-Anne à Paris (GHU PARIS Psychiatrie & Neurosciences)
- (en) Yuuki Inoue, Nobuyuki Tanaka, Yoshinori Tanaka et Shingo Inoue, « Clathrin-Dependent Entry of Severe Acute Respiratory Syndrome Coronavirus into Target Cells Expressing ACE2 with the Cytoplasmic Tail Deleted », Journal of Virology, vol. 81, no 16, , p. 8722–8729 (ISSN 0022-538X et 1098-5514, PMID 17522231, PMCID PMC1951348, DOI 10.1128/JVI.00253-07, lire en ligne, consulté le )
- communiqué publié ce lundi 4 mai 2020.
- « Traitement contre le Covid-19 : les effets d’un antipsychotique prometteurs, une première étude sur l’homme lancée en France », sur Franceinfo, (consulté le )
- Communiqué de l'INSERM : Lancement d’un essai clinique européen contre le Covid-9
- Interview réalisée par Xavier Azalbert du professeur Christian Perronne, chef du service infectiologie de l'hôpital Raymond Poincaré de Garches, France-Soir, 4 avril 2020.
- « VIDEO. Coronavirus : les traitements testés n'ont pas d'"effet statistiquement significatif" à ce stade, révèle Olivier Véran », sur Franceinfo, (consulté le )
- « Covid-19 : Essai Discovery, premier point d'étape au 7 avril 2020 », sur Inserm - La science pour la santé (consulté le )
- Florian Gouthière, « Est-il vrai que l'essai clinique Discovery ne permet pas de tester le protocole du professeur Raoult ? », sur Libération.fr, (consulté le )
- Ramon MAITA, « CHU-ANGERS - Etude Hycovid – Foire Aux Questions (FAQ) », sur CHU-ANGERS (consulté le )
- « Covid-19 : le CHU d’Angers lance une étude d’envergure nationale sur l'hydroxychloroquine », sur lequotidiendumedecin.fr,
- (en) « UN health chief announces global 'solidarity trial' to jumpstart search for COVID-19 treatment », UN News, (consulté le )
- (en) Kai Kupferschmidt et Jon CohenMar. 22, « WHO launches global megatrial of the four most promising coronavirus treatments », sur Science | AAAS, (consulté le )
- (en) Sunny H Wong, Rashid NS Lui et Joseph JY Sung, « Covid‐19 and the digestive system », Journal of Gastroenterology and Hepatology, , jgh.15047 (ISSN 0815-9319 et 1440-1746, DOI 10.1111/jgh.15047, lire en ligne, consulté le )
- (en) Wei-jie Guan, Zheng-yi Ni, Yu Hu et Wen-hua Liang, « Clinical Characteristics of Coronavirus Disease 2019 in China », New England Journal of Medicine, , NEJMoa2002032 (ISSN 0028-4793 et 1533-4406, PMID 32109013, PMCID PMC7092819, DOI 10.1056/NEJMoa2002032, lire en ligne, consulté le )
- (en) Nanshan Chen, Min Zhou, Xuan Dong et Jieming Qu, « Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study », The Lancet, vol. 395, no 10223, , p. 507–513 (PMID 32007143, PMCID PMC7135076, DOI 10.1016/S0140-6736(20)30211-7, lire en ligne, consulté le )
- (en) Joyce W Y Mak, Francis K L Chan et Siew C Ng, « Probiotics and COVID-19: one size does not fit all », The Lancet Gastroenterology & Hepatology, , S2468125320301229 (PMID 32087794, PMCID PMC7182525, DOI 10.1016/S2468-1253(20)30122-9, lire en ligne, consulté le )
- Mitjà et Clotet, « Use of antiviral drugs to reduce COVID-19 transmission », The Lancet Global Health, Elsevier BV, (ISSN 2214-109X, DOI 10.1016/s2214-109x(20)30114-5)
- Allison L. Totura & Sina Bavari (2019) Broad-spectrum coronavirus antiviral drug discovery, Expert Opinion on Drug Discovery, 14:4, 397-412, DOI: 10.1080/17460441.2019.1581171
- (ch) Sun Meili, Yang Jianmin, Sun Yuping et Su Guohai, « Inhibitors of RAS Might Be a Good Choice for the Therapy of COVID-19 Pneumonia », Chinese Journal of Tuberculosis and Respiratory Diseases, vol. 43, no 00, , E014–E014 (ISSN 1001-0939, DOI 10.3760/cma.j.issn.1001-0939.2020.0014, lire en ligne, consulté le )
- Phadke M & Saunik S (2020) Rapid response: Use of angiotensin receptor blockers such as Telmisartan, Losartsan in nCoV Wuhan Corona Virus infections—Novel mode of treatment. Response to the emerging novel coronavirus outbreak. BMJ, 368, m406.
- Cao, Wang, Wen et Liu, « A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19 », New England Journal of Medicine, (ISSN 0028-4793, PMID 32187464, DOI 10.1056/nejmoa2001282)
- (en) Lindsey R. Baden et Eric J. Rubin, « Covid-19 — The Search for Effective Therapy », New England Journal of Medicine, , NEJMe2005477 (ISSN 0028-4793 et 1533-4406, PMID 32187463, PMCID PMC7121446, DOI 10.1056/NEJMe2005477, lire en ligne, consulté le )
- « Coronavirus: Japanese anti-viral drug effective in treating patients, Chinese official says », The Independant, (lire en ligne, consulté le )
- https://asia.nikkei.com/Business/Companies/Avigan-coronavirus-hope-puts-Fujifilm-s-health-care-in-focus
- https://asia.nikkei.com/Spotlight/Coronavirus/Abe-says-Japan-aims-to-approve-Avigan-as-coronavirus-treatment
- « Coronavirus : des chercheurs estiment le coût de certains traitements potentiels à 1 dollar par jour », Le Monde.fr, (lire en ligne, consulté le )
- « Adaptive COVID-19 Treatment Trial (ACTT) | NIH: National Institute of Allergy and Infectious Diseases », sur www.niaid.nih.gov (consulté le )
- « Covid-19 : résultats contradictoires pour l’antiviral remdesivir », Le Monde, (lire en ligne, consulté le )
- Sy Mukherjee, « Gilead's coronavirus treatment is barreling its way into new clinical trials », Fortune, (consulté le )
- Ned Pagliarulo, « A closer look at the Ebola drug that's become the top hope for a coronavirus treatment », BioPharma Dive, (consulté le ) : « There's only one drug right now that we think may have real efficacy. And that's remdesivir." said Bruce Aylward, a senior advisor and international leader of the World Health Organization's joint mission to China »
- « Coronavirus : le médicament "remdesivir" vanté aux Etats-Unis est-il vraiment efficace ? », sur RTBF Info, (consulté le )
- « Coronavirus dans le monde : déconfinement à des rythmes variés aux Etats-Unis, qui misent sur le remdesivir », Le Monde.fr, (lire en ligne, consulté le )
- Essai enregistré sur ClinicalTrials.gov sous le n° NCT04257656
- « Coronavirus Covid-19 : le remdesivir inefficace selon les résultats d'un essai clinique », sur Sciences et Avenir (consulté le )
- (en) Yeming Wang, Dingyu Zhang, Guanhua Du et Ronghui Du, « Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial », The Lancet, , S0140673620310229 (DOI 10.1016/S0140-6736(20)31022-9, lire en ligne, consulté le )
- « Vancouver biotech identifying antibodies for COVID-19 », BIV, (lire en ligne, consulté le )
- (en) Huijie Bian, Zhao-Hui Zheng, Ding Wei et Zheng Zhang, « Meplazumab treats COVID-19 pneumonia: an open-labelled, concurrent controlled add-on clinical trial », Infectious Diseases (except HIV/AIDS), (DOI 10.1101/2020.03.21.20040691, lire en ligne, consulté le )
- (en) Ke Wang, Wei Chen, Yu-Sen Zhou et Jian-Qi Lian, « SARS-CoV-2 invades host cells via a novel route: CD147-spike protein », Microbiology, (DOI 10.1101/2020.03.14.988345, lire en ligne, consulté le )
- Commission de la transparence HAS[1]
- (en) « Effective Treatment of Severe COVID-19 Patients with Tocilizumab », sur ChinaXiv.org (consulté le ).
- (en) « China approves use of Roche drug in battle against coronavirus complications », sur Reuters (consulté le ).
- (en) « How an Arthritis Drug Could Treat Coronavirus Infections », sur American Council on Science and Health (consulté le ).
- (it) « Coronavirus, via libera dell'Aifa al farmaco anti-artrite efficace su 3 pazienti e a un antivirale: test in 5 centri », sur www.ilmessaggero.it (consulté le ).
- (en) « How doctors can potentially significantly reduce the number of deaths from Covid-19 », sur Vox (consulté le ).
- Ruan Qiurong, « Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China », Intensive Care Medicine (en), (DOI 10.1007/s00134-020-05991-x, lire en ligne, consulté le ).
- Solveig Godeluck, « Coronavirus : les Hôpitaux de Paris ont bon espoir d'avoir trouvé un traitement pour les cas graves », Les Échos, (lire en ligne, consulté le ).
- « Coronavirus : l’essai clinique Discovery englué faute de coopération européenne », Le Monde.fr, (lire en ligne, consulté le )
- « Government of Canada funds 49 additional COVID-19 research projects – Details of the funded projects », Government of Canada, (consulté le )
- Amy Maxmen, « Le sang des patients guéris du Covid-19 pourrait sauver des vies », sur Pourlascience.fr (consulté le )
- (en) Rita Rubin, « Testing an Old Therapy Against a New Disease: Convalescent Plasma for COVID-19 », JAMA, (DOI 10.1001/jama.2020.7456, lire en ligne, consulté le )
- (en) « New York Center First to Collect Plasma From COVID-19 Patients as Possible Treatment », sur Time (consulté le )
- (en-US) Amy Dockser Marcus, « Convalescent Plasma Is Safe to Treat Covid-19, National Study Shows », Wall Street Journal, (ISSN 0099-9660, lire en ligne, consulté le )
- (en) Cormac Sheridan, « Convalescent serum lines up as first-choice treatment for coronavirus », Nature Biotechnology, (DOI 10.1038/d41587-020-00011-1, lire en ligne, consulté le )
- INSERM - Coviplasm : tester l’efficacité de la transfusion de plasma de patients convalescents du Covid-19 dans le traitement de la maladie
- (en) Tung Thanh Le, Zacharias Andreadakis, Arun Kumar et Raúl Gómez Román, « The COVID-19 vaccine development landscape », Nature Reviews Drug Discovery, , d41573–020–00073-5 (ISSN 1474-1776 et 1474-1784, DOI 10.1038/d41573-020-00073-5, lire en ligne, consulté le )
- (en) « Sigma receptor », dans Wikipedia, (lire en ligne)
- (en) David E. Gordon, Gwendolyn M. Jang, Mehdi Bouhaddou et Jiewei Xu, « A SARS-CoV-2 protein interaction map reveals targets for drug repurposing », Nature, , p. 1–13 (ISSN 1476-4687, DOI 10.1038/s41586-020-2286-9, lire en ligne, consulté le )
- Francesco Berardi, Carmen Abate, Savina Ferorelli et Vincenzo Uricchio, « Exploring the Importance of Piperazine N-Atoms for σ2 Receptor Affinity and Activity in a Series of Analogs of 1-Cyclohexyl-4-[3-(5-methoxy-1,2,3,4-tetrahydronaphthalen-1-yl)propyl]piperazine (PB28) », Journal of Medicinal Chemistry, vol. 52, no 23, , p. 7817–7828 (ISSN 0022-2623, DOI 10.1021/jm9007505, lire en ligne, consulté le )
- (en) Daniel Lauster, Simon Klenk, Kai Ludwig et Saba Nojoumi, « Phage capsid nanoparticles with defined ligand arrangement block influenza virus entry », Nature Nanotechnology, , p. 1–7 (ISSN 1748-3395, DOI 10.1038/s41565-020-0660-2, lire en ligne, consulté le )
- (en-US) « Influenza and Coronavirus Demise Could Lie with Phage Nanoparticles », sur GEN - Genetic Engineering and Biotechnology News, (consulté le )
- Serrano G, Kochergina I, Albors A, Diaz E, Oroval M, Hueso G, et al. (2020) Liposomal Lactoferrin as Potential Preventative and Cure for COVID-19. Int J Res Health Sci. 2020;8(1):8-15. e-ISSN: 2321-7251
- Chang R & Sun WZ (2020) Lactoferrin may reduce the incidence and attenuate the severity of COVID-19 in infants and children. Preprint at: https://doi.org/10.22541/au.158586333.32247750
- Chang, R., Zen Sun, W., & Bun Ng, T. (2020).Lactoferrin as potential preventative and treatment for COVID-19.
- Raymond Chang, M. D., Wei-Zen Sun, M. D., & Chang, R. Lactoferrin as potential preventative and treatment for COVID-19
- (en) Harri Hemilä, « Vitamin C intake and susceptibility to pneumonia: », The Pediatric Infectious Disease Journal, vol. 16, no 9, , p. 836–837 (ISSN 0891-3668, DOI 10.1097/00006454-199709000-00003)
- (en) Harri Hemilä, « Vitamin C Supplementation and Respiratory Infections: a Systematic Review », Military Medicine, vol. 169, no 11, , p. 920–925 (ISSN 0026-4075 et 1930-613X, DOI 10.7205/MILMED.169.11.920, résumé)
- Anitra C. Carr, « A new clinical trial to test high-dose vitamin C in patients with COVID-19 », Critical Care, vol. 24, no 1, , p. 133 (ISSN 1364-8535, PMID 32264963, PMCID PMC7137406, DOI 10.1186/s13054-020-02851-4, lire en ligne, consulté le )
- Erol, A. (2020). High-dose intravenous vitamin C treatment for COVID-19. https://osf.io/p7ex8/download?format=pdf
- (en) Alpha A. Fowler, Jonathon D. Truwit, R. Duncan Hite et Peter E. Morris, « Effect of Vitamin C Infusion on Organ Failure and Biomarkers of Inflammation and Vascular Injury in Patients With Sepsis and Severe Acute Respiratory Failure: The CITRIS-ALI Randomized Clinical Trial », JAMA, vol. 322, no 13, , p. 1261 (ISSN 0098-7484, PMID 31573637, PMCID PMC6777268, DOI 10.1001/jama.2019.11825, lire en ligne, consulté le )
- Vitamine_D#Carence_et_insuffisance
- William B. Grant et al, « Evidence that Vitamin D Supplementation Could Reduce Risk of Influenza and COVID-19 Infections and Deaths », Nutrients, vol. 12, no 4, , p. 988-1007 (DOI 10.3390/nu12040988, lire en ligne)
- Alba Panarese et Endrit Shahini, « Covid-19, and vitamin D », Aliment Pharmacology and Therapeutics, vol. 2020, no 00, , p. 1-3 (DOI 10.1111/apt.15752, lire en ligne)
- Erreur de référence : Balise
<ref>incorrecte : aucun texte n’a été fourni pour les références nomméesVitD_COVID19 - (en) William B. Grant, Henry Lahore, Sharon L. McDonnell et Carole A. Baggerly, « Evidence that Vitamin D Supplementation Could Reduce Risk of Influenza and COVID-19 Infections and Deaths », Nutrients, vol. 12, no 4, , p. 988 (ISSN 2072-6643, DOI 10.3390/nu12040988, lire en ligne, consulté le )
- (en) Chaolin Huang, Yeming Wang, Xingwang Li et Lili Ren, « Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China », The Lancet, vol. 395, no 10223, , p. 497–506 (PMID 31986264, PMCID PMC7159299, DOI 10.1016/S0140-6736(20)30183-5, lire en ligne, consulté le )
- (en-US) « Zinc,Fact Sheet for Health Professionals », sur ods.od.nih.gov (consulté le ).
- Ananda Prasad, « Zinc in human health: An update », The Journal of Trace Elements in Experimental Medicine, vol. 11, nos 2-3, , p. 77-87 (ISSN 1520-670X, DOI 10.1002/(SICI)1520-670X(1998)11:2/3<63::AID-JTRA2>3.0.CO;2-5, <63::AID-JTRA2>3.0.CO;2-5 lire en ligne)
- Ananda Prasad, « Discovery of Human Zinc Deficiency: Its Impact on Human Health and Disease », Advances in Nutrition, vol. 4, no 2, , p. 176-190 (ISSN 2161-8313, DOI https://doi.org/10.3945/an.112.003210, lire en ligne)
- Lothar Ibs et Rink, « Zinc-Altered Immune function », Journal of Nutrition, vol. 133, no 5, , p. 1452S–1456S (DOI 10.1093/jn/133.5.1452S, lire en ligne)
- Amir Noeparast et Gil Verschelden, « Can Zinc Correction in SARS-CoV-2 Patients Improve Treatment Outcomes? », preprint, (DOI 10.20944/preprints202004.0094.v1, lire en ligne)
- Anatoly V. Skalny, Lothar Rink, Olga P. Ajsuvakova et Michael Aschner, « Zinc and respiratory tract infections: Perspectives for COVID‑19 (Review) », International Journal of Molecular Medicine, (ISSN 1107-3756, DOI 10.3892/ijmm.2020.4575, lire en ligne, consulté le )
- L'Est républicain, Un médecin mosellan constate l’efficacité d’un protocole à base d’azithromycine, 11/04/2020
- (en-US) « Correspondence from Dr Vladimir Zelenko on Treatment of COVID-19 in New York », sur mai68.org (consulté le ).
- Amir Noeparast et Gil Verschelden, « Can Zinc Correction in SARS-CoV-2 Patients Improve Treatment Outcomes », preprint, (DOI 10.20944/preprints202004.0094.v1, lire en ligne)
- M. Scholz et R. Derwand, « Does Zinc Supplementation Enhance the Clinical Efficacy of Chloroquine/Hydroxychloroquine to Win Todays Battle Against COVID-19? », Preprints 2020, 2020040124 (doi: 10.20944/preprints202004.0124.v1)., (DOI 10.20944/preprints202004.0124.v1, lire en ligne)
- Qiao-Li Chai, « Effect of azithromycin combined with licorzinc therapy on inflammatory response and immune response in children with mycoplasma pneumonia », Journal of Hainan Medical University, vol. 23, no 14, , p. 62-65 (lire en ligne)
- Maladie_à_coronavirus_2019
- Ayako Fukunaka et Yoshio Fujitani, « Role of Zinc Homeostasis in the Pathogenesis of Diabetes and Obesity », International Journal of Molecular Science, vol. 199, no 2, , p. 476-489 (DOI 10.3390/ijms19020476, lire en ligne)
- (pt-BR) H Vannucchi et al., Serum levels of vitamin A, E, C and B2, carotenoid and zinc in hospitalized elderly patients. Revista de Saude Publica, 01 Apr 1994, 28(2):121-126 DOI: 10.1590/s0034-89101994000200005 . Texte ne pdf : [2]
- Scott Read, Stephanie Obeid, Chantelle Ahlenstiel et Golo Ahlenstiel, « The Role of Zinc in Antiviral Immunity », Advances in Nutrition, vol. 10, no 4, , p. 696-710 (DOI 10.1093/advances/nmz013, lire en ligne)
- Nour Zahi Gammoh et Lothar Rink, « Zinc in Infection and Inflammation », Nutrients, vol. 9, no 6, , p. 624-648 (DOI 10.3390/nu9060624, lire en ligne)
- Vincent Coquaz, « L'antibiotique azithromycine est-il vraiment efficace contre le Covid, comme l'affirme cette publication virale ? », Libération, (lire en ligne, consulté le )
- « Un médecin mosellan constate l’efficacité d’un protocole à base d’azithromycine », sur www.estrepublicain.fr (consulté le ).
- (en) Waleed Alhazzani, Morten Hylander Møller, Yaseen M. Arabi et Mark Loeb, « Surviving Sepsis Campaign: guidelines on the management of critically ill adults with Coronavirus Disease 2019 (COVID-19) », Intensive Care Medicine, (ISSN 1432-1238, PMID 32222812, PMCID PMC7101866, DOI 10.1007/s00134-020-06022-5, lire en ligne, consulté le )
- (en) Oliver Schacht, « COVID-19 Patients Need to Be Tested for Bacteria and Fungi, Not Just the Coronavirus », sur Scientific American Blog Network (consulté le )
- « Lorraine. Des médecins mosellans sommés de se taire », sur www.republicain-lorrain.fr (consulté le )
- Cathy LG, « COVID-19 : L'espoir par des traitements antibiotiques ? », sur Club de Mediapart (consulté le )
- basicblog, « Covid-19 : Traitement au macrolides du Dr Sabine PALIARD-FRANCO, le rapport disparu », sur Club de Mediapart (consulté le )
- AgoraVox, Des médecins ont trouvé un traitement contre le Covid-19 à base d’azithromycine, 11/04/2020
- Mediapart, Covid 19, l'espoir par des traitements antibiotiques ?, 14/04/2020
- Société Française de Gériatrie et Gérontologie, RETOUR D’EXPÉRIENCE sur la prise en charge de MALADES SUSPECTS DE COVID 19 : GROUPE I CABINET MÉDICAL DE CHABONS. Dr Sabine PALIARD-FRANCO, 29/03/2020
- Par David Opoczynski à 17h28, « Covid-19 : à New York, des traitements à l’hydroxychloroquine et l’azithromycine restent sans effet », sur leparisien.fr, (consulté le )
- (en) Yahira M. Báez-Santos et Sarah E. St. John, « The SARS-coronavirus papain-like protease: Structure, function and inhibition by designed antiviral compounds », sur Antiviral Research, (PMID 25554382, PMCID PMC5896749, DOI 10.1016/j.antiviral.2014.12.015, consulté le ), p. 21–38
- (en) Eleanor M. Cottam et Helena J. Maier, « Coronavirus nsp6 proteins generate autophagosomes from the endoplasmic reticulum via an omegasome intermediate », sur Autophagy, (ISSN 1554-8627, PMID 21799305, PMCID PMC3242798, DOI 10.4161/auto.7.11.16642, consulté le ), p. 1335–1347
- (en) Yang N et Shen Hm, « Targeting the Endocytic Pathway and Autophagy Process as a Novel Therapeutic Strategy in COVID-19 », sur International journal of biological sciences, (PMID 32226290, PMCID PMC7098027, DOI 10.7150/ijbs.45498, consulté le )
- Didac Carmona-Gutierrez et Maria A. Bauer, « Digesting the crisis: autophagy and coronaviruses », sur Microbial Cell, (PMID 32391393, PMCID PMC7199282, DOI 10.15698/mic2020.05.715, consulté le ), p. 119–128
- (en) Andy Goren, John McCoy, Carlos G. Wambier et Sergio Vano-Galvan, « What does androgenetic alopecia have to do with COVID-19? An insight into a potential new therapy », Dermatologic Therapy, , e13365 (DOI 10.1111/dth.13365, lire en ligne, consulté le )
- (en) Jane A. McCrohon, Alison K. Death, Shirley Nakhla et Wendy Jessup, « Androgen Receptor Expression Is Greater in Macrophages From Male Than From Female Donors: A Sex Difference With Implications for Atherogenesis », Circulation, vol. 101, no 3, , p. 224–226 (ISSN 0009-7322 et 1524-4539, DOI 10.1161/01.CIR.101.3.224, lire en ligne, consulté le )
- Damian Garde, « An updated guide to the coronavirus drugs and vaccines in development », STAT, (consulté le )
- (en) Colson P, Rolain JM, Lagier JC, Brouqui P et Raoult D, « Chloroquine and hydroxychloroquine as available weapons to fight COVID-19 », Int. J. Antimicrob. Agents, , p. 105932 (PMID 32145363, DOI 10.1016/j.ijantimicag.2020.105932)
- (en) Franck Touret et Xavier de Lamballerie, « Of chloroquine and COVID-19 », Antiviral Research, vol. 177, , p. 104762 (ISSN 0166-3542, DOI 10.1016/j.antiviral.2020.104762, lire en ligne, consulté le ).
- « La chloroquine, une piste pour lutter contre le SARS-CoV-2 », Le Monde, (lire en ligne, consulté le ).
- « ÉTUDE INA. Comment Didier Raoult et la chloroquine ont surgi dans le traitement médiatique du coronavirus », sur La Revue des Médias (consulté le )
- (en) Alex John London et Jonathan Kimmelman, « Against pandemic research exceptionalism », Science, (ISSN 0036-8075 et 1095-9203, PMID 32327600, DOI 10.1126/science.abc1731, lire en ligne, consulté le ) :
« As of this writing, more than 18 clinical trials enrolling more than 75,000 patients have been registered in North America for testing various hydroxychloroquine regimens for COVID-19. This massive commitment concentrates resources on nearly identical clinical hypotheses, creates competition for recruitment, and neglects opportunities to test other clinical hypotheses. »
- (en) Heidi Ledford, « Chloroquine hype is derailing the search for coronavirus treatments », Nature, (DOI 10.1038/d41586-020-01165-3, lire en ligne, consulté le ) :
« So far, there is very little data backing the idea that hydroxychloroquine works against coronavirus infection, yet the fervour surrounding it has created drug shortages and affected enrolment in clinical trials for other potential treatments. »
- (en) Manli Wang, Ruiyuan Cao, Leike Zhang et Xinglou Yang, « Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro », Cell Research, vol. 30, no 3, , p. 269–271 (ISSN 1748-7838, DOI 10.1038/s41422-020-0282-0, lire en ligne, consulté le )
- Jianjun Gao, Zhenxue Tian et Xu Yang, « Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies », BioScience Trends, vol. 14, no 1, , p. 72–73 (ISSN 1881-7815 et 1881-7823, DOI 10.5582/bst.2020.01047, lire en ligne, consulté le )
- .
- (ko) « Physicians work out treatment guidelines for coronavirus », m.koreabiomed.com, (consulté le )
- Hervé Morin, « Un antipaludéen pourra-t-il contrer l’épidémie de Covid-19 ? », Le Monde, (lire en ligne).
- (en) Philippe Colson, Jean-Marc Rolain et Didier Raoult, « Chloroquine for the 2019 novel coronavirus SARS-CoV-2 », International Journal of Antimicrobial Agents, , p. 105923 (DOI 10.1016/j.ijantimicag.2020.105923, lire en ligne, consulté le ).
- « Coronavirus : le professeur Raoult, spécialiste des maladies infectieuses, valide un traitement contre le Covid-19 », sur France 3 Provence-Alpes-Côte d'Azur (consulté le ).
- IHU Méditerranée-Infection, « Coronavirus : diagnostiquons et traitons ! Premiers résultats pour la chloroquine », .
- « La chloroquine est-elle un bon traitement contre le coronavirus ? », Sciences et Avenir (consulté le ).
- « ”Fake news” et désinformation autour du coronavirus SARS-CoV2 », Communiqué de presse, Inserm, (consulté le ).
- Pauline Moullot, « La chloroquine, un médicament contre le paludisme, est-elle efficace contre le Covid-19 ? », Libération, (consulté le ).
- (zh) CHEN Jun, « A pilot study of hydroxychloroquine in treatment of patients with common coronavirus disease-19 (COVID-19) », Journal of Zhejiang University (Medical Science), , p. 0–0 (ISSN 1008-9292, DOI 10.3785/j.issn.1008-9292.2020.03.03, lire en ligne, consulté le )
- (en) Tara Haelle, « Hydroxychloroquine Use For COVID-19 Coronavirus Shows No Benefit In First Small—But Limited—Controlled Trial », Forbes, (lire en ligne)
- en anglais : « more tolerable safety profile »
- (en) Yao, Ye, Zhang et Cui, « In Vitro Antiviral Activity and Projection of Optimized Dosing Design of Hydroxychloroquine for the Treatment of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) (CC-BY-SA 4.0) », Clinical Infectious Diseases, (PMID 32150618, DOI 10.1093/cid/ciaa237, lire en ligne)
- Cortegiani, Ingoglia, Ippolito et Giarratano, « A systematic review on the efficacy and safety of chloroquine for the treatment of COVID-19 », Journal of Critical Care, (ISSN 0883-9441, PMID 32173110, DOI 10.1016/j.jcrc.2020.03.005, lire en ligne)
- « Coronavirus stade 3 : le traitement à la chloroquine efficace, selon le professeur Raoult de l'IHU de Marseille », sur France 3 Provence-Alpes-Côte d'Azur (consulté le )
- Gautret et al., Hydroxychloroquine and azithromycin as a treatment of COVID‐19: results of an open‐label non‐randomized clinical trial, International Journal of Antimicrobial Agents, 17 mars 2020, DOI 10.1016/j.ijantimicag.2020.105949
- (en) Franck Touret et Xavier de Lamballerie, « Of chloroquine and COVID-19 », Antiviral Research, vol. 177, , p. 104762 (DOI 10.1016/j.antiviral.2020.104762, lire en ligne, consulté le ).
- « VIDÉO - Coronavirus : le traitement à la chloroquine testé à Marseille serait efficace », sur France Bleu, (consulté le ).
- « La chloroquine, une piste pour lutter contre le SARS-CoV-2 », Le Monde, (lire en ligne, consulté le ).
- « Exclusif - Coronavirus : « On sait guérir la maladie », affirme l'infectiologue Didier Raoult », Les Échos, (consulté le ).
- (en) Philippe Gautret, Jean Christophe Lagier, Philippe Parola et Van Thuan Hoang, « Hydroxychloroquine and Azithromycin as a treatment of COVID-19: preliminary results of an open-label non-randomized clinical trial », medRxiv, , p. 2020.03.16.20037135 (DOI 10.1101/2020.03.16.20037135, lire en ligne, consulté le ).
- (en) Philippe Gautret, Jean-Christophe Lagier, Philippe Parola et Van Thuan Hoang, « Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial », International Journal of Antimicrobial Agents, , p. 105949 (DOI 10.1016/j.ijantimicag.2020.105949, lire en ligne, consulté le ).
- « Chloroquine : un remède français contre le Covid-19 ? », France Culture, (consulté le ).
- (en) Dahly D., Gates S. & Morris T., « Statistical review of Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial », Zenodo preprints, (lire en ligne).
- (en) Author eliesbik, « Thoughts on the Gautret et al. paper about Hydroxychloroquine and Azithromycin treatment of COVID-19 infections », sur Science Integrity Digest, (consulté le ).
- (en) « Hydroxychloroquine and Azithromycin as a treatment of COVID-19: preliminary results of an open-label non-randomized clinical trial », sur PubPeer.
- « Chloroquine : le protocole Raoult », sur France Culture, (consulté le )
- « Coronavirus : Résultat d'analyse Dr.RAOULT », MEDIAPART, (lire en ligne, consulté le ).
- « Chloroquine et Covid-19 : tout ce qu'il faut savoir », sur futura-sciences.com, (consulté le ).
- « COVID-19 : la bagarre pour publier vite n'est pas acceptable car de mauvais articles sont diffusés aux journalistes et patients »
- « Editorial board - International journal of antimicrobial agents »
- « Statement on IJAA paper Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial (Gautret P et al. ) »
- (en) M. T. C. Media, « ISAC / Elsevier Statement | International Society of Antimicrobial Chemotherapy », sur www.isac.world (consulté le )
- Jérôme Vincent, « À l'hôpital Bichat, le raout sur la chloroquine nous affecte », sur Le Point, (consulté le )
- (en) Elizabeth Cohen et Dr. Minali Nigam, « Publisher of hydroxychloroquine study touted by Trump says the research didn't meet its standards », CNN, (lire en ligne, consulté le ).
- « Coronavirus : "On ne va pas s'en tirer avec un mois de confinement" (Renaud Piarroux) », sur LaProvence.com, (consulté le )
- « fnc-tucker-20200318-coronavirus-drug-rigano | Media Matters for America », sur www.mediamatters.org (consulté le )
- https://www.parismatch.com/Actu/International/Apres-une-mort-l-enthousiasme-de-Trump-pour-la-chloroquine-questionne-1679900
- « Après une mort, l'enthousiasme de Trump pour la chloroquine questionné », Paris Match (consulté le ).
- « De Marseille à Fox News : comment les essais de Didier Raoult sur la chloroquine ont convaincu Donald Trump », sur Marianne, (consulté le ).
- (en) Katie Thomas et Denise Grady, « Trump’s Embrace of Unproven Drugs to Treat Coronavirus Defies Science », The New York Times, (consulté le ).
- (en-GB) David Smith, « Trump sows confusion with claim coronavirus drug will be ready soon », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- « Pandémie. Coronavirus : Trump sème la confusion en promettant un traitement presque immédiatement », sur Courrier international, (consulté le ).
- Rouguyata Sall, « Coronavirus : pourquoi la chloroquine est exclue de l’essai clinique national », sur Mediapart (consulté le ).
- (en) « Plaquenil (hydroxychloroquine sulfate) dose, indications, adverse effects, interactions... from PDR.net », www.pdr.net (consulté le )
- (en) Colson P, Rolain JM, Lagier JC, Brouqui P et Raoult D, « Chloroquine and hydroxychloroquine as available weapons to fight COVID-19 », Int. J. Antimicrob. Agents, , p. 105932 (PMID 32145363, DOI 10.1016/j.ijantimicag.2020.105932).
- Florian Gouthière, « Covid-19 : la chloroquine a-t-elle été utilisée pour soigner les malades en Chine ? », sur Libération.fr, (consulté le )
- (en) Franck Touret et Xavier de Lamballerie, « Of chloroquine and COVID-19 », Antiviral Research, vol. 177, , p. 104762 (ISSN 0166-3542, DOI 10.1016/j.antiviral.2020.104762, lire en ligne, consulté le ).
- (en-CA) News, « Arizona man dies, wife in critical condition after taking aquarium cleaner containing malaria drug for coronavirus », sur nationalpost.com, (consulté le ).
- « Coronavirus : un homme meurt après avoir avalé du phosphate de chloroquine, un produit pour aquarium », sur LA VDN, (consulté le ).
- « Des cas d'empoisonnement à la chloroquine », sur TVA Nouvelles (consulté le ).
- (en-GB) Julia Carrie Wong, « Hydroxychloroquine: how an unproven drug became Trump’s coronavirus miracle cure », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le )
- Décret no 2020-314 du 25 mars 2020 complétant le décret no 2020-293 du 23 mars 2020 prescrivant les mesures générales nécessaires pour faire face à l'épidémie de Covid-19 dans le cadre de l'état d'urgence sanitaire, (lire en ligne)
- « Coronavirus : le gouvernement autorise la prescription de chloroquine en traitement du Covid-19 », sur France 3 Provence-Alpes-Côte d'Azur (consulté le )
- « Covid-19 : L'hydroxychloroquine autorisée à l’hôpital pour le traitement des formes graves uniquement », sur Sciences et Avenir (consulté le )
- « COVID-19 : les ordonnances de chloroquine et d’hydroxychloroquine jugées inappropriées », sur Collège des médecins du Québec (consulté le ).
- « Chloroquine pour la COVID-19: des ordonnances «inappropriées et non indiquées» », sur Le Soleil, (consulté le ).
- Philippe Gautret et al., « Clinical and microbiological effect of a combination of hydroxychloroquine and azithromycin in 80 COVID-19 patients with at least a six-day follow up: an observational study », sur https://www.mediterranee-infection.com/,
- « Coronavirus et hydroxychloroquine : le professeur Raoult publie une nouvelle étude, aussitôt critiquée », Le Monde.fr, (lire en ligne, consulté le )
- (en) Waleed Alhazzani, Morten Hylander Møller, Yaseen M. Arabi et Mark Loeb, « Surviving Sepsis Campaign: guidelines on the management of critically ill adults with Coronavirus Disease 2019 (COVID-19) », Intensive Care Medicine, (ISSN 0342-4642 et 1432-1238, DOI 10.1007/s00134-020-06022-5, lire en ligne, consulté le )
- (en) Vincent MJ, Bergeron E, Benjannet S, Erickson BR, Rollin PE, Ksiazek TG, Seidah NG, Nichol ST, « Chloroquine is a potent inhibitor of SARS coronavirus infection and spread », Virol J, no 2, , p. 69. (PMID 16115318, PMCID PMC1232869, DOI 10.1186/1743-422X-2-69, lire en ligne [html])
- (en) Roques P, Thiberville SD, Dupuis-Maguiraga L, Lum FM, Labadie K, Martinon F, Gras G, Lebon P, de Lamballerie X, Le Grand R, « Paradoxical Effect of Chloroquine Treatment in Enhancing Chikungunya Virus Infection », Viruses, (PMID 29772762, PMCID PMC5977261, DOI 10.3390/v10050268)
- Chen ZW, Hu JJ, Zhang ZW et al. , Efficacy of hydroxychloroquine in patients with COVID-19: results of a randomized clinical trial, medRxiv, 30/03/2020
- Vidal, Premiers résultats cliniques positifs pour l’hydroxychloroquine dans la COVID-19 modérée[3]
- La Croix, Coronavirus: nouvelles études sur un possible traitement à la chloroquine, 31/03/2020
- Science (revue), Comparing HydroxyChloroquine Trials, 31/03/2020
- Heidi.news, Pour la première fois, un essai mené à Wuhan confirme l'intérêt de la chloroquine contre le coronavirus, 31/03/2020
- Jean Michel Molina, Constance Delaugerre, Jerome Le Goff et Breno Mela-Lima, « No Evidence of Rapid Antiviral Clearance or Clinical Benefit with the Combination of Hydroxychloroquine and Azithromycin in Patients with Severe COVID-19 Infection », Médecine et Maladies Infectieuses, (ISSN 0399-077X, DOI 10.1016/j.medmal.2020.03.006, lire en ligne, consulté le )
- « Chloroquine: «Ne perdons plus de temps !», l'appel de personnalités médicales », sur leparisien.fr,
- Le Figaro, Chloroquine: l’appel de trois grands noms de la santé en faveur des préconisations du Pr Raoult, 05/04/2020
- Le Point, Une pétition en faveur de la chloroquine dépasse les 200.000 signataires, 05/04/2020
- Jacqueline Howard, Elizabeth Cohen, Nadia Kounang and Per Nyberg CNN, « Heart risk concerns mount around use of chloroquine and hydroxychloroquine for Covid-19 treatment », sur CNN (consulté le )
- (en) « Caution recommended on COVID-19 treatment with hydroxychloroquine and azithromycin for patients with cardiovascular disease », sur heart.org,
- (en) Yves Sciama, « Is France’s president fueling the hype over an unproven coronavirus treatment? », sur Science | AAAS, (consulté le )
- Les Échos, Exclusif - Didier Raoult dévoile à Emmanuel Macron une étude estimant à 91 % l'efficacité de son traitement contre le coronavirus Chloroquine: ce que contiennent les résultats de la dernière étude du professeur Raoult, 09/04/2020
- BFM TV, Chloroquine: ce que contiennent les résultats de la dernière étude du professeur Raoult, 09/04/2020
- France Info, Coronavirus : que vaut la nouvelle étude du professeur Raoult, qui vante l'efficacité de l'hydroxychloroquine ?[4]
- « Coronavirus : les effets indésirables graves s’accumulent sur l’hydroxychloroquine », Le Monde.fr, (lire en ligne, consulté le )
- France Info[5]
- Libération[6]
- (en) Million et al., « Early treatment of 1061 COVID-19 patients with hydroxychloroquine and azithromycin, Marseille, France » (consulté le ), p. 3
- « En Suède, le désamour pour l’hydroxychloroquine », Le Monde.fr, (lire en ligne, consulté le )
- Damien Coulomb, « Covid-19 : les travaux du Pr Raoult sur l'association hydroxychloroquine + azithromycine seraient-ils hors-la-loi ? », Le Quotidien du médecin, (lire en ligne, consulté le ).
- « « Hydroxychloroquine, l’amour à mort » », Le Monde.fr, (lire en ligne, consulté le )
- Pascale Pascariello, « Chloroquine: de plus en plus de complications cardiaques signalées », sur Mediapart (consulté le )
- « Hydroxychloroquine : primum non nocere », sur France Culture,
- « Covid-19 : nouvelle alerte sur les effets indésirables de l’hydroxychloroquine », Le Monde.fr, (lire en ligne, consulté le )
- ANSM[7]
- (en) Mayla Borba, Fernando de Almeida Val, Vanderson Sousa Sampaio et Marcia Araujo Alexandre, « Chloroquine diphosphate in two different dosages as adjunctive therapy of hospitalized patients with severe respiratory syndrome in the context of coronavirus (SARS-CoV-2) infection: Preliminary safety results of a randomized, double-blinded, phase IIb clinical trial (CloroCovid-19 Study) », medRxiv, , p. 2020.04.07.20056424 (DOI 10.1101/2020.04.07.20056424, lire en ligne, consulté le )
- (en-US) Katie Thomas et Knvul Sheikh, « Small Chloroquine Study Halted Over Risk of Fatal Heart Complications », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le )
- (en) Rachael Rettner-Senior Writer 13 April 2020, « Trial of chloroquine to treat COVID-19 stopped early due to heart complications », sur livescience.com (consulté le )
- [8]
- (en) Jennifer C. E. Lane, James Weaver, Kristin Kostka et Talita Duarte-Salles, « Safety of hydroxychloroquine, alone and in combination with azithromycin, in light of rapid wide-spread use for COVID-19: a multinational, network cohort and self-controlled case series study », medRxiv, , p. 2020.04.08.20054551 (DOI 10.1101/2020.04.08.20054551, lire en ligne, consulté le ) :
« Conclusions: Short-term hydroxychloroquine treatment is safe, but addition of azithromycin may induce heart failure and cardiovascular mortality, potentially due to synergistic effects on QT length. We call for caution if such combination is to be used in the management of Covid-19. »
- (en) Kelly ServickApr. 21 et 2020, « Antimalarials widely used against COVID-19 heighten risk of cardiac arrest. How can doctors minimize the danger? », sur Science | AAAS, (consulté le )
- Santé Canada met en garde contre la chloroquine et l'hydroxychloroquine[9]
- (en) Heidi Ledford, « Chloroquine hype is derailing the search for coronavirus treatments », Nature, vol. 580, , p. 573–573 (DOI 10.1038/d41586-020-01165-3, lire en ligne, consulté le )
- Chloroquine : l'anti-viral qui paralyse la recherche médicale mondiale[10]
- (en) Alex John London et Jonathan Kimmelman, « Against pandemic research exceptionalism », Science, (ISSN 0036-8075 et 1095-9203, PMID 32327600, DOI 10.1126/science.abc1731, lire en ligne, consulté le )
- « Une épidémie de mauvaise science », Le Temps, (ISSN 1423-3967, lire en ligne, consulté le )
- Covid-19 : selon la pharmacocinétique, le traitement à l'hydroxychloroquine ne peut pas marcher[11]
- « Hydroxychloroquine application is associated with a decreased mortality in critically ill patients with COVID-19 », sur medrxiv
- « Coronavirus - Une première étude confirme l'efficacité de l'hydroxychloroquine pour les patients gravement atteints », sur lindependant.fr,
- « Veille scientifique sur le COVID-19: Hydroxychloroquine application is associated with a decreased mortality in critically ill patients with COVID-19 », sur Bibliovid (consulté le )
- « Lecture critique de l’étude de Yu et al. MedRxiv 2020 (FR+ENG) »
- « Coronavirus - Etude chinoise sur la chloroquine: Didier Raoult appelle "à ne plus restreindre son utilisation" », sur lindependant.fr,
- Europe 1, Chloroquine : "Pas le début du commencement d'une preuve que c'est efficace" contre le Covid-19[12]
- Le Quotidien du médecin, Un traitement efficace contre Covid-19 existe ! Deux études vont clore la polémique Raoult, estime un microbiologiste[13]
- Joshua Geleris, Yifei Sun, Jonathan Platt et Jason Zucker, « Observational Study of Hydroxychloroquine in Hospitalized Patients with Covid-19 », New England Journal of Medicine, vol. 0, no 0, , null (ISSN 0028-4793, PMID 32379955, PMCID PMC7224609, DOI 10.1056/NEJMoa2012410, lire en ligne, consulté le )
- (en) Eli S. Rosenberg, Elizabeth M. Dufort, Tomoko Udo et Larissa A. Wilberschied, « Association of Treatment With Hydroxychloroquine or Azithromycin With In-Hospital Mortality in Patients With COVID-19 in New York State », JAMA, (DOI 10.1001/jama.2020.8630, lire en ligne, consulté le )
- Nicolas Martin, « Et l’hydroxychloroquine dans tout ça ? », sur France Culture (consulté le )
- (en) « Clinical efficacy of hydroxychloroquine in patients with covid-19 pneumonia who require oxygen: observational comparative study using routine care data », British Medical Journal (BMJ), (lire en ligne)
- (en) « Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial », British Medical Journal (BMJ), (lire en ligne)
- « Coronavirus : deux études concluent à l'inefficacité de l'hydroxychloroquine contre le Covid-19 », France Info, (lire en ligne)
- (en) Mandeep R. Mehra, Sapan S. Desai, Frank Ruschitzka et Amit N. Patel, « Hydroxychloroquine or chloroquine with or without a macrolide for treatment of COVID-19: a multinational registry analysis », The Lancet, vol. 0, no 0, (ISSN 0140-6736 et 1474-547X, DOI 10.1016/S0140-6736(20)31180-6, lire en ligne, consulté le )
- https://www.theguardian.com/science/2020/may/22/hydroxychloroquine-trumps-covid-19-cure-increases-deaths-global-study-finds
- Société MedinCell, french-leader.com (consulté le ).
- (en) Leon Caly, Julian D. Druce, Mike G. Catton et David A. Jans, « The FDA-approved drug ivermectin inhibits the replication of SARS-CoV-2 in vitro », Antiviral Research, vol. 178, , p. 104787 (ISSN 0166-3542, PMID 32251768, PMCID PMC7129059, DOI 10.1016/j.antiviral.2020.104787, lire en ligne, consulté le )
- « Coronavirus : une entreprise héraultaise en passe de trouver un traitement contre le covid-19 ? », publié le sur le site Actu.fr/metropolitain (consulté le )
- (en) Veronika Götz, Linda Magar, Dominik Dornfeld et Sebastian Giese, « Influenza A viruses escape from MxA restriction at the expense of efficient nuclear vRNP import », Scientific Reports, vol. 6, no 1, , p. 1–15 (ISSN 2045-2322, PMID 26988202, PMCID PMC4796820, DOI 10.1038/srep23138, lire en ligne, consulté le )
- (en) Lindsay Lundberg, Chelsea Pinkham, Alan Baer et Moushimi Amaya, « Nuclear import and export inhibitors alter capsid protein distribution in mammalian cells and reduce Venezuelan Equine Encephalitis Virus replication », Antiviral Research, vol. 100, no 3, , p. 662–672 (ISSN 0166-3542, DOI 10.1016/j.antiviral.2013.10.004, lire en ligne, consulté le )
- (en) M. Y. F. Tay, J. E. Fraser, W. K. K. Chan et N. J. Moreland, « Nuclear localization of dengue virus (DENV) 1–4 non-structural protein 5; protection against all 4 DENV serotypes by the inhibitor Ivermectin », Antiviral Research, vol. 99, no 3, , p. 301–306 (ISSN 0166-3542, DOI 10.1016/j.antiviral.2013.06.002, lire en ligne, consulté le )
- (en) Kylie M. Wagstaff, Haran Sivakumaran, Steven M. Heaton et David Harrich, « Ivermectin is a specific inhibitor of importin α/β-mediated nuclear import able to inhibit replication of HIV-1 and dengue virus », Biochemical Journal, vol. 443, no 3, , p. 851–856 (ISSN 0264-6021, PMID 22417684, PMCID PMC3327999, DOI 10.1042/BJ20120150, lire en ligne, consulté le )
- (en) Amit Patel, « Usefulness of Ivermectin in COVID-19 Illness », {{Article}} : paramètre «
périodique» manquant, Social Science Research Network, no ID 3580524, (lire en ligne, consulté le ) - Le Quotidien du Médecin, Covid-19 : avec l'essai Stroma-CoV-2, l’AP-HP mise sur les cellules stromales mésenchymateuses de sang de cordon pour contrôler le syndrome de détresse respiratoire aigu, 03/04/2020
- « Potentiel remède contre le Covid-19, le sang de ver marin passe à l’essai », sur www.pourquoidocteur.fr (consulté le )
- « Covid-19 : l'essai clinique avec le sang de ver marin a été précipitamment interrompu », sur Sciences et Avenir (consulté le )
- « L'essai clinique avec du sang de vers marins pour les malades du Covid-19 suspendu "en urgence" », sur Le Huffington Post, (consulté le )
- « Covid-19 : un point sur les traitements » [audio], sur France Culture, (consulté le )
- « Risques de surdosage grave de la colchicine - Rappel des règles de bon usage - Point d'Information - ANSM : Agence nationale de sécurité du médicament et des produits de santé », sur ansm.sante.fr (consulté le )
- « COVID-19 : pourquoi envisager la colchicine ? », sur Medscape (consulté le )
- (en) Makoto Miyara, Florence Tubach, Valérie Pourcher et Capucine Morelot-Panzini, « Low incidence of daily active tobacco smoking in patients with symptomatic COVID-19 », Qeios, (ISSN 2632-3834, DOI 10.32388/WPP19W.3, lire en ligne, consulté le )
- (en) Jean-Pierre Changeux, Zahir Amoura, Felix Rey et Makoto Miyara, « A nicotinic hypothesis for Covid-19 with preventive and therapeutic implications », Qeios, (ISSN 2632-3834, DOI 10.32388/FXGQSB, lire en ligne, consulté le )
- (en) Yanwei Li, Wei Zhou, Li Yang et Ran You, « Physiological and pathological regulation of ACE2, the SARS-CoV-2 receptor », Pharmacological Research, , p. 104833 (ISSN 1043-6618, DOI 10.1016/j.phrs.2020.104833, lire en ligne, consulté le )
- Outi Saijonmaa, Tuulikki Nyman et Frej Fyhrquist, « Regulation of angiotensin-converting enzyme production by nicotine in human endothelial cells », American Journal of Physiology-Heart and Circulatory Physiology, vol. 289, no 5, , H2000–H2004 (ISSN 0363-6135, DOI 10.1152/ajpheart.01238.2004, lire en ligne, consulté le )
- (en) Jesus Gonzalez-Rubio, « Cytokine release syndrome (CRS) and nicotine in COVID-19 patients: trying to calm the storm », sur osf.io, OSF Preprints, (DOI 10.31219/osf.io/chd2k, consulté le )
- « Coronavirus: la nicotine, une alliée potentielle contre le Covid-19? », sur RFI, (consulté le )
Articles connexes
Liens externes
- COVID-19 ( Questions & Réponses ) par l' Organisation mondiale de la santé
- COVID-19 ( Q&A ) par les Centers for Disease Control and Prevention (CDC) des États - Unis
- Coronavirus par l'Institut national américain des allergies et des maladies infectieuses
- COVID-19 ( Q&A ) par le Centre européen de prévention et de contrôle des maladies
- COVID-19 par la Commission nationale chinoise de la santé
- Site de la base de données de ClinicalTrials
