« Biodiversité marine des lagons de La Réunion » : différence entre les versions
→Gastéropodes : +1 |
+18 |
||
| Ligne 421 : | Ligne 421 : | ||
=== [[Ophiure]]s === |
=== [[Ophiure]]s === |
||
Les ophiures (du grec ''ophis'', « serpent », et ''oura'', « queue »<ref name="OphiureEtymo">{{Lien web |langue=fr |auteur= |lien auteur= |coauteurs= |url=http://www.cnrtl.fr/definition/academie9/ophiure |titre=Ophiure |série= |jour= |mois= |année= |site=Dictionnaire de l'cadémie Française, 9e édition |éditeur= |isbn= |page= |citation= |en ligne le= |consulté le= |id= }}.</ref>) ne sont pas des étoiles de mer, mais un groupe proche (toutes deux font partie de la sous-classe des [[Asterozoa]]). Parmi les différences on trouve des bras très fins et très souples, indépendants du corps, qui ne se touchent pas à leur base, et l’absence d’anus (les rejets se font par la bouche). Elles sont de surcroît beaucoup plus rapides, et se déplacent en se portant sur leurs longs bras. Le corps discoïdal est aplati sur la face inférieure, et généralement bombé en face supérieure. Il existe un ordre d’ophiures dont la morphologie est totalement différente, les [[Euryalida]] ou « gorgonocéphales », dont les nombreux et longs bras très ramifiés se déploient la nuit pour capturer le plancton ; on n'en trouve pas dans les lagons de la Réunion. |
Les ophiures (du grec ''ophis'', « serpent », et ''oura'', « queue »<ref name="OphiureEtymo">{{Lien web |langue=fr |auteur= |lien auteur= |coauteurs= |url=http://www.cnrtl.fr/definition/academie9/ophiure |titre=Ophiure |série= |jour= |mois= |année= |site=Dictionnaire de l'cadémie Française, 9e édition |éditeur= |isbn= |page= |citation= |en ligne le= |consulté le= |id= }}.</ref>) ne sont pas des étoiles de mer, mais un groupe proche (toutes deux font partie de la sous-classe des [[Asterozoa]]). Parmi les différences on trouve des bras très fins et très souples, indépendants du corps, qui ne se touchent pas à leur base, et l’absence d’anus (les rejets se font par la bouche). Elles sont de surcroît beaucoup plus rapides, et se déplacent en se portant sur leurs longs bras. Le corps discoïdal est aplati sur la face inférieure, et généralement bombé en face supérieure. Il existe un ordre d’ophiures dont la morphologie est totalement différente, les [[Euryalida]] ou « gorgonocéphales », dont les nombreux et longs bras très ramifiés se déploient la nuit pour capturer le plancton ; on n'en trouve pas dans les lagons de la Réunion. |
||
La détermination de l’espèce, voire du genre, est particulièrement difficile chez les ophiures et demande souvent un examen microscopique, quand ce n’est pas une analyse ADN<ref name="OphiuresADN">{{article|langue=en|prénom1=Sabine|nom1=Stöhr|prénom2=Timothy D.|nom2=O'Hara|prénom3=Ben|nom3=Thuy|titre=Global Diversity of Brittle Stars (Echinodermata: Ophiuroidea) |périodique=|volume=PLOS One|numéro=|année=2012|pages=|issn=|DOI=10.1371/journal.pone.0031940|url=http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0031940}}.</ref>. |
|||
<gallery mode="packed"> |
<gallery mode="packed"> |
||
Fichier:Ophiocoma erinacea.jpg|<center>Ophiure noire (''[[Ophiocoma erinaceus]]'')</center> |
Fichier:Ophiocoma erinacea.jpg|<center>Ophiure noire (''[[Ophiocoma erinaceus]]'')</center> |
||
| Ligne 476 : | Ligne 477 : | ||
Fichier:Holothuria arenicola.jpg|Holothurie des sables (''[[Holothuria arenicola]]'') |
Fichier:Holothuria arenicola.jpg|Holothurie des sables (''[[Holothuria arenicola]]'') |
||
Fichier:Holothuria atra.jpg|Holothurie à ocelles noires (''[[Holothuria atra]]'') |
Fichier:Holothuria atra.jpg|Holothurie à ocelles noires (''[[Holothuria atra]]'') |
||
Fichier:Holothuria cinerascens Réunion.jpg|Holothurie cendrée (''[[Holothuria cinerascens]]'') |
Fichier:Holothuria cinerascens Réunion.jpg|<center>Holothurie cendrée (''[[Holothuria cinerascens]]'')</center> |
||
Fichier:Holothuria difficilis Réunion.jpg|Holothurie difficile (''[[Holothuria difficilis]]'') |
Fichier:Holothuria difficilis Réunion.jpg|<center>Holothurie difficile (''[[Holothuria difficilis]]'')</center> |
||
Fichier:Holothuria flavomaculata Réunion.jpg|Holothurie-serpent rouge (''[[Holothuria flavomaculata]]'') |
Fichier:Holothuria flavomaculata Réunion.jpg|<center>Holothurie-serpent rouge (''[[Holothuria flavomaculata]]'')</center> |
||
Fichier:Holothuria fuscocinerea.jpg|Holothurie cendre brune (''[[Holothuria fuscocinerea]]''), de nuit. |
Fichier:Holothuria fuscocinerea.jpg|<center>Holothurie cendre brune (''[[Holothuria fuscocinerea]]''), de nuit.</center> |
||
Fichier:Holothuria hilla Réunion.jpg|Holothurie contractile (''[[Holothuria hilla]]'') |
Fichier:Holothuria hilla Réunion.jpg|<center>Holothurie contractile (''[[Holothuria hilla]]'')</center> |
||
Fichier:Holothuria impatiens Réunion.jpg|''[[Holothuria impatiens]]'' |
Fichier:Holothuria impatiens Réunion.jpg|<center>''[[Holothuria impatiens]]''</center> |
||
Fichier:Holothuria leucospilota Réunion 2.jpg|<center>Holothurie noire de l'Indo-Pacifique (''[[Holothuria leucospilota]]'')</center> |
Fichier:Holothuria leucospilota Réunion 2.jpg|<center>Holothurie noire de l'Indo-Pacifique (''[[Holothuria leucospilota]]'')</center> |
||
Fichier:Holothuria lineata Réunion.jpg|''[[Holothuria lineata]]'' |
Fichier:Holothuria lineata Réunion.jpg|<center>''[[Holothuria lineata]]''</center> |
||
Fichier:Holothuria nobilis.jpg|Holothurie noire à mamelles (''[[Holothuria nobilis]]'') |
Fichier:Holothuria nobilis.jpg|<center>Holothurie noire à mamelles (''[[Holothuria nobilis]]'')</center> |
||
Fichier:Holothuria pardalis.jpg|''[[Holothuria verrucosa]]'' |
Fichier:Holothuria pardalis.jpg|<center>''[[Holothuria verrucosa]]''</center> |
||
Fichier:Holothuria pervicax Réunion.jpg|<center>Holothurie têtue (''[[Holothuria pervicax]]'')</center> |
Fichier:Holothuria pervicax Réunion.jpg|<center>Holothurie têtue (''[[Holothuria pervicax]]'')</center> |
||
Fichier:Holothuria (Stauropora) sp..jpg|''[[Holothuria|Holothuria (Stauropora)]] sp.'' |
Fichier:Holothuria (Stauropora) sp..jpg|<center>''[[Holothuria|Holothuria (Stauropora)]] sp.''</center> |
||
Fichier:Stichopus chloronotus Réunion.jpg|<center>Holothurie verte (''[[Stichopus chloronotus]]'')</center> |
Fichier:Stichopus chloronotus Réunion.jpg|<center>Holothurie verte (''[[Stichopus chloronotus]]'')</center> |
||
Fichier:Stichopus |
Fichier:Stichopus herrmanni Réunion.jpg|<center>Une holothurie curry (''[[Stichopus herrmanni]]'')</center> |
||
Fichier:Stichopus monotuberculatus Réunion.jpg|<center>Holothurie dragon (''[[Stichopus monotuberculatus]]'')</center> |
|||
</gallery> |
</gallery> |
||
| Ligne 503 : | Ligne 505 : | ||
Fichier:Conus coronatus Réunion.jpg|''[[Conus coronatus]]'' |
Fichier:Conus coronatus Réunion.jpg|''[[Conus coronatus]]'' |
||
Fichier:Conus ebraeus.jpg|Cône hébreu (''[[Conus ebraeus]]'') |
Fichier:Conus ebraeus.jpg|Cône hébreu (''[[Conus ebraeus]]'') |
||
Fichier:Conus frigidus à confirmer.jpg|''[[Conus frigidus]]'' |
|||
Fichier:Conus lividus Réunion.jpg|Cône livide (''[[Conus lividus]]'') |
Fichier:Conus lividus Réunion.jpg|Cône livide (''[[Conus lividus]]'') |
||
Fichier:Conus miles Réunion.jpg|Cône soldat (''[[Conus miles]]'') |
Fichier:Conus miles Réunion.jpg|Cône soldat (''[[Conus miles]]'') |
||
Fichier:Conus miliaris.jpg|''[[Conus miliaris]]'' |
|||
Fichier:Conus nussatella.jpg|Cône nussatelle (''[[Conus nussatella]]'') |
Fichier:Conus nussatella.jpg|Cône nussatelle (''[[Conus nussatella]]'') |
||
Fichier:Conus striatus (de nuit).jpg|Cône strié (''[[Conus striatus]]''), de nuit. |
Fichier:Conus striatus (de nuit).jpg|Cône strié (''[[Conus striatus]]''), de nuit. |
||
Fichier:Conus violaceus (très rare à LR, assez rare ailleurs).jpg|Cône violacé (''[[Conus violaceus]]''), rare. |
Fichier:Conus violaceus (très rare à LR, assez rare ailleurs).jpg|Cône violacé (''[[Conus violaceus]]''), rare. |
||
Fichier:Conus virgo (robe brune rare).jpg|Cône vierge (''[[Conus virgo]]''), en robe brune, ce qui est rare. |
Fichier:Conus virgo (robe brune rare).jpg|Cône vierge (''[[Conus virgo]]''), en robe brune, ce qui est rare. |
||
Fichier:Mitra acuminata.jpg|''[[Mitra acuminata]]'' |
|||
Fichier:Mitra (Mitra) coffea.jpg|''[[Mitra coffea|Mitra (Mitra) coffea]]'' |
Fichier:Mitra (Mitra) coffea.jpg|''[[Mitra coffea|Mitra (Mitra) coffea]]'' |
||
Fichier:Drupa rubusidaeus Réunion.jpg|''[[Drupa rubusidaeus]]'' |
Fichier:Drupa rubusidaeus Réunion.jpg|''[[Drupa rubusidaeus]]'' |
||
| Ligne 548 : | Ligne 553 : | ||
Fichier:Cerithium alucastrum.jpg|''[[Cerithium alucastrum]]''{{Exp|?}} |
Fichier:Cerithium alucastrum.jpg|''[[Cerithium alucastrum]]''{{Exp|?}} |
||
Fichier:Cerithium echinatum, à confirmer.jpg|''[[Cerithium echinatum]]''{{Exp|?}} |
Fichier:Cerithium echinatum, à confirmer.jpg|''[[Cerithium echinatum]]''{{Exp|?}} |
||
[[File:Cerithium nesioticum.jpg|Un ''[[Cerithium nesioticum]]'' prédaté |
|||
Fichier:Cerithium sp..jpg|''[[Cerithium]] sp.'' (probablement ''[[Cerithium columna|C. columna]]'') |
Fichier:Cerithium sp..jpg|''[[Cerithium]] sp.'' (probablement ''[[Cerithium columna|C. columna]]'') |
||
Fichier:Cerithium torulosum.jpg|''[[Cerithium torulosum]]'' |
Fichier:Cerithium torulosum.jpg|''[[Cerithium torulosum]]'' |
||
| Ligne 622 : | Ligne 628 : | ||
Fichier:Berthellina sp..jpg|Une berthelline (''[[Berthellina]] sp.'') |
Fichier:Berthellina sp..jpg|Une berthelline (''[[Berthellina]] sp.'') |
||
Fichier:Umbraculum umbraculum Réunion.jpg|Ombrelle (''[[Umbraculum umbraculum]]'') |
Fichier:Umbraculum umbraculum Réunion.jpg|Ombrelle (''[[Umbraculum umbraculum]]'') |
||
Fichier:Coquille de Bulla vernicosa.jpg|Une coquille de ''[[Bulla vernicosa]]'' |
|||
</gallery> |
</gallery> |
||
| Ligne 649 : | Ligne 656 : | ||
Fichier:Acrosterigma discus.jpg|Un bivalve ''[[Acrosterigma discus]]'' (couverte par du [[mycélium]] de champignon marin) |
Fichier:Acrosterigma discus.jpg|Un bivalve ''[[Acrosterigma discus]]'' (couverte par du [[mycélium]] de champignon marin) |
||
Fichier:Pinna muricata Réunion.jpg|''[[Pinna muricata]]'' |
Fichier:Pinna muricata Réunion.jpg|''[[Pinna muricata]]'' |
||
Fichier:Cardita variegata.jpg|''[[Cardita variegata]]'' |
|||
Fichier:Un bivalve de la famille des Galeommatidae.jpg|''[[Amphilepida aurantia]]''{{Exp|?}}. |
Fichier:Un bivalve de la famille des Galeommatidae.jpg|''[[Amphilepida aurantia]]''{{Exp|?}}. |
||
Fichier:Pinctada sp..jpg|Un bivalve du genre ''[[Pinctada]]'' |
|||
Fichier:Pectinidae à déterminer.jpg|Un bivalve non identifié de la famille des [[Pectinidae]] |
|||
Fichier:Pteriidae à déterminer (juvénile probable).jpg|Un bivalve non identifié de la famille des [[Pteriidae]] |
|||
Fichier:Ostreidae à déterminer - 1.jpg|Un bivalve non identifié |
|||
Fichier:Ostreidae à déterminer - 2.jpg|Un bivalve non identifié |
|||
Fichier:Ostreidae à déterminer - 3.jpg|Un bivalve non identifié |
|||
Fichier:Ostreidae à déterminer - 4.jpg|Un bivalve non identifié |
|||
Fichier:Ostreidae à déterminer - 5.jpg|Un bivalve non identifié |
|||
Fichier:Bivalve à déterminer.jpg|Un bivalve non identifié |
|||
</gallery> |
</gallery> |
||
| Ligne 699 : | Ligne 716 : | ||
Fichier:Calcinus latens.jpg|Bernard-l'ermite du Japon (''[[Calcinus latens]]'') |
Fichier:Calcinus latens.jpg|Bernard-l'ermite du Japon (''[[Calcinus latens]]'') |
||
Fichier:Calcinus morgani.JPG|''[[Calcinus morgani]]'' |
Fichier:Calcinus morgani.JPG|''[[Calcinus morgani]]'' |
||
Fichier:Calcinus rosaceus.jpg|''[[Calcinus rosaceus]]'' |
|||
Fichier:Clibanarius humilis.jpg|''[[Clibanarius humilis]]'' |
Fichier:Clibanarius humilis.jpg|''[[Clibanarius humilis]]'' |
||
Fichier:Coenobita rugosus Réunion.JPG|Bernard-l'ermite terrestre ou Cénobite stridulant (''[[Coenobita rugosus]]''), sur une plage. |
Fichier:Coenobita rugosus Réunion.JPG|Bernard-l'ermite terrestre ou Cénobite stridulant (''[[Coenobita rugosus]]''), sur une plage. |
||
| Ligne 726 : | Ligne 744 : | ||
Fichier:Periclimenes soror, sur Cucita schmideliana.JPG|Crevette des astérides (''[[Periclimenes soror]]'') sur une [[Culcita schmideliana|étoile-coussin]]. |
Fichier:Periclimenes soror, sur Cucita schmideliana.JPG|Crevette des astérides (''[[Periclimenes soror]]'') sur une [[Culcita schmideliana|étoile-coussin]]. |
||
Fichier:Saron marmoratus (de nuit).jpg|Crevette marbrée (''[[Saron marmoratus]]''), de nuit. |
Fichier:Saron marmoratus (de nuit).jpg|Crevette marbrée (''[[Saron marmoratus]]''), de nuit. |
||
Fichier:Saron neglectus Réunion.JPG|''[[Saron neglectus]]'' dans un massif de ''[[Pocillopora]]'' |
|||
Fichier:Cinetorhynchus hendersoni, de nuit.jpg|''[[Cinetorhynchus hendersoni]]'' |
Fichier:Cinetorhynchus hendersoni, de nuit.jpg|''[[Cinetorhynchus hendersoni]]'' |
||
Fichier:Stegopontonia commensalis, sur Diadematidae.jpg|Crevette des oursins (''[[Stegopontonia commensalis]]'') sur un ''[[Diadema (animal)|Diadema]]'' |
Fichier:Stegopontonia commensalis, sur Diadematidae.jpg|Crevette des oursins (''[[Stegopontonia commensalis]]'') sur un ''[[Diadema (animal)|Diadema]]'' |
||
Version du 17 septembre 2014 à 12:25

L'île de La Réunion est un département d'outre-mer français situé dans le sud-ouest de l'océan Indien. C'est une île volcanique relativement jeune (3 millions d'années[1]) en forme caractéristique de cône, dont la base se situe directement sur le plancher océanique (et non pas sur un plateau continental), ce qui explique son isolement. Sa jeunesse est la cause de la faible surface occupée par les formations coralliennes, âgées de 8 000 ans[2], se présentant pour la plupart sous la forme de récifs frangeants[1],[2].
Ces formations délimitent des « lagons » (il s'agit plus techniquement de « dépressions d'arrière-récif »[1],[2]) peu profonds dont le plus grand ne dépasse pas 200 m de large, pour 1 à 2 m de fond environ[3]. Ces lagons, qui forment une ceinture récifale discontinue de 25 km de long (soit 12% du littoral de l'île) pour une surface totale de 12 km2[1],[2], sont situés sur la côte ouest et sud-ouest de l’île. Les plus importants sont ceux de L’Ermitage (St Gilles), St Leu, L'Étang-Salé et St Pierre. Les platiers sont étroits et les tombants en arrière des barrières coralliennes plongent rapidement à des profondeurs importantes. S'il existe plusieurs compartiments récifaux de petite taille, le principal se situe dans l'ouest de l'île, dans la région de Saint-Gilles les Bains, et a une superficie de quelques kilomètres carrés. Les lagons de L’Ermitage, St Leu et L'Étang-Salé sont protégés par la Réserve naturelle marine de La Réunion (RNMR), d’une surface de 3500 hectares, créée en février 2007[4].
La température de l'eau des lagons varie entre 22 et 30 °C[5],[6]. Au niveau de la faune, les récifs coralliens de la Réunion, aussi bien au niveau des platiers que des barrières, sont dominés par des espèces de corail branchu à croissance rapide du genre Acropora (famille des Acroporidae). La décomposition de la matière organique du platier est essentiellement assurée par deux espèces d'holothuries (échinodermes) : l'holothurie noire (Holothuria leucospilota) et le cordon mauresque (Synapta maculata) parfois aussi appelé « serpent de mer ».
Malgré la faible surface des récifs coralliens, la biodiversité marine de la Réunion est comparable aux autres îles du secteur, qui vaut à l'archipel des Mascareignes son inscription parmi les 10 principaux « hot spots » de biodiversité mondiale[7]. Les recherches scientifiques récentes font état à la Réunion de plus de 190 espèces de coraux[7], plus de 1300 espèces de mollusques[8], plus de 500 espèces de crustacés[9], plus de 130 espèces d'échinodermes[7] et plus de 1000 espèces de poissons[10], dont quelques espèces endémiques de la région et, dans une moindre mesure, de l’île.

Cependant, près d’un tiers de ces espèces était déjà considéré comme menacé ou vulnérable en 2009[10]. Les causes de cet état de fait sont la pollution, la surpêche et le braconnage ainsi que la pression anthropique, notamment liée à la densification de l’urbanisation des zones côtières et au rejet des eaux usées[10]. En effet, les récifs coralliens comptent parmi les écosystèmes côtiers les plus riches en matière de biodiversité, mais ils sont aussi les plus fragiles[11]. Par exemple, un phénomène de blanchissement des coraux (entraînant leur forte mortalité) a été observé en mars 2014[12], corrélé à un épisode de mortalité massive des poissons dû à une bactérie pathogène (Streptococcus iniae), dont la prolifération pourrait être due à un surenrichissement des eaux du lagon[13]. Cette épidémie meurtrière semble s'être résorbée naturellement[14], mais continue de susciter la perplexité et l'inquiétude des autorités[15].
Il reste que les lagons se repeuplent continuellement, quoique avec plus ou moins de facilité selon leur état[16], du fait du « recrutement » continuel de post-larves[2] et juvéniles venus de l’océan. Ils font ainsi largement office de nursery pour de nombreuses espèces, et sont des lieux privilégiés pour observer le développement et les comportements des stades précoces de très nombreux poissons et invertébrés. Ces recrutements se font soit sur l’année et par petites cohortes, soit massivement et durant des pics correspondant aux pics de ponte précédents pendant la saison chaude[17]. Ils ont souvent lieu les nuits de nouvelle lune, mais peuvent aussi se produire en plein jour[17].
Cet article, loin d'être exhaustif, se propose d'illustrer quelques-unes des espèces susceptibles d’être rencontrées dans les lagons pour chacun des principaux groupes d'animaux marins macroscopiques.


Vue générale
Ces vues mettent en évidence la faible distance entre les barrières récifales et la côte caractéristique des « lagons » réunionnais, qui sont en fait des récifs frangeants. Chacun a ses particularités, morphologiques, hydrologiques, etc., ce qui influe sur la biodiversité de chaque site.
-
Le lagon de l'Ermitage et sa passe.
-
Vue du lagon de L'Ermitage au matin.
-
Vue du lagon de Saint-Leu.
-
Le lagon de L'Étang-Salé vu du ciel.
-
Le lagon de l'Etang Salé à marée basse.
-
Le début du lagon de Saint-Pierre.
-
L’extrémité sud du lagon de St Pierre, à Terre Sainte.
Reptiles
Les seuls reptiles marins présents à la Réunion sont des tortues. Le nombre d’espèces de tortues marines connues dans le monde est de sept ou huit, selon les spécialistes[18]. Leur espérance de vie est de 80 ans en moyenne, et leur maturité sexuelle est tardive (jusqu’à 30 ans)[19]. Leurs aires d’alimentation et de ponte peuvent être éloignées de plusieurs milliers de kilomètres[18]. Toutes les tortues marines sont considérées par l’UICN comme en danger, et la CITES interdit leur chasse et leur commercialisation[20].
Seules deux espèces ont été observées sur les côtes réunionnaises : la tortue verte (Chelonia mydas), et la tortue imbriquée (Eretmochelys imbricata) ; cependant on peut rencontrer au large la tortue caouanne (Caretta caretta), la tortue olivâtre (Lepidochelys olivacea) et la tortue luth (Dermochelys coriacea). La Réunion, ancienne aire de ponte, avait été désertée par les tortues du fait de la chasse et de l’occupation toujours plus dense du littoral. On observe un retour des pontes en nombre relativement élevé depuis 2004[21]. Les juvéniles profitent de la nourriture et de la protection que leur offrent les eaux peu profondes des lagons pour terminer leur croissance en sécurité. La tortue verte y broute les herbiers de Syringodium isoetifolium, l’imbriquée se nourrit probablement d’éponges et d’algues. Elles font des allers et retours entre le lagon et les pentes externes, avant de s’installer sur les secondes. Les adultes n’ont jamais été observés dans les lagons. Les tortues sont suivies à La Réunion par un programme de photo-identification[22] développé par l’Observatoire des tortues marines Kélonia[23]. Ce programme s’inscrit dans un suivi international des tortues marines du sud-ouest de l’océan Indien. Il existe une charte d’approche des tortues[24].
-
Tortue verte immature (Chelonia mydas).
-
Tortue imbriquée immature (Eretmochelys imbricata).
Poissons
De très nombreuses espèces de poissons trouvent refuge dans les récifs coralliens, qui leur donnent de multiples abris et une nourriture abondante et diversifiée. Certaines espèces ne s'y trouvent cependant que pendant leur stade juvénile, avant de rejoindre des eaux plus profondes à la maturité. D’autres encore font des incursions sporadiques dans les lagons, généralement autour des passes, puis rejoignent les pentes. D'un point de vue scientifique, la classe des Pisces (mot latin signifiant « poissons »), fonctionnelle dans la systématique héritée de Carl von Linné, a été abandonnée par les classifications modernes du vivant : cette classe a été divisée en trois classes de vertébrés marins (Agnathes, Chondrichthyens et Ostéichthyens), et il faut noter que pour la classification phylogénétique le terme de poisson ne peut plus avoir aucun sens[25]. Les populations de poissons ne sont pas également réparties : on estime que 50% des poissons occupent 17% des océans[26]. La Réunion, avec au moins 1 090 espèces, est d’une richesse enviable de ce point de vue.
Raies et requins
Les requins ne rentrent que très exceptionnellement dans les lagons réunionnais (grandes marées, houles importantes). Surpris ensuite par la faible profondeur à marée basse ils cherchent à en sortir et, stressés, ne développent pas de comportements alimentaires ni territoriaux, et ne sont donc pas agressifs. Il n’y a jamais eu d’incident à déplorer avec des squales dans les lagons de La Réunion.
-
Raie aigle (Myliobatis aquila)
Poissons téléostéens
L’infra-classe des Téléostéens[27] (du grec « téléios », achevé, et « osteon », os) regroupe les poissons osseux dont le squelette est entièrement ossifié. Ils sont caractérisés notamment par une nageoire caudale qui n’est qu’apparemment symétrique (la colonne vertébrale s’achève dans le lobe supérieur), et par une mâchoire dont l’articulation leur permet de projeter leur bouche vers la proie, créant ainsi un flux aspirant qui la gobe. Les téléostéens regroupent 96% des espèces de poissons et 47% des vertébrés actuels[25].
- Poissons serpentiformes (« Elopomorphes » : anguilles, murènes, congres)
Comme l’indique l’adjectif, les poissons serpentiformes ont l’aspect morphologique et souvent le type de déplacement d’un serpent, mais là s’arrête leur rapport avec les reptiles ophidiens. Il n’y aucun serpent marin dans les lagons de La Réunion.
-
Murène étoilée (Echidna nebulosa)
-
Murène à barres (Echidna polyzona)
-
Murène zébrée (Gymnomuraena zebra)
-
Murène Gymnothorax eurostus
-
Murène à taches jaunes (Gymnothorax flavimarginatus)
-
Murène tatouée (Gymnothorax griseus)
-
Murène de Java (Gymnothorax javanicus)
-
Murène ponctuée (Gymnothorax meleagris)
-
Murène ondulante (Gymnothorax undulatus)
-
Congre de sable argenté (Ariosoma anago) juvénile?
-
Congre à moustaches (Conger cinereus), de nuit.
-
Anguille-serpent à bandes (Myrichthys colubrinus)
-
Anguille-serpent maculée (Myrichthys maculosus)
- Poissons siluriformes
Les poissons siluriformes regroupent les poissons-chats et les silures. Ils se distinguent des autres ordres par des caractéristiques du crâne et de la vessie natatoire. La plupart des espèces vivent en eau douce ou saumâtres.
-
Poissons-chats rayés (Plotosus lineatus)
- Poissons aulopiformes
Les poissons aulopiformes sont caractérisés par la structure de leurs branchies. Le nom de l’ordre est formé par le mot grec « aulos », qui signifie tuyau, flûte, et le mot latin « forma », forme, en référence à la forme allongée de certains d’entre eux. Ce sont tous des prédateurs.
-
Poisson-lézard (Saurida gracilis)
-
Poisson-lézard à ligne bleue (Synodus dermatogenys)
- Poissons Lophiiformes
Les poissons lophiiformes (du grec « lophos », crête) sont caractérisés par des morphologies plus ou moins difformes, par une ouverture branchiale de petite taille en forme de tube, et par la première vertèbre soudée au crâne[28]. Tous sont marins. De nombreux genres sont caractérisés par la modification de la première épine dorsale (l’illicium), libre et modifiée en un leurre (esca)[28] qui attire les proies vers la bouche. L'ordre comporte notamment les antennaires (poissons-crapauds, poissons-grenouilles, poissons-pêcheurs).
-
Un antennaire peint (Antennarius pictus)
- Poissons mugiliformes
Le radical du nom de l’ordre est dérivé du mot latin « mugil », qui désigne un mulet. Il ne comprend qu’une famille, les Mugilidae. Certaines classifications récentes (comme celle suivie par FishBase) placent ces poissons parmi les Perciformes[29].
-
Un mulet à queue bleue (Crenimugil crenilabis)
-
Un mulet Oedalechilus labiosus
- Poissons Atheriniformes
Le radical de l’adjectif vient du grec « atherine », qui désigne un éperlan[30]. Ce sont des poissons au corps généralement fin et long et aux flancs argentés, dont certaines espèces vivent en eau douce.
-
Un banc d'athérines Atherinomorus lacunosus juvéniles
- Poissons Beloniformes
Beloniforme vient du mot grec « belone », qui signifie aiguille[31]. La plupart des familles de cet ordre ont un corps fuselé et argenté. Certaines vivent en eaux douces ou saumâtres. L’ordre des béloniformes contient les poissons-volants.
-
Une aiguille crocodile (Tylosurus crocodilus crocodilus)
-
Un demi-bec (Hemiramphus far) de nuit, avec son reflet.
- Poissons Beryciformes
Le nom de cet ordre vient du grec « beryx », ou « berys »[32], qui désignait dans la Grèce antique un poisson dont l’identification précise n’a pas pu être faite[33]. Ces poissons sont caractérisés par leur morphologie crânienne et par la présence de canaux à mucus sous la peau de la tête, ainsi que par le nombre de rayons de la nageoire caudale[34] .
-
Un groupe de poissons-soldats à œillères (Myripristis murdjan) sous un massif de corail.
-
Un poisson-écureuil tacheté (Neoniphon sammara)
-
Un poisson-écureuil diadème (Sargocentron diadema)
-
Un poisson-écureuil tacheté (Sargocentron punctatissimum)
-
Un poisson-écureuil géant (Sargocentron spiniferum)
- Poissons Syngnathiformes
Le radical du nom de l’ordre est formé à partir des mots grecs « sun », ensemble, et « gnathos », mâchoire[35], pour désigner des familles de poissons aux mâchoires soudées formant un museau tubulaire au bout duquel se situe une petite bouche. Parmi les familles représentées dans cet ordre, les Syngnathidae (syngnathes et hippocampes) sont couverts de plaques osseuses, et sont notamment caractérisés par le fait que ce sont les mâles qui incubent dans une poche ventrale les œufs pondus par les femelles.
-
Un poisson-trompette de l'indo-pacifique (Aulostomus chinensis)
-
Un syngnathe à réseaux (Corythoichthys flavofasciatus)
-
Un syngnathe de Schultz (Corythoichthys schultz)
-
Un syngnathe à double menton (Doryrhamphus bicarinatus)
-
Un poisson-flûte (Fistularia commersonii)
-
Deux poissons-fantômes robustes (Solenostomus cyanopterus)
- Poissons Scorpaeniformes (poissons à rayons épineux souvent pourvus d'un venin puissant : grondins, rascasses, poissons-scorpions, poissons-pierres)
Le mot vient du grec « scorpios », qui signifie scorpion[36] , probablement du fait que de nombreuses espèces groupées dans cet ordre possèdent des glandes à venin reliées aux rayons de certaines de leurs nageoires. Ils sont caractérisés par une cuirasse osseuse recouvrant la tête[37]. Aucun de ces poissons n’est agressif, mais les poissons scorpions et pierres se confondent souvent parfaitement avec leur environnement, et les rascasses sont presque toujours situées sous la partie haute d’une anfractuosité ou d’un massif de corail tabulaire : il est donc difficile de les voir et il vaut mieux faire attention à l’endroit où l’on pose ses mains ou ses pieds.
-
Un grondin volant oriental (Dactyloptena orientalis)
-
Le minuscule Caracanthus madagascariensis caché dans son massif de Pocillopora.
-
Un poisson-diable ou faux-poisson pierre (Scorpaenopsis diabolus)
-
Un poisson-scorpion à bosse (Scorpaenopsis gibbosa)
-
Scorpaenopsis oxycephala de nuit
-
Un Poisson-scorpion feuille (Taenianotus triacanthus)
-
Un poisson scorpion à antennes (Pterois antennata)
-
Une rascasse volante (Pterois miles)
-
Un pterois ocellé (Dendrochirus biocellatus)
-
Un pterois zèbre Dendrochirus zebra
-
Deux dangereux poissons-pierres (Synanceia verrucosa)
- Poissons Perciformes
Le nom de cet ordre vient du mot grec « perke »[38], donnant le latin « perca », qui signifie perche. Cet ordre, qui regroupe presque un tiers des poissons marins, doit être compris comme provisoire en attendant que les relations de parenté entre les espèces qu’il inclut soient mieux comprises[39].
-
Un mérou céleste (Cephalopholis argus)
-
Un mérou Risdael (Epinephelus macrospilos)
-
Un mérou gâteau de cire (Epinephelus merra)
-
Un mérou à quatre selles (Epinephelus spilotoceps)
-
Un mérou loutre (Epinephelus tauvina)
-
Un mérou croissant jaune (Variola louti) juvénile
-
Un poisson-savon à six lignes (Grammistes sexlineatus)
-
Un banc de Kuhlia caudavittata juvéniles
-
Un banc de poissons pavillons rayés (Kuhlia mugil) juvéniles
-
Un beauclaire (Heteropriacanthus cruentatus)
-
Un apogon à grandes dents (Cheilodipterus macrodon) juvénile
-
Un poisson-cardinal Pristiapogon kallopterus
-
Un apogon Ostorhinchus cf. taeniophorus?
-
Un malacanthe bleu (Malacanthus latovittatus)
-
Une carangue rayée (Carangoides ferdau) juvénile avec sa méduse Thysanostoma loriferum
-
Une jeune carangue tachetée (Carangoides orthogrammus)
-
Une carangue bleue (Caranx melampygus)
-
Un banc de carangues mouchetées (Caranx papuensis) juvéniles
-
Un groupe de jeunes pompaneaux muscadin (Trachinotus baillonii)
-
Un vivaneau chien rouge (Lutjanus bohar)
-
Un vivaneau queue noire (Lutjanus fulvus)
-
Un vivaneau bossu (Lutjanus gibbus) juvénile
-
Un groupe de vivaneaux à lignes bleues (Lutjanus kasmira)
-
Un vivaneau à tache noire (Lutjanus monostigma)
-
Deux fusiliers ou caesios azur (Caesio caerulaurea)
-
Une gerre (Gerres longirostris)
-
Un bec de cane mahsena (Lethrinus mahsena)
-
Un bec de cane bleuté (Lethrinus nebulosus)
-
Un banc d'empereurs striés (Gnathodentex aureolineatus)
-
Un empereur bossu (Monotaxis grandoculis)
-
Groupe de barbures rayées (Polydactylus plebeius)
-
Un capucin à lignes blanches (Parupeneus ciliatus)
-
Un surmulet à ligne jaune (Mulloidichthys flavolineatus)
-
Un banc de surmulets à nageoires jaunes (Mulloidichthys vanicolensis)
-
Un barbet rayé (Parupeneus barberinus)
-
Des rougets-barbets dorés (Parupeneus cyclostomus) dans deux livrées différentes.
-
Un jeune Parupeneus indicus
-
Un rouget à longue barbe (Parupeneus macronemus)
-
Un rouget-barbet à deux taches (Parupeneus trifasciatus)
-
Un balayeur (Pempheris sp.)
-
Deux calicagères bleues ou saupes tropicales (Kyphosus cinerascens)
-
Un platax orbiculaire (Platax orbicularis)
Les expressions « poissons-papillons » et « poissons-cochers » sont des noms vernaculaires qui regroupent des poissons de la famille des Chaetodontidae. Cette famille contient 12 genres et 129 espèces, largement dominées par le genre Chaetodon (88 espèces)[40]. Leur livrée est le plus souvent jaune et blanche avec des lignes généralement obliques sur le corps et un « masque » noir traversant l’œil sur la face. Ils ont un dos élevé et le corps très comprimé latéralement. La majorité vit entre 0 et 30 m de profondeur. Ils se nourrissent de polypes coralliens, d’invertébrés, d’œufs de poissons et d’algues[41], certains sont des planctonivores facultatifs[42]. De nombreuses espèces sont considérées comme des bio-indicateurs de l’état de santé des coraux, notamment les corallivores stricts, et la famille dans son ensemble est utilisée pour évaluer le statut écologique d’un récif[43]. 24 espèces de Chaetodontidae sont recensées à La Réunion[10].
-
Un poisson-papillon cocher (Chaetodon auriga)
-
Un chétodon très moucheté (Chaetodon guttatissimus)
-
Un groupe de poissons-papillon à larme de l'océan Indien (Chaetodon interruptus)
-
Un poisson-papillon de Klein (Chaetodon kleinii)
-
Un poisson-papillon linéolé (Chaetodon lineolatus)
-
Un poisson-papillon raton-laveur (Chaetodon lunula)
-
Un chétodon à damier (Chaetodon madagaskariensis)
-
Un poisson-papillon à dos noir (Chaetodon melannotus)
-
Un poisson-papillon de Meyer (Chaetodon meyeri)
-
Un poisson-papillon à chevrons (Chaetodon trifascialis)
-
Deux poissons-papillon à trois bandes (Chaetodon trifasciatus)
-
Un poisson-papillon vagabond (Chaetodon vagabundus)
-
Un poisson-papillon à tête jaune (Chaetodon xanthocephalus)
-
Un poisson-pincette jaune (Forcipiger flavissimus)
-
Un poisson cocher (Heniochus acuminatus)
-
Un poisson-cocher masqué (Heniochus monoceros)
Les poissons-anges appartiennent à la famille des Pomacanthidae, qui contient 8 genres et 90 espèces[44]. Ils ont un corps ovale et généralement de vives couleurs, et sont caractérisés par un long aiguillon situé à l’angle inférieur des opercules. Plusieurs espèces sont hermaphrodites protogynes (ce qui signifie que tous les individus naissent femelle et que certains deviendront mâles quand la situation l’exigera) et forment des harems[45]. D’autres sont monogames ou forment des aires de parade[46] en saison de reproduction[45]. Les poissons-anges se nourrissent, selon les genres, d’algues, d’invertébrés sessiles ou de plancton[47]. La livrée des juvéniles est souvent très différente de celle des adultes. 10 espèces de Pomacanthidae sont présentes à La Réunion[10]. Contrairement aux poissons-papillons ce sont des poissons farouches.
-
Un poisson-ange empereur (Pomacanthus imperator) juvénile
-
Un poisson-ange empereur (Pomacanthus imperator) adulte
-
Un poisson-ange africain (Centropyge acanthops)
-
Un poisson-ange brun (Centropyge multispinis)
Les poissons-éperviers (ou poissons-faucons) appartiennent à la famille des Cirrhitidae, qui comprend 13 genres et 40 espèces[48]. Ils doivent leurs noms vernaculaires à leur technique de chasse, à l’affût sur une branche de corail. Ils sont caractérisés par les touffes de cirrhes qui se trouvent au sommet des rayons durs de leur nageoire dorsale. Les poissons-éperviers sont hermaphrodites protogynes[49] et peuvent être monogames et territoriaux, ou former des harems[50]. Tous sont carnivores et se nourrissent de petits poissons et de crustacés[49]. 10 espèces de Cirrhitidae sont pour le moment recensées à La Réunion.
-
Un épervier lutin (Cirrhitichthys oxycephalus)
-
Un épervier de corail (Cirrhitus pinnulatus)
-
Un épervier strié (Paracirrhites arcatus)
-
Un poisson-faucon de Forster (Paracirrhites forsteri)
Les poissons-demoiselles sont regroupés dans la famille des Pomacentridae, qui comprend 29 genres et 387 espèces[51]. Ils sont caractérisés par une petite bouche et une ligne latérale incomplète et interrompue[51]. Les stratégies de reproduction sont très variables : polygamie mâle ou femelle, monogamie et partenariat multiple pour chaque sexe[52]. Ces espèces pondent dans des nids situés sur un substrat quelconque, le mâle s’occupant des œufs en les défendant et en les ventilant jusqu’à éclosion[53]. Les Pomacentridae incluent la sous-famille des Amphiprioninae, dits « poissons-clowns », qui vivent en symbiose avec des espèces d’anémones, parfois une seule, et sont hermaphrodites protandres (tous les individus naissent mâles et le plus âgé d’entre eux changera de sexe à la disparition de la femelle dominante)[54]. Les poissons-demoiselles peuvent être herbivores, omnivores ou planctonivores, les espèces territoriales sont très agressives[53]. 46 espèces de Pomacentridae ont été recensées à La Réunion.
-
Un sergent-major à sept bandes (Abudefduf septemfasciatus)
-
Un sergent-major à queue en ciseaux (Abudefduf sexfasciatus)
-
Un sergent-major à tache noire (Abudefduf sordidus)
-
Un sergent-major à tache ovale (Abudefduf sparoides)
-
Un poisson-bagnard (Abudefduf vaigiensis)
-
Une castagnole bicolore (Chromis dimidiata)
-
Des demoiselles bleu-vert (Chromis viridis)
-
Une demoiselle de Brownrigg (Chrysiptera brownriggii)
-
Une demoiselle grise (Chrysiptera glauca)
-
Une demoiselle à un point (Chrysiptera unimaculata)
-
Un banc de demoiselles à trois bandes noires (ou demoiselles à queue blanche, Dascyllus aruanus)
-
Une demoiselle à trois taches (Dascyllus trimaculatus) juvénile
-
Une demoiselle à barre noire (Plectroglyphidodon dickii)
-
Une demoiselle aux yeux brillants Plectroglyphidodon imparipennis
-
Une demoiselle de Johnston (Plectroglyphidodon johnstonianus)
-
Une demoiselle à points bleus (Plectroglyphidodon lacrymatus) juvénile
-
Une demoiselle bleue et jaune (Pomacentrus caeruleus)
-
Un grégoire d'ébène (Stegastes limbatus)
-
Un grégoire noir (Stegastes nigricans)
-
Un grégoire mauricien (Stegastes pelicieri)
-
Un grégoire fermier (Stegastes punctatus)
Les labres, vieilles et girelles sont regroupés dans la famille des Labridae, qui comprend 71 genres et 517 espèces[55]. Leur morphologie est extrêmement variable, tout comme le sont leurs tailles et leurs couleurs. Une des particularités de la plupart est d’avoir des lèvres charnues nettement apparentes sur le museau, d’où vient leur nom vernaculaire et celui du premier genre décrit (Labrus), le mot « labrum » signifiant lèvre en latin[56]. De nombreuses espèces sont hermaphrodites protogynes, les unes diandriques (il y a des mâles qui le sont dès la naissance, et d’autres qui le sont devenus), les autres monandriques (tous les mâles sont des femelles ayant changé de sexe)[57]. Les femelles et les mâles, ainsi que les juvéniles, ont souvent des livrées, et parfois des morphologies, très différentes. Les gamètes des labres du domaine Indo-Pacifique sont libérés en pleine eau, les œufs sont donc pélagiques (les labres des régions tempérées pondent dans un nid le plus souvent aménagé sur le substrat). La majorité des espèces, carnivores, cherchent des invertébrés en fouillant le fond mais d’autres sont planctonivores[55]. Parmi les carnivores, certaines sont « nettoyeuses » : elles se nourrissent des parasites des autres poissons[58]. 52 espèces de Labridés ont été pour le moment recensées à La Réunion.
-
Un labre constellé (Anampses caeruleopunctatus) femelle
-
Un labre constellé (Anampses caeruleopunctatus) mâle
-
Un labre à queue jaune (Anampses meleagrides) juvénile
-
Un labre à poitrine jaune (Anampses twistii)
-
Une vieille tachetée (Cheilinus chlorourus)
-
Un labre à queue triple (Cheilinus trilobatus)
-
Un labre cigare (Cheilio inermis)
-
Un labre à six lignes (Pseudocheilinus hexataenia)
-
Deux girelles clowns (Coris aygula) mâles
-
Une girelle africaine (Coris cuvieri)
-
Un labre traître (Epibulus insidiator)
-
Un labre-oiseau (Gomphosus caeruleus) femelle
-
Un labre-oiseau (Gomphosus caeruleus) mâle
-
Un labre échiquier (Halichoeres hortulanus)
-
Un labre obscur (Halichoeres marginatus) mâle
-
Un labre nébuleux (Halichoeres nebulosus)
-
Un labre zig-zag (Halichoeres scapularis) femelle
-
Un labre zig-zag (Halichoeres scapularis) mâle
-
Un tamarin à bandes (Hemigymnus fasciatus)
-
Un labre nettoyeur à queue jaune (Labroides bicolor) en train de déparasiter un Mulloidichthys flavolineatus
-
Un labre nettoyeur (Labroides dimidiatus) se préparant à déparasiter un Chaetodon vagabundus
-
Un labre-rasoir masqué (Novaculichthys taeniourus)
-
Le labre des herbiers Novaculoides macrolepidotus
-
Un labre à queue de comète (Oxycheilinus bimaculatus)
-
Un labre ruban à lignes bleues (Stethojulis albovittata) femelle
-
Un labre ruban à lignes bleues (Stethojulis albovittata) mâle
-
Une girelle-paon bariolée (Thalassoma genivittatum)
-
Une girelle-paon à taches d'encre (Thalassoma hardwicke)
-
Une girelle-paon à épaules jaunes (Thalassoma hebraicum)
-
Une girelle-paon clown (Thalassoma trilobatum)
-
Un labre Stethojulis strigiventer
Les poissons-perroquets appartiennent à la famille des Scaridae, qui comprend 10 genres et 100 espèces[59]. À quelques exceptions près ils ont des dents antérieures fusionnées en forme de bec de perroquet. Les Scaridae possèdent de larges écailles cycloïdes et ont généralement de vives couleurs. Ce sont des poissons herbivores, dont de nombreuses espèces raclent le corail pour se nourrir des algues qui le couvrent. Les éléments calcaires ainsi ingérés sont ensuite évacués et sont une des sources du sable corallien[60]. Les Scaridae dont le statut sexuel est connu sont tous hermaphrodites protogynes[61], à l’exception du perroquet des herbiers (Leptoscarus vaigiensis)[62]. Les livrées mâles et femelles, et souvent celles des juvéniles, sont très différentes, les femelles étant plus ternes. 15 espèces de poissons-perroquets sont recensées à La Réunion.
-
Un poisson-perroquet des carolines (Calotomus carolinus) femelle
-
Un poisson-perroquet des carolines (Calotomus carolinus) mâle
-
Un poisson-perroquet vert (Chlorurus enneacanthus)
-
Un poisson-perroquet bossu bleu (Chlorurus gibbus) juvénile?
-
Deux poissons-perroquets brûlés (Chlorurus sordidus) femelles, derrière une demoiselle et une idole des Maures.
-
Un poisson-perroquet jaune (Hipposcarus harid) femelle.
-
Un groupe de poissons-perroquets des herbiers (Leptoscarus vaigiensis). Les mâles ont une bande latérale blanche.
-
Un poisson perroquet Scarus falcipinnis femelle
-
Un poisson-perroquet à écailles jaunes (Scarus ghobban) femelle
-
Un poisson-perroquet Scarus globiceps
-
Un poisson-perroquet commun (Scarus psittacus) femelle
-
Un poisson-perroquet commun (Scarus psittacus) mâle
-
Un poisson-perroquet à cinq selles (Scarus scaber) femelle
-
Un poisson-perroquet à cinq selles (Scarus scaber) mâle
Les blennies font partie de la famille des Blenniidae, qui comprend 57 genres et 396 espèces[63], dont certaines vivent en eaux saumâtres ou douces[64]. Elles sont notamment caractérisées par un corps effilé et sans écailles, un museau droit et des nageoires dorsale et pectorale particulièrement longues. Elles portent généralement des cirres au-dessus des yeux et sur la nuque. La plupart vivent sur le substrat (ce pourquoi ces espèces ne possèdent pas de vessie natatoire) et se nourrissent d’algues et d’invertébrés, ou de plancton. Les blennies à dents de sabre (regroupées dans 5 genres) vivent en pleine eau et se nourrissent des écailles, de la peau ou de morceaux de nageoires des poissons qu’elles attirent en imitant la livrée ou la danse des labres nettoyeurs[65]. Les femelles déposent leurs œufs dans un abri choisi par le mâle, qui les défendra jusqu’à l’éclosion[66]. 34 espèces de Blenniidae ont été recensées à La Réunion.
-
Une blennie à dents de sabre ou faux nettoyeur (Aspidontus tractus), mimétique de Labroides dimidiatus
-
Une blennie Blenniella periophthalmus
-
Une blennie léopard (Exallias brevis) dans un corail Millepora
-
Couple de blennies à rides (Istiblennius edentulus)
-
Une blennie à mitre (Petroscirtes mitratus)
-
Une blennie à dents acérées (Plagiotremus tapeinosoma)
Les gobies appartiennent à la famille des Gobiidae, la plus vaste des familles de poissons, qui comprend 250 genres et 1686 espèces[67], que l’on peut trouver en eaux douces, saumâtres ou marines. La plupart des gobies mesurent moins de 10 cm. Ils sont caractérisés par une tête large et aplatie, des lèvres charnues, la présence de deux nageoires dorsales et des pelviennes souvent soudées de façon à former une ventouse[68]. La majorité des gobies se nourrit de petits invertébrés, mais certains sont planctonivores. Certains sont en relation symbiotique avec une crevette, notamment du genre Alpheus, l’association pouvant être sélective entre une espèce de gobies et une ou deux espèces de crevettes[69], et certaines autres sont nettoyeuses[70]. Quelques espèces sont hermaphrodites protogynes. Les œufs sont fixés sous des pierres ou des coquilles, et seront gardés par le mâle jusqu’à éclosion[68]. 52 espèces de Gobies ont été recensées à La Réunion.
-
Un gobie galone (Amblygobius semicinctus)
-
Un gobie étoilé (Asterropteryx semipunctata)
-
Un gobie pygmée (Eviota sp.)
-
Un gobie Fusigobius maximus? de nuit, dans un cocon de Scarus psittacus
-
Deux gobies à œil rayé (Gnatholepis cauerensis)
-
Un gobie décoré (Istigobius decoratus)
-
Un minuscule gobie Paragobiodon modestus caché dans un corail Pocillopora
-
Un minuscule gobie nain de Michel (Pleurosicya micheli) sur un corail Millepora
-
Un gobie à six taches (Valenciennea sexguttata)
-
Un couple de gobies soyeux à joues bleues (Valenciennea strigata), rares en pleine eau.
Les poissons-chirurgiens appartiennent à la famille des Acanthuridae, qui comprend 6 genres et 82 espèces[71]. Cette famille inclut les poissons-licornes ou nasons. Ils sont caractérisés par un dos élevé, un front bombé, des nageoires dorsale et anale longues et une petite bouche terminale. Une paire d’épines tranchantes, mobiles chez les chirurgiens et fixe chez les nasons, arme les flancs du pédoncule caudal (ce sont les « scalpels » qui justifient le nom vernaculaire du groupe). La majorité se nourrit d’algues, mais certaines espèces consomment du zooplancton, des détritus ou des invertébrés[72]. Les poissons chirurgiens sont territoriaux, certaines espèces forment des harems. La reproduction se fait par couples ou en groupes, ou les deux dans quelques espèces[73]. Les gamètes sont libérés en pleine eau, la fécondation est donc externe. 28 espèces d’Acanthuridae ont été recensées à La Réunion.
-
Un poisson chirurgien sombre (Acanthurus blochii)
-
Un chirurgien couronné (Acanthurus dussumieri)
-
Un chirurgien à poitrine blanche (Acanthurus leucosternon)
-
Un chirurgien à virgule noire (Acanthurus nigricauda) en livrée claire
-
Un chirurgien brun (Acanthurus nigrofuscus) juvénile
-
Un chirurgien barré (Acanthurus polyzona)
-
Un groupe de chirurgiens lieutenants ou fer à cheval (Acanthurus tennentii) broutant
-
Un banc de chirurgiens bagnards (Acanthurus triostegus)
-
Un chirurgien à masque jaune ou à aile jaune (Acanthurus xanthopterus)
-
Un chirurgien strié ou anneau d'or indien (Ctenochaetus striatus)
-
Un chirurgien Ctenochaetus truncatus
-
Une licorne indienne à épines orange ou nasique à éperons oranges (Naso elegans)
-
Un nason à éperons bleus (Naso unicornis)
-
Un chirurgien voilier (Zebrasoma desjardinii) passant du stade juvénile au stade adulte
-
Un chirurgien à brosses (Zebrasoma scopas)
- Autres perciformes
-
Un groupe de sigans vermiculés (Siganus argenteus)
-
Idole des Maures (Zanclus cornutus)
-
Un jeune barracuda (Sphyraena barracuda) de nuit
-
Un barracuda obtus (Sphyraena obtusata)
- Poissons Pleuronectiformes
Le terme vient des mots grecs « pleura », côté, et « nektos », nageur[74] : ce sont des poissons asymétriques qui nagent sur un de leurs flancs, autrement dit des poissons plats. Ils ont en conséquence les deux yeux du même côté du corps, bien que leurs larves présentent la même symétrie que les autres poissons[75]. Ils nagent en ondulant au-dessus du substrat.
-
Un turbot tropical (Bothus mancus)
-
La rare et très discrète sole Aseraggodes diringeri
- Poissons Tetraodontiformes
Le radical du nom de l’ordre est formé à partir des mots grecs « tetra », quatre, et « odous », dents[76] mais parmi les familles concernées, seuls les Tétraodontidés ont quatre plaques dentales. Ce groupe hétérogène est caractérisé par l’absence d’écailles imbriquées, des ouvertures branchiales de petite taille, une petite bouche et des pelviennes absentes ou transformées en épine enkystée dans une poche extensible[77].
-
Un baliste ondulé (Balistapus undulatus)
-
Un baliste à moustache (Balistoides viridescens)
-
Un baliste à marges jaunes (Pseudobalistes flavimarginatus)
-
Un baliste vermiculé (Pseudobalistes fuscus) subadulte
-
Un baliste Picasso (Rhinecanthus aculeatus) en attitude d'intimidation
-
Un baliste Picasso à bandeau noir (Rhinecanthus rectangulus)
-
Un baliste à gorge bleue (Sufflamen chrysopterum)
-
Un poisson-lime gribouillé ou bourse écriture (Aluterus scriptus), en livrée d'intimidation avant le pillage des algues des grégoires jardiniers
-
Un poisson-lime balai (Amanses scopas)
-
Un poisson-lime à bande noire (Pervagor janthinosoma)
-
Un poisson-lime à taches oranges (Oxymonacanthus longirostris)
-
Un monacanthe rayé (Cantherhines dumerilii)
-
Un poisson-lime panthère (Cantherhines pardalis)
-
Un monacanthe à selles noires (Paraluteres prionurus) en livrée nuptiale, mimétique de Canthigaster valentini.
-
Un poisson-coffre jaune (Ostracion cubicus)
-
Un poisson-coffre pintade (Ostracion meleagris) femelle
-
Un poisson-coffre pintade (Ostracion meleagris) mâle
-
Un poisson-vache à longues cornes (Lactoria cornuta)
-
Un poisson-ballon à taches blanches (Arothron hispidus)
-
Un poisson-ballon à lignes brunes (Arothron immaculatus) , en livrée de camouflage (normalement blanc)
-
Un poisson-ballon moucheté ou tétrodon pintade (Arothron meleagris)
-
Un poisson ballon à taches noires (Arothron nigropunctatus) en livrée blanche
-
Un poisson-ballon étoilé (Arothron stellatus)
-
Un poisson porc-épic (Diodon hystrix) de nuit
-
Une bourse de sable (Canthigaster bennetti)
-
Un canthigaster tacheté (Canthigaster solandri)
-
Un canthigaster à selles (Canthigaster valentini)
Échinodermes
Les échinodermes comprennent les étoiles de mer, holothuries, oursins, ophiures et crinoïdes : ces animaux sont généralement caractérisés par le fait que leur corps est structuré en une symétrie centrale (au lieu de bilatérale chez la plupart des animaux), généralement d'ordre 5 (« pentaradiale »), visible chez les étoiles de mer, les oursins et les ophiures, et plus discrète chez les holothuries et les crinoïdes.
À l'exception notable du groupe des crinoïdes (absents du lagon et peu représentés sur la pente externe), ces animaux sont très présents dans toutes les zones du lagon. Les holothuries, notamment le cordon mauresque (Synapta maculata) et l'holothurie noire (Holothuria leucospilota), sont les grands nettoyeurs du récif. Ils se nourrissent principalement de la matière organique en décomposition présente dans le substrat, et permettent ainsi de limiter la prolifération des bactéries et de constituer un sédiment épuré et homogène. Le cordon mauresque, de par son allure de serpent, peut parfois effrayer les baigneurs, mais cet animal est inoffensif et ses mouvements sont d'une lenteur extrême.
En revanche, l'étoile Acanthaster planci et l'oursin Toxopneustes pileolus sont très venimeux (mais eux aussi lents et non agressifs).
Étoiles de mer
La classe des Asteroidea (les étoiles de mer) comprend environ 1 800 espèces réparties dans tous les océans[78]. On peut en trouver à toutes les profondeurs, de la zone de balancement des marées à −6 000 mètres de fond[79]. Elles peuvent avoir cinq bras ou davantage, et jusqu’à plus de vingt pour Acanthaster planci[80]. Chez certaines (les « étoiles-coussins »), les bras sont à peine suggérés. Toutes ont un disque central portant en partie supérieure (face « aborale ») l’anus et le madréporite, et sur la face inférieure (face « orale ») une bouche dépourvue de dents mais par laquelle certaines astérides peuvent « dévaginer » leur estomac pour le projeter sur la proie et commencer ainsi à la digérer de façon externe. L'étoile Acanthaster planci se nourrit de corail et est recouverte de piquants venimeux, dont la piqûre provoque douleurs cuisantes, érythème et œdème.
-
Étoile de mer « Couronne d'épines » (Acanthaster planci). Ses piquants sont venimeux -
Asteropsis carinifera juvénile
-
Étoile rouge poreuse (Fromia milleporella)
-
Comète de mer (Linckia multifora)
-
Étoile coussin (Culcita schmideliana)
-
Une petite étoile de la famille des Asterinidae.
Ophiures
Les ophiures (du grec ophis, « serpent », et oura, « queue »[81]) ne sont pas des étoiles de mer, mais un groupe proche (toutes deux font partie de la sous-classe des Asterozoa). Parmi les différences on trouve des bras très fins et très souples, indépendants du corps, qui ne se touchent pas à leur base, et l’absence d’anus (les rejets se font par la bouche). Elles sont de surcroît beaucoup plus rapides, et se déplacent en se portant sur leurs longs bras. Le corps discoïdal est aplati sur la face inférieure, et généralement bombé en face supérieure. Il existe un ordre d’ophiures dont la morphologie est totalement différente, les Euryalida ou « gorgonocéphales », dont les nombreux et longs bras très ramifiés se déploient la nuit pour capturer le plancton ; on n'en trouve pas dans les lagons de la Réunion. La détermination de l’espèce, voire du genre, est particulièrement difficile chez les ophiures et demande souvent un examen microscopique, quand ce n’est pas une analyse ADN[82].
-
Ophiure noire (Ophiocoma erinaceus) -
Ophiure Ophiocoma pica -
Ophiure du platier (Ophiocoma scolopendrina)? -
Ophiocoma sp. (breviceps ou doederleinii?) -
Ophiure indéterminée (Ophioplocus sp.)? -
Ophiure indéterminée (Macrophiothrix sp.) -
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
-
Une ophiure non identifiée.
Oursins
Le corps des oursins est protégé par une coque calcaire (appelée « test »), recouverte de solides piquants (appelés « radioles »). Chez les oursins dits « réguliers » le test a la forme d’une sphère ou demi-sphère plus ou moins aplatie dorsalement et armée de piquants de taille variable selon des familles. Ceux-ci sont articulés à leur base et servent à la défense et en partie à la locomotion (assistés par de petits pieds à ventouse appelés « podia »). Au centre de la face orale se trouve une bouche dotée d’un appareil masticateur à cinq dents nommé « lanterne d'Aristote ». Les oursins de faible profondeur sont pour la plupart des brouteurs d'algues. Il existe aussi des oursins « irréguliers » qui peuvent être oblongs ou plats, et chez lesquels l'anus et parfois la bouche ont migré vers un bord du test. Les oursins bien dissimulés peuvent provoquer des piqûres douloureuses chez les baigneurs imprudents, et certaines espèces (famille des Diadematidae : genres Diadema et Echinothrix) possèdent un léger venin dans leurs piquants, alors que chez l'oursin-fleur le danger ne vient pas des piquants mais de ses pédicellaires en forme de fleur, qui délivrent un puissant venin pouvant provoquer des troubles respiratoires graves.
-
Oursin-diadème de Savigny (Diadema savignyi) de nuit. -
Oursin-diadème (Diadema setosum). -
Jeune oursin à double-piquants (Echinothrix calamaris) -
Oursin perforant (Echinometra mathaei) -
Oursin crayon (Heterocentrotus mamillatus) -
Oursin crayon (Heterocentrotus trigonarius) -
Oursin-fleur venimeux (Toxopneustes pileolus) -
Oursin comestible (Tripneustes gratilla) -
Oursin noir (Stomopneustes variolaris) -
Oursin mine (Eucidaris metularia)
Holothuries (« concombres de mer »)
La classe des Holothuroidea (du grec « holothoúrion », donné par Aristote à un animal qui n’a pu être déterminé[83]) regroupe des animaux marins au corps généralement cylindrique, plus ou moins mou selon les espèces, qui présentent une symétrie bilatérale apparente tout en conservant organiquement la symétrie pentaradiaire propre aux échinodermes. Autour de la bouche située en position antérieure, on observe une couronne de tentacules mobiles et rétractables chargés de prélever des particules de sédiment et de les porter à la bouche. En partie postérieure se trouve l’orifice cloacal servant à la respiration et à l’évacuation des déjections. C’est aussi par cet orifice que sortent, en situation de stress, de longs filaments blancs et collants appelés tubes de Cuvier chez les espèces qui en possèdent. Les holothuries se meuvent lentement, soit sur des centaines de podias terminés par une ventouse, soit, pour les Apodida qui n’en sont pas pourvus, en rampant. Les holothuries sont très nombreuses à la Réunion, et ne présentent aucun danger. Cependant, le stress d’une agression (le pied d’un être humain marchant dans l’eau, par exemple) peut leur faire projeter leurs tubes de Cuvier. Le contact avec ces tubules peut provoquer des démangeaisons, et présenter un risque pour les yeux. Les holothuries serpentiformes sont « collantes » : leur peau contient d’innombrables ossicules calcaires microscopiques qui fixent l’animal sur la peau ou la combinaison du plongeur au moindre contact.
-
Holothurie-serpent collante (Euapta godeffroyi) -
Cordon mauresque (Synapta maculata) -
Polyplectana sp.
-
Holothurie chevelue (Actinopyga capillata), de nuit. -
Holothurie brune (Actinopyga echinites), forme réunionnaise[84]. -
Holothurie des brisants (Actinopyga mauritiana)
-
Holothurie de sable brune (Bohadschia vitiensis), de nuit.
-
Holothurie des sables (Holothuria arenicola)
-
Holothurie à ocelles noires (Holothuria atra)
-
Holothurie cendrée (Holothuria cinerascens) -
Holothurie difficile (Holothuria difficilis) -
Holothurie-serpent rouge (Holothuria flavomaculata) -
Holothurie cendre brune (Holothuria fuscocinerea), de nuit. -
Holothurie contractile (Holothuria hilla) -
Holothurie noire de l'Indo-Pacifique (Holothuria leucospilota) -
Holothurie noire à mamelles (Holothuria nobilis) -
Holothurie têtue (Holothuria pervicax) -
Holothurie verte (Stichopus chloronotus) -
Une holothurie curry (Stichopus herrmanni) -
Holothurie dragon (Stichopus monotuberculatus)
Mollusques
L’embranchement des Mollusques tire son nom du mot latin « mollis », qui signifie mou, de même que la science qui les étudie, la malacologie, tire le sien du grec « malakos », qui a le même sens. Le corps des mollusques est donc mou. Cet embranchement très hétérogène d’animaux marins et terrestres est unifié par l’existence d’un tégument (le manteau) fabriquant des spicules et capable, chez la majorité d’entre eux, de produire une coquille (mais pas chez les limaces de mer par exemple). La coquille protège la masse viscérale qui se situe au-dessus d’un pied musculeux et généralement locomoteur. Un repli du manteau (la cavité palléale) protège les branchies et les organes excréteurs et reproducteurs. La cavité buccale est armée d’une sorte de langue râpeuse couverte de minuscules dents chitineuses (la radula)[85]. Les Céphalopodes (poulpes, calmars et seiches) sont également des mollusques sans coquille apparente, que l'évolution a dotés de capacités très particulières[86].
Gastéropodes
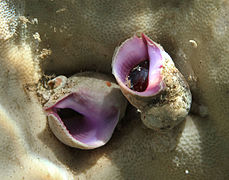
Les gastéropodes (du grec « gastêr », ventre ou estomac et « pous, podos », pied) possèdent généralement une coquille univalve spiralée qui peut être d’aspect très variable et qui est ou non fermée par un opercule calcaire ou corné[87]. La coquille est absente, ou résiduelle et interne chez certains Opisthobranches (limaces de mer)[88]. La tête est le plus souvent munie de tentacules, portant des yeux à leur extrémité ou à leur base. Le « pied » ventral large permet la locomotion par reptation (parfois aussi la nage par ondulations). La masse viscérale se trouve dans la coquille. Les gastéropodes sont les seuls mollusques à contenir des espèces terrestres. Ils peuvent être brouteurs ou carnivores.
La collecte intensive de coquillages vivants a fait fortement régresser les populations de certaines espèces comme les porcelaines et le « Casque rouge » (Cypraecassis rufa)[7]. Il convient de noter que les espèces du genre Conus sont venimeuses, certaines pouvant mettre en danger la vie d'un humain[89] (notamment Conus geographus, C. textile, C.tulipa, C.aulicus et C. striatus)[90].
-
Cône ponctué (Conus arenatus)
-
Cône astrologue (Conus chaldaeus)
-
Cône hébreu (Conus ebraeus)
-
Cône livide (Conus lividus)
-
Cône soldat (Conus miles)
-
Cône nussatelle (Conus nussatella)
-
Cône strié (Conus striatus), de nuit.
-
Cône violacé (Conus violaceus), rare.
-
Cône vierge (Conus virgo), en robe brune, ce qui est rare.
-
Porcelaine tigre (Cypraea tigris)
-
Porcelaine érodée (Erosaria erosa)
-
Porcelaine Isabelle (Luria isabella)
-
Porcelaine lynx (Lyncina lynx)
-
Porcelaine daim (Lyncina vitellus)
-
Porcelaine arabe (Mauritia arabica)
-
Porcelaine arabe, variété « immanis » (Mauritia arabica immanis)
-
Notadusta punctata immature
-
Porcelaine monnaie ou « cauri » (Monetaria moneta)
-
Cyprée, ou Porcelaine à tête de serpent (Monetaria caputserpentis)
-
Cymbiola sp. immature
-
Casque rouge (Cypraecassis rufa)
-
Mancinella sp.
-
Tectus sp.
-
Une troque Trochus flammulatus
-
Tonne perdrix (Tonna perdix)
-
Turban à bouche d'argent (Turbo argyrostomus)
-
Une ranelle géante (Tutufa bubo)
-
Cerithium sp. (probablement C. columna)
-
Strombe lentigineux (Lentigo lentiginosus)
-
Un Juvénile de Strombidae (peut-être Harpago arthriticus)
-
Une espèce non identifiée de la famille des Fasciolariidae (possible variation de Pleuroplaca trapezium)
-
Un escargot abeille (Engina mendicaria unilineata)
-
Ormeau (Haliotis varia)
-
Cheilea tectumsinense (rare)
Limaces de mer
Les limaces de mer ne sont pas les cousines marines des limaces terrestres. Elles forment le groupe des Opistobranches, caractérisé notamment par la position des branchies en arrière du cœur (le mot grec « opisthos » signifie postérieur). Ce groupe contient cinq ordres principaux (Cephalaspidea, Sacoglossa, Anaspidea, Notaspidea et Nudibranchia), le dernier regroupant le plus grand nombre d’espèces[91], dont beaucoup sont présentes à La Réunion[92]. Certaines, comme la danseuse espagnole, peuvent nager par ondulations des bords du manteau. Les aplysies, de l’ordre des Anaspidea, portent le nom vernaculaire de « lièvres de mer » en raison de leurs rhinophores érigés qui font penser à des oreilles de lapin. Elles peuvent nager au moyen des expansions latérales du manteau[93]. La majorité des Opisthobranches sont carnivores, les éponges étant la proie élective de nombreuses espèces.
- « Lièvres de mer (Anaspidea, famille des Aplysiidae) »
-
Dolabelle commune (Dolabella auricularia)
-
Dolabrifera dolabrifera (parfois appelé « Doladola »)
-
Stylocheilus longicauda avec sa ponte.
-
Doris guêpe (Aegires minor)
-
Asteronotus verruqueux (Asteronotus cespitosus) et sa ponte.
-
Discodoris azurée (Montereina coerulescens)
-
Doris à papilles orangées ou Doris impudique (Gymnodoris impudica), de nuit.
-
Halgerda à lignes jaunes (Halgerda formosa)
-
Danseuse espagnole (Hexabranchus sanguineus)
-
Jorunna funèbre (Jorunna funebris)
-
Jorunna veineuse (Jorunna rubescens)
-
Phestilla lugubre (Phestilla lugubris)
-
Phyllidie indienne (Phyllidia marindica)
-
Phyllidie verruqueuse (Phyllidia varicosa)
-
Phyllidie rose (Phyllidiella rosans)
-
Phyllidiopsis xishaensis juvénile
-
Doris à papilles (Sebadoris nubilosa)
- Autres Opisthobranches
-
Céphalaspide-sangsue (Chelidonura hirundinina)
-
Chélidonure ponctué (Chelidonura punctata)
-
Phanerophtalme olive (Phanerophthalmus smaragdinus)
-
philinopsis à lignes bleues (Philinopsis speciosa)
-
Placobranche ocellé (Plakobranchus ocellatus)
-
Une berthelline (Berthellina sp.)
-
Ombrelle (Umbraculum umbraculum)
-
Une coquille de Bulla vernicosa
Céphalopodes
La classe des Céphalopodes (du grec « képhalé », tête, et « pous, podos », pied) comprend des animaux strictement marins dont le corps est composé d’un manteau en partie antérieure duquel se trouve une tête armée de huit ou dix bras (huit pour les poulpes, dix pour calmars et seiches), exception faite des nautiles, qui en possèdent environ 90[94]. Les bras, très musculeux et munis de ventouses puissantes, rayonnent à partir de la bouche. Celle-ci possède des mandibules cornées en forme de bec de perroquet derrière lesquelles se trouve une radula. Les yeux et le système nerveux sont extrêmement développés. La coquille est soit modifiée à l’intérieur du manteau (la « plume » des calmars et « l’os » des seiches) soit absente, comme chez les poulpes. Un entonnoir orientable placé à l’ouverture de la cavité palléale permet la respiration, l’élimination des déchets et la propulsion au moyen de contractions[95]. Les nautiles sont les seuls céphalopodes à avoir une coquille externe et des bras sans ventouses[96].
-
Poulpe tacheté (Callistoctopus macropus), dans sa livrée agressive.
-
Couple de poulpes des récifs (Octopus cyanea), en plein accouplement.
-
Calmar des récifs (Sepioteuthis lessoniana)
-
Banc de calmars des récifs.
Bivalves
Les bivalves sont une classe de mollusques de mer et d'eau douce caractérisée par une coquille divisée en deux parties (les valves) plus ou moins symétriques et articulées. Ils possèdent un pied puissant quand ils sont fouisseurs, mais les espèces fixées développent une touffe de fibres appelée byssus, qui leur permet de s’ancrer sur un substrat dur. Ce sont majoritairement des animaux filtreurs qui se nourrissent des particules organiques en suspension dans l’eau[97], même si certains comme les bénitiers sont capables de photosynthèse grâce à des algues symbiotiques, comme les coraux. Les fouisseurs disposent d’un siphon qui leur permet de se nourrir alors qu’ils sont cachés dans le sédiment. Les bivalves sont les seuls mollusques à n’avoir pas de tête différenciée, mais certains possèdent quand même des « yeux » photorécepteurs[98].
-
Une huître perlière (Pinctada radiata)
-
Lime fragile (Limaria fragilis)
-
Bénitier géant (Tridacna maxima)
-
Grand bénitier gaufré (Tridacna squamosa)
-
Une colonie de Modiolus auriculatus
-
Un bivalve Acrosterigma discus (couverte par du mycélium de champignon marin)
-
Un bivalve du genre Pinctada
-
Un bivalve non identifié de la famille des Pectinidae
-
Un bivalve non identifié de la famille des Pteriidae
-
Un bivalve non identifié
-
Un bivalve non identifié
-
Un bivalve non identifié
-
Un bivalve non identifié
-
Un bivalve non identifié
-
Un bivalve non identifié
Crustacés
Les crustacés sont des arthropodes (animaux à pattes articulées) marins recouverts d’un exosquelette chitineux (la carapace, pour ce qui concerne la partie céphalo-thoracique), ce pourquoi leur croissance impose des mues. On estime leur nombre total entre 65 000 et 80 000 espèces, qui sont le plus souvent marines[99]. Leur taille adulte peut aller de 0,2 mm pour le plus petit des copépodes planctoniques[100] à une taille de carapace de plus de 40 cm[101] pour le Crabe de cocotier. La majorité est carnivore et/ou nécrophage. Ils jouent un rôle important dans les écosystèmes récifaux[102].
Crabes
Les « vrais crabes » sont des crustacés décapodes (à dix pattes), essentiellement représentés par l’infra-ordre des Brachyura. Leur première paire de pattes est modifiée pour porter des pinces à fonction de préhension, de défense et de communication. Ces pinces, de taille et de morphologie très variable, peuvent être dissymétriques. Certains sont capables de nager grâce à une dernière paire de pattes adaptée. Un certain nombre d’espèces vit en association avec d’autres organismes, soit pour se camoufler (éponges, algues, gorgones, etc.) ou se défendre (anémones), soit dans le cadre d’une relation symbiotique, comme les Trapeziidae avec les coraux Pocillopora, soit en parasite, comme le crabe Hapalocarcinus marsupialis (famille des Cryptochiridae), dont la femelle forme des galles dans les mêmes coraux, et trouve protection dans cette prison à vie[102]. 214 espèces de « vrais crabes » ont été recensées à La Réunion en 2008, mais cet inventaire reste provisoire[9].
-
Crabe honteux (Calappa hepatica)
-
Crabe décorateur (Camposcia retusa)
-
Crabe à taches rouges (Carpilius maculatus), de nuit.
-
Crabe coureur (Geograpsus grayi)
-
Un crabe du genre Liomera?
-
Crabe boxeur à mosaïque (Lybia tessellata)
-
Micippa platipes sur le dos
-
Crabe fantôme juvénile (Ocypode ceratophtalmus)
-
Crabe fantôme pâle (Ocypode pallidula)
-
Crabe à oursins (Percnon planissimum)
-
Accouplement de deux Thalamita coeruleipes de nuit
-
Trapézie à tache jaunes (Trapezia flavopunctata) dans un Pocillopora eydouxi
-
Xanthias punctatus de nuit
-
Galle de corail Pocillopora autour d’une femelle de Cryptochiridae (probablement Hapalocarcinus marsupialis).
-
Un crabe de la famille des Majidae
Pagures
Les pagures, ou bernard-l’ermite, habitent en permanence dans une coquille vide de gastéropode qu’ils abandonnent pour une autre plus grande quand leur croissance l’exige. Leur abdomen, mou et asymétrique, est spiralé pour pouvoir se loger dans les coquilles. La nécessité et le danger de changer de coquille provoquent un comportement social appelé « chaîne de vacances » : de nombreux pagures de taille différente se réunissent autour d’une coquille vide adaptée à la croissance du plus gros d’entre eux, et chacun passe ensuite dans la coquille de l’autre, la plus petite restant vide[103]. Plusieurs espèces sont en association symbiotique avec des anémones. Un inventaire provisoire établi en 2008 a recensé 32 espèces de bernard l’ermite à La Réunion[9].
-
Bernard-l'ermite (Aniculus ursus)
-
Pagure élégant ou bernard-l'ermite à pattes bleues (Calcinus elegans)
-
Bernard-l'ermite à grosse pince (Calcinus laevimanus)
-
Bernard-l'ermite du Japon (Calcinus latens)
-
Bernard-l'ermite terrestre ou Cénobite stridulant (Coenobita rugosus), sur une plage.
-
Pagure à anémones (Dardanus deformis)
-
Bernard-l'ermite à taches bleues (Dardanus guttatus) dans une coquille désaffectée de Strombus lentiginosus
-
Pagure des récifs (Dardanus lagopodes)
-
Bernard-l'ermite à points blancs (Dardanus megistos)
Squilles et Langoustes
Les squilles font partie de l’ordre des Stomatopoda. Le terme, qui vient du grec « stóma », bouche, et « pous, podos », pied, est justifié par les cinq premières paires d’appendices thoraciques, qui servent chez eux de « pattes mâchoires »[104], les trois dernières paires de pattes étant seules locomotrices. La deuxième paire distingue deux groupes fonctionnels, les squilles aux pattes ravisseuses, armées de dents longues et aigues, et celles dont la base du dernier segment est une sorte de massue[105]. La vitesse de frappe de cette paire de pattes est telle (elle peut atteindre 23 m/s[106]) qu’elle produit une détonation et des bulles par cavitation au contact de la proie[107], capable de briser une paroi d’aquarium. La vision des squilles est une des plus élaborées du règne animal[108]. Les langoustes sont des décapodes sans pinces appartenant pour l’essentiel à la famille des Palinuridae. Leur pêche est réglementée à La Réunion[109], mais elles sont victimes du braconnage. 13 espèces de squilles et 14 de langoustes (au sens large) ont été recensées dans les eaux de l’île en 2008. Squilles et langoustes sont présentes dans le lagon mais elles sont rarement visibles, les premières parce qu’elles sont discrètes, les secondes parce qu’elles ne sortent de leur abri que la nuit.
-
Squille à ocelles oranges (Gonodactylus platysoma)
-
Squille multicolore ou crevette-mante paon (Odontodactylus scyllarus)
-
Langouste fourchette (Panulirus penicillatus)
Crevettes
La majorité des « vraies crevettes » est regroupée dans l’infra-ordre des Caridea, le plus grand nombre d’espèces étant marines. Elles sont caractérisées par un corps long et hydrodynamique équipé d’appendices natatoires biramés sous l’abdomen (ce qui leur permet de nager), par de petites pinces au bout des deux premières paires de pattes (et de la troisième paire chez les Stenopodidae) et généralement par un rostre denticulé à l’extrémité du céphalothorax[110]. La plupart des crevettes sont carnivores, détritivores ou omnivores, mais certaines, dont les pinces sont remplacées par des soies en éventail, sont filtreuses. De nombreuses espèces vivent en association avec des coraux dont beaucoup sont dépendantes (hôtes obligatoires)[102]. Elles peuvent aussi être associées à des poissons (gobies), des anémones, des bivalves, des éponges, des oursins et même des vers polychètes comme le ver de feu[102]. 182 espèces de crevettes ont été recensées à La Réunion en 2008[9].
-
Une crevette Alpheus leviusculus
-
Alpheus lottini, cachée dans un Pocillopora
-
Une crevette Alpheus cf. lobidens?
-
Une crevette danseuse aux yeux verts (Cinetorhynchus reticulatus)
-
Crevette des astérides (Periclimenes soror) sur une étoile-coussin.
-
Crevette marbrée (Saron marmoratus), de nuit.
-
Saron neglectus dans un massif de Pocillopora
-
Crevette des oursins (Stegopontonia commensalis) sur un Diadema
-
Grande crevette nettoyeuse (Stenopus hispidus)
-
Crevette nettoyeuse de Bruun (Urocaridella antonbruunii) sur un Cantherhines dumerilii, de nuit.
-
Crevette bourdon (Gnathophyllum americanum)
-
Une crevette du genre Salmoneus (peut-être S. serratidigitus)
-
Une Neaxius acanthus tentant de se nourrir d'un cadavre de chirurgien bagnard.
Cirripèdes
Les Cirripedia (des mots latins « cirrus », « boucle de cheveux », et « pes, pedis », pied) sont des crustacés malgré leur apparence, comme le prouvent leurs stades larvaires. Ils comprennent les Lépadomorphes (anatifes), les Balanomorphes, comme les balanes, et les parasites Rhizocéphales, comme les sacculines. Ils sont exclusivement marins. Leurs larves se fixent par les antennules sur un support quelconque, et entament une métamorphose complète qui produira les morphologies adultes très particulières de ce groupe[111]. Les animaux ainsi fixés ne se déplaceront plus jamais[112]. Quand ils ne sont pas parasites les adultes peuvent être pédonculés, ou operculés et sessiles. Les cirripèdes sont munis de fouets garnis de soies (les « cirres ») destinés à capter des particules organiques en suspension dans l’eau.
-
Une colonie d'anatifes nonnettes (Lepas anserifera), amenée sur la plage de L’Ermitage par la houle.
vers marins
Les vers marins se répartissent en huit embranchements : les Annélides, les Plathelminthes, les Sipunculiens, les Némertes, les Acanthocéphales, les Phoronidiens, les Nématodes et les Nématophores. Ces embranchements ne manifestent pas de liens de parenté directs[113]. Le plan d’organisation qui fait leur unité se situe dans la structure et le développement des embryons[114]. Ils ne sont pas nécessairement « vermiformes ».
Vers polychètes
Les polychètes (sous-ordre des Polychaeta, du grec « poly », plusieurs, et « chet- », soies) sont des vers annélides segmentés très majoritairement marins. Ils comprennent environ 10 000 espèces[115]. Ils ont une tête différenciée porteuse de mâchoires qui apparaissent quand le pharynx est dévaginé[116]. Chaque segment du corps porte des parapodes qui leur permettent de marcher rapidement, et à l’occasion de nager[117]. Ces parapodes sont équipés de soies chitineuses, qui sont urticantes chez certaines espèces. Ils peuvent être fixés (vers tubicoles) ou errants, soit sur le fond, soit en pleine eau. Les vers fixés sont microphages et capturent les particules alimentaires contenues dans l’eau au moyen d’appendices ramifiés divers, les errants sont carnivores[118]. Leur taille peut aller de quelques dixièmes de millimètres[116] à trois mètres (Eunice aphroditois[119]).
-
Un ver arbre de Noël (Spirobranchus giganteus)
-
Un ver de feu (Eurythoe complanata), urtiquant
-
Un polychète de la famille des Hesionidae
-
Un ver Paralepidonotus sp.?
-
Un ver polynoïde (Polynoidae, possiblement Lepidasthenia sp.)
-
Une sabelle (famille des Sabellidae)
-
Une autre variété de sabelle
-
Un ver de la famille des Sigalionidae
-
Un ver de la famille des Syllidae
-
Un ver Spirorbe (Spirorbis)
-
Un ver terebellide (Terebellidae)
Vers plathelminthes
Les Plathelminthes (du grec « platus », plat et « helmins », ver) sont des vers plats dont de nombreuses espèces sont des parasites[120]. Les vers les plus connus de la classe des Turbellaria (vers plats non exclusivement parasites) sont les planaires, vers libres, nageurs ou rampants, dont l’épaisseur du corps peut mesurer moins d’un millimètre[121]. Elles peuvent se reproduire de façon sexuée (les planaires sont hermaphrodites, la reproduction est croisée) ou par scissiparité. Leur corps étant extrêmement fragile, elles sont capables de régénérer une de ses parties amputées, y compris la tête, qui contient un réseau organisé de neurones[122]. Ce sont des êtres complexes, qui sont capables d’apprentissage et donc de mémoire, les contenus mémorisés restant intacts après décapitation et régénération de la tête[123]. 32 espèces de planaires ont pour le moment été recensées à La Réunion[124].
-
Un plathelminthe Pseudobiceros damawan de nuit
-
Un plathelminthe Pseudobiceros uniarborensis
-
Un plathelminthe du genre Pseudobiceros
-
Un plathelminthe du genre Pericelis
-
Un plathelminthe du genre Paraplanocera
-
Un autre plathelminthe du genre Paraplanocera, avec ses œufs.
-
Un plathelminthe du genre Pericelis
-
Un plathelminthe de la famille des Prosthiostomidae
-
Un plathelminthe du genre Thysanozoon ou Acanthozoon
Autres types de vers
-
Un ver némerte (Nemertea)
-
Un ver balanoglosse (balanoglossus, entéropneuste)
-
Glossobalanus sp. (entéropneuste)
-
Un ver de la famille des Bonelliidae (Échiuriens)
-
Un ver tubicole non identifié.
Cnidaires
L’embranchement des cnidaires (du grec « knidê », ortie de mer) regroupe les anémones de mer, les méduses et les coraux. Ils comprennent des formes fixées (corail, anémones de mer), et des formes libres (méduses, siphonophores...). Ils possèdent tous des cellules urticantes, les cnidoblastes (cellules spécialisées comportant un appareil venimeux muni d’une sorte de harpon) à usage défensif ou de prédation[125]. Leur symétrie est radiaire (d’ordre 4 ou 6, ce qui détermine notamment le nombre des tentacules) et se distribue autour d’un orifice central, à la fois bouche et anus. Ils sont tous carnivores. Les coraux chassent le zooplancton la nuit en utilisant leurs cnidoblastes[126], les anémones et les méduses capturent de petits animaux (des poissons, des crustacés, des vers, etc.) en pleine eau au moyen de leurs filaments.
À l’échelle mondiale, les coraux, qui représentent moins de 0,15% de la surface des océans, abritent cependant plus du quart de la biodiversité marine[127]. À La Réunion ils sont dominés par une espèce branchue du genre Acropora, mais n’en sont pas moins représentés par plusieurs dizaines de genres. Dans l’archipel des Mascareignes, où se trouve La Réunion, on trouve en tout 53 genres et 189 espèces de scléractiniaires[127]. Les méduses et les anémones de mer sont beaucoup moins nombreuses dans les lagons.
Coraux
Les coraux sont des scléractiniaires caractérisés par un squelette calcaire protégeant un polype. Ils comprennent des espèces coloniales et des espèces solitaires. Les espèces coloniales, constructrices des récifs, vivent en symbiose avec des algues unicellulaires (« zooxanthelles »[128]) qui assurent par photosynthèse une grande partie de la nourriture des polypes hôtes et leur fournissent de l’oxygène[129]. Ce pourquoi la vie des coraux est dépendante de la lumière : ils ne peuvent pas vivre au-delà de 50 m de profondeur[130], sauf pour les espèces ne dépendant pas de ces algues. Les algues photosynthétiques donnent aussi leurs couleurs aux coraux : le Blanchissement des coraux provient de leur expulsion, qui peut être due à une augmentation de la température de l’eau ou à la pollution, le recouvrement par des sédiments terrigènes, etc. Si les zooxanthelles ne peuvent pas revenir dans les coraux assez rapidement, ils meurent[131].
Sauf pour certaines espèces bien caractéristiques, la détermination des coraux in situ ou d'après photo est assez hasardeuse dans la mesure où seuls un examen microscopique des squelettes calcaires des polypes, ou une analyse ADN permettent de discriminer certaines espèces d'aspect semblable.
-
Corail digitiforme (Acropora digitifera)?
-
Corail digité (Acropora gemmifera)
-
Corail tabulaire (Acropora hyacinthus)?
-
Corail arborescent (Acropora muricata)
-
Corail verruqueux (Pocillopora damicornis)
-
Corail-framboise brun (Pocillopora eydouxi)
-
Corail framboise (Pocillopora verrucosa)
-
Corail Montipora sp.
-
Corail Montipora sp.
-
Corail coupe (Turbinaria peltata, colonie morte)
-
Cyphastrea serailia (polypes rétractés)
-
Corail poreux montagneux (Porites lutea)
-
Corail cristal (Galaxea fascicularis)
-
Goniopora sp.
-
Corail cerveau Platygyra daedalea?
-
Corail cerveau Platygyra lamellina
-
Corail Acanthastrea echinata
-
Corail Montastrea sp.
-
Corail champignon (Fungia scutaria?)
-
Corail-champignon hirsute (Danafungia horrida)
-
Corail « pomme-chips » (Pavona cactus)
-
Pavona sp.
-
Corail mou Lobophytum sp.
-
Corail mou Sinularia sp.
-
Corail mou Sinularia sp. (autre espèce)
-
Corail dégradé en certaines parties du platier corallien.
Hydrozoaires
La classe des hydrozoaires comprend des animaux fixés ou libres, généralement coloniaux. Pour en rester à ceux qu’on peut observer dans les lagons de La Réunion, certains produisent un squelette calcaire, comme les « coraux de feu », d’autres passent leur vie en pleine eau, comme les méduses, d’autres encore sont des colonies de milliers de polypes organisés en quatre spécialisations, comme le siphonophore qu’est la physalie. La plupart sont munies de cnidoblastes très urticantes pour l’homme : les espèces les mieux armées provoquent des douleurs violentes, et certaines comme la physalie sont potentiellement dangereuses[132].
-
Corail de feu (Millepora exaesa)
-
Corail de feu en plaques (Millepora platyphylla)
-
Corail de feu (Millepora tenera)
-
La méduse Thysanostoma loriferum
-
La dangereuse physalie (Physalia utriculus) entre parfois dans les lagons, poussée par la houle ou les vents.
anémones
Les anémones de mer font partie de la classe des Anthozoa (du grec « anthos », fleur, et « zoon », animal) qui présentent une symétrie d’ordre six, ou un multiple de six. Leurs tentacules peuvent être très nombreux, jusqu’à près de 200[133]. Outre leurs cnidoblastes, certaines espèces peuvent projeter des filaments urticants (les aconties). Elles sont solitaires ou coloniale[134] et se fixent au substrat au moyen d’une ventouse, mais elles peuvent se déplacer si nécessaire. De nombreuses espèces hébergent des zooxanthelles. Dix espèces[135] sont en association symbiotique avec des espèces de poisson-clown, protégées de leur venin par un mucus[136]. D’autres le sont avec des pagures[137], et le « crabe-boxeur » Lybia tessellata en agite deux au bout de ses pinces dès qu’il est inquiété.
-
Anémone zoanthaire Palythoa natalensis
-
Anémone cuir encroûtante (Palythoa tuberculosa)
-
Anémone adhésive (Cryptodendrum adhaesivum).
-
Une Anémone de Mertens (Stichodactyla mertensii)
-
Rhodactis rhodostoma (anémone corallimorphaire, ici de nuit)
-
Rhodactis sp.
-
Anémone des Bernard-l'hermite (Calliactis polypus), avec des aconties.
-
Anémone du genre Telmatactis
-
Thalassianthus sp.
-
Verrillactis paguri? sur le bord columellaire d'une coquille habitée par un pagure.
Éponges
Les spongiaires (éponges) sont regroupés dans l’embranchement des Porifera (du latin « porus », trou, et « ferre », porter). L’absence de système nerveux qui les caractérise les fait souvent prendre pour des algues ou des végétaux. Elles peuvent avoir des formes, des couleurs et des tailles très diverses. Leur rigidité est due à la présence de millions d'ossicules calcaires ou siliceux indépendants présents sous le derme (les spicules), mais certaines espèces les remplacent par des fibres de spongine[138]. Elles respirent et se nourrissent en filtrant de grandes quantités d’eau au moyen d’une multitude de pores inhalants et d’un pore exhalant, appelé oscule. Une éponge carnivore a cependant été découverte en 1992[139]. Les éponges se reproduisent par voie sexuée ou par bourgeonnement[140]. À La Réunion plusieurs espèces d'éponges colonisent les lagons. Les espèces des familles Clionaidae et Axinellidae sont les plus fréquentes, mais les données scientifiques sont encore lacunaires sur ces populations[7]. Le contact avec certaines espèces peut provoquer des irritations ou des brûlures. Chez de nombreuses éponges, la variabilité morphologique est telle que la détermination de l’espèce ne peut se faire qu’à l’issue d’un examen microscopique des spicules : l'identification par photographie est donc souvent très délicate. En conséquence, ce chapitre illustre des formes observables, mais la détermination précise de l'espèce n'a pas toujours été possible.
-
Une éponge Scopalina rubra?
-
Une éponge oreille d'éléphant (Stylissa carteri)?
-
Une éponge de la famille des Tetillidae
-
Une éponge du genre Tethya
-
Une éponge du genre Clathrina
-
Une éponge du genre Chelonaplysilla
-
Une éponge du genre Cinachyrella)
-
Une éponge du genre Placospongia
-
Une démosponge de la famille de Callyspongiidae
-
Une éponge de la famille des Tetillidae (peut-être Craniella sp.)
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée
-
Une éponge non identifiée.
Foraminifères
Les foraminifères forment un embranchement de protozoaires (animaux unicellulaires), caractérisés par leur squelette minéral perforé (du latin foramen, « trou »[141]). Ce sont des animaux extrêmement abondants depuis plusieurs centaines de millions d'années, ce qui leur confère une grande importance au niveau écologique mais aussi paléontologique[142] (notamment du fait qu'ils forment un des groupes de fossiles les plus abondants et diversifiés). Leur coquille minérale est appelée « test »[142] (comme le squelette des oursins) ; celle-ci comprend une ou plusieurs chambres[143] (ou loculus ou loges) reliées entre elles, et est munie d'un ou plusieurs orifices (« foramen ») qui relient ces loges au milieu extérieur. De ces foramens sortent des pseudopodes[144], qui permettent à l'animal d'interagir avec son environnement : préhension, alimentation, déplacement. Leur taille varie généralement de 38 µm à 1 mm, mais certaines espèces peuvent cependant mesurer plus de 18 cm[145]. On en recense actuellement plus de 6000 espèces vivantes[146], ce qui est sans doute peu comparé à la diversité effective.
-
Homotrema sp.?
-
Un foraminifère non identifié.
Algues et végétaux marins
Du fait qu'il s'agisse d'un récif corallien, les macro-algues sont relativement peu fréquentes dans les lagons de la Réunion[7], en dehors de l’invasion saisonnière de certaines espèces, ou de leur multiplication liée à l’eutrophisation des eaux lagonnaires[147]. Pour ce qui concerne les végétaux, on rencontre de petits herbiers isolés, en zone sablo-détritique ou corallienne, de La Saline les Bains jusque dans la partie nord du récif de St Gilles où leur densité est la plus forte[7]. Ces herbiers sont monospécifiques : ils sont produits par la seule espèce Syringodium isoetifolium (ordre des Alismatales), équivalent tropical de la posidonie méditerranéenne[7]. La turbinaire (Turbinaria ornata) est également bien présente à certains endroits. La Réunion ne comporte pas de mangroves[7].
Végétaux marins
Les phanérogames (des mots grecs « phaneros », visible, et « gamos », union : les organes de reproduction sont apparents) sont des plantes à fleurs et graines le plus souvent terrestres, mais il existe une soixantaine d’espèces dont les ancêtres sont redevenus marins il y a environ 100 millions d’années[148]. Elles comportent des racines, des tiges horizontales ou verticales, et des feuilles qui assurent, comme celles des plantes terrestres, la fonction chlorophyllienne[149]. Ces phanérogames marines peuvent couvrir de vastes étendues et ont un rôle écologique important : stabilisation des sédiments, réduction de la vitesse des courants, oxygénation de l’eau, stockage de carbone, apport de nourriture pour certaines espèces, nourricerie pour d’autres, etc[150]. Les herbiers sont cependant en régression partout dans le monde, notamment du fait de la pression anthropique sur ces milieux[150].
-
L'herbe marine Syringodium isoetifolium (plante à fleur)
Algues vertes (Chlorophyta)
Les Chlorobionta (du grec « chloro », vert, et « biôn », vivant) comprennent les plantes terrestres et les algues vertes. Les algues vertes marines appartiennent à l’infra-règne des Chlorophyta. Elles peuvent être unicellulaires ou très complexes. Leur couleur vient de pigments, les chlorophylles a et b, présents dans le cytoplasme de leurs cellules[151].
Algues rouges (Rhodophyta)
Les algues rouges doivent leurs couleurs (qui peuvent aller du brun foncé au rose) à des pigments rouges (phycoérythrines) et bleus (phycocyanines) qui masquent les chlorophylles[151]. Les couleurs varient de surcroît en fonction de l’exposition à la lumière.
-
Liagora sp.
-
Peyssonnelia (Peyssonnelia sp., algue rouge calcaire)
-
Mesophyllum sp.
-
Algue encroûtante de la famille des Corallinaceae
Algues brunes (Ochrophyta)
La couleur des algues brunes vient de l’abondance d’un pigment caroténoïde brun (la fucoxanthine)[151], associé aux chlorophylles c1 et c2[152]. Ce pigment masque les chlorophylles a et b[151].
-
Dictyota sp.
-
Turbinaire (Turbinaria ornata)
-
Bloom de diatomées (Bacillariophyta) sur l'herbe marine Syringodium isoetifolium
Algues bleues (Cyanophyta)
Les cyanobactéries, souvent appelées algues bleues (ou bleu-vert), ne sont pas des algues mais des bactéries procaryotes coloniales. Ce sont le plus souvent des formes filamenteuses de consistance éventuellement gluante, dont le plus grand nombre est microscopique. Malgré leur nom vernaculaire elles peuvent prendre diverses couleurs et sont rarement bleues. Ces couleurs viennent des pigments bleus (phycocyanines) et rouges (phycoérythrines) qui masquent la chlorophylle a[151]. Leur pullulation, due notamment à l’eutrophisation des eaux, peut provoquer des catastrophes écologiques et présenter un danger pour les hommes[153].
-
Une colonie de cyanophycées Lyngbya majuscula
-
Une colonie de cyanophycées Symploca hydnoides?
-
Une colonie de cyanophycées Phormidium cf. laysanense
-
Une colonie de cyanophycées du genre Anabaena
-
Une colonie de cyanophycées du genre Hydrocoleum
-
Une colonie de cyanophycées du genre Hydrocoleum
Notes et références
- Emmanuel Tessier, Dynamique des peuplements ichtyologiques associés aux récifs artificiels à l’île de la Réunion (ouest de l’océan Indien) – Implication dans la gestion des pêcheries côtières., Saint Denis, Thèse de doctorat sous la direction de Pascale Chabanet et Catherine Aliaume, , 254 p. (lire en ligne).
- Patrick Durville, Colonisation ichtyologique des platiers de La Réunion et biologie des post-larves de poissons coralliens, Saint Denis, Thèse de doctorat sous la direction de Chantal Conand et René Galzin, (lire en ligne).
- Étude comparative des récifs coralliens de l’archipel des Mascareignes, Station marine d’Endoume et Centre d’Océanographie, Marseille, et Centre Universitaire de La Réunion, Saint Denis de La Réunion, in : Guézé P. (dir.) Biologie marine et exploitation des ressources de l'Océan Indien occidental, Paris : ORSTOM, 1976, (47), p. 153-177
- Réserve naturelle marine de La Réunion, Plan de gestion 2012-2016, « Section A, Diagnostic », 2012 lire en ligne.
- Emmanuel Cordier, Dynamique hydrosédimentaire du récif frangeant de L’Ermitage/La Saline : processus physiques et flux sédimentaires, Saint Denis, thèse de doctorat sous la direction de J. Coudray et B. Millet, .
- « Faune marine de la Réunion », sur LiledelaReunion.com (consulté le ).
- « Biodiversité marine à La Réunion », sur VieOcéane (consulté le ).
- GIP RNMR & Vie Océane, « La Réserve Naturelle Nationale Marine de la Réunion : un patrimoine naturel à préserver », sur http://www.reservemarinereunion.fr (consulté le ).
- Joseph Poupin, « Crustacés de la Réunion, décapodes et stomatopodes », sur http://horizon.documentation.ird.fr, IRD, .
- (en) Ronald Fricke, Thierry Mulochau, Patrick Durville, Pascale Chabanet, Emmanuel Tessier et Yves Letourneur, « Annotated checklist of the fish species (Pisces) of La Réunion, including a Red List of threatened and declining species », Stuttgarter Beiträge zur Naturkunde A, Neue Serie, vol. 2, , p. 1–168 (lire en ligne). L'évaluation donnée dans cette étude a depuis été revue légèrement à la hausse (Durville 2011), donnant au moins 1090 espèces de poissons.
- C. Gabrié, « L’état des récifs coralliens en France Outre-Mer », Initiative Française pour les récifs coralliens (Ifrecor), , p. 136 (lire en ligne).
- Fabrice Floch, « L’Ermitage : plus de 7000 poissons retrouvés morts sur la plage en 15 jours », sur Réunion 1ère, . Cette estimation est sans doute très inférieure à la réalité, du fait que de nombreux cadavres sont consommés avant d'atteindre la plage.
- « Des milliers de poissons morts dans le lagon: Une bactérie à l'origine de l'hécatombe », sur Zinfos974,
- « Poissons morts : le phénomène s’estompe », sur linfo.re, .
- Jean-Pascal Quod, « Mortalité de masse des poissons côtiers - Jean-Pascal Quod : "Une maladie émergente, au même titre que le chikungunya" », sur http://reunion.orange.fr/news.
- (en) D.L. Dixson, D. Abrego et M.E. Hay, « Chemically mediated behavior of recruiting corals and fishes: A tipping point that may limit reef recovery », Science, vol. 345, no 6199, , p. 892 (DOI 10.1126/science.1255057, lire en ligne).
- Matthieu Juncker, « Approvisionnement en larves de poissons du lagon de Wallis (Pacifique Sud) », Thèse de doctorat sous la direction de Claude Chauvet et Laurent Wantiez, (lire en ligne).
- Groupe de spécialistes des tortues marines UICN/CSE, Une stratégie mondiale pour la sauvegarde des espèces de tortues marines, Arlington, VA, Etats-Unis, Commission de la sauvegarde des espèce de l'UICN, , 30 p. (ISBN 2-8317-0266-6).
- « Les reptiles marins », sur www.commissionoceanindien.org.
- « Conservation des tortues marines dans les territoires français du Sud Ouest de l'océan Indien », sur wwz.ifremer.fr.
- « La Réunion : Terre d’asile pour les tortues marines », sur kelonia.org, .
- « Programme de photo-identification », sur Kelonia.org.
- « Site officiel de Kelonia ».
- « Tortues marines : charte d'observation en mer », sur www.kelonia.org/fr/.
- Guillaume Lecointre, Cyril Gallut, Bruno Chanet et Agnès Dettaï, « Évolution : du rififi chez les poissons », Pour la Science, no 390, (lire en ligne).
- (en) R.W. Wilson et al., « Contribution of fish to the marine inorganic carbon cycle », Science, vol. 323, no 359, (DOI 10.1126/science.1157972, lire en ligne).
- « Teleostei », sur ITIS.
- (en) « Order Summary for Lophiiformes », sur FishBase.
- (en) « Family Mugilidae », sur http://newfoundpress.utk.edu..
- « Atheriniformes », sur FishBase.
- (en) « Beloniformes », sur FishBase.
- (en) « Beryciformes », sur FishBase.
- (en) « Beryx decadactylus », sur FishBase.
- (en) « beryciformes », sur encyclopedia.com.
- (en) « Syngnathiformes », sur FishBase.
- (en) « Scorpaeniformes », sur FishBase.
- Bernard Le Garff, « Les Poissons », sur le site de l'université Rennes-1.
- (en) « Perciformes », sur FishBase.
- (en) « Perciformes », sur http://newfoundpress.utk.edu.
- WoRMS (2013), Chaetodontidae. In: Froese, R. and D. Pauly. Editors. (2013) FishBase, via World Register of Marine Species (lien)
- « Famille Chaetodontidae », sur aquasystematique.com.
- (en) Philip Jay Motta, « Tooth attachment, replacement and growth in the butterfly fish, Chaetodon miliaris, (Chaetodontidae, Perciformes) », Can. J. Zool., vol. 62, , p. 183-189 (lire en ligne).
- (en) Michel Kulbicki et Y.M. Bozec, « The use of butterflyfish (Chaetodontidae) species richness as a proxy of total species richness of reef fish assemblages in the Western and Central Pacific », Aquatic Conservation: Marine and Freshwater Ecosystems, vol. 15, , p. 127-141 (lire en ligne).
- WoRMS (2013) : Pomacanthidae, In: Froese, R. and D. Pauly. Editors. (2013) FishBase, through World Register of Marine Species (lire en ligne).
- (en) « Family Pomacanthidae - Angelfishes », sur FishBase.
- « Aire de parade », sur www.babylon.com.
- Michel Kulbicki, « Les Chaetodons et les Pomacanthidae », sur www.com.univ-mrs.fr.
- Cirrhitidae, dans Froese, R. and D. Pauly (Editors), 2013, FishBase via World Register of Marine Species.
- (en) « Family Cirrhitidae - Hawkfishes », sur FishBase.
- (en) Tatsuru Kadota, Jun Osato, Hiroaki Hashimoto et Yoichi Sakai, « Harem structure and female territoriality in the dwarf hawkfish Cirrhitichthys falco (Cirrhitidae) », Environmental Biology of Fishes, vol. 92, no 1, , p. 79-88 (lire en ligne).
- (en) « Family Pomacentridae - Damselfishes », sur FishBase.
- (en) « Pomacentridae Damselfishes », sur animaldiversity.ummz.umich.edu.
- Sophie Jugant, « Importance des récifs coralliens pour les poissons récifaux : exemple des Demoiselles (Pomacentridae), dans l’archipel des Maldives. », Thèse d'exercice, Médecine vétérinaire, Ecole Nationale Vétérinaire de Toulouse, , p. 142 (lire en ligne).
- « POISSON-CLOWN BISTRÉ », sur www.ifrecor.nc.
- (en) « Family Labridae - Wrasses », sur FishBase.
- « Labre », sur le Trésor de la Langue Française.
- (en) Yvonne Sadovy De Mitcheson et Min Liu, « Functional hermaphroditism in teleosts », Fish and fisheries, vol. 9, no 1, , p. 1-43 (DOI 10.1111/j.1467-2979.2007.00266.x, lire en ligne).
- « Labroides dimidiatus (Valenciennes, 1839) », sur DORIS, .
- (en) « Family Scaridae - Parrotfishes », sur FishBase.
- (en) Daniel M. Russell, « Parrotfish and sand production (part 2) », sur searchresearch1.blogspot.fr.
- (en) Hawaii Cooperative Fishery Research Unit, « Biology of parrotfishes in Hawaii », Report prepared for the Western Pacific Regional Fishery Management Council, (lire en ligne).
- (en) E. Lieske et R. Myers, Coral Reef Fishes : 2nd edition, Princeton University Press, .
- (en) « Family Blenniidae - Combtooth blennies », sur FishBase.
- (en) « Blennidae - Habitat », sur Encyclopedia of Life.
- (en) « Blennidae - Details », sur Encyclopedia of Life.
- (en) « Blennidae - Reproduction », sur Encyclopedia of Life.
- (en) « Family Gobiidae - Gobies », sur FishBase.
- (en) « Gobiidae », sur ftp.fao.org.
- (en) J. Lynn Preston, « Communication systems and social interactions in a goby-shrimp symbiosis », Animal Behaviour, vol. 26, , p. 791 -802 (lire en ligne).
- (en) Elizabeth A. Whiteman et Isabelle M. Côté, « Sex differences in cleaning behaviour and diet of a Caribbean cleaning goby », Journal of the Marine Biological Association of the UK, vol. 82, no 4, , p. 655-664 (lire en ligne).
- (en) « Family Acanthuridae - Surgeonfishes, tangs, unicornfishes », sur FishBase.
- (en) Francesco Santini, « A multi-locus timetree of surgeonfishes (Acanthuridae, Percomorpha), with revised family taxonomy », Molecul arPhylo genetics and Evolution, vol. 68, (lire en ligne).
- (en) « Acanthuridae : Surgeonfishes, tangs, unicornfishes », sur Animal Diversity Web.
- Pierre Avenas et Henriette Walter, La fabuleuse histoire du nom des poissons (lire en ligne).
- « Un groupe d’intérêt durable pour l’équipe : les pleuronectiformes », sur http://www.acanthoweb.fr.
- (en) « Tetraodontiformes », sur FishBase.
- Bernard Seret, « Poissons de mer de l'ouest africain tropical », sur www.aprapam.org.
- (en) Christopher Mah, « How many starfish species are there ? Where do they Live ? How long have they been around ? Five Points about Sea Star Diversity », sur The Echinoblog, .
- (en) Christopher Mah, « Asteroidea », sur MarineSpecies.org.
- (en) Larissa Ault et al., « Acanthaster planci », sur Animal Diversity.
- « Ophiure », sur Dictionnaire de l'cadémie Française, 9e édition.
- (en) Sabine Stöhr, Timothy D. O'Hara et Ben Thuy, « Global Diversity of Brittle Stars (Echinodermata: Ophiuroidea) », {{Article}} : paramètre «
périodique» manquant, vol. PLOS One, (DOI 10.1371/journal.pone.0031940, lire en ligne). - (en) Alexander M. Kerr, « A Philology of Òλοθóυριου : From Ancient Times to Linnaeus, including Middle and Far Eastern Sources », University of Guam Marine Laboratory Technical Report, no 151, (lire en ligne).
- À la Réunion, cette espèce présente des séries de points bruns sur le bivium, contrairement aux spécimens du Pacifique.
- « Classifications des Mollusques », sur mglebrusc.free.fr.
- « Céphalopode », sur Larousse.
- J.M. Gaillard, « Gastéropodes », sur ftp.fao.org.
- « Classification des gastéropodes », sur Univ-LeHavre.fr.
- (en) R. Endean et Clare Rudkin, « Further studies of the venoms of Conidae », Toxicon, vol. 2, no 4, , p. 225–249 (DOI 10.1016/0041-0101(65)90021-8, lire en ligne).
- Maurice Jay, « Famille des conidae : genre Conus représenté à la Réunion », sur Vie Océane (consulté le ).
- Philibert Bidgrain, « Les limaces de mer », sur VieOcéane, .
- Philibert Bidgrain, « Site des Nudibranches du Sud Ouest de l'Océan Indien », sur SeaSlugs.Free.fr.
- François Cabane, « Aplysie ou lièvre de mer, ou limace de mer », sur le site de l'IFREMER.
- « Nautilus pompilius », sur U-Bordeaux.
- « Céphalopodes », sur ftp.fao.org.
- « Céphalopodes », sur Larousse.
- « Notice et résumé de "Les diatomées marines à l'origine de la croissance des bivalves dans une lagune méditerranéenne" », sur bibliomer.com.
- « Les mollusques », sur univ-montp2.fr.
- « Les arthropodes mandibulates », sur mon.univ-montp2.fr.
- Stéphane Gasparini, « Les copépodes », sur le site de l'Observatoire Océanologique de Villefranche.
- (en) « Coconut crab : the largest land arthropod on earth », sur le site du Kenya Wildlife Service (consulté le ).
- Joseph Poupin, Systématique et Écologie des Crustacés Décapodes et Stomatopodes de Polynésie Française., Université de Perpignan, Mémoire d'HDR, (lire en ligne).
- (en) Randi D. Rotjan, Jeffrey R. Chabot et Sara M. Lewis, « Social context of shell acquisition in Coenobita clypeatus hermit crabs », Behavioral Ecology, vol. 21, no 3, , p. 639-646 (lire en ligne).
- « La classification des crustacés », sur www.cosmovisions.com.
- (en) R.B. Mannings, « Stomatopods », sur ftp.fao.org.
- (en) Alex Rose, « The science behind stomatopods », sur www.coralscience.org.
- (en) S. N. Patek, W. L. Korff et R. L. Caldwell, « Biomechanics: Deadly strike mechanism of a mantis shrimp », Nature, vol. 428, , p. 819-820 (DOI 10.1038/428819a, lire en ligne).
- Maurice Mashaal, « Optique de haute technologie chez la crevette-mante », sur Pour la Science, .
- Préfecture de la Réunion, « Arrêté n°1742 du 15 Juillet 2008 réglementant l'exercice de la pêche maritime professionnelle dans les eaux du département de la Réunion », sur www.reservemarinereunion.fr.
- « Caridea », sur le petit Buffon électronique (site de l'université Jussieu).
- Guy Echallier, « CIRRIPEDES », sur le site de l'université Jussieu.
- « Cirripèdes », sur l'Encyclopaedia Universalis.
- « Les vers ».
- Herman Denis, Alain Collenot, « Taxinomie et embryologie : une connexion ancienne et fructueuse », sur ipubli-inserm.inist.fr.
- (en) « Polychaeta », sur Encyclopedia of Life.
- « Les annélides », sur http://mon.univ-montp2.fr.
- Antoine Morin, « Les Annélides », sur le site de l'Université d'Ottawa.
- « Polychètes », sur Ecosociosystemes.fr.
- (en) Bec Crew, « Eunice aphroditois is rainbow, terrifying », sur blogs.scientificamerican.com.
- (en) Ben Waggoner, B. R. Speer, « Introduction to the Platyhelminthes », sur ucmp.berkeley.edu.
- (en) « Marine flatworms », sur wildsingapore.com.
- Clément Lamy, « Les planaires », sur efor.fr.
- (en) Tal Shomrat et Michael Levin, « An Automated Training Paradigm Reveals Long-term Memory in Planaria and Its Persistence Through Head Regeneration », Journal of Experimental Biology, vol. 216, , p. 3799-3810 (DOI 0.1242/jeb.087809, lire en ligne).
- Philibert Bidgrain, « Site des Planaires du Sud Ouest de l'Océan Indien », sur SeaSlugs.free.fr.
- « Description des cnidaires », sur www.univ-lehavre.fr.
- « Aspects de la nutrition des coraux (scléractiniaires) », sur vieoceane.free.fr.
- Base de connaissance sur les coraux des Mascareignes, La Réunion, IREMIA.
- Pierre-André Bourque, « L'animal corail », sur www2.ggl.ulaval.ca.
- Paola Furla et Denis Allemand, « Relation de couple au soleil : l’endosymbiose Cnidaires-Dinoflagellés », Dossiers endosymbiose, sur www.sb-roscoff.fr, .
- « Corail », sur Larousse.fr.
- Jean-Pascal Quod et Loïc Charpy, « Le blanchissement corallien », sur www.com.univ-mrs.fr.
- Jean-Paul Poirier, « Les envenimations marines », sur http://www.camip.info.
- « Les anémones, des polypes solitaires », sur www.centrescientifique.mc.
- « Taxonomie et biologie des coraux », sur www.centrescientifique.mc.
- (en) Daphne G. Fautin, « Field guide to anemone fishes and their host sea anemones », sur www.nhm.ku.edu.
- (en) Dapnhe Gail Fautin, « The anemonefish symbiosis : What is known and what is not », Symbiosis, vol. 10, , p. 23-46 (lire en ligne).
- « Pagure », sur Larousse.
- « Spongiaires », sur www.ecosociosystemes.fr.
- « Découverte d’éponges originales dans une grotte sous-marine », sur www.cnrs.fr.
- « Biologie des Spongiaires », sur www.univ-lehavre.fr.
- « Foraminifères », sur CNTRL.
- « Les foraminifères : marqueurs du climat », sur IFREMER.fr.
- « Les foraminifères », sur http://geologie.mnhn.fr/.
- « Rhizopodes », sur ecosociosystemes.fr.
- (en) « What are foraminifera », sur bprc.osu.edu.
- (en) « Foraminifera », sur www.ucl.ac.uk.
- Alain Ménesguen, « L’eutrophisation des eaux marines et saumâtres en Europe, en particulier en France. », sur archimer.ifremer.fr, IFREMER.
- .
- Michel Lauret, Jocelyne Oheix, Valérie Derolez, Thierry Laugier, Guide de reconnaissance et de suivi des macrophytes des lagunes du Languedoc-Roussillon, IFREMER, coll. « Réseau de suivi lagunaire », , 148 p..
- (en) Robert J. Orth et al., « A Global Crisis for Seagrass Ecosystems », BioScience, vol. 56, no 12, (lire en ligne).
- Claude Payri, « Les algues en Polynésie Française », sur www.com.univ-mrs.fr.
- « IOPs dans l’eau marine », sur www.com.univ-mrs.fr.
- (en) Centers for Disease Control and Prevention, « Facts about cyanobacteria and cyanobacterial harmful algal blooms », sur www.ncf-net.org.
Voir aussi
Sources
Le symbole ![]() indique les sources privilégiées dans l'élaboration de cette page.
indique les sources privilégiées dans l'élaboration de cette page.
Ressources sur la faune marine de la Réunion
- GIP RNMR & Vie Océane, « La Réserve Naturelle Nationale Marine de la Réunion : un patrimoine naturel à préserver », sur http://www.ReserveMarineReunion.fr.

Sites de référence en identification d'espèces marines
- « FishBase », sur http://FishBase.MNHN.fr, site co-géré par le MNHN.

- « Données d'observations pour la reconnaissance et l'identification de la faune et de la flore subaquatiques », sur DORIS, site partenaire du MNHN géré par la CNEBS de la FFESSM.

- « Sous Les Mers », sur www.souslesmers.fr, administré par François Cornu.

- (en) « Marine Species Identification Portal », sur species-identification.org.
- « Nudibranches et planaires du sud-ouest de l’océan Indien », sur SeaSlugs.free.fr, administré par Philibert Bidgrain.

Bases de données taxinomiques
- (en) « World Register of Marine Species », sur World Register of Marine Species.

- (en) « Catalog of Fishes », sur http://research.calacademy.org.

- (en) « Système d'information taxonomique intégré », sur ITIS.
- (en) « Sea Life Base », sur Sealifebase.org.










































































































































































































































































































![Holothurie brune (Actinopyga echinites), forme réunionnaise[84].](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Actinopyga_echinites_de_la_R%C3%A9union_avec_points_bruns.jpg/231px-Actinopyga_echinites_de_la_R%C3%A9union_avec_points_bruns.jpg)