« Origine de la vie » : différence entre les versions
→Apparition de la vie sur Terre, le registre fossile : reformulation des fossiles contestés ; la contestation porte sur les organismes fossiles, pas sur les traces de vie géochimiques ; wikification ; (à suivre, resserrage de boulons restant à faire) |
→Apparition de la vie sur Terre, le registre fossile : wikification réf |
||
| Ligne 49 : | Ligne 49 : | ||
Le premier intervalle de temps de l’histoire de la Terre est l’[[éon]] de l’[[Hadéen]], il s’étend de la formation de la planète jusqu’au début de l’éon de l’[[Archéen]], c’est-à-dire il y a entre environ {{âge stratigraphique|hadéen|2=sans PSM|3=sans Ma}} et {{âge stratigraphique|archéen|2=sans PSM}} (millions d'années). |
Le premier intervalle de temps de l’histoire de la Terre est l’[[éon]] de l’[[Hadéen]], il s’étend de la formation de la planète jusqu’au début de l’éon de l’[[Archéen]], c’est-à-dire il y a entre environ {{âge stratigraphique|hadéen|2=sans PSM|3=sans Ma}} et {{âge stratigraphique|archéen|2=sans PSM}} (millions d'années). |
||
Les fossiles connus les plus anciens sont des [[micro-organisme]]s marins de type [[bactérie]]n. Il s’agit essentiellement de [[stromatolithe]]s constitués de [[cyanobacteria|cyanobactéries]], qui forment des empilements de lamines que l’on retrouve ensuite sous forme de reliefs ou de dômes fossilisés dans les sédiments. Les plus anciens qui ne soient pas controversés ont été découverts en [[Australie]] et datent d'environ {{nobr|3,5 Ga}}<ref>{{en}} Van Kranendonk, M. J., Philippot, P., Lepot, K., Bodorkos, S. & Pirajno, F. (2008),''Geological setting of Earth’s oldest fossils in the c. 3.5 Ga Dresser Formation, Pilbara craton, Western Australia''. Precambr. Res. 167, 93–124.</ref>{{,}}<ref name="Dodd2017"/>{{,}}<ref name="Bella2015"/>{{,}}<ref>Abderrazak El Albani et Alain Meunier, ''Aux origines de la vie'', Dunod, 2016.</ref>. On trouve aussi des fossiles bactériens bien conservés dans les [[chaille]]s de la formation {{Lien|langue=en|fr=Strelley Pool}} ([[Australie-Occidentale]]), qui datent de {{unité|3,4|Ga}}<ref>{{article| langue=en| titre=Chemical nature of the 3.4 Ga Strelley Pool microfossils| auteur1=J. Alleon| auteur2=S. Bernard| auteur3=C. Le Guillou| auteur4=O. Beyssac| auteur5=K. Sugitani| auteur6=F. Robert| périodique=Geochemical Perspectives Letters| volume=7| pages=37-42| doi=10.7185/geochemlet.1817| date=16 août 2018}}.</ref>. D'autres, âgés de {{unité|3,7 Ga}}, ont été décrits au [[Groenland]]<ref>{{en |
Les fossiles connus les plus anciens sont des [[micro-organisme]]s marins de type [[bactérie]]n. Il s’agit essentiellement de [[stromatolithe]]s constitués de [[cyanobacteria|cyanobactéries]], qui forment des empilements de lamines que l’on retrouve ensuite sous forme de reliefs ou de dômes fossilisés dans les sédiments. Les plus anciens qui ne soient pas controversés ont été découverts en [[Australie]] et datent d'environ {{nobr|3,5 Ga}}<ref>{{en}} Van Kranendonk, M. J., Philippot, P., Lepot, K., Bodorkos, S. & Pirajno, F. (2008),''Geological setting of Earth’s oldest fossils in the c. 3.5 Ga Dresser Formation, Pilbara craton, Western Australia''. Precambr. Res. 167, 93–124.</ref>{{,}}<ref name="Dodd2017"/>{{,}}<ref name="Bella2015"/>{{,}}<ref>Abderrazak El Albani et Alain Meunier, ''Aux origines de la vie'', Dunod, 2016.</ref>. On trouve aussi des fossiles bactériens bien conservés dans les [[chaille]]s de la formation {{Lien|langue=en|fr=Strelley Pool}} ([[Australie-Occidentale]]), qui datent de {{unité|3,4|Ga}}<ref>{{article| langue=en| titre=Chemical nature of the 3.4 Ga Strelley Pool microfossils| auteur1=J. Alleon| auteur2=S. Bernard| auteur3=C. Le Guillou| auteur4=O. Beyssac| auteur5=K. Sugitani| auteur6=F. Robert| périodique=Geochemical Perspectives Letters| volume=7| pages=37-42| doi=10.7185/geochemlet.1817| date=16 août 2018}}.</ref>. D'autres, âgés de {{unité|3,7 Ga}}, ont été décrits au [[Groenland]]<ref>{{article| langue=en| auteur1=Allen P. Nutman| auteur2=Vickie C. Bennett| auteur3=Clark R. L. Friend| auteur4=Martin J. Van Kranendonk| auteur5=Allan R. Chivas| titre=Rapid emergence of life shown by discovery of 3,700-million-year-old microbial structures| date=22 septembre 2016| périodique=[[Nature (revue)|Nature]]| volume=537| pages=pages 535-538| doi=10.1038/nature19355}}.</ref> mais leur interprétation a été contestés en 2018, au profit d'une explication abiotique<ref>{{article| langue=en| titre=Proposed early signs of life not set in stone| auteur=Mark A. van Zuilen| périodique=[[Nature (revue)|Nature]]| date= 17 octobre 2018| volume=563| pages=190-191| doi=10.1038/d41586-018-06994-x}}.</ref>{{,}}<ref>https://www.nature.com/articles/s41586-018-0610-4 Abigail C. Allwood, Minik T. Rosing, David T. Flannery, Joel A. Hurowitz & Christopher M. Heirwegh, ''Reassessing evidence of life in 3,700-million-year-old rocks of Greenland'', Nature, 2018</ref>. |
||
D’autres micro-organismes (des tubes et des filaments [[micromètre|micrométriques]] [[épigénie|épigénisés]] en [[hématite]]) semblent s’être développés très tôt et avoir été fossilisés par des dépôts minéraux à proximité de [[mont hydrothermal|sources hydrothermales sous-marines]]. En 2017, E. Bella et son équipe décrivent des fossiles de « micro-organismes putatifs » découverts dans des sédiments ferrugineux [[affleurement|affleurant]] dans la [[ceinture de roches vertes de Nuvvuagittuq]], au [[Québec]]<ref>Des microfossiles vieux de 3,77 milliards d’années découverts au Canada, [https://www.lemonde.fr/sciences/article/2017/03/01/des-microfossiles-vieux-de-3-77-milliards-d-annees-decouverts-au-canada_5087765_1650684.html].</ref>{{,}}<ref name="Dodd2017" />. Ils sont datés d'au moins {{nobr|3,77 Ga}}, peut-être même de {{nobr|4,28 Ga}}<ref name="Dodd2017" />. |
D’autres micro-organismes (des tubes et des filaments [[micromètre|micrométriques]] [[épigénie|épigénisés]] en [[hématite]]) semblent s’être développés très tôt et avoir été fossilisés par des dépôts minéraux à proximité de [[mont hydrothermal|sources hydrothermales sous-marines]]. En 2017, E. Bella et son équipe décrivent des fossiles de « micro-organismes putatifs » découverts dans des sédiments ferrugineux [[affleurement|affleurant]] dans la [[ceinture de roches vertes de Nuvvuagittuq]], au [[Québec]]<ref>Des microfossiles vieux de 3,77 milliards d’années découverts au Canada, [https://www.lemonde.fr/sciences/article/2017/03/01/des-microfossiles-vieux-de-3-77-milliards-d-annees-decouverts-au-canada_5087765_1650684.html].</ref>{{,}}<ref name="Dodd2017" />. Ils sont datés d'au moins {{nobr|3,77 Ga}}, peut-être même de {{nobr|4,28 Ga}}<ref name="Dodd2017" />. |
||
Version du 11 août 2019 à 17:09
Les origines de la vie sur Terre demeurent incertaines. On ne sait pas dire avec certitude quand la vie est apparue sur Terre ni où et comment. Les plus anciens micro-organismes fossiles sont datés d'au moins 3,5 Ga (milliards d'années). Une étude publiée en 2015 sur des inclusions de carbone considérées comme d'origine organique leur assigne un âge de 4,1 milliards d'années[1] et plus récemment des précipités hydrofuges sous-marins trouvés dans des roches sédimentaires ferrugineuses de la Ceinture de roches vertes de Nuvvuagittuq (Québec) ont été interprétés comme de possibles traces de vie (organismes filamenteux) il y a au moins 3,77 milliards d'années et peut-être 4,28 milliards d'années[2].
Il y a donc des indices de plus en plus nombreux d'une vie bactérienne dès l'Hadéen.


Étapes vers l'apparition de la vie
Il n'existe pas de modèle normalisé pour décrire l'origine de la vie. En réalité, il y a, dans les années 2010, deux approches principales sur l'origine de la vie[3] :
- l’une (fondée sur la théorie de l'information et les problématiques de codage de l'information) met l'accent sur le rôle-clé des acides nucléiques dans le processus de la sélection naturelle qui a modelé au fil des générations les organismes vivants à partir de systèmes en quelque sorte prébiotiques ;
- l’autre qui privilégie le rôle du métabolisme, considère les organismes vivants comme des systèmes éloignés de leur état d’équilibre thermodynamique et qui parviennent à se maintenir grâce à des processus qui deviennent ainsi métaboliques : les systèmes parvenant à entretenir de tels processus auto-organisés perdureront mieux que les autres. Voir les articles Homéostasie et Auto-organisation.
Les modèles « gènes d'abord »

Dans ce modèle, l'apparition du génome a précédé l'apparition du métabolisme. Des molécules d'ADN ou d'ARN auraient ainsi existé seules, s'autorépliquant à partir des molécules présentes dans leur environnement. Les « individus » sont donc représentés par les molécules d'acides nucléiques elles-mêmes.
L’école de pensée privilégiant les acides nucléiques se subdivise en deux classes d’hypothèses[4] :
- la première est que les premières formes de vie sur Terre ont utilisé l’ARN comme seul constituant génétique capable d’encoder l’information nécessaire aux catalyses biologiques ;
- la deuxième est encore plus restrictive puisqu’elle considère l’ARN comme la première forme de vie sur Terre, c’est-à-dire comme le premier système chimique à l’origine de l’évolution biologique, l'hypothèse du monde à ARN.
Les modèles « métabolisme d'abord »
Plusieurs modèles rejettent l'idée de l'autoréplication d'un gène « nu » et font l'hypothèse de l'apparition d'un métabolisme primitif qui aurait précédé l'émergence de la réplication de l'ARN. Une des premières versions de cette hypothèse fut présentée en 1924 par Alexandre Oparine avec son idée de vésicules primitives capables de se répliquer (coacervats), à une époque où on ne connaissait pas encore la structure de l'ADN.
L’école de pensée privilégiant le rôle du métabolisme[5],[6], comme le concept d’autopoïèse[7], s’inspire du concept du système dissipatif qui se maintient loin de l'équilibre thermodynamique, grâce au flux de matière et d'énergie qui le traverse[8].
Le problème de cette approche est de ne pouvoir rendre compte de l'évolution de ces systèmes métaboliques[9], car ils se répliquent sans transmettre d’information, c’est-à-dire qu’ils n'ont pas d'hérédité[10].
D'autres variantes sont apparues dans les années 1980 et 1990 comme la théorie de Günter Wächtershäuser (en) sur un monde sulfuro-ferreux, ou les modèles de Christian de Duve fondés sur la chimie des thioesters. Les thiols, et donc la cystéine, ont pu jouer un rôle majeur[11].
D'autres arguments plus abstraits ont aussi été présentés, comme les modèles mathématiques de Freeman Dyson au début des années 1980 sur la probabilité de l'émergence d'un métabolisme sans présence de gènes, ou encore les travaux de Stuart Kauffman sur les ensembles globalement autocatalytiques (voir génération spontanée pour une présentation des idées de Kauffman sur l'origine de la vie).
Principales étapes
Le modèle le plus couramment accepté[réf. nécessaire] est fondé sur l'enchaînement supposé des événements suivants :
- Formation de la « soupe primitive ». Des conditions prébiotiques plausibles entraînent la création de molécules organiques simples, qui sont les briques de base du vivant. Les réactions de synthèses organiques conduisant à la formation de catalyseurs favorables à ces mêmes synthèses bénéficient d'un avantage sélectif. Suivant les auteurs, des mécanismes différents expliquent la formation des monomères initiaux, et leur polymérisation ultérieure.
- Cloisonnement et compartimentation des milieux réactifs. Des phospholipides forment spontanément des doubles couches qui sont la structure de base des membranes cellulaires. L'organisation spatiale permet des différences de compositions entre milieux, et la mise en place d'échanges trans-membranaires. Apparition de cycles réactifs à la base d'un métabolisme élémentaire, capable d'alimenter un processus de production et reproduction du milieu chimique en puisant sur des ressources extérieures ; les collections de cycles capables de produire leur propres catalyseurs présentent un avantage sélectif, d'autant que les réactifs sont concentrés au sein des compartiments comprenant ces catalyseurs ; de même, y sont concentrés les produits de ces réactions, produits qui peuvent constituer les réactifs d'une phase suivante du métabolisme
- Réplication de molécules remplissant un rôle bien précis (molécules fonctionnelles). Les mécanismes qui produisent aléatoirement des molécules d'acide ribonucléique (ARN), en mesure d'agir comme des ARN-enzymes sont capables, dans certaines conditions très particulières, de se dupliquer. C'est une première forme de génome, on est alors en présence de protocellules. Le métabolisme d'ensemble permet aux compartiments élémentaires de maintenir une composition chimique et un métabolisme stable, de dupliquer les molécules qui régulent ce milieu, autorisant la séparation d'une cellule initiale en deux cellules fonctionnellement équivalentes.
- Spécialisation de la fonction enzymatique et de la réplication.
- Les ARN-enzymes sont progressivement remplacées par des protéines-enzymes, grâce à l'apparition des ribozymes, ceux-ci étant capables de réaliser la biosynthèse des protéines. Cette synthèse est permise grâce à la transcription de séquences codantes de certaines molécules d'ARN.
- L'ADN apparaît et remplace l'ARN dans le rôle de support du génome, dans le même temps les ribozymes sont complétés par des protéines, formant les ribosomes. C'est l'apparition de l'organisation actuelle des organismes vivants.
Cette logique d'apparition correspond au modèle « métabolisme d'abord ». Les étapes 2 et 3 sont parfois inversées, l'isolement en compartiment et l'émergence du métabolisme étant alors présenté après l'apparition des ARN autoréplicants (hypothèse « gènes d'abord »).
Apparition de la vie sur Terre, le registre fossile
Le premier intervalle de temps de l’histoire de la Terre est l’éon de l’Hadéen, il s’étend de la formation de la planète jusqu’au début de l’éon de l’Archéen, c’est-à-dire il y a entre environ 4 567 et 4 031 ± 3,0 Ma (millions d'années).
Les fossiles connus les plus anciens sont des micro-organismes marins de type bactérien. Il s’agit essentiellement de stromatolithes constitués de cyanobactéries, qui forment des empilements de lamines que l’on retrouve ensuite sous forme de reliefs ou de dômes fossilisés dans les sédiments. Les plus anciens qui ne soient pas controversés ont été découverts en Australie et datent d'environ 3,5 Ga[12],[2],[1],[13]. On trouve aussi des fossiles bactériens bien conservés dans les chailles de la formation Strelley Pool (en) (Australie-Occidentale), qui datent de 3,4 Ga[14]. D'autres, âgés de 3,7 Ga, ont été décrits au Groenland[15] mais leur interprétation a été contestés en 2018, au profit d'une explication abiotique[16],[17].
D’autres micro-organismes (des tubes et des filaments micrométriques épigénisés en hématite) semblent s’être développés très tôt et avoir été fossilisés par des dépôts minéraux à proximité de sources hydrothermales sous-marines. En 2017, E. Bella et son équipe décrivent des fossiles de « micro-organismes putatifs » découverts dans des sédiments ferrugineux affleurant dans la ceinture de roches vertes de Nuvvuagittuq, au Québec[18],[2]. Ils sont datés d'au moins 3,77 Ga, peut-être même de 4,28 Ga[2].
Parallèlement à la recherche de microfossiles dans les sédiments les plus anciens de la Terre, l’analyse isotopique, en 2015, d’inclusions de carbone, sous forme de graphite, dans des zircons détritiques de la région de Jack Hills en Australie-Occidentale, a fourni un âge de 4,1 Ga[1].
Le même travail, fait à l'ouest du Groënland (dans les roches métasédimentaires d'Isua, qui datent d’il y a plus de 3,7 milliards d'années), a mis en évidence des composés carbonés pauvres en 13C présentant des rapports isotopiques compatibles avec une origine biogène[19],[20],[21]. Ces composés sont notamment trouvés en inclusion dans des cristaux de grenat métamorphique, dans un environnement de litage sédimentaire riche en carbone entièrement graphitisé. Jusqu'à mi-2017, les études n’avaient pas mis en évidence d'autres éléments permettant la vie, tels que de l'hydrogène, de l'oxygène, de l'azote et du phosphore, structurellement associés à cette matière carbonée[22],[23], puis une étude des inclusions trouvées dans les porphyroblastes de grenat a conclu que les spectres d'absorption de l’infrarouge de ces matériaux sont compatibles avec la présence de carbone lié à l'azote et à l'oxygène, et probablement aussi au phosphate, avec des niveaux de liaisons C-H ou O-H faibles[24]. Ceci plaide en faveur d’une matière organique biogénique restée isolée durant des milliards d'années, et métamorphisée à environ 500 °C, ce qui en ferait les plus anciennes traces de carbone biogénique actuellement (2017) connues sur la planète, hypothèse avancée par Ohtomo et al. en 2014[25], puis par Nutman en 2016[26].
Chimie prébiotique
Problématique
La chimie prébiotique est une branche de la biochimie qui se propose d'étudier les conditions primitives de la vie sur Terre, et surtout la manière dont elle est apparue à partir de quelques molécules inertes.
La vie repose sur la chimie du carbone en présence d'eau, et met principalement en jeu cinq familles de composés chimiques :
- les lipides sont des molécules grasses comprenant de longues chaînes d'hydrocarbones. Elles jouent notamment un rôle important dans la structure des membranes cellulaires, conditionnant de manière active ou passive le passage d'autres molécules vers l'intérieur ou l'extérieur des cellules ;
- les hydrates de carbone sont des sucres. Différents « oses » monomères peuvent s'assembler en polymères appelés polysaccharides, comme la cellulose qui rigidifie les parois de la plupart des cellules végétales ;
- les bases azotées sont des molécules organiques dans lesquelles un groupe azoté amine joue un rôle important. La chlorophylle est par exemple construite sur un noyau de porphyrine constitué de quatre sous-unités amine, et joue un rôle essentiel pour capturer l'énergie solaire nécessaire à la vie végétale ;
- les monomères des acides nucléiques sont formés par un monosaccharide, une base azotée, et un ou plusieurs groupe phosphate ; les polymères correspondants matérialisent les gènes sous forme d'ADN ou d'ARN, et permettent la transcription de protéines ;
- une protéine est un polymère, généralement formé par l'assemblage de monomères pris parmi une vingtaine d'acides aminés, composés organiques comportant à la fois un groupe carboxyle (CO2H) et un groupe amine (NH2), et une chaîne hydrocarbone. Les protéines permettent la catalyse de nombreux processus chimiques indispensables à la vie.
Toute théorie de l'abiogénèse doit pouvoir expliquer l'origine et les interactions de ces cinq classes de molécules[27].
Conditions chimiques initiales

L’atmosphère de l’Archéen ne contient apparemment pas ou très peu d’oxygène libre. Selon Alexandre Oparine et John Haldane, l'atmosphère terrestre primitive, lors de sa formation, était composée de méthane (CH4), d'ammoniac (NH3), de vapeur d'eau (H2O), de gaz carbonique (CO2) et d'hydrogène sulfuré (H2S). Par l'action du rayonnement ultraviolet provoquant la photodissociation de ces molécules, l'atmosphère a évolué progressivement, perdant son méthane pour évoluer vers une atmosphère de gaz carbonique et d'azote. Lors de l'apparition de la vie, l'atmosphère est moyennement réductrice : (CO2 ; N2). Des modèles plus anciens considéraient une atmosphère fortement réductrice comme probable : (CH4 ; NH3).
Sa température est supérieure à celle d’aujourd’hui, bien que le Soleil soit de 25 à 30 % moins lumineux que de nos jours, la différence est compensée par la présence de gaz à effet de serre, ou, alternativement, par l'absence de nuages réfléchissants et un albédo de surface plus bas. La pression est de quelques atmosphères.
La température dans la majorité des modèles est de 40 °C à 85 °C, bien qu’une atmosphère plus tempérée soit possible[28]. L’eau sous forme liquide est présente, les océans ont probablement fini de se former durant l’Hadéen.
L'expérience Urey-Miller et l'origine des molécules organiques
Le biochimiste Robert Shapiro a résumé les théories d'Oparine et Haldane sur la « soupe primordiale » de la manière suivante[29] :
- La Terre avait primitivement une atmosphère réductrice ;
- Cette atmosphère a produit des composés organiques simples (monomères) sous l'action de diverses sources d'énergie ;
- Ces composés se sont accumulés au fil du temps dans une sorte de soupe chimique, qui a pu se trouver concentrée en divers endroits (côte et lagune, mont hydrothermal, etc.) ;
- Par la suite, des polymères et composés plus complexes se sont développés dans le mélange, conduisant finalement à la Vie.
Les trois premières étapes ont fait l'objet de reconstitutions et d'études en laboratoire ; mais la quatrième « étape » de cette théorie a été qualifiée de très simpliste - rappelant le coup de baguette magique des contes de fées.
En 1953, le chimiste américain Stanley Miller réalisa une série d'expériences dans le cadre de sa thèse de doctorat.
Les expériences de Miller-Urey furent décisives dans la compréhension de la chimie prébiotique. En effet, à partir d'eau (H2O), de méthane (CH4), d'ammoniac (NH3) et d'hydrogène (H2), on a recueilli des acides aminés (dont 13 des 22 qui sont utilisés pour fabriquer des protéines dans les cellules des organismes), des sucres, des lipides, et quelques composants des acides nucléiques mais pas d'acides nucléiques entiers (ADN ou ARN). Des racémiques des énantiomères gauche lévogyre et droite dextrogyre se sont formés.
Les travaux révolutionnaires de Miller ont donné lieu à de très nombreuses publications, la composition de l'atmosphère terrestre primitive faisant débat.
En 2009, Sutherland et son équipe[30] sont parvenus à établir une voie de synthèse des nucléotides à base pyrimidique, l'acide uridylique et l'acide cytidylique. Les chercheurs butaient sur cette voie de synthèse prébiotique depuis 40 ans en raison de la difficulté à trouver la bonne façon de lier le ribose à la base azotée. La clé de cette voie est de passer par un précurseur commun au ribose et la base azotée. Ce précurseur, le 2-aminooxazol, est obtenu à partir de molécules organiques élémentaires : le glycéraldéhyde, le cyanamide, le cyanoacétaldéhyde, le cyanoacétylène et le phosphate inorganique. Le mélange réactionnel alimenté par de l'azote gazeux est soumis à un cycle de chauffage-refroidissement afin de simuler le cycle d'évaporation d'une mare par le rayonnement solaire et l'alimentation par la pluie. Après une semaine le 2-aminooxazol s'accumule dans le réacteur. Le précurseur se transforme ensuite en ribose et cytosine liés ensemble. Le phosphate est ensuite ajouté au milieu réactionnel en présence d'UV durant trois jours (l'absence d'ozone dans les conditions prébiotiques engendrait un bombardement intense d'UV). L'acide cytidylique se synthétise sous l'effet du rayonnement UV et quelques nucléotides portant une cytosine se transforment en acide uridylique. Pour les deux autres nucléotides, l'équipe de Sutherland travaillait sur un précurseur commun aux acides nucléiques à base purique.
La formation de molécules organiques se rencontre également dans l'Atmosphère de Titan.
Kauffman et les réseaux autocatalytiques

Que des formes complexes ne puissent pas avoir une origine aléatoire était un principe très généralement accepté. En 2002, Stuart Kauffman est le premier à l’avoir mis en doute à la suite d’expériences numériques, point de vue qu'il défendit dans l'introduction de son ouvrage Self Organization in Biological Systems. Il étudiait la dynamique de réseaux d’automates cellulaires engendrés d’une façon aléatoire. Il a alors observé que des formes stables animées d’un mouvement périodique apparaissaient spontanément, quelles que soient les conditions initiales. Il voyait ainsi des formes complexes et durables engendrées d’une façon purement aléatoire. Il a vite compris que son observation renouvelle d’une façon très originale nos façons d’expliquer les phénomènes et qu’il pouvait l’appliquer à la question de l’origine de la vie. Il a mis quelques années avant de le faire accepter par d’autres scientifiques.
Lorsque de nombreuses molécules différentes sont mises en présence, on peut décrire la dynamique chimique par un réseau. Chaque espèce de molécule est reliée aux autres espèces avec lesquelles elle réagit. Un tel réseau peut avoir des boucles autocatalytiques, c’est-à-dire qu’une espèce moléculaire, appelons-la A, favorise, ou catalyse, des réactions chimiques qui vont conduire à la production de molécules du type A. Une telle boucle est potentiellement explosive, parce qu’il y a un effet boule de neige, mais si les espèces à partir desquelles A est produite sont en quantité limitée, l’autoproduction de A est elle-même limitée.
Les êtres vivants sont toujours des réseaux autocatalytiques. Toutes leurs molécules (ADN, protéines et autres) réagissent avec les molécules ingérées (les aliments) pour produire des molécules semblables à elles-mêmes. Les plantes sont même capables d’utiliser la lumière du soleil dans ce but.
En étudiant des modèles, Kauffman a établi que sous des conditions assez générales un réseau de réactions chimiques contient nécessairement des réseaux autocatalytiques. Il suffit que le réseau soit suffisamment touffu, que les espèces moléculaires soient suffisamment nombreuses et réactives les unes vis-à-vis des autres.
Les réseaux autocatalytiques expliquent la reproduction des molécules mais à eux seuls ils ne suffisent pas pour expliquer la reproduction des unicellulaires.
Pression de sélection sur les molécules complexes
La « soupe primordiale » est initialement formée par des molécules relativement simples, mais sa composition se complexifie progressivement suite aux réactions chimiques portant sur les molécules de première génération. D'une part, l'action de la source d'énergie (rayonnement ultraviolet ou autre) sur ces premières molécules formées crée des radicaux libres plus complexes, capables d'interagir avec les molécules de premières générations pour conduire par générations successives à des molécules de plus en plus lourdes. D'autre part, les molécules ainsi formées peuvent directement réagir entre elles, conduisant à de nouvelles synthèses.
Dans un premier temps, l'évolution de la composition ne dépend que de la constante d'équilibre et de la concentration molaire des paires de molécules susceptibles d'interagir. Cependant, dans un deuxième temps, certaines des molécules formées peuvent intervenir comme catalyseur sur telle ou telle réaction. À partir du moment où l'effet d'un catalyseur porte sur des réactions chimiques qui conduisent (directement ou non) à sa propre formation, une réaction en chaîne est susceptible de se mettre en place. Cette rétroaction chimique déplace l'équilibre global de la composition, augmentant progressivement la concentration du catalyseur, et tendant à assécher les réactifs consommés, qui ne peuvent alors plus alimenter d'autres types de synthèses.
Ainsi, avant même qu'un code génétique puisse se mettre en place, une pression de sélection a pu s'exercer sur la formation des molécules plus complexes, ou sur la formation de groupe fonctionnel au sein de ces molécules. Les réactions de synthèses organiques conduisant à la formation de catalyseurs favorables à ces mêmes synthèses bénéficient d'un avantage sélectif[31].
À un premier niveau, cette pression de sélection chimique ne fait initialement que favoriser la formation de molécules et de groupes fonctionnels résultant de voies de synthèse relativement simples.
Cependant, des chaînes polymérisées formées de monomères de même famille ont pu être synthétisées dans ce milieu. Dans des conditions chimiques favorables, certaines de ces chaînes polymérisées peuvent servir de modèles pour leur propre réplication[31], devenant ainsi leur propre catalyseur. Si l'on suppose que le milieu chimique est favorable et contient les constituants nécessaires, non seulement à la synthèse de ces polymères, mais également à leur réplication, les réactions chimiques de premier niveau, présentes dans la « soupe primordiale » initiale, conduisent alors, à un second niveau, à alimenter non seulement la formation, mais également la réplication de chaînes polymérisées.
Ces chaînes évoluent par mutation, peuvent se complexifier, et certaines des chaînes formées peuvent à leur tour intervenir comme catalyseur sur telle ou telle réaction de premier niveau. Ceci conduit à un second niveau de rétroaction, où des collections de chaînes polymérisées servent de catalyseurs aux différentes réactions nécessaires pour la synthèse et l'assemblage de leurs constituants. Cette « pré-vie » est capable de sélection et de mutation[31], mais n'est pas encore capable à ce niveau de stabiliser ni un métabolisme défini, ni une réplication fidèle.
Sélection naturelle moléculaire
Pour Richard Dawkins[32], un système chimique « réplicateur » (ce qu'est, fondamentalement, un réseau autocatalytique) présente la propriété importante de ne pas être parfait : les répliques produites ne sont pas toujours strictement identiques au modèle original, et ces différences peuvent influer la capacité à se répliquer. Par ailleurs, les espèces chimiques de ce système peuvent avoir des durées de vie limitées et/ou subir des transformations chimiques (des « mutations »), que ce soit par l'agressivité chimique du milieu où elles évoluent, par l'agitation thermique, ou par des rayonnements ionisants. Enfin, ces réplicateurs se « nourrissent » d'espèces chimiques de base, qui forment une ressource limitée dont le renouvellement ne peut qu'être lent en comparaison avec la croissance exponentielle d'une boucle autocatalytique.
La « soupe prébiotique » va donc progressivement se peupler de différentes variantes de réplicateurs, en compétition pour accéder aux ressources de base et réaliser le plus de duplications possibles dans une durée de vie limitée. Dans cet environnement, une variante devient d'autant plus majoritaire qu'elle présente des caractéristiques assurant un avantage comparatif par rapport aux autres variantes[32] :
- Toutes choses égales par ailleurs, une espèce de molécule pourra contribuer à un nombre de répliques d'autant plus élevé que la durée de vie de cette molécule dans le milieu considéré est importante. Il y a donc une pression de sélection vers une longévité croissante de l'assemblage chimique formant le réplicateur.
- Toutes choses égales par ailleurs, un cycle chimique produira un nombre de répliques d'autant plus élevé qu'il peut les produire rapidement. Il y a donc une pression de sélection vers une « fécondité » croissante du réplicateur.
- Toutes choses égales par ailleurs, une variante deviendra d'autant plus majoritaire qu'elle assure une reproduction fidèle de son type. Il y a donc une pression de sélection vers une précision croissante de la duplication.
Que ce soit la longévité, la fécondité, ou la fidélité de la reproduction, dans tous les cas la pression de sélection favorise structurellement la meilleure performance dans l'une de ces trois formes de stabilité. À partir du moment où des boucles chimiques autocatalytiques se mettent en place, la « soupe prébiotique » est donc le lieu d'une sorte de sélection de survie conduisant à favoriser à terme toute nouvelle variante qui présente une meilleure stabilité, ou qui réduit la stabilité des variantes de réplicateurs avec lesquelles elle est en compétition[32].
Les premiers polymères
Catalyse et métabolisme
Une cellule peut être comparée à un récipient contenant un mélange de quelques milliers de composés chimiques[33]. Potentiellement, chaque composé A peut réagir avec n'importe quel autre B, conduisant potentiellement à des millions de réactions possibles A+B→C. Dans cette « soupe chimique », un composé A donné peut réagir avec différents composés B1, B2, etc. conduisant aux composés C1, C2, etc. Cependant ces réactions peuvent être plus ou moins rapides, suivant des ordres de grandeurs très différents. En pratique, ce qui consommera effectivement le composé A sera celle de ces réactions qui est la plus rapide, et pour laquelle le composant Bi est suffisamment présent.
Un catalyseur se présente comme une espèce chimique intermédiaire K, qui peut fixer faiblement deux molécules particulières A et B (successivement, par exemple A+K→KA puis KA+B→KAB, ou dans l'ordre inverse). Une fois les deux composés A et B fixés, leur maintien dans leur position relative par le support K est tel que la vitesse de transition A+B→C peut être multipliée par un facteur allant jusqu'au million ou au milliard[33]. La réaction étant faite, son produit C se sépare du complexe KC→K+C, et le catalyseur K, qui n'a pas été altéré par ce cycle, peut capturer deux nouvelles molécules A et B et démarrer un nouveau cycle.
L'effet du catalyseur est tel, que les seules réactions observées en pratique sont celles pour lesquelles un catalyseur est présent, dès lors que cette possibilité existe. La présence dans la « soupe chimique » d'un catalyseur K catalysant la réaction A+B→C élimine pratiquement les alternatives, comme dans un procédé chimique industriel un réacteur K recevant deux tuyaux de A et de B pour produire le composé C. L'ensemble des catalyseurs présents dans cette « soupe chimique » va donc structurer les réactions qui s'y déroulent, suivant ce qui constitue un métabolisme déterminé.
Polymérisation : condensation sur surfaces minérales

Le scénario de la « soupe primitive » comportant des micelles ayant des limites, les scientifiques commencèrent à repenser l'évolution de la vie prébiotique sans membrane, et imaginèrent des molécules organiques capables de croître sur une surface minérale. Les chimistes Graham Cairns-Smith et Günter Wächtershäuser (en), montrèrent que les argiles et les cristaux de pyrite permettent l'agglutination des molécules organiques facilement. Une surface est plus stable qu'un espace tridimensionnel comme l'eau, mais aussi plus réduit (deux dimensions). Dans un espace tridimensionnel, les molécules sont sujettes à des contraintes selon tous les axes. Ainsi, à la surface des cristaux le milieu devient très réactif et facilite l'agglomération des molécules organiques.
L'assemblage de petites molécules (comme les acides aminés) en macromolécules (comme les protéines) nécessite l'élimination de molécules d'eau. Or, la thermodynamique indique qu'il est défavorable de réaliser une telle condensation dans l'eau elle-même. Il est possible pour résoudre cette contradiction de faire appel à des surfaces minérales, comme les micas, les argiles ou les pyrites. L'adsorption des petites molécules sur ces surfaces les concentre et les modifie chimiquement, ce qui peut rendre la formation de macromolécules plus favorable.
L'argile, par exemple, se trouve très abondamment sur Terre et est constituée d'un empilement de couches fines. Entre les différentes couches de l'argile peuvent se glisser certaines petites molécules organiques, ce qui permet une adsorption importante. L'argile est aussi un catalyseur très efficace pour de nombreuses réactions organiques, et aurait donc pu permettre la polymérisation des acides aminés et/ou des acides nucléiques. Le chimiste anglais Graham Cairns-Smith a développé cette hypothèse dans Seven clues to the origin of life en 1985 (L'énigme de la vie, 1990).
Asymétrie des biomolécules

La chimie prébiotique conduit a priori à un racémique de molécules. Or, on sait depuis le milieu du XIXe siècle (notamment avec des travaux de Pasteur en 1847) que les acides aminés et les glucides simples naturels n'existent pratiquement que sous une de leurs deux formes énantiomères : la forme L pour les premiers et la forme D pour les seconds. On parle d'homochiralité du vivant. Si l'on suppose que cette asymétrie dans les composés monomères remonte à la formation de la « soupe originelle », se pose alors la question de l'origine de cette énantiospécificité originelle.
Cette asymétrie des molécules biologiques a été utilisée comme argument en faveur d'un dessein intelligent de l'origine de la vie.
Si l'on admet en revanche que l'énantiospécificité n'intervient qu'avec la formation de polymères, elle peut recevoir une explication plus simple. Les polypeptides sont plus stables quand ils sont formés par des acides aminés de même forme, qu'ils soient tous L ou tous D. Une chaîne composée d'un mélange des deux sortes d'isomères ne serait pas stable, parce que quand un acide aminé L est associé à un D, les deux chaînes latérales dépassent du même côté, conduisant à une tension structurelle qui affaiblit la liaison chimique[34].
Du moment que l'avantage sélectif appartient aux cycles qui produisent leurs propres catalyseurs, il suffit que le premier polypeptide impliqué dans un cycle favorable ait été composé de L pour que sa synthèse elle-même ait par la suite favorisé ce type de composé.
Métabolisme et génome : un monde à ARN

S'il est logique de penser que des polymères non homogènes aient pu faire l'objet d'une pression de sélection, la nature exacte de ces polymères est une question ouverte quand on étudie la biochimie actuelle. En effet, celle-ci sépare actuellement la fonction de catalyseur tenue par les polypeptides (polymères d'acide aminé), et celle de support et de réplication de l'information, tenue par l'ADN. Ces deux aspects sont inter-dépendants, mais actuellement mutuellement exclusifs. On pensait que seules les protéines-enzymes étaient capables d'une activité catalytique, mais ces protéines sont trop complexes et variées pour être dupliquées ; alors que la logique d'une approche de type abiogenèse suppose l'existence d'un polymère à la fois auto-répliquant et ayant des fonctions de catalyseur.
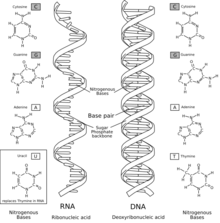
L'hypothèse du monde à acide ribonucléique (ARN) est que l'ARN était la principale — et sans doute la seule — forme de vie avant l'émergence de la première cellule à ADN. C'est Walter Gilbert qui a utilisé pour la première fois le terme « monde à ARN » (en anglais : RNA world) en 1986.
L'ARN est un polymère linéaire constitué d'un enchaînement de nucléotides. On trouve quatre bases nucléiques dans l'ARN : l'adénine, la guanine, la cytosine et l'uracile. L'ARN a de nombreuses similitudes avec l'ADN, avec cependant quelques différences importantes : d'un point de vue structurel, l'ARN est chimiquement moins stable ; sur le plan fonctionnel, l'ARN se trouve le plus souvent dans les cellules sous forme monocaténaire, c'est-à-dire de simple brin ; enfin, les molécules d'ARN présentes dans les cellules sont plus courtes, leur taille variant de quelques dizaines à quelques milliers de nucléotides.
La plupart des ARN naturels sont présents sous forme monocaténaire (simple brin) dans la cellule[35]. Les brins d'ARN se replient le plus souvent sur eux-mêmes, formant une structure intramoléculaire qui peut être très stable et très compacte. La description des appariements internes entre les bases d'un ARN s'appelle la structure secondaire. La base de cette structure est la formation d'appariements internes, entre bases complémentaires : A avec U, G avec C (et, parfois, G avec U).
Le prix Nobel de chimie Thomas Cech indiqua que l'ARN pouvait être la première molécule répliquante du fait de ses propriétés catalytiques et auto-catalytiques :
- la structure des ARN est à la base de la richesse de leurs fonctions, et en particulier de leur capacité à catalyser des réactions chimiques (ribozymes) ;
- inversement, les règles d'appariement relativement rigides entre les bases de l'ARN permettent de transcrire un brin en son négatif, et par une nouvelle transcription permettent de dupliquer l'original.
Évolution d'une population d'ARN
Le nom de Manfred Eigen est lié à la théorie des hypercycles (en), la liaison cyclique de cycles de réactions comme explication de l'auto-organisation des systèmes prébiotiques, qu'il a décrit dans les années 1970. Eigen souligna le problème que représente l'accumulation explosive d'erreurs (en) si la recopie n'est pas fidèle : pour qu'une molécule de longueur L puisse s'imposer par rapport à ses allèles, il faut que le taux d'erreur par nucléotide soit inversement proportionnel à la longueur L[33]. Cette contrainte conduit au paradoxe d'Eigen (en) : sans système de correction d'erreur, la longueur maximale d'une molécule répliquante ne peut guère dépasser une centaine de bases ; mais pour qu'une molécule répliquante code une enzyme correctrice sa longueur doit être significativement plus grande qu'une centaine de bases : comment une molécule répliquante capable d'engendrer un métabolisme complexe comprenant de nombreuses enzymes catalysantes a-t-il pu émerger ?
La solution proposée par Eigen est que le métabolisme initial a pu être un hypercycle ; chaque catalyseur élémentaire étant à la fois capable d'être répliqué dans l'environnement formé par les autres, et étant de longueur suffisamment faible pour rester sous le seuil catastrophique. L'ensemble peut alors déterminer un métabolisme complexe, sans que l'information nécessaire à sa définition soit concentrée sur un polymère unique[33]. Par ailleurs, ce système est stable si la reproduction d'un catalyseur n'est pas autonome, mais dépend de la production des autres[33]. C'est par exemple sa capacité optimale à se dupliquer rapidement dans un environnement peuplé d'enzimes ARN polymérase ARN-dépendante et de bases d'ADN, y compris sans amorce d'ARN initiale[36], qui caractérise le monstre de Spiegelman (en) : cette chaîne de 218 nucléotides d'ARN est un parasite prospérant dans un milieu contenant l'ARN polymérase et les bases d'ARN.
En 1990, Larry Gold et Jack Szostak ont mis au point une méthode visant à diriger l'évolution d'ARN, afin de sélectionner ceux montrant une activité catalytique. Ils ont depuis réussi à obtenir des ribozymes capables de lier des nucléotides entre eux, de lier des acides aminés à des ARN, d'effectuer des réactions d'oxydo-réductions, de se lier à des composants de la membrane, etc.
Il est donc en théorie possible, sur ce modèle, que l'ARN seul suffise à établir un métabolisme primitif. Toutefois, il reste encore à découvrir un ARN capable de se répliquer lui-même.
L'hypothèse d'un monde à ARN a aujourd'hui la faveur des scientifiques et est fondée sur plusieurs éléments. Notamment sur le fait que l'ARN est en théorie capable aussi bien d'assurer des tâches métaboliques que d'être le support d'une information génétique.
L'image se dégageant de ces études est celle d'une population de brins d'ARN en interdépendance mutuelle, se reproduisant au sein d'une sorte d'écosystème chimique, et où chaque brin est en compétition sélective par rapport à ses propres allèles.
Des molécules organiques aux protocellules
Formation spontanée des vésicules
Il suffit d’agiter une eau savonneuse pour obtenir de la mousse. L’écume de la mer se forme de la même façon, d’autant plus facilement que l’eau est plus sale. On l’explique à partir du caractère amphiphile de certaines molécules. Des molécules sont hydrophiles si elles « préfèrent » être dans l’eau que dans l’huile, c’est-à-dire si spontanément, du fait des lois de la physique statistique, elles se concentrent davantage dans l’eau que dans l’huile. Elles sont hydrophobes, ou lipophiles, dans le cas inverse. Certaines molécules, telles que celles du savon, sont allongées avec une extrémité hydrophile et l’autre hydrophobe, c’est pourquoi elles sont dites amphiphiles. Lorsqu’elles sont mises en solution dans l’eau, elles forment alors spontanément de nombreuses structures qui peuvent être très complexes et notamment des bicouches qui se replient en vésicules. Une bicouche est une membrane, plongée dans l'eau, dont les deux faces sont composées de têtes hydrophiles, les extrémités hydrophobes étant rassemblées à l’intérieur de la bicouche. Une vésicule est un petit sac plein d’eau, qui flotte dans l’eau, et dont la membrane est une bicouche.
Les cellules des êtres vivants sont des vésicules très élaborées. Leur membrane est essentiellement une bicouche lipidique, mais elle est beaucoup plus complexe que les membranes des vésicules dans l’eau savonneuse. L’intérieur de la cellule surtout est très différent de son extérieur, ce qui n’est pas le cas des vésicules que l’on forme en agitant une eau sale.
Structures cellulaires en émulsion

Les expériences sur la formation spontanée de membranes cellulaires sont bien antérieures aux synthèses de Urey-Miller de 1953.
Après de multiples réflexions et hypothèses, le biochimiste soviétique Alexandre Oparine est parvenu à créer de petites structures sphériques appelées coacervats à partir d'une émulsion contenant des protéines histones et de la gomme arabique, en 1922. Il s'agissait de sphérules colloïdales, de quelques micromètres de diamètre en suspension et liées entre elles. Les savons et les émulsions sont des substances de type colloïde.
Les coacervats d'Oparine ont la propriété d'être séparés du monde par une surface hydrophobe polyhémiacétalique (ils ont un intérieur et un extérieur) tout comme les cellules biologiques (mais dans le cas étudié, il ne s'agit pas de lipides). La similarité ne s'arrête pas là : en présence de catalyseurs, ces coacervats échangeaient des substances avec le monde extérieur, grossissaient et finissaient par se multiplier par scission.
C'est à partir de cette expérience que l'on imagina la synthèse possible d'un système vivant à partir de molécules organiques, d'eau et d'énergie provenant d'un rayonnement électromagnétique (Soleil, éclairs) : la « soupe prébiotique ».
Reprenant ces travaux, l'Anglais John Haldane proposa, en 1929, que ces systèmes « biologiques » ne pouvaient évoluer dans une atmosphère oxydante, en présence d'oxygène. En effet, la survie des molécules organiques (glucides, lipides, protéines, etc.) n'est possible qu'en l'absence de leur oxydation par le dioxygène.
Vésicules lipidiques

L'apparition de vésicules dont la membrane serait formée de phospholipides pose de sérieux problèmes car ces lipides n'étaient pas présents sur la Terre primitive. Cependant des molécules amphiphiles plus simples ont pu être synthétisées de manière abiotique dans des conditions particulières. Par exemple il est reconnu que les sources hydrothermales ('mont hydrothermal') sont des environnements favorables pour des synthèses abiotiques soutenues[37]. À des températures entre 100 °C et 400 °C, des composés amphiphiles peuvent être produits par des réactions chimiques semblables au procédé Fischer-Tropsch[38]. De fait, la production abiotique de chaines courtes d'hydrocarbures a été récemment découverte au niveau du site hydrothermal Lost City situé au milieu de l'Atlantique[39]. Les concentrations millimolaires de méthane pourraient être à l'origine des réactions chimiques réductrices du carbone au niveau de ce type de site hydrothermal[40].
De nombreuses expériences ont montré que les vésicules dont la membrane est formée de lipides amphiphile sont capables de croître et de se diviser à partir de l'insertion additionnelle de nouveaux lipides. L'idée principale de cette théorie est que la composition moléculaire des membranes vésiculaires serait un moyen primitif de stockage d'information, et d'évolution possible vers l'apparition de biopolymères[41],[42].
Les études réalisées sur des vésicules lipidiques se sont limitées jusqu'à maintenant à des membranes formées de un à deux types de composés amphiphile. Ces conditions expérimentales ne reflètent pas les résultats de simulations de réactions de chimie prébiotique qui, typiquement, produisent un mélange très hétérogène de composés[43]. Dans le cadre de cette hypothèse d'une membrane formée d'une bicouche lipidique composée d'un mélange hétérogène de molécules amphiphile il existe un nombre considérable de combinaisons possibles pour le positionnement respectif des différents types de molécules au sein de la membrane.
Parmi toutes ces combinaisons potentielles il se peut qu'une combinaison, correspondant à un positionnement local spécifique de la partie interne de la membrane, favorise l'émergence d'un hypercycle selon la terminologie de Manfred Eigen[44]. Il s'agit en fait d'une réaction autocatalytique mutuelle entre une molécule, dont la synthèse est catalysée par le positionnement local spécifique, et le site réactif membranaire qui apparaît suite à la stabilisation de la conformation spatiale du positionnement local par la molécule.
À partir d'expériences réalisées sur des vésicules à membrane hétérogène[45] on peut en déduire que les paires site réactif/molécule seraient transmissibles aux vésicules filles. Une telle hérédité pourrait être à l'origine de lignées distinctes de vésicules permettant à la sélection naturelle d'opérer[46].
Protocellules

De très nombreuses vésicules ont pu se former dans l’océan primitif, aussi facilement qu’aujourd’hui l’écume de la mer. Qu’une telle vésicule soit le lieu de réactions autocatalytiques est tout à fait plausible.
En fin de comptes, si la « soupe prébiotique » contenait des vésicules siège de réactions autocatalytiques, la sélection naturelle moléculaire a alors favorisé les cycles et molécules suivant « la longévité, la fécondité, ou la fidélité de la reproduction » dans ces conditions, c'est-à-dire compte tenu de la présence de membranes. Pour le système autocatalytique relativement homogène que forme globalement la « soupe primitive », le fait qu'une partie se retrouve isolée dans une vésicule favorise probablement la longévité de cet échantillon, du fait de la protection contre les agressions et variations du milieu externes, et contre la dilution interne. Mais c'est un facteur a priori défavorable pour sa fécondité, dans la mesure où la membrane est une barrière pour l'accès aux molécules élémentaires consommées par le cycle.
Dans un tel milieu, la pression de sélection favorise donc les systèmes où la membrane pouvait être rendue suffisamment semi-perméable pour laisser passer les molécules élémentaires nécessaire à l'alimentation du cycle autocatalytique. Si ses membranes sont telles qu’elles laissent pénétrer les petites molécules nécessaires à la reproduction des grosses, alors on obtient, par le simple jeu des lois physiques et chimiques, une vésicule capable de s’alimenter et de grandir. Bien sûr les vésicules ne sont pas toujours dotées d’une telle capacité, mais si elles sont assez nombreuses et assez diversifiées, un tel événement n’est peut-être pas complètement improbable.
Selon Maynard Smith, deux conditions sont nécessaires pour former une véritable protocellule :
- Les molécules capables de répliquer la forme de base (les réplicateurs) doivent se lier entre elles en un « chromosome », formant ainsi une unité structurelle, garantissant aux réplicateurs de former un tout cohérent après la réplication ;
- la membrane doit posséder des mécanismes d'échange avec le milieu extérieur, autres que les systèmes à protéines actuels.
Selon Wilhelm Reich, des vésicules appelées bions sont apparues lors de ses expériences, à partir de matières minérales et organiques portées à ébullition. Ces vésicules se seraient organisées et auraient donné naissance à des cellules présentant toutes les caractéristiques de la vie[47]. La validité de ces expériences est rejetée par l'ensemble de la communauté scientifique ; les disciples de Reich estiment que ce rejet est le signe d'un complot universel contre leur maître à penser.
De l'ARN à l'ADN
Origine de l’ADN et du code génétique
Les premiers réseaux autocatalytiques n’étaient pas aussi élaborés que ceux d’aujourd’hui, fondés sur la machinerie très complexe de l’ADN, des ribosomes, du code génétique et des protéines. Mais les êtres vivants primitifs étaient capables d’évoluer. Leurs réseaux autocatalytiques pouvaient être modifiés par l’incorporation de nouvelles molécules, absorbées de façon exceptionnelle.
De telles modifications sont héritables, parce qu’une fois qu’une molécule est incorporée à un réseau autocatalytique, elle devient capable de se reproduire. Les conditions de l’évolution par la sélection naturelle, telles qu’elles ont été énoncées par Darwin (L'Origine des espèces)[48], sont donc réunies : variations aléatoires héritables et compétition au sein d’une population pour l’accès aux ressources. Les cellules primitives les plus performantes sont celles qui se reproduisaient le mieux et elles tendaient à dominer la population. On peut alors supposer que les êtres vivants primitifs ont évolué. Leurs techniques autocatalytiques rudimentaires se sont perfectionnées jusqu’à atteindre un point de quasi-perfection, à savoir les techniques de réplication de l'ADN et de fabrication des protéines qui sont possédées depuis des milliards d’années par tous les êtres vivants.
Dans l'hypothèse du monde à ARN, apparaissent tout d'abord des viroïdes ressemblant à des ARN auto-catalytiques, présents dans des compartiments isolés (qu'ils soient membranaires ou cristallins). Puis des protocellules, capables de métabolisme archaïque, sont soumises à une évolution darwinienne, évoluant ainsi vers des cellules à ARN, capables de présenter une activité variée et complexe.
Ribozymes ou protéines ?
Bien que l'ARN soit donc à l'origine de l'ADN dans le métabolisme cellulaire, cette réaction est très difficile à réaliser. De fait, dans les trois lignées, elle est catalysée par des protéines spécialisées : les ribonucléotides-réductases. De plus, cette réaction est très coûteuse en énergie, du fait de la réduction du ribose, et elle produit des radicaux libres, très réactifs, sur la protéine. L'ARN étant une molécule fragile, il paraît improbable qu'elle puisse supporter des radicaux libres sans l'intervention de protéines.
Ainsi, l'origine de l'ADN trouve vraisemblablement sa source après l'apparition des protéines, indispensables à chaque étape de sa synthèse à partir de précurseurs de type ARN, au sein de la cellule.
Intérêt de l'ADN
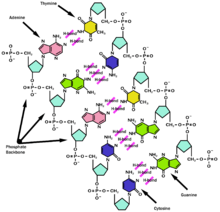
L'ADN présente un certain nombre d'avantages sur l'ARN, en termes de conservation de l'intégrité de l'information génétique.
Tout d'abord il se casse moins facilement, car le désoxyribose de l'ADN contient un atome d'oxygène de moins que le ribose de l'ARN. Or l'oxygène peut facilement interagir sur les liaisons entre nucléotides, posant alors un problème de stabilité.
Certains auteurs avancent l'hypothèse que la désamination spontanée de la cytosine en uracile, aisément détectable dans l'ADN (où U n'est pas normalement présent) par la machinerie cellulaire de réparation des mutations, expliquerait l'utilisation de la base T dans l'ADN. L'ARN (notamment l'ARNm), molécule régulièrement renouvelée dans la cellule, ne voit pas sa séquence contrôlée par des systèmes de réparation, d'où une conservation de la base U dans cette molécule. Dans cette hypothèse, la base U est donc ancestrale, la base T dérivée.
Avantage sélectif de l'ADN : l'hypothèse du virus

Les avantages en termes de stabilité de l'ADN pourraient ne pas suffire à expliquer son adoption. Ainsi, Patrick Forterre avance l'hypothèse qu'un avantage sélectif supplémentaire peut être dû aux conflits entre virus et cellules vivantes.
Dans ce modèle, le premier organisme à ADN serait un virus. L'ADN conférerait au virus le pouvoir de résister à des enzymes dégradant les génomes à ARN, arme de défense probable des cellules. On retrouve le même principe chez des virus actuels, qui altèrent leur ADN pour résister à des enzymes produites par des bactéries infectées.
Actuellement, on peut observer que les enzymes nécessaires à la rétrotranscription de l'ARN vers l'ADN sont très présentes chez les rétrovirus, dont le génome est porté par de l'ARN. De la même façon, de nombreux virus codent leurs propres enzymes de synthèse de l'ADN.
Cette hypothèse est également corroborée par la découverte de virus à ADN, dont celui-ci contient, non pas des groupements thymines, mais des groupements uraciles. Du point de vue évolutif, il y aurait donc eu d'abord apparition des désoxyribonucléotides, puis de l'ADN à uracile (ADN-U), puis d'ADN à thymine (ADN-T), qui se serait progressivement imposé. D'après Patrick Forterre, il est même probable que l'ADN-T ait été « inventé deux fois », chez des virus différents.
Les virus à ARN seraient ici des reliques du monde à ARN, les virus à ADN-U seraient alors des reliques du monde ayant précédé celui à ADN-T.
Les virus, premiers organismes à ADN

Les virus à ADN pourraient être plus anciens que la première cellule à ADN : la première cellule à ADN l'aurait donc emprunté à un ou plusieurs virus, sous la pression d'une course aux armements (théorie de la reine rouge).
Didier Raoult et Jean-Michel Claverie ont ainsi découvert le mimivirus : un virus géant à ADN (son génome étant deux fois plus long que le plus petit génome bactérien connu). La particularité de ce virus est qu'il peut produire des protéines impliquées dans la traduction de l'ARN en protéines (comme des enzymes chargeant des acides aminés sur des ARNt), il pourrait donc avoir pour ancêtres des virus plus anciens que la première cellule à ADN.
Eugène Koonin et ses collègues ont mis en avant, en comparant des génomes séquencés, que la plupart des enzymes impliqués dans la réplication de l'ADN sont différents entre les eubactéries et les eucaryotes (accompagnés des archées). Ils en concluent que l'ADN aurait été inventé indépendamment dans la lignée des eubactéries et celle conduisant aux eucaryotes et aux archées[réf. nécessaire].
De même, les enzymes de réplications des virus à ADN sont très différentes d'un virus à l'autre, ainsi que par rapport aux enzymes cellulaires jouant le même rôle.
Ces indices laissent penser que les enzymes liées à l'ADN sont apparues au cours d'un « premier âge » du monde à ADN, où existaient cellules à ARN et virus à ARN et à ADN.
Passage de l'ADN dans les cellules
La nature du génome du plus ancien ancêtre commun à tous les êtres vivants (que les scientifiques prénomment LUCA) reste inconnue : faisait-il encore partie du monde à ARN, ou avait-il déjà un génome à ADN ? Quoi qu'il en soit, LUCA est le fruit d'une longue évolution. Le génome des premières cellules, qui ont précédé LUCA, était sans doute constitué par des molécules d'ARN et non pas d'ADN. Contrairement à l'ADN, l'ARN peut en effet jouer à la fois le rôle d'enzyme et de matériel génétique. Stanley Miller et Christian de Duve pensent que l'apparition de l'ARN a été elle-même un évènement tardif, en effet, cette molécule ne semble pas pouvoir être synthétisée par les méthodes simples de la chimie prébiotique. L'ARN aurait donc été précédé par des molécules dont nous ne connaîtrons sans doute jamais la nature exacte.
Ce qui amène les scientifiques à penser que l'ARN a précédé l'ADN résulte de ce constat : les trois grandes lignées du vivant ne partagent que le système de biosynthèse des protéines, alors qu'elles diffèrent sur le système de réplication de l'ADN[49].
Il existe alors plusieurs hypothèses pour le passage de l'ADN (d'origine viral) dans les cellules vivantes : soit ce passage s'est produit une seule fois, soit il a pu avoir lieu plusieurs fois, indépendamment dans les différentes lignées. Dans le premier cas, les premiers gènes des enzymes de réplications auraient donc été remplacés par la suite par ceux d'un autre virus, formant ainsi les trois lignées.
L'hypothèse de Patrick Forterre est que les trois lignées du vivant trouvent leurs sources dans le remplacement du génome à ARN par le génome à ADN de trois virus différents. On retrouve notamment ici l'hypothèse d'une origine virale du noyau des eucaryotes.
Les travaux de Carl Woese semblent appuyer cette hypothèse, en démontrant que la vitesse d'évolution des protéines semble avoir chuté au moment de l'apparition des trois lignées. Cette diminution serait due au passage de l'ARN à l'ADN, les génomes à ADN étant plus stables, et donc moins sensibles aux mutations.
Dans ce scénario, l'apparition de trois lignées uniquement s'explique par le fait que les cellules à ADN ont peu à peu supplanté les cellules à ARN, empêchant ainsi l'apparition de nouvelles lignées par passage ARN→ADN.
Autres modèles
Controverse sur la véracité de la théorie
On ne peut pas remonter le temps pour aller voir comment était l’océan primitif et comment il a évolué. Mais on peut trouver des témoignages indirects. Le passé laisse des traces dans le présent. Si on a les bons outils, théoriques et observationnels, on peut déduire le passé à partir du présent. Par exemple, les techniques autocatalytiques d’aujourd’hui se sont en quelque sorte fossilisées depuis des milliards d’années, puisqu’elles n’ont pas ou peu évolué. Elles nous renseignent donc sur un passé très lointain. En combinant ces informations avec d’autres, on peut espérer remonter encore plus loin dans le temps. Des expériences en laboratoire de chimie prébiotique peuvent apporter des renseignements précieux.
La théorie de la génération spontanée peut être combinée avec celle de la panspermie afin d'élargir le volume de matières mis en jeu à d'autres planètes viables. Néanmoins, elle rajoute la question de la probabilité que des organismes vivants puissent être véhiculés par des astéroïdes d'une planète viable à une autre au hasard des collisions intersidérales.
Milieu de collision entre planète et noyaux de comètes
Selon des travaux de modélisation présentés en 2010[50], la compression brutale des matériaux constituant le noyau de glace d'une comète, au moment du choc avec une planète pourrait donner lieu à la production d'acides aminés. Cette modélisation a pris comme base 210 molécules diluées dans un mélange d'eau, de méthanol, d'ammoniac, de dioxyde de carbone et de monoxyde de carbone, des composés qu'on estime être présents couramment dans le noyau des comètes. Avec une vitesse d'impact de 29 km/s, la pression atteint 10 gigapascals et une température de 700 K. Selon les auteurs, d'autres simulations, à pressions et températures plus élevées conduisent à des réactions chimiques encore plus complexes. Selon le modèle, une simulation de 47 gigapascals et une température de 3 141 K pour les 20 premières picosecondes[réf. souhaitée] de l'impact fait naître des molécules complexes, dont de grosses molécules à liaisons carbone-azote qui pourraient être les premières briques de la vie. Le calcul a nécessité environ quelques milliers d'heures d'ordinateur sur le superordinateur du cluster Atlas du Lawrence Livermore.
Sources hydrothermales : le monde du soufre et de l'azote

Les sources hydrothermales ont été découvertes en 1977 à 2 600 mètres de profondeur, là où deux plaques tectoniques se séparent.
Les monts hydrothermaux sont situés sur la couche sédimentaire. Leur diamètre à la base varie de 25 à 100 mètres et leur hauteur varie de 70 à 100 mètres. Les cheminées de ces fumeurs sont parfois recouvertes d'une croûte d'oxyde de manganèse. Les fumeurs situés sur ces monts sont composés d'un solide friable dont la couleur varie du gris noir à l'ocre, ce sont des sulfures de fer, de cuivre et de zinc.
Ces sources sont particulièrement intéressantes car on y a trouvé la vie où on la croyait impossible : milieu privé d'oxygène, à haute température, chargé de métaux et de soufre, dans l'obscurité la plus totale. Cependant les gradients de température importants autour de ces zones et le fait que les ultraviolets destructeurs ne parviennent pas si profondément (alors qu'ils détruisent toute molécule formée à la surface) sont de bonnes conditions pour l'apparition de la vie.
Ces organismes au mode de vie extrêmophile (forte température, forte acidité, niveaux de radiation extrême) ont les mêmes formes que ceux que l'on connait plus près de la surface (ADN, protéines, sucres, etc.) mais puisent leur énergie de l'oxydation du sulfure d'hydrogène (H2S) pour transformer le carbone minéral en matière organique. Il s'agit d'archéobactéries hyperthermophiles (90-110 °C). Ce mode de vie correspondrait alors aux conditions de milieu qui régnaient sur Terre il y a 3,5 à 3,8 milliards d'années[52].
D'autre part, des expériences ont été menées[53], au laboratoire de géophysique de la Carnegie Institution de Washington, et ont montré que dans les conditions qui existent autour des évents, il y a formation d'ammoniac (NH3), forme réduite de l'azote qui est tant nécessaire à la formation des molécules organiques de la première partie et qui n'existait pas dans l'atmosphère oxydante. Les sources hydrothermales sont donc de bonnes sources de NH3.
Dans le cadre de l'International Ocean Discovery Program (en), les géomicrobiologistes et géochimistes ont pu observer des acides aminés aromatiques, molécules complexes indispensables au vivant, synthétisés abiotiquement par des réactions de Friedel-Crafts catalysées par une stéatite (argile riche en fer) durant l'altération de serpentinites du massif Atlantis au niveau de la dorsale médio-atlantique (serpentinisation des péridotites et stéatisation qui ne sont qu'une des facettes d'un phénomène plus général, l'hydrothermalisme du site de Lost City (en) associé aux roches du manteau)[54]. « C’est l’interaction entre l’eau de mer et les minéraux de ces roches, issues du manteau terrestre, ainsi que la structure en feuillet de l’argile résultant de leur altération qui ont sans doute apporté les conditions idéales pour la formation de ces constituants primaires des premières briques du vivant, tel un "miroir géologique" aux expériences atmosphériques de Miller[55] ».
Une origine extraterrestre primitive (exogenèse)
Une hypothèse alternative est que la vie se soit d'abord formée hors de la Terre.
Les composés organiques sont relativement fréquents dans l'espace, notamment dans les zones lointaines du système solaire où l'évaporation des composés volatils est très réduite. Certaines comètes présentent des couches externes de matière sombre, qu'on pense être une sorte de bitume formé par une combinaison de composés carbonés simples exposés aux rayons ultraviolets. La pluie de matériaux cométaires sur la Terre primitive pourrait avoir apporté des quantités de molécules organiques complexes, ce qui aurait favorisé l'apparition de la vie sur Terre.
Ce serait plutôt là un apport de matériaux organiques, plus ou moins complexes (qui a dû se faire !), que l'apport de la vie elle-même.
Panspermie
Une hypothèse plus large est la panspermie, une théorie selon laquelle l'origine de la vie sur Terre serait dû à une contamination extraterrestre. Des transferts d'organismes vivants microscopiques à travers l'espace jusqu'à la Terre, naturels ou délibérés, grâce aux comètes ou aux météorites par exemple. Certains pensent aussi que la vie est originaire de l'espace, les théories sont nombreuses.
En cas de contamination volontaire, on parle de panspermie dirigée.
Ces théories d'une origine extraterrestre n'expliquent pas directement comment la vie est apparue, car elles ne font a priori que reporter le problème. Cependant, elles élargissent les conditions dans lesquelles la vie a pu apparaître dans l'Univers. Les futurs échantillons de sols ramenés de Mars et de comètes permettront peut-être d'obtenir de nouveaux éléments de réponse.
Origine de l’évolution darwinienne plutôt qu’origine de la vie
Des scientifiques préfèrent étudier la question de l'origine de la vie à partir d’un paradigme ou d’un point de vue différent. Il s’agit de traiter la question de comment et quand l’évolution a commencé au lieu d’essayer de définir la vie et de délimiter une frontière quant à son origine.
Aujourd’hui il semble y avoir un consensus parmi les chercheurs sur l’origine de la vie (chimistes, géochimistes, biochimistes, exo/astrobiologistes, informaticiens, philosophes et historiens des sciences) qu’il est absolument nécessaire de trouver une définition universelle de la vie[56]. Cependant le nombre de définitions ne cesse d’augmenter[57]. De fait, la frontière entre systèmes vivants et systèmes non vivants de même que le moment à partir duquel le non vivant serait devenu vivant sont arbitraires.
On constate depuis quelques années un changement profond car le problème de la vie n’est plus de rechercher les principes qui la sous-tendent mais est devenu un problème de nature historique. La question n’est plus : « Qu’est-ce qui caractérise les organismes par rapport aux objets inanimés ? » ; mais plutôt : « comment ces caractéristiques se sont progressivement installées dans les systèmes que nous appelons des organismes[58]? ». Finalement, la question deviendrait : « Comment l'évolution darwinienne a-t-elle émergé sur la Terre, il y a 4 milliards d'années environ, dans un monde qui ne la contenait pas encore[59]? »
Notes et références
- (en) Elizabeth A. Bella, Patrick Boehnkea, T. Mark Harrisona et Wendy L. Maob, « Potentially biogenic carbon preserved in a 4.1 billion-year-old zircon », Proceedings of the National Academy of Sciences, (DOI 10.1073/pnas.1517557112).
- (en) Matthew S. Dodd, Dominic Papineau, Tor Grenne, John F. Slack, Martin Rittner, Franco Pirajno, Jonathan O’Neil & Crispin T. S. (2017) Little Evidence for early life in Earth’s oldest hydrothermal vent precipitates, Nature, 543, p. 60–64 (02 March 2017) doi:10.1038/nature21377 résumé.
- Lazcano, A. (2010) Which way to life?, Orig. Life Evol. Biosph. 40:161–167.
- Benner et al., in Gesteland RF, Cech TR, Atkins JF. (2006), The RNA World, 3e éd., Cold Spring Harbor Laboratory Press, New York, NY, USA, 2006.
- Oparin A, Fesenkov V., Life in the Universe, Moscou : USSR Academy of Sciences publisher, 3rd edition, 1956 (in Russian). English translation: Oparin, A. et V. Fesenkov. Life in the Universe. New York: Twayne Publishers (1961).
- Bernal, J.D. (1959) The problem of stages in biopoiesis In The Origin of Life on the Earth, edited by A.I. Oparin, Pergamon Press, London, p. 38–43.
- Varela FG, Maturanaa HR, Uribea R. (May 1974) Autopoiesis: The organization of living systems, its characterization and a model, Biosystems 5(4):187-196.
- Nicolis G; Prigogine I. (1989). Exploring complexity: An introduction, New York, NY: W. H. Freeman. (ISBN 0716718596).
- Tirard S, Morange M, Lazcano A. (2010) The Definition of Life: A Brief History of an Elusive Scientific Endeavor, Astrobiology 10:1003-1009.
- Orgel, L.E. (2000) Self-organizing biochemical cycles, Proc Natl Acad Sci USA 97:12503–12507.
- (en) Yannick Vallee, Ibrahim Shalayel, Kieu-Dung Ly et K. V. Raghavendra Rao, « At the very beginning of life on Earth: the thiol-rich peptide (TRP) world hypothesis », International Journal of Developmental Biology, vol. 61, nos 8-9, (ISSN 0214-6282 et 1696-3547, lire en ligne, consulté le )
- (en) Van Kranendonk, M. J., Philippot, P., Lepot, K., Bodorkos, S. & Pirajno, F. (2008),Geological setting of Earth’s oldest fossils in the c. 3.5 Ga Dresser Formation, Pilbara craton, Western Australia. Precambr. Res. 167, 93–124.
- Abderrazak El Albani et Alain Meunier, Aux origines de la vie, Dunod, 2016.
- (en) J. Alleon, S. Bernard, C. Le Guillou, O. Beyssac, K. Sugitani et F. Robert, « Chemical nature of the 3.4 Ga Strelley Pool microfossils », Geochemical Perspectives Letters, vol. 7, , p. 37-42 (DOI 10.7185/geochemlet.1817).
- (en) Allen P. Nutman, Vickie C. Bennett, Clark R. L. Friend, Martin J. Van Kranendonk et Allan R. Chivas, « Rapid emergence of life shown by discovery of 3,700-million-year-old microbial structures », Nature, vol. 537, , pages 535-538 (DOI 10.1038/nature19355).
- (en) Mark A. van Zuilen, « Proposed early signs of life not set in stone », Nature, vol. 563, , p. 190-191 (DOI 10.1038/d41586-018-06994-x).
- https://www.nature.com/articles/s41586-018-0610-4 Abigail C. Allwood, Minik T. Rosing, David T. Flannery, Joel A. Hurowitz & Christopher M. Heirwegh, Reassessing evidence of life in 3,700-million-year-old rocks of Greenland, Nature, 2018
- Des microfossiles vieux de 3,77 milliards d’années découverts au Canada, [1].
- Rosing, M. T. (1999) « 13C-Depleted carbon microparticles in >3700-Ma sea-floor sedimentary rocks from west greenland ». Science 283, 674–676 CAS .
- Ohtomo Y, Kakegawa T, Ishida A, Nagase T & Rosing M.T (2014), “Evidence for biogenic graphite in early Archaean Isua metasedimentary rocks”. Nat. Geosci. 7, 25–28 .
- Bell, E. A., Boehnke, P., Harrison, T. M. & Mao, W. L. (2015) “Potentially biogenic carbon preserved in a 4.1 billion-year-old zircon”. Proc. Natl Acad. Sci. USA 112, 14518–14521 .
- Pinti, D. L., Hashizume, K. & Matsuda, J (2001). « Nitrogen and argon signatures in 3.8 to 2.8 Ga metasediments: clues on the chemical state of the Archean ocean and the deep biosphere”. Geochim. Cosmochim. Acta 65, 2301–2315 .
- van Zuilen, M.A & al. (2005) “Nitrogen and argon isotopic signatures in graphite from the 3.8-Ga-old Isua Supracrustal Belt” Southern West Greenland. Geochim. Cosmochim. Acta 69, 1241–1252 .
- Hassenkam T, Andersson M.P, Dalby K.N, Mackenzie D.M.A & Rosing M.T (2017), Elements of Eoarchean life trapped in mineral inclusions ; Nature doi:10.1038/nature23261 publié en ligne le 24 Juillet 2017 | résumé.
- Ohtomo, Y., Kakegawa, T., Ishida, A., Nagase, T. & Rosing, M. T. Evidence for biogenic graphite in early Archaean Isua metasedimentary rocks. Nat. Geosci. 7, 25–28 (2014).
- Nutman, A.P, Bennett V.C, Friend C.R.L, Van Kranendonk MJ & Chivas A.R (2016). « Rapid emergence of life shown by discovery of 3,700-million-year-old microbial structures”. Nature 537, 535–538 .
- Ward, Peter et Kirschvink, Joe, A New History of Life: the radical discoveries about the origins and evolution of life on earth, Bloomsbury Press, , 39–40 p..
- (en) « Atmospheric composition and climate on the early Earth »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), James F. Kating et Tazwell Howard, septembre 2006.
- (en) Robert Shapiro, Origins: A Skeptic's Guide to the Creation of Life on Earth, Bantam Books, (ISBN 0-671-45939-2), p. 110.
- Matthew W. Powner, Béatrice Gerland et John D. Sutherland. Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions, Nature 2009;459:239-242.
- Voir Prevolutionary dynamics and the origin of evolution, Martin Nowak, Hisashi Ohtsuki, Proceedings of the National Academy of Science of the USA, 2008.
- The Selfish Gene, Richard Dawkins, 1976.
- Richard Dawking, The ancestor's tale, Chap. Canterbury.
- Cité d'après Isaac Asimov, Asimov's new guide to science (1984), chap. 12.
- Harvey Lodish, Arnold Berk, Paul Matsudaira, Chris-A Kaiser, M. Krieger, M.P. Scott, Lodish Zipursky et James Darnell, Biologie moléculaire de la cellule, Bruxelles, de Boeck, , 3e éd. (ISBN 978-2804148027).
- M Sumper et R. Luce, « Evidence for de novo production of self-replicating and environmentally adapted RNA structures by bacteriophage Qbeta replicase », Proceedings of the National Academy of Sciences, vol. 72, no 1, , p. 162–166 (PMID 1054493, PMCID 432262, DOI 10.1073/pnas.72.1.162).
- Baross J, Hoffman SE. Submarine hydrothermal vents and associated gradient environments as sites for the origin and evolution of life. Orig. Life Evol. Biosph. 1985;15:327-345.
- Rushdi AI, Simoneit BR. Lipid formation by aqueous Fischer-Tropsch-type synthesis over a temperature range of 100 to 400 degrees C. Orig.Life Evol.Biosph. 2001;31:103-118.
- (en) G. Proskurowski, « Abiogenic Hydrocarbon Production at Lost City Hydrothermal Field », Science, vol. 319, no 5863, , p. 604–607 (DOI 10.1126/science.1151194).
- (en) William Martin, « Hydrothermal vents and the origin of life », Nature Reviews Microbiology, (DOI 10.1038/nrmicro1991).
- Origin of Life at the Weizmann Institute.
- (en) Segré, D., Ben-Eli, D., Deamer, D. et Lancet, D., « The Lipid World », Origins of Life and Evolution of Biospheres 2001, vol. 31, nos 1–2, february–april 2001, p. 119–45 (PMID 11296516, DOI 10.1023/A:1006746807104, lire en ligne [PDF], consulté le ).
- (en) I. A. Chen, « From Self-Assembled Vesicles to Protocells », Cold Spring Harbor Perspectives in Biology, vol. 2, no 7, , a002170–a002170 (DOI 10.1101/cshperspect.a002170, cshperspectives.cshlp.org).
- Eigen M, Schuster P. The hypercycle. A principle of natural self-organization. Part A: Emergence of the hypercycle. Naturwissenschaften 1977;64:541-565.
- (en) J. W. Szostak, « An optimal degree of physical and chemical heterogeneity for the origin of life? », Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 366, no 1580, , p. 2894–2901 (DOI 10.1098/rstb.2011.0140).
- (en) Marc Tessera, « Origin of Evolution versus Origin of Life: A Shift of Paradigm », International Journal of Molecular Sciences, vol. 12, no 6, , p. 3445–3458 (DOI 10.3390/ijms12063445).
- Voir La biopathie du cancer, Wilhelm Reich.
- Charles Darwin, L’Origine des espèces [édition du Bicentenaire], trad. A. Berra sous la direction de P. Tort, coord. par M. Prum. Précédé de Patrick Tort, « Naître à vingt ans. Genèse et jeunesse de L’Origine ». Paris, Champion Classiques, 2009.
- Marie-Christine Maurel, « À la frontière du vivant : les viroïdes », sur The Conversation (consulté le ).
- travaux de Nir Goldman et de ses collègues du Lawrence Livermore National Laboratory à Livermore, présentés le 24 mars 2010 devant l'American Chemical Society à San Francisco, Californie, et relayés par une brève du Journal Nature (26 mars 2010 ; On line : doi:10.1038/news.2010.152).
- Luciano Paolozzi, Jean-Claude Liébart, Microbiologie, Dunod, , p. 50.
- (en) Gregory Bock, Evolution of hydrothermal ecosystems on Earth (and Mars ?), Wiley, , p. 11.
- Abiotic nitrogen reduction on the early Earth (Brandes et al., 1998).
- (en) Bénédicte Ménez, Céline Pisapia, Muriel Andreani, Frédéric Jamme, Quentin P. Vanbellingen, Alain Brunelle, Laurent Richard, Paul Dumas & Matthieu Réfrégiers, « Abiotic synthesis of amino acids in the recesses of the oceanic lithosphere », Nature, (DOI 10.1038/s41586-018-0684-z).
- « Les premières briques à l’origine de la vie sur Terre observées dans des roches océaniques profondes », sur ipgp.fr, .
- Tsokolov SA., Why is the definition of life so elusive? Epistemological considerations, Astrobiology 2009;9:401-412.
- Trifonov EN., Vocabulary of Definitions of Life Suggests a Definition, J. Biomol. Struct. Dyn. 2011;29(2):259-266 http://www.jbsdonline.com.
- S. Tirard S et al., The Definition of Life: A Brief History of an Elusive Scientific Endeavor, Astrobiology 2010;10:1003-1009.
- Tessera M., Is A n+1 Definition of Life Useful?, J. Biomol. Struct. Dyn. 2012;29(4):635-636 from http://www.jbsdonline.com.
Sources
- (en) John Desmond Bernal, The origin of life, éd. Weidenfeld & Nicolson, 1967.
- Guillemette Lauters, Olivier Lenaerts, Daniel Rousselet et Eric Depiereux, Bioscope : L’origine de la vie.
- John Maynard Smith, Eörs Szathmáry, Les Origines de la vie, éd. Dunod, 2000. (ISBN 2100048600)
- (en) J. William Schopf, Anatoliy B. Kudryavtsev, David G. Agresti, Thomas J. Wdowiak, Andrew D. Czaja, « Laser−Raman imagery of Earth's earliest fossils », dans Nature, vol. 416, p. 73–76, mars 2002 [(en) lire en ligne].
- Marie-Christine Maurel, La Naissance de la vie : de l'évolution prébiotique à l'évolution biologique, éd. Dunod, 2003 (3e éd.). (ISBN 2100068822)
- (en) N. Fujii, T. Saito, Homochirality and life, dans The Chemical Records, vol. 4, no 5, p. 267–78, 2004 [(en) lire en ligne]
- Uwe Meierhenrich, « Un pas vers l’origine de l’homochiralité… »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ), novembre 2005.
- Patrick Forterre, « L'origine du génome », dans Les dossiers de La Recherche : l'histoire de la vie, les grandes étapes de l'évolution, no 19, p. 34–40, mai 2005.
- Marc-André Selosse, « Quelle parenté entre les trois grandes lignées du vivant ? », dans Les dossiers de La Recherche : l'histoire de la vie, les grandes étapes de l'évolution, no 19, p. 42–45, mai 2005.
- « Laurent Nahon : « L'asymétrie des biomolécules vient de l'espace » », propos recueillis par Franck Daninos, dans La Recherche, no 390, octobre 2005.
- (en) U. Meierhenrich, L. Nahon, C. Alcaraz, J. Bredehöft, S. Hoffmann, B. Barbier, A. Brack, « Asymmetric VUV photodecomposition of the amino acid D,L-Leucine in the solid state », dans Angewandte Chemie International Edition, vol. 44, p. 5630–5634, juillet 2005 [(en) lire en ligne].
Webographie
- Le site de la Société Française d'Exobiologie (SFE).
- Conférence de Patrick Forterre : Regards croisés sur les origines de la vie (2009) à l'« ENS Cachan »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ).
Bibliographie
- Éric Karsenti, Aux sources de la vie, Flammarion, , 306 p. (lire en ligne)
- Abderrazak El Albani et Alain Meunier, Aux origines de la vie, Dunod, 2016
- (en) Uwe Meierhenrich, Amino acids and the asymmetry of life, Springer-Verlag, 2008. (ISBN 978-3-540-76885-2)
- (en) Site consacré au mimivirus.
- (en) Anthony M. Poole, « What is the Last Universal Common Ancestor ? »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ), septembre 2002.
- (en) Antonio Lazcano « The Origins of Life. Have too many cooks spoiled the prebiotic soup? » (consulté le ), Natural History magazine, février 2006.
- (en) Erwin Schrödinger, What Is Life?, 1944 (traduction française : Qu'est-ce que la vie ?, éd. Seuil).
- Joël de Rosnay, Les Origines de la vie, éd. Seuil, 1966. (ISBN 2020002167)
- Jean C. Baudet, La vie expliquée par la chimie, Vuibert, Paris, 2006.
- André Brack, Bénédicte Leclercq, La vie est-elle universelle ? – Des premiers êtres vivants à l'exploration spatiale, éd. EDP Sciences, 2003. (ISBN 2-86883-674-7).
- Sous la direction de Muriel Gargaud, Didier Despois, Jean-Paul Parisot, L'Environnement de la Terre Primitive, Coll. L'origine de la Vie sur Terre et dans l'Univers, Presses universitaires de Bordeaux, 2001. (ISBN 2-86781-267-4).
- (en) Jeffrey L. Bada, « How life began on Earth: a status report », Earth and Planetary Science Letters, vol. 226, nos 1-2, , p. 1-15 (DOI 10.1016/j.epsl.2004.07.036)
- Charles Darwin, L’Origine des espèces [édition du Bicentenaire], trad. A. Berra sous la direction de P. Tort, coord. par M. Prum. Précédé de Patrick Tort, « Naître à vingt ans. Genèse et jeunesse de L’Origine ». Paris, Champion Classiques, 2009.
Voir aussi
Articles connexes
- Auto-organisation
- Biologie, Biologie cellulaire, Vie
- Biochimies hypothétiques
- Chauvinisme du carbone
- Exobiologie
- Génération spontanée
- Habitabilité d'une planète
- Histoire évolutive du vivant
- Protéinoïde
- Bombardement par rayonnement ionisant
- Naissance du vivant
- Vie sur d'autres planètes
- Application de la pensée complexe à la naissance du vivant
- Application de la pensée complexe à la vie sur d'autres planètes
Liens externes
 Écouter La leçon consacrée aux origines chimiques de la vie et dispensée par Jacques Reisse au Collège Belgique (2009).
Écouter La leçon consacrée aux origines chimiques de la vie et dispensée par Jacques Reisse au Collège Belgique (2009).- Institut Jacques-Monod, « Les origines du vivant », sur Université Pierre-et-Marie-Curie - Paris VI (consulté le )

