Cystéine
| Cystéine | |
 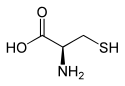 L ou R(+)-cystéine et D ou S(-)-cystéine |
|
| Identification | |
|---|---|
| Nom UICPA | acide 2-amino- 3-mercapto-propanoïque |
| Synonymes |
C, Cys |
| No CAS | (racémique) L ou R(+) D ou S(–) |
| No ECHA | 100.000.145 |
| No CE | 200-158-2 L 213-062-0 D |
| No E | E920 L |
| FEMA | 3263 L |
| Propriétés chimiques | |
| Formule | C3H7NO2S [Isomères] |
| Masse molaire[1] | 121,158 ± 0,009 g/mol C 29,74 %, H 5,82 %, N 11,56 %, O 26,41 %, S 26,47 %, |
| pKa | 1,91 8,14 10,28 |
| Propriétés physiques | |
| T° fusion | 240 °C |
| Solubilité | 280 g·L-1 dans l'eau (25 °C) |
| Propriétés biochimiques | |
| Codons | UGU, UGC |
| pH isoélectrique | 5,07[2] |
| Acide aminé essentiel | selon les cas |
| Occurrence chez les vertébrés | 3,3 %[3] |
| Précautions | |
| SIMDUT[4] | |
Produit non contrôlé |
|
| Directive 67/548/EEC | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La cystéine (abréviations IUPAC-IUBMB : Cys et C), du grec ancien κύστις (« vessie »[5])[6], est un acide α-aminé dont l'énantiomère L est l'un des 22 acides aminés protéinogènes, encodé sur les ARN messagers par les codons UGU et UGC. Elle n'est pas considérée comme essentielle pour l'homme mais peut être produite en quantité insuffisante par l'organisme selon l'état de santé des individus — notamment dans le cas de certaines maladies métaboliques et de syndromes de malabsorption — ainsi que chez les enfants et les personnes âgées.
Il s'agit d'un acide α-aminé naturel caractérisé par la présence d'un groupe sulfhydryle –SH formant un thiol ; la sélénocystéine et la tellurocystéine en sont des analogues dont l'atome de soufre est remplacé respectivement par un atome de sélénium et de tellure.
La cystéine est présente en petites quantités dans la plupart des protéines. Sa présence dans les protéines est très importante, notamment parce qu'elle permet la formation de ponts disulfure. Le groupe thiol est très fragile car il s'oxyde facilement. Son oxydation conduit à la cystine, qui consiste en deux molécules de cystéine unies par un pont disulfure. Un oxydant plus énergique peut oxyder la cystéine sur son soufre en donnant l'acide cystéique HO3S–CH2–CH(NH2)COOH, à l'origine de la taurine, produit de décarboxylation présent dans la bile sous forme de taurocholate.
Différentes réactions sont utilisées pour « protéger » les thiols des cystéines, ou pour réduire les ponts disulfures, en particulier :
- Déplacement par un large excès de thiols libres :
- par des monothiols de type R-SH. Le plus couramment utilisé est le 2-Mercaptoéthanol : HSH2C–CH2OH,
- par des dithiols cyclisables, par exemple le dithiothréitol : HSH2C–CHOH–CHOH–CH2SH ;
- Alkylation des thiols libres.
Le blocage par alkylation est couramment utilisé lors de l'étude des protéines. Il utilise en particulier l'iodoacétamide conduisant à une carboxyamidométhylation :
- Cys–SH + IH2C–CONH2 → Cys–S–CH2–CONH2.
La cystéine peut être prise comme complément alimentaire sous forme de N-acétylcystéine (NAC).
Elle a pu jouer un rôle important dans le développement de la vie sur terre[7].
Application[modifier | modifier le code]
La cystéine est autorisée comme additif alimentaire et porte le numéro E920.
Production[modifier | modifier le code]
L'acide L-cystéique et la L-cystéine peuvent être produits en quantités industrielles à partir de certains OGM, notamment Escherichia coli à partir de glucose et de sels minéraux[8], de plumes dissoutes dans de l’acide chlorhydrique ainsi que de cheveux humains, qui en contiennent davantage. Ce dernier mode de production a été interdit en France par un avis du Conseil supérieur d'hygiène publique de France par un avis daté du 8 juin 1999[9] « étant donné la recommandation générale du Comité scientifique de l’alimentation humaine s’opposant au recyclage intra-espèce » ; cette décision est cependant difficilement applicable car l'origine de la cystéine distribuée ne peut être facilement déterminée.
L'Autorité européenne de sécurité des aliments (EFSA) a autorisé, par une directive d'[10], l'emploi de L-cystéine dans les biscuits pour nourrissons et enfants en bas âge afin de prévenir les risques d'étouffement par émiettement des biscuits à faible teneur en matières grasses. Plus généralement, la cystéine permet aux pâtes de mieux retenir les gaz et de conserver durablement des formes volumineuses, ce qui favorise l'écoulement de ces produits chez les pâtissiers.
Aliments sources de cystéine[modifier | modifier le code]
- Levure de bière
- Germe de blé
- Ail
- Oignon
- Chou de Bruxelles
- Chanvre
- Brocoli
- Produits laitiers
- Noix
- Graines
- Fonio
- Fruits de mer
- Poisson
- Œufs
- Viande
Action dans le corps humain[modifier | modifier le code]
La cystéine intervient dans la synthèse de la mélanine, le pigment naturel de la peau et des cheveux.
Elle intervient aussi dans la synthèse du coenzyme A qui joue de nombreux rôles dans le métabolisme humain.
Et parce que ses résidus fixent les cations métalliques, elle semble impliquée dans certains processus de contamination[11], bioconcentration, et détoxication naturelle de l'organisme (chélation de métaux lourds ou métalloïdes toxiques[12])[12].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Francis A. Carey, « Table of pKa and pI values », sur Département de chimie de l'université de Calgary, (consulté le ).
- (en) M. Beals, L. Gross, S. Harrell, « Amino Acid Frequency », sur The Institute for Environmental Modeling (TIEM) à l'université du Tennessee (consulté le ).
- « Cystéine (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Abrégé du dictionnaire grec-français A. Bailly, p. 520.
- Terminologie médicale par Georges Dolisi
- (en) Yannick Vallee, Ibrahim Shalayel, Kieu-Dung Ly et K. V. Raghavendra Rao, « At the very beginning of life on Earth: the thiol-rich peptide (TRP) world hypothesis », International Journal of Developmental Biology, vol. 61, nos 8-9, (ISSN 0214-6282 et 1696-3547, lire en ligne, consulté le )
- Cysteine sur le site GMO Compass.
- http://www.economie.gouv.fr/files/files/directions_services/dgccrf/boccrf/00_01/a0010016.htm Avis du Conseil supérieur d’hygiène publique de France relatif à la demande d’autorisation d’emploi de L. Cystéine issue de cheveux humains en alimentation humaine].
- Directive de la Commission 2010/69/UE du 22 octobre 2010 modifiant les annexes de la directive 95/2/CE du Parlement européen et du Conseil concernant les additifs alimentaires autres que les colorants et les édulcorants.
- HMCOF SEABIRDS "Contamination par les métaux lourds des oiseaux marins et des marsouins de la Mer du Nord ;" Bulletin de la Société royale des sciences de Liège 61 (1992): 163.)
- MOENNE, Alejandra. "Eucaryotic metallothioneins: proteins, gene regulation and copper homeostasis." Cahiers de biologie marine 42.1-2 (2001): 125-135.
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- (en) http://www.chemie.fu-berlin.de/chemistry/bio/aminoacid/cystein_en.html
- (en) nature hydrophobe de la cystéine.
- Étude pilote sur la tolérabilité de l'ingestion d'un isolat de protéine riche en cystéine (Immunocal) chez les autistes
Bibliographie[modifier | modifier le code]
- Brattström, L., et al. "Homocysteine and cysteine: determinants of plasma levels in middle‐aged and elderly subjects." Journal of internal medicine 236.6 (1994): 633-641 (résumé).
- Quig, David. "Cysteine metabolism and metal toxicity." Alternative Medicine Review 3 (1998): 262-270.
- Rhee, Sue Goo, et al. "Hydrogen peroxide: a key messenger that modulates protein phosphorylation through cysteine oxidation." Science Signaling 2000.53 (2000): pe1-pe1 (résumé).
- Turk, Vito, and Wolfram Bode. "The cystatins: protein inhibitors of cysteine proteinases." FEBS letters 285.2 (1991): 213-219.
- Turk, Vito, Boris Turk, and Dušan Turk. "Lysosomal cysteine proteases: facts and opportunities." The EMBO journal 20.17 (2001): 4629-4633 (résumé).
- Van Wart, Harold E., and Henning Birkedal-Hansen. "The cysteine switch: a principle of regulation of metalloproteinase activity with potential applicability to the entire matrix metalloproteinase gene family." Proceedings of the National Academy of Sciences 87.14 (1990): 5578-5582 résumé.


