« Maladie de Chagas » : différence entre les versions
relecture et ref |
ajouts mef et ref |
||
| Ligne 21 : | Ligne 21 : | ||
== Histoire == |
== Histoire == |
||
{{section en travaux|date=avril 2024}} |
|||
=== Période précolombienne === |
=== Période précolombienne === |
||
De nombreuses [[Momie|momies]], bien conservées en raison d'une [[Dessiccation|dessication]] en [[climat aride]], ont été retrouvées dans la [[Région de Tarapacá|région de Tarapaca]] (nord du [[Chili]]), datées du Ier millénaire av. J.-C. Des études de [[paléopathologie]], publiées à partir de 1985, montrent que plusieurs d'entre elles présentent un [[Achalasie|mégaœsophage]] avec [[cardiomégalie]] et [[Colectasie|mégacolon]], ensemble caractéristique évoquant une maladie de Chagas<ref>{{Ouvrage|langue=en|auteur1=Kenneth F. Kiple|directeur1=oui|auteur2=Marvin J. Allison|titre=The Cambridge World History of Human Disease|lieu=Cambridge|éditeur=Cambridge University Press|date=1993|pages totales=1176|passage=636-638.|isbn=0-521-33286-9|numéro chapitre=VIII.25|titre chapitre=Chagas' Disease}}</ref>. |
De nombreuses [[Momie|momies]], bien conservées en raison d'une [[Dessiccation|dessication]] en [[climat aride]], ont été retrouvées dans la [[Région de Tarapacá|région de Tarapaca]] (nord du [[Chili]]), datées du Ier millénaire av. J.-C. Des études de [[paléopathologie]], publiées à partir de 1985, montrent que plusieurs d'entre elles présentent un [[Achalasie|mégaœsophage]] avec [[cardiomégalie]] et [[Colectasie|mégacolon]], ensemble caractéristique évoquant une maladie de Chagas<ref>{{Ouvrage|langue=en|auteur1=Kenneth F. Kiple|directeur1=oui|auteur2=Marvin J. Allison|titre=The Cambridge World History of Human Disease|lieu=Cambridge|éditeur=Cambridge University Press|date=1993|pages totales=1176|passage=636-638.|isbn=0-521-33286-9|numéro chapitre=VIII.25|titre chapitre=Chagas' Disease}}</ref>. |
||
| Ligne 44 : | Ligne 43 : | ||
=== La découverte de Chagas === |
=== La découverte de Chagas === |
||
| ⚫ | |||
La maladie a été décrite pour la première fois en 1909 par le [[médecin]] [[brésil]]ien spécialiste des maladies infectieuses [[Carlos Chagas]], assistant d'[[Oswaldo Cruz]], directeur-fondateur de l'institut de [[sérothérapie]] de Rio de Janeiro en 1900, qui deviendra l'institut Oswaldo Cruz en 1908<ref name=":5">{{Article|prénom1=Matthias|nom1=Perleth|titre=The Discovery of Chagas' disease and the formation of the early Chagas' disease concept|périodique=History and Philosophy of the Life Sciences|volume=19|numéro=2|pages=211–236|date=1997|issn=0391-9714|lire en ligne=https://www.jstor.org/stable/23332045|consulté le=2024-04-09}}</ref>. |
La maladie a été décrite pour la première fois en 1909 par le [[médecin]] [[brésil]]ien spécialiste des maladies infectieuses [[Carlos Chagas]], assistant d'[[Oswaldo Cruz]], directeur-fondateur de l'institut de [[sérothérapie]] de Rio de Janeiro en 1900, qui deviendra l'institut Oswaldo Cruz en 1908<ref name=":5">{{Article|prénom1=Matthias|nom1=Perleth|titre=The Discovery of Chagas' disease and the formation of the early Chagas' disease concept|périodique=History and Philosophy of the Life Sciences|volume=19|numéro=2|pages=211–236|date=1997|issn=0391-9714|lire en ligne=https://www.jstor.org/stable/23332045|consulté le=2024-04-09}}</ref>. |
||
Au cours de recherches sur le [[paludisme]], Carlos Chagas découvre que les intestins de punaises [[Triatominae|''Triatominea'']] hébergent un [[protozoaire]] flagellé, une nouvelle espèce du genre ''[[Trypanosoma]]''. Il adresse des spécimens à Oswaldo Cruz qui démontre expérimentalement que ce nouveau protozoaire pouvait être transmis aux singes [[Ouistiti|marmousets]] piqués par l’insecte infecté<ref name=":4" />{{,}}<ref name=":6">{{Article|prénom1=Chen|nom1=Chao|prénom2=José L.|nom2=Leone|prénom3=Carlos A.|nom3=Vigliano|titre=Chagas disease: Historic perspective|périodique=Biochimica Et Biophysica Acta. Molecular Basis of Disease|volume=1866|numéro=5|pages=165689|date=2020-05-01|issn=1879-260X|pmid=32001300|doi=10.1016/j.bbadis.2020.165689|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/32001300/|consulté le=2024-04-03}}</ref>. |
Au cours de recherches sur le [[paludisme]], Carlos Chagas découvre que les intestins de punaises [[Triatominae|''Triatominea'']] hébergent un [[protozoaire]] flagellé, une nouvelle espèce du genre ''[[Trypanosoma]]''. Il adresse des spécimens à Oswaldo Cruz qui démontre expérimentalement que ce nouveau protozoaire pouvait être transmis aux singes [[Ouistiti|marmousets]] piqués par l’insecte infecté<ref name=":4" />{{,}}<ref name=":6">{{Article|prénom1=Chen|nom1=Chao|prénom2=José L.|nom2=Leone|prénom3=Carlos A.|nom3=Vigliano|titre=Chagas disease: Historic perspective|périodique=Biochimica Et Biophysica Acta. Molecular Basis of Disease|volume=1866|numéro=5|pages=165689|date=2020-05-01|issn=1879-260X|pmid=32001300|doi=10.1016/j.bbadis.2020.165689|lire en ligne=https://pubmed.ncbi.nlm.nih.gov/32001300/|consulté le=2024-04-03}}</ref>. |
||
| ⚫ | |||
Chagas a appelé ce [[parasitisme|parasite]] [[Agent infectieux|pathogène]] ''{{Langue|la|Trypanosoma cruzi}}''<ref name="Chagas_1909">{{article|langue=en|lang=de|auteur=C. Chagas|titre=Neue Trypanosomen|journal=Vorläufige Mitteilung. Arch. Schiff. Tropenhyg.|vol=13|numéro=|pages=120-122|année=1909}}.</ref> pour honorer son maître. Plus tard la même année, il le nomme ''{{Langue|la|Schizotrypanum cruzi}}''<ref name=Chagas_1909b>{{article |langue=en| auteur = Chagas C| titre = Nova tripanozomiase humana : Estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem [''New human trypanosomiasis. Studies about the morphology and life-cycle of ''Schizotripanum cruzi'', etiological agent of a new morbid entity of man''] | journal = Mem Inst Oswaldo Cruz | année = 1909 | vol = 1 | no =2 | pages = 159-218 | lang=pt}}.</ref> (du grec ''schizo-'' séparer) car il a cru distinguer un [[dimorphisme sexuel]] du parasite, ce qui était inexact et le résultat d'une confusion avec un parasite accessoire du genre fongique ''[[Pneumocystis jirovecii|Pneumocystis]]''. Chagas a intégré à tort un nouveau [[fungi]] dans le cycle d'un nouveau protozoaire. Aussi, il reviendra à l'appellation ''T. cruzi''<ref name=":5" />{{,}}<ref name=":7">{{Ouvrage|langue=fr|auteur1=Dominique Lecourt|directeur1=oui|auteur2=François Delaporte|titre=Dictionnaire de la pensée médicale|lieu=Paris|éditeur=Quadrige / PUF|année=2004|pages totales=1270|passage=1163-1167.|isbn=2 13 053960 2}}{{Commentaire biblio|Article Trypanosomiase américaine : Maladie de Chagas}}</ref>. |
Chagas a appelé ce [[parasitisme|parasite]] [[Agent infectieux|pathogène]] ''{{Langue|la|Trypanosoma cruzi}}''<ref name="Chagas_1909">{{article|langue=en|lang=de|auteur=C. Chagas|titre=Neue Trypanosomen|journal=Vorläufige Mitteilung. Arch. Schiff. Tropenhyg.|vol=13|numéro=|pages=120-122|année=1909}}.</ref> pour honorer son maître. Plus tard la même année, il le nomme ''{{Langue|la|Schizotrypanum cruzi}}''<ref name=Chagas_1909b>{{article |langue=en| auteur = Chagas C| titre = Nova tripanozomiase humana : Estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem [''New human trypanosomiasis. Studies about the morphology and life-cycle of ''Schizotripanum cruzi'', etiological agent of a new morbid entity of man''] | journal = Mem Inst Oswaldo Cruz | année = 1909 | vol = 1 | no =2 | pages = 159-218 | lang=pt}}.</ref> (du grec ''schizo-'' séparer) car il a cru distinguer un [[dimorphisme sexuel]] du parasite, ce qui était inexact et le résultat d'une confusion avec un parasite accessoire du genre fongique ''[[Pneumocystis jirovecii|Pneumocystis]]''. Chagas a intégré à tort un nouveau [[fungi]] dans le cycle d'un nouveau protozoaire. Aussi, il reviendra à l'appellation ''T. cruzi''<ref name=":5" />{{,}}<ref name=":7">{{Ouvrage|langue=fr|auteur1=Dominique Lecourt|directeur1=oui|auteur2=François Delaporte|titre=Dictionnaire de la pensée médicale|lieu=Paris|éditeur=Quadrige / PUF|année=2004|pages totales=1270|passage=1163-1167.|isbn=2 13 053960 2}}{{Commentaire biblio|Article Trypanosomiase américaine : Maladie de Chagas}}</ref>. |
||
| Ligne 55 : | Ligne 53 : | ||
Le {{Date|14|avril|1909}}, Chagas découvre ''T. cruzi'' dans le sang d'une petite fille de deux ans, prénommée Bérénice, présentant une fièvre avec [[adénopathie]], gros foie ([[hépatomégalie]]) et grosse rate ([[splénomégalie]]). C'est le premier diagnostic d'un cas humain de maladie de Chagas<ref name=":4" />. |
Le {{Date|14|avril|1909}}, Chagas découvre ''T. cruzi'' dans le sang d'une petite fille de deux ans, prénommée Bérénice, présentant une fièvre avec [[adénopathie]], gros foie ([[hépatomégalie]]) et grosse rate ([[splénomégalie]]). C'est le premier diagnostic d'un cas humain de maladie de Chagas<ref name=":4" />. |
||
Le travail de Chagas est unique dans l’[[histoire de la médecine]]. Il est le le seul chercheur à avoir décrit, en près d'un an, une nouvelle [[maladie infectieuse]] dans un système complet et cohérent : son agent pathogène, son [[insecte vecteur|vecteur]], son [[Hôte (biologie)|hôte]], ses manifestations cliniques et son [[épidémiologie]]. De plus, il fait façon inverse, en découvrant d'abord la cause (l'agent pathogène) puis l'effet (la maladie)<ref name=":5" />{{,}}<ref name=":6" />. |
Le travail de Chagas est unique dans l’[[histoire de la médecine]]. Il est le le seul chercheur à avoir décrit, en près d'un an, une nouvelle [[maladie infectieuse]] dans un système complet et cohérent : son agent pathogène, son [[insecte vecteur|vecteur]], son [[Hôte (biologie)|hôte]], ses manifestations cliniques et son [[épidémiologie]]. De plus, il le fait de façon inverse, en découvrant d'abord la cause (l'agent pathogène) puis l'effet (la maladie)<ref name=":5" />{{,}}<ref name=":6" />. |
||
Dans les années 1920, et jusqu'à la mort de Chagas en 1934, la maladie a eu du mal à être reconnue, car Chagas considère sa maladie une « [[thyroïdite]] parasitaire », comme la cause principale du [[crétinisme]] au Brésil : ''T. cruzi'' serait l'agent spécifique du « [[goitre]] du [[Minas Gerais]] ». En dehors des motivations de jalousie ou des rivalités d'influence et de pouvoir, des adversaires de Chagas ont pu, de bonne foi, critiquer les failles scientifiques du système de Chagas : par exemple la difficulté de trouver des ''T. cruzi'' chez les goitreux du Brésil, ou l'absence de goitreux en [[Argentine]] où l'on trouve facilement des punaises infectées par ''T. cruzi''<ref name=":5" />{{,}}<ref name=":7" />. |
|||
=== La redécouverte de la maladie de Chagas === |
|||
Chagas a forgé une [[Entité#En médecine|entité médicale]] en superposant deux affections concomitantes : une maladie infectieuse parasitaire ([[trypanosomiase]] américaine) et une maladie [[Système endocrinien|endocrinienne]] (crétinisme du goitre endémique). Ce qui peut se comprendre, non seulement par simultanéité de situation et d'apparence, mais aussi par simultanéité conceptuelle. Le passage au {{s-|XX}} est marqué par la difficile séparation entre la [[Théorie des miasmes]] (qui expliquait à la fois les fièvres contagieuses et le crétinisme) et la microbiologie (le microbe comme miasme figuré), et par la naissance tout aussi difficile d'une nouvelle [[parasitologie]] qui doit trouver ses marques entre la [[protozoologie]], l'[[Entomologie médicale|entomologie]] et la [[microbiologie]]<ref name=":5" />{{,}}<ref name=":7" />. |
|||
En 1935, la maladie de Chagas est redécouverte par le médecin argentin {{Lien|langue=en|trad=Cecilio Romaña|fr=Cecilio Romaña}} dans une région sans goitre endémique. Romaña décrit, chez neuf malades porteurs de ''T. cruzi'' en phase aiguë, non pas un « [[myxœdème]] du visage » mais une [[conjonctivite]] avec œdème des paupières et [[Adénopathie|adénopathies]] satellites ou « signe de Romaña ». Grâce à ce signe, la maladie de Chagas pouvait être diagnostiquée dès son début par tout [[médecin généraliste]]<ref name=":6" />{{,}}<ref name=":7" />. |
|||
Les progrès des examens médicaux des années 1940-1960 ([[Immunologie clinique|immunologie]], explorations cardiaques, digestives, neurologiques…) permettent de confirmer ou rectifier les formes chroniques décrites par Chagas. L'importance et la fréquence de la maladie, dans ses formes aiguës et chroniques, est désormais reconnue dans toute l'[[Amérique latine]]<ref name=":4" />{{,}}<ref name=":6" />. |
|||
En 2020, l'OMS inaugure la première journée mondiale de la maladie de Chagas, en choisissant le 14 avril, le jour anniversaire de la découverte par Chagas du cas Bérénice, premier cas humain de la maladie<ref>{{Article|prénom1=Simone Petraglia|nom1=Kropf|prénom2=Nísia Trindade|nom2=Lima|titre=The history of Chagas disease: reflections on science in action|périodique=Memorias Do Instituto Oswaldo Cruz|volume=117|pages=e200372|date=2022|issn=1678-8060|pmid=35584507|pmcid=9113750|doi=10.1590/0074-02760200372|lire en ligne=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9113750/|consulté le=2024-04-07}}</ref>. |
|||
Avant les années 1960, la maladie n'a pas été considérée comme un problème majeur de [[santé publique]] chez l'homme. Les manifestations de la maladie de Chagas au Brésil dans les années 1920 ont été largement ignorées<ref name=":5" />. |
|||
== Épidémiologie et distribution géographique == |
== Épidémiologie et distribution géographique == |
||
Version du 9 avril 2024 à 21:25
| Causes | Trypanosoma cruzi |
|---|---|
| Transmission | Transmission par les insectes (d) |
| Incubation min | 5 j |
| Incubation max | 14 j |
| Symptômes | Chagome (en), signe de Romana (en), cardiomyopathie, myocardite, hépatomégalie, splénomégalie et mégacolon |
| Médicament | Benznidazole et Nifurtimox |
|---|---|
| Spécialité | Infectiologie et parasitologie |
| CIM-10 | B57 |
|---|---|
| CIM-9 | 086 |
| DiseasesDB | 13415 |
| MedlinePlus | 001372 |
| eMedicine | 214581 |
| MeSH | D014355 |
| Patient UK | American-trypanosomiasis |
La trypanosomiase américaine (brésilienne) ou maladie de Chagas est une forme de trypanosomiase (comme la maladie du sommeil), une maladie parasitaire qui sévit dans les régions tropicales d'Amérique du Sud et centrale. Elle est provoquée par Trypanosoma cruzi, un trypanosome qui est transmis par des réduves, sorte de punaises hématophages de la sous-famille des Triatominae (genres Panstrongylus, Triatoma et Rhodnius), telles la vinchuca (Triatoma infestans, Triatoma protracta et Rhodnius prolixus (en)). Selon l'OMS près de 12 000 personnes meurent de la maladie de Chagas chaque année. Il s'agit d'une des vingt maladies tropicales négligées listées par l'OMS.
Histoire
Période précolombienne
De nombreuses momies, bien conservées en raison d'une dessication en climat aride, ont été retrouvées dans la région de Tarapaca (nord du Chili), datées du Ier millénaire av. J.-C. Des études de paléopathologie, publiées à partir de 1985, montrent que plusieurs d'entre elles présentent un mégaœsophage avec cardiomégalie et mégacolon, ensemble caractéristique évoquant une maladie de Chagas[1].
En 1999, L'ADN du parasite a été retrouvé dans une momie vieille de 4000 ans de la même région[2]et en 2004 cela a été confirmé au Pérou et au Chili (désert d'Atacama) sur des momies de la culture chinchorro, datées de 7000 ans av.J.C[3], et des cultures qui ont suivi dans la même région jusqu'à la conquête espagnole du XVIe siècle[4].
L'hypothèse retenue est que la maladie de Chagas serait originaire des régions côtières des Andes, où se trouvait un cycle sauvage (entre parasite, vecteur et vertébrés sauvages). La maladie humaine apparait chez les chinchorros, le premier peuple amérindien à quitter la vie nomade des chasseurs-cueilleurs pour se sédentariser (villages de pêcheurs puis agriculture et élevage) avec début de déforestation. Ceci concorde avec le fait que la maladie était absente chez les autochtones d'Amazonie, toujours mobiles et sans domestication animale[4].
D'autres cas précolombiens ont été signalés au Texas (désert de Chihuahua), et au Brésil (Vallée du Rio Peruaçu (pt)). Des céramiques péruviennes datées du XIIIe au XVIe siècle seraient des représentations possibles de sujets atteints de maladie de Chagas[4].
Du XVIe au XIXe siècle
Plusieurs chroniqueurs ou médecins signalent une maladie locale connue sous le nom de « bicho », une maladie qui frappe les indigènes comme les conquistadors et dont la description pourrait correspondre à la forme digestive chronique de maladie de Chagas[4].
Le cas le plus célèbre est celui de Charles Darwin (1809-1889) qui pourrait avoir souffert de cette maladie à la suite d'une piqûre d'un prétendu grand moustique noir de la pampa (vinchuca) (voir la maladie de Charles Darwin (en)). L'épisode a été rapporté par Darwin dans ses journaux intimes dans Le Voyage du Beagle comme étant survenu le 25 à l'est des Andes[4],[5] près de Mendoza.
Darwin était jeune et en bonne santé, bien que six mois auparavant il ait été malade pendant un mois près de Valparaíso. Cependant en 1837, presque un an après son retour en Angleterre, il a commencé à souffrir par intermittence d'une étrange association de symptômes, qui l'a frappé d'incapacité pratiquement pour tout le reste de sa vie. Les tentatives faites pour examiner les restes de Darwin conservés à l'abbaye de Westminster en utilisant les techniques modernes de PCR se sont heurtées à un refus du conservateur de l'abbaye[6].
La découverte de Chagas
La maladie a été décrite pour la première fois en 1909 par le médecin brésilien spécialiste des maladies infectieuses Carlos Chagas, assistant d'Oswaldo Cruz, directeur-fondateur de l'institut de sérothérapie de Rio de Janeiro en 1900, qui deviendra l'institut Oswaldo Cruz en 1908[7].
Au cours de recherches sur le paludisme, Carlos Chagas découvre que les intestins de punaises Triatominea hébergent un protozoaire flagellé, une nouvelle espèce du genre Trypanosoma. Il adresse des spécimens à Oswaldo Cruz qui démontre expérimentalement que ce nouveau protozoaire pouvait être transmis aux singes marmousets piqués par l’insecte infecté[4],[8].

Chagas a appelé ce parasite pathogène Trypanosoma cruzi[9] pour honorer son maître. Plus tard la même année, il le nomme Schizotrypanum cruzi[10] (du grec schizo- séparer) car il a cru distinguer un dimorphisme sexuel du parasite, ce qui était inexact et le résultat d'une confusion avec un parasite accessoire du genre fongique Pneumocystis. Chagas a intégré à tort un nouveau fungi dans le cycle d'un nouveau protozoaire. Aussi, il reviendra à l'appellation T. cruzi[7],[11].
Il a aussi cru détecter T. cruzi dans les glandes salivaires de l'insecte, en faisant de la piqûre le mode dominant de transmission. En fait, les excréments de l'insecte représentent la principe source d'infection, ce qui sera démontré par son collègue Émile Brumpt en 1912[11].
Le , Chagas découvre T. cruzi dans le sang d'une petite fille de deux ans, prénommée Bérénice, présentant une fièvre avec adénopathie, gros foie (hépatomégalie) et grosse rate (splénomégalie). C'est le premier diagnostic d'un cas humain de maladie de Chagas[4].
Le travail de Chagas est unique dans l’histoire de la médecine. Il est le le seul chercheur à avoir décrit, en près d'un an, une nouvelle maladie infectieuse dans un système complet et cohérent : son agent pathogène, son vecteur, son hôte, ses manifestations cliniques et son épidémiologie. De plus, il le fait de façon inverse, en découvrant d'abord la cause (l'agent pathogène) puis l'effet (la maladie)[7],[8].
Dans les années 1920, et jusqu'à la mort de Chagas en 1934, la maladie a eu du mal à être reconnue, car Chagas considère sa maladie une « thyroïdite parasitaire », comme la cause principale du crétinisme au Brésil : T. cruzi serait l'agent spécifique du « goitre du Minas Gerais ». En dehors des motivations de jalousie ou des rivalités d'influence et de pouvoir, des adversaires de Chagas ont pu, de bonne foi, critiquer les failles scientifiques du système de Chagas : par exemple la difficulté de trouver des T. cruzi chez les goitreux du Brésil, ou l'absence de goitreux en Argentine où l'on trouve facilement des punaises infectées par T. cruzi[7],[11].
La redécouverte de la maladie de Chagas
Chagas a forgé une entité médicale en superposant deux affections concomitantes : une maladie infectieuse parasitaire (trypanosomiase américaine) et une maladie endocrinienne (crétinisme du goitre endémique). Ce qui peut se comprendre, non seulement par simultanéité de situation et d'apparence, mais aussi par simultanéité conceptuelle. Le passage au XXe siècle est marqué par la difficile séparation entre la Théorie des miasmes (qui expliquait à la fois les fièvres contagieuses et le crétinisme) et la microbiologie (le microbe comme miasme figuré), et par la naissance tout aussi difficile d'une nouvelle parasitologie qui doit trouver ses marques entre la protozoologie, l'entomologie et la microbiologie[7],[11].
En 1935, la maladie de Chagas est redécouverte par le médecin argentin Cecilio Romaña (en) dans une région sans goitre endémique. Romaña décrit, chez neuf malades porteurs de T. cruzi en phase aiguë, non pas un « myxœdème du visage » mais une conjonctivite avec œdème des paupières et adénopathies satellites ou « signe de Romaña ». Grâce à ce signe, la maladie de Chagas pouvait être diagnostiquée dès son début par tout médecin généraliste[8],[11].
Les progrès des examens médicaux des années 1940-1960 (immunologie, explorations cardiaques, digestives, neurologiques…) permettent de confirmer ou rectifier les formes chroniques décrites par Chagas. L'importance et la fréquence de la maladie, dans ses formes aiguës et chroniques, est désormais reconnue dans toute l'Amérique latine[4],[8].
En 2020, l'OMS inaugure la première journée mondiale de la maladie de Chagas, en choisissant le 14 avril, le jour anniversaire de la découverte par Chagas du cas Bérénice, premier cas humain de la maladie[12].
Épidémiologie et distribution géographique
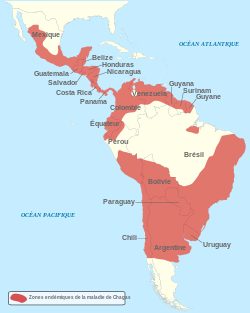
En 2024, la maladie de Chagas affecte entre 6 et 7 millions de personnes, et en tue environ 12 000. Selon l'OMS, 75 millions de personnes vivent dans une zone à risque[13].
La maladie de Chagas chronique demeure un problème de santé important dans de nombreux pays d’Amérique latine, en dépit de l'efficacité des mesures d'hygiène et de prévention, telles que l’élimination des insectes vecteurs de la transmission, qui ont réduit à zéro le nombre de nouvelles infections dans au moins deux pays[Lesquels ?] de la région. Avec l’accroissement des mouvements de population, le risque de transmission par transfusion sanguine est cependant devenu plus réel aux États-Unis[14]. En outre, T.cruzi s'est déjà avéré capable d'infecter l'opossum sauvage et le raton laveur jusque loin au nord dans un État comme la Caroline du Nord[15].
La maladie est présente dans presque toutes les Amériques, du sud des États-Unis au nord de l’Argentine, la plupart du temps dans des zones rurales pauvres, d’Amérique centrale et d’Amérique du Sud[16].
La maladie se rencontre presque exclusivement dans les zones rurales, où les Triatominae peuvent se multiplier et trouver leur nourriture sur un réservoir naturel de T.cruzi (le plus répandu étant l’opossum et le tatou). Selon les interactions locales entre les vecteurs et leurs hôtes, d'autres humains infectés, ainsi que les animaux domestiques comme les chats, les chiens, les cochons d'Inde et les animaux sauvages comme les rongeurs, les singes, les écureuils (Spermophilus beecheyi) et beaucoup d'autres pourraient également être d’importants réservoirs de parasites. Bien que les Triatominae se nourrissent sur les oiseaux, ceux-ci semblent être immunisés contre l'infection et donc ne sont pas considérés comme un réservoir de T. cruzi, mais des soupçons demeurent sur leur rôle comme ressource alimentaire pour les vecteurs près des habitations humaines.
Les insectes du genre triatomine sont connus dans différents pays sous des noms populaires de vinchuca, de barbeiro (le barbier), de chipo et d'autres noms[17], parce qu'ils sucent le sang en piquant le visage de ses victimes, la nuit. Les insectes, qui développent un comportement principalement domiciliaire et anthropophile une fois qu’ils ont infesté une maison[18], sont habituellement cachés pendant le jour dans les crevasses et les trous dans les murs et les toits des maisons mal construites. Plus rarement, les maisons mieux construites peuvent héberger l'insecte vecteur, en raison de l'utilisation des matériaux de mauvaise qualité pour faire des toits, comme le bambou et le chaume. Une moustiquaire, roulée sous le matelas, assurera une protection dans ces situations, quand l'insecte adulte peut venir du haut vers le bas, mais une larve d’une des cinq étapes nymphales (les instars) est capable de ramper du plancher vers le haut.
Même lorsque les colonies d’insectes sont éradiquées d'une maison et des abris environnants pour les animaux domestiques, elles peuvent revenir (par exemple, en volant) à partir des plantes ou des animaux qui font partie du cycle antique d'infection sylvestre naturelle[pas clair]. Ceci peut se produire particulièrement dans les zones de savane ouverte intercalées entre des bosquets et des habitations.
La végétation dense, comme dans une forêt tropicale, et les habitats urbains, n’offrent pas des conditions idéales pour l'établissement du cycle de transmission humaine. Cependant, dans les régions où l’habitat forestier et sa faune est grignoté par l'exploitation économique et l'extension de l’habitat humain, comme dans les zones nouvellement déforestées, les zones cultivées de palmiers piassava palm (Leopoldinia piassaba (en)) et certaines parties de l’Amazonie, la maladie peut réapparaître, quand les insectes recherchent une nouvelle proie[19].
Depuis 1990, la maladie de Chagas est plus souvent présente en Guyane Française avec des cas humains autochtones et des cas canins en zone résidentielle[20].
Les pays non endémiques (dont l'Europe) comptent de nombreux cas d'importation[21] (probablement de l'ordre de 50 000 cas en Espagne par exemple[22]). En France, les cas importés étaient très rare avant les années 2000 (un seul cas rapporté en 1988). En 2008, l'émergence de la maladie se confirme en métropole avec 18 cas importés signalés depuis 2004[23], l'estimation du nombre réel de cas infectés étant de l'ordre de 1500 en 2009[24], ce qui peut avoir son importance en politique transfusionnelle (évaluation du risque)[25].
Manifestations cliniques
La maladie humaine se développe en deux phases : la phase aiguë dans les deux mois après l’infection, et la phase chronique qui peut s’étendre sur plusieurs années, voire toute la vie. Des auteurs décrivent trois phases, selon qu'ils distinguent une phase de début dans la phase aiguë, ou une phase de complications tardives dans la phase chronique[26],[27].
Phase aiguë

Début
La phase de début correspond à une incubation de une à deux semaines (passage des parasites dans le sang circulant). Elle peut être asymptomatique, passant inaperçue, ou se résumer à des symptômes peu spécifiques : fièvre, anorexie, lymphadénopathie, légère hépatosplénomégalie[26].
Lorsque l'infection s'est faite par voie transcutanée, elle peut se manifester par un chancre d'inoculation ou nodule cutané isolé ressemblant à un furoncle, appelé « chagome », qui apparaît au point d’inoculation[26].
Quand le site d'inoculation est conjonctival et muqueux (20 % des cas), le patient peut développer une conjonctivite unilatérale et un œdème périorbitaire, ainsi qu’une lymphadénite pré-auriculaire. Cette constellation de symptômes, constituant un signe pathognomonique[28], est appelée « signe de Romaña[29] », fréquemment retrouvé chez l'enfant[26].
État
Cette période correspond à la primo-invasion des organes. En sus des troubles précédents, de rares cas de myocardite ou de méningo-encéphalite peuvent se produire chez l'adulte et surtout chez l'enfant (2 à 5 % des enfants de moins de 2 ans, atteints de Chagas, en meurent), notamment lors d'infections par voie orale[26].
Au bout de deux mois environ, tous les symptômes disparaissent spontanément. Mais en l'absence de traitement efficace, une phase chronique asymptomatique peut durer, dans près de deux tiers des cas, de plusieurs années à toute la vie, ou se manifester par des complications tardives d'organes dans un tiers des cas environ[26],[27].
Phase chronique
Dans la phase chronique symptomatique, des complications tardives se produisent dans les années, voire les décennies qui suivent l'infection initiale. Ces atteintes, de gravité variable, concernent le cœur, le système digestif et le système nerveux.
L'atteinte cardiaque la plus sévère est celle du muscle cardiaque : une cardiomyopathie avec insuffisance cardiaque et troubles du rythme, potentiellement mortelle[27]. L'atteinte cardiaque repose sur plusieurs mécanismes : altération du système nerveux végétatif, troubles de la microcirculation, attaque directe du parasite et par l'intermédiaire du système immunitaire[30], avec intervention du TNF-alpha[31]. Il existe également une susceptibilité génétique[32]. Le risque de développer une atteinte cardiaque est d'environ 25 % à 10 ans[33].
Il existe parfois une dilatation du tube digestif, comme le mégaœsophage (avec achalasie et troubles de la déglutition) et le mégacôlon (avec constipation pouvant évoluer vers un syndrome de type occlusif), conduisant à une malnutrition et une perte de poids[26].
Les troubles neurologiques sont plus rares : ce sont des méningo-encéphalites fébriles[26] pouvant conduire jusqu’à la démence.
Ces réactivations aiguës de phase chronique sont plus fréquentes chez les patients immunodéprimés : infection à VIH, greffés, sous immunodépresseurs[26],[27].
Cycle parasitaire
Mécanismes de transmission
Trypanosoma cruzi fait partie du même genre que l'agent infectieux responsable de la maladie du sommeil africaine, mais ses manifestations cliniques, sa répartition géographique, son cycle de vie et son insecte vecteur sont tout à fait différents.
Un insecte vecteur infecté du genre triatomine se nourrit du sang d’un mammifère et libère des trypomastigotes dans ses déjections près du point de piqûre. La victime, en grattant l'emplacement de la plaie, fait pénétrer des trypomastigotes dans l’hôte par la blessure, ou par des muqueuses saines, telles que la conjonctive. Puis, à l’intérieur de l’hôte, les trypomastigotes envahissent les cellules, où ils se transforment en amastigotes intracellulaires. Les amastigotes se divisent par scissiparité et se métamorphosent en trypomastigotes, puis sont libérés dans la circulation comme trypomastigotes circulants. Ces trypomastigotes infectent des cellules d'un type particulier et se transforment en amastigotes intracellulaires dans de nouveaux sites d'infection. Des manifestations cliniques et la mort des cellules des tissus cibles peuvent se produire en raison de ce cycle infectieux. Par exemple, il a été montré par l’anatomopathologiste autrichien et brésilien, le Dr Fritz Köberle (en) dans les années 1950 à l’école de Médecine de l'université de São Paulo à Ribeirão Preto, au Brésil, que les amastigotes intracellulaires détruisent les neurones intra-muraux du système nerveux autonome de l'intestin et du cœur, ce qui conduit respectivement au mégacôlon et à l’anévrisme.
Les trypomastigotes circulants ne peuvent pas se diviser (contrairement de ceux du trypanosome africain. La multiplication du parasite reprend seulement quand il envahit une autre cellule ou est ingéré par un autre vecteur. Le kissing bug s’infecte en se nourrissant de sang humain ou animal qui contient des parasites en circulation. D'ailleurs les insectes pourraient répandre l'infection entre eux par leur comportement prédateur et cannibale. Les trypomastigotes ingérés se transforment en épimastigotes dans l’intestin du vecteur. Les parasites se multiplient et se différencient dans l’intestin et deviennent des trypomastigotes métacycliques infectieux dans l’intestin de l’insecte.
Trypanosoma cruzi peut également être transmis par des transfusions sanguines, des organes transplantés, ou par voie transplacentaire, et le lait maternel, ainsi que[34] dans des accidents de laboratoire. Selon l’Organisation mondiale de la santé, le taux d'infection dans les banques de sang d’Amérique latine varie entre 3 % et 53 %, soit un niveau plus élevé que pour l'infection à HIV et l’hépatite B et C[17].
Les enfants peuvent également contracter la maladie de Chagas in utero (pendant la grossesse). La maladie de Chagas explique environ 13 % des cas de mortalité périnatale dans certaines régions du Brésil. On recommande aux femmes enceintes de se faire dépister pour la maladie[35].
Deux types de Trypanosoma cruzi, appelés I et II, sont décrits, avec une répartition géographique différente[36].

Mécanismes de transmission accessoires
Depuis 1991, les chercheurs soupçonnaient que la transmission du trypanosome était possible par voie orale[37]. La raison était la présence d'un certain nombre de micro-épidémies limitées à des périodes et à des endroits particuliers (tels qu'une ferme ou un logement familial), en particulier dans des secteurs non-endémiques tels que l’Amazonie (17 épisodes de ce type ont été enregistrés entre 1968 et 1997). En 1991 au Brésil, des ouvriers agricoles de l'État de Paraíba ont été apparemment infectés par la consommation de nourriture contaminée par des déjections d’opossum. En 1997 à Macapá, dans l'État d’Amapá, 17 membres de deux familles ont été probablement infectés en buvant du jus de fruit de palmier Euterpe oleracea contaminé par des insectes vecteurs écrasés de type triatomine[38].
Au début de l’année 2005, une nouvelle épidémie avec 27 cas a été signalée dans l’Amapá.
En au Brésil, une nouvelle manifestation a été enregistrée dans l'État de Santa Catarina. Celle-ci semble confirmer ce mécanisme alternatif de transmission. En effet, plusieurs personnes de Santa Catarina qui avaient ingéré du jus de canne à sucre (garapa) dans un kiosque au bord de la route ont contracté la maladie de Chagas[39]. En , 49 cas avaient été confirmés dans cet Etat, dont six décès.
Jusqu’à présent, le mécanisme présumé est que des insectes porteurs du trypanosome ont été écrasés dans la matière première. Les services d'hygiène de Santa Catarina ont estimé que 60 000 personnes pouvaient avoir été en contact avec la nourriture contaminée à Santa Catarina. Ces services ont invité toutes les personnes concernées à se soumettre à des analyses de sang. Ils ont interdit la vente de ce jus dans l'État jusqu'à ce que le risque soit circonscrit.
La gravité inhabituelle de cette épidémie a été attribuée à une hypothétique charge parasitaire particulièrement élevée : à l’origine de cette infection transmise par voie orale. Les chercheurs brésiliens de l’Institut Oswaldo Cruz, à Rio de Janeiro, étaient capables d’infecter des souris par voie digestive avec des préparations infectées par le trypanosome.
Diagnostic de laboratoire
La mise en évidence de l'agent causal est la procédure de diagnostic utilisée dans la phase aiguë de la maladie de Chagas. Elle donne presque toujours des résultats positifs, et peut être réalisée par :
- Examen au microscope :
a) De sang frais prélevé sur anticoagulant ou culot globulaire, pour les parasites mobiles ;
b) Un étalement de sang contaminé sur lame fixé au colorant de Giemsa, pour la visualisation du parasite ; il peut être confondu avec Trypanosoma rangeli, 50 % plus long qui n'est pas considéré comme pathogène pour l'homme.
- Isolement de l'agent par :
a) Inoculation à la souris ;
b) Culture sur milieu spécial (par exemple : NNN, LIT, etc.) ;
c) Xénodiagnostic, un test au cours duquel les Réduves, des insectes non infectés sont nourries par le sang du patient, et le contenu de leur intestin est testé pour une recherche de parasites pendant les 4 semaines qui suivent.
- Tests variés de diagnostic immunologique ; (en essayant également de distinguer les souches de (zymodemes) des T.cruzi qui ont une pathogénicité différente).
- Test de fixation du complément.
- Hémagglutination indirecte.
- Analyse en immunofluorescence indirecte.
- Analyse en radioimmunologie.
- Analyse ELISA (titrage immunoenzymatique utilisant un antigène adsorbé).
- Diagnostic par des techniques de biologie moléculaire.
- PCR, réaction en chaîne de polymérase, une technique prometteuse mais manque de sensibilité en raison d'une charge parasitaire souvent trop faible ou uniquement tissulaire.
Pronostic
Un indice pour l'évaluation du pronostic des patients qui ont la maladie de Chagas a été publié dans l'édition du du New England Journal of Medicine[40].
Basé sur l'étude de plus de 500 patients, cet indice inclut des aspects cliniques, radiographique, électrocardiographiques, échocardiographique et des résultats d’enregistrement Holter et permet d'évaluer le pronostic de survie à dix ans des patients.
| Facteur de risques | points |
|---|---|
| classe NYHA III ou IV | 5 |
| Cardiomégalie | 5 |
| Anomalies de mobilité de la paroi | 3 |
| Tachycardie ventriculaire non-soutenue | 3 |
| Bas voltage de l’ECG | 2 |
| Sexe masculin | 2 |
| Nombre total de points | Risque de mort dans les dix ans |
|---|---|
| 0-6 | 10 % |
| 7-11 | 40 % |
| 12-20 | 85 % |
Traitement
Les médicaments utilisés pour traiter la maladie de Chagas ne sont habituellement efficaces que s’ils sont administrés pendant la phase aiguë de l'infection. Les molécules de choix sont l’azole ou les dérivés nitrés comme le benznidazole[41] ou le nifurtimox (un nouveau protocole thérapeutique est en cours d'investigation par le service pharmacologique du CDC), mais des résistances à ces molécules ont déjà été rapportées[42].
En outre, ces substances sont très toxiques et ont de nombreux effets secondaires, et ne peuvent pas être administrés sans surveillance médicale. L'agent antifongique nommé amphotéricine B a été proposé comme traitement de deuxième intention, mais le coût et la toxicité relativement élevée de cette molécule ont limité son utilisation. D'ailleurs, une étude sur l'administration prolongée de drogues pendant dix ans au Brésil a indiqué que la chimiothérapie courante ne supprimait pas totalement la parasitémie[43].
Ainsi, la décision d’administrer une thérapie antiparasitaire devrait être individualisée après consultation avec un spécialiste.
Dans la phase chronique, le traitement a pour but de contrôler les manifestations cliniques de la maladie, par exemple : drogues pour stimuler le cœur, pour éviter la défaillance cardiaque et les troubles du rythme, traitement chirurgical pour le mégacôlon, etc., mais la maladie elle-même n'est pas curable dans cette phase. Les manifestations cardiaques chroniques provoquées par la maladie de Chagas sont maintenant une indication courante de transplantation cardiaque. Jusqu’à récemment, cependant, la maladie de Chagas était considérée comme une contre-indication à la transplantation, puisque les lésions cardiaques pouvaient récidiver lorsque le parasite saisirait pour se développer l'opportunité fournie par le traitement immunosuppresseur qui suit l’intervention chirurgicale. La recherche qui a changé l’indication de la transplantation pour les patients atteints de la maladie de Chagas a été conduite par l’équipe du Dr Adib Jatene à l’institut du cœur de l'université de São Paulo, au Brésil[44].
La recherche a montré que les taux de survie chez les patients atteints de maladie de Chagas pouvaient être sensiblement améliorés en utilisant des doses plus faibles d'immunosuppresseur ciclosporine. Récemment, la transplantation de moelle osseuse et l’injection dans le muscle cardiaque de cellules souches s’est montrée efficace pour réduire nettement les risques d'arrêt cardiaque chez les patients atteints de Chagas[45].
Des patients ont également tiré des bénéfices de la prévention stricte de la réinfection, bien que la raison de ce phénomène ne soit pas encore clairement élucidée.
Quelques exemples de la lutte pour des avancées thérapeutiques :
- l’utilisation des inhibiteurs de l’oxydosqualène cyclase et des inhibiteurs de protéases à cystéine s'est avérée efficace pour traiter les infections expérimentales chez les animaux[46] ;
- les Dermaseptines provenant d’une grenouille de l’espèce Phyllomedusa oreades et P. distincta. Activité Anti-Trypanosoma cruzi sans cytotoxicité pour les cellules de mammifères[47] ;
- synthèse d’inhibiteurs des enzymes impliquées dans le métabolisme de la trypanothione qui est propre au groupe des parasites flagellés[48] ;
- le déshydroleucodine sesquiterpène lactone (DhL) affecte la croissance des cultures d’epimastigotes de Trypanosoma cruzi[49].
- le génome de Trypanosoma cruzi a été séquencé[50].
Des protéines qui sont produites par la maladie mais pas par des humains ont été identifiées comme cibles possibles pour des médicaments contre la maladie[50].
Prévention
Contrôle du vecteur

La prévention est basée sur la lutte contre le vecteur (Triatoma) en utilisant des aérosols et des peintures contenant des insecticides (pyréthrinoïdes de synthèse), et en améliorant le logement et les conditions sanitaires dans les zones rurales. Pour les habitants des villes, il peut être dangereux de passer des vacances et de camper en plein air, dans les zones désertiques ou de dormir dans des hôtels ou des maisons en pisé dans des zones d’endémie, une moustiquaire est recommandée. Si le voyageur a l'intention de voyager dans une zone à risque il devrait pouvoir obtenir une information sur les zones d’endémie de la maladie de Chagas dans des bulletins de renseignements pour les voyageurs, tels que les CDC.
Dans la plupart des pays où la maladie de Chagas est endémique, les tests sanguins sont déjà obligatoires pour les donneurs de sang, puisque la transfusion peut être une voie importante de transmission.
Dans le passé, le sang des donneurs était mélangé à 0,25 g L−1 de violet de gentiane pour mettre en évidence les parasites.
Avec toutes ces mesures, quelques résultats ont été atteints dans le combat contre la maladie de Chagas en Amérique latine : une réduction de 72 % de l'incidence de l'infection humaine chez les enfants et de jeunes adultes des pays de l'initiative du cône méridional, et au moins deux pays (l’Uruguay, en 1997, et le Chili, en 1999), ont été déclarés exempts de toute transmission par un vecteur et par transfusion. Au Brésil, où vit la plus grande partie de la population exposée au risque, 10 États sur les 12 au stade endémique ont été également déclarés exempts de la maladie.
Quelques points de repère pour le contrôle du vecteur :
- Un piège à levure a été testé pour surveiller les infestations par certaines espèces d’insectes : « Efficacité des pièges à levure avec Triatoma sordida, Triatoma brasiliensis, Triatoma pseudomaculata, et Panstrongylus megistus dans des essais en laboratoire »[51]
- Des résultats prometteurs ont été obtenus avec le traitement des habitats du vecteur avec le champignon Beauveria bassiana, (qui est également en cours d’évaluation pour la prévention du paludisme) : « Activité d’une préparation d’huile de Beauveria bassiana contre le Triatoma sordida dans des zones péridomestiques au centre du Brésil. » [52]
- Ciblage du symbiote des Triatominae[53].
Recherche vaccinale
Il n'existe pas de vaccins disponibles contre la maladie de Chagas. La recherche de vaccins efficaces s'est d'abord porté vers des vaccins inactivés (parasites tués par des moyens physico-chimiques) avec l'idée de cibler des antigènes à tous les stades du parasite, puis sur des vaccins vivants (parasites atténués ou plus ou moins génétiquement modifiés), et des vaccins utilisant des protozoaires similaires à T. cruzi, mais non pathogènes pour l'humain[54].
Ces études menées sur des modèles souris, chien, et primate non-humain, ont pu montrer un certain degré d'efficacité, mais elles sont difficilement comparables, difficiles à évaluer et extrapoler à l'homme, et elles n'ont pas dépassé le stade préclinique[55].
Plus récemment des vaccins potentiels (vivants atténués, par ADN recombinant, par protéines recombinantes, par vecteur viral...) sont étudiés par plusieurs groupes de recherche. Les premiers résultats sur les modèles animaux sont encourageants, mais de nombreux problèmes restent à résoudre (comme la durée de protection ou son efficacité sur la diversité des souches de parasites). En 2021, seuls deux candidats-vaccins (un vivant atténué, et un à protéines recombinantes) pourraient progresser vers les phases 2 et 3 des essais cliniques[55].
Les analyses économiques montrent qu'un vaccin, même d'une faible efficacité de 25 % contre la maladie de Chagas, pourrait rester avantageux en termes de coût-efficacité pour réduire la transmission congénitale au cours de la grossesse. La maladie de Chagas reste une des plus négligée des maladies tropicales négligées, et un défi demeure : le besoin de volonté politique et d'investissement économique[55].
Notes et références
- (en) Kenneth F. Kiple (dir.) et Marvin J. Allison, The Cambridge World History of Human Disease, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), chap. VIII.25 (« Chagas' Disease »), p. 636-638.
- Guhl F, Jaramillo C, Vallejo GA, Yockteng R, Cárdenas-Arroyo F, Fornaciari G, Arriaza B, Aufderheide AC. Isolation of Trypanosoma cruzi DNA in 4,000-year-old mummified human tissue from northern Chile, Am J Phys Anthropol, 1999;108:401–407
- Arthur C. Aufderheide, Wilmar Salo, Michael Madden et John Streitz, « A 9,000-year record of Chagas' disease », Proceedings of the National Academy of Sciences of the United States of America, vol. 101, no 7, , p. 2034–2039 (ISSN 0027-8424, PMID 14766963, DOI 10.1073/pnas.0307312101, lire en ligne, consulté le )
- Dietmar Steverding, « The history of Chagas disease », Parasites & Vectors, vol. 7, , p. 317 (ISSN 1756-3305, PMID 25011546, PMCID 4105117, DOI 10.1186/1756-3305-7-317, lire en ligne, consulté le )
- R. E. Bernstein, « Darwin's illness: Chagas' disease resurgens », Journal of the Royal Society of Medicine, vol. 77, no 7, , p. 608–609 (ISSN 0141-0768, PMID 6431091, PMCID 1439957, DOI 10.1177/014107688407700715, lire en ligne, consulté le )
- (en) Adler D, « Darwin's Illness », Isr J Med Sci, vol. 25, no 4, , p. 218-21 (PMID 2496051).
- Matthias Perleth, « The Discovery of Chagas' disease and the formation of the early Chagas' disease concept », History and Philosophy of the Life Sciences, vol. 19, no 2, , p. 211–236 (ISSN 0391-9714, lire en ligne, consulté le )
- Chen Chao, José L. Leone et Carlos A. Vigliano, « Chagas disease: Historic perspective », Biochimica Et Biophysica Acta. Molecular Basis of Disease, vol. 1866, no 5, , p. 165689 (ISSN 1879-260X, PMID 32001300, DOI 10.1016/j.bbadis.2020.165689, lire en ligne, consulté le )
- (en) C. Chagas, « Neue Trypanosomen », Vorläufige Mitteilung. Arch. Schiff. Tropenhyg., vol. 13, , p. 120-122.
- (en) Chagas C, « Nova tripanozomiase humana : Estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem [New human trypanosomiasis. Studies about the morphology and life-cycle of Schizotripanum cruzi, etiological agent of a new morbid entity of man] », Mem Inst Oswaldo Cruz, vol. 1, no 2, , p. 159-218.
- Dominique Lecourt (dir.) et François Delaporte, Dictionnaire de la pensée médicale, Paris, Quadrige / PUF, , 1270 p. (ISBN 2 13 053960 2), p. 1163-1167.Article Trypanosomiase américaine : Maladie de Chagas
- Simone Petraglia Kropf et Nísia Trindade Lima, « The history of Chagas disease: reflections on science in action », Memorias Do Instituto Oswaldo Cruz, vol. 117, , e200372 (ISSN 1678-8060, PMID 35584507, PMCID 9113750, DOI 10.1590/0074-02760200372, lire en ligne, consulté le )
- (en) « Chagas disease », sur www.who.int (consulté le )
- (en) Kirchhoff LV. « American trypanosomiasis (Chagas disease) --a tropical disease now in the United States » N Engl J Med. 1993 Aug 26;329(9):639-44. Online..
- (en) Karsten V, Davis C, Kuhn R. « Trypanosoma cruzi in wild raccoons and opossums in North Carolina » J Parasitol. 1992 Jun;78(3):547-9. .
- (en) Centers for Disease Control (CDC). « American Trypanosomyasis Fact Sheet » Consulté le 24 septembre 2006.
- (en) WHO. Chagas. Consulté le 24 septembre 2006.
- (en) Grijalva MJ, Palomeque-Rodriguez FS, Costales JA. et al. « High household infestation rates by synanthropic vectors of Chagas disease in southern Ecuador » J Med Entomol. 2005 Jan;42(1):68-74. .
- (en) Teixeira AR, Monteiro PS, Rebelo JM. et al. « Emerging Chagas Disease : Trophic Network and Cycle of Transmission of Trypanosoma cruzi from Palm Trees in the Amazon » Emerg Infect Dis. 2001 Jan-Feb ; 7(1):100-12. PDF full text..
- « Emergence de la maladie de Chagas en Guyane française : évaluation en 2005 et perspectives », sur vie-publique.fr,
- (en) K.M. Bonney, « Chagas disease in the 21st Century : a public health success or an emerging threat? », Parasite, vol. 21, no 11, (PMID 24626257, DOI 10.1051/parasite/2014012, lire en ligne [PDF]).
- (en) J. Gascon, C. Bern et M.-J. Pinazo, « Chagas disease in Spain, the United States and other non-endemic countries », Acta Trop, vol. 115, , p. 22–27 (lire en ligne [PDF]).
- SPF, « L'émergence de la trypanosomose humaine américaine (maladie de Chagas) se confirme en France métropolitaine. Numéro thématique. Santé des voyageurs et des expatriés », sur www.santepubliquefrance.fr (consulté le )
- SPF, « Maladie de Chagas en France : estimation du nombre de personnes infectées et d'atteintes cardiaques en 2009, selon les groupes à risque », sur www.santepubliquefrance.fr (consulté le )
- SPF, « Maladie de Chagas et risque transfusionnel en France. Journées de veille sanitaire, Paris, 29 et 30 novembre 2007 », sur www.santepubliquefrance.fr (consulté le )
- Jean-François Pays, « Maladie de Chagas : quand y penser en France ? », La Revue du Praticien, vol. 63, , p. 913-918.
- E. Pilly, Maladies Infectieuses et Tropicales, Alinéa Plus, (ISBN 978-2-916641-66-9), chap. 111 (« Trypanosomoses humaines »), p. 533-534.
- Jean-François Pays, « Chagas a-t-il vraiment découvert la maladie de Chagas ? », La Revue du Praticien, vol. 50, , p. 1053-1056.
- il s'agit du médecin argentin Cecilio Romaña (en) (1899-1997).
- (en) Marin-Neto JA, Cunha-Neto E, Maciel BC, Simões MV, « Pathogenesis of chronic Chagas heart disease » Circulation 2007;115:1109–1123
- (en) C.W. Pissetti, D. Correia, R.F. de Oliveira et al., « Genetic and functional role of TNF-alpha in the development Trypanosoma cruzi infection », PLoS Negl Trop Dis, vol. 5, , e976 (DOI 10.1371/journal.pntd.0000976).
- (en) Torres OA, Calzada JE, Beraún Y, Morillo CA, González A, González CI, Martín J, « Role of the IFNG +874T/A polymorphism in Chagas disease in a Colombian population » Infect Genet Evol. 2010;10:682–685. .
- (en) Sabino EC, Ribeiro AL, Salemi VMC. et al. « Ten-year incidence of Chagas cardiomyopathy among asymptomatic Trypanosoma cruzi-seropositive blood donors » Circulation 2013;127:1105–1115. .
- (en) Santos Ferreira C, Amato Neto V, Gakiya E. et al. « Microwave treatment of human milk to prevent transmission of Chagas disease » Rev Inst Med Trop São Paulo. 2003 Jan-Feb;45(1):41-2. .
- (en) L. Hudson et M.J. Turner, « Immunological Conséquences of Infection and Vaccination in South American Trypanosomiasis [and Discussion] », Phil. Trans. R. Soc. B, vol. 307, no 1131, , p. 51-61 (DOI 10.1098/rstb.1984.0108).
- (en) Rassi A Jr, Rassi A, Marin-Neto JA, « Chagas disease » Lancet 2010;375:1388–1402 .
- (en) Shikanai-Yasuda MA, Marcondes CB, Guedes LA. et al. « Possible oral transmission of acute Chagas disease in Brazil » Rev Inst Med Trop São Paulo. 1991 Sep-Oct;33(5):351-7. .
- (en) da Silva Valente S, de Costa Valente V, Neto H. « Considerations on the epidemiology and transmission of Chagas disease in the Brazilian Amazon » Mem Inst Oswaldo Cruz 1999;94 Suppl 1: 395-8. .
- (en) UK Health Protection Agency (HPA). Chagas’ disease (American trypanosomiasis) in southern Brazil. Consulté le 24 septembre 2006.
- .
- (en) Garcia S, Ramos CO, Senra JF, et al. « Treatment with benznidazole during the chronic phase of experimental Chagas disease decreases cardiac alterations » Antimicrob Agents Chemother. 2005 Apr;49(4):1521-8. Online.
- (en) Buckner FS, Wilson AJ, White TC, Van Voorhis WC. « Induction of resistance to azole drugs in Trypanosoma cruzi » Antimicrob Agents Chemother. 1998 Dec;42(12):3245-50. Online.
- (en) Lauria-Pires L, Braga MS, Vexenat AC, et al. « Progressive chronic Chagas heart disease ten years after treatment with anti-Trypanosoma cruzi nitroderivatives » Am J Trop Med Hyg. 2000 Sep-Oct;63(3-4):111-8. PDF Full text.
- (en) Bocchi EA, Bellotti G, Mocelin AO, Uip D, et al. « Heart transplantation for chronic Chagas' heart disease » Ann Thorac Surg. 1996 Jun;61(6):1727-33. Résumé en ligne.
- (pt) Vilas-Boas F, Feitosa GS, Soares MB, Mota A, et al. « [Early results of bone marrow cell transplantation to the myocardium of patients with heart failure due to Chagas disease] » Arq Bras Cardiol. 2006 Aug;87(2):159-66. PDF Full text. Accessible également ici..
- (en) Engel JC, Doyle PS, Hsieh I, McKerrow JH. « Cysteine protease inhibitors cure an experimental Trypanosoma cruzi infection » J Exp Med. 1998 Aug 17;188(4):725-34. Résumé en ligne..
- G.D. Brand, J.R.S.A. Leite, L.P. Silva et al., « Dermaseptins from Phyllomedusa oreades and Phyllomedusa distincta. Anti-Trypanosoma cruzi activity without cytotoxicity to mammalian cells », J Biol Chem, (DOI 10.1074/jbc.M209289200).
- (en) Fairlamb AH, Cerami A. « Metabolism and functions of trypanothione in the Kinetoplastida » Annu Rev Microbiol. 1992;46:695-729. .
- (en) Brengio SD, Belmonte SA, Guerreiro E, et al. « The sesquiterpene lactone dehydroleucodine (DhL) affects the growth of cultured epimastigotes of Trypanosoma cruzi » J Parasitol. 2000 Apr;86(2):407-12. .
- (en) El-Sayed NM, Myler PJ, Bartholomeu DC, et al. (2005). « The genome sequence of Trypanosoma cruzi, etiologic agent of Chagas disease » Science 309 (5733): 409-15. .
- (en) Pires HH, Lazzari CR, Diotaiuti L, Lorenzo MG. « Performance of yeast-baited traps with Triatoma sordida, Triatoma brasiliensis, Triatoma pseudomaculata, and Panstrongylus megistus in laboratory assays » Rev Panam Salud Publica. 2000 Jun;7(6):384-8. .
- (en) Luz C, Rocha LF, Nery GV, Magalhaes BP, Tigano MS. « Activity of oil-formulated Beauveria bassiana against Triatoma sordida in peridomestic areas in Central Brazil » Mem Inst Oswaldo Cruz. 2004 Mar;99(2):211-8. En ligne..
- (en) Recherche PubMed au sujet de la symbiose aux Triatominae.
- (en) Expedito José de Albuquerque Luna et Sérgio Roberto de Souza Leão da Costa Campos, « Vaccine development against neglected tropical diseases », Cadernos de Saúde Pública, vol. 36, (ISSN 0102-311X et 1678-4464, DOI 10.1590/0102-311X00215720, lire en ligne, consulté le )
- (en) Eric Dumonteil et Claudia Herrera, « The Case for the Development of a Chagas Disease Vaccine: Why? How? When? », Tropical Medicine and Infectious Disease, vol. 6, no 1, , p. 16 (ISSN 2414-6366, DOI 10.3390/tropicalmed6010016, lire en ligne, consulté le )
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Chagas disease » (voir la liste des auteurs).
Voir aussi
Liens externes
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Lutte microbiologique dans la maladie de Chagas - Hyphomycètes contre vecteurs Film réalisé par Hervé Lièvre, production SFRS (CERIMES) - vidéo en ligne, 1990, 21 minutes.
- Dans l'Ombre du tiroir - Éco-épidémiologie de la maladie de Chagas Film réalisé par Lionel Legros, production SFRS(CERIMES)/Fondation Nicolas hulot - vidéo en ligne, 1998, 27 minutes.