« Pic vert » : différence entre les versions
+ section Vol |
+ sections Comportement social et Soin du plumage |
||
| Ligne 207 : | Ligne 207 : | ||
Le Pic vert affiche un taux de succès reproducteur assez élevé, comme c'est typiquement le cas pour les oiseaux nichant dans des cavités. En règle générale, un couple peut mener jusqu'à l'envol deux à cinq jeunes, voire six ou sept<ref>{{harvsp|id=GOR|Gorman|2023|p=124}}.</ref>. L'étude des archives du BTO, qui porte sur {{Unité|252|nids}}, montre un taux d'éclosion de 86,8 % et un taux de jeunes à l'envol de 95,3 %<ref name="GB94" />. L'échec d'une nichée peut tenir à un événement météo, à la prédation ou au déplacement forcé par un autre cavernicole, comme l'[[Étourneau sansonnet]], ou l'[[Écureuil gris]] en [[Grande-Bretagne]], où il est [[Espèce envahissante|envahissant]]<ref>{{Article|auteur1=Stuart E. Newson|auteur2=David I. Leech|auteur3=Chris M. Hewson|auteur4=Humphrey Q. P. Crick|auteur5=Phil V. Grice|titre=Potential impact of grey squirrels ''Sciurus carolinensis'' on woodland bird populations in England|périodique= Journal of Ornithology|année=2010|volume=151|passage=211-218|langue=en|doi=10.1007/s10336-009-0445-8}}</ref>. Le Pic vert peut aussi être dérangé par l'être humain<ref>{{harvsp|id=GOR|Gorman|2023|p=125}}.</ref>. |
Le Pic vert affiche un taux de succès reproducteur assez élevé, comme c'est typiquement le cas pour les oiseaux nichant dans des cavités. En règle générale, un couple peut mener jusqu'à l'envol deux à cinq jeunes, voire six ou sept<ref>{{harvsp|id=GOR|Gorman|2023|p=124}}.</ref>. L'étude des archives du BTO, qui porte sur {{Unité|252|nids}}, montre un taux d'éclosion de 86,8 % et un taux de jeunes à l'envol de 95,3 %<ref name="GB94" />. L'échec d'une nichée peut tenir à un événement météo, à la prédation ou au déplacement forcé par un autre cavernicole, comme l'[[Étourneau sansonnet]], ou l'[[Écureuil gris]] en [[Grande-Bretagne]], où il est [[Espèce envahissante|envahissant]]<ref>{{Article|auteur1=Stuart E. Newson|auteur2=David I. Leech|auteur3=Chris M. Hewson|auteur4=Humphrey Q. P. Crick|auteur5=Phil V. Grice|titre=Potential impact of grey squirrels ''Sciurus carolinensis'' on woodland bird populations in England|périodique= Journal of Ornithology|année=2010|volume=151|passage=211-218|langue=en|doi=10.1007/s10336-009-0445-8}}</ref>. Le Pic vert peut aussi être dérangé par l'être humain<ref>{{harvsp|id=GOR|Gorman|2023|p=125}}.</ref>. |
||
=== Comportement social === |
|||
Comme la plupart des pics, le Pic vert n'est pas [[Grégarisme|grégaire]], mais solitaire. Il tolère assez peu la présence d'autres Pics verts. Il ne se rassemble pas en troupes et ne forme pas de dortoirs. Il ne cherche pas sa nourriture à plusieurs et le fait même assez rarement en couple<ref>{{harvsp|id=GOR|Gorman|2023|p=94}}.</ref>. Il tend au contraire à protéger ses ressources (arbres avec des loges pour dormir ou sources abondantes de fourmis) contre ses [[conspécifique]]s. En cas de dispute, les confrontations se font généralement mâle contre mâle et femelle contre femelle. En cas de confrontation d'un sexe contre l'autre, le mâle est systématiquement dominant. La défense du domaine vital passe rarement par un affrontement physique : le plus souvent, les deux individus adoptent une série de comportements stéréotypés, comme hocher la tête ou ouvrir et remuer les ailes. Ces comportements peuvent être repris lors des parades nuptiales<ref>{{harvsp|id=GOR|Gorman|2023|p=96}}.</ref>. |
|||
Bien qu'ils occupent volontiers les parcs, jardins et cimetières, les Pics verts restent des oiseaux assez discrets et farouches. Ils sont difficiles à approcher par l'homme et s'envolent facilement<ref>{{harvsp|id=GOR|Gorman|2023|p=98}}.</ref>. |
|||
=== Soin du plumage === |
|||
[[Fichier:Woodpecker in bath (48011842957).jpg|vignette|Pic vert femelle en train de prendre son bain, en Pologne.]] |
|||
Comme tous les oiseaux, le Pic vert consacre une partie importante de la journée à sa [[toilettage|toilette]] : à l'aide de son bec, il stimule sa [[glande uropygienne]], puis se lisse les plumes pour arranger son plumage et enlever la poussière et une partie de ses [[ectoparasite]]s. Une séance de toilette consiste typiquement à s'ébrouer, à hérisser ses plumes, avant de les peigner individuellement avec son bec. Le Pic vert est capable de se contorsionner pour atteindre les plumes en haut du dos. Il ne pratique pas le toilettage mutuel (''{{langue|en|allopreening}}'') avec un autre individu<ref>{{harvsp|id=GOR|Gorman|2023|p=100}}.</ref>. |
|||
Le Pic vert pratique régulièrement les bains de soleil, le plus souvent sur un perchoir, mais parfois aussi au sol. Il s'oriente généralement face au soleil puis hérisse les plumes de sa calotte, ouvre le bec et étale les plumes des ailes et de la queue. Il peut lui arriver de somnoler pendant quelques minutes<ref>{{Article|langue=de|auteur1=Josef Reichholf|titre=Sich-Sonnen beim Grünspecht ''Picus viridis''|périodique=Ornithologische Mitteilungen|volume=532|année=2001|passage=50-52}}.</ref>. Les raisons pour lesquelles plusieurs espèces d'oiseaux pratiquent ces bains ne sont pas connues avec certitude : absorption ou évacuation de la chaleur, élimination des parasites du plumage, production de [[vitamine D]], simple plaisir<ref>{{Article|langue=en|auteur1=R. J. Kennedy|titre=Sunbathing behaviour of birds|périodique=British Birds|volume=62|numéro=7|année=1969|mois=juillet|passage=249-258|lire en ligne=http://britishbirds.co.uk/wp-content/uploads/article_files/V62/V62_N07/V62_N07_P249_258_A055.pdf}}.</ref> ? |
|||
Le Pic vert prend également d'autres bains : de poussière, d'eau, mais aussi [[Bain de fourmis|de fourmis]]<ref>{{harvsp|id=GOR|Gorman|2023|p=102}}.</ref>. Le Pic vert pratique le formicage à la fois passif et actif. Dans le premier cas, il s'assied parmi les insectes et les laisse envahir son plumage, en se contentant d'écarter les plumes des ailes et de la queue pour faciliter la montée des fourmis. Dans le second cas, il prélève une ou plusieurs fourmis avec son bec et se toilette vigoureusement avec. Dans les deux cas, l'objectif est de forcer les fourmis à émettre de l'[[acide formique]], mais comme pour les bains de soleil, la cause n'est pas connue avec certitude : élimination des parasites, toilettage du plumage, facilitation de la mue ou [[auto-stimulation]] ? Une autre hypothèse est que le Pic vert force les fourmis à émettre leur acide pour les rendre ensuite plus comestibles<ref>{{Article|langue=en|auteur1=Olivia P. Judson|auteur2=Andrew T. D. Bennett|titre=‘Anting’ as food preparation: formic acid is worse on an empty stomach|périodique=Behavioral Ecology and Sociobiology|année=1992|mois=décembre|volume=31|passage=437-439|doi=10.1007/BF00170611}}.</ref>. Aucune de ces explications ne fait l'objet d'un consensus<ref>{{Article|langue=en|auteur1=N. S. Morozov|titre=Why do birds practice anting?|périodique=Biology Bulletin Reviews|volume=5|passage=353-365|année=2015|doi=10.1134/S2079086415040076}}.</ref>. |
|||
== Répartition et habitat == |
== Répartition et habitat == |
||
Version du 12 novembre 2023 à 20:39
Picus viridis
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Classe | Aves |
| Ordre | Piciformes |
| Famille | Picidae |
| Genre | Picus |
Le Pic vert (Picus viridis), connu aussi sous le nom vernaculaire de pivert[1], est une espèce d'oiseaux appartenant à l'ordre des Piciformes de la famille des Picidae. Il est commun à très commun dans son aire de répartition, qui couvre l'ensemble de l'Europe occidentale (excepté l'Irlande), de l'Atlantique jusqu'à la Volga, en Russie.
Comme son nom l'indique, il est majoritairement vert, avec le croupion jaune. Il porte une calotte rouge, avec une face noir striée de blanc, ainsi qu'une moustache rouge cernée de noir chez le mâle ou toute noire chez la femelle. Il se reconnaît à son vol ondulant et à son cri, un long ricanement sonore. Il ne se confond guère qu'avec le Pic de Sharpe, parfois considéré comme une sous-espèce, qui le remplace dans la péninsule ibérique, en Languedoc-Roussillon et au Pays basque, ainsi qu'avec le Pic cendré, un peu plus petit.
Le Pic vert affectionne les milieux semi-ouverts : forêt extensive, bocages, mais aussi parcs et jardins. On le trouve du littoral jusqu'à la forêt subalpine. Il niche dans des feuillus (chêne, hêtre, marronnier, etc.) où le mâle creuse une loge en hauteur. La femelle pond quatre à six œufs blancs, couvés par les deux parents alternativement.
Le Pic vert se trouve souvent au sol, où il cherche sa nourriture, essentiellement des fourmis.
Dénomination, taxonomie et systématique
Noms et étymologie
Le nom binominal du Pic vert, Picus viridis est une traduction littérale de son nom en latin. Le mot picus désignait déjà le Pic vert chez les Romains. Il ne possède pas d'étymologie claire[2].
La plupart des langues de son aire de répartition le nomment également comme un pic de couleur verte : Grünspecht en allemand, Πράσινος Δρυοκολάπτης en grec moderne, Picchio verde en italien, Groene Specht en néerlandais, Ghionoaie verde en roumain, par exemple. En Espagne, où se trouve son proche cousin le Pic de Sharpe, il est le « Pic euroasiatique » (Pito euroasiático)[3].
En anglais, il est également le Pic vert (Green Woodpecker), un nom qu'on trouve déjà dans la Chronique anglo-saxonne, mais il possède une vaste collection de noms vernaculaires plus ou moins anciens, souvent très locaux. Le plus souvent, il est celui qui tape sur le bois ou qui le creuse : wood hack, wood knacker, wood speck, etc. Dans le comté de Northumberland, il est celui qui creuse les trous : hew hole, avec de nombreuses variantes comme highaw ou ickwall. On y refère aussi souvent comme l'oiseau qui apporte la pluie (rain bird). De nos jours, le nom vernaculaire le plus fréquent en anglais est yaffle, mot d'origine onomatopéique qui se réfère à son « rire »[4]. Plus récemment, l'ONG Birdlife International et le Handbook of the Birds of the World ont opté pour le nom Eurasian Green Woodpecker ou « Pic vert d'Eurasie », pour le distinguer d'autres pics verts dans le monde.
Taxonomie
L'espèce Picus viridis a été décrite initialement par le naturaliste suédois Carl von Linné en [5].

Suivant les travaux phylogénique de Pons et al. (2011) et Perktas et al. (2011), le Congrès ornithologique international sépare l'ancienne sous-espèce Picus viridis sharpei du Pic vert (Picus viridis) et l'élève au rang d'espèce. Il devient le Pic de Sharpe (Picus sharpei).
D'après la classification de référence (version 3.5, 2013) du Congrès ornithologique international, cette espèce est constituée des trois sous-espèces suivantes (ordre phylogénique) :
- Picus viridis viridis Linnaeus, 1758 ; présente dans le nord et le centre de l'Europe ;
- Picus viridis karelini Brandt, 1841 ; présente du sud-est de l'Europe au sud-ouest du Turkménistan ;
- Picus viridis innominatus (Zarudny & Loudon, 1905) ; présente dans le sud-ouest de l'Iran.
Le Pic de Levaillant (Picus vaillantii) et le Pic de Sharpe (Picus sharpei) ont longtemps été considérés comme des sous-espèces, mais sont maintenant considérés comme des espèces à part entière. Il a aussi été suggeré que P. v. innominatus, sous-espèce très isolée des autres populations, pourrait elle aussi être une espèce à part entière.
Au nord de la chaîne pyrénéenne existe une zone à l'intérieur de laquelle on trouve des individus présentant des caractères hybrides de plumage et génétique entre Picus v. viridis et Picus sharpei. En Occitanie, cette zone s'étend approximativement entre Béziers et Nîmes[6]. Dans cette zone, on rencontre également des P. viridis et des P. sharpei ; ces derniers sont de plus en plus rares au fur et à mesure que l'on s'éloigne des Pyrénées (et inversement pour le Pic vert).
Description
Dimensions
Le Pic vert est le deuxième plus grand pic dans son aire de répartition, derrière le Pic noir qui est 50 % plus gros[7].
| Dimension | Moyenne | Min. | Max. |
|---|---|---|---|
| Longueur (de la pointe du bec à l'extrémité de la queue) | 32 cm | 30 cm | 36 cm |
| Longueur de l'aile | 16,3 cm | Mâles : 15,8 cm Femelles : 15,9 cm |
Mâles : 17,2 cm Femelles : 16,9 cm |
| Envergure | 41 cm | 40 cm | 46 cm |
| Longueur de la queue | 10 cm | 9,4 cm | 10,6 cm |
| Longueur du bec | 4,5 cm | 4 cm | 5,3 cm |
| Poids | 190 g | 138 g | 220 g |
Apparence extérieure
Le Pic vert a le dessus vert, le croupion jaune et le dessous gris-vert. Les deux sexes possèdent une calotte rouge, souvent striée de gris. Le pourtour des yeux et les joues sont noires. Les couvertures parotiques, les côtés de la nuque et du cou sont gris, parfois teintés de verdâtre[7].
Le Pic vert arbore un léger dimorphisme sexuel : le mâle possède une moustache noire cernée de rouge, tandis que celle de la femelle est toute noire[9]. Les jeunes se distinguent facilement des adultes jusqu'à la première mue, à la fin de l'été ou en automne : ils sont abondamment tachetés de gris clair sur le manteau, le dos, les scapulaires et les couvertures alaires[10]. Ils ne possèdent pas le masque facial noir des adultes[10].
-
Femelle.
-
Femelle (à gauche) et son jeune (à droite).
-
Détail de la tête d'un mâle
Anatomie
Le Pic vert possède le bec droit, en ciseau, caractéristique des pics. Comparé aux autres pics, toutefois, son bec est relativement long, avec un culmen légèrement recourbé, moins adapté au tambourinage, mais plus apte au creusage du sol, pour chercher sa nourriture. Les narines sont longues et étroites, recouvertes par des plumes sétiformes (plumes réduites au rachis) qui les protègent contre la poussière et les petits copeaux produits quand il creuse le bois[11].

Comme tous les pics, le Pic vert arbore des griffes puissantes, très recourbées, à l'extrémité de doigts courts et écailleux. Ses muscles postérieurs développés lui offrent une poigne solide pour grimper le long des troncs et s'agripper aux branches[12]. La disposition de ses doigts — deuxième et troisième doigts vers l'avant, pouce et quatrième doigt vers l'arrière — est qualifiée de zygodactylie. Elle se retrouve non seulement chez les pics, mais aussi chez les perroquets (Psittaciformes), les chouettes et hiboux (Strigiformes) et les coucous (Cuculiformes). Un tel arrrangement, évolué depuis l'anisodactylie des oiseaux percheurs, est optimal non pas pour grimper, mais pour s'agripper[13],[14].
Les pics présentent aussi la particularité d'avoir une langue particulièrement longue et protractile, c'est-à-dire qu'ils peuvent l'allonger hors de leurs becs. Celle du Pic vert est plus longue, plus plate et plus large que celles des espèces plus arboricoles : elle mesure en moyenne 13 cm de long et peut s'étendre de 10 cm environ hors du bec. Cette langue est équipée de pointes, mais moins que les autres pics qui s'en servent pour harponner des larves foreuses du bois. Elle est également collante : une glande salivaire particulièrement développée, située sous et derrière la boîte crânienne, la recouvre d'un mucus visqueux pour mieux attraper les fourmis et autres proies[15].
Les pics terrestres ont pour catactéristique un os hyoïde long et flexible : il part de la base de la mandibule vers l'arrière, puis se divise en deux branches, passant de chaque côté de l'occiput, s'étendant au-dessus du crâne pour revenir s'unir sous le front. Quand il est poussé vers l'avant, l'os hyoïde étend la langue hors du bec et contribue à contrôler ses mouvements, ce qui permet au Pic vert de l'insérer dans des ouvertures étroites telles que les galeries des fourmillières[16],[17].
Mue

Le Pic vert pratique une mue partielle, c'est-à-dire qu'il ne renouvelle pas tout son plumage chaque année : il conserve une partie des couvertures primaires et secondaires. La mue commence en mai-juin, une fois que les jeunes se sont envolés, et dure jusqu'en novembre[18].
Chaque aile compte dix rémiges primaires et onze à douze secondaires. P6 et P5 sont habituellement les plus longues. La primaire la plus externe, P10, est courte chez les adultes, mais plus longue et plus large (jusqu'à 30 %) chez les juvéniles[19]. Les primaires muent dans l'ordre ascendant à partir de la primaire la plus interne, P1. La mue des rémiges secondaires se produit à partir de deux foyers : elle est ascendante à partir de S1 et ascendante et descendante à partir de S8[18].
La queue comporte douze rectrices renforcées, car elles servent de support quand le Pic vert grimpe le long des troncs. Les deux plumes centrales sont les plus longues et robustes ; elles sont muées en dernier[20]. En numérotant R1 les deux plumes centrales, la mue se produit par paire à partir de R2 jusqu'à R6, avant de terminer par R1[18].
La mue post-juvénile est plus compliquée. Elle commence alors que les juvéniles sont encore au nid, en mai ou juin suivant l'endroit, et dure jusqu'à l'automne. Ils renouvellent les primaires et rectrices, ainsi que les couvertures et la plupart des plumes du corps[21]. En revanche, ils conservent le plus souvent les secondaires, les couvertures internes, et la plupart des couvertures primaires et tertiaires. Cette mue a été décrite comme « à l'économie », car il est probable qu'elle ait pour but de gagner du temps et de conserver de l'énergie[22].
Vol
En vol, le Pic vert présente une silhouette assez robuste, en tonneau, avec un arrière assez court et un cou assez long. La tête est assez grosse, avec un bec long et pointu. Vu de dessous, le Pic a des ailes très larges, plutôt courtes et arrondies. La queue est en forme de losange, avec une encoche[23].
Son vol est direct et puissant. Dès que la distance est un peu longue, le Pic vert adopte un vol ondulé caractéristique, alternant une phase battue où il prend de l'altitude et une phase non-battue où il descend. Il lui arrive également de planer, sur courte distance, en tenant les ailes un peu basses[23].
Confusions possibles
Une observation rapide du Pic vert en vol peut donner lieu à une confusion avec la femelle ou le juvénile du Loriot d'Europe, qui est jaunâtre et a également un vol rapide et ondulé entre les arbres[7].
Le Pic vert peut être confondu avec le Pic de Sharpe, son proche cousin, parfois considéré comme une sous-espèce, qui le remplace dans les Pyrénées et la péninsule Ibérique. Le Pic de Sharpe se différencie du Pic vert par la couleur grise et non noire de sa zone oculaire, ses moustaches peu marquées, ainsi que par des sous-caudales non rayées[6].
Le Pic cendré ressemble également beaucoup au Pic vert. Il s'en distingue par un bec plus court et plus fin et par une tête plutôt grise, avec seulement d’étroits traits loraux et une moustache noirs, sans rouge à la nuque ni noir autour de l'œil. En vol, son croupion est plus terne et moins jaune que chez le Pic vert.
Comportement
Territoire et domaine vital
Le territoire est l'espace défendu par un animal, entre autres contre ses conspécifiques, tandis que le domaine vital est celui dans lequel il recherche sa nourriture, se reproduit et élève ses petits[24] Le Pic vert adopte un comportement territorial à proximité immédiate de son nid, mais il ne possède pas de territoire bien défini[25]. Son domaine vital a été estimé par plusieurs études. En Angleterre, le suivi d'un couple équipé de radio-émetteurs a montré que le mâle couvrait 151 hectares, contre 15 hectares pour la femelle[26]. En Allemagne, trois individus équipés de radio-émetteurs ont été suivis : une femelle et deux mâles. Le domaine vital de la femelle a été de 24,8 hectares durant la période de reproduction, mais de 127,9 hectares deux mois après l'envol des jeunes. Celui d'un mâle s'est élevé à 53 hectares, dont 18 seulement utilisés pour la recherche de nourriture. Le troisième individu, également un mâle, a eu un domaine vital de 25,8 hectares[27]. En Norvège, à la limite nord de l'aire de répartition du Pic vert, son domaine vital a été estimé à 100 hectares[28]. Il semble donc que la superficie du domaine vital dépende des ressources disponibles[25].
Alimentation
Régime alimentaire

Le Pic vert cherche essentiellement sa nourriture au sol et possède un régime alimentaire assez étroit. Comme le Pic noir, le Pic cendré, le Pic de Sharpe et le Torcol fourmilier, il se nourrit principalement de fourmis. Quand elles sont abondantes, elles constituent quasiment sa seule nourriture[29],[30].
L'analyse d'estomacs de Pics verts a montré que les fourmis pouvaient être consommées par millions[31]. Comme tous les insectivores, les Pics verts produisent des fientes dures qui contiennent les restes chitineux indigestes de leurs proies. Les leurs sont de forme cylindrique, recouvertes d'une membrane grisâtre, et sont constituées quasi-exclusivement de fourmis[32].
Les Pics verts attrapent les fourmis directement au sol ou creusent les fourmilières, qu'elles soient à dôme ou sous terre. Ils les consomment à tous les stades de développement, de l'œuf à l'adulte, qu'il s'agisse d'ouvrières ou de reines[33],[30]. Les genres Formica, Myrmica et Lasius constituent la base de leur alimentation. Une étude britannique portant sur un couple de Pics verts équipés de radio-émetteurs pendant la saison de reproduction a montré qu'ils favorisaient les pâturages de moutons et les pelouses de jardins, où ils cherchaient Lasius flavus, la fourmi jaune, dans l'herbe courte[26]. Dans le Brabant-Septentrional, aux Pays-Bas, l'analyse des fientes de jeunes au nid et d'adultes montre une prédominance de Lasius niger, la fourmi noire des jardins, chez les Pics verts vivant dans les milieux semi-ouverts, tandis que les oiseaux vivant dans la forêt consommaient plutôt Lasius platythorax et avaient un régime plus diversifié[34].
La disponibilité des fourmis joue de fait un rôle crucial dans la distribution, la population et le succès reproducteur du Pic vert[35]. Lors d'hivers rigoureux, quand le sol est gelé, les Pics verts peuvent se tourner vers l'intérieur des bois, plus chaud, pour fouiller les fourmilières dans les troncs d'arbre en décomposition. Ils visitent aussi davantage les fourmilières forestières, protégées de la neige par le couvert des arbres. Une étude a montré que la fourmi rousse des bois, Formica rufa, peut jouer un rôle crucial en hiver[36]. En Europe continentale, les Pics verts peuvent chercher aussi les fourmis charpentières (espèces du genre Camponotus)[35].
D'autres invertébrés figurent également au menu des Pics verts, en particulier ceux qui vivent dans le sol : vers de terre, larves de coléoptères, chenilles, guêpes et abeilles à différents stades de développement. Ils se nourrissent également d'araignées prélevées sur leur toile[37]. L'étude de fientes de Pics verts néerlandais a montré que ces autres invertébrés pouvaient représenter une part substantielle de leur alimentation en hiver, quand les fourmis ouvrières s'enterrent très profondément. La punaise des chatons du bouleau (Kleidocerys resedae) formait ainsi 31 % du contenu des fientes analysées[34].
Les Pics verts se nourrissent occasionnellement de végétaux : baies, graines et fruits abattus par le vent, comme les pommes, les poires, les cerises et le raisin[35]. Un Pic vert a été observé dans un jardin anglais en train de manger la chair de pommes tombées au sol, en laissant de côté la peau et les pépins[38].
Techniques de chasse

Les Pics verts sont capables de se souvenir de sources de nourriture abondantes, comme les colonies de fourmis. Pour ce faire, ils utilisent principalement leur sens de la vue[39]. Une étude menée en Norvège suggère qu'ils se fient à des repères structurels du paysage quand ils choisissent leur zone de chasse, ce qui peut les conduire à passer à côté d'autres zones riches en fourmis[28]. Ils peuvent chasser toute la journée, de l'aube au crépuscule. Ils cherchent leurs proies essentiellement au sol, de préférence dans des pelouses à l'herbe courte, pâturées ou tontes. Ils délaissent les zones dont la végétation est trop haute et dense ou dont la terre est trop compacte[30],[26]. Ils fouillent aussi les arbres, les buissons, les lits de rivière asséchés, les falaises, les carrières, les murs en briques et les toits. Ils peuvent chercher des insectes dans les bouses de vache, sur les champignons, dans les toiles d'araignée ou les feuilles mortes[40].
Les Pics verts chassent en utilisant uniquement leur bec, dont ils se servent comme levier pour casser des mottes d'herbe ou soulever l'écorce, comme pelle pour creuser le sol ou le bois mort, et comme balai pour disperser les feuilles mortes. Ils utilisent également leur longue langue pour détecter les proies qu'ils ne peuvent pas voir[41] et pour inspecter les endroits trop étroits pour leur bec.
Quand ils trouvent une source de fourmis abondante, les Pics verts y forent plusieurs trous coniques, typiquement de 5 à 10 cm de diamètre et de 10 à 60 cm de profondeur[42], qu'ils inspectent ensuite par rotation pendant plusieurs jours, voire semaines de suite[43]. Ils fouillent ces trous en entrant la tête ou la partie avant du corps, mais rarement le corps entier. L'inspection de chaque trou reste relativement courte, apparemment parce que le Pic vert ne supporte qu'un temps limité les attaques des fourmis qui défendent leur fourmilière : il observe souvent des pauses pour se gratter avec les pattes ou avec le bec, pour ébouriffer son plumage, voire s'éloigne un peu pour se toiletter[44].
En hiver, quand le sol est gelé ou que la neige est trop épaisse, les Pics verts peuvent se tourner vers des surfaces verticales pour chercher leur nourriture : falaises, murs en pierre, carrières et même bâtiments[43],[33]. Ainsi, ils ont été observés l'hiver, en Hongrie, en train de fouiller des murs et des toits de maisons, d'immeubles, d'hôtels et une base militaire en ruines : ces endroits restaient largement dépourvus de neige. En outre, les Pics verts y recherchaient leur nourriture le plus souvent l'après-midi, probablement parce que l'activité des invertébrés est plus importante aux heures les moins froides[37]. Sur les bâtiments, les Pics verts fouillent aussi les gouttières, les avant-toits et les toitures en chaume[45].
Des Pics verts ont été observés à plusieurs reprises en train de fracturer des ruches pour se nourrir des abeilles à l'intérieur, mais aussi des rayons de miel. Ce comportement semble appris et localisé. Les attaques de ruches se produisent le plus souvent en hiver, sans doute parce que les autres sources de nourriture se font plus rares ou difficiles à exploiter[46].
Chant
Le Pic vert picasse[47] et peupleute (peupleute ou pleupeute[48]). Les deux sexes ont un cri d'appel très sonore, semblable à un rire « Kiakiakiakia-kiakiakiak » crescendo puis décrescendo. Ce « rire » a également un rôle de manifestation territoriale. Lorsqu'il se déplace en vol, ou lorsqu'il est surpris et dérangé, il pousse un « kuk-ku-kuk... kuk-kuk... ku... » bien typique.
Bien qu'on l'entende moins souvent tambouriner que d'autres espèces de pics, le Pic vert pratique également le tambourinage pour communiquer. Le son produit est généralement plus sourd et grave que chez les autres pics car l'oiseau frappe souvent directement sur le tronc de l'arbre et non sur une branche plus fine produisant un son plus clair comme c'est le cas par exemple du Pic épeiche ou du Pic épeichette. Le tambourinage du Pic vert reste rarement entendu mais cela peut être dû aux sonorités de basses fréquences qui sont moins facilement détectables par l'oreille humaine en milieu forestier bruyant, surtout lorsque d'autres espèces de pics tambourinent également.
Reproduction
Le Pic vert se reproduit à partir de sa deuxième année calendaire. Il est monogame et la copulation hors-couple est rare[25].
Parades nuptiales
Si le temps est suffisamment clément, les parades nuptiales peuvent commencer dès la fin de l'hiver, le plus souvent à proximité d'une cavité susceptible de servir de loge. Assez simples, elles consistent en appels répétés, poursuites aériennes, révérences et touchers de bec. La copulation se passe sur une branche horizontale ou au sol. Le mâle apporte de la nourriture en guide d'offrande, tout en hochant la tête de manière répétée. Quand elle est prête, la femelle se penche vers le sol dans une attitude prostrée, tout en poussant de petits cris. Le mâle la monte ensuite pour le baiser cloacal[49].
Nidification

Les pics se distinguent de la plupart des autres oiseaux en ce qu'ils creusent leur nid dans les arbres, d'où leur nom. Cette cavité, qualifiée de « loge », comporte typiquement une entrée de même diamètre que le corps du pic et un couloir assez court qui débouche sur une chambre plus grande[50]. Même s'il passe le plus clair de son temps au sol, pour chercher sa nourriture, le Pic vert n'y fait pas exception. Il commence à creuser sa loge au printemps, généralement en mars ou avril. Il commence par pratiquer plusieurs cavités, dont certaines sont terminées et d'autres non. L'une d'entre elles est retenue pour pondre, tandis que d'autres peuvent servent pour dormir.
Les travaux de creusement durent entre quinze et trente jours[51]. Les deux sexes contribuent au creusement de la loge de nidification, le mâle se chargeant de la plus grande part des gros travaux[52]. Il arrive que le Pic vert réutilise une loge à succès, qui a déjà mené une nichée à l'envol, parfois pendant plusieurs années. La réutilisation pourrait être liée au manque de sites propices[53].
Les critères de choix de l'emplacement ne sont pas connus avec certitude. En règle générale, les Pics verts sont fidèles à leur site de nidification : les nouveaux trous sont souvent voisins des anciens, parfois dans le même arbre[54]. L'examen de 146 nids en France, dans le bassin de l'Adour, a montré que 72 % étaient situés dans des arbres sains et 28 % dans des arbres non sains[55]. Néanmoins, il est difficile pour un humain d'évaluer l'état sanitaire d'un arbre. Il semble que les pics en général, Pic vert compris, préfèrent les arbres d'apparence saine, mais pourris à l'intérieur et donc plus faciles à creuser[56].
Les Pics verts ne sont pas inféodés à une essence d'arbre particulière. Dans l'étude pyrénéenne précédemment citée, ils ont utilisé treize essences, les plus fréquemment retenus étant le chêne, le hêtre et le peuplier[55]. Une étude réalisée dans le parc national Danube-Auen, en Autriche, montre qu'ils tendent à éviter les peupliers hybrides euraméricains et les saules, sans doute en raison du caractère moins favorable des habitats humides[57].
La loge est généralement située sur le tronc principal d'un grand arbre, sous la canopée, avec une ligne de vol dégagée. Dans l'étude du bassin de l'Adour, 86,8 % des 197 nids examinés étaient situés sur le tronc et 13,2 % sur les branches[55]. En Hongrie, 100 % des 33 nids documentés étaient situés sur le tronc[58]. Le diamètre moyen du tronc ou de la branche abritant la loge a été mesuré à 39,4 cm dans une étude portant sur quatre nids britanniques[59] et à 43,1 cm dans l'étude hongroise[58].
Le trou d'entrée se situe le plus souvent entre 2 et 6 m de hauteur[60]. Dans l'étude hongroise, le mode était de 5 m et la moyenne de 5,6 m[58]. En règle générale, le trou d'entrée mesure entre 5 et 7 cm de diamètre. Un examen des archives du British Trust for Ornithology (BTO) de 1939 à 1989 montre un diamètre moyen de 5,3 cm[59]. La plupart des trous d'entrée sont circulaires, mais ils peuvent aussi être légèrement ovales : sur les 33 loges de l'étude hongroise, 28 possédaient un trou circulaire, quatre un trou ovale verticalement et un trou ovale horizontalement[58]. Les dimensions de la chambre de nidification sont également variables : la largeur typique se situe entre 15 et 20 cm. L'étude des archives du BTO rapporte des profondeurs entre 20 et 107 cm, avec une moyenne de 38,1 cm[59].
L'orientation du trou d'entrée n'est pas laissée au hasard[61]. Sous les latitudes septentrionales, il est orienté entre le sud-ouest et le sud-est, parce que ces directions assurent un meilleur ensoleillement et une exposition réduite aux vents froids[62]. D'autres facteurs entrent également en ligne de compte : si le terrain n'est pas plat, les trous font généralement face à la pente, peut-être pour avoir une vue plus dégagée[63]. Si l'arbre dans lequel est creusée la loge est isolé, le trou d'entrée a plus de chances de faire face au nord que s'il appartient à une forêt, peut-être pour éviter une surchauffe au soleil[63].
Incubation

Le Pic vert ne pond qu'une seule fois par an, mais il peut renouveler sa ponte si elle a été détruite avant l'éclosion[25]. La ponte se fait au rythme d'un œuf par jour, directement contre le bois. Le Pic vert n'apporte pas de matériau extérieur dans sa loge, mais la poussière et les copeaux liés à l'excavation peuvent constituer un rembourrage de quelques centimètres. La ponte peut démarrer dès la fin des travaux, le plus souvent fin avril ou début mai. Sa date exacte est fonction de la latitude et des températures des mois précédents : des hivers très froids, avec des printemps en retard, peuvent décaler la date de ponte[64].
La ponte compte généralement 5 à 7 œufs, avec de rares extrêmes allant de 3 à 11[64]. blancs, couvés par les deux parents pendant une quinzaine de jours. L'étude de 49 nichées en Hongrie a montré une ponte de 3 œufs, deux de 4 œufs, quinze de 5 œufs, onze de 6 œufs, 17 de 7 œufs et trois de 8 œufs, soit une moyenne de 6 œufs par ponte[65].
Les œufs sont ellipsoïdaux et mesurent en moyenne 30 à 33 mm sur le grand axe et 21 à 25 mm sur le petit axe. Ils pèsent typiquement 9 g. Ils sont de couleur blanche, brillants et sans tache[66]. Au sein d'une ponte, un, voire deux œufs peuvent être visiblement plus petits que les autres[67].
L'incubation commence quand la ponte est terminée ou quand la femelle a pondu son avant-dernier œuf et dure 15 à 20 jours. Elle est assurée par les deux sexes à tour de rôle, par quarts de 1,5 à 2,5 heures. Comme c'est le cas pour la plupart des pics, le mâle assure souvent l'incubation nocturne[66].
Jeunes au nid

Les œufs d'un même nid éclosent les uns après les autres. Une nichée peut donc comprendre des oisillons à un stade de développement assez différent[66]. Les coquilles d'œuf et les œufs non éclos sont évacués par les parents[68].
Comme tous les pics, les jeunes Pics verts à l'éclosion sont nidicoles et altriciaux : ils sont nus et aveugles. Ils doivent se blottir les uns contre les autres pour se tenir chaud et sont complètement dépendants de leurs parents, qui les couvrent pendant leurs premiers jours. Les jeunes développent rapidement un bourrelet de couleur claire à la commissure du bec, qui sert à guider les parents dans l'obscurité de la loge[66].
Les deux parents apportent à leurs jeunes de la nourriture régurgitée — des invertébrés réduits en bouillie – qu'ils commencent par leur fourrer dans le gosier. Par la suite, ils déposent la nourriture dans leur bec[33],[69]. Quand les jeunes sont encore petits, les parents entrent dans la loge pour les nourrir. À ce stade, les jeunes réclament uniquement quand leurs parents arrivent. Par la suite, ils réclament constamment. Après environ dix jours, les jeunes commencent à grimper l'intérieur de la loge et à sortir la tête par le trou d'entrée pour réclamer[70]. Les membres de la fratrie se bousculent pour être les mieux placés et quémandent agressivement, au point de donner des coups de bec à leurs parents quand ils arrivent, ce qui incite ces derniers à espacer leurs visites progressivement[71].
Pendant les premiers jours, les parents assurent l'hygiène du nid en évacuant ou en mangeant les sacs fécaux[72]. Ils y renoncent par la suite, peut-être à cause du manque de place dans l'intérieur de la loge ou parce que les fientes sont devenues trop grosses. Le temps que les jeunes s'envolent, le plancher de la loge est devenu couvert de fientes et de restes de nourriture[70].
Après quelque temps, les parents cessent de nourrir leurs jeunes à l'entrée de la loge. Ils se perchent dans les branches avoisinantes, parfois dans un arbre voisin, en émettant de petits cris pour inciter les jeunes à quitter la loge. Les conditions de vie dans la loge, devenue sale et bondée, peuvent aussi contribuer à la décision des jeunes[72]. Une fois les jeunes dehors, les parents se les répartissent et s'occupent chacun d'un groupe pendant une durée qui va jusqu'à sept semaines[68].
Succès reproducteur
Le Pic vert affiche un taux de succès reproducteur assez élevé, comme c'est typiquement le cas pour les oiseaux nichant dans des cavités. En règle générale, un couple peut mener jusqu'à l'envol deux à cinq jeunes, voire six ou sept[73]. L'étude des archives du BTO, qui porte sur 252 nids, montre un taux d'éclosion de 86,8 % et un taux de jeunes à l'envol de 95,3 %[59]. L'échec d'une nichée peut tenir à un événement météo, à la prédation ou au déplacement forcé par un autre cavernicole, comme l'Étourneau sansonnet, ou l'Écureuil gris en Grande-Bretagne, où il est envahissant[74]. Le Pic vert peut aussi être dérangé par l'être humain[75].
Comportement social
Comme la plupart des pics, le Pic vert n'est pas grégaire, mais solitaire. Il tolère assez peu la présence d'autres Pics verts. Il ne se rassemble pas en troupes et ne forme pas de dortoirs. Il ne cherche pas sa nourriture à plusieurs et le fait même assez rarement en couple[76]. Il tend au contraire à protéger ses ressources (arbres avec des loges pour dormir ou sources abondantes de fourmis) contre ses conspécifiques. En cas de dispute, les confrontations se font généralement mâle contre mâle et femelle contre femelle. En cas de confrontation d'un sexe contre l'autre, le mâle est systématiquement dominant. La défense du domaine vital passe rarement par un affrontement physique : le plus souvent, les deux individus adoptent une série de comportements stéréotypés, comme hocher la tête ou ouvrir et remuer les ailes. Ces comportements peuvent être repris lors des parades nuptiales[77].
Bien qu'ils occupent volontiers les parcs, jardins et cimetières, les Pics verts restent des oiseaux assez discrets et farouches. Ils sont difficiles à approcher par l'homme et s'envolent facilement[78].
Soin du plumage

Comme tous les oiseaux, le Pic vert consacre une partie importante de la journée à sa toilette : à l'aide de son bec, il stimule sa glande uropygienne, puis se lisse les plumes pour arranger son plumage et enlever la poussière et une partie de ses ectoparasites. Une séance de toilette consiste typiquement à s'ébrouer, à hérisser ses plumes, avant de les peigner individuellement avec son bec. Le Pic vert est capable de se contorsionner pour atteindre les plumes en haut du dos. Il ne pratique pas le toilettage mutuel (allopreening) avec un autre individu[79].
Le Pic vert pratique régulièrement les bains de soleil, le plus souvent sur un perchoir, mais parfois aussi au sol. Il s'oriente généralement face au soleil puis hérisse les plumes de sa calotte, ouvre le bec et étale les plumes des ailes et de la queue. Il peut lui arriver de somnoler pendant quelques minutes[80]. Les raisons pour lesquelles plusieurs espèces d'oiseaux pratiquent ces bains ne sont pas connues avec certitude : absorption ou évacuation de la chaleur, élimination des parasites du plumage, production de vitamine D, simple plaisir[81] ?
Le Pic vert prend également d'autres bains : de poussière, d'eau, mais aussi de fourmis[82]. Le Pic vert pratique le formicage à la fois passif et actif. Dans le premier cas, il s'assied parmi les insectes et les laisse envahir son plumage, en se contentant d'écarter les plumes des ailes et de la queue pour faciliter la montée des fourmis. Dans le second cas, il prélève une ou plusieurs fourmis avec son bec et se toilette vigoureusement avec. Dans les deux cas, l'objectif est de forcer les fourmis à émettre de l'acide formique, mais comme pour les bains de soleil, la cause n'est pas connue avec certitude : élimination des parasites, toilettage du plumage, facilitation de la mue ou auto-stimulation ? Une autre hypothèse est que le Pic vert force les fourmis à émettre leur acide pour les rendre ensuite plus comestibles[83]. Aucune de ces explications ne fait l'objet d'un consensus[84].
Répartition et habitat
Répartition

Ce pic peuple une grande partie de l'Europe. Son aire de répartition va de la Grande-Bretagne et le sud de la Scandinavie. Son aire de répartition va de la Grande-Bretagne (jusqu'au sud de l'Écosse) à l'ouest jusqu'en Russie d'Europe, au Caucase et à la mer Caspienne à l'est. Elle s'étend au nord jusqu'au sud de la Norvège et de la Suède et au sud à l'Italie, les Balkans et la Turquie. Des populations isolées se trouvent au nord-est de l'Irak et au sud-ouest de l'Iran. Sa présence au Turkménistan est sujette à caution : il n'y a été observé que dans le Kopet-Dag, à la frontière avec l'Iran et le dernier signalement remonte au début des années 1990[85].
Le Pic vert ne niche pas en Finlande ni dans les petites îles de la mer Baltique. Il n'est pas non plus présent dans les îles de la mer Méditerranée, de la mer Adriatique, de la mer Égée ni de la mer Ionienne. Il est tout aussi absent des îles Anglo-Normandes et de l'Irlande. Des individus erratiques peuvent toutefois être observés dans ces régions[85].
Habitat

Le Pic vert a besoin, pour nicher, de boisements de feuillus ouverts et matures et, pour se nourrir, d'herbages courts pâturés ou fauchés[86].
Le Pic vert favorise les forêts et bois feuillus ou mixtes. Même en Norvège, où les conifères prédominent, les Pics verts se rencontrent plus souvent dans les forêts mixtes, où les feuillus sont majoritaires[87]. Ils préfèrent généralement les arbres à bois tendre, plus faciles à creuser, sans pour autant éviter les arbres à bois dur. Ils apprécient également les parcs arborés, les boisements semi-artificiels avec des clairières, les jeunes plantations peu denses à proximité d'herbages et les terres agricoles avec des bosquets et des haies d'arbres[88].
À l'instar de son proche cousin, le Pic de Sharpe, le Pic vert est le moins forestier des pics. Il a besoin de milieux ouverts couverts d'herbe, où les fourmis abondent : prés, pâturages, prairies, landes, jusqu'aux espaces herbeux des dunes et des milieux littoraux[88]. Il s'est bien adapté aux nouvelles surfaces herbeuses créées par l'homme : pâturages permanents en milieu agricole, gazons en milieu résidentiel. L'usage massif d'insecticides lui est très défavorable[60] et inversement, la présence de zones non traitées peut être vitale pour lui[88].
La plupart des Pics verts se trouvent à faible altitude : ils ne dépassent guère 1 200 m d'altitude, mais on en trouve aussi dans des zones montagneuses, comme les Alpes, les Balkans, les Carpathes ou les monts Zagros[89]. Dans ces régions, ils préfèrent généralement les boisements plus chauds, sur le versant sud, avec à proximité des prairies, des clairières ou des couloirs d'avalanche[90]. Sa nidification a été prouvée à 2 120 m dans le Valais, en Suisse[33] et à 3 000 m dans le Caucase[91].
Le Pic vert devient de plus en plus synanthrope, c'est-à-dire qu'il se rapproche des humains : il est désormais souvent présent dans les parcs, jardins, cimetières, golfs et terrains de sport, jusqu'au cœur des villes. En région parisienne, par exemple, il est présent dans le cimetière de Bagneux et celui de Pantin, ainsi que dans les bois et les forêts du Grand Paris[92]. S'il est décrit comme « nicheur possible » vers 1970 au square des Batignolles[93], il s'est vraisemblablement installé dans Paris intra-muros au début du XXe siècle. Il se trouve au parc Montsouris, au parc des Buttes-Chaumont, au parc de Bercy, au Jardin des plantes au Jardin du Luxembourg et au cimetière du Père-Lachaise, tous dotés de pelouses avec de vieux arbres. Le Pic vert niche également dans l'Inner London et dans les centre-villes de Berlin et de Varsovie[92].
Effectifs
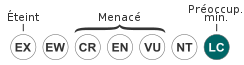
L'Europe concentre près de 95 % de la population mondiale de Pics verts, qui est estimée entre 1,24 et 2,23 millions d'individus adultes[94]. Sa tendance est stable, sauf dans les pays Baltes, la Biélorussie et l'Ukraine, où elle est en déclin[91]. L'importance de ses effectifs et sa tendance stable entraînent son classement en espèce de préoccupation mineure par l'UICN. Le tableau ci-dessous fournit les effectifs et leur tendance dans tous les pays européens où le Pic vert est documenté quantitativement, sur la base des données de BirdLife International en 2015. La qualité des données est décrite comme suit :
- bonne : bon état de connaissance — donnée quantitative fiable disponible pour l'ensemble du pays et sur toute la période ;
- moyenne : état de connaissance moyen — données à disposition médiocres, périmées ou incomplètes ;
- mauvaise : état de connaissance médiocre – peu connu, sans donnée quantitative disponible.
| Pays/Territoire | Nombre de couples | Tendance depuis 2000 | Qualité des données |
|---|---|---|---|
| Albanie | 1 000-1 500 | -10–20 % | mauvaise |
| Allemagne | 42 000-76 000 | +42-77 % | bonne |
| Andorre | 50-100 | ? | moyenne |
| Arménie | 300-600 | ? | moyenne |
| Autriche | 16 000-26 000 | stable | moyenne |
| Azerbaïdjan | 2 000-8 000 | ? | mauvaise |
| Belgique | 7 900-10 200 | stable | moyenne |
| Biélorussie | 18 000-24 000 | stable | moyenne |
| Bosnie-Herzégovine | 5 000-8 000 | ? | mauvaise |
| Bulgarie | 2 400-4 200 | stable | moyenne |
| Croatie | 8 000-9 000 | ? | mauvaise |
| Danemark | 5 000 | -60 % | moyenne |
| Estonie | 20-50 | -50-70 % | moyenne |
| France | 200 000-350 000 | stable | moyenne |
| Géorgie | présent | ? | ? |
| Grèce | 5 000-10 000 | ? | mauvaise |
| Hongrie | 8 300-11 400 | ? | moyenne |
| Italie | 60 000-120 000 | +70-80 % | moyenne |
| Kosovo | 1 200-2 000 | ? | moyenne |
| Lettonie | 34 360-71 160 | ? | moyenne |
| Liechtenstein | 30-40 | stable | moyenne |
| Lituanie | 400-800 | stable | moyenne |
| Luxembourg | 250-400 | fluctue (0-30 %) | moyenne |
| Macédoine du Nord | 2 500-10 000 | ? | mauvaise |
| Moldavie | 1-5 | fluctue | moyenne |
| Monténégro | 600-800 | ? | mauvaise |
| Norvège | 3 000-6 500 | ? | mauvaise |
| Pays-Bas | 9 314-11 384 | +29-86 % | moyenne |
| Pologne | 51 000-55 000 | -10–30 % | bonne |
| Roumanie | 60 000-120 000 | ? | mauvaise |
| Royaume-Uni | 47 000–58 000 | +18 % | moyenne |
| Russie | 30 000-70 000 | ? | mauvaise |
| Serbie | 7 500-11 000 | stable | moyenne |
| Slovaquie | 1 200-2 000 | stable | moyenne |
| Slovénie | 9 000-15 000 | -0-28 % | bonne |
| Suède | 10 000-18 000 | -19-41 % | moyenne |
| Suisse | 6 000-12 000 | stable | moyenne |
| Tchéquie | (9 000-18 000) | stable | moyenne |
| Turquie | (8 000-12 000) | stable | mauvaise |
| Ukraine | 500-800 | -5-10 % | mauvaise |
| Europe des 27 | 515 000-899 000 | en hausse | |
| Europe | 587 000-1 050 000 | en hausse |
Mouvements
Le Pic vert est sédentaire : il ne migre pas. La plupart des individus conservent le même domaine vital toute l'année. Une fois installés dans une zone répondant à leurs besoins, il est rare qu'ils déménagent. En revanche, ils peuvent quitter leur territoire de nidification en automne ou en hiver pour un territoire où la nourriture est abondante : jardins, vergers ou terres agricoles. Ils peuvent aussi effectuer des mouvements altitudinaux, c'est-à-dire descendre vers la plaine depuis un territoire montagneux, couvert par la neige en hiver[96].
La dispersion post-juvénile est elle aussi assez limitée : les jeunes, mis dehors par leurs parents à la fin de l'été, tendent à rester assez près de l'endroit où ils sont nés[97]. En Grande-Bretagne, la distance moyenne entre le baguage et la reprise est de 1 km pour les adultes et 3 km pour les jeunes, avec un record de 71 km durant l'hiver rigoureux de 1963[98]. En Norvège, les reprises se font dans un rayon de 20 km[99].
État des populations, pression et menaces
Comme tous les pics, le Pic vert a sans doute beaucoup souffert de la raréfaction des bois morts et arbres sénescents en forêt. Avec le Pic mar, il semble cependant moins sensible à l'offre « forestière » de bois mort et gros bois-mort. Il est menacé également par l'Homme à cause de la déforestation car les arbres sont son milieu de vie[100].
Notes et références
- Informations lexicographiques et étymologiques de « pivert » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- Alfred Ernout et Antoine Meillet, Dictionnaire étymologique de la langue latine, Klincksieck, (réimpr. 2001), p. 505-506.
- Winkler et Christie 2015, p. 18.
- Gorman 2023, p. 182-183.
- Linnaeus, C. 1758: Systema Naturae per regna tria naturæ, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis, Tomus I. Editio decima, reformata. Holmiæ: impensis direct. Laurentii Salvii. i–ii, 1–824 pp doi: 10.5962/bhl.title.542: page 113
- Georges Olioso et Jean-Marc Pons, « Variation géographique du plumage des pics verts du Languedoc-Roussillon », Ornithos, vol. 18, no 2, , p. 73-83.
- Gorman 2023, p. 18.
- Gorman 2023, p. 19.
- Gorman 2023, p. 21.
- Gorman 2023, p. 22.
- Gorman 2023, p. 9.
- Gorman 2023, p. 10.
- (en) Walter J. Bock et Waldron DeWitt Miller, « The scansorial foot of the woodpeckers, with comments on the evolution of perching and climbing feet in birds », American Museum Novitates, no 1931, .
- Gorman 2023, p. 13.
- Gorman 2023, p. 14.
- (en) Lester L. Short, « The Evolution of terrestrial Woodpeckers », American Museum Novitates, no 2467, .
- Gorman 2023, p. 15.
- (en) H. B. Ginn et D. S. Melville, Moult in Birds, British Trust for Ornithology, , p. 62.
- (de + en) Wilfried Hansen et Jürgen Synnatzschke, Die Steuerfedern der Vögel Mitteleuropas. The Tail Feathers of the Birds of Central Europe, Gütersloh, Verlagsgruppe Federfuehrer Publishers, .
- (en) Lukas Jenni et Raffael Winkler, The Biology of Moult in Birds, Londres, Helm, , p. 21.
- (de) Raffael Winkler, « Mauserumfang und Altersbestimmung von Spechten », Ornithologisches Informationsblatt der Schweizerischen Vogelwarte, Sempach, Vogelwarte, .
- (de) Hans-Heiner Bergmann, « Weiteres zur Jugendmauser der Spechte: Beispiel Grünspecht Picus viridis », Ornithologischer Anzeiger, vol. 57, nos 1-2, , p. 61-64.
- (en) Tomasz Cofta, Flight Identification of European Passerines and Select Landbirds : An Illustrated and Photographic Guide, Princeton, Princeton University Press, (ISBN 978-0-691-17757-1), p. 94-95.
- (en) William Henry Burt, « Territoriality and home range concepts as applied to mammals », Journal of Mammalogy, vol. 24, no 3, , p. 346–352 (DOI 10.2307/1374834).
- Gorman 2023, p. 115.
- (en) Daniel Alder et Stuart Marsden, « Characteristics of feeding-site selection by breeding Green Woodpeckers Picus viridis in a UK agricultural landscape », Bird Study, vol. 57, no 1, (DOI 10.1080/00063650903437511).
- (de + en) Karl Ruge, « Zur Größe und Struktur der Habitate des Grünspechts Picus viridis in Baden-Württemberg », Charadrius, vol. 53, nos 1–2, , p. 51-54.
- (en) Jørund Rolstad, Beate Løken et Erlend Rolstad, « Habitat selection as a hierarchical spatial process: the green woodpecker at the northern edge of its distribution range », Oecologia, vol. 124, , p. 116–129 (DOI doi.org/10.1007/s004420050031).
- (ro) I. Korodi Gal, « Contribuții la cunoașterea biologiei reproducerii și hranei puilor la ghionoaia verde (Picus viridis L.) », Muzeul Brukenthal. Studii și Comunicări. Științele Naturii, vol. 19, , p. 329-336.
- (de + en) Karl-Friedrich Raqué et Klaus Ruge, « Bedeutung von Ameisen fur die Ernährung von Griin- und Grauspecht, Picus viridis und Picus canus und die Auswirkung der Bewirtschaftung auf die Ameisenfauna », Tichodroma, vol. 12 (supplément 1), .
- Gorman 2023, p. 150.
- Roy Brown, John Ferguson, Michael Lawrence et David Lees (trad. Maxime Zucca), Traces et indices d'oiseaux. Pistes, nids, plumes, crânes, Lausanne et Paris, Delachaux et Niestlé, (réimpr. février 2018) (ISBN 978-2-603-02057-9), p. 135-136.
- Blume 1996.
- (en) J. Klosters, P. Wouters et W. de Veer, « Diet of the European Green Woodpecker Picus viridis in the Southern Netherlands », Limosa, vol. 87, no 2, , p. 74-81.
- Gorman 2023, p. 153.
- (en) G. J. de Bruyn, L. Goosen-De Roo, A.I.M. Hubregtse-van den Berg et H.R. Feijen, « Predation of Ants by Woodpeckers », Ekologia Polska, vol. 20, no 9, , p. 83-91.
- (en) Gerard Gorman et Daniel Alder, « Substrate influences foraging selection by Eurasian Green Woodpeckers Picus viridis in autumn and winter: observations in Hungary over a 20-year period », Ornis Hungarica, vol. 30, no 1, , p. 173-178 (DOI 10.2478/orhu-2022-0013).
- (en) M. Everett et E. Everett, « Green Woodpeckers feeding on apples », British Birds, vol. 112, , p. 48-49.
- Gorman 2023, p. 155.
- Gorman 2023, p. 157.
- (en) Walter J. Bock, « Functional and evolutionary morphology of woodpeckers », Ostrich. Journal of African Ornithology, vol. 70, no 1, (DOI 10.1080/00306525.1999.9639746).
- (en) Gerard Gorman, « Foraging signs and cavities of some European woodpeckers (Picidae): Identifying the clues that lead to establishing the presence of species », Denisia, vol. 36 (Neue Serie 164), , p. 97-97.
- (de) Hans Löhrl, « Zur Nahrungssuche von Grau- und Grünspecht (Picus canus, P. viridis) im Winterhalbjahr », Vogelwelt, vol. 98, , p. 15-22.
- Gorman 2023, p. 159.
- Gorman 2023, p. 163.
- Gorman 2023, p. 165.
- « picasser — Wiktionnaire », sur fr.wiktionary.org (consulté le )
- « Annexe:Animaux communs en français — Wiktionnaire », sur fr.wiktionary.org (consulté le )
- Gorman 2023, p. 116.
- Gorman 2023, p. 126.
- André Labitte, « Notes sur la biologie du Pic-vert Picus viridis », Alauda, vol. 21, , p. 165-178.
- Gorman 2023, p. 127.
- (en) Alastair J.K. Henderson et Andrew C.B. Henderson, « High and low Green Woodpecker nest holes », British Birds, vol. 95, , p. 88.
- Gorman 2023, p. 128.
- (fr + en) Jean Louis Grangé et Jean-Marc Fourcade, « Caractéristiques des arbres de nid de la guilde des Picidés des Pyrénées occidentales et des Landes », Alauda, vol. 87, no 4, , p. 267-282 (lire en ligne).
- Gorman 2023, p. 130.
- (de + en) Stefanie Riemer, « Siedlungsdichte und Habitatwahl des Grünspechts Picus viridis im Nationalpark Donauauen (Niederösterreich) », Vogelwarte, vol. 48, , p. 275-282 (lire en ligne).
- Gerald Gorman, « Attributes of Eurasian Green Woodpecker (Picus viridis) nest cavities in Hungary », Ornis Hungarica, vol. 28, no 2, , p. 204–211 (DOI 10.2478/orhu-2020-0025).
- (en) David E. Glue et Tim Boswell, « Comparative nesting ecology of the three British breeding woodpeckers », British Birds, vol. 87, , p. 253-259 (lire en ligne).
- (en) David E. Glue, « Green Woodpecker Picus viridis », dans James B. Reid, David W. Gibbons, Robert A. Chapman, The New Atlas of Breeding Birds in Britain and Ireland, 1988-1991, Londres, T. & A.D. Poyser, , p. 264-265.
- (en) Lukas Landler, Michelle A. Jusino, James Skelton et Jeffrey R. Walters, « Global trends in woodpecker cavity entrance orientation: latitudinal and continental effects suggest regional climate influence », Acta Ornithologica, vol. 49, no 2, , p. 257-266 (DOI 10.3161/173484714X687145).
- Gorman 2023, p. 134.
- (en) Ingvar Stenberg, « Nest site selection in six woodpecker species », Fauna Norvegica Series C, Cinclus, vol. 19, , p. 21-38.
- Gorman 2023, p. 117.
- (hu) László Haraszthy, Magyarország Fészkelő Madarainak Költésbiológiája, vol. 1, Csákvár, Pro Vértes, (ISBN 9786158009324), p. 839-841.
- Gorman 2023, p. 118.
- (hu) Béla Solti, « A Mátra Múzeum madártani gyűjteménye III. Németh Márton tojásgyűjtemény », Folia historico-naturalia Musei Matraensis, Supplementum 5, , p. 150-151 (lire en ligne).
- Gorman 2023, p. 122.
- Gorman 2023, p. 120.
- (en) N. Tracy, « Some notes on the nesting of the Green Woodpecker », British Birds, vol. 39, , p. 19–22 (lire en ligne).
- Gorman 2023, p. 121.
- (en) H.R. Tutt, « Nest-sanitation and fledging of the Green Woodpecker », British Birds, vol. 39, , p. 19–22 (lire en ligne).
- Gorman 2023, p. 124.
- (en) Stuart E. Newson, David I. Leech, Chris M. Hewson, Humphrey Q. P. Crick et Phil V. Grice, « Potential impact of grey squirrels Sciurus carolinensis on woodland bird populations in England », Journal of Ornithology, vol. 151, , p. 211-218 (DOI 10.1007/s10336-009-0445-8)
- Gorman 2023, p. 125.
- Gorman 2023, p. 94.
- Gorman 2023, p. 96.
- Gorman 2023, p. 98.
- Gorman 2023, p. 100.
- (de) Josef Reichholf, « Sich-Sonnen beim Grünspecht Picus viridis », Ornithologische Mitteilungen, vol. 532, , p. 50-52.
- (en) R. J. Kennedy, « Sunbathing behaviour of birds », British Birds, vol. 62, no 7, , p. 249-258 (lire en ligne).
- Gorman 2023, p. 102.
- (en) Olivia P. Judson et Andrew T. D. Bennett, « ‘Anting’ as food preparation: formic acid is worse on an empty stomach », Behavioral Ecology and Sociobiology, vol. 31, , p. 437-439 (DOI 10.1007/BF00170611).
- (en) N. S. Morozov, « Why do birds practice anting? », Biology Bulletin Reviews, vol. 5, , p. 353-365 (DOI 10.1134/S2079086415040076).
- Gorman 2023, p. 62.
- Gorman 2023, p. 83.
- (no) Ingvar Stenberg, « Grønspett Picus viridis », dans Jan Ove Gjershaug, Per Gustav Thingstad, Steinar Eldøy et Stein Byrkjeland, Norsk fugleatlas, Klæbu, Norsk Ornitologisk Forening, , p. 300.
- Gorman 2023, p. 84.
- Gorman 2023, p. 87.
- (en) Werner Weißmair et Norbert Pühringer, « Population density and habitat selection of woodpeckers in mountain forests of the Northern Limestone Alps (Austria) », Denisia, vol. 36 (Neue Serie 164), , p. 113-134 (lire en ligne).
- (en) Tomasz Wilk, « Picus viridis Eurasian Green Woodpecker », dans Verena Keller, Sergi Herrando, Petr Voříšek, Martí Franch, Marina Kipson, Pietro Milanesi, David Martí, Marc Anton, Alena Klvanová, Mikhail V. Kalyakin, Hans-Günther Bauer et Ruud P.B. Foppen, European breeding bird atlas, vol. 2. Distribution, abundance and change, Barcelone, Lynx Edicions, (ISBN 978-84-16728-38-1), p. 494-495.
- Frédéric Mahler, « Pic vert Picus viridis », dans Frédéric Mahler, Olivier Disson, Christian Gloria, Manuel Leick-Jonard, Maxime Zucca, Atlas des oiseaux nicheurs du Grand Paris 2015-1018, LPO-IDF, (ISBN 978-2-917791-23-3), p. 86-87.
- Frédéric Mahler, Guilhem Lesaffre, Maxime Zucca et Jacques Coatmeur, Oiseaux nicheurs de Paris. Un atlas urbain, Delachaux et Niestlé, (ISBN 978-2-603-01692-3), p. 62-63.
- Gorman 2023, p. 64.
- Birdlife International, « Picus viridis (Eurasian Green Woodpecker) European Red List of birds supplementary material », (consulté le ).
- (en) Pierandrea Brichetti et Giancarlo Fracasso, The Birds of Italy, vol. 2: Pteroclidae – Locustellidae, Belvedere (ISBN 9788889504635), p. 141-143.
- Gorman 2023, p. 107.
- (en) Dawn Balmer, Simon Gillings, Brian Caffrey, Bob Swann, Iain Downie et Rob Fuller, Bird Atlas 2007-11 : The Breeding and Wintering Birds of Britain and Ireland, Thetford, British Trust for Ornithology, (ISBN 978-1-908581-28-0).
- (no + en) Vidar Bakken, Olav Runde et Even Tjørve, Norsk ringmerkingsatlas, vol. 2, Museum Stavanger, (ISBN 8290054653).
- Pierre Mollet, Niklaus Zbinden et Hans Schmid (2009), « Steigende Bestandszahlen bei spechten und anderen Vogelarten dank Zunahme von Totholz ? [traduction : Est-ce que les effectifs de pics augmentent grâce à l'accroissement de la quantité de bois mort ?] », Schweiz. Z Forstwes., vol. 160, no 11, p. 334-340.
Annexes
Bibliographie
- (de) Dieter Blume, Schwarzspecht, Grauspecht, Grünspecht, Magdebourg, Westarp Wissenschaften, coll. « Die neue Brehm-Bücherei », , 2e éd. (1re éd. 1966) (ISBN 9783894324971).
- Philippe Clergeau et Patrick Chefson, Les Pics, Payot, coll. « Atlas visuels Payot », (ISBN 2-601-02220-5).
- (en) Gerard Gorman, Woodpeckers of Europe: a study of the European Picidae, Chalfont St Peter, Bruce Coleman Books, (ISBN 1-872842-05-4).
- (en) Gerard Gorman, Woodpeckers of the world: the complete guide, Londres, Christopher Helm, (ISBN 978-1-4081-4715-3).
- (en) Gerard Gorman, Woodpecker, Reaktion Books, coll. « Animal », (ISBN 978-1-78023-829-6).
- (en) Gerard Gorman, Woodpeckers, Bloomsbury Wildlife, coll. « RSPB Spotlight », (ISBN 978-1-4729-5118-2).
- (en) Gerard Gorman, The Green Woodpecker. A natural and cultural History of Picus viridis, Londres, Pelagic Publishing, coll. « Pelagic monographs », (ISBN 978-1-78427-436-8).
- (en) U. Perktas, G.F. Barrowclough et J.G. Groth, « Phylogeography and species limits in the green woodpecker complex (Aves: Picidae): multiple Pleistocene refugia and range expansion across Europe and the Near East », Biological Journal of the Linnean Society, vol. 104, , p. 710-723.
- (en) J.-M. Pons, G. Olioso, C. Cruaud et J. Fuchs, « Phylogeography of the Eurasian green woodpecker (Picus viridis) », J. Biogeogr., vol. 38, , p. 311-325.
- (en) Hans Winkler et David Christie, « Eurasian Green Woodpecker (Picus viridis), version 1.0 », dans J. del Hoyo, A. Elliott, J. Sargatal, D.A. Christie et E. de Juana (eds.), Birds of the World, Barcelone, Lynx Edicions, (DOI 10.2173/bow.eugwoo2.01)
Liens externes
- Ressources relatives au vivant :
- Animal Diversity Web
- Avibase
- BioLib
- BirdFacts
- BirdLife International
- Dyntaxa
- EPPO Global Database
- EU-nomen
- Fauna Europaea
- Paleobiology Database
- Global Biodiversity Information Facility
- iNaturalist
- Interim Register of Marine and Nonmarine Genera
- Internet Bird Collection
- Nálezová databáze ochrany přírody
- NBN Atlas
- Nederlands Soortenregister
- Oiseaux.net
- Système d'information taxonomique intégré
- TAXREF (INPN)
- Union internationale pour la conservation de la nature
- Xeno-canto
- ZooBank
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) Référence Congrès ornithologique international : Picus viridis dans l'ordre Piciformes
- (fr + en) Référence Avibase : Picus viridis (+ répartition)
- (en) Référence NCBI : Picus viridis (taxons inclus)
- (en) Référence UICN : espèce Picus viridis Linnaeus, 1758 (consulté le )
- (fr) Référence Oiseaux.net : Picus viridis (+ répartition)