« Photosynthèse » : différence entre les versions
m Formulation. |
Compléments. |
||
| Ligne 455 : | Ligne 455 : | ||
=== Fixation du carbone en {{fchim|C|4}} === |
=== Fixation du carbone en {{fchim|C|4}} === |
||
{{Article principal| |
{{Article principal|Fixation du carbone en C4{{!}}fixation du carbone en {{fchim|C|4}}}} |
||
{{multiple image |
{{multiple image |
||
| Ligne 531 : | Ligne 531 : | ||
</ref> ; pour autant, sa consommation à l'[[hectare]] est supérieure à celle du blé en raison d'un rendement plus élevé.<!-- |
</ref> ; pour autant, sa consommation à l'[[hectare]] est supérieure à celle du blé en raison d'un rendement plus élevé.<!-- |
||
Francocentré : |
*** Francocentré : *** |
||
C'est aussi une des cultures les plus irriguée dans certaines régions françaises, telles que les [[Landes (département)|Landes]], car les besoins en eau sont concentrés sur juillet/aout<ref>http://www.linternaute.com/savoir/dossier/eau-virtuelle/cereales.shtml D'après les chiffres de la FAO, 5750 m<sup>3</sup> par hectare, légèrement plus que le blé]</ref>. A contrario, le maïs n'est quasiment pas irrigué en Bretagne-Pays de Loire (25 % des surfaces en France)<ref>http://www.agpm.com/pages/generalites.php?PHPSESSID=cc765b3e529e276608b52a126cd34563</ref>. Ce caractère a été hérité de la plante ancêtre, la [[téosinte]], qui, elle, est adaptée à un milieu chaud et sec, car sa production de biomasse est moindre. Il a été maintenu par la [[sélection naturelle#La sélection artificielle|sélection artificielle]] car il assure de bons rendements.--> |
C'est aussi une des cultures les plus irriguée dans certaines régions françaises, telles que les [[Landes (département)|Landes]], car les besoins en eau sont concentrés sur juillet/aout<ref>http://www.linternaute.com/savoir/dossier/eau-virtuelle/cereales.shtml D'après les chiffres de la FAO, 5750 m<sup>3</sup> par hectare, légèrement plus que le blé]</ref>. A contrario, le maïs n'est quasiment pas irrigué en Bretagne-Pays de Loire (25 % des surfaces en France)<ref>http://www.agpm.com/pages/generalites.php?PHPSESSID=cc765b3e529e276608b52a126cd34563</ref>. Ce caractère a été hérité de la plante ancêtre, la [[téosinte]], qui, elle, est adaptée à un milieu chaud et sec, car sa production de biomasse est moindre. Il a été maintenu par la [[sélection naturelle#La sélection artificielle|sélection artificielle]] car il assure de bons rendements.--> |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
{{Article détaillé|métabolisme acide crassulacéen}} |
|||
Ces plantes possèdent les deux types d'enzymes carboxylantes comme les plantes de type C4. Elles diffèrent de ces dernières du fait que la fixation du carbone n'est pas séparée dans l'espace (mésophylle/gaine périvasculaire) mais dans le temps (nuit/jour). Durant la nuit, lorsque les [[stomates]] sont ouverts, un stock de malate est produit, puis stocké dans la vacuole des cellules photosynthétiques. Au cours de la journée, ces malates sont retransformés en dioxyde de carbone et le cycle de Calvin peut s’effectuer, le {{formule chimique|CO|2}} restant disponible pour la photosynthèse malgré la fermeture des [[stomates]]. Ainsi les pertes d'eau par transpiration sont limitées. Ce mécanisme est observé notamment chez les [[Crassulaceae]] (« plantes grasses », comme le cactus). |
|||
Le [[métabolisme acide crassulacéen]] (CAM) est caractéristique des plantes qui poussent en environnement [[aridité|aride]]<ref name="10.1093/aob/mcn145"> |
|||
| ⚫ | |||
{{Article |
|||
| langue = en |
|||
| nom1 = Ana Herrera |
|||
| titre = Crassulacean acid metabolism and fitness under water deficit stress: if not for carbon gain, what is facultative CAM good for? |
|||
| périodique = Annals of Botany |
|||
| volume = 103 |
|||
| numéro = 4 |
|||
| jour = |
|||
| mois = |
|||
| année = 2009 |
|||
| pages = 645-653 |
|||
| url texte = http://aob.oxfordjournals.org/content/103/4/645.full.pdf+html |
|||
| consulté le = 26 janvier 2014 |
|||
}} {{DOI|10.1093/aob/mcn145}}</ref>. Il permet de limiter les pertes d'eau diurnes par [[Transpiration végétale|transpiration]] en maintenant les [[stomate]]s fermés pendant la journée et en ne les ouvrant que la nuit<ref name="10.1146/annurev.pp.36.060185.003115"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = I. P. Ting |
|||
| ⚫ | |||
| périodique = Annual Review of Plant Physiology |
|||
| volume = 36 |
|||
| numéro = |
|||
| jour = |
|||
| mois = juin |
|||
| année = 1985 |
|||
| pages = 595-622 |
|||
| url texte = http://www.annualreviews.org/doi/abs/10.1146/annurev.pp.36.060185.003115 |
|||
| consulté le = 26 janvier 2014 |
|||
}} {{DOI|10.1146/annurev.pp.36.060185.003115}}</ref>. C'est donc la nuit que le [[dioxyde de carbone]] peut être absorbé par la [[plante]] et fixé sous forme d'[[acide organique]] à quatre [[atome]]s de [[carbone]] tels que le [[Acide malique|malate]] ou l'[[Acide aspartique|aspartate]], comme pour les plantes en {{fchim|C|4}}. Mais, à la différence de ces dernières, les composés en {{fchim|C|4}} ainsi formés la nuit sont stockés dans les [[vacuole]]s des [[Cellule (biologie)|cellules]] pour être utilisés par le [[cycle de Calvin]] dans la journée, alors que, chez les plantes en {{fchim|C|4}}, ces composés formés dans les cellules du [[mésophylle]] pendant la journée migrent dans la foulée vers les cellules des gaines périvasculaires pour y être utilisés par le cycle de Calvin. |
|||
Le stockage nocturne des composés en {{fchim|C|4}} dans des vacuoles est rendu nécessaire par le fait que le cycle de Calvin ne peut fonctionner que le jour : il requiert en effet de l'énergie métabolique ([[Adénosine triphosphate|ATP]]) et du pouvoir réducteur ([[Nicotinamide adénine dinucléotide phosphate|NADPH]]), qui sont produits par les réactions directement dépendantes de la lumière. |
|||
Ce mécanisme existe également chez un certain nombre de plantes aquatiques<ref name="10.1007/BF02856581"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Jon E. Keeley |
|||
| titre = CAM photosynthesis in submerged aquatic plants |
|||
| périodique = The Botanical Review |
|||
| volume = 64 |
|||
| numéro = 2 |
|||
| jour = |
|||
| mois = avril-juin |
|||
| année = 1998 |
|||
| pages = 121-175 |
|||
| url texte = http://link.springer.com/article/10.1007/BF02856581 |
|||
| consulté le = 26 janvier 2014 |
|||
| ⚫ | |||
== Cas particuliers de photosynthèse == |
== Cas particuliers de photosynthèse == |
||
Version du 26 janvier 2014 à 20:00


La photosynthèse (grec φῶς phōs, lumière et σύνθεσις sýnthesis, assemblage) est le processus bioénergétique qui permet aux plantes, aux algues et à certaines bactéries, dites photoautotrophes, de synthétiser de la matière organique en utilisant la lumière du soleil[1]. Des glucides, par exemple des oses tels que le glucose, sont synthétisés à partir du dioxyde de carbone CO2 et de l'eau H2O avec libération d'oxygène O2 comme sous-produit de l'oxydation de l'eau. C'est la photosynthèse qui maintient constant le taux d'oxygène dans l'atmosphère terrestre et fournit toute la matière organique ainsi que l'essentiel de l'énergie utilisées par la vie sur Terre[2].
Tous les organismes photosynthétiques ne réalisent pas la photosynthèse de la même façon, mais ce processus commence toujours par l'absorption de l'énergie lumineuse par des protéines appelées centres réactionnels qui contiennent des pigments photosynthétiques appelés chlorophylles. Chez les plantes, ces protéines se trouvent dans la membrane des thylakoïdes, des structures incluses dans les chloroplastes, présents essentiellement dans les feuilles, tandis que chez les bactéries elles sont incluses dans la membrane plasmique. Au cours de ces réactions dépendantes de la lumière, une partie de l'énergie lumineuse sert à exciter des électrons d'une substance donneuse, le plus souvent de l'eau, électrons qui servent à leur tour à produire du nicotinamide adénine dinucléotide phosphate réduit (NADPH) ainsi que de l'adénosine triphosphate (ATP).
Chez les plantes, les algues et les cyanobactéries, les glucides sont produits par une série de réactions indépendantes de la lumière appelées cycle de Calvin, mais certaines bactéries utilisent d'autres voies métaboliques pour réaliser la fixation du carbone, comme le cycle de Krebs inverse. Dans le cycle de Calvin, le CO2 atmosphérique est fixé sur des composés organiques tels que le ribulose-1,5-bisphosphate. Les composés formés sont ensuite réduits et convertis par exemple en glucose à l'aide du NADPH et de l'ATP formés à la suite des réaction dépendantes de la lumière. La photosynthèse est ainsi la principale voie de transformation du carbone minéral en carbone organique. En tout, les organismes photosynthétiques assimilent chaque année entre 100 et 115 milliards de tonnes de carbone en biomasse[3],[4].
Les premiers organismes photosynthétiques sont probablement apparus très tôt au cours de l'évolution et devaient sans doute utiliser des réducteurs tels que l'hydrogène H2 et le sulfure d'hydrogène H2S au lieu de l'eau[5]. Les cyanobactéries sont apparues plus tard, et l'excès d'oxygène alors libéré dans l'environnement aurait contribué à la « catastrophe de l'oxygène » il y a environ 2,4 milliards d'années[6], rendant possible l'évolution des êtres vivants vers des formes de vie plus complexes. Aujourd'hui, la puissance moyenne captée par la photosynthèse à l'échelle du globe avoisine 130 térawatts[7],[8],[9], ce qui équivaut à environ six fois la consommation énergétique de l'humanité[10].
Vue générale
Principe
Les organismes photosynthétiques sont photoautotrophes, de qui signifie qu'ils sont capables de synthétiser leurs biomolécules directement à partir de composés minéraux — le plus souvent le dioxyde de carbone CO2 et l'eau H2O — à l'aide de l'énergie lumineuse reçue du soleil. Cependant, tous les organismes capables d'utiliser l'énergie lumineuse pour leur métabolisme ne sont pas nécessairement photosynthétiques : les organismes dits photohétérotrophes synthétisent leurs biomolécules à partir de composés organiques, et non pas de CO2, comme sources de carbone[2].
Chez les plantes, les algues et les cyanobactéries, la photosynthèse libère de l'oxygène O2. C'est ce qu'on appelle la photosynthèse oxygénique. Bien qu'il y ait des différences dans la biosynthèse réalisée par ces organismes, les mécanismes généraux restent tout à fait semblables d'une espèce à l'autre. Il existe cependant des bactéries qui possèdent une photosynthèse anoxygénique, laquelle consomme du CO2 mais ne libère pas d'O2.
Le dioxyde de carbone est converti en glucides à travers un processus appelé fixation du carbone. Il s'agit de réactions d'oxydoréduction endothermiques, de sorte que ce processus a besoin d'une part d'électrons pour réduire le CO2 en sucres et d'autre part d'énergie pour rendre ces réaction thermodynamiquement favorables. La photosynthèse est globalement la réciproque de la respiration cellulaire, au cours de laquelle des composés organiques tels que le glucose sont oxydés en dioxyde de carbone et en eau afin de libérer de l'énergie et de produire des coenzymes réductrices. Cependant, ces deux processus impliquent des réactions chimiques différentes réalisées dans des compartiments cellulaires différents.
La photosynthèse se déroule en deux phases : lors de la première, les réactions dépendantes de la lumière captent l'énergie lumineuse et l'utilisent pour produire une coenzyme réductrice, le NADPH, et une coenzyme qui stocke l'énergie chimique, l'ATP, tandis que, lors de la seconde phase, les réaction indépendantes de la lumière utilisent ces coenzymes pour absorber et réduire le dioxyde de carbone.
La plupart des organismes photosynthétiques oxygéniques utilisent la lumière visible, bien qu'au moins trois d'entre eux utilisent le proche infrarouge ou, plus particulièrement, le rouge lointain[11] (autour de 800 nm de longueur d'onde).
On relèvera enfin que, si la photosynthèse est un processus biologique spécifique aux plantes, aux algues et à certains microorganismes (dont des protistes et des bactéries), il existe également un animal connu pour être le siège d'un processus de photosynthèse se déroulant dans des chloroplastes qu'il ne produit pas lui-même mais qu'il absorbe avec les algues dont il se nourrit.
Donneurs d'électrons
L'équation globale de la photosynthèse peut s'écrire :
Dans la photosynthèse oxygénique, l'eau est le donneur d'électrons, dont la dissociation libère de l'oxygène tandis que de l'eau est reformée à partir d'un atome d'oxygène du dioxyde de carbone :
On simplifie généralement l'équation en éliminant 2n H2O dans les deux termes, ce qui donne :
La photosynthèse anoxygénique utilise d'autres composés que l'eau comme donneur d'électrons. Ainsi, les bactéries pourpres sulfureuses utilisent le sulfure d'hydrogène H2S :
Les bactéries sulfureuses vertes sont par exemple capables d'utiliser le sulfure d'hydrogène H2S, le thiosulfate S2O32– et le soufre élémentaire S0 comme donneurs d'électrons, tandis que les bactéries vertes non sulfureuses peuvent utiliser l'hydrogène H2. Certains microorganismes sont capables d'utiliser l'arsénite AsO33– pour réduire le dioxyde de carbone CO2 en monoxyde de carbone CO avec formation d'arséniate AsO43–, ce qui peut être représenté par l'équation suivante[12],[13] :
Parmi les donneurs d'électrons rencontrés chez les organismes photosynthétiques, on peut encore relever le fer ferreux Fe2+, les ions nitrite NO2–, voire des composés organiques tels que des acides et des alcools simples, par exemple l'acide acétique CH3COOH et l'éthanol CH3CH2OH.
Organites et membranes de la photosynthèse
Chez les bactéries photosynthétiques, les protéines qui absorbent la lumière pour la photosynthèse sont incluses dans des membranes cellulaires, ce qui représente l'arrangement le plus simple pour ces protéines[14]. Cette membrane peut cependant être repliée en feuillets cylindriques appelés thylakoïdes[15] ou en vésicules sphériques de membranes intracytoplasmiques[16]. Ces structures peuvent remplir la majeure partie de l'intérieur d'une cellule, offrant ainsi une très grande surface membranaire pour permettre à la bactérie d'absorber davantage de lumière[15].

(1) membrane externe ;
(2) espace intermembranaire ;
(3) membrane interne ;
(4) stroma ;
(5) lumen du thylakoïde ;
(6) membrane du thylakoïde ;
(7) granum (empilement de thylakoïdes) ;
(8) thylakoïde ;
(9) amidon ;
(10) ribosome ;
(11) ADN chloroplastique ;
(12) plastoglobule (gouttelette lipidique).
Chez les plantes et les algues, la photosynthèse se déroule dans des organites appelés chloroplastes. Une cellule typique de plante contient environ dix à cent chloroplastes. Ces derniers sont enveloppés par une membrane interne et une membrane externe de nature phospholipidique et séparées par un espace intermembranaire. L'intérieur du chloroplaste est constitué d'un fluide aqueux appelé stroma. Dans le stroma se trouvent des thylakoïdes empilés en grana où siège la photosynthèse. Les thylakoïdes sont en forme de disques aplatis délimités par une membrane contenant l'espace thylakoïde ou lumen. La photosynthèse se déroule précisément dans la membrane des thylakoïdes, qui contient des complexes protéiques membranaires intégraux et périphériques ainsi que les pigments qui absorbent l'énergie lumineuse et constituent les photosystèmes.
Les plantes absorbent la lumière essentiellement grâce à des pigments appelés chlorophylles, ce qui explique leur couleur verte. Outre les chlorophylles, elles utilisent des carotènes et des xanthophylles[17]. Les algues utilisent également de la chlorophylle, mais avec divers autres pigments tels que la phycocyanine, les carotènes, et les xanthophylles chez les algues vertes, la phycoérythrine chez les algues rouges et la fucoxanthine chez les algues brunes et les diatomées, ce qui donne une grande variété de couleurs.
Ces pigments sont rassemblés chez les plantes et les algues dans des structures appelées antennes collectrices au sein desquelles les pigments sont organisés pour optimiser leur coopération.
Bien que toutes les cellules de plantes vertes possèdent des chloroplastes, l'énergie lumineuse est absorbée essentiellement par les feuilles, hormis chez certaines espèces adaptées à un ensoleillement fort et à une forte aridité, telles que les euphorbes et les cactus chez lesquelles le principal organe photosynthétique est la tige. Les cellules des tissus intérieurs d'une feuille — le mésophylle — peut contenir entre 450 000 et 800 000 chloroplastes par millimètre carré. La surface de la feuille est recouverte d'une cuticule cireuse et imperméable qui protège la feuille de l'excès d'évaporation d'eau et réduit l'absorption de la lumière bleue et ultraviolette afin de limiter l'échauffement de la plante. L'épiderme transparent permet à la lumière de le traverser pour mieux atteindre le mésophylle, où se déroule l'essentiel de la photosytnhèse.
Les deux phases de la photosynthèse
La photosynthèse comprend deux ensembles de réactions distincts :
- des réactions directement dépendantes de la lumière, dites « phase lumineuse » ou « phase claire », dont l'équation générale d'une photophosphorylation non cyclique chez les plantes vertes peut s'écrire[18] :
- des réaction non directement dépendantes de la lumière, dites « phase obscure » ou « phase sombre », dont l'équation générale chez les plantes vertes peut s'écrire :
Réactions directement dépendantes de la lumière
Chez les plantes, les réaction directement dépendantes de la lumière se déroulent au sein des membranes des thylakoïdes à l'intérieur des chloroplastes et permettent la production d'ATP, la plupart du temps couplée à la production de NADPH par oxydation de l'eau.
Toutes les longueurs d'onde ne sont pas utilisée pour la photosynthèse. Le spectre d'action photosynthétique dépend des pigments accessoires : chez les plantes vertes par exemple, le spectre d'action provient des chlorophylles et des caroténoïdes, avec des pics d'absorption pour la lumière bleu-violet et rouge ; chez les algues, le spectre d'action se superpose au spectre d'absorption de phycobilines pour la lumière bleu-vert, ce qui permet à ces algues de se développer dans des eaux plus profondes, qui absorbent les longueurs d'onde plus grandes utilisées par les plantes vertes. Les longueurs d'onde qui ne sont pas absorbées sont celles qui donnent leur couleur aux organismes photosynthétiques : algues vertes, algues rouges, bactéries pourpres.
Les réactions directement dépendantes de la lumière peuvent être cycliques ou non cycliques.
Photophosphorylation non cyclique
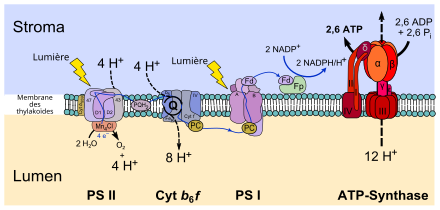
La photophosphorylation non cyclique consiste en un flux d'électrons depuis une molécule d'eau vers une molécule de NADP+ à travers une série d'enzymes membranaires et de protéines transporteuses avec génération d'un gradient de concentration en protons à travers la membrane des thylakoïdes au niveau du complexe cytochrome b6f. Ce gradient de concentration de protons génère un gradient électrochimique utilisé par l'ATP synthase pour réaliser la phosphorylation de l'ADP en ATP, ce qu'on appelle un couplage chimiosmotique. Ainsi, au cours de la photophosphorylation non cyclique, l'eau H2O est oxydée en oxygène O2 au niveau du photosystème II et le NADP+ est réduit en NADPH par la ferrédoxine-NADP+ réductase.
Plus précisément, l'absorption d'un photon par une molécule de chlorophylle P680 du photosystème II conduit à l'excitation d'un électron, qui acquiert suffisamment d'énergie pour être cédé à un accepteur d'électrons par un phénomène de séparation de charges photoinduite. L'accepteur d'électrons primaire est une molécule de chlorophylle dépourvue d'atome de magnésium central appelée phéophytine. De là, l'électron excité passe sur une plastoquinone puis à travers le complexe cytochrome b6f avant d'être transporté sur une plastocyanine jusqu'à un photosystème I. Celui-ci contient un dimère de chlorophylle P700 capable d'exciter un électron par absorption d'un photon, électron transmis par la suite à une ferrédoxine, qui le cède à une ferrédoxine-NADP+ réductase pour réduire une molécule de NADP+ en NADPH.
Photophosphorylation cyclique
La photophosphorylation cyclique ne fait intervenir que le photosystème I, le complexe cytochrome b6f et la plastocyanine ; le photosystème I absorbe l'énergie lumineuse, ce qui permet d'exciter un électron, transféré à un complexe cytochrome b6f auquel il cède son énergie en générant un gadient électrochimique utilisé par une ATP synthase pour produire de l'ATP, avant de revenir au photosystème I via une plastocyanine. Ces réactions ne produisent ni O2 ni NADPH.
Schéma en Z
Le « schéma en Z » représente les variations d'énergie des électrons au cours de la photophosphorylation non cyclique :
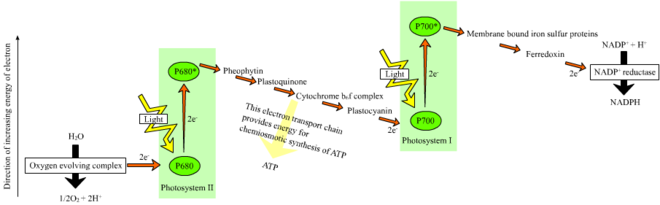
On peut le tracer précisément à partir des valeurs du potentiel d'oxydoréduction E°' des différents couples rédox[19] :
| Couple rédox | Potentiel d'oxydoréduction (V) |
|---|---|
| H2O / O2 | + 0,82 |
| P680 / P680+ | + 0,9 |
| P680* / P680 | - 0,8 |
| Phéophytine réduite / oxydée | - 0,6 |
| Plastoquinone réduite / oxydée | 0 |
| Complexe cytochrome b6f | - 0,2 et + 0,2 |
| P700 / P700+ | + 0,4 |
| P700* / P700 | -1,3 |
| Ferrédoxine réduite / oxydée | - 0,42 |
| NADPH / NADP+ | - 0,32 |
Complexe d'oxydation de l'eau
L'eau H2O est la source d'électrons de la photosynthèse chez les plantes et les cyanobactéries. Deux molécules d'eau sont oxydées par quatre réactions successives de séparation de charges dans le photosystème II pour donner une molécule de dioxygène O2, quatre protons H+ et quatre électrons e–. Chacun des quatre électrons transite par un résidu de tyrosine jusqu'au P680 qui sert de donneur d'électrons primaire du centre réactionnel du photosystème II.
L'oxydation de l'eau est catalysée par un cluster oxométallique comprenant quatre cations de manganèse et un cation de calcium. Cette structure se lie à deux molécules d'eau et permet les quatre oxydations successives aboutissant à la libération d'une molécule d'O2 et de quatre H+, ces derniers contribuant à l'établissement du gradient électrochimique à travers la membrane des thylakoïdes. Le photosystème II est la seule enzyme connue capable d'oxyder l'eau de cette façon. L'oxygène libéré est en fait un déchet, utilisé cependant par la majorité des êtres vivants pour leur respiration cellulaire, y compris les organismes photosynthétiques[20].
Réactions non directement dépendantes de la lumière
Le dioxyde de carbone CO2 atmosphérique est assimilé par une enzyme, la RuBisCO, qui le condense sur du ribulose-1,5-bisphosphate pour donner deux molécules de 3-phosphoglycérate utilisées pour synthétiser divers glucides. Le 3-phosphoglycérate est réduit en glycéraldéhyde-3-phosphate à l'aide du NADPH et de l'ATP produits par les réactions directement dépendantes de la lumière.
Cinq molécules de glycéraldéhyde-3-phosphate sur six sont utilisées pour régénérer du ribulose-1,5-bisphosphate, tandis qu'une molécule de glycéraldéhyde-3-phosphate sur six est utilisée pour produire des hexoses phosphate, lesquels sont utilisés à leur tour pour produire du saccharose, de l'amidon et de la cellulose. La fixation du carbone par le cycle de Calvin produit ainsi des intermédiaires qui sont ensuite utilisés pour synthétiser des glucides ainsi que des précurseurs de lipides et d'acides aminés ; ils peuvent également être utilisés par la cellule comme composés énergétiques oxydés par respiration cellulaire.
Ces réactions ne dépendent de la lumière que de façon indirecte, car elles requièrent l'ATP et le NADPH produits par les réactions directement dépendantes de la lumière, de sorte qu'elles ne se déroulent que le jour bien qu'elles n'aient pas besoin de photons.
Les trois modes de fixation du carbone dans la photosynthèse
Il existe diverses voies métaboliques de fixation du carbone. Celles des organismes photosynthétiques reposent dans presque tous les cas sur le cycle de Calvin, mais certains microorganismes peuvent utiliser à la place le cycle de Krebs inverse[21]. Il existe également d'autres voies de fixation du carbone, rencontrées chez certains microorganismes, telles que la voie de Wood-Ljungdahl, ou encore le cycle du 3-hydroxypropionate et ses diverses variantes. La fixation du carbone par le cycle de Calvin diffère selon les plantes en fonction du mécanisme de concentration du dioxyde de carbone autour de la RuBisCO afin d'optimiser l'activité carboxylase de cette enzyme en limitant son activité oxygénase responsable de la photorespiration.
Fixation du carbone en C3

à 3 atomes de carbone (en bleu).
Chez les plantes en C3, la fixation du carbone débute directement par le cycle de Calvin. On parle de « plantes en C3 » en référence au 3-phosphoglycérate, molécule à trois atomes de carbone formée par condensation du dioxyde de carbone CO2 sur du ribulose-1,5-bisphosphate par la RuBisCO :

+ CO2 + H2O → 2 
D-ribulose-1,5-bisphosphate 3-phospho-D-glycérate Ribulose-1,5-bisphosphate carboxylase/oxygénase (RuBisCO) – EC
Les plantes en C3 tendent à se développer dans les environnement riches en eaux souterraines où le rayonnement solaire et la température sont modérés et la concentration de CO2 de l'ordre de 200 ppm ou plus[22]. Apparues au cours du Mésozoïque et du Paléozoïque, elles ont supplanté les plantes en C4 et représentent aujourd'hui environ 95 % de la biomasse végétale. Elle perdent par transpiration 97 % de l'eau absorbée par leurs racines[23]. Le riz et l'orge, par exemple, sont des plantes en C3.
Les plantes en C3 ne peuvent pas pousser dans les zones trop chaudes parce que l'activité oxygénase de la RuBisCO augmente avec la température par rapport à l'activité carboxylase, c'est-à-dire que la photorespiration devient prépondérante sur la fixation du carbone, ce qui conduit à une perte nette de carbone et d'azote par la plante. Dans les zones sèches, les plantes en C3 referment leurs stomates pour limiter leurs pertes en eau, mais cela a également pour effet de limiter l'entrée du dioxyde de carbone dans les feuilles et donc la concentration en CO2 dans ces dernières : cela réduit le ratio CO2/O2 et donc augmente la photorespiration.
Fixation du carbone en C4
Chez les plantes en C4, la fixation du carbone débute par la formation d'oxaloacétate, molécule comportant quatre atomes de carbone formée dès la première étape du processus par fixation du CO2 sur du phosphoénolpyruvate par la phosphoénolpyruvate carboxylase, une enzyme à l'activité carboxylase plus efficace que celle de la RuBisCO :

La fixation du CO2 sur le phosphoénolpyruvate se déroule au niveau des cellules du mésophylle (en haut sur le schéma ci-contre), tissu situé entre les nervures des feuilles, et y est converti en malate par la malate déshydrogénase à NADP+ ou en aspartate par l'aspartate aminotransférase. C'est sous cette forme qu'il circule vers les cellules des gaines périvasculaires (en bas sur le schéma ci-contre), où le CO2 est libéré pour être mis à disposition de la RuBisCO et rejoindre le cycle de Calvin : dans ces cellules, la RuBisCO est en effet isolée de l'oxygène atmosphérique et est donc saturée en dioxyde de carbone issu de la décarboxylation du malate ou de l'aspartate, ce qui l'oriente presque exclusivement vers son activité carboxylase ; la photorespiration est fortement réduite en augmentant la pression partielle de CO2 autour de la RuBisCO, dont l'activité oxygénase est ainsi limitée.
Ce type de photosynthèse est notamment présent chez des graminées d'origine tropicale et aride, comme la canne à sucre, le maïs ou le sorgho. La fermeture de leurs stomates plus longtemps permet à ces plantes de limiter les pertes d'eau, mais présente l'inconvénient d'abaisser rapidement la pression partielle en CO2 dans la feuille ; la voie en C4 permet précisément de compenser ce phénomène et même de concentrer le CO2 là où la fixation du carbone a lieu, ce qui en optimise le rendement.
Les plantes en C4 représentent aujourd'hui environ 5 % de la biomasse végétale et 3 % des espèces de plantes connues[24],[25]. En dépit de leur relative rareté, elles sont cependant responsables d'environ 30 % de la fixation du carbone sur Terre[26].
De nombreuses espèces de différentes familles de plantes sont en C4. Opuntia ficus-indica est un exemple chez les Cactaceae. Le maïs est une plante en C4, qui consomme 400 litres d'eau par kilogramme de matière sèche produite, contre 1 500 litres pour le blé[27] ; pour autant, sa consommation à l'hectare est supérieure à celle du blé en raison d'un rendement plus élevé.
Métabolisme acide crassulacéen (CAM)
Le métabolisme acide crassulacéen (CAM) est caractéristique des plantes qui poussent en environnement aride[28]. Il permet de limiter les pertes d'eau diurnes par transpiration en maintenant les stomates fermés pendant la journée et en ne les ouvrant que la nuit[29]. C'est donc la nuit que le dioxyde de carbone peut être absorbé par la plante et fixé sous forme d'acide organique à quatre atomes de carbone tels que le malate ou l'aspartate, comme pour les plantes en C4. Mais, à la différence de ces dernières, les composés en C4 ainsi formés la nuit sont stockés dans les vacuoles des cellules pour être utilisés par le cycle de Calvin dans la journée, alors que, chez les plantes en C4, ces composés formés dans les cellules du mésophylle pendant la journée migrent dans la foulée vers les cellules des gaines périvasculaires pour y être utilisés par le cycle de Calvin.
Le stockage nocturne des composés en C4 dans des vacuoles est rendu nécessaire par le fait que le cycle de Calvin ne peut fonctionner que le jour : il requiert en effet de l'énergie métabolique (ATP) et du pouvoir réducteur (NADPH), qui sont produits par les réactions directement dépendantes de la lumière.
Ce mécanisme existe également chez un certain nombre de plantes aquatiques[30]. Il répond cette fois à la limitation de la disponibilité en CO2 pendant la journée, par exemple du fait de la consommation de ce gaz dissous par les autres plantes.
Cas particuliers de photosynthèse
Animaux et photosynthèse
La limace de mer, Elysia chlorotica, est le premier animal découvert capable d'utiliser la photosynthèse pour produire de l'énergie. Cette photosynthèse est effectuée par les chloroplastes de sa principale source de nourriture, l'algue Vaucheria litorea. Ils sont séquestrés par l'épithélium digestif de la limace pendant plusieurs mois, continuant la photosynthèse. Cependant, les chloroplastes de Vaucheria litorea ont transféré une grande partie de leurs gènes nécessaires à la photosynthèse vers le noyau de cette algue au cours de l'évolution[31]. La photosynthèse est néanmoins maintenue chez la limace de mer grâce au transfert d'un gène nécessaire à la photosynthèse du noyau de l'algue vers celui de la limace[31].
De nombreux autres animaux peuvent établir une symbiose avec une algue : vers plats, coraux, anémones de mer, éponges, limaces de mer... La salamandre maculée est toutefois le seul vertébré connu à ce jour (2011) qui établisse une symbiose avec une algue, en l'occurrence Oophila amblystomatis[32].
Photosynthèse artificielle
La reproduction artificielle des réactions de photosynthèse fait l'objet de nombreuses recherches, qui se focalisent en général sur l'une ou l'autre des deux phases de la photosynthèse.
Ainsi, une équipe du National Renewable Energy Laboratory rapporte en 1998 avoir créé un dispositif permettant de dissocier l'oxygène et l'hydrogène de l'eau à partir d'énergie solaire[33]. Le dispositif est cependant instable et fabriqué à partir de matériaux rares. Une équipe du MIT indique en 2011 être parvenue à des résultats similaires, cette fois avec un dispositif stable et à partir de matériaux courants et bon marchés[34].
Une équipe de l'université de Kyoto annonce quant à elle en 2007 un procédé capable de capter le CO2 atmosphérique 300 fois plus efficacement que les plantes[35],[36], à partir de dioxyde de manganèse.
En mars 2011, une équipe de l'institut de technologie du Massachusetts dirigé par le Dr Daniel Nocera a annoncé avoir réussi à fabriquer une feuille artificielle, faite de matériaux durables et peu couteux, permettant de décomposer l'eau en oxygène et hydrogène, à l'aide de la lumière du soleil afin de créer de l'électricité propre[37]. Les catalyseurs utilisés par Nocera, permettant d'accélérer le processus d’électrolyse de l'eau, ont été réalisés à partir de cobalt (ou de nickel [5]), et fonctionnent à pH 7, à température ambiante et sous pression atmosphérique[38].
La découverte du mécanisme
- Dans l'Antiquité, Aristote pensait que le sol fournissait aux plantes les éléments dont elles ont besoin.
- Au XVIIe siècle, Jan Baptist van Helmont démontre qu'un saule planté en bac a pris 77 kg en 5 ans alors que le sol contenu dans le bac ne diminue que de 57 g ; il attribue la différence à l'action de l'eau.
- Au XVIIIe siècle, plusieurs scientifiques mettent en évidence les notions de respiration et de production d’oxygène par les plantes et l'importance de la lumière dans ce dernier phénomène. Ce sont d’abord deux chimistes anglais : Stephen Hales en 1727, qui pense que l'air et la lumière contribuent à la croissance des plantes, et Joseph Priestley entre 1771 et 1777 qui met en évidence le rejet d’oxygène. À leur suite, Jan Ingen-Housz, médecin et botaniste hollandais, établit en 1779 le rôle de la lumière dans la production d’oxygène par les plantes. Puis Jean Senebier, un pasteur suisse, à partir des travaux d’Antoine Lavoisier sur la composition de l'air, comprend que les plantes consomment du dioxyde de carbone et rejettent du dioxygène lors de cette phase.
- Au début du XIXe siècle, Nicolas Théodore de Saussure démontre la consommation d’eau lors de la photosynthèse. La chlorophylle est isolée par des chimistes français en 1817, Pierre Joseph Pelletier et Joseph Bienaimé Caventou.
- Au milieu du XIXe siècle les grandes lignes du mécanisme sont comprises, transformation de l'énergie lumineuse, consommation d’eau et de dioxyde de carbone, production d’amidon et rejet de dioxygène. L'expérience cruciale d’Engelmann (1882), où des bactéries servent d’indicateur de la production d’oxygène, montre clairement le rôle de la couleur de la lumière.
- C'est au cours du XXe siècle que l'explication plus détaillée du processus s’établit. Le début du siècle voit la description de la structure chimique de la chlorophylle puis la découverte de l'existence des types a et b. Robert Emerson établit en 1932[39] que 2 500 molécules de chlorophylle sont nécessaires pour émettre 1 molécule d'O2. Dans les années 1930, les travaux de Robert Hill permettent d'y voir plus clair. À l'issue de ses expériences, la photosynthèse se présente comme une réaction d'oxydo-réduction au cours de laquelle le carbone passe d'une forme oxydée à une forme réduite : CO2 → HCHO ; et l'oxygène d'une forme réduite à une forme oxydée : H2O → O2
- On a récemment découvert du nanoplancton qui vit à des profondeurs où il n'y a pratiquement plus de lumière. Certaines algues marines (cryptophytes, dont rhodomonas sp. et chroomonas sp.), à température ambiante et en condition d'illumination défavorable, sont capables, grâce à des « antennes » protéiques, et semble-t-il grâce à des protéines (bilines) utilisées en plus de la chlorophylle, de mieux capter la lumière et d'utiliser la cohérence quantique pour optimiser leur utilisation du rayonnement solaire incident. Cela leur permet de conduire plus de 95 % des photons jusqu'à leur « but »[40]. Ce phénomène pourrait exister chez d'autres végétaux, voire être courant.
Production d'oxygène & captage d'énergie
À l’échelle planétaire, ce sont les algues et le phytoplancton marin qui produisent le plus d’oxygène, suivi des forêts. On a longtemps cru que les mers froides et tempérées étaient les seules à avoir un bilan positif en termes d’oxygène, mais une étude de 2009 [41]montre que les océans subtropicaux oligotrophes sont également producteurs d’oxygène, bien qu'ayant une production saisonnière irrégulière. Ces océans jouent donc un rôle en termes de puits de carbone. Pour le sud de l'hémisphère nord, la production d’oxygène est basse en début d’hiver, augmente jusqu’en août pour redescendre à l'automne[réf. à confirmer][42]. De même on a longtemps cru que l'oxygène n'était produit que dans les couches très superficielles de l’océan, alors qu'il existe également du nanoplancton, vivant généralement à grande profondeur, photosynthétique[réf. souhaitée]. Dans les zones de dystrophisation ou dans les zones mortes de la mer, ce bilan peut être négatif.
Le flux d’énergie capté par la photosynthèse (à l’échelle planétaire) est immense, approximativement 100 térawatts[43]: qui est environ de 10 fois plus élevé que la consommation énergétique mondiale (intégrée sur un an) [Note 1]. Ce qui signifie qu'environ un peu moins du millième de l’insolation reçue par la Terre est captée par la photosynthèse et fournit pratiquement toute l’énergie de la biosphère.
Notes
- Qui s’élève à environ 10 à 12 térawatts.
Références
-
(en) Howard Gest, « History of the word photosynthesis and evolution of its definition », Photosynthesis Research, vol. 73, nos 1-3, , p. 7-10 (lire en ligne) DOI 10.1023/A:1020419417954
« Photosynthesis is a series of processes in which electromagnetic energy is converted to chemical energy used for biosynthesis of organic cell materials; a photosynthetic organism is one in which a major fraction of the energy required for cellular syntheses is supplied by light »
— Gest 1993
- (en) Donald A. Bryant et Niels-Ulrik Frigaard, « Prokaryotic photosynthesis and phototrophy illuminated », Trends in Microbiology, vol. 14, no 11, , p. 488-496 (lire en ligne) DOI 10.1016/j.tim.2006.09.001
- (en) Christopher B. Field, Michael J. Behrenfeld, James T. Randerson et Paul Falkowski, « Primary Production of the Biosphere: Integrating Terrestrial and Oceanic Components », Science, vol. 281, no 5374, , p. 237-240 (lire en ligne) DOI 10.1126/science.281.5374.237
- (en) McGraw-Hill Encyclopedia of Science & Technology, vol. 13, New York, McGraw-Hill, (ISBN 0-07-144143-3), « Photosynthesis »
- (en) John M. Olson, « Photosynthesis in the Archean Era », Photosynthesis Research, vol. 88, no 2, , p. 109-117 (lire en ligne) DOI 10.1007/s11120-006-9040-5
- (en) Roger Buick, « When did oxygenic photosynthesis evolve? », Philosophical Transactions of the Royal Society B, Biological Sciences, vol. 363, no 1504, , p. 2731-2743 (PMCID 2606769, lire en ligne) DOI 10.1098/rstb.2008.0041
- (en) Kenneth H. Nealson et Pamela G. Conrad, « Life: past, present and future », Philosophical Transactions of the Royal Society B, Biological Sciences, vol. 354, no 1392, , p. 1923-1939 (PMCID 1692713, lire en ligne) DOI 10.1098/rstb.1999.0532
-
(en) Whitmarsh J, Govindjee, Concepts in photobiology: photosynthesis and photomorphogenesis, Boston, Kluwer Academic Publishers, , 11–51 p. (ISBN 0-7923-5519-9, lire en ligne), « The photosynthetic process » :
« 100 x 1015 grams of carbon/year fixed by photosynthetic organisms which is equivalent to 4 x 1018 kJ/yr = 4 x 1021J/yr of free energy stored as reduced carbon; (4 x 1018 kJ/yr) / (31,556,900 sec/yr) = 1.27 x 1014 J/yr; (1.27 x 1014 J/yr) / (1012 J/sec / TW) = 127 TW. »
-
(en) Steger U, Achterberg W, Blok K, Bode H, Frenz W, Gather C, Hanekamp G, Imboden D, Jahnke M, Kost M, Kurz R, Nutzinger HG, Ziesemer T, Sustainable development and innovation in the energy sector, Berlin, Springer, (ISBN 3-540-23103-X, lire en ligne), p. 32 :
« The average global rate of photosynthesis is 130 TW (1 TW = 1 terawatt = 1012 watt). »
- (en) « World Consumption of Primary Energy by Energy Type and Selected Country Groups, 1980–2004 » [xls], Energy Information Administration, (consulté le )
- (en) « Scientists discover unique microbe in California's largest lake » (consulté le )
- (en) Anaerobic Photosynthesis, Chemical & Engineering News, 86, 33, 18 août 2008, p. 36
- (en) Kulp TR, Hoeft SE, Asao M, Madigan MT, Hollibaugh JT, Fisher JC, Stolz JF, Culbertson CW, Miller LG, Oremland RS, « Arsenic(III) fuels anoxygenic photosynthesis in hot spring biofilms from Mono Lake, California », Science, vol. 321, no 5891, , p. 967-70 (Bibcode 2008Sci...321..967K, lire en ligne) DOI 10.1126/science.1160799
- (en) Christine L Tavano et Timothy J Donohue, « Development of the bacterial photosynthetic apparatus », Current Opinion in Microbiology, vol. 9, no 6, , p. 625-631 (PMCID 2765710, lire en ligne) DOI 10.1016/j.mib.2006.10.005
- (en) Conrad W. Mullineaux, « The thylakoid membranes of cyanobacteria: structure, dynamics and function », Australian Journal of Plant Physiology, vol. 26, no 7, , p. 671-677 (lire en ligne) DOI 10.1071/PP99027
- (en) Melih K. Şener, John D. Olsen, C. Neil Hunter et Klaus Schulten, « Atomic-level structural and functional model of a bacterial photosynthetic membrane vesicle », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 40, , p. 15723-15728 (PMCID 2000399, Bibcode 2007PNAS..10415723S, lire en ligne) DOI 10.1073/pnas.0706861104
- (en) Campbell NA, Williamson B, Heyden RJ, Biology Exploring Life, Upper Saddle River, NJ, Pearson Prentice Hall, (ISBN 0-13-250882-6, lire en ligne)
- (en) Raven PH, Evert RF, Eichhorn SE, Biology of Plants,, New York, 7e, , 124–127 p. (ISBN 0-7167-1007-2)
- 12 - Le Schéma en Z, sur le site de l'UFR de biologie de l'université Pierre-et-Marie-Curie à Paris, France.
- (en) Yulia Pushkar, Junko Yano, Kenneth Sauer, Alain Boussac et Vittal K. Yachandra, « Structural changes in the Mn4Ca cluster and the mechanism of photosynthetic water splitting », Proceedings of the National Academy of Sciences of the United States of America, vol. 105, no 6, , p. 1879-1884 (PMCID 2542863, Bibcode 2008PNAS..105.1879P, lire en ligne) DOI 10.1073/pnas.0707092105
- (en) M. C. W. Evans, Bob B. Buchanan et Daniel I. Arnon, « A new ferredoxin-dependent carbon reduction cycle in a photosynthetic bacterium », Proceedings of the National Academy of Sciences of the United States of America, vol. 55, no 4, , p. 928-934 (PMCID 224252, lire en ligne) DOI 10.1073/pnas.55.4.928
- C. Michael Hogan. 2011. "Respiration". Encyclopedia of Earth. Eds. Mark McGinley and C. J. Cleveland. National Council for Science and the Environment. Washington, D.C.
- (en) J. A. Raven et D. Edwards, « Roots: evolutionary origins and biogeochemical significance », Journal of Experimental Botany, vol. 52, no supplément 1, , p. 381-401 (lire en ligne) DOI 10.1093/jexbot/52.suppl_1.381
- (en) Rowan Sage, Russell Monson, C4 Plant Biology, , 228–229 p. (ISBN 0-12-614440-0, lire en ligne)
- (en) W. J. Bond, F. I. Woodward et G. F. Midgley, « The global distribution of ecosystems in a world without fire », New Phytologist, vol. 165, no 2, , p. 525-538 (lire en ligne) DOI 10.1111/j.1469-8137.2004.01252.x
- (en) Colin P Osborne et David J Beerling, « Nature's green revolution: the remarkable evolutionary rise of C4 plants », Philosophical Transactions of the Royal Society B, Biological Sciences, vol. 361, no 1465, , p. 173-194 (PMCID 1626541, lire en ligne) DOI 10.1098/rstb.2005.1737
- http://www.snv.jussieu.fr/vie/dossiers/eau/eaugestion/eauagriculture.html L'eau et les activités agricoles
- (en) Ana Herrera, « Crassulacean acid metabolism and fitness under water deficit stress: if not for carbon gain, what is facultative CAM good for? », Annals of Botany, vol. 103, no 4, , p. 645-653 (lire en ligne) DOI 10.1093/aob/mcn145
- (en) I. P. Ting, « Crassulacean Acid Metabolism », Annual Review of Plant Physiology, vol. 36, , p. 595-622 (lire en ligne) DOI 10.1146/annurev.pp.36.060185.003115
- (en) Jon E. Keeley, « CAM photosynthesis in submerged aquatic plants », The Botanical Review, vol. 64, no 2, , p. 121-175 (lire en ligne) DOI 10.1007/BF02856581
- (en) Mary E. Rumpho, Jared M. Worful, Jungho Lee, Krishna Kannan, Mary S. Tyler, Debanish Bhattacharya, Ahmed Moustafa et James R. Manhart, « Horizontal gene transfer of the algal nuclear gene psbO to the photosynthetic sea slug Elysia chlorotica », PNAS, vol. 105, no 46, , p. 17867-17871 (DOI 10.1073/pnas.0804968105)
- Animaux mangeurs de lumière, article dans Science & Vie n° 1130, novembre 2011, pp. 104-109.
- (en) Oscar Khaselev et John A. Turner, « A Monolithic Photovoltaic-Photoelectrochemical Device for Hydrogen Production via Water Splitting », Science, vol. 280, , p. 425 (résumé)
- (en) « Debut of the first practical “artificial leaf” », sur American Chemical Society, .
- Barbara Ngouyombo, ambassade de France au Japon, « Bulletin électronique Japon 435 »
- « Photosynthèse artificielle pour réduire la pollution atmosphérique », sur techno-science.net
- http://www.gurumed.org/2011/03/28/photosynthse-cration-des-premires-feuilles-artificielles-fabricables/
- http://sciencetonnante.wordpress.com/2011/04/26/la-photosynthese-artificielle-de-l%E2%80%99energie-a-partir-de-soleil-et-d%E2%80%99eau/
- Gerald Karp, Biologie Cellulaire et Moléculaire, De Boeck Université, , 872 p. (ISBN 2-8041-4537-9, lire en ligne), p. 225
- (en) Elisabetta Collini, Cathy Y. Wong, Krystyna E. Wilk, Paul M. G. Curmi, Paul Brumer et Gregory D. Scholes, « Coherently wired light-harvesting in photosynthetic marine algae at ambient temperature », Nature, vol. 463, , p. 644-647 (DOI 10.1038/nature08811, résumé)
- (en) S. Riser et K. Johnson, « Net production of oxygen in the subtropical ocean », Nature, no 451, , p. 323-5 (DOI 10.1038/nature06441, lire en ligne) (étude conduite sur 3 ans).
- « Les océans subtropicaux aussi sont producteurs d’oxygène », Science et Avenir, , p. 19
- (en) Kenneth H. Nealson et Pamela G. Conrad, « Life: past, present and future », Philosophical Transactions of The Royal Society of London B Biological Sciences, vol. 354, no 1392, , p. 1923–39 (PMID 10670014, PMCID 1692713, DOI 10.1098/rstb.1999.0532, résumé)
Voir aussi
Articles connexes
Liens externes
- [flash] (en) « la photosynthèse »
- « Qu'est-ce que la biomasse ? »
- « La Photosynthèse », sur le site de l'Université Pierre et Marie Curie - Très complet sur la photosynthèse.
Modèle:Lien AdQ Modèle:Lien AdQ Modèle:Lien AdQ Modèle:Lien AdQ Modèle:Lien BA Modèle:Lien AdQ





