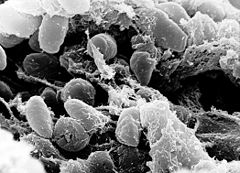
Yersinia pestis
| Domaine | Bacteria |
|---|---|
| Division | Pseudomonadota |
| Classe | Gammaproteobacteria |
| Ordre | Enterobacterales |
| Famille | Yersiniaceae |
| Genre | Yersinia |
Yersinia pestis est une espèce de bacilles Gram négatifs de la famille des Yersiniaceae. C'est l'agent infectieux responsable de la peste.
Elle fut découverte en 1894 par Alexandre Yersin, un bactériologiste franco-suisse travaillant pour l'Institut Pasteur, durant la peste de Hong Kong, en même temps que Kitasato Shibasaburō mais séparément. Kitasato tout d'abord la baptisa Pasteurella pestis en l'honneur de Pasteur. Ce n'est que plus tard qu'elle prit son nom actuel, en hommage à Yersin.
Yersinia pestis a été formellement identifiée comme responsable de la première et deuxième pandémie historique de peste, notamment dans une tombe de Bavière du VIe siècle, dans une fosse commune de la peste londonienne de 1665, ainsi que dans un charnier de la peste de 1720 à Marseille. Les descriptions précises des symptômes lors de la peste qui toucha l'Europe en 1347-1352 laissent également peu de doutes.
Caractères bactériologiques[modifier | modifier le code]
Morphologie et culture[modifier | modifier le code]

Yersinia pestis, de la famille des Enterobacteriaceæ, est un coccobacille court (en coque, de forme arrondie) de 0,5 à 0,8 μm de largeur sur 1 à 3 μm de longueur. Il est à Gram négatif, non flagellé, encapsulé, se colorant souvent (Giemsa et Wayson (en)) ) en bipolaire de façon nette dans le frottis de pus[1].
La bactérie est aérobie et facultativement anaérobie. Sa culture est lente, mais facile sur des milieux standards à température optimum vers 28 - 30 °C, et jusqu'à 35 °C[1]. Elle ne produit pas d'uréase et reste immobile (différences avec les autres Yersinia).
Après 48 heures d'incubation, les colonies apparaissent fines, mates et translucides. Selon les milieux de culture elles sont blanchâtres avec un centre rouge (milieu solide CIN – avec Cefsulodine, Irgasan, et Novobiocine (en)–, à 36 heures) colonies dites « œil de bœuf », ou limpides avec un voile et un dépôt floconneux (milieux liquides)[2],[3].
Classifications[modifier | modifier le code]
Après sa découverte en 1894, Y. pestis a été rangé dans les Pasteurella, mais son pouvoir pathogène, ses propriétés biochimiques et enzymatiques sont très différents, et le genre Yersinia a été créé pour la distinguer[4].
Y. pestis a d'abord été subdivisé en trois sous-espèces ou biovars (souches se distinguant par des critères biochimiques, mais avec le même pouvoir pathogène)[4] :
- Antiqua, présent en Afrique centrale ;
- Medievalis, présent dans la région de la Mer Caspienne et en Sibérie ;
- Orientalis, présent en Extrême-Orient et en Amérique.
Dans les années 1950, et jusqu'à la fin du XXe siècle, on supposait que ces trois souches étaient à l'origine des trois pandémies historiques de peste : Antiqua pour la peste de Justinien, Medievalis pour la deuxième pandémie, et Orientalis pour la troisième pandémie de peste[4],[5].
Avec la paléogénomique, cette théorie est finalement considérée comme inexacte au début du XXIe siècle : la peste de Justinien est due à un biovar disparu ou non retrouvé, et la deuxième et troisième pandémie à Orientalis. Les autres biovars sont strictement liés aux rongeurs[6].
Il existe une nouvelle nomenclature basée sur le séquençage génétique : Y. pestis est subdivisé en 5 embranchements majeurs, numérotés de 0 à 4[6].
Émergence et évolution[modifier | modifier le code]
Le genre Yersinia comprend trois espèces d'importance médicovétérinaire : Y. enterocolitica, Y. pseudotuberculosis, et Y. pestis. Ces trois espèces peuvent partager ou non des plasmides de virulence[6].
Le génome de Y. pestis est très proche de celui de Y. pseudotuberculosis. Les deux espèces divergent par acquisition ou perte de gènes modifiant les caractères et la virulence de la bactérie.
Néolithique tardif et âge du bronze[modifier | modifier le code]
Une souche ancienne de la bactérie a été identifiée sur un chasseur-pêcheur-cueilleur d’Europe centrale, nommé RV 2039 et daté d'environ 5 000 ans (5300-5050 cal AP) et trouvé à Riņņukalns, au nord de la Lettonie. La souche de Riņņukalns correspond au génome connu de Yersinia pestis le plus ancien depuis la divergence avec Yersinia pseudotuberculosis. Cette souche contient déjà la plupart des gènes de la bactérie médiévale mais il manque le facteur de virulence ymt[7] permettant aux puces d'être vecteur de la maladie, un mode de transmission qui a accru le risque de contamination interhumaine. Cette forme très précoce de Y. pestis était probablement transmise par des morsures de rongeurs et vraisemblablement moins virulente que les souches plus récentes[8],[9]. Elle précède la souche RISE509 trouvée dans l'Altaï (Sibérie)[10].
Une deuxième divergence se produit lors de l'âge du bronze tardif (~ 1800 av. J.C.), avec l'émergence de lignées pleinement adaptées à la transmission par puce, à l'origine de la peste bubonique[11]. Il s'agit ici d'une perte de fonction de trois gènes, facilitant la formation de biofilm bactérien et le blocage proventriculaire de la puce, tandis que l'acquisition du gène PPla permet une invasion plus efficace de l'hôte (mammifère)[6]. Il s'agirait de l'acquisition du gène ymt – Yersinia murine toxin – qui permet la colonisation de l'ensemble de l'intestin de la puce[6]. Cette adaptation a été trouvée chez deux individus associés à la culture Srubnaya de la région de Samara en Russie il y a environ 3 800 ans (âge du bronze) et un individu de l'âge du fer de Kapan, en Arménie, à partir d'environ 2 900 ans.
Interprétations[modifier | modifier le code]
Les études de paléogénomique révèlent que de multiples lignées indépendantes de Y. pestis ont divergé et se sont répandues à travers l'Eurasie, se propageant probablement à travers les premiers réseaux commerciaux plutôt que par des migrations humaines massives. Une première phase de divergences significatives s'est produite à la fin du néolithique avec apparition de trois lignées, l'une toujours actuelle, les deux autres éteintes au néolithique et au début de l'âge du bronze[12]. Cette divergence est postérieure à la souche de Riņņukalns[9].
Ces données plaident en faveur de l'existence de pandémies préhistoriques de peste pouvant expliquer en partie une période de « déclin néolithique » observé en Eurasie occidentale (disparition subite de grandes colonies agricoles lors du VIe millénaire av. J.-C)[13]. Le lieu exact de l'émergence de souches menant aux pandémies historiques de peste reste indéterminé[12].
Les études paléogénomiques confirment la présence de Y. pestis dans les trois pandémies historiques de peste[12],[13]:
- la peste de Justinien au VIIIe siècle[14], liée à une souche d'origine asiatique désormais disparue.
- la deuxième pandémie du XIVe au XVIIIe siècle (incluant la peste noire médiévale)[15], lié au biovar Orientalis. Elle se distingue de la première par une meilleure adaptation à des ectoparasites humains (autres que la puce du rat).
- la troisième pandémie ou peste de Chine, dont les souches dérivent de celles de la seconde pandémie. Elle se caractérise par une diffusion rapide dans les populations locales de rongeurs.
Pouvoir pathogène[modifier | modifier le code]
Parmi les déterminants de la virulence de la bactérie, les principaux sont[1],[12] :
- des protéines de surface, telles que les protéines Yops – Yersinia outer proteins – qui bloquent la phagocytose, inhibent les cytokines proinflammatoires des macrophages, et détruisent le cytosquelette des cellules cibles. D'autres comme la protéase Pla – Plasminogen activator – (du gène PPla) ont des propriétés invasives, fibrinolytiques et anticoagulantes (facteur responsable de la peste septicémique et pulmonaire).
- des régions chromosomiques de pathogénicité interfèrent avec le métabolisme du fer de l'hôte, par la production de sidérophores qui captent le fer au profit du métabolisme de la bactérie.
L'infection humaine est le plus souvent le résultat d'une piqûre de puce, représentant l'injection d'environ 24 000 bactéries[3], alors que la dose minimale infectante est très faible (une dizaine de bactéries)[16]. La plupart d'entre elles sont éliminées efficacement par les granulocytes neutrophiles, mais quelques-unes sont susceptibles de survivre et de se multiplier dans les macrophages[12].
Y. pestis est intracellulaire facultatif, et comme d'autres bactéries à Gram négatif, elle est capable de secréter des protéines de virulence directement à l'intérieur des cellules cibles par « injectisome » ou Système de sécrétion de type III (en). Ceci lui permet de contourner les défenses immunitaires de l'hôte, en coupant ses lignes de communication moléculaire[17].
L'infection à Y. pestis se distingue par la brutalité de la transition entre une phase silencieuse pré-inflammatoire, où la bactérie se dissémine dans la lymphe (peste bubonique), le sang (peste septicémique) ou les poumons (peste pulmonaire), et une violente explosion inflammatoire accompagnée de phénomènes d'apoptose[12].
En laboratoire, le pouvoir pathogène est très marqué pour le rat, le cobaye, la souris, et les primates non-humains. Des modèles animaux de la peste humaine ont été développés, le plus utilisé étant celui de la souris, notamment pour la recherche vaccinale. Cependant le modèle souris ne reproduit pas exactement la peste humaine, car la souris est sensible à une exotoxine produite par Y. pestis qui n'a pas d'activité chez l'Humain[3].
Diagnostic biologique[modifier | modifier le code]
Le diagnostic bactériologique peut se faire par examen direct sur des prélèvements de pus (ponction de bubon), de sang, ou respiratoires (crachats, prélèvement pharyngés....). L'identification précise est faite par profil biochimique, ou l'utilisation de bactériophage lysant uniquement Y. pestis[16].
Y. pestis possède au moins 16 antigènes, mais il existe des antigènes commun avec Yersinia pseudotuberculosis[4]. Le diagnostic immunologique porte principalement sur la détection de l'antigène F1 très spécifique de Y. pestis, soit par sérodiagnostic (hémagglutination passive), soit par ELISA[16]. Cet antigène F1 provient de la capsule bactérienne, il est secrété à 37 °C et thermostable[6]. Il s'agit alors de diagnostic sérologique de confirmation rétrospective (intérêt épidémiologique).
Depuis les années 2000, un test de diagnostic rapide par immunochromatographie a été mis au point. La bandelette permet de détecter l'antigène F1 en 15 minutes[2].
Il existe plusieurs techniques de diagnostic biologique moléculaire, dont la PCR et la spectrométrie de masse. D'autres permettent une discrimination très fine des souches, dans un but épidémiologique ou historique[2],[6].

Épidémiologie[modifier | modifier le code]
Le bacille de Yersin existe chez les rongeurs sauvages qui représentent le réservoir naturel du germe et chez lesquels peut sévir la peste selvatique. Le vecteur intermédiaire principal est le rat, rongeur péri-domestique très sensible au bacille pesteux. L'épizootie chez les rats est propagée par leurs ectoparasites, essentiellement par les puces (Xenopsylla cheopis). Le bacille se développe dans le tube digestif de la puce, le bloquant et incitant la puce à piquer davantage : lors de morsures, des bacilles sont régurgités dans la plaie, assurant ainsi la transmission de la maladie. Lorsque la population de rats est décimée, les ectoparasites en surnombre provenant des cadavres cherchent de nouveaux hôtes : si le nombre de rats survivants est réduit, les puces peuvent chercher à parasiter des hôtes inhabituels, en particulier l'humain. Les puces peuvent rester contagieuses pendant plusieurs semaines.
Le rôle joué par les rats dans l'épidémiologie de la peste explique le cheminement des grandes épidémies de l'histoire. Ces rongeurs étant fréquents dans les ports, le point de départ d'une épidémie sur un continent se situait presque invariablement dans une ville portuaire où les rats pesteux provenant d'un foyer lointain étaient amenés par les navires.
Maladie chez l'humain[modifier | modifier le code]
Chez l'humain, la maladie peut revêtir différents aspects suivant la porte d'entrée du germe et le stade d'évolution :
- après la morsure de puce, le germe se développe sur place et après une courte incubation de 3 à 6 jours atteint par voie lymphatique le premier relais ganglionnaire (souvent inguinal en cas de morsure aux membres inférieurs). Là, la bactérie est provisoirement arrêtée et provoque le gonflement et la suppuration du ganglion, réalisant la peste bubonique, le bubon pouvant se fistuliser et laisser s'écouler le pus. Ce stade local est parfaitement curable et le malade est peu contagieux ;
- la barrière ganglionnaire est rapidement franchie et, à la forme bubonique, fait suite la peste septicémique rapidement mortelle ;
- au cours de l'essaimage du germe, les poumons peuvent être le siège d'un foyer pneumonique. Cette pneumonie pesteuse rend le malade contagieux, les expectorations étant riches en bacilles. La propagation se fait alors très rapidement entre individus par inhalation de particules chargées de germes qui engendrent d'emblée une peste pneumonique sans passer par le stade bubonique.
Prophylaxie et traitement[modifier | modifier le code]
- Maladie à déclaration obligatoire.
- Isolement du cas.
- Mesures de dératisation sur les navires. Quarantaine. Surveillance des rats dans les ports ainsi que des rongeurs sauvages dans les foyers d'endémie.
- Lutte contre les ectoparasites (insecticides).
- La vaccination est utilisée en zone d'endémie (ex. armée américaine au Vietnam) mais son efficacité est de courte durée (3 à 6 mois).
- La précocité du traitement est capitale. Les formes septicémiques et pneumoniques ont une évolution trop rapide tandis que les antibiotiques sont bien actifs au stade bubonique.
Les molécules efficaces contre Y. pestis sont la streptomycine[18],[19], chloramphénicol ou tétracyclines[20] (dont la doxycycline) ou la gentamicine[21]. Y. pestis ne possède pas de résistance naturelle aux antibiotiques, cependant l'acquisition de plasmides procurant cette résistance reste possible, par transmission horizontale avec d'autres entérobactéries. En 2018, aucune épidémie à Y. pestis résistant aux antibiotiques n'a été décrite[16].
Notes et références[modifier | modifier le code]
- Fritz H. Kayser (trad. de l'allemand), Manuel de poche de microbiologie médicale, Paris, Flammarion Médecine-Sciences, , 764 p. (ISBN 978-2-257-11335-1), p. 226 et 303-304.
- Anne-Sophie Leguern, « La réémergence de la peste », La Revue du Praticien, vol. 66, , p. 413-418.
- (en) Stanley Plotkin (dir.) et E. Diane Williamson, Vaccines, Philadelphie, Saunders Elsevier, , 1725 p. (ISBN 978-1-4160-3611-1, lire en ligne), chap. 22 (« Plague vaccines »), p. 519-523.
- Jean-Noël Biraben, Les hommes et la peste en France et dans les pays européens et méditerranéens, t. I : La peste dans l'histoire, Paris, Mouton, , 455 p. (ISBN 2-7193-0930-3), p. 7-9.
- M Achtman, K Zurth, G Morelli, G Torrea, A Guiyoule et E Carniel, « Yersinia pestis, the cause of plague, is a recently emerged clone of Yersinia pseudotuberculosis », Proc Natl Acad Sci USA, vol. 96, no #24, , p. 14043–14048 (PMID 10570195, PMCID 24187, DOI 10.1073/pnas.96.24.14043, Bibcode 1999PNAS...9614043A)
- Gérard Duvallet, Entomologie médicale et vétérinaire, Quae - IRD, (ISBN 978-2-7099-2376-7), p. 465-466.
- Il manque au plasmide pMT1 une section de 20 kb contenant le facteur de virulence appelé Yersinia murine toxin.
- Découverte de la plus ancienne souche de peste chez un fossile humain
- (en) Julian Susat, Harald Lübke et al., A 5,000-year-old hunter-gatherer already plagued by Yersinia pestis, Cell Reports, Volume 35, numéro 13, 29 juin 2021, 109278
- (en) Nicolás Rascovan et al., Emergence and Spread of Basal Lineages of Yersinia pestis during the Neolithic Decline, Cell, Volume 176, numéro 1-2, P295-305.E10, 10 janvier 2019
- (en) Maria A. Spyrou, Rezeda I. Tukhbatova, Chuan-Chao Wang, Aida Andrades Valtueña, Aditya K. Lankapalli, Vitaly V. Kondrashin, Victor A. Tsybin, Aleksandr Khokhlov, Denise Kühnert, Alexander Herbig, Kirsten I. Bos & Johannes Krause, Analysis of 3800-year-old Yersinia pestis genomes suggests Bronze Age origin for bubonic plague, nature.com, 8 juin 2018
- Christian E. Demeure, Olivier Dussurget, Guillem Mas Fiol et Anne-Sophie Le Guern, « Yersinia pestis and plague: an updated view on evolution, virulence determinants, immune subversion, vaccination, and diagnostics », Genes and Immunity, vol. 20, no 5, , p. 357–370 (ISSN 1466-4879, PMID 30940874, PMCID 6760536, DOI 10.1038/s41435-019-0065-0, lire en ligne, consulté le )
- François Renaud, « La peste : Yersinia pestis dans tous ses états », Histoire des Sciences Médicales, vol. II, , p. 177-190.
- (en) I.Wiechmann, G. Grupe « Detection of Yersinia pestis DNA in two early medieval skeletal finds from Aschheim (Upper Bavaria, 6th century A.D.) » American Journal of Physical Anthropology, 2005-126 :48-55
- (en) « DNA of bacteria responsible for London Great Plague of 1665 identified for first time », sur Crossrail (consulté le )
- Adrien Galy, « La peste : mise au point et actualités », sur ResearchGate, Revue de médecine interne, (consulté le )
- Prescott (trad. de l'anglais), Microbiologie, Bruxelles, De Boeck, , 1088 p. (ISBN 978-2-8041-6012-8), p. 822-824.
- (en) Wagle PM. « Recent advances in the treatment of bubonic plague » Indian J Med Sci 1948;2:489–94
- (en) Meyer KF. « Modern therapy of plague » JAMA 1950;144(12):982–5.
- (en) Kilonzo BS, Makundi RH, Mbise TJ. « A decade of plague epidemiology and control in the Western Usambara mountains, north-east Tanzania » Acta Trop. 1992;50(4):323–9.
- (en) Mwengee W, Butler T, Mgema S. et al. « Treatment of plague with gentamicin or doxycycline in a randomized clinical trial in Tanzania » Clin Infect Dis 2006;42(5):614–21.
Liens externes[modifier | modifier le code]
- Ressources relatives au vivant :
- Ressources relatives à la santé :
- Notice dans un dictionnaire ou une encyclopédie généraliste :
- La mise en évidence du bacille de la peste - Texte de Yersin (1894) et commentaires