Brome
| Brome | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Ampoule de brome. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Position dans le tableau périodique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Br | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom | Brome | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro atomique | 35 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe | 17 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Période | 4e période | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloc | Bloc p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Famille d'éléments | Halogène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Ar] 3d10 4s2 4p5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques de l'élément | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 79,904 ± 0,001 u[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | 115 pm (94 pm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 120 ± 3 pm[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | 195 pm[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État d’oxydation | -1, 0, 1, 3, 5, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 2,96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | Acide fort | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 11,813 8 eV | 2e : 21,591 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e : 36 eV | 4e : 47,3 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5e : 59,7 eV | 6e : 88,6 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7e : 103,0 eV | 8e : 192,8 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques du corps simple | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | Liquide (non-magnétique) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allotrope à l'état standard | Dibrome Br2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 7,59 g·l-1 (gaz)[1] 3,12 g·cm-3 (liquide, 20 °C)[1] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Système cristallin | Orthorhombique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | brun rougeâtre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | −7,2 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | 58,8 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 5,286 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 29,96 kJ·mol-1 (1 atm, 58,8 °C); 30,91 kJ·mol-1 (1 atm, 25 °C)[1] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 21,055×10-3 m3·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | 5 800 Pa à 6,95 °C[réf. nécessaire] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 206 m·s-1 à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 480 J·kg-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 0,122 W·m-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | [4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dibrome Br2 :H314, H330, H400, P210, P273, P304+P340, P305+P351+P338, P309+P310 et P403+P233 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dibrome Br2 : |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le brome est un élément chimique de la famille des halogènes, de symbole Br et de numéro atomique 35. Les autres halogènes sont le fluor, le chlore, l'iode et l'astate. Son nom dérive du mot grec « bromos » (puanteur) en raison de son odeur piquante.
Le brome existe dans les conditions normales de température et de pression sous forme du corps simple dibrome Br2 de couleur brunâtre. C'est une molécule diatomique homonucléaire
Antoine Jérôme Balard et Carl Löwig ont découvert ce corps simple simultanément en 1825.
L'élément chimique brome est peu abondant, il n'est que le 62e élément chimique de la croute terrestre[6]. Dans la nature, il n'est jamais présent sous forme de dibrome, mais le plus souvent sous forme de bromure. À cause du lessivage des roches et de la grande solubilité de nombreux bromures métalliques, l'élément chimique brome s'est accumulé dans les océans où il n'est que 289 fois moins présent que l'élément chimique chlore. L'eau de mer est donc un bon minerai de brome. Les eaux de la mer morte contiennent 50 000 ppm d'ions bromure et constituent, avec des gisements aux USA et en Chine, les principales réserves mondiales[6] .
Dans les minerais, l'ion bromure est souvent associé à l'argent. Le minéral correspondant est la bromargyrite AgBr (découvert à Mexico en 1841)[7] et embolite Ag(Br, Cl).
Histoire

Le premier composé du brome utilisé (bien avant que l'élément chimique ne soit isolé) remonte à l'antiquité. Le magnifique pigment mentionné dans la bible[8] et connu des romains sous le nom de pourpre de Tyr a été analysé en 1909 par P. Friedländer ; c'est le 6,6'-dibromoindigo[7]. Ce colorant était à l'époque extrait de l'escargot Murex brandaris. Il en fallait 12 000 pour préparer 1,5 g de colorant.
Le brome a été découvert indépendamment par Antoine Jérôme Balard en 1826[9] et par Carl Löwig en 1825[10]. Voir un fac-similé du mémoire de Balard à cette référence[11].
Le chimiste Antoine Jérôme Balard a trouvé le brome dans les eaux mères restant après avoir cristallisé le chlorure de sodium et le sulfate de sodium des prés-salés de Montpellier. Le jeune Balard (23 ans) avait remarqué la coloration jaune-soutenu de cette eau lors de l'addition de dichlore. L'extraction par l'éther et la potasse conduisait à un sel (KBr) qu'il traita par le dioxyde de manganèse MnO2 (oxydant) en présence d'acide sulfurique. Il obtint ainsi un liquide rouge (Br2) Balard développa rapidement la chimie du brome et reconnu son caractère élémentaire, par comparaison au monochlorure d'iode ICl qui avait été isolé 15 ans auparavant[7]. Balard a nommé cet élément « muride », dérivé du latin muria[12].
Un an plus tôt, en 1825, le chimiste Carl Löwig avait pu isoler un peu de dibrome en l'extrayant d'un échantillon d'eau. Pour extraire le dibrome de l'eau, il a saturé la solution avec du dichlore et l'a extrait grâce à sa solubilité dans l'éther diéthylique. L'évaporation de ce solvant a laissé une substance liquide brune. Malheureusement, le retard de la publication de sa découverte a permis à Antoine Balard[13] de publier en premier la découverte de ce nouvel élément chimique.
Après que les trois chimistes français Louis-Nicolas Vauquelin, Louis Jacques Thénard, et Louis Joseph Gay-Lussac eurent approuvé la découverte de Balard, ses résultats furent présentés à l'Académie des sciences et publiés dans les Annales de chimie et physique. Dans sa publication, à la demande de M. Anglada, Balard changea le nom muride en Brôme ou brome, du grec βρωμος (bromos) qui signifie puanteur [14].
Le brome (avec le chlore et l'iode) a pris une place importante, au cours de l'histoire de la chimie, pour comprendre la structure des composés organiques. Par exemple, Jean-Baptiste Dumas formulait en 1838 (bien avant que la tétravalence du carbone soit établie) une théorie de la substitution dont une des règles indiquait que, lors d'une déhydrogénation par le chlore, le brome ou l'iode, un atome H était remplacé par un atome d'halogène.
Production
La production industrielle du dibrome résulte de l'oxydation des ions bromure par le dichlore[7]. La source de bromure en Amérique est généralement la saumure d'Arkansas qui en contient quatre à cinq mille ppm. L'Europe s'approvisionne dans les eaux de la Mer morte (4000 à 6000 ppm). L'eau des océans avec 65 ppm reste une source utilisée.
Après oxydation par le dichlore, le dibrome est extrait en insufflant un courant d'air dans la solution de dibrome. Le dibrome est ensuite condensé et purifié. Bien que le procédé soit simple dans son principe, il nécessite, d'un point de vue technologique, de mettre en place des matériaux hautement résistants à l'oxydation[15].
Isotopes
Le brome possède 32 isotopes connus, de nombre de masse variant de 66 à 97, ainsi que 13 isomères nucléaires. Parmi ces isotopes, deux sont stables, le brome 79 et le brome 81, et constituent l'ensemble du brome naturel dans une proportion 50/50. La masse atomique standard du brome est donc de 79,904(1) u.
Le radioisotope a plus longue durée de vie est le brome 77, avec une demi-vie de 57,036 heures.
Propriétés

Dans les conditions normale, le dibrome est un liquide de densité supérieure à 3 (ce qui est beaucoup comparé aux liquides usuels, mais nettement moins que le mercure qui a une densité voisine de 13,6) et de couleur brun-rouge. Il est toxique et non-métallique à pression ordinaire (il le devient à très haute pression, à partir de 55 GPa). A température ordinaire, c'est un liquide extrêmement volatil qui dégage des vapeurs rousses, de la même couleur que le dioxyde d'azote. Avec le mercure, le dibrome est le seul corps simple liquide à température ambiante. Il dégage une odeur suffocante apparentée à celle du dichlore. Son point de fusion est de -7,2 °C (19 °F, 265,8 K) ; dans un environnement froid le dibrome peut donc facilement geler. Son point d'ébullition n'est pas très élevé : 58,8 °C (137,8 °F, 332 K)[16] car les interactions entre molécules de dibrome sont faiblement attractives ; ce sont des interactions de van der Waals.
Le dibrome est plus oxydant que le diiode mais moins que le dichlore. Son potentiel rédox est E° = 1,07 V (1,36 V pour Cl2/Cl- et 0,54 V pour I2/I-). Il réagit avec la plupart des autres corps simples, donc les métaux, pour former des sels : bromure de sodium, bromure de fer etc.
Le brome est l'un des sept éléments qui forment une molécule diatomique, à l'instar de O2, N2, etc. Il réagit avec la majorité des composés organiques.
La solubilité dans l'eau du dibrome est largement supérieure à celle des autres dihalogènes. Elle est de 35 grammes par litre, soit 0,214 mol.L-1. La solution de dibrome dans l'eau s'appelle l'eau de brome. Elle est surmontée de vapeur de dibrome ; cette vapeur est d'autant plus colorée que l'eau de brome est concentrée (loi de Henry). L'eau de brome est légèrement acide (jusqu'à pH = 2,6 pour une concentration élevée[17]). Le dibrome est également largement soluble dans les solvants organiques.
L'élément chimique brome entre dans la composition de plusieurs composés interhalogénés : BrF, BrF3, BrF5, BrCl et IBr. Leur formation se produit par interaction directe entre les dihalogènes correspondants dans la bonne stœchiométrie. Dans les composés BrF3 et dans BrF5, l'atome central est Br. Ce dernier adopte une géométrie conforme à celle prévue par la théorie VSEPR. Les anions interhalogénés existent également comme par exemple BrF6-.
Dans des conditions fortement oxydantes, Br2 devient cationique (Br2+). C'est le cation dibrominium. Le cation Br5+ existe également.
Dans l'eau en présence d'ions bromure, le dibrome se transforme en tribromure Br3- (à l'image de l'ion triodure I3-, plus connu). En milieu aqueux basique, le dibrome se dismute en ions bromure Br- et ions bromate BrO3-, ce que montre bien un diagramme de Pourbaix (à faire). Dans l'eau les entités Br2, Br3-, HBrO, BrO-, HBrO3 et BrO3- coexistent[17].
Le bromure d'argent AgBr est moins soluble que son homologue AgCl et plus que AgI. La précipitation de AgBr résultant de l'addition d'une solution de nitrate d'argent à une solution de bromure de sodium est une réaction classique en chimie analytique qualitative ou quantitative. Cette dernière peut être suivie par potentiométrie avec une électrode d'argent et une électrode de référence au calomel protégée par une allonge de nitrate de sodium.
En chimie de coordination, la série spectrochimique montre que le ligand bromure est à champ plus faible que le ligand chlorure.
En chimie organique, les halogénures d'alkyle s'hydrolysent assez facilement en présence d'eau. Plus généralement, l'ion bromure est un bon groupe partant dans les conditions d'une substitution nucléophile.
Utilisations
- Utilisation courante pour la désinfection de l'eau des piscines[18].
- L'utilisation du bromure d'argent en photographie argentique a été un procédé gros consommateur d'élément chimique brome. L'implication de AgBr dans le procédé photographique remonte à 1840[7]. Ce procédé est devenu minoritaire, faisant place aux photos numériques ;
- L'usage du bromure de potassium KBr comme sédatif et anti-convulsant dans le traitement de l'épilepsie a été initié en 1857[7]. Un bromure (bromure de potassium) a été utilisé pour calmer ou inhiber le désir sexuel de soldats vivant dans la promiscuité ou en opération. Ce sont ses propriétés de perturbateur endocrinien (anti-androgènes) qui étaient impliquées.
- C'est devenu un contaminant courant de l'environnement (sous forme de PBPE) ; Il figure en effet parmi des centaines de composés retardateur de flamme très couramment utilisés dans des isolants, matières plastiques et textiles (surtout utilisés aux USA où la règlementation a tardé à prendre en compte l'écotoxicité et la toxicité de nombreux polybromodiphényléthers. On en trouve aujourd'hui dans tous les organismes animaux filtreurs ou prédateurs de la planète, et ils s'avèrent pour certains être facteurs de délétion de la spermatogenèse et facteurs de débilité mentale à faible dose (Voir l'article polybromodiphényléther pour plus de détails).
- Et encore dans les lampes halogènes, les extincteurs, les colorants, en cosmétique (notamment pour les cheveux).
- De nombreux intermédiaires de synthèse en chimie fine contiennent un atome de brome, auquel on substitue d'autres groupements lors d'étapes ultérieures de synthèse.
Les traces de dibrome présentes dans l'atmosphère proviennent du gaz « halon » relâché par l’utilisation des extincteurs ainsi que par la transformation de certains produits agricoles.
Composés
Composés minéraux
Les composés minéraux du brome sont pour beaucoup des bromures au sens strict (c'est-à-dire où l'anion Br- est présent). Certains composés également nommés "bromure" sont des composés moléculaires (ex. bromure de soufre). Il existe aussi de nombreux composés du brome aux nombres d'oxydation différents de -I comme les oxoanions et leurs acides correspondant, ou les composés interhalogénés.
Bromure ioniques
Les bromures sont dits ioniques si l'élément brome n'est pas lié à un voisin par une liaison covalente, éventuellement polarisée, mais s'il est présent à titre d'ion individuel Br-.
Bromures métalliques

Il existe de nombreux bromures métalliques comme le bromure de sodium, le bromure de cuivre CuBr2 etc. Ce sont tous des solides dans les conditions normales. Ils ne sont colorés que quand l'ion métallique est coloré, sinon, ils sont blancs comme le bromure de sodium ci-contre, l'ion bromure ne participant pas à la couleur du sel.
Contre ion
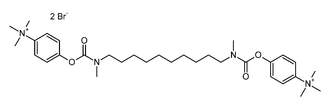
L'ion bromure se rencontre souvent comme contre ion d'ions complexes, par exemple dans le cas des ammonium organiques. C'est le cas du bromure de démécarium de formule ci-contre. Ce composé est un inhibiteur de l'acétylcholinestérase.
C'est aussi le cas avec les composés organomagnésiens, par exemple le bromure de phényle magnésium C6H5MgBr.
Bromures moléculaires
Les bromures sont moléculaires s'il existe une liaison covalente, le plus souvent polarisée, entre Br et son atome voisin. Dans cette section ne sont traités que les composés inorganiques. Les bromures organiques sont mentionnés plus loin.
Acide bromhydrique
Le bromure d'hydrogène HBr est un gaz dans les conditions normales, structurellement identique au chlorure d'hydrogène plus connu, HCl. Sa solution aqueuse est l'acide bromhydrique ; c'est un acide est un acide fort dans l'eau.
Dérivés d'acides

De nombreux composés du brome dérivent d'un acide minéral (pour les acides organiques voir ci-dessous) par remplacement du groupe d'atome OH par Br. C'est le cas du bromure de thionyle SOBr2, formule ci-contre et du bromure de sulfuryle SO2Br2 qui sont des dérivés de l'acide sulfureux et de l'acide sulfurique respectivement.
Les composés phosphorés tribromure de phosphore PBr3 et pentabromure de phosphore PBr5 sont des dérivés de l'acide phosphoreux H3PO3 et de l'acide phosphorique H3PO4 respectivement.
Composés interhalogénés
Les composés interhalogénés sont des composés moléculaires qui ne contiennent que des atomes d'halogènes. Ils sont préparés par interaction directe de deux dihalogènes (par exemple Br2 et Cl2). Plusieurs composés interhalogénés contiennent du brome:
- Les composés contenant F et Br :
- BrF
- BrF3
- Le pentafluorure de brome BrF5 : liquide incolore fumant, très toxique, extrêmement réactif y compris avec l'eau au contact de laquelle il explose.
- Un composés contenant Br et Cl : BrCl.
- Deux composés contenant I et Br
- IBr
- IBr5
Autres bromures

Le bromure de soufre SBr2 est un liquide orange-rouge (voir photo). C'est un composé qui a la même structure que le sulfure d'hydrogène H2S.
Oxoanions
Les anions oxygénés du brome existent aux degrés d'oxydation +I, +III, +V et +VII. Il s'agit respectivement de l'ion hypobromite BrO-, bromite BrO2-, bromate BrO3- et perbromate BrO4-. Dans l'eau, l'ion bromate est majoritaire en milieu basique. L'ion hypobromite est responsable du caractère bactéricide du brome mis à profit dans la stérilisation de l'eau par le dibrome. L'ion perbromate n'a été synthétisé que tardivement (1968 par radiochimie[19], 1969 par une méthode chimique[20]).
Ces oxoanions sont des bases dont l'acide conjugué est d'autant plus fort que le brome est dans un état d'oxydation élevé. L'acide bromique HBrO3 et l'acide perbromique HBrO4 sont des acides forts.
Composés organiques

De très nombreux composés organiques contiennent du brome. Ils sont structurellement identique à leurs homologues chlorés. Par exemple le bromure d'acétyle CH3COBr dérive de l'acide éthanoïque par remplacement du groupe d'atomes OH par l'atome Br. Il est structurellement identique au chlorure d'acétyle CH3COCl. Certains ont une importance industrielle :
- Le dibromoéthane a été un additif des essences qui captait le plomb provenant de la décomposition de l'antidétonnant PbEt4 (Tétraéthylplomb). La production du dibromoéthane consommait (dans les années 70) à elle seule 70% de la production mondiale de brome[11]. La disparition de ces additifs dans les essences a été compensé par l'émergence d'autres utilisation du brome (en particulier le bromométhane)[15].
- L'éosine B contient deux atomes de brome par molécule et l'éosine Y en contient quatre.
- De nombreux composés du brome contribuent à la destruction de la couche d'ozone (60 fois plus "efficaces" que les CFC). Un plan d'élimination est programmé au niveau mondial (protocole de Montréal). Notamment:
- Bromure de méthyle CH3Br : Pesticide à très large spectre (vers, insectes, rongeurs). Il est très toxique par inhalation. Le bromométhane est le plus efficace des nématicides connu, pour tuer les vers[15].
- Halons, composés de carbone, fluor, brome et chlore (CF3Br, CF2BrCl, C2F4Br2) utilisés pour éteindre les incendies, notamment en présence d'électricité.
Voir aussi
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- Paul Arnaud, Brigitte Jamart, Jacques Bodiguel, Nicolas Brosse, Chimie Organique 1er cycle/Licence, PCEM, Pharmacie, Cours, QCM et applications, Dunod, , 710 p., Broché (ISBN 2100070355)
- Base de données Chemical Abstracts interrogée via SciFinder Web le 15 décembre 2009 (résultats de la recherche)
- Entrée « Bromine » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 21 août 2018 (JavaScript nécessaire)
- http://www.societechimiquedefrance.fr/produit-du-jour/brome.html
- N.N. Greenwood, A. Earnshaw (2003). Chemistry of the Elements, Elsevier Ed., p.793.
- Ezekiel, 27:7,16.
- (en) A. J. Balard, « Mémoire sur une substance particulière contenue dans l'eau de la mer" », Annales de Chimie et de Physique 2nd series, vol. 32, , p. 337–381 (lire en ligne)
- (en) Carl Löwig, « Über Brombereitung und eine auffallende Zersetzung des Aethers durch Chlor (Sur la préparation du brome et une éclatante décomposition de l'éther par le chlore) », Magazine für Pharmacie, vol. 21, , p. 31–36 (lire en ligne)
- http://www.persee.fr/web/revues/home/prescript/article/pharm_0035-2349_1977_num_65_232_1749
- Antoine Balard, « Mémoire sur une substance particulière contenue dans l'eau de la mer », Annals of Philosophy, , p. 387– and 411– (lire en ligne)
- (en) Carl Löwig, « Ueber einige Bromverbindungen und über Bromdarstellung », Annalen der Physik, vol. 90, no 11, , p. 485–499 (DOI 10.1002/andp.18280901113)
- pages 382-384.
- N.N. Greenwood, A. Earnshaw (2003). Chemistry of the Elements, Elsevier Ed., p.798.
- http://www.chemicalelements.com/elements/br.html
- Michalowski T. (1994). Calcultation of pH and Potential E for Bromine Aqueous Solution. J. Chem. Educ. 71(7) p.560-2.
- [1]
- Evan H. Appelman (1968). Synthesis of perbromates, J. Am. Chem. Soc., 1968, 90 (7), pp 1900–1901. http://pubs.acs.org/doi/abs/10.1021/ja01009a040
- E.H. Appelman (1969). Research Article Perbromic acid and perbromates: synthesis and some properties, J. Am. Chem. Soc., 8, 223-7. http://pubs.acs.org/doi/abs/10.1021/ic50072a008
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux Alcalins |
Alcalino- terreux |
Lanthanides | Métaux de transition |
Métaux pauvres |
Métal- loïdes |
Non- métaux |
Halo- gènes |
Gaz nobles |
Éléments non classés |
| Actinides | |||||||||
| Superactinides | |||||||||





