« Herpès » : différence entre les versions
→Recherche : mise en forme |
m utilisation du modèle:Cite pmid |
||
| Ligne 33 : | Ligne 33 : | ||
En France, une étude {{pc|Herpimax}} publiée en 2002 a porté sur un échantillon de {{formatnum:4,412}} personnes collecté en 1996 dans le cadre du programme SU.VI.MAX. |
En France, une étude {{pc|Herpimax}} publiée en 2002 a porté sur un échantillon de {{formatnum:4,412}} personnes collecté en 1996 dans le cadre du programme SU.VI.MAX. |
||
Cette étude a fait ressortir une [[séroprévalence]] moyenne dans la population de 67 % pour le HSV-1 et de 17,2 % pour le HSV-2<ref name="stiFR2002">{{ |
Cette étude a fait ressortir une [[séroprévalence]] moyenne dans la population de 67 % pour le HSV-1 et de 17,2 % pour le HSV-2<ref name="stiFR2002">{{Cite pmid |12238654}}</ref>. |
||
En Australie, une étude publiée en 2006 a porté sur un échantillon de {{formatnum:4,000}} personnes collecté en 1999-2000 dans le cadre du programme AusDiab. |
En Australie, une étude publiée en 2006 a porté sur un échantillon de {{formatnum:4,000}} personnes collecté en 1999-2000 dans le cadre du programme AusDiab. |
||
| Ligne 223 : | Ligne 223 : | ||
* l'émodine aurait un effet anti-HSV chez la souris<ref>{{en}} Xiong HR, Luo J, Hou W, Xiao H, Yang ZQ. « The effect of Emodin; an anthraquinone derivative extracted from the roots of Rheum tanguticum; against Herpes Simplex Virus in vitro and in vivo » ''J Ethnopharmacol.'' 2011 Jan 27;133(2):718-23. Epub 2010 Nov 2. PMID 21050882</ref>. L’émodine peut être extraite de diverses plantes dont la [[rhubarbe]] ornementale (''{{Lang|la|Rheum palmatum}}'') ou la [[renouée du Japon]] (''{{Lang|la|Fallopia japonica}}'' ou ''{{Lang|la|Polygonum cuspidatum}}''). |
* l'émodine aurait un effet anti-HSV chez la souris<ref>{{en}} Xiong HR, Luo J, Hou W, Xiao H, Yang ZQ. « The effect of Emodin; an anthraquinone derivative extracted from the roots of Rheum tanguticum; against Herpes Simplex Virus in vitro and in vivo » ''J Ethnopharmacol.'' 2011 Jan 27;133(2):718-23. Epub 2010 Nov 2. PMID 21050882</ref>. L’émodine peut être extraite de diverses plantes dont la [[rhubarbe]] ornementale (''{{Lang|la|Rheum palmatum}}'') ou la [[renouée du Japon]] (''{{Lang|la|Fallopia japonica}}'' ou ''{{Lang|la|Polygonum cuspidatum}}''). |
||
* le [[xylomannan]], un polysaccharide sulfaté issu d'algues rouges comme ''Nothogenia fastigiata '', aurait un effet sur la réplication de l'HSV-1 et l'HSV-2<ref name="damonte1994">{{Cite pmid |8031312}}</ref>. De plus, cette molécule est capable de diminuer l’adsorption du virus sur ses cellules hôtes. Son activité semblerait également plus efficace que l'[[héparine]]<ref name="ghoh2009">{{Cite pmid |19641232}}</ref>. |
* le [[xylomannan]], un polysaccharide sulfaté issu d'algues rouges comme ''Nothogenia fastigiata '', aurait un effet sur la réplication de l'HSV-1 et l'HSV-2<ref name="damonte1994">{{Cite pmid |8031312}}</ref>. De plus, cette molécule est capable de diminuer l’adsorption du virus sur ses cellules hôtes. Son activité semblerait également plus efficace que l'[[héparine]]<ref name="ghoh2009">{{Cite pmid |19641232}}</ref>. |
||
* Le galactofucane sulfaté, extrait d'un grand nombre d'algues brunes (notamment présent chez ''Undaria pinnatifida,'' le "wakamé" communément consommé en Asie), présenterait potentiellement une activité anti-herpétique. En effet, une étude épidémiologique menée sur différentes communautés à travers le monde a révélé une importante différence de séroprévalence du virus HSV-2, notamment entre des femmes d'origine |
* Le galactofucane sulfaté, extrait d'un grand nombre d'algues brunes (notamment présent chez ''Undaria pinnatifida,'' le "wakamé" communément consommé en Asie), présenterait potentiellement une activité anti-herpétique. En effet, une étude épidémiologique menée sur différentes communautés à travers le monde a révélé une importante différence de séroprévalence du virus HSV-2, notamment entre des femmes d'origine afro-américaine et japonaise, chez lesquelles celui-ci était respectivement de 50 % et 7 %<ref name="cooper2002">{{Cite pmid |12443533}}</ref>{{,}}<ref>{{Article |langue=en |auteur1=Nahmias AJ |titre= Sero-epidemiological and -sociological patterns of Herpes simplex virus infection in the world |périodique=Scandinavian journal of infectious diseases |numéro= |jour= |mois= |année=1990 |issn = |lire en ligne = |pages = }}</ref>. Malgré l'absence de résultats cliniques à ce jour, le lien entre l'ingestion régulière de macroalgues marines contenant ces polysaccharides sulfatés et le faible taux de prévalence de ce virus chez les populations japonaises, a été fortement suspecté. Des résultats obtenus lors de précédentes études ont montré que des fractions aqueuses de ''Undaria pinnatifida'' ainsi que des extraits de galactofucanes sulfatés, partiellement purifiés, avaient une activité anti-herpétique ''in vitro'' sur toutes les souches virales testées, activité par ailleurs plus forte contre les souches HSV-2 en comparaison avec les souches HSV-1<ref>{{Article |langue=en |auteur1=Thompson KD |titre=Anti-viral activity of Tasmanian seaweed extracts against clinical strains of Herpes simplex virus |
||
| ⚫ | |||
with healing and inhibition of reactivation of Herpes|périodique = BMC Complementary |
|||
| ⚫ | seaweed extracts against Herpes simplex virus (HSV)|périodique = Abstract. 27th International Herpes virus workshop conference |numéro= |jour= |mois= |année=2002 |issn= |lire en ligne= |pages= }}</ref>. Le mode d'action de ces extraits a été identifié comme étant une inhibition de l'adsorption du virus sur la membrane de la cellule hôte. En comparaison, les souches traitées à l'acyclovir, molécule largement utilisée actuellement comme anti-herpétique, s’avéraient pour un grand nombre d'entre elles être résistantes à ce traitement. |
||
and Alternative Medicine|numéro = |jour = |mois = |année = 2002|issn = |lire en ligne = |pages = }}</ref><ref>{{Article|langue = |auteur1 = Nahmias AJ|titre = Sero-epidemiological |
|||
and -sociological patterns of Herpes simplex virus infection |
|||
in the world|périodique = Scandinavian journal of infectious diseases|numéro = |jour = |mois = |année = 1990|issn = |lire en ligne = |pages = }}</ref>. Malgré l'absence de résultats cliniques à ce jour, le lien entre l'ingestion régulière de macroalgues marines contenant ces polysaccharides sulfatés et le faible taux de prévalence de ce virus chez les populations japonaises, a été fortement suspecté. Des résultats obtenus lors de précédentes études ont montré que des fractions aqueuses de ''Undaria pinnatifida'' ainsi que des extraits de galactofucanes sulfatés, partiellement purifiés, avaient une activité anti-herpétique ''in vitro'' sur toutes les souches virales testées, activité par ailleurs plus forte contre les souches HSV-2 en comparaison avec les souches HSV-1<ref>{{Article|langue = |auteur1 = Thompson KD|titre = Anti-viral activity of Tasmanian seaweed |
|||
extracts against clinical strains of Herpes simplex virus |
|||
| ⚫ | |||
seaweed extracts against Herpes simplex virus (HSV)|périodique = Abstract. |
|||
| ⚫ | 27th International Herpes virus workshop conference|numéro |
||
== Notes et références == |
== Notes et références == |
||
Version du 3 octobre 2014 à 00:48
| Causes | Human alphaherpesvirus 1 (en) ou Human alphaherpesvirus 2 (d) |
|---|---|
| Transmission | Transmission par contact (d), transmission aéroportée (d) et transmission placentaire (d) |
| Incubation min | 4 j |
| Incubation max | 12 j |
| Symptômes | Exanthème, fièvre légère (d), phlyctène et adénopathie |
| Médicament | Vidarabine (en), benzocaïne, foscarnet, trifluridine, penciclovir (en), valaciclovir, aciclovir, docosanol, acedoben sodium (d) et famciclovir |
|---|---|
| Spécialité | Infectiologie et dermatologie |
| CISP-2 | S71 |
|---|---|
| CIM-10 | A60, B00, G05.1, P35.2 |
| CIM-9 | 054.0, 054.1, 054.2, 054.3, 771.2 |
| DiseasesDB | 5841 33021 |
| eMedicine | 218580 |
| MeSH | D006561 |
L'herpès est une maladie virale contagieuse responsable d'affection de la peau et des muqueuses caractérisée par une éruption vésiculeuse de boutons groupés.
L'herpès est une maladie considérée comme bénigne chez les sujets en bonne santé, mais peut se révéler très sérieuse chez les sujets présentant un déficit immunitaire, les nourrissons ou les femmes enceintes.
Cette maladie, vécue parfois péniblement, ne peut jamais être totalement guérie et impose donc au porteur de prendre des précautions, y compris en dehors des crises où il reste potentiellement contagieux.
Virus
- Le virus de l'herpès, Herpes simplex virus (HSV), appartient à la famille Herpesviridae. Cette famille comprend aussi le virus de la varicelle et du zona, ainsi que le cytomégalovirus HHV-5, et le Virus d'Epstein-Barr. Comme tous les Herpesviridae, le virus de l'herpès est un virus à ADN double brin classé dans le Groupe I.
- Le virus de l’herpès comprend deux types :
- HSV-1 responsable de 95 % des herpès oro-faciaux, ainsi que bon nombre d'herpès neuro-méningés et ophtalmiques. Selon les études il est aussi responsable de 20 à 40 % des herpès génitaux par contamination oro-génitale.
- HSV-2 responsable principalement de l’herpès génital, mais aussi de 5 % des herpès oro-faciaux.
- Les HSV sont des virus dermoneurotropes, comme le virus de la varicelle, malgré la réponse immunitaire de la primo infection, ils persistent la vie entière dans le ganglion de Gasser pour les manifestations oro-faciales et les ganglions sacrés pour les manifestations anales, génitale et fessières.
Épidémiologie
La contamination est strictement inter-humaine pour les deux types viraux[1].
En France, une étude Herpimax publiée en 2002 a porté sur un échantillon de 4,412 personnes collecté en 1996 dans le cadre du programme SU.VI.MAX. Cette étude a fait ressortir une séroprévalence moyenne dans la population de 67 % pour le HSV-1 et de 17,2 % pour le HSV-2[2].
En Australie, une étude publiée en 2006 a porté sur un échantillon de 4,000 personnes collecté en 1999-2000 dans le cadre du programme AusDiab. Cette étude a fait ressortir une séroprévalence moyenne dans la population de 75,7 % pour le HSV-1 et de 12,1 % pour le HSV-2[3].
Aux États-Unis, une étude publiée en 2006 a porté sur un échantillon de 11 508 personnes collecté en 1999-2004 dans le cadre du programme NHANES du National Center for Health Statistics. Cette étude a fait ressortir une séroprévalence moyenne dans la population de 57,7 % pour le HSV-1 et de 17,0 % pour le HSV-2[4]. En mars 2010, les Centers for National Disease ont indiqué que la prévalence du HSV-2 restait élevée (16,2 %) plus particulièrement chez les Afro-Américains (39,2 % de prévalence) et les femmes noires (48,0 % de prévalence)[5].
L'herpès est mal diagnostiqué, soit parce qu'il est asymptomatique, soit parce qu'il est confondu avec une mycose ou une irritation, soit parce que les patients n'arrivent pas à obtenir un rendez-vous suffisamment tôt chez leur médecin. Un tiers de la population adulte présenterait des symptômes de l'herpès, mais à peine un quart de ces personnes ont vu leur diagnostic confirmé par un médecin[6].
Physiopathologie
Les HSV 1 et 2 sont des virus connus depuis longtemps. Ils peuvent infecter l’homme sans danger pendant toute une vie en restant sous forme dormante dans les ganglions nerveux[réf. nécessaire]. De l’autre côté, ils peuvent se manifester sous des formes génitale et faciale qui se propagent facilement chez les sujets ayant des contacts intimes. La virulence de la primo infection dépend aussi du type d’herpès ainsi que de sa souche mais aussi de l’âge de l’hôte et de son statut immunitaire. Ainsi la primo-infection est plus spécialement asymptomatique chez le jeune enfant[7]. Normalement, la primo-infection est asymptomatique et est un élément crucial dans la limitation de la réplication du virus ce qui permet généralement l’évitement des symptômes. Cependant, quelques individus peuvent expérimenter une infection primaire avec des vésicules d’herpès gingivo-stomatique[8]. Généralement, l’infection par l’herpès génital, qui peut elle aussi être asymptomatique, peut présenter des lésions génitales ulcérantes accompagnées ou non de symptômes généralisés tels que fièvre et maux de tête[9],[10]. Une infection herpétique peut mener à un herpès cornéen.
Les infections herpétiques se propagent rarement vers d’autres organes. Généralement, seuls les patients immunodéprimés ou les femmes enceintes peuvent présenter des complications plus graves telles que par exemple une méningite[11],[12]. Dans les cas de l'herpès 1 ou communément appelé herpès labial, les manifestations sont fréquentes sur le pourtour de la bouche ou autour des narines, mais également à l'intérieur de la bouche, au fond de la gorge, sur les gencives, sur les joues ou sur le front, voire les yeux. Pour l'herpès génital (hsv-2), les manifestations se situent principalement près des organes génitaux. Cependant, il est possible de voir une infection au HSV-1 sur les organes génitaux et une infection HSV-2 dans la région faciale. De plus, la persistance du virus est définitive, on reste porteur du virus dans les ganglions sensitifs jusqu’à sa mort.
La pénétration du virus dans l'organisme se produit à l'occasion d'un contact avec un sujet infecté (même s'il n'y a pas de manifestations cutanées) : les virus pénètrent chez l'hôte lorsqu'il existe une brèche cutanéo-muqueuse, et vont se multiplier dans les cellules épithéliales où ils sont responsables d'une dégénérescence cellulaire avec ballonisation aspécifique. Ces mécanismes peuvent être à l'origine des manifestations de primo-infection herpétique. Dans un second temps, les virus vont rejoindre le ganglion nerveux correspondant à la zone infectée, par voie centripète, en « remontant » le long des nerfs sensitifs. Enfin, les récurrences herpétiques se produisent lorsque, en réponse à un stress physique ou psychique variable, les virus regagnent la peau pour s'y développer à nouveau. Ces épisodes sont plus ou moins fréquents d'un individu à l'autre, et d'intensité variable, mais fixes dans leur topographie.
Lors de cette primo-infection une lutte entre le système immunitaire et le virus est engagée ce qui inhibe en partie la réplication du HSV dans le corps humain. Les armes de défense non spécifiques sont utilisés dès le début de l’infection. Les macrophages orchestrent en grande partie cette défense anti-herpétique dans les premières heures de l’infection. Le HSV induit la production de INF-α/β et de TNF chez les macrophages. Ces cytokines jouent un rôle d'activateur sur les macrophages eux-mêmes et sur leur production d'espèces réactives de l'oxygène (ERO) qui ont tous deux comme résultats de freiner la prolifération du virus dans les cellules avoisinantes[13]. Cependant, le virus HSV 1 et 2 contourne le système de défense de l’hôte. En effet, l’herpès contourne les mécanismes de défenses par l’inhibition de la présentation de l’antigène de surface des cellules hôte infectées. Le virus inhibe donc l'exposition du CMH1 et donc inhibe l'action des T cytotoxique. Les virus HSV 1 et 2 s'expriment tous deux, rapidement après l’invasion de l’hôte, par une protéine ICP47 qui inhibe le transporteur de l’antigène[14], ainsi l'anticorps ne peut pas exécuter son action de reconnaissance.
Manifestations cliniques
Dans la moitié des cas, les manifestations cliniques de la primo-infection sont parfaitement asymptomatiques. Dans l'autre moitié, les manifestations sont la plupart du temps caractérisées par un bouquet de vésicules transparentes devenant rapidement jaunâtres et croûteuses avec des sensations de picotements, de brûlures ou de démangeaisons caractérisées[15].
Alors que les patients symptomatiques et asymptomatiques ont des taux d'excrétion virale identiques, on ne sait pas encore pourquoi la réactivation du virus a tendance à être asymptomatique chez certains individus et symptomatiques chez d'autres.
Pour les sujets symptomatiques, le nombre d'occurrences, c’est-à-dire de crises, varie selon les individus et dépend de trois facteurs :
- la force du système immunitaire qui dépend notamment du stress, des menstruations, de l'exposition aux climats extrêmes ou d'autres maladies ;
- l'âge après la primo-infection : on assiste généralement à une baisse de la gravité et de la fréquence des récidives avec le temps ;
- le type d'infection : le HSV-1 est principalement responsable de l'herpès labial, et le HSV-2 de l'herpès génital. Selon l'emplacement des lésions, on classe la fréquence des occurrences dans l'ordre suivant :
- HSV-2 génital : répétitif la première année. Le nombre moyen d'occurrences dans l'année qui suit une primo-infection est de 4. 20 % des patients ont plus de 10 occurrences par an. Certains patients n'ont eu aucune occurrence[16],
- HSV-1 labial : de une à six fois par an selon les individus,
- HSV-1 génital : le nombre moyen d'occurrences dans l'année qui suit une primo-infection est faible. 40 % des patients n'ont eu aucune occurrence, 50 % une à deux, et 10 % autant d'occurrences que les infections HSV-2 génitale[17],
- HSV-2 labial : particulièrement rare.
Herpès labial
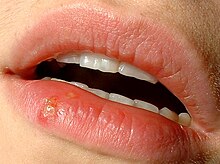
C'est le classique bouton de fièvre qui se transmet essentiellement par contact buccal.
La forme la plus connue est la forme labiale. Elle évolue via plusieurs stades :
- Signes préliminaires : démangeaisons, sensation d'existence d'un léger œdème, rougeurs...
- Apparition de papules : la lèvre gonfle localement (il arrive qu'une grosse partie de la lèvre gonfle durant quelques jours avant de se localiser) et rougit.
- Mûrissage des papules : les papules deviennent des cloques puis des vésicules transparentes contenant un liquide clair. Les vésicules finissent ensuite par éclater, libérant ainsi le liquide. À ce moment, le virus étant sorti, le risque de contamination est plus fort.
- Dessèchement : après leur éclatement, les vésicules laissent place à des plaies souvent douloureuses (brûlures) puis sèchent assez rapidement pour former des croûtes qui disparaissent en quelques jours.
Un accès d'herpès labial dure de 8 à 15 jours. L'affection est contagieuse en tout temps, mais plus encore lorsque les lésions sont encore présentes (y compris sous forme de croutes, qu'il ne faut pas toucher, qui peuvent saigner légèrement sans que cela ne soit visible).
Herpès génital
Encéphalite herpétique
Moyens diagnostiques
Les moyens diagnostiques sont essentiellement utilisés en cas d'herpès génital. En cas d'herpès oro-facial l'examen clinique visuel est en général suffisant. Les examens de laboratoire sont de deux natures : par prélèvements de lésion, ou par prise de sang.
Prélèvements de lésions
Les lésions prélevées par un écouvillonnage appuyé peuvent être analysées par différentes techniques :
- Par culture virale
C'est le moyen de référence mais elle doit être pratiquée par un laboratoire spécialisé, ce qui nécessite parfois le transport du prélèvement qui doit se faire dans les plus brefs délais et être maintenu réfrigéré ou congelé si le délai de transport dépasse 36 heures.
La sensibilité est comprise entre 60 et 100 % elle diminue en fonction de la zone prélevée et du temps écoulé entre l'apparition des vésicules et le prélèvement.
Un bon prélèvement doit être fait dans une vésicule fraîche au contenu non troublé, moins de 48h après son apparition.
C'est une technique rapide sa sensibilité est de 80 à 90 % et sa spécificité de 85 à 95 %
C'est une technique très rapide mais elle nécessite la lecture au microscope à fluorescence par un personnel spécialisé et averti. La sensibilité est de 75 à 100 % et la spécificité de 95 %.
- Par PCR
Les délais sont plus long (24 à 48 heures) et nécessite un transport dans un laboratoire spécialisé.
C'est une technique très sensible et spécifique utilisable même sur un prélèvement de mauvaise qualité ou mal conservé.
Toutefois son coût élevé empêche son utilisation en routine.
- Par cytodiagnostic de Tzanck
L'intérêt de cette ancienne technique est limité aux situations où une autre technique ne peut être utilisée. Elle est peu sensible (60 %) et peu spécifique car elle ne permet pas de distinguer l'herpès de la varicelle et du zona.
Sérologies
La sérologie herpétique est principalement indiquée si l’examen direct est négatif et en l’absence de lésions, ou pour établir le diagnostic du HSV-1 ou du HSV-2.
On distingue deux types de sérologies :
- la sérologie non spécifique de type détecte les anticorps communs à HSV-1 et HSV-2. Elle présente d’excellentes spécificité et sensibilité. Elle révèle la présence d’anticorps IgG ou IgM dirigés contre l’un ou l’autre des deux virus et ne permet pas de spécifier le type de virus en cause ;
- la sérologie spécifique de type permet de distinguer les anticorps anti-HSV-1 et anti-HSV-2. Les trousses commercialisées présentent, selon la population étudiée, une sensibilité et une spécificité d’environ 90 à 100 %. Elle n’est pas inscrite à la nomenclature des actes de biologie médicale.
La sérologie spécifique de HSV-1 ne permet pas d’établir un diagnostic d’infection génitale ancienne à HSV-1. En revanche, une séropositivité pour HSV-2 permet généralement d’établir le diagnostic d’herpès génital à HSV-2[18].
Une réaction sérologique peut être négative alors que le sujet est atteint d'herpès car 1 à 3 mois sont nécessaires à la séroconversion.
Traitement
Deux formes de traitements existent à ce jour autour de crèmes à appliquer ou de médicaments antiviraux. Les traitements sont d’autant plus efficaces qu’ils sont administrés très précocement dès l’apparition des tout premiers signes. Plus le traitement antiviral sera pris tôt et plus celle-ci sera limitée en intensité et en durée. Les antiviraux empêchent le virus de se reproduire, et n’agissent que dans les cellules infectées par le virus.
Précautions de base
Des précautions d’hygiène sont indispensables pour limiter le risque de contamination, et doivent être respectées tant par les malades que par l'entourage, même en l'absence de crise visible. Ces précautions aident également à limiter le risque d'auto-inoculation, qui peut amener le virus dans des zones très sensibles (herpès génital ou oculaire, aux conséquences graves).
Ces mesures peuvent sembler lourdes au quotidien : elles restent pourtant le seul moyen d'éviter la maladie, qui peut dans certains cas avoir des conséquences dramatiques (aucun vaccin ou médicament n'éradiquant le virus). En effet, le simple bouton de fièvre peut évoluer vers des formes plus graves, par simple progression du virus, ou auto-contamination d'autres zones du corps. Beaucoup de gens ignorent ces précautions ou ne veulent pas les mettre en pratique, ce qui explique que le virus soit si répandu.
Certaines personnes sont plus à risque que d'autres : immunodéprimé, nouveau-né, femme enceinte, dermatite atopique.
Toute personne atteinte, même si la maladie se limite pour le moment à de simples boutons de fièvre, est contaminée et doit prendre les précautions suivantes pour protéger son entourage :
- se laver soigneusement et régulièrement les mains, surtout après tout contact avec la lésion (même sans gratter) ; le faire avec encore plus d'attention si on va toucher de la nourriture ou de la vaisselle, une autre personne ou ses affaires personnelles (particulièrement des affaires d'hygiène) bien que le virus ne conserve son pouvoir infectant que 2 heures sur un support sec ;
- éviter d'utiliser les objets ayant été en contact direct avec la salive ou la bouche d'une personne infectée ;
- éviter les rapports sexuels oro-génitaux pour ne pas transmettre un herpès labial au niveau génital ;
- séparer le linge de toilette ;
- ne pas se toucher les yeux (un geste machinal rapide suffit pour la transmission), et bien sûr, ne pas humecter ses lentilles de contact avec sa salive (risque très direct de contamination) ;
- ne pas gratter les lésions, et plus généralement, ne jamais toucher la zone infectée ;
- si le geste est machinal, prendre l'habitude de ne plus toucher les lésions, et se nettoyer les mains (ongles compris) chaque fois qu'on le fait ;
- maintenir les parties atteintes aussi propres et sèches que possible, et ne pas les serrer sous des vêtements trop près du corps ;
- éviter tout contact avec un nouveau-né (son système immunitaire est encore fragile) ;
- en cas de bouton de fièvre (même débutant ou presque terminé), éviter d'embrasser, y compris sur les joues, et ce jusqu'à ce que les lésions soient complètement sèches.
Traitement spécifique

Les traitements actuels ne guérissent pas la maladie mais réduisent la charge virale en période de crise. Les médicaments utilisés sont des antiviraux dont quelque exemples sont l'aciclovir, et sa prodrogue le valaciclovir, le famciclovir et le cidofovir.
Le mécanisme d'action : les antiviraux sont des analogues de base étant incorporés par les cellules infectées par les virus. La thymidine kinase des virus est moins spécifique que la thymidine kinase des cellules humaines et permettent donc de phosphoryler des analogues de bases. Par la suite, ces analogues de bases entrent en compétition avec les bases phosphatées de la cellule et une fois incorporé les analogues de bases inhibent la l'ADN polymérase. Exemple en absence d'infection, l'aciclovir n'est pas transformé en aciclovir monophosphate car il y a absence de TK virale et donc les étapes ultérieures ne sont pas possibles. Cependant, certain HSV sont résistant aux traitements contre les antiviraux. L'une des causes de résistance est la mutation du gène de la thymidine kinase chez l'HSV [19].
D'autres molécules à action anti-virale sont en cours de développement, comme le pritelivir.
Herpès labial
- Traitement préventif (ref :dictionnaire Vidal) :
- Valaciclovir 500 mg : 1 comprimé par jour à vie.
- Valaciclovir 500 mg : 2 comprimés dans l'heure qui suit les premiers symptômes (picotements, démangeaisons), puis 2 comprimés par jour pendant 10 jours.
- Traitement du premier épisode (ref : Dictionnaire Vidal) :
- aciclovir crème à 5 % : Ce traitement peut être délivré sans ordonnance et n'est pas pris en charge par l'assurance maladie. Nota Bene : les tubes de 10 grammes sont remboursés mais leur utilisation est limitée à l'herpès génital,
- ibacitabine gel à 1 % : ce traitement peut être délivré sans ordonnance et n'est pas pris en charge par l'assurance maladie,
- docosanol crème à 10 % : ce traitement de conseil peut être délivré sans ordonnance et n'est pas pris en charge par l'assurance maladie. Le docosanol est un alcool gras antiviral qui inhibe la fusion du virus avec la cellule en modifiant la structure de la membrane cellulaire,
- patchs commercialisés en pharmacies : ces pellicules transparentes imprégnées de principes actifs limitent les poussées si elles sont utilisées suffisamment tôt. Couvrant la zone infectée, elles limitent également — sans le supprimer — le risque de contamination ou d'auto-inoculation, mais elles ne dispensent pas pour autant des précautions d'hygiène décrites plus haut dans l'article,
- aciclovir 200 mg : cinq comprimés par jour à prise régulièrement espacées pendant une durée de 10 jours (primo-infection) ou de 5 jours (récurrences), uniquement pris en charge par l'assurance maladie en cas de gingivo-stomatite,
- Traitement de la récurrence de l'herpès labial ; le plus précocement possible (ref : Dictionnaire Vidal) :
- valaciclovir 500 mg, quatre comprimés dès l'apparition dès premiers symptômes, quatre comprimés 12 heures après la première prise, traitement sur une journée[20]. (Non pris en charge en France par l'assurance maladie),
- aciclovir 200 mg : deux comprimés par jour en une seule prise pendant une durée de six mois minimum et 12 mois maximum après quoi le traitement doit être réévalué. (Non pris en charge en France par l'Assurance maladie).
Les personnes souffrant d'au moins six récurrences par an peuvent bénéficier d'un traitement préventif oral sur prescription médicale et pris en charge par l'assurance maladie[réf. souhaitée].
Herpès génital
- Traitement du premier épisode (ref :dictionnaire Vidal) :
- Valaciclovir 500 mg : 1 comprimé par jour matin et soir pendant 10 jours.
- Aciclovir 200 mg : 5 comprimés par jour à prise régulièrement espacées pendant une durée de 10 jours
- traitement des récurrences (ref :dictionnaire Vidal) :
- Valaciclovir 500 mg : 2 comprimés par jour en une prise pendant 5 jours.
- Aciclovir 200 mg : 5 comprimés par jour à prise régulièrement espacées pendant une durée de 5 jours.
- Traitement de la femme enceinte : L'aciclovir et le valaciclovir ont été utilisés chez la femme enceinte sans qu'aucune embryo-foetopathie ait été constatée[réf. souhaitée]. Toutefois l'utilisation des antiviraux doit être restreinte au cas où un bénéfice est attendu pour la mère et/ou l'enfant.
- Traitement du premier épisode[réf. souhaitée] :
- Aciclovir 200 mg 5 comprimés par jour à prises régulièrement espacées, et cela pour une durée allant jusqu'au jour de l'accouchement. L'Aciclovir reste le traitement de référence, car il est utilisé depuis plus longtemps que le valaciclovir.
- Traitement du premier épisode[réf. souhaitée] :
- traitement préventif des récurrences, pour les personnes souffrant de plus de 6 récurrences par an{ (ref :dictionnaire Vidal) :
- Valaciclovir 500 mg : 1 comprimé par jour pendant une durée de 6 mois minimum et 12 mois maximum après quoi le traitement doit être ré-évalué.
- Aciclovir 200 mg : 2 comprimés par jour en une seule prise pendant une durée de 6 mois minimum et 12 mois maximum après quoi le traitement doit être réévalué.
Nota bene : la crème Zovirax à 5 % tube de 10 grammes n'est plus conseillée par la conférence de consensus de Lyon.
Encéphalite herpétique
Traitement alternatif
En curatif :
- L'application de l'Huile essentielle de camphrier[réf. nécessaire] ;
- l'application de l'Huile essentielle d'arbre à thé n'a pas d'efficacité démontrée[21] ;
- l'application de vinaigre de cidre[réf. nécessaire] en compresses aurait la faculté de réduire les boutons de fièvre provoqués par l'herpès[réf. nécessaire] ;
- l'application de dentifrice[réf. nécessaire] (de préférence à base de plantes, pâte blanche) sur la zone des picotements ou du bouton apparent peut également empêcher l'apparition du bouton ou le dessécher plus rapidement[réf. nécessaire] ;
- l'application d'un glaçon[réf. nécessaire] sur le bouton de fièvre, herpès jusqu'à ce que le glaçon fonde dès le début des picotements empêche ou réduit les gonflements et picotements du bouton[réf. souhaitée] ;
- l'extrait de pépin de pamplemousse[réf. nécessaire], un antibiotique[réf. nécessaire] naturel, qui existe sous différentes formes dans le commerce aurait des effets bénéfiques sur l'herpès[réf. nécessaire]. Attention aux interactions du pamplemousse avec les médicaments ;
- le miel[réf. nécessaire], par ailleurs connu pour son effet antiseptique, permettrait également, appliqué sur la zone de picotements, de prévenir ou de limiter la poussée d'herpès labial[réf. nécessaire] ;
- la teinture-mère d'échinacée[réf. nécessaire] prise dès les premiers symptômes freinera le développement.(compendium Cérès)[réf. nécessaire] ;
- la poudre d'aspégic[réf. nécessaire] simplement appliquée localement soulage rapidement la douleur et l'inflammation[réf. nécessaire] ;
- l'eau de Dalibour[réf. nécessaire] est une préparation pharmaceutique à base de sulfates de zinc et de cuivre qui assèche le bouton et ralentit sa croissance[réf. nécessaire].
En préventif
- l'acérola ou des baies de goji[réf. nécessaire], contenant beaucoup de vitamine C ;
- la Chlorella[réf. nécessaire], une micro algue d'eau douce
Vaccin
Recherche
- la glycyrrhizine, acide glycyrrhizique, principe actif de la réglisse, agirait contre le virus de l'herpès chez la souris[22] ;
- l'émodine aurait un effet anti-HSV chez la souris[23]. L’émodine peut être extraite de diverses plantes dont la rhubarbe ornementale (Rheum palmatum) ou la renouée du Japon (Fallopia japonica ou Polygonum cuspidatum).
- le xylomannan, un polysaccharide sulfaté issu d'algues rouges comme Nothogenia fastigiata , aurait un effet sur la réplication de l'HSV-1 et l'HSV-2[24]. De plus, cette molécule est capable de diminuer l’adsorption du virus sur ses cellules hôtes. Son activité semblerait également plus efficace que l'héparine[25].
- Le galactofucane sulfaté, extrait d'un grand nombre d'algues brunes (notamment présent chez Undaria pinnatifida, le "wakamé" communément consommé en Asie), présenterait potentiellement une activité anti-herpétique. En effet, une étude épidémiologique menée sur différentes communautés à travers le monde a révélé une importante différence de séroprévalence du virus HSV-2, notamment entre des femmes d'origine afro-américaine et japonaise, chez lesquelles celui-ci était respectivement de 50 % et 7 %[26],[27]. Malgré l'absence de résultats cliniques à ce jour, le lien entre l'ingestion régulière de macroalgues marines contenant ces polysaccharides sulfatés et le faible taux de prévalence de ce virus chez les populations japonaises, a été fortement suspecté. Des résultats obtenus lors de précédentes études ont montré que des fractions aqueuses de Undaria pinnatifida ainsi que des extraits de galactofucanes sulfatés, partiellement purifiés, avaient une activité anti-herpétique in vitro sur toutes les souches virales testées, activité par ailleurs plus forte contre les souches HSV-2 en comparaison avec les souches HSV-1[28],[29]. Le mode d'action de ces extraits a été identifié comme étant une inhibition de l'adsorption du virus sur la membrane de la cellule hôte. En comparaison, les souches traitées à l'acyclovir, molécule largement utilisée actuellement comme anti-herpétique, s’avéraient pour un grand nombre d'entre elles être résistantes à ce traitement.
Notes et références
- Conférence de consensus : Prise en charge de l'herpès cutanéo-muqueux chez le sujet immunocompétent (manifestations oculaires exclues) mercredi 7 novembre 2001 Espace Landowski - Boulogne ANAES
- (en) Malkin JE, Morand P, Denis Malvy, Ly TD, Chanzy B, de Labareyre C, El Hasnaoui A, Hercberg S, « Seroprevalence of HSV-1 and HSV-2 infection in the general French population », Sex Transm Infect, vol. 78, no 3, , p. 201-3. (PMID 12238654, PMCID PMC1744464, lire en ligne [html])
- (en) Cunningham AL, Taylor R, Taylor J, Marks C, Shaw J, Mindel A. « Prevalence of infection with herpes simplex virus types 1 and 2 in Australia: a nationwide population based survey » Sex Transm Infect. 2006;82(2):164-8. PMID 16581748
- (en)Trends in Herpes Simplex Virus Type 1 and Type 2 Seroprevalence in the United States
- (en)CDC Analysis of National Herpes Prevalence
- Sondage effectué en 2005 par téléphone auprès de plus de 10 000 Français par l'Institut IPSOS pour l'Association Herpès
- (en) Cesario TC, Poland JD, Wulff H, Chin TD, Wenner HA. « Six years experience with herpes simplex virus in a children's home » Am J Epidemiol. 1969;90(5):416-22. PMID 4311429
- (en) McMillan JA, Weiner LB, Higgins AM, Lamparella VJ. « Pharyngitis associated with herpes simplex virus in college students » Pediatr Infect Dis J. 1993;12:280–4. PMID 8387178
- (en) Corey, L. Herpes simplex virus. In: Mandell GL, Bennett JE and Dolin R, editors Principles and practice of infectious diseases. Fifth. Vol. 125. Churchill Livingstone; 2000. p. 1564–1580.
- (en) Prober CG, Hensleigh PA, Boucher FD, Yasukawa LL, Au DS, Arvin AM. « Use of routine viral cultures at delivery to identify neonates exposed to herpes simplex virus » N Engl J Med. 1988;318:887–91. PMID 2832756
- (en) Flewett TH, Parker RG, Philip WM. « Acute hepatitis due to Herpes simplex virus in an adult » J Clin Pathol. 1969;22:60–6. PMID 4306578
- (en) Hillard P, Seeds J, Cefalo R. « Disseminated herpes simplex in pregnancy: two cases and a review » Obstet Gynecol Surv. 1982;37:449–53. PMID 6752785
- (en) Svend Ellermann-Eriksen « Macrophages and cytokines in the early defence against herpes simplex virus » Virol J. 2005 Aug 3;2:59 PMID 16076403
- Richard-A. Goldsby, Thomas-J. Kindt, Barbara-A. Osborne Immunologie : Le cours de Janis Kuby avec questions de révision p. 428
- Guillaume J.-C., Lebrun-Vignès B., « Herpès », sur http://www.therapeutique-dermatologique.org/, (consulté le )
- ANAES, 2001
- (en) Wald A, Zeh J, Selke S, Ashley RL, Corey L. « Virologic characteristics of subclinical and symptomatic genital herpes infections » N Engl J Med. 1995;333(12):770-5. PMID 7643884
- Jean-Elie Malkin « Quelle place pour la sérologie herpétique dans l’herpès génital ? » La Presse Médicale 2008;37(9):1251-60.
- (en) Kening Wang, Gowtham Mahalingam, Susan E. Hoover, Erik K. Mont, Steven M. Holland, Jeffrey I. Cohen, and Stephen E. Straus « Diverse Herpes Simplex Virus Type 1 Thymidine Kinase Mutants in Individual Human Neurons and Ganglia » J Virol. 2007;81(13):6817–26. PMID 17459924
- http://www.eurekasante.fr/medicaments/vidal-famille/medicament-gp4061-VALACICLOVIR-BIOGARAN.html
- (en) Carson CF, Ashton L, Dry L, Smith DW, Riley TV. « Melaleuca alternifolia (tea tree) oil gel (6%) for the treatment of recurrent herpes labialis » J Antimicrob Chemother. 2001;48(3):450-1. PMID 11533019
- (en) Sekizawa T, Yanagi K, Itoyama Y. « Glycyrrhizin increases survival of mice with herpes simplex encephalitis » Acta Virol. 2001 Feb;45(1):51-4. PMID 11394578
- (en) Xiong HR, Luo J, Hou W, Xiao H, Yang ZQ. « The effect of Emodin; an anthraquinone derivative extracted from the roots of Rheum tanguticum; against Herpes Simplex Virus in vitro and in vivo » J Ethnopharmacol. 2011 Jan 27;133(2):718-23. Epub 2010 Nov 2. PMID 21050882
- (en) Damonte E, Neyts J, Pujol CA, Snoeck R, Andrei G, Ikeda S, Witvrouw M, Reymen D, Haines H, Matulewicz MC. et al., « Antiviral activity of a sulphated polysaccharide from the red seaweed Nothogenia fastigiata », Biochem Pharmacol, vol. 47, no 12, , p. 2187-92. (PMID 8031312)
- (en) Ghosh T, Pujol CA, Damonte EB, Sinha S, Ray B, « Sulfated xylomannans from the red seaweed Sebdenia polydactyla: structural features, chemical modification and antiviral activity », Antivir Chem Chemother, vol. 19, no 6, , p. 235-42. (PMID 19641232)
- (en) Cooper R, Dragar C, Elliot K, Fitton JH, Godwin J, Thompson K, « GFS, a preparation of Tasmanian Undaria pinnatifida is associated with healing and inhibition of reactivation of Herpes », BMC Complement Altern Med, no 2, , p. 11 (PMID 12443533, PMCID PMC139995, DOI 10.1186/1472-6882-2-11, lire en ligne [html])
- (en) Nahmias AJ, « Sero-epidemiological and -sociological patterns of Herpes simplex virus infection in the world », Scandinavian journal of infectious diseases,
- (en) Thompson KD, « Anti-viral activity of Tasmanian seaweed extracts against clinical strains of Herpes simplex virus (HSV) », Abstract. 18th Annual Clinical Virology Symposium,
- (en) Thompson KD, « The mode of action of two Tasmanian seaweed extracts against Herpes simplex virus (HSV) », Abstract. 27th International Herpes virus workshop conference,

