Myélome
| Médicament | Bortézomib, cisplatine, (RS)-cyclophosphamide, melphalan, thalidomide, aldesleukine (d), procarbazine, chlorhydrate de doxorubicine (en), ixazomib, (RS)-lénalidomide, acétate de dexaméthasone (en), Plerixafor, (S)-thalidomide (d), (RS)-cyclophosphamide et thalidomide |
|---|---|
| Spécialité | Hématologie |
| CIM-10 | C90.0 |
|---|---|
| CIM-9 | 203.0 |
| ICD-O | M9732/3 |
| OMIM | 254500 |
| DiseasesDB | 8628 |
| MedlinePlus | 000583 |
| eMedicine | 204369 |
| MeSH | D009101 |
| Patient UK | Myeloma-pro |
Le myélome multiple (MM ou myélome multiple des os ou maladie de Kahler, de maladie de Kahler-Bozzolo[1]) est un cancer hématologique (signifiant qu'il se développe à partir des cellules de l'hématopoïèse, qui sont à l'origine des cellules du sang, formées dans la moelle osseuse)[2].
C'est une lymphopathie B maligne (prolifération maligne d'un clone plasmocytaire ; les cellules touchées seront toutes des plasmocytes (qui sont des lymphocytes B activés en différenciation terminale), cellules du système immunitaire produisant les anticorps (immunoglobulines) pour combattre les infections et maladies.
Ce myélome est caractérisé par le développement dans le squelette de multiples tumeurs ostéolytiques à plasmocytes (plasmocytomes) sécrétant dans la plupart des cas soit une immunoglobuline monoclonale de type G (52 % des cas), soit de type A (21 % des cas), soit une chaîne légère Kappa ou Lambda (12 %).
Épidémiologie
[modifier | modifier le code]Le myélome multiple représente le plus répandu des cancers hémopathiques (10 % du total)[3], le premier après le lymphome non-hodgkinien ; il compte pour 1 % de tous les cancers et 2 % de tous les décès par cancer.
Il affecte plus d'hommes que de femmes (sex-ratio : 3/2)[3]. Et il est plus fréquent chez les afro-américains[4] et plus rare en Chine[5] ; est 2 à 3 fois plus fréquent chez les Noirs que chez les Blancs[6].
Incidence
[modifier | modifier le code]Le taux d'incidence annuel du MM est environ de 4 cas pour 100 000 individus[6] ;
Cette incidence est en hausse depuis plusieurs décennies, en grande partie probablement en raison d'une amélioration du diagnostic et du vieillissement de la population générale[6].
Au début des années 2000 en France, l'incidence est de 4 000 cas par an et aux États-Unis, 45 000 personnes vivent avec le myélome avec environ près de 20 000 nouveaux cas par an[5]. Au Canada, chaque année, environ 2 000 personnes reçoivent un diagnostic de myélome multiple[7].
Les gammapathies de signification indéterminée (ou MGUS pour Monoclonal Gammopathy of Unknown Significance) sont les premiers précurseurs, souvent trouvées par hasard lors de tests demandés pour d'autres problèmes de santé. Elles sont plus fréquentes avec l'âge : 1 % des gens en développent à 50 ans, et 5 % à 80 ans[3].
15 à 20 % des MGUS évoluent ensuite en myélome multiple selon Kyle (2018)[3], mais la plupart des porteurs de MGUS peuvent vivre de nombreuses années sans développer de myélome ; la plupart des MGUS ne progresseront jamais[8].
Un myélome peut « couver » durant des années sans symptômes ; le myélome couvant a été décrit en 1980, chez six patients ayant assez de protéines monoclonales dans leur sang et assez de cellules plasmatiques anormales dans leur moelle osseuse pour suggérer un myélome, bien que n'en présentant toujours aucun symptômes, même après 5 ans de suivi[9]. Comme le MGUS, le myélome « couvant » est asymptomatique mais les patients dans ces états précurseurs ont des niveaux plus élevés de protéines monoclonales que celles atteintes de MGUS, plus de cellules plasmatiques anormales dans leur moelle osseuse (au moins 10 %) ou les deux[8].
L'âge moyen de diagnostic tend à diminuer, après avoir été de 65 à 70 ans (65 ans vers 2015)[3] et son incidence augmente avec l'âge : « 7 pour 100 000 à 50 ans, 20 pour 100 000 à 80 ans »[3]. Cette maladie est rare chez les jeunes ; selon Bladé et Kyle (1998) chez les moins de 40 ans elle comptait alors pour seulement 2 % de tous les myélomes, et chez les moins de 30 ans ce taux tombe à 0,3 %[10].
Vers 2010, après le diagnostic, la survie sans incident est estimée à 5 mois, la survie totale à 56 mois[11].
Physiopathologie
[modifier | modifier le code]En cas de MGUS (Monoclonal Gammopathy of Unknown Significance) on observe uniquement une sécrétion anormalement élevée d'immunoglobuline (Ig) monoclonale, par des clones plasmocytaires qui ont échappé au contrôle de l'organisme[3].
Les MGUS, souvent bénins et sans signes cliniques, peuvent avoir plusieurs origines : des stimulations antigéniques longues ou répétées telles que des infections chroniques bactériennes ou virales (hépatite par exemple), un cancer profond distant, ou par le vieillissement du système immunitaire.
Certains MGUS évoluent en myélome. Alors, en plus de l'immunoglobuline monoclonale, le plasmocyte (ou le stroma conjonctif l'entourant) sécrètent de nombreuses autres molécules, dont des OAF (Osteoclast Activating Factors) ; principalement : IL-6, TNFα, IL-1, voie Rank- Rank-L qui tous stimulent la résorption osseuse ostéoclastique[3]. L'os se déminéralise alors, ce qui suscite des lacunes osseuses, des douleurs osseuses, et une hypercalcémie. Dans un second temps la formation ostéoblastique est en outre inhibée par une sécrétion de DKK1 et de sclérostine[3].
Parallèlement le plasmocyte pathologique (myélomateux) sécrète également des molécules inhibant l'érythropoïèse (d'où l'anémie)[3]. Et plusieurs autres cytokines peuvent affecter les lymphocytes B et inhiber le rétrocontrôle de la prolifération plasmocytaire. Ces substances peuvent aussi réduire la production normale des immunoglobulines (par les plasmocytes non myélomateux), ce qui diminuera l'immunité face aux infections différentes.
La recherche s'attache à mieux comprendre les conditions prédéterminantes de la maladie (gammapathie monoclonale, myélome multiple « couvant »...) pour aider à déterminer chez qui ce cancer risque le plus de progresser et qui pourrait bénéficier d'un traitement précoce, lequel invite à envisager une politique de dépistage pour traiter la maladie avant même qu'elle ne se développe[12], avec alors bien moins de risques pour le patient[13].
On a récemment compris que le myélome multiple ne correspond pas à une maladie unique, mais plutôt à un large éventail de situations pathologiques, dont la progression est liée à plusieurs facteurs génétiques, très différents[13]. Il pourrait en ressortir à l'avenir des façons innovantes de personnaliser les traitements[13].
Causes
[modifier | modifier le code]Elles sont mal comprises mais outre l'âge, des facteurs environnementaux semblent en cause au moins dans un certain nombre de cas :
- l'exposition à la radioactivité est un facteur de risque certain, découvert avec l'usage du radium[14] ; ainsi dans le secteur de l’horlogerie, les femmes payées pour peindre les aiguilles lumineuse au radium ont vu leur risque de développer un myélome multiplié par trois dans la cohorte d’avant 1930[15],[16],[17], probablement en raison de l'irradiation gamma et d'une exposition au radon produit par le radium[18] ;
- l'exposition médicale épisodique à d'autres rayonnements ionisants accroit le risque de leucémies aiguës et myélocytaires, alors qu'ils n'induisent pas ou peu de lymphomes. Ainsi une étude épidémiologique a porté sur 12 955 femmes traitées pour des troubles gynécologiques bénins dans 17 hôpitaux de Nouvelle-Angleterre et de l'État de New York, suivies durant 25 ans en moyenne. 9 770 d'entre elles avaient été traitées par rayonnement (intracavitaire 226 Ra, ou rayons X externes), et 3 185 par curetage, chirurgie et/ou hormones. En moyenne le traitement avait été suivi à l'âge de 46,5 ans ; et chez les patientes irradiées, la moelle osseuse a été exposée à une dose active de 119 cGy. 40 des patientes irradiées sont ensuite morte d'un cancer de type leucémie aiguë, myélocytaire ou monocytaire, soit 70 % de plus qu'attendu dans la population générale des États-Unis ; contre 3 décès chez les femmes non-irradiées. Aucune relation dose-effet n'a été observée. Le risque était le plus élevé dans les 5 années suivant l'irradiation mais persistait même après 30 ans (avec un risque temporel différent pour chaque sous-type de leucémie : la surmortalité due à un myélome ne concernait presque que la quinzaine d'années suivant l'irradiation, alors que le risque de leucémie aiguë, aussi élevé, s'étalait dans le temps. La radiothérapie au radium est plus mise en cause que l'exposition aux rayons X[19],[20] ;
- l'exposition à certains pesticides[21] et/ou organochlorés[22] (ex. : chlordécone dérogatoirement utilisé comme pesticide sur la banane) est aussi un facteur de risque. Ainsi en Martinique, une analyse du risque de cancer (par zones) commandée par l'InVS a conclu à une « surincidence statistiquement significative du myélome multiple[23] » chez l'homme adulte résidant dans la zone où le chlordecone a été le plus utilisé et serait encore le plus présent dans les sols (selon le BRGM). En outre, le gradient de l’incidence du myélome augmentait peu à peu des zones supposées les moins polluées à celles qui le sont potentiellement le plus[23]. Les agriculteurs sont particulièrement touchés[24],[25],[26],[27],[28],[29]. Une étude récente (2019) a montré que le glyphosate (herbicide le plus utilisé au monde, déjà suspecté d'être cancérigène[30]) s'est montré capable, à la dose d'1g/L d'induire le premier stade et l'induction du myélome multiple chez la souris sauvage[31] ;
- l'exposition au benzène est une cause suspectée, mais encore discutée[3] ;
- prédisposition génétique ; Plusieurs cas de MM ont été décrits chez des jumeaux homozygotes[3], une cause génétique semble donc exister, expliquant plusieurs cas familiaux décrits, mais, notait Michel Laroche en 2018 : la cause génétique serait plus rare pour le MM que pour d'autres lymphopathies chroniques comme la Leucémie lymphoïde chronique (LLC) ou la maladie de Waldenström.
Les personnes noires sont statistiquement d'une part plus à risque d'être atteintes, et d'autre part d'avoir un pronostic pire que chez les Blancs. En 2020 on cherche encore à démêler les facteurs génétiques et sociaux (racisme structurel des soins de santé inclus) expliquant cette disparité[13] ; en effet « lorsque les deux groupes ont un accès égal aux traitements, tels que les greffes de cellules souches, les chances sont inversées, selon une étude sur des personnes traitées par le système de santé américain des anciens combattants »[32] ; à traitement égale les anciens combattants noirs ont une durée de survie médiane de 7,1 ans, alors qu'elle n'est que de 5,8 ans chez les anciens combattants blancs[33], néanmoins, au vu d'études antérieures faites aux États-Unis et au Ghana le myélome multiple, ainsi que les troubles plasmocytaires annonciateurs de la maladie sont deux fois plus fréquents chez les Noirs que chez les Blancs. Les variantes des génomes ancestraux doivent encore être mieux étudiés[33].
Quelques anomalies ou mutations chromosomiques semblent associées à un risque accru de progression. Elles concernent le mécanismes de réparation de l'ADN, ou la voie de la protéine kinase activée par un mitogène, connue pour être en cause dans d'autres cancers)[34] ; - le microenvironnement de la moelle osseuse entourant les plasmocytes malins semblent aussi pouvoir influer sur le risque de progression de ce cancer, de même que les mécanismes de régulation immunitaire (contribuant, ou non, à contenir la population de plasmocytes anormaux)[8].
Diagnostic
[modifier | modifier le code]Circonstances du diagnostic
[modifier | modifier le code]Le diagnostic est souvent fortuit, lors d'un examen sanguin de routine, parfois même à l'occasion d'un examen de fond d'œil[6].
Les symptômes les plus fréquents sont :
- des douleurs osseuses ou des fractures pathologiques (spontanées ou après une trop faible contrainte)[35],[36] ;
- une asthénie, qui peut être liée à une anémie, une hypercalcémie ou une insuffisance rénale ;
- des fourmillements dans les extrémités et des douleurs neuropathiques.
Diagnostic biologique
[modifier | modifier le code]La principale conséquence du myélome est la présence d'une très grande quantité d'immunoglobulines dans le sang. Ces immunoglobulines sont des protéines, qui se manifestent par :
- l'élévation de la vitesse de sédimentation ;
- une hyperprotidémie ;
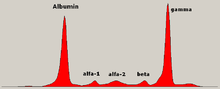
- un pic dans la zone des gamma-globulines à l'électrophorèse des protéines du sérum dans les formes à chaîne complète. L'immunofixation permet de prouver le caractère monoclonal du pic (c'est-à-dire dérivant d'un même clone tumoral de plasmocytes) . Dans les formes à chaînes légères, on observe une hypogammaglobulinémie, la quantité de chaînes légères n'étant quasiment jamais suffisante pour faire apparaître un pic monoclonal visible.
L'hypercalcémie, fréquente, est liée aux destructions osseuses.
On retrouve aussi un excès de protéines dans les urines ; cette protéinurie est constituée de chaînes légères des immunoglobulines monoclonales, aussi appelées protéine de Bence-Jones. L'immunoélectrophorèse ou l'immunofixation des protéines urinaires détermine le type de chaîne, kappa ou lambda. Ce pic est décelé dans les bêtaglobulines.
Une gammapathie monoclonale bénigne ne comporte ni anémie, ni lésion osseuse, ni complication viscérale[37]. Comme son nom l'indique, elle n'a pas du tout le même caractère de gravité que le myélome et ne requiert qu'une simple surveillance.
Autres examens
[modifier | modifier le code]

Le myélogramme étudie les cellules de la moelle osseuse, prélevées par ponction, à la recherche d'un excès de plasmocytes. Dans le myélome, la moelle est infiltrée par des plasmocytes, qui présentent d'habitude de nombreuses anomalies morphologiques et sont fréquemment en mitose.
La radiographie du squelette montre très fréquemment des lésions osseuses de type ostéolyse.
La tomodensitométrie à faible dose de tous le corps est plus sensible que la radiographie conventionnelle pour décrire les aspects ostéolytiques ; elle est recommandée depuis 2015 en Europe comme nouvelle norme pour détecter les lésions lytiques du grade 1A du myélome[38].
Évolution et complications
[modifier | modifier le code]Le myélome est une maladie grave. Il en existe cependant des formes atténuées (faible masse tumorale) pouvant rester asymptomatiques (sans signe apparent) pendant des années.
Le myélome peut se compliquer :
- d'infections, car la présence d'une immunoglobuline en grande quantité inhibe la synthèse normale des autres immunoglobulines, ce qui empêche le corps de faire face aux agents infectieux, qui sont une cause majeure de mortalité ;
- de troubles osseux : douleurs, fractures, tassement vertébral, etc. ;
- d'insuffisance rénale, surtout en cas de protéines à chaînes légères ;
- de troubles neurologiques : compression de la moelle épinière après un tassement vertébral, atteinte des nerfs, épidurite ;
- d'anémie microcytaire et de thrombopénie (diminution du nombre de plaquettes sanguines pouvant causer des hémorragies), par de multiples mécanismes, dont insuffisance médullaire : déficit de la production par la moelle ;
- de troubles oculaires[39]. Selon une étude récente (2019), les nouveaux traitements du myélome multiple n'empêchent pas un risque accru d'opacités du cristallin (+46 %) et du syndrome de l'œil sec (+53 %), deux phénomènes probablement dus au dépôt de protéines M dans différentes parties de l'œil[40].
La stratification de la maladie peut être faite suivant différents critères. Celle de Durie et Salmon[41] a été employée jusqu'en 2005. Elle a été remplacée alors par une classification internationale[42].
Traitement
[modifier | modifier le code]Le traitement classique du myélome a longtemps été une chimiothérapie pénible, pour les cas de maladie active, combinant le plus souvent (depuis les années 1960) du melphalan et des corticoïdes.
Aujourd'hui de nouvelles thérapies, dites « ciblées » sont adaptées à l'âge, au stade de la maladie, à l'état des reins du patient, etc. Elles ont totalement modifié la prise en charge du myélome multiple (bortézomib[43] ou Velcade, la thalidomide[44], doxorubicine liposomale pegylée ou Caelyx et la lénalidomide ou Revlimid). La thalidomide est donnée en première intention en association avec le melphalan et la prednisone.
Le lénalidomide est donné en seconde intention en association avec la dexaméthasone pour les formes réfractaires ou en cas de rechute après au moins une ligne thérapeutique ayant comporté des alkylants et lorsqu'aucune alternative n'existe. La lénalidomide est reconnue à l'échelle mondiale comme étant l'un des médicaments les plus efficaces en association pour le traitement du myélome multiple. Il altère la voie de signalisation NF-κB dans les cellules osseuses, entraînant la suppression de l'expression génique spécifique des ostéoclastes. Cela procure des effets thérapeutiques contre la résorption osseuse et fait du lénalidomide une option thérapeutique précieuse pour les maladies ostéolytiques telles que le myélome multiple [45] C'est aussi un traitement qui prolonge la vie des patients et qui, dans bien des cas, leur permet de conserver pleinement une vie active[7],[46]. Le bortezomib est potentiellement utilisé à plusieurs stades de la maladie, notamment en première ligne associé à la thalidomide et au melphalan.
Jusqu'à la fin du XXe siècle, on s'abstenait de traitement si le myélome était dormant ou à un stade très peu avancé, car « les traitements contre le myélome étaient si exigeants et toxiques — chimiothérapie à haute dose suivie d'une perfusion des propres cellules souches de la personne, par exemple — qu'ils étaient difficiles à justifier chez les personnes n'ayant pas de symptômes et pouvant ne jamais développer le cancer »[8]. Depuis le début des années 2000, des inhibiteurs du protéasome (bortézomib, imides immunomodulateurs comme le lénalidomide) ont changé les règles car ils sont mieux tolérés et plus efficaces (permettant souvent une rémission temporaire du myélome actif)[8]. En 2020, on se demande s'il ne serait pas utile de traiter plus tôt, même si (comme pour le GMUS) un myélome latent peut ne jamais évoluer vers la maladie active, alors que quelques autres se transformeront en cancer quelques années après le diagnostic ; la question est encore en suspens car les traitements, bien que plus doux qu'autrefois, ont néanmoins encore des effets secondaires, notamment un risque d'induction de certains autres cancers, et ils sont extrêmement coûteux[8]. Les doses ne peuvent être diminuées (sinon on élimine les cellules myélomateuses les moins agressives, au profit des plus agressives qui prennent alors le dessus)[8].
Il faut aussi lutter contre les douleurs osseuses, l'hypercalcémie, et traiter les complications s'il y a lieu. Les bisphosphonates sont utilisés contre la lyse osseuse et auraient une action propre contre le myélome[47].
Depuis la fin des années 1990, on privilégie les techniques dites d'autogreffe de cellules souches, consistant à prélever des cellules souches qu'on « nettoie » des cellules porteuses de la maladie et qu'on congèle, puis à mettre le malade en aplasie (destruction totale des plasmocytes). On réinjecte alors les cellules souches, qui vont régénérer des plasmocytes « sains ». Les résultats sont très favorables[48]. Cette technique peut être répétée, surtout en cas de réponse incomplète de la première autogreffe[49], la survie moyenne dépassant alors les sept ans[50].
En 2014 on a élargi la définition du myélome actif pour y inclure les patients asymptomatiques mais dont les analyses révèlent des biomarqueurs associés à un risque de 80 % de développer des symptômes dans les deux ans. Le nombre de patients ayant un statut de maladie active est alors passé de 10 à 15 % des patients diagnostiqués pour myélome couvant. On leur recommande alors un traitement immédiat[8].
En 2015 le réseau European Myeloma Network a émis les remarques et recommandations suivantes :
- si la fonction rénale le permet, et qu'une maladie osseuse est déjà présente lors du diagnostic, l'acide zolédronique ou le pamidronate sont à utiliser (grade 1A)[38] ;
- Les patients symptomatiques mais pour lesquels la radiographie conventionnelle ne montre pas de lésions lytiques peuvent être traités par l'acide zolédronique (grade 1B), mais son avantage n'est pas clair si la tomodensitométrie ou l'imagerie par résonance magnétique (IRM) ne montrent pas de lésion osseuse[38] ;
- si le myélome est asymptomatique, les bisphosphonates ne sont pas recommandés (grade 1A).
- l'administration de l'acide zolédronique doit être continue, mais « il n'est pas clair si les patients qui obtiennent au moins une très bonne réponse partielle bénéficient de son utilisation continue (grade 1B) »[38] ;
- des agents stimulant l'érythropoïèse peuvent être prescrits aux patients souffrant d'anémie symptomatique persistante (hémoglobine <10g/dL) si d'autres causes d'anémie ont été exclues (grade 1B). Si ce traitement se montre inefficace après 6 à 8 semaines la prise de ces agents érythropoïétiques doit être stoppée[38] ;
- en cas d'insuffisance rénale, le bortézomib est recommandé (grade 1A)[38] ;
- Si le traitement induit une neuropathie périphérique, il doit être modifié (grade 1C)[38] ;
- une vaccination antigrippale est recommandée ; et vacciner contre la pneumonie à pneumocoque et la grippe est approprié, mais en sachant qu'une réponse immunitaire sous-optimale risque de rendre le vaccin moins efficace (grade 1C)[38] ;
- l'aciclovir prophylactique (ou valacyclovir) est recommandé pour les patients recevant des inhibiteurs du protéasome, une greffe autologue ou allogénique (grade 1A)[38].
Virothérapies ? Selon Brian Owens (Nature, novembre 2020), « les thérapies qui utilisent des virus pour attaquer les cellules tumorales sont à nouveau prometteuses après des déceptions précoces »[51].
Immunothérapies[52] ? Cette voie, qui a connu un grand succès contre de nombreuses autres formes de cancer, fait aussi des progrès contre cette maladie[13].
Dans les années 2000-2010, l'immunothérapie cellulaire cible une protéine dite "antigène de maturation des cellules B" (ou "BCMA"). Cependant chaque cellules cancéreuses n'expriment pas cette protéine, ce qui explique que chez certains patients ce traitement ne fonctionne pas ou autorise des rechutes.
En 2019, on a trouvé un récepteur (dit GPRC5D) anormalement exprimé par les cellules de la moelle osseuse dans le myélome multiple. Il semble pouvoir être une cible presque idéale pour un immunothérapie (dite thérapie par cellules T de récepteur d'antigène chimérique ou thérapie CAR-T). On ne le connait en effet pas dans les cellules d'autres tissus (hormis dans le follicule pileux). On a donc conçu des cellules immunitaires ciblant uniquement les cellules tumorales porteuses de GPRC5D[53]. Elles se sont montrées efficaces chez la souris de laboratoire modifiée pour exprimer des cellules de myélome multiple humain. Des malades au stade avancés pourraient aussi bénéficier d'un tel traitement encore à tester chez l'être humain[53].
Pronostic
[modifier | modifier le code]Jusqu'en 2010 environ, ce pronostic était médiocre[13].
Ce cancer reste assez fréquent (second cancer du sang le plus courant après la leucémie) — mais entre 2010 et 2020, de nouveaux traitements en ont amélioré le pronostic[13].
Le système international de pronostic (« International Staging System ») peut aider à prédire la durée de survie qui dépend de la phase de la maladie.
| Taux sérique / stade | I | II | III |
|---|---|---|---|
| β2-microglobuline | <3,5mg/L | ni I, ni III | >5,5mg/L |
| Albumine | ≥35g/L | ||
| Médiane de survie | 62 mois | 45 mois | 29 mois |
La survie médiane est de 62 mois pour la phase 1 de la maladie, de 45 mois pour la phase 2 de la maladie, et 29 mois pour la phase 3 de la maladie[55].
Les anomalies cytogénétiques de type 6p21 et 11q13 sont associées à un meilleur pronostic.
Les calculs de durée de survie sont toujours effectués par analyses rétrospectives, et il est probable que de nouveaux développements de traitement permettent déjà d'améliorer les perspectives de ceux qui avaient traditionnellement « de faibles chances de survie ».
Personnes connues ayant été atteintes de la maladie de Kahler
[modifier | modifier le code]- Contrairement à ce que le Quid notamment a écrit dans son édition de 2007, Georges Pompidou (1911-1974) est mort des suites d'une maladie de Waldenström, et non pas d'un myélome[56].
- Roy Scheider (1932-2008), acteur américain[57].
- Peter Boyle (1935-2006), acteur américain.
- Bourvil (1917-1970), acteur français[58].
- Jean Marais (1913-1998), acteur français[59].
- Marc Simoneau (1940-2013), animateur canadien à la radio[60].
- Lisa Ray (1972-), mannequin et actrice canadienne, se déclare atteinte de la maladie en juin 2009, après le traitement, en rémission 10 mois plus tard[61] et toujours en rémission en 2015[62].
- Rick Davies (1944 -), fondateur du groupe Supertramp[63].
- Colin Powell, général et homme politique américain, est atteint de la maladie. Il décède le 18 octobre 2021 à la suite de complications liées au Covid-19[64].
Notes et références
[modifier | modifier le code]- (en) « Notice biographique », sur Who Named It?
- « Dictionnaire médical de l'Académie de Médecine », sur dictionnaire.academie-medecine.fr (consulté le )
- Laroche M (2018) Chapitre 21 : Myélome multiple des os (maladie de Kahler)| Rhumatologie pour le praticien, 257. (résumé)
- (en) Cohen HJ, Crawford J, Rao MK, Pieper CF, Currie MS, « Racial differences in the prevalence of monoclonal gammopathy in a community-based sample of the elderly » Am. J. Med. 1998;104:439-444
- (en) Raab MS, Podar K, Breitkreutz I, Richardson PG, Anderson KC, « Multiple myeloma » Lancet 2009;374:324-339
- Vilela M.A (2016) Recurrence of Multiple Myeloma Detected by Fundoscopy–Case Report. EC Ophthalmology, 4, 542-545.
- « Une percée pour les patients souffrant de myélome multiple »
- (en) Sarah DeWeerdt, « Burning questions about smouldering myeloma », Nature, vol. 587, no 7835, , S58–S59 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-03225-0, lire en ligne, consulté le )
- Robert A. Kyle et Philip R. Greipp, « Smoldering Multiple Myeloma », New England Journal of Medicine, vol. 302, no 24, , p. 1347–1349 (ISSN 0028-4793, PMID 7374679, DOI 10.1056/NEJM198006123022405, lire en ligne, consulté le )
- Bladé J & Kyle R.A (1998) Multiple myeloma in young patients: clinical presentation and treatment approach. Leukemia & lymphoma, 30(5-6), 493-501 (résumé)
- (en) Kumar SK, Lee JH, Lahuerta JJ, Morgan G, Durie BG. et al.; International Myeloma Working Group, « Risk of progression and survival in multiple myeloma relapsing after therapy with IMiDs and bortezomib: a multicenter international myeloma working group study », Leukemia, vol. 26, no 1, , p. 149-57. (PMID 21799510, PMCID PMC4109061, DOI 10.1038/leu.2011.196, lire en ligne [html])
- (en) S. Vincent Rajkumar, « The screening imperative for multiple myeloma », Nature, vol. 587, no 7835, , S63–S63 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-03227-y, lire en ligne, consulté le )
- (en) Brian Owens, « Outlook: Multiple myeloma », Nature, vol. 587, no 7835, , S55–S55 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-03223-2, lire en ligne, consulté le )
- Peyton W.T (1934) Effect of Radium on the Spinal Coed: Report of Two Cases of Myeloma. The American Journal of Cancer, 20(3), 558-572.
- Amiard J.C (2019) Les accidents nucléaires industriels et médicaux: Conséquences environnementales, écologiques, sanitaires et socio-économiques (Vol. 2). ISTE Group. Voir p 47 (exgtraits)
- Stebbings J.H, Lucas H.F & Stehney A.F (1984) Mortality from cancers of major sites in female radium dial workers. American journal of industrial medicine, 5(6), 435-459.
- Stebbings J.h, Lucas H.F & Stehney A.F (1983) Multiple myeloma, leukemia, and breast cancer among the US radium dial workers (No. CONF-830101--6). Argonne National Lab..
- Stebbings J.H (2001) Health risks from radium in workplaces: an unfinished story. Occupational medicine (Philadelphia, Pa.), 16(2), 259-270.(résumé)
- Ritsu Sakata & al. (2012) Cancer Mortality Following Radiotherapy for Benign Gynecologic Disorders. Radiation Research 178:4, 266-279. mis en ligne le 02 aout 2012.
- Inskip P.D & al. (1993) Leukemia, lymphoma, and multiple myeloma after pelvic radiotherapy for benign disease. Radiation research, 135(1), 108-124.
- Presutti, R., Harris, S. A., Kachuri, L., Spinelli, J. J., Pahwa, M., Blair, A., ... & McLaughlin, J. R. (2016) Pesticide exposures and the risk of multiple myeloma in men: An analysis of the North American Pooled Project. International journal of cancer, 139(8), 1703-1714.
- Weber, L., Song, K., Boyle, T., Gaudreau, É., Lai, A., Sutherland, H. J., ... & Spinelli, J. J. (2018) Organochlorine levels in plasma and risk of multiple myeloma. Journal of occupational and environmental medicine, 60(10), 911-916 (résumé)
- Dieye M, Quénel P, Goria S, Blateau A, Colonna M et al. Étude de la répartition spatiale des cancers possiblement liés à la pollution des sols par les pesticides organochlorés, en Martinique. Saint-Maurice (Fra) : Institut de veille sanitaire, août 2009, 27 p. (Disponible sur le site de l'InVS
- Tual, S., Busson, A., Boulanger, M., Renier, M., Piel, C., Pouchieu, C., ... & Lemarchand, C. (2019). Occupational exposure to pesticides and multiple myeloma in the AGRICAN cohort. Cancer Causes & Control, 30(11), 1243-1250 (résumé).
- Packard, E., Shahid, Z., Groff, A., Patel, R., & Jain, R. (2019) Multiple Myeloma in an Agricultural Worker Exposed to Pesticides. Cureus, 11(5).
- Davoren MJ, Schiestl RH. (2018) Glyphosate-based herbicides and cancer risk: a post-IARC decision review of potential mechanisms, policy and avenues of research. Carcinogenesis. ;39(10):1207–15
- Brown LM, Burmeister LF, Everett GD, Blair A. (1993) Pesticide exposures and multiple myeloma in Iowa men. Cancer Causes Control : CCC. ;4(2):153–6.
- Orsi L, Delabre L, Monnereau A, Delval P, Berthou C, Fenaux P, Marit G, Soubeyran P, Huguet F, Milpied N, et al. (2009) Occupational exposure to pesticides and lymphoid neoplasms among men: results of a French case-control study. Occup Environ Med. ;66(5):291–8.
- Kachuri L, Demers PA, Blair A, Spinelli JJ, Pahwa M, McLaughlin JR, Pahwa P, Dosman JA, Harris SA. Multiple pesticide exposures and the risk of multiple myeloma in Canadian men. Int J Cancer. 2013;133(8):1846–58.
- Andreotti G, Koutros S, Hofmann JN, Sandler DP, Lubin JH, Lynch CF, Lerro CC, De Roos AJ, Parks CG, Alavanja MC, et al. (2018) Glyphosate use and cancer incidence in the agricultural health study. J Natl Cancer Inst. ;110(5):509–16.
- Wang, L., Deng, Q., Hu, H., Liu, M., Gong, Z., Zhang, S., ... & Li, Y. (2019) Glyphosate induces benign monoclonal gammopathy and promotes multiple myeloma progression in mice. Journal of hematology & oncology, 12(1), 70.
- (en) Jyoti Madhusoodanan, « Research round-up: Multiple myeloma », Nature, vol. 587, no 7835, , S68–S69 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-03230-3, lire en ligne, consulté le )
- (en) Cassandra Willyard, « How researchers are addressing the racial imbalance in multiple myeloma », Nature, vol. 587, no 7835, , S64–S65 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-03228-x, lire en ligne, consulté le )
- Mark Bustoros, Romanos Sklavenitis-Pistofidis, Jihye Park et Robert Redd, « Genomic Profiling of Smoldering Multiple Myeloma Identifies Patients at a High Risk of Disease Progression », Journal of Clinical Oncology, vol. 38, no 21, , p. 2380–2389 (ISSN 0732-183X, PMID 32442065, PMCID PMC7367550, DOI 10.1200/JCO.20.00437, lire en ligne, consulté le )
- Akiki A, Arlettaz Y. « Lésion lytique périacétabulaire d’apparition rapide : un indicatif d’un myélome multiple ? (Multiple myeloma as a cause of rapid acetabular osteolysis) » Rev Med Suisse 2007 Sep 5;3(123):1968-70.
- (en) Nau KC, Lewis WD. « Multiple myeloma: diagnosis and treatment » Am Fam Physician 2008;78(7):853-9.
- (en) « Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group » Br J Haematol. 2003;121:749-757
- Terpos E (2015) European Myeloma Network guidelines for the management of multiple myeloma-related complications. | Haematologica. 2015 Oct;100(10):1254-66. doi: 10.3324/haematol.2014.117176 (résumé).
- Delaney W.V & Liaricos S.V (1968) Chorioretinal destruction in multiple myeloma. American journal of ophthalmology, 66(1), 52-55 (résumé/1re page de l'article).
- Pennisi, M., Berchicci, L., Miserocchi, E., Mussetti, A., Cacioppo, V., David, A., ... & Montefusco, V. (2019). Ocular disorders in multiple myeloma patients: cross-sectional study of prevalence and association with treatment. Leukemia & lymphoma, 60(2), 477-482 (résumé).
- (en) Durie BG, Salmon SE. « A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival »] Cancer 1975;36:842-54.
- (en) Greipp PR, Miguel J San, Durie BG et al. « International staging system for multiple myeloma » J Clin Oncol. 2005;23:3412-3420
- (en) Mateos MV, Hernandez JM, Hernandez MT et al. « Bortezomib plus melphalan and prednisone in elderly untreated patients with multiple myeloma: results of a multicenter phase 1/2 study » Blood 2006;108:2165-2172
- (en) Rajkumar SV, Blood E, Vesole D, Fonseca R, Greipp PR, « Phase III clinical trial of thalidomide plus dexamethasone compared with dexamethasone alone in newly diagnosed multiple myeloma: a clinical trial coordinated by the Eastern Cooperative Oncology Group » J Clin Oncol. 2006;24:431-436
- (en) I. Breitkreutz, M. S. Raab, S. Vallet et T. Hideshima, « Lenalidomide inhibits osteoclastogenesis, survival factors and bone-remodeling markers in multiple myeloma », Leukemia, vol. 22, no 10, , p. 1925–1932 (ISSN 1476-5551, DOI 10.1038/leu.2008.174, lire en ligne, consulté le )
- (en) Scott LJ, Lyseng-Williamson KA, « Spotlight on lenalidomide in relapsed or refractory multiple myeloma », BioDrugs, vol. 25, no 5, , p. 333-7. (PMID 21942918, DOI 10.2165/11207120-000000000-00000).
- (en) Berenson JR. « Myeloma bone disease » Best Pract Res Clin Haematol. 2005;18:653-672
- (en) Attal M, Harousseau JL, Stoppa AM et al. « A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Français du Myélome » N Engl J Med. 1996;335:91-97
- (en) Attal M, Harousseau JL, Facon T et al. « Single versus double autologous stem-cell transplantation for multiple myeloma » N Engl J Med. 2003;349:2495-502.
- (en) Barlogie B, Jagannath S, Desikan KR et al. « Total therapy with tandem transplants for newly diagnosed multiple myeloma » Blood 1999;93:55-65
- (en) Carolyn Brown, « Scientists are harnessing viruses to treat tumours », Nature, vol. 587, no 7835, , S60–S62 (DOI 10.1038/d41586-020-03226-z, lire en ligne, consulté le ).
- (en) Dalmeet Singh Chawla, « Immunotherapies target multiple myeloma », Nature, vol. 587, no 7835, , S66–S67 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-020-03229-w, lire en ligne, consulté le ).
- (en) Eric L. Smith, Kim Harrington, Mette Staehr et Reed Masakayan, « GPRC5D is a target for the immunotherapy of multiple myeloma with rationally designed CAR T cells », Science Translational Medicine, vol. 11, no 485, , eaau7746 (ISSN 1946-6234 et 1946-6242, PMID 30918115, PMCID PMC7508042, DOI 10.1126/scitranslmed.aau7746, lire en ligne, consulté le ).
- Collège français des enseignants en rhumatologie., Rhumatologie, Issy-les-Moulineaux, Elsevier Masson, dl 2015, cop. 2015, 393 p. (ISBN 978-2-294-73896-8, OCLC 927163734, lire en ligne)
- (en) Survie médiane
- De Saint-Sauveur C, 1974 : Georges Pompidou, le calvaire d'un président, Le Parisien, 2 avril 2017
- « Tribute Honors Roy Scheider, Benefits UAMS Myeloma Institute. », sur University of Arkansas for Medical Sciences, (consulté le )
- Le Républicain Lorrain, 21 novembre 2010
- Nini Pasquali, Jean Marais sans masque, Éditions De la Loupe, 2004, page 182 (ISBN 978-2-84868-032-3)
- Boivin, Mathieu, « Marc Simoneau décède du cancer », Le Soleil, 3 mai 2013, consulté en ligne le 3 mai 2013.
- (en) « Actress Lisa Ray says she’s cancer free », The Star, Toronto, 22 avril 2010
- (en) Vinayak Chakravorty, « 'I have been living a full life since I was diagnosed': Lisa Ray on her triumph over cancer. », sur dailymail.co.uk, (consulté le )
- « Supertramp cancels European tour because of singer's cancer » (consulté le )
- « Colin Powell, l’ancien secrétaire d’Etat américain, est mort du Covid-19 », sur Le Monde, (consulté le )
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]En France :
- Le site de la FFRMG Fondation Française pour la Recherche contre le Myélome et les Gammapathies
- Le site de l'AF3M Association Française des Malades du Myélome Multiple
- Site d'information des malades sur le myélome proposé avec l'Intergroupe Francophone du Myélome
- Guide ALD no 30, de la HAS, décembre 2010
- Le site de l'IFM (Intergroupe Francophone du Myélome), dédié aux hématologues
- Liste d'échanges et d'entraide autour du myélome, dédiée à tous
En Europe :
- Myeloma Euronet - Réseau européen de groupes de patients atteints de myélome
- Asbl Mymu (Wallonie - Bruxelles) - Groupement belge de patients atteints de myélome multiple
- Myelom Kontaktgruppe Schweiz (MkGS) - Groupe de contact sur le myélome en Suisse
Au Canada :
- Myeloma Canada -Groupe de patients atteints de myélome.
Dans le reste du monde :
- de Gunzburg Myeloma Research Foundation (site américain)
- IMF International Myeloma Foundation (possibilité de sélectionner le français)
- MMRF Multiple Myeloma Research Foundation (site américain)
Bibliographie
[modifier | modifier le code]- Anderson, K., Ismaila, N., Flynn, P. J., Halabi, S., Jagannath, S., Ogaily, M. S., ... & Kyle, R. A. (2018) Role of bone-modifying agents in multiple myeloma: American Society of Clinical Oncology clinical practice guideline update. American Society of Clinical Oncology.
- Cornell, R. F., D'Souza, A., Kassim, A. A., Costa, L. J., Innis-Shelton, R. D., Zhang, M. J., ... & Bashey, A. (2017). Maintenance versus induction therapy choice on outcomes after autologous transplantation for multiple myeloma. Biology of Blood and Marrow Transplantation, 23(2), 269-277.
- Fikri M, S. Semlali, A. El Quessar, M. R. El Hassani, M. Jiddane (2006) Maladie de Kahler révélée par un plasmocytome solitaire de la voûte (Research article) ; Revue Neurologique ; Volume 162, Issues 6–7 ; June ; Pages 757-759
- Hillengass, J., Usmani, S., Rajkumar, S. V., Durie, B. G., Mateos, M. V., Lonial, S., ... & Du, J. (2019) International myeloma working group consensus recommendations on imaging in monoclonal plasma cell disorders. The Lancet Oncology, 20(6), e302-e312.
- Liautard J, A. Le Quellec, L. Cuissard, A. J. Clurana (1993) Tumeur sciatique plasmocytaire de la maladie de Kahler: imagerie inédite ; La Revue de Médecine InterneVolume 14, Issue 6June 1993Page 575
- Mouhdi H, M. Lezrek, R. Lachkar, Z. Benchrif, R. Daouidi(2007) La localisation orbitaire dans la maladie de Kahler (Conference abstract) ; Journal Français d'Ophtalmologie ; Volume 30, Supplement 2 ; April; Page 2s329
- Musto, P., Anderson, K. C., Attal, M., Richardson, P. G., Badros, A., Hou, J., ... & Einsele, H. (2017) Second primary malignancies in multiple myeloma: an overview and IMWG consensus. Annals of Oncology, 28(2), 228-245.

