Utilisateur:Senkuchan/Brouillon/Ricine
| Ricine | ||
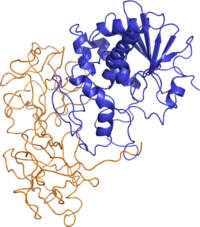 Structure de la ricine. La chaîne A est représentée en bleu et la chaîne B en orange. (PDB 2AAI[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Symbole | RCOM_2159910 | |
| Synonymes | RT Agent W |
|
| Fonction | Toxine végétale | |
| N° EC | 3.2.2.22 | |
| Ricinus communis | ||
| Localisation | génome complet : 0 - 0,01 Mb | |
| Masse moléculaire | ~64 000 Da[2] | |
| Entrez | 8287993 | |
| UniProt | P02879 | |
| RefSeq (ARNm) | XM_002534603.1 | |
| RefSeq (protéine) | XP_002534649.1 | |
La ricine /ʁisin/ est une glycoprotéine et une toxine végétale produite par une plante de la famille des Euphorbiacées, le ricin commun (Ricinus communis). Il s'agit d'un hétérodimère constitué de deux chaînes polypeptidiques, où la chaîne B est une lectine et la chaîne A agit comme une protéine inactivatrice de ribosome[3]. Son mécanisme d'action lui confère une forte cytotoxicité, qui fait de la ricine l'une des substances les plus toxiques connues par l'homme. La dose létale médiane (DL50) de la ricine chez la souris est d'environ 5 microgrammes par kilogramme de poids corporel par injection intraveineuse. Par extrapolation des cas d'intoxication aux graines de ricin, la dose létale orale de la ricine chez l'homme a été estimée entre 1 et 20 mg/kg de poids corporel (environ 5 à 10 graines)[4],[5].
La ricine est considérée comme une arme biologique potentielle[6]. Elle est classée comme « agent biologique toxique de catégorie B » par le CDC d'Atlanta[7] et inscrite sur la liste des select agents du HHS[8] et au tableau 1 (schedule 1) de la Convention sur l'interdiction des armes chimiques[9]. Plusieurs cas de son utilisation comme poison ont été rapportés, notamment lors de l'assassinat du journaliste dissident bulgare Guéorgui Markov[10].
Étymologie et dénominations[modifier | modifier le code]
La ricine est une toxalbumine découverte en 1888 par le scientifique allemand Peter Hermann Stillmark, le fondateur de la lectinologie[11]. Le nom donné par Stillmark à la toxine est dérivé du nom de la plante d'où elle est extraite, le ricin – nom lui-même dérivé du latin ricinus (« tique, ricin ») – avec le suffixe -ine (désignant un produit extrait d’une plante).
L'armée britannique assigne à la toxine le code "W" (Agent W) durant la Seconde Guerre mondiale[11].
Plusieurs dénominations spécifiques sont trouvées dans la littérature scientifique anglophone : lectine ou RIP de type 2 de Ricinus communis et l'acronyme "RT" (pour "Ricinus toxin") afin de distinguer les deux chaînes de la ricine, "RTA" et "RTB".
Biochimie[modifier | modifier le code]
La ricine est une glycoprotéine de poids moléculaire 64 kDa, formée de deux chaînes polypeptidiques A et B, reliées entre elles par un pont disulfure. La chaîne B permet à la toxine de se fixer à la paroi cellulaire et la chaîne A, responsable des propriétés toxiques, est capable d’inhiber la synthèse des protéines en attaquant l'ARN des ribosomes, entraînant la mort cellulaire[12]. La ricine est ainsi classée comme une protéine inactivant les ribosomes (en anglais Ribosome-inactivating protein aussi désigné par l'acronyme RIP) de type 2. Alors que les RIP de type 1 sont composées d'une seule chaîne protéique qui possède une activité catalytique, les RIP de type 2, également connues sous le nom d'holotoxines, sont composées de deux chaînes protéiques différentes qui forment un complexe hétérodimérique. Les RIP de type 2 sont constitués d'une chaîne A fonctionnellement équivalente à un RIP de type 1, reliée de manière covalente par une seule liaison disulfure à une chaîne B qui est catalytiquement inactive, mais qui sert de médiateur pour le transport du complexe protéique A-B de la surface de la cellule, via des vésicules porteuses, vers la lumière du réticulum endoplasmique (RE). Les RIP de type 1 et de type 2 sont fonctionnellement actifs contre les ribosomes in vitro ; cependant seuls les RIP de type 2 présentent une cytotoxicité in vivo en raison des propriétés de la chaîne B qui s'apparentent à celles d'une lectine. Pour que la ricine puisse inactiver les ribosomes, la liaison disulfure de la ricine doit être clivée par oxydoréduction[13].
Biosynthèse[modifier | modifier le code]
La ricine est synthétisée dans l'endosperme des graines de ricin[12]. Le précurseur protéique de la ricine (proricine) a une longueur de 576 résidus d'acides aminés et contient un peptide signal (résidus 1-35), la chaîne A de la ricine (36-302), un peptide de liaison (303-314) et la chaîne B de la ricine (315-576)[14]. La séquence signal N-terminale transmet le prépolypeptide au réticulum endoplasmique (RE), puis le peptide signal est clivé. Dans le lumen du RE, le propolypeptide est glycosylé et une protéine disulfure isomérase catalyse la formation de liaisons disulfure entre les cystéines 294 et 318. Le propolypeptide est ensuite glycosylé dans l'appareil de Golgi et transporté vers les corps de stockage des protéines. Le propolypeptide est clivé dans les corps protéiques par une endopeptidase pour produire la protéine de ricine mature, composée d'une chaîne A de 267 résidus et d'une chaîne B de 262 résidus, liées par une seule liaison covalente disulfure[12].
Structure[modifier | modifier le code]

En termes de structure, la ricine ressemble beaucoup à l'abrine. La structure quaternaire de la ricine est un hétérodimère globulaire glycosylé d'environ 60-65 kDa. La chaîne A et la chaîne B de la toxine ont des poids moléculaires similaires, d'environ 32 kDa et 34 kDa, respectivement.
- La chaîne A de la ricine (RTA) est une N-glycoside hydrolase composée de 267 acides aminés[15]. Elle possède trois domaines structuraux avec environ 50 % du polypeptide arrangé en hélices alpha et en feuillets bêta[16]. Les trois domaines forment une fente prononcée qui est le site actif de la RTA.
- La chaîne B de la ricine (RTB) est une lectine composée de 262 acides aminés capable de se lier aux résidus de galactose terminaux sur les surfaces cellulaires[17]. La RTB forme une structure bilobée, en forme d'haltère, dépourvue d'hélice alpha ou de feuillet bêta, dont les lobes individuels contiennent trois sous-domaines. Au moins un de ces trois sous-domaines dans chaque lobe homologue possède une poche de liaison aux sucres qui confère à la RTB son caractère fonctionnel.
Mécanisme d'action[modifier | modifier le code]
La chaîne B de la ricine se lie à des glucides complexes à la surface des cellules eucaryotes contenant soit des résidus terminaux de N-acétylgalactosamine, soit des résidus de bêta-1,4-galactose. En outre, les glycanes de type mannose de la ricine sont capables de se lier aux cellules qui expriment des récepteurs de mannose (une lectine type-C)[18]. Il a été démontré que la RTB se lie à la surface cellulaire à raison de 106-108 molécules de ricine par cellule[19].
La liaison abondante de la ricine aux membranes de surface permet l'internalisation avec tous les types d'invaginations membranaires. L'holotoxine peut être absorbée par des puits recouverts de clathrine, ainsi que par des voies indépendantes de la clathrine, notamment par les cavéoles et la macropinocytose[20],[21]. Les vésicules intracellulaires transportent la ricine vers les endosomes qui sont acheminés vers l'appareil de Golgi. On pense que l'acidification active des endosomes a peu d'effet sur les propriétés fonctionnelles de la ricine. La ricine étant stable dans une large gamme de pH, la dégradation dans les endosomes ou les lysosomes n'offre que peu ou pas de protection contre la ricine[22]. On pense que les molécules de ricine suivent un transport rétrograde via les endosomes précoces, le réseau trans-golgien et l'appareil de Golgi pour pénétrer dans la lumière du réticulum endoplasmique (RE)[23].
Pour que la ricine fonctionne de manière cytotoxique, la RTA doit être clivée par réduction à partir de la RTB afin de libérer un bloc stérique du site actif de la RTA. Ce processus est catalysé par la protéine PDI (protéine disulfure isomérase) qui réside dans la lumière du RE[24],[25]. La RTA libre dans la lumière du RE se déplie alors partiellement et s'enfouit partiellement dans la membrane du RE, où l'on pense qu'elle imite une protéine mal repliée associée à la membrane[26]. Des rôles pour les protéines chaperons du RE GRP94[27], EDEM[28] et BiP[29] ont été proposés avant la "dislocation" de RTA de la lumière du RE vers le cytosol d'une manière qui utilise des composants de la voie de dégradation des protéines associée au réticulum endoplasmique (ERAD). La voie de dégradation des protéines associée au réticulum endoplasmique (ERAD) évacue normalement les protéines mal repliées du réticulum endoplasmique vers le cytosol afin qu'elles soient détruites par les protéasomes cytosoliques. La dislocation de RTA nécessite des complexes E3 ubiquitine ligase intégrés à la membrane du RE[30], mais RTA évite l'ubiquitination qui se produit habituellement avec les substrats ERAD en raison de sa faible teneur en résidus lysine, qui sont les sites d'attachement habituels de l'ubiquitine[31]. Ainsi, la RTA évite le sort habituel des protéines disloquées (destruction qui est médiée par le ciblage des protéines ubiquitinylées vers les protéasomes cytosoliques). Dans le cytosol des cellules de mammifères, la RTA subit ensuite un triage par les chaperons moléculaires cytosoliques Hsc70 et Hsp90 et leurs co-chaperons, ainsi que par une sous-unité (RPT5) du protéasome lui-même, ce qui entraîne son repliement dans une conformation catalytique[32],[33], qui dépurine les ribosomes, stoppant ainsi la synthèse des protéines.
La RTA possède une activité ARNr N-glycosylase qui est responsable du clivage d'une liaison glycosidique dans le grand ARNr de la sous-unité 60S des ribosomes eucaryotes[34]. La RTA hydrolyse de manière spécifique et irréversible la liaison N-glycosidique du résidu adénine en position 4324 (A4324) dans l'ARNr 28S, mais laisse intact le squelette phosphodiester de l'ARN[35]. La ricine cible A4324 qui est contenu dans une séquence hautement conservée de 12 [[nucléotide]s que l'on trouve universellement dans les ribosomes eucaryotes. La séquence 5'-AGUACGAGAGGA-3', appelée boucle sarcine-ricine, est importante pour la liaison des facteurs d'élongation pendant la synthèse des protéines[36]. L'événement de dépurination inactive rapidement et complètement le ribosome, ce qui entraîne une toxicité due à l'inhibition de la synthèse des protéines. Une seule molécule de RTA dans le cytosol est capable de dépuriner environ 1 500 ribosomes par minute. Ainsi on estime qu'une seule molécule de ricine est capable de tuer une seule cellule.
Le site actif de RTA contient plusieurs résidus d'acides aminés invariants impliqués dans la dépurination de l'ARN ribosomal[37]. Bien que le mécanisme exact de l'événement soit inconnu, les résidus d'acides aminés clés identifiés comprennent la tyrosine aux positions 80 et 123, l'acide glutamique à la position 177, et l'arginine à la position 180. En particulier, il a été démontré que Arg180 et Glu177 sont impliqués dans le mécanisme catalytique, et non dans la liaison au substrat, grâce à des études de cinétique enzymatique impliquant des mutants de RTA. Un modèle de réaction proposé est le suivant[38] :
- Le substrat de la boucle sarcine-ricine se lie au site actif de RTA avec l'adénine cible empilée contre tyr80 et tyr123.
- Arg180 est positionné de manière à pouvoir protoner N-3 de l'adénine et rompre la liaison entre N-9 de l'anneau adénine et C-1' du ribose.
- La rupture de la liaison entraîne la formation d'un ion oxycarbonium sur le ribose, stabilisé par le Glu177.
- La protonation N-3 de l'adénine par Arg180 permet la déprotonation d'une molécule d'eau voisine.
- L'hydroxyle résultant attaque l'ion carbonium du ribose.
- La dépurination de l'adénine donne un ribose neutre sur un squelette d'ARN phosphodiester intact.
Rôle évolutif[modifier | modifier le code]
Le rôle de la ricine et des autres RIP dans la nature, et plus largement dans l'évolution des plantes, est encore mal compris. Une hypothèse assez répandue est que les RIP pourraient constituer une défense contre les prédateurs et/ou les parasites. Il est possible que l'activité antivirale des RIP prévienne ou au moins limite les infections virales chez certaines plantes. En outre, il est probable que les RIP de type 2 toxiques dissuadent les animaux de manger les plantes qui les contiennent, ce qui est moins probable dans le cas des RIP de type 1, qui sont présents dans les plantes comestibles. Comme l'expression des RIP est renforcée dans les plantes ou les feuilles en état de sénescence ou soumises à divers stress biotiques et abiotiques, ils pourraient également jouer un rôle dans la résistance des plantes au stress, peut-être via la réorganisation du métabolisme des protéines par l'inhibition de la synthèse des protéines[39].
Propriétés physico-chimiques[modifier | modifier le code]
La ricine purifiée est une poudre blanche soluble dans l'eau et stable dans une large gamme de pH. Elle est inactivée par la chaleur, à 80°C dans une solution aqueuse pendant une heure, et nécessite des températures plus élevées ou des périodes d'inactivation plus longues lorsqu'elle se présente sous forme de poudre ou de produit brut (non purifié)[5]. La ricine est également inactivée par une exposition de 30 minutes à des concentrations d'hypochlorite de sodium (NAClO) de 0,1 % à 2,5 % (eau de javel diluée)[40].
Applications thérapeutiques[modifier | modifier le code]
Toxicologie[modifier | modifier le code]
La toxicité de la ricine dans les modèles animaux comme la souris est relativement bien documentée. Les valeurs de toxicocinétique et toxicodynamique chez l'homme sont souvent extrapolées à partir des données obtenues par l'étude de la toxine chez l'animal et au travers des cas d'intoxication occasionnels. La section présente fait le résumé des connaissances sur la toxicité de la ricine[4],[5],[10],[41].
Ingestion[modifier | modifier le code]
La littérature ne fait état d'aucun cas d'empoisonnement dû à l'ingestion de ricine purifiée. Tous les rapports cliniques concernant l'empoisonnement font référence à l'ingestion de graines de ricin[42]. La dose létale médiane orale (DL50) chez la souris est de 30 mg/kg, soit environ 1000 fois plus élevée que par injection ou inhalation (donc la ricine est mille fois plus toxique par voie pulmonaire ou parentérale). Cette toxicité plus faible par voie orale est due à la dégradation de la toxine dans le tractus gastro-intestinal. Dans des rapports sur l'ingestion de graines de ricin chez l'homme, la dose orale létale chez l'homme a été estimée à 1-20 mg/kg de poids corporel (ce qui correspond à environ 8 graines de ricin). Mais les doses de ricine estimées à partir du nombre de graines ingérées peuvent donner des estimations inexactes en raison de la variation de la taille, du poids et de la teneur en eau des graines ; de la région, de la saison et de la période de croissance de la plante au moment de la récolte des graines ; ainsi que du degré de mastication, de l'âge et des comorbidités[43],[4],[44],[45],[46]. Les symptômes (de légers à mortels) se manifestent, selon les cas, après l'ingestion d'un nombre de graines variant entre 0,5 et 30. Dans un cas, il a été rapporté que l'ingestion de 2 graines seulement a suffit à causer la mort[44]. Dans les modèles animaux, la ricine ingérée est absorbée dans les 2 heures par les vaisseaux lymphatiques et sanguins, et elle s'accumule principalement dans le foie et la rate.
Injection[modifier | modifier le code]
Il existe peu de données publiées sur l'exposition humaine à la ricine par voie parentérale. La DL50 chez la souris est d'environ 5 à 10 μg/kg[47],[48]. Les doses létales minimales varient de 0,7 à 2 μg/kg chez la souris et de 1 à 1,75 μg/kg chez le chien[49].
Inhalation[modifier | modifier le code]
Le dépôt pulmonaire et la létalité après inhalation de ricine sont fortement influencés par la taille des particules (diamètre aérodynamique équivalent)[50]. Les particules de faible taille peuvent se déposer plus profondément dans les voies respiratoires, ce qui entraîne une mortalité plus élevée[51]. Les particules d'un diamètre de plus en plus grand se déposent généralement plus haut dans les voies respiratoires et peuvent être balayées par le système mucociliaire, puis avalées[52]. La DL50 chez les souris exposées à une forme de ricine, de taille particulaire inférieure à 5 μm, est d'environ 3 à 5 μg/kg. Des singes exposés à la ricine inhalée ont développé une dyspnée progressive 20 à 24 heures après l'administration de 21 à 42 μg/kg de particules de 1 à 2 μm de diamètre[53]. Trois des cinq singes sont morts, respectivement après 36, 40 et 48 heures. L'autopsie a révélé un œdème pulmonaire diffus avec des zones multifocales de nécrose et d'inflammation. Les lésions étaient significativement plus graves dans les voies aériennes distales et les alvéoles. La toxicité résulte de l'inhibition de la synthèse des protéines, de la libération de cytokines et de lésions directes de la membrane épithéliale. La cible principale de la toxicité après inhalation de ricine sont les pneumocytes de type I et II[51],[53],[54],[55]. Il n'y a pas eu d'absorption systémique significative après une exposition par inhalation et la toxicité était principalement limitée aux voies respiratoires dans ces études sur les animaux[52],[56],[51].
Arme de guerre biologique[modifier | modifier le code]
Risque criminel[modifier | modifier le code]
Régulation et contrôle[modifier | modifier le code]
Méthodes de détection et d'analyse[modifier | modifier le code]
Aspects médicaux de l'intoxication[modifier | modifier le code]
L'intoxication à la ricine est très rare et souvent d'origine accidentelle. La section présente fait état des recommandations provenant d'instituts américains de biodéfense[57] et de médecine militaire[58] sur son diagnostic et sa prise en charge.
Signes et symptômes[modifier | modifier le code]
La pathologie dépend de la voie d'exposition. Après une exposition par aérosol, les signes et symptômes dépendent de la dose inhalée. Les expositions accidentelles sublétales à des aérosols, qui se sont produites chez l'homme dans les années 1940, étaient caractérisées par l'apparition de fièvre, d'oppression thoracique, de toux, de dyspnée, de nausées et d'arthralgies dans un délai de 4 à 8 heures[59],[4]. L'apparition d'une transpiration abondante quelques heures plus tard coïncidait généralement avec la disparition de la plupart des symptômes. Bien que des expositions létales à des aérosols chez l'homme n'ont jamais été décrites, les changements physiopathologiques graves observés dans les voies respiratoires des animaux, y compris la nécrose et l'inondation sévère des alvéoles, ont été suffisants pour provoquer la mort par syndrome de détresse respiratoire aigu (SDRA) et insuffisance respiratoire. Le délai avant la mort chez les animaux de laboratoire dépend de la dose et se situe entre 36 et 72 heures après l'inhalation[60]. On peut s'attendre à ce que les humains exposés développent une inflammation pulmonaire grave accompagnée d'une toux progressive, d'une dyspnée, d'une cyanose et d'un œdème pulmonaire.
Par d'autres voies d'exposition, la ricine n'est pas un irritant direct des poumons ; cependant, l'injection intraveineuse (IV) peut provoquer un œdème périvasculaire pulmonaire minime dû à une lésion de l'endothélium vasculaire. L'ingestion (intoxication orale) provoque une nécrose de l'épithélium gastro-intestinal, une hémorragie locale et une nécrose hépatique, splénique et rénale. Seuls 13 décès ont été enregistrés depuis la fin des années 1880 sur les 875 cas accidentels d'ingestion signalés[42]. L'ingestion de ricine est rarement mortelle en raison de la dégradation de la toxine par le faible pH de l'acide gastrique. L'injection intramusculaire (IM) provoque une nécrose locale grave des muscles et des ganglions lymphatiques régionaux, avec une atteinte modérée des organes viscéraux.
Diagnostic[modifier | modifier le code]
Une attaque à la ricine en aérosol serait principalement diagnostiquée par l'observation des caractéristiques cliniques dans le contexte épidémiologique approprié. Une lésion pulmonaire aiguë affectant un grand nombre de cas géographiquement regroupés devrait faire suspecter une attaque avec un irritant pulmonaire tel que la ricine, bien que d'autres agents pulmonaires puissent présenter des signes et des symptômes similaires. D'autres menaces biologiques, telles que l'entérotoxine B staphylococcique (SEB), la fièvre Q, la tularémie, la peste et certains agents chimiques de guerre comme le phosgène, doivent être pris en compte dans le diagnostic différentiel. L'œdème pulmonaire induit par la ricine devrait survenir beaucoup plus tard (1 à 3 jours après l'exposition) que celui induit par le SEB (environ 12 heures après l'exposition) ou le phosgène (environ 6 heures après l'exposition). L'intoxication à la ricine évolue malgré un traitement antibiotique, contrairement à un processus infectieux. L'intoxication à la ricine ne provoque pas de médiastinite comme dans le cas de l'anthrax par inhalation. Les patients atteints d'une intoxication à la ricine n'atteignent pas un plateau clinique comme dans le cas d'une intoxication au SEB. Les autres caractéristiques cliniques ou diagnostiques de soutien après une exposition à la ricine par aérosol sont les suivantes : infiltrats bilatéraux sur la radiographie du thorax, hypoxémie artérielle, leucocytose neutrophile et aspirat bronchique riche en protéines par rapport au plasma, ce qui est caractéristique d'un œdème pulmonaire de haute perméabilité.
Des immunodosages spécifiques du sérum et des sécrétions respiratoires, des prélèvements cutanés et/ou nasaux, ou des colorations immunohistochimiques de tissus peuvent être utilisés lorsqu'ils sont disponibles. En raison de l'absorption cellulaire et de la distribution rapides de la toxine, une détection précoce est essentielle pour les soins et la survie du patient[61]. La ricine a une demi-vie biphasique, une phase alpha et une phase bêta, ce qui limite la détection à 24 heures après l'intoxication[62]. Plusieurs méthodes et plates-formes biochimiques sont utilisées pour la détection de la ricine : billes magnétiques marquées liées à des anticorps, anticorps de capture et de détection, ou par chromatographie en phase liquide-spectrométrie de masse (LC/MS)[59].
Traitement[modifier | modifier le code]
La prise en charge des patients intoxiqués par la ricine varie en fonction de la voie d'exposition. Les patients présentant une intoxication pulmonaire sont pris en charge par le niveau approprié d'assistance respiratoire (oxygène, intubation, ventilation, pression expiratoire positive et surveillance hémodynamique) et par le traitement de l'œdème pulmonaire, le cas échéant. L'intoxication gastro-intestinale est traitée au mieux par un lavage gastrique, suivi de l'utilisation de cathartiques, tels que le citrate de magnésium. L'administration de charbon suractivé au patient peut être utilisée pour neutraliser la toxine non liée. Il est important de remplacer les pertes de liquide gastro-intestinal par des fluides. Les anticorps anti-ricine peuvent atténuer les dommages causés s'ils sont administrés dès les premiers stades de l'intoxication[63],[64]. Les AINS peuvent être utilisés pour limiter les effets inflammatoires associés à la toxine. En cas d'exposition percutanée, le traitement est avant tout un traitement de soutien.
Prophylaxie[modifier | modifier le code]
Les masques à gaz sont efficaces pour prévenir l'exposition aux aérosols de toxine. Bien qu'aucun vaccin approuvé et commercialisé ne soit actuellement disponible, des vaccins candidats sont en cours de développement. L'USAMRIID (United States Army Medical Research Institute of Infectious Diseases) dispose actuellement d'un vaccin à base de chaîne A (RTA) de la ricine, RVEc™, qui fait l'objet d'essais cliniques. Ce vaccin est bien toléré et immunogène, conférant une protection contre les expositions létales par aérosol chez les animaux[65]. Le second vaccin candidat appelé RiVax est construit à partir d'une autre chaîne RTA recombinante, il a fait l'objet d'un essai clinique de phase 1[64]. (voir la section Développement de contre-mesures)
Développement de contre-mesures[modifier | modifier le code]
Anticorps thérapeutiques[modifier | modifier le code]
Inhibiteurs chimiques[modifier | modifier le code]
Vaccins anti-ricine[modifier | modifier le code]
Dans la fiction[modifier | modifier le code]
Toxicologie[modifier | modifier le code]
La ricine est très toxique si elle est inhalée, injectée ou ingérée. Elle peut également être toxique si la poussière entre en contact avec les yeux ou si elle est absorbée par une peau endommagée. Elle agit comme une toxine en inhibant la synthèse des protéines[28][29] et empêche les cellules d'assembler divers acides aminés en protéines conformément aux messages qu'elles reçoivent de l'ARN messager dans le cadre d'un processus mené par le ribosome de la cellule (la machinerie de fabrication des protéines), c'est-à-dire le niveau le plus élémentaire du métabolisme cellulaire, essentiel à toutes les cellules vivantes et, partant, à la vie elle-même. La ricine résiste à la digestion par les peptidases, mais elle n'y échappe pas. En cas d'ingestion, la pathologie de la ricine est largement limitée au tractus gastro-intestinal, où elle peut provoquer des lésions des muqueuses. Avec un traitement approprié, la plupart des patients se rétablissent bien[30][31].
Symptômes[modifier | modifier le code]
Comme les symptômes sont dus à une incapacité à fabriquer des protéines, ils peuvent prendre de quelques heures à quelques jours pour se manifester, en fonction de la voie d'exposition et de la dose. En cas d'ingestion, les symptômes gastro-intestinaux peuvent se manifester dans les six heures ; ces symptômes ne sont pas toujours apparents. Dans les deux à cinq jours suivant l'exposition à la ricine, ses effets sur le système nerveux central, les glandes surrénales, les reins et le foie apparaissent[29].
L'ingestion de ricine provoque des douleurs, des inflammations et des hémorragies au niveau des muqueuses du système gastro-intestinal. Les symptômes gastro-intestinaux évoluent rapidement vers des nausées sévères, des vomissements, des diarrhées et des difficultés à avaler (dysphagie). L'hémorragie provoque des selles sanguinolentes (méléna) et des vomissements de sang (hématémèse). Le faible volume sanguin (hypovolémie) causé par la perte de liquide gastro-intestinal peut entraîner une défaillance des organes du pancréas, des reins, du foie et du tractus gastro-intestinal et évoluer vers un état de choc. L'état de choc et la défaillance des organes sont indiqués par la désorientation, la stupeur, la faiblesse, la somnolence, une soif excessive (polydipsie), une faible production d'urine (oligurie) et des urines sanglantes (hématurie)[29].
Les symptômes de l'inhalation de ricine sont différents de ceux causés par l'ingestion. Les premiers symptômes comprennent une toux et de la fièvre[29].
En cas d'exposition cutanée ou par inhalation, la ricine peut provoquer une allergie. Cela se traduit par un gonflement (œdème) des yeux et des lèvres, de l'asthme, une irritation des bronches, une gorge sèche et douloureuse, une congestion, une rougeur de la peau (érythème), des cloques cutanées (vésication), une respiration sifflante, des démangeaisons et des larmoiements, une oppression thoracique et une irritation de la peau[29].
Traitement[modifier | modifier le code]
Un antidote a été mis au point par l'armée britannique, bien qu'en 2006 il n'ait pas encore été testé sur l'homme[32][33]. En 2005, un autre antidote mis au point par l'armée américaine s'est avéré sûr et efficace sur des souris de laboratoire auxquelles on avait injecté du sang riche en anticorps mélangé à de la ricine, et a fait l'objet de quelques tests sur l'homme[34]. Des anticorps monoclonaux font l'objet d'une étude scientifique en tant que traitement possible de l'empoisonnement à la ricine[35].
Des traitements symptomatiques et de soutien sont disponibles pour l'empoisonnement à la ricine. Les traitements existants visent à minimiser les effets du poison. Les traitements possibles comprennent l'administration de liquides ou d'électrolytes par voie intraveineuse, la gestion des voies respiratoires, la ventilation assistée ou l'administration de médicaments pour remédier aux crises d'épilepsie et à l'hypotension artérielle. Si la ricine a été ingérée récemment, l'estomac peut être rincé par l'ingestion de charbon actif ou par un lavage gastrique. Les survivants développent souvent des lésions organiques à long terme. La ricine provoque de graves diarrhées et vomissements, et les victimes peuvent mourir d'un choc circulatoire ou d'une défaillance d'organe ; la ricine inhalée peut provoquer un œdème pulmonaire fatal ou une défaillance respiratoire. La mort survient généralement dans les 3 à 5 jours suivant l'exposition[29].
Prévention[modifier | modifier le code]
La vaccination est possible en injectant une forme inactive de la chaîne protéique A[9]. Cette vaccination est efficace pendant plusieurs mois en raison de la production par l'organisme d'anticorps contre la protéine étrangère. En 1978, le transfuge bulgare Vladimir Kostov a survécu à une attaque à la ricine similaire à celle de Georgi Markov, probablement grâce à la production d'anticorps par son corps. Lorsque l'on a retiré du bas de son dos une pastille contenant de la ricine, on a constaté qu'une partie de la couche de cire d'origine y était encore attachée. Pour cette raison, seules de petites quantités de ricine s'étaient échappées de la pastille, provoquant quelques symptômes mais permettant à son corps de développer une immunité contre un nouvel empoisonnement[9].
Sources[modifier | modifier le code]
Les graines de Ricinus communis sont généralement broyées pour en extraire l'huile de ricin[9]. La ricine n'étant pas soluble dans l'huile, on en trouve peu dans l'huile de ricin extraite[9]. L'huile extraite est également chauffée à plus de 80 °C pour dénaturer la ricine éventuellement présente[9]. Les graines broyées restantes, appelées diversement " tourteau ", " tourteau d'huile " et " tourteau de presse ", peuvent contenir jusqu'à 5 % de ricine[36]. [Alors que le tourteau de noix de coco, d'arachides et parfois de graines de coton peut être utilisé comme aliment pour le bétail ou comme engrais, la nature toxique des graines de ricin empêche d'utiliser leur tourteau comme aliment pour le bétail, à moins que la ricine ne soit d'abord désactivée par autoclavage[37]. L'ingestion accidentelle de tourteau de Ricinus communis destiné à l'engrais a été signalée comme étant responsable d'un empoisonnement mortel à la ricine chez les animaux[28][38].
Les décès dus à l'ingestion de graines de ricin sont rares, en partie à cause de leur tégument indigeste et parce qu'une partie de la ricine est désactivée dans l'estomac[5]. La pulpe de huit haricots est considérée comme dangereuse pour un adulte[39]. Rauber et Heard ont écrit qu'un examen attentif des rapports de cas du début du 20e siècle indique que les perceptions publiques et professionnelles de la toxicité de la ricine "ne reflètent pas exactement les capacités de la prise en charge médicale moderne"[40].
La plupart des épisodes d'intoxication aiguë chez l'homme résultent de l'ingestion orale de graines de ricin, dont 5 à 20 peuvent s'avérer mortelles pour un adulte. L'ingestion de graines de ricin s'avère rarement fatale, à moins que la graine ne soit soigneusement mâchée. Le taux de survie à l'ingestion de graines de ricin est de 98 %[9]. En 2013, une femme de 37 ans a survécu aux États-Unis après avoir ingéré 30 graines[41]. Les victimes manifestent souvent des nausées, des diarrhées, une accélération du rythme cardiaque, une hypotension artérielle et des convulsions pouvant durer jusqu'à une semaine[28]. Les concentrations de ricine ou de ricinine dans le sang, le plasma ou l'urine peuvent être mesurées pour confirmer le diagnostic. Les tests de laboratoire font généralement appel à l'immunodosage ou à la chromatographie liquide et à la spectrométrie de masse[42].
Applications thérapeutiques[modifier | modifier le code]
Bien qu'aucune thérapeutique approuvée ne soit actuellement basée sur la ricine, celle-ci pourrait être utilisée dans le traitement des tumeurs, comme une "balle magique" pour détruire les cellules ciblées[14]. La ricine étant une protéine, elle peut être liée à un anticorps monoclonal pour cibler les cellules cancéreuses reconnues par l'anticorps. Le principal problème de la ricine est que ses séquences d'internalisation natives sont réparties dans l'ensemble de la protéine. Si l'une de ces séquences d'internalisation natives est présente dans un agent thérapeutique, le médicament sera internalisé par des cellules non tumorales non ciblées, ainsi que par des cellules cancéreuses ciblées, et les tuera.
La modification de la ricine peut réduire suffisamment la probabilité que le composant ricine de ces immunotoxines soit internalisé par les mauvaises cellules, tout en conservant son activité de destruction cellulaire lorsqu'il est internalisé par les cellules ciblées. Cependant, les toxines bactériennes, telles que la toxine diphtérique, qui est utilisée dans le diftitox de denileukin, un traitement approuvé par la FDA pour la leucémie et le lymphome, se sont avérées plus pratiques. Une approche prometteuse pour la ricine consiste à utiliser la sous-unité B non toxique (une lectine) comme vecteur d'antigènes dans les cellules, ce qui augmente considérablement leur immunogénicité. L'utilisation de la ricine comme adjuvant a des implications potentielles pour le développement de vaccins pour les muqueuses.
Régulation et contrôle[modifier | modifier le code]
Aux États-Unis, la ricine figure sur la liste des agents sélectifs du ministère de la santé et des services sociaux[43], et les scientifiques doivent s'enregistrer auprès du ministère de la santé et des services sociaux pour utiliser la ricine dans leurs recherches. Toutefois, les chercheurs qui contrôlent moins de 1000 mg sont exemptés de la réglementation[44].
Aux États-Unis, la ricine est classée comme une substance extrêmement dangereuse au sens de la section 302 de la loi américaine sur la planification des urgences et le droit à la connaissance des communautés (42 U.S.C. 11002), et les installations qui la produisent, la stockent ou l'utilisent en quantités significatives sont soumises à des exigences strictes en matière de déclaration[45].
Arme de guerre chimique ou biologique[modifier | modifier le code]
Les États-Unis ont étudié le potentiel militaire de la ricine pendant la Première Guerre mondiale[46]. À l'époque, on envisageait de l'utiliser soit comme poussière toxique, soit comme enrobage de balles et d'éclats d'obus. Le concept de nuage de poussière n'a pas pu être développé de manière adéquate, et le concept de balle/éclat d'obus enrobé aurait violé la Convention de La Haye de 1899 (adoptée en droit américain par 32 Stat. 1903), en particulier l'annexe §2, Ch.1, article 23, qui stipule "... il est spécialement défendu... [La Première Guerre mondiale s'est achevée avant que les États-Unis n'utilisent la ricine comme arme.
Pendant la Seconde Guerre mondiale, les États-Unis et le Canada ont entrepris d'étudier la ricine dans les bombes à fragmentation[48] Bien qu'il y ait eu des projets de production de masse et plusieurs essais sur le terrain avec différents concepts de bombes, la conclusion finale a été qu'il n'était pas plus économique d'utiliser la ricine que le phosgène. Cette conclusion était basée sur la comparaison des armes finales, plutôt que sur la toxicité de la ricine (LCt50 ~10 mg/min-m3). La ricine a reçu le symbole militaire W ou plus tard WA. L'intérêt pour la ricine s'est maintenu pendant une courte période après la Seconde Guerre mondiale, mais s'est rapidement estompé lorsque le corps chimique de l'armée américaine a lancé un programme d'armement du sarin[49].
L'Union soviétique possédait également de la ricine militarisée. Le KGB a mis au point des armes à base de ricine qui ont été utilisées en dehors du bloc soviétique, notamment lors de l'assassinat de Markov[50][51].
Malgré l'extrême toxicité de la ricine et son utilité en tant qu'agent de guerre chimique/biologique, il est difficile d'en limiter la production. Le ricin, dont la ricine est dérivée, est une plante ornementale commune qui peut être cultivée à la maison sans aucun soin particulier.
En vertu de la convention sur les armes biologiques de 1972 et de la convention sur les armes chimiques de 1997, la ricine est inscrite au tableau 1 des substances réglementées. Malgré cela, plus d'un million de tonnes métriques (1 100 000 tonnes courtes) de graines de ricin sont traitées chaque année, et environ 5 % du total est transformé en un déchet contenant des concentrations négligeables de toxine de ricin non dénaturée[52].
La ricine est de plusieurs ordres de grandeur moins toxique que la toxine botulique ou tétanique, mais cette dernière est plus difficile à obtenir. Comparée à la botuline ou à l'anthrax en tant qu'armes biologiques ou chimiques, la quantité de ricine nécessaire pour atteindre la DL50 dans une zone géographique étendue est nettement supérieure à celle d'un agent tel que l'anthrax (des tonnes de ricine contre seulement des kilogrammes d'anthrax)[53]. La ricine est facile à produire, mais n'est pas aussi pratique ou susceptible de faire autant de victimes que d'autres agents[30]. La ricine est facilement dénaturée par des températures supérieures à 80 °C, ce qui signifie que de nombreuses méthodes de déploiement de la ricine produiraient suffisamment de chaleur pour la dénaturer[36]. Une fois déployée, une zone contaminée par la ricine reste dangereuse jusqu'à ce que les liaisons entre les chaînes A ou B soient rompues, un processus qui prend deux ou trois jours[9]. En revanche, les spores d'anthrax peuvent rester mortelles pendant des décennies. Jan van Aken, expert allemand en armes biologiques, a expliqué dans un rapport pour The Sunshine Project que les expériences d'Al-Qaïda avec la ricine suggèrent leur incapacité à produire du botulinum ou de l'anthrax[54].
Antidotes et vaccins[modifier | modifier le code]
Les premières molécules protégeant contre la ricine ont été découvertes récemment (2010) par des équipes françaises. Elles ont identifié deux composés chimiques capables de bloquer de manière sélective le transport de la toxine vers les cellules humaines, après l'analyse de 16 500 composés. À la suite de l'injection d'une dose létale de ricine à des souris, elles ont pu remarquer qu'une de ces molécules leur a permis de survivre. Ces travaux ouvrent ainsi la voie à la mise au point d'un antidote[66].
Protection préventive[modifier | modifier le code]
On dispose maintenant d'une molécule active préventivement, si ingérée avant l'exposition.
En 2010, une équipe[67] a annoncé[68],[69] avoir découvert une molécule dite Rétro-2, qui — in vivo — protège, préventivement, des souris contre la toxine issue de la ricine. Cette molécule semble également protéger de toxines produites par le choléra ou par la bactérie Shigella, cause de dysenteries (shigellose)[68]. Ces chercheurs avaient antérieurement identifié une autre molécule (dite Rétro-1), mais qui ne semble active que in vitro contre la toxicité de la ricine[68]. Le mécanisme de protection est l'inhibition de l'entrée de la toxine dans les cellules cibles, entre les endosomes précoces et l'appareil de Golgi. Les souris exposées à un empoisonnement à la ricine par voie nasale ont toutes survécu (contre 15 % pour le groupe témoin).
Une société biopharmaceutique appelée Soligenix, Inc. a obtenu une licence pour un vaccin anti-ricine appelé RiVax de Vitetta et al. à UT Southwestern. Le vaccin s'est avéré sûr et immunogène chez la souris, le lapin et l'homme. Deux essais cliniques ont été réalisés avec succès[55]. Soligenix a obtenu un brevet américain pour Rivax. Le candidat vaccin contre la ricine a obtenu le statut de médicament orphelin aux États-Unis et dans la CEE et, en 2019, il faisait l'objet d'essais cliniques aux États-Unis. Des subventions de l'Institut national des allergies et des maladies infectieuses et de la Food and Drug Administration des États-Unis ont soutenu le développement du vaccin candidat[56].
Risque criminel[modifier | modifier le code]
La ricine a été impliquée dans un certain nombre d'attaques réelles ou planifiées contre des individus. En 1978, le dissident bulgare Georgi Markov a été assassiné par la police secrète bulgare qui l'a abattu subrepticement dans une rue de Londres avec ce qui s'est avéré plus tard être un parapluie modifié utilisant du gaz comprimé pour tirer une minuscule boulette contenant de la ricine dans sa jambe[30][60]. Il est décédé à l'hôpital quelques jours plus tard ; son corps a été remis à une branche spéciale de poison du ministère britannique de la Défense qui a découvert la boulette au cours d'une autopsie. Les principaux suspects sont la police secrète bulgare : Georgi Markov avait quitté la Bulgarie quelques années auparavant et avait par la suite écrit des livres et fait des émissions de radio très critiques à l'égard du régime communiste bulgare. Cependant, on pensait à l'époque que la Bulgarie n'aurait pas été en mesure de produire la pastille, et on pensait également que le KGB l'avait fournie. Le KGB a nié toute implication, bien que des transfuges célèbres du KGB, Oleg Kalugin et Oleg Gordievsky, aient par la suite confirmé l'implication du KGB. Le dissident soviétique Alexandre Soljenitsyne a présenté des symptômes semblables à ceux de la ricine (mais y a survécu) après une rencontre en 1971 avec des agents du KGB[61].
Dix jours avant l'agression de Georgi Markov, un autre transfuge bulgare, Vladimir Kostov, a survécu à une agression similaire. Kostov se trouvait sur un escalier roulant du métro parisien lorsqu'il a senti une piqûre dans le bas du dos, au-dessus de la ceinture de son pantalon. Il a eu de la fièvre, mais s'est rétabli. Après la mort de Markov, la blessure au dos de Kostov a été examinée et une pastille de ricine identique à celle utilisée contre Markov a été retirée[9].
Plusieurs individus et groupes terroristes ont expérimenté la ricine ou envisagé de l'utiliser[62]. Il y a eu des incidents au cours desquels le poison a été envoyé par la poste à des hommes politiques américains. Par exemple, le 29 mai 2013, deux lettres anonymes envoyées au maire de New York, Michael Bloomberg, contenaient des traces de ricine[63]. Une autre lettre a été envoyée aux bureaux de Mayors Against Illegal Guns à Washington, D.C. Une lettre contenant de la ricine aurait également été envoyée au président américain Barack Obama à la même époque. Shannon Richardson, une actrice, a ensuite été accusée du crime et a plaidé coupable en décembre[64] ; elle a été condamnée à 18 ans de prison et à une amende de restitution de 367 000 USD[65]. [Le 2 octobre 2018, deux lettres suspectées de contenir de la ricine ont été envoyées au Pentagone, l'une adressée au secrétaire à la Défense James Mattis et l'autre au chef des opérations navales, l'amiral John Richardson[66]. Le 23 juillet 2019, la prison d'État de Pelican Bay, en Californie, a reçu une lettre dans laquelle il était indiqué qu'elle contenait une substance suspecte. Les autorités ont confirmé par la suite qu'elle contenait de la ricine ; aucun effet préjudiciable n'a été constaté.
En 2020, certains médias de la République tchèque ont rapporté, sur la base d'informations des services de renseignement, qu'une personne munie d'un passeport diplomatique russe et de ricine était arrivée à Prague avec l'intention d'assassiner trois hommes politiques. Le président russe Vladimir Poutine a démenti ces informations. Les cibles auraient été Zdeněk Hřib, le maire de Prague (capitale de la République tchèque), qui était impliqué dans le changement de nom d'une place de Prague, "Pod Kaštany", où se trouve l'ambassade de Russie, en place de Boris Nemtsov, un homme politique de l'opposition assassiné au Kremlin en 2015 ; Ondřej Kolář, le maire du district municipal de Prague 6, qui a participé au retrait de la statue controversée du maréchal Konev de l'ère soviétique ; et Pavel Novotný, le maire du district de Řeporyje, au sud-ouest de Prague. Ils ont tous bénéficié d'une protection policière[68][69] Le président tchèque Miloš Zeman a par la suite décrit la protection policière de Zdeněk Hřib comme une tentative d'un politicien insignifiant d'attirer l'attention. Zeman a également confondu la ricine avec l'huile de ricin, un laxatif non toxique[70].
En 2018[71] et 2023, la police allemande a déjoué des tentatives d'attentats à la ricine perpétrés par des personnes soutenant l'organisation terroriste islamiste Daesh (qui se fait également appeler État islamique, EI), après avoir reçu des informations qui proviendraient du FBI américain[72].
Dans la fiction[modifier | modifier le code]
Dans son roman La Vengeance du Kremlin (2013), l'écrivain Gérard de Villiers met en scène une équipe de tueurs qui tentent d'assassiner Malko Linge en le piquant à l'aide d'un dard empoisonné à la ricine. Un autre produit chimique létal est employé dans le roman pour assassiner avec succès Boris Berezovsky, le fluorure de sodium.
Dans la série télévisée Breaking Bad, la ricine est un élément central de l'intrigue du début de la saison 2 et des saisons 3, 4 et 5[70].
La popularité de Breaking Bad a inspiré plusieurs affaires criminelles réelles impliquant de la ricine ou des substances similaires. À Londres, une femme tente d'empoisonner sa mère avec de l'abrine après que cette dernière ait interféré avec ses projets de mariage[71]. En Angleterre, un homme de Liverpool est condamné après avoir tenté d'acheter 500 mg de ricine sur le dark web auprès d'un agent du FBI sous couverture. Il est condamné en 2015 à huit ans d'emprisonnement[72].
Dans le roman Le crime est notre affaire d'Agatha Christie, la ricine est utilisée comme élément de l'intrigue.
Dans la dernière saison de Walker, Texas Ranger, la ricine est utilisée par Emil Lavocat pour assassiner le meilleur ami et ancien partenaire du Texas Ranger titulaire, C.D. Parker, afin de se venger d'eux et de tous les Rangers de leur compagnie pour son emprisonnement. Bien que le meurtre ait été maquillé en crise cardiaque vers la fin de "The Avenging Angel", la vérité sur la mort de C.D. est révélée dans le final, "The Final Show/Down", lorsque Walker et Trivette font exhumer et autopsier le corps de C.D. Parker.
Dans le film The Good Mother (2013), une mère injecte de la ricine à ses filles et les nourrit dans un cas de syndrome de Münchhausen par procuration ; elle est arrêtée après la mort d'une de ses filles.
Dans le film The Interview (2014), un timbre transdermique contenant de la ricine est utilisé dans le cadre d'un complot de la CIA visant à assassiner le dictateur nord-coréen Kim Jong-un par une poignée de main.
Notes et références[modifier | modifier le code]
- (en) Earl Rutenber, Betsy J. Katzin, Stephen Ernst, Edward J. Collins, Debra Mlsna, Michael P. Ready et Jon D. Robertus, « Crystallographic refinement of ricin to 2.5 Å », Proteins, vol. 10, no 3, , p. 240-250 (PMID 1881880, DOI 10.1002/prot.340100308, lire en ligne).
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- Olsnes et Pihl 1982.
- Bradberry 2003.
- Audi 2005.
- Maillard et LeClaire 2008.
- (en) Centers for Disease Control and Prevention, « Bioterrorism Agents/Diseases »
 , sur Emergency Preparedness and Response (consulté le )
, sur Emergency Preparedness and Response (consulté le )
- (en) Federal Select Agent Program, « Select Agents and Toxins List »
 , sur Federal Select Agent Program (consulté le )
, sur Federal Select Agent Program (consulté le )
- Organisation pour l'interdiction des armes chimiques, « Convention sur l'Interdiction de la Mise au Point, de la Fabrication, du Stockage et de l'Emploi des Armes Chimiques et sur leur Destruction »
 [PDF], sur Organisation pour l'interdiction des armes chimiques (consulté le )
[PDF], sur Organisation pour l'interdiction des armes chimiques (consulté le )
- Gupta et Salem 2020.
- Olsnes 2004.
- Stirpe et Lappi 2014.
- (en) H. Tonie Wright et Jon D. Robertus, « The intersubunit disulfide bridge of ricin is essential for cytotoxicity », Archives of Biochemistry and Biophysics, vol. 256, no 1, , p. 280–284 (DOI 10.1016/0003-9861(87)90447-4, lire en ligne, consulté le )
- « P02879 Ricin precursor – Ricinus communis (Castor bean) », UniProtKB, UniProt Consortium
- (en) Sjur Olsnes et Alexander Pihl, « Different biological properties of the two constituent peptide chains of ricin a toxic protein inhibiting protein synthesis », Biochemistry, vol. 12, no 16, , p. 3121–3126 (ISSN 0006-2960 et 1520-4995, DOI 10.1021/bi00740a028, lire en ligne, consulté le )
- (en) Simon A. Weston, Alec D. Tucker, David R. Thatcher et Dean J. Derbyshire, « X-ray Structure of Recombinant Ricin A-Chain at 1.8 Å Resolution », Journal of Molecular Biology, vol. 244, no 4, , p. 410–422 (DOI 10.1006/jmbi.1994.1739, lire en ligne, consulté le )
- (en) R. Wales, P.T. Richardson, L.M. Roberts et H.R. Woodland, « Mutational analysis of the galactose binding ability of recombinant ricin B chain. », Journal of Biological Chemistry, vol. 266, no 29, , p. 19172–19179 (DOI 10.1016/S0021-9258(18)54978-4, lire en ligne, consulté le )
- (en) Sigurdur Magnusson, Rune Kjeken et Trond Berg, « Characterization of Two Distinct Pathways of Endocytosis of Ricin by Rat Liver Endothelial Cells », Experimental Cell Research, vol. 205, no 1, , p. 118–125 (DOI 10.1006/excr.1993.1065, lire en ligne, consulté le )
- (en) Nathalie Sphyris, J. Michael Lord, Richard Wales et Lynne M. Roberts, « Mutational Analysis of the Ricinus Lectin B-chains », Journal of Biological Chemistry, vol. 270, no 35, , p. 20292–20297 (DOI 10.1074/jbc.270.35.20292, lire en ligne, consulté le )
- (en) M Moya, A Dautry-Varsat, B Goud et D Louvard, « Inhibition of coated pit formation in Hep2 cells blocks the cytotoxicity of diphtheria toxin but not that of ricin toxin. », The Journal of cell biology, vol. 101, no 2, , p. 548–559 (ISSN 0021-9525 et 1540-8140, PMID 2862151, PMCID PMC2113662, DOI 10.1083/jcb.101.2.548, lire en ligne, consulté le )
- (en) Benjamin J Nichols et Jennifer Lippincott-Schwartz, « Endocytosis without clathrin coats », Trends in Cell Biology, vol. 11, no 10, , p. 406–412 (DOI 10.1016/S0962-8924(01)02107-9, lire en ligne, consulté le )
- (en) Michael J Lord, Nicholas A Jolliffe, Catherine J Marsden et Cassandra S C Pateman, « Ricin: Mechanisms of Cytotoxicity », Toxicological Reviews, vol. 22, no 1, , p. 53–64 (ISSN 1176-2551, DOI 10.2165/00139709-200322010-00006, lire en ligne, consulté le )
- (en) Robert A Spooner, Daniel C Smith, Andrew J Easton et Lynne M Roberts, « Retrograde transport pathways utilised by viruses and protein toxins », Virology Journal, vol. 3, no 1, (ISSN 1743-422X, PMID 16603059, PMCID PMC1524934, DOI 10.1186/1743-422X-3-26, lire en ligne, consulté le )
- (en) Robert A. Spooner, Peter D. Watson, Catherine J. Marsden et Daniel C. Smith, « Protein disulphide-isomerase reduces ricin to its A and B chains in the endoplasmic reticulum », Biochemical Journal, vol. 383, no 2, , p. 285–293 (ISSN 0264-6021 et 1470-8728, PMID 15225124, PMCID PMC1134069, DOI 10.1042/BJ20040742, lire en ligne, consulté le )
- (en) Giuseppe Bellisola, Giulio Fracasso, Rodolfo Ippoliti et Gianfranco Menestrina, « Reductive activation of ricin and ricin A-chain immunotoxins by protein disulfide isomerase and thioredoxin reductase », Biochemical Pharmacology, vol. 67, no 9, , p. 1721–1731 (DOI 10.1016/j.bcp.2004.01.013, lire en ligne, consulté le )
- (en) Peter U. Mayerhofer, Jonathan P. Cook, Judit Wahlman et Teresa T.J. Pinheiro, « Ricin A Chain Insertion into Endoplasmic Reticulum Membranes Is Triggered by a Temperature Increase to 37 °C », Journal of Biological Chemistry, vol. 284, no 15, , p. 10232–10242 (PMID 19211561, PMCID PMC2665077, DOI 10.1074/jbc.M808387200, lire en ligne, consulté le )
- (en) Robert A. Spooner, Philip J. Hart, Jonathan P. Cook et Paola Pietroni, « Cytosolic chaperones influence the fate of a toxin dislocated from the endoplasmic reticulum », Proceedings of the National Academy of Sciences, vol. 105, no 45, , p. 17408–17413 (ISSN 0027-8424 et 1091-6490, PMID 18988734, PMCID PMC2580750, DOI 10.1073/pnas.0809013105, lire en ligne, consulté le )
- (en) Monika Slominska-Wojewodzka, Tone F. Gregers, Sébastien Wälchli et Kirsten Sandvig, « EDEM Is Involved in Retrotranslocation of Ricin from the Endoplasmic Reticulum to the Cytosol », Molecular Biology of the Cell, vol. 17, no 4, , p. 1664–1675 (ISSN 1059-1524 et 1939-4586, PMID 16452630, PMCID PMC1415288, DOI 10.1091/mbc.e05-10-0961, lire en ligne, consulté le )
- (en) Tone Gregers, Sigrid Skånland, Sébastien Wälchli et Oddmund Bakke, « BiP Negatively Affects Ricin Transport », Toxins, vol. 5, no 5, , p. 969–982 (ISSN 2072-6651, PMID 23666197, PMCID PMC3709273, DOI 10.3390/toxins5050969, lire en ligne, consulté le )
- (en) Shuyu Li, Robert A. Spooner, Stuart C. H. Allen et Christopher P. Guise, « Folding-competent and Folding-defective Forms of Ricin A Chain Have Different Fates after Retrotranslocation from the Endoplasmic Reticulum », Molecular Biology of the Cell, vol. 21, no 15, , p. 2543–2554 (ISSN 1059-1524 et 1939-4586, PMID 20519439, PMCID PMC2912342, DOI 10.1091/mbc.e09-08-0743, lire en ligne, consulté le )
- (en) Emma D. Deeks, Jonathan P. Cook, Philip J. Day et Daniel C. Smith, « The Low Lysine Content of Ricin A Chain Reduces the Risk of Proteolytic Degradation after Translocation from the Endoplasmic Reticulum to the Cytosol », Biochemistry, vol. 41, no 10, , p. 3405–3413 (ISSN 0006-2960 et 1520-4995, DOI 10.1021/bi011580v, lire en ligne, consulté le )
- (en) Robert A. Spooner, Philip J. Hart, Jonathan P. Cook et Paola Pietroni, « Cytosolic chaperones influence the fate of a toxin dislocated from the endoplasmic reticulum », Proceedings of the National Academy of Sciences, vol. 105, no 45, , p. 17408–17413 (ISSN 0027-8424 et 1091-6490, PMID 18988734, PMCID PMC2580750, DOI 10.1073/pnas.0809013105, lire en ligne, consulté le )
- (en) Paola Pietroni, Nishi Vasisht, Jonathan P. Cook et David M. Roberts, « The proteasome cap RPT5/Rpt5p subunit prevents aggregation of unfolded ricin A chain », Biochemical Journal, vol. 453, no 3, , p. 435–445 (ISSN 0264-6021 et 1470-8728, PMID 23617410, PMCID PMC3778710, DOI 10.1042/BJ20130133, lire en ligne, consulté le )
- (en) Y Endo et K Tsurugi, « RNA N-glycosidase activity of ricin A-chain. Mechanism of action of the toxic lectin ricin on eukaryotic ribosomes. », Journal of Biological Chemistry, vol. 262, no 17, , p. 8128–8130 (DOI 10.1016/S0021-9258(18)47538-2, lire en ligne, consulté le )
- (en) Y Endo et K Tsurugi, « The RNA N-glycosidase activity of ricin A-chain. The characteristics of the enzymatic activity of ricin A-chain with ribosomes and with rRNA. », Journal of Biological Chemistry, vol. 263, no 18, , p. 8735–8739 (DOI 10.1016/S0021-9258(18)68367-X, lire en ligne, consulté le )
- (en) Simonetta Sperti, Lucio Montanaro, Alessandro Mattioli et Fiorenzo Stirpe, « Inhibition by ricin of protein synthesis in vitro : 60S ribosomal subunit as the target of the toxin ( Short Communication ) », Biochemical Journal, vol. 136, no 3, , p. 813–815 (ISSN 0306-3283, PMID 4360718, PMCID PMC1166019, DOI 10.1042/bj1360813, lire en ligne, consulté le )
- (en) Michael J Lord, Nicholas A Jolliffe, Catherine J Marsden et Cassandra S C Pateman, « Ricin: Mechanisms of Cytotoxicity », Toxicological Reviews, vol. 22, no 1, , p. 53–64 (ISSN 1176-2551, DOI 10.2165/00139709-200322010-00006, lire en ligne, consulté le )
- (en) Simon A. Weston, Alec D. Tucker, David R. Thatcher et Dean J. Derbyshire, « X-ray Structure of Recombinant Ricin A-Chain at 1.8 Å Resolution », Journal of Molecular Biology, vol. 244, no 4, , p. 410–422 (DOI 10.1006/jmbi.1994.1739, lire en ligne, consulté le )
- Stirpe et Lappi 2014, p. 4-5.
- Millard et LeClaire 2008, p. 446.
- Millard et LeClaire 2008.
- Worbs 2011.
- Balint 1974.
- Kathryn R Challoner et Margaret M McCarron, « Castor bean intoxication », Annals of Emergency Medicine, vol. 19, no 10, , p. 1177–1183 (ISSN 0196-0644, DOI 10.1016/s0196-0644(05)81525-2, lire en ligne, consulté le )
- A. Rauber et J. Heard, « Castor bean toxicity re-examined: a new perspective », Veterinary and Human Toxicology, vol. 27, no 6, , p. 498–502 (ISSN 0145-6296, PMID 4082461, lire en ligne, consulté le )
- (en) J. Kopferschmitt, F. Flesch, A. Lugnier et Ph. Sauder, « Acute Voluntary Intoxication by Ricin », Human Toxicology, vol. 2, no 2, , p. 239–242 (ISSN 0144-5952, DOI 10.1177/096032718300200211, lire en ligne, consulté le )
- (en) Aslak Godal, Øystein Fodstad, Kristian Ingebrigtsen et Alexander Pihl, « Pharmacological studies of ricin in mice and humans », Cancer Chemotherapy and Pharmacology, vol. 13, no 3, , p. 157–163 (ISSN 1432-0843, DOI 10.1007/BF00269021, lire en ligne, consulté le )
- (en) Ø Fodstad, S. Olsnes et A. Pihl, « Toxicity, distribution and elimination of the cancerostatic lectins abrin and ricin after parenteral injection into mice », British Journal of Cancer, vol. 34, no 4, , p. 418–425 (ISSN 1532-1827, PMID 974006, PMCID PMC2025264, DOI 10.1038/bjc.1976.187, lire en ligne, consulté le )
- (en) ø. Fodstad, J. V. Johannessen, L. Schjerven et A. Pihl, « Toxicity of abrin and ricin in mice and dogs », Journal of Toxicology and Environmental Health, vol. 5, no 6, , p. 1073–1084 (ISSN 0098-4108, DOI 10.1080/15287397909529815, lire en ligne, consulté le )
- Henderson 2016.
- (en) Gareth D. Griffiths, Paul Rice, Anthony C. Allenby et Stephen C. Bailey, « Inhalation Toxicology and Histopathology of Ricin and Abrin Toxins », Inhalation Toxicology, vol. 7, no 2, , p. 269–288 (ISSN 0895-8378 et 1091-7691, DOI 10.3109/08958379509029098, lire en ligne, consulté le )
- (en) Chad J. Roy, Martha Hale, Justin M. Hartings et Louise Pitt, « Impact of Inhalation Exposure Modality and Particle Size on the Respiratory Deposition of Ricin in BALB/c Mice », Inhalation Toxicology, vol. 15, no 6, , p. 619–638 (ISSN 0895-8378 et 1091-7691, DOI 10.1080/08958370390205092, lire en ligne, consulté le )
- (en) C. L. Wilhelmsen et M. L. M. Pitt, « Lesions of Acute Inhaled Lethal Ricin Intoxication in Rhesus Monkeys », Veterinary Pathology, vol. 33, no 3, , p. 296–302 (ISSN 0300-9858 et 1544-2217, DOI 10.1177/030098589603300306, lire en ligne, consulté le )
- (en) R. F. R. Brown et D. E. White, « Ultrastructure of rat lung following inhalation of ricin aerosol », International Journal of Experimental Pathology, vol. 78, no 4, , p. 267–276 (ISSN 0959-9673 et 1365-2613, PMID 9505938, PMCID PMC2694539, DOI 10.1046/j.1365-2613.1997.300363.x, lire en ligne, consulté le )
- Gareth D. Griffiths, Chrostopher D. Lindsay et David G. Upshall, « Examination of the toxicity of several protein toxins of plant origin using bovine pulmonary endothelial cells », Toxicology, vol. 90, no 1, , p. 11–27 (ISSN 0300-483X, DOI 10.1016/0300-483X(94)90201-1, lire en ligne, consulté le )
- Jeffrey A. Doebler, Norman D. Wiltshire, Thomas W. Mayer et James E. Estep, « The distribution of [125I]ricin in mice following aerosol inhalation exposure », Toxicology, vol. 98, no 1, , p. 137–149 (ISSN 0300-483X, DOI 10.1016/0300-483X(94)02978-4, lire en ligne, consulté le )
- USAMRIID 2020.
- Roxas-Duncan 2018.
- (en) Frank Musshoff et Burkhard Madea, « Ricin poisoning and forensic toxicology », Drug Testing and Analysis, vol. 1, no 4, , p. 184–191 (ISSN 1942-7603 et 1942-7611, DOI 10.1002/dta.27, lire en ligne, consulté le )
- Hans Bigalke et Andreas Rummel, « Medical aspects of toxin weapons », Toxicology, the Toxicologist and the Response to Incidents with Chemical and Biological Warfare Agents, vol. 214, no 3, , p. 210–220 (ISSN 0300-483X, DOI 10.1016/j.tox.2005.06.015, lire en ligne, consulté le )
- C. S. Ramsden, M. T. Drayson et E. B. Bell, « The toxicity, distribution and excretion of ricin holotoxin in rats », Toxicology, vol. 55, no 1, , p. 161–171 (ISSN 0300-483X, DOI 10.1016/0300-483X(89)90183-2, lire en ligne, consulté le )
- (en) Xiaohua He, Stephanie McMahon, Thomas D. Henderson Ii et Stephen M. Griffey, « Ricin Toxicokinetics and Its Sensitive Detection in Mouse Sera or Feces Using Immuno-PCR », PLOS ONE, vol. 5, no 9, , e12858 (ISSN 1932-6203, PMID 20877567, PMCID PMC2943921, DOI 10.1371/journal.pone.0012858, lire en ligne, consulté le )
- (en) Gareth D. Griffiths, « Understanding Ricin from a Defensive Viewpoint », Toxins, vol. 3, no 11, , p. 1373–1392 (ISSN 2072-6651, PMID 22174975, PMCID PMC3237001, DOI 10.3390/toxins3111373, lire en ligne, consulté le )
- Rasetti-Escargueil et Avril 2023.
- Marsden 2005.
- Inhibition of retrograde transport protects mice from lethal ricin challenge
- équipe associant le CEA, l'Institut Curie, le CNRS, l'Afssaps et l'Université de Montpellier, dans le cadre du programme interministériel de R&D NRBC-E (nucléaire, radiologique, biologique, chimique et explosifs) confié au CEA en 2005 par le SGDSN ; résultats publiés en ligne par la revue Cell
- Communiqué CNRS no 1860, intitulé « Découverte de molécules pour se protéger de la ricine, arme du bioterrorisme » 2010/04/16
- B. Stechmann, SK Bai, E. Gobbo, R. Lopez, G. Merer, S. Pinchard, L. Panigai, D. Tenza, G. Raposo, B. Beaumelle, D. Sauvaire, D. Gillet, L. Johannes, J. Barbier. ; Inhibition of retrograde transport protects mice from lethal ricin challenge. Cell, online, (résumé + illustration), 2010
- « Things You Should Know About Ricin Before Watching the 'Breaking Bad' Finale » [archive du ], sur National Geographic, National Geographic Society, (consulté le )
- (en) « Woman tried to poison mother in plot inspired by Breaking Bad, court told », The Guardian, London, (lire en ligne)
- (en) « Breaking Bad fan guilty of Dark Web ricin plot », BBC News, (lire en ligne)
Annexes[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- [Olsnes 2004] (en) Sjur Olsnes, « The history of ricin, abrin and related toxins », Toxicon, vol. 44, no 4, , p. 361-370 (PMID 15302520, DOI 10.1016/j.toxicon.2004.05.003
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Polito et al. 2019] (en) Letizia Polito et al., « Ricin: An Ancient Story for a Timeless Plant Toxin », Toxins, vol. 11, no 6, (PMID 36828415, PMCID PMC9966136, DOI 10.3390/toxins15020100
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Balint 1974] (en) G.A. Balint, « Ricin: the toxic protein of castor oil seeds », Toxicology, vol. 2, no 1, , p. 77-102 (ISSN 1879-3185, PMID 4823740, DOI 10.1016/0300-483X(74)90044-4
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Olsnes et Pihl 1982] (en) Sjur Olsnes et Alexander Pihl, « Chapter 3 - Toxic lectins and related proteins », dans Philip Cohen et Simon van Heyningen (eds.), Molecular Action of Toxins and Viruses, Elsevier Biomedical Press, coll. « Molecular Aspects of Cellular Regulation » (no 2), (ISBN 0-444-80400-5, DOI 10.1016/B978-0-444-80400-6.50008-3
 , lire en ligne [PDF]), p. 51–105.
, lire en ligne [PDF]), p. 51–105. 
- [Sharon et Lis 2007] (en) Nathan Sharon et Halina Lis, Lectins, Springer Dordrecht, (ISBN 978-1-4020-6953-6, DOI 10.1007/978-1-4020-6953-6
 , lire en ligne [PDF]).
, lire en ligne [PDF]). 
- [Stirpe et Lappi 2014] (en) Fiorenzo Stirpe et Douglas A. Lappi, Ribosome-inactivating Proteins : Ricin and Related Proteins, John Wiley & Sons, (ISBN 978-1-118-12565-6, lire en ligne).

- [Mantis 2012] (en) Nicholas J. Mantis, Ricin and Shiga Toxins : Pathogenesis, Immunity, Vaccines and Therapeutics, vol. 357, Springer Berlin, Heidelberg, coll. « Current Topics in Microbiology and Immunology », (ISBN 978-3-642-27470-1, ISSN 2196-9965, DOI 10.1007/978-3-642-27470-1
 , lire en ligne).
, lire en ligne). 
- [Nielsen et Boston 2001] (en) Kirsten Nielsen et Rebecca S. Boston, « RIBOSOME-INACTIVATING PROTEINS: A Plant Perspective », Annual Review of Plant Physiology and Plant Molecular Biology, vol. 52, , p. 785-816 (PMID 11337416, DOI 10.1146/annurev.arplant.52.1.785
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Millard et LeClaire 2008] (en) Charles B. Millard et Ross D. LeClaire, « Ricin and Related Toxins: Review and Perspective », dans Brian J. Lukey, James A. Romano Jr., James A. Romano, Harry Salem, Brian J Lukey et Harry Salem (eds.), Chemical warfare agents : Chemistry, Pharmacology, Toxicology, and Therapeutics, CRC Press, , 2e éd. (ISBN 978-1-4200-4661-8, DOI 10.1201/9781420046625), p. 423–467.

- [Gupta et Salem 2020] (en) Ramesh C. Gupta et Harry Salem, « Chapter 28 - Ricin », dans Ramesh C. Gupta (ed.), Handbook of Toxicology of Chemical Warfare Agents, Academic Press, , 3e éd. (ISBN 978-0-12-819090-6, DOI 10.1016/B978-0-12-819090-6.00028-3
 , lire en ligne [PDF]), p. 413–426.
, lire en ligne [PDF]), p. 413–426. 
- [Henderson et al. 2016] (en) Terry J. Henderson et al., « The Structural Biology and Biochemistry of the Ricin Toxin and the Military Use and Inhalation Toxicology of Ricin Aerosols », dans Harry Salem et Sidney Katz (eds.), Aerobiology: The Toxicology of Airborne Pathogens and Toxins, Royal Society of Chemistry, coll. « Issues in Toxicology » (no 25), (ISBN 978-1-84973-594-0, DOI 10.1039/9781849737913
 , lire en ligne), p. 186–218.
, lire en ligne), p. 186–218. 
- [Bradberry et al. 2003] (en) Sally M. Bradberry et al., « Ricin Poisoning », Toxicological Reviews, vol. 22, no 1, , p. 65-70 (PMID 14579548, DOI 10.2165/00139709-200322010-00007
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Worbs et al. 2011] (en) Syvia Worbs et al., « Ricinus communis Intoxications in Human and Veterinary Medicine — A Summary of Real Cases », Toxins, vol. 3, no 10, , p. 1332-1372 (PMID 22069699, PMCID PMC3210461, DOI 10.3390/toxins3101332
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Audi et al. 2005] (en) Jennifer Audi et al., « Ricin poisoning: a comprehensive review », JAMA, vol. 294, no 18, , p. 2342-2351 (PMID 16278363, DOI 10.1001/jama.294.18.2342
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Roxas-Duncan et al. 2018] (en) Virginia I. Roxas-Duncan et al., « Ricin », dans Medical Aspects of Biological Warfare, Fort Sam Houston, Texas, Office of The Surgeon General, Borden Institute, US Army Medical Department Center and School Health Readiness Center of Excellence, coll. « Textbooks of Military Medicine », , 2e éd. (ISBN 978-0-16-094159-7, lire en ligne [PDF]), p. 373–401.

- [USAMRIID 2020] (en) USAMRIID, « Ricin », dans USAMRIID’s Medical Management of Biological Casualties Handbook, Fort Detrick, Frederick, Maryland, United States Government Publishing Office, , 9e éd. (ISBN 978-0-16-095526-6, lire en ligne [PDF]), p. 113–117.

- [Roxas-Duncan et Smith 2012] (en) Virginia I. Roxas-Duncan et Leonard A. Smith, « Ricin Perspective in Bioterrorism », dans Virginia I. Roxas-Duncan et Leonard A. Smith (eds.), Bioterrorism, InTech, (ISBN 978-953-51-0205-2, DOI 10.5772/33392
 , lire en ligne [PDF]), p. 133–156.
, lire en ligne [PDF]), p. 133–156. 
- [Schep et al. 2009] (en) Leo J. Schep et al., « Ricin as a weapon of mass terror — Separating fact from fiction », Environment International, vol. 35, no 8, , p. 1267-1271 (PMID 19767104, DOI 10.1016/j.envint.2009.08.004
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Bozza et al. 2014] (en) William P. Bozza et al., « Ricin detection: Tracking active toxin », Biotechnology Advances, vol. 33, no 1, , p. 117-123 (PMID 25481398, DOI 10.1016/j.biotechadv.2014.11.012
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Foster et al. 2020] (en) Jeffrey T. Foster et al., « Chapter 16 - Ricin forensics: comparisons to microbial forensics », dans Bruce Budowle, Steven Schutzer et Stephen Morse (eds.), Microbial Forensics, Academic Press, , 3e éd. (ISBN 978-0-12-815379-6, DOI 10.1016/B978-0-12-815379-6.00016-7
 , lire en ligne [PDF]), p. 241–250.
, lire en ligne [PDF]), p. 241–250. 
- [Marsden et al. 2005] (en) Catherine J. Marsden et al., « Ricin: current understanding and prospects for an antiricin vaccine », Expert Review of Vaccines, vol. 4, no 2, , p. 229-237 (PMID 15889996, DOI 10.1586/14760584.4.2.229
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Reisler et Smith 2012] (en) Ronald B. Reisler et Leonard A. Smith, « The Need for Continued Development of Ricin Countermeasures », Advances in Preventive Medicine, vol. 2012, (PMID 22536516, PMCID 149737, DOI 10.1155/2012/149737
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
- [Rasetti-Escargueil et Avril 2023] (en) Christine Rasetti-Escargueil et Arnaud Avril, « Medical Countermeasures against Ricin Intoxication », Toxins, vol. 15, no 2, (PMID 36828415, PMCID PMC9966136, DOI 10.3390/toxins15020100
 , lire en ligne [PDF], consulté le ).
, lire en ligne [PDF], consulté le ). 
Articles connexes[modifier | modifier le code]
- Ricin commun
- Phytotoxine
- Toxalbumine
- Protéine inactivatrice de ribosome (Ribosome-inactivating protein, RIP)
- Lectine
- Abrine
- Arme biologique
- Bioterrorisme
- Convention sur l'interdiction des armes chimiques
Liens externes[modifier | modifier le code]
- [vidéo] Un poison à portée de main : la ricine | L'Histoire nous le dira # 205
- [vidéo] (en) Ricin: The Perfect Poison
Portail/biochimie/biologiecellulaire et moléculaire/médecine/botanique
CatégorieRicine CatégorieRicin commun CatégorieProtéine CatégoriePhytotoxine CatégorieLectine CatégorieProtéine inactivatrice de ribosome CatégorieArme biologique CatégorieSubstance inscrite au tableau 1 de l'OIAC
