Oxyde d'étain(II)
| Oxyde d'étain(II) | |
| |
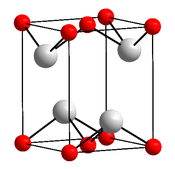
| __ Sn2+ __ O2− Structure cristalline de l'oxyde d'étain(II) |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.040.439 |
| No CE | 244-499-5 |
| No RTECS | XQ3700000 |
| PubChem | 88989 |
| Apparence | poudre cristallisée noire bleutée inodore[1] |
| Propriétés chimiques | |
| Formule | SnO |
| Masse molaire[2] | 134,709 ± 0,007 g/mol O 11,88 %, Sn 88,12 %, |
| Propriétés physiques | |
| T° fusion | 1 080 °C[3] |
| Masse volumique | 6,45 g·cm-3[3] |
| Cristallographie | |
| Système cristallin | Tétragonal |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | P44/nmm (no 129) |
| Notation Schönflies | D74h |
| Strukturbericht | B10 |
| Précautions | |
| NFPA 704[3] | |
| Composés apparentés | |
| Autres cations | Monoxyde de carbone Dioxyde de silicium Oxyde de plomb(II) |
| Autres anions | Sulfure d'étain(II) Séléniure d'étain Tellurure d'étain |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'oxyde d'étain(II) est un composé chimique de formule SnO. Il se présente sous la forme d'un solide noir bleuté inodore combustible mais difficilement inflammable et pratiquement insoluble dans l'eau[1].
Propriétés[modifier | modifier le code]
Il cristallise dans le système tétragonal avec le groupe d'espace P4/nmm (no 129) et pour paramètres cristallins a = 380,0 pm, c = 483,6 pm et Z = 2. Il en existe jusqu'à 270 °C un polymorphe rouge, métastable dans les conditions normales, de structure orthorhombique avec le groupe d'espace Cmc21 (no 36) et les paramètres a = 500,5 pm, b = 574,6 pm, c = 1 105 pm et Z = 8[4].
Il se dismute en étain et dioxyde d'étain SnO2 au-dessus de 300 °C[5] :
- 4 SnO ⟶ Sn3O4 + Sn ;
- Sn3O4 ⟶ 2 SnO2 + Sn.
Dans certaines conditions, cette dismutation peut également conduire à la formation d'oxyde d'étain(II,IV) (de) Sn2O3[6]. Hydraté ou sec, l'oxyde d'étain(II) se dissout dans les solutions aussi bien acides que basiques, ce qui en fait un ampholyte[7]. Dans les acides, il donne des sels d'étain(II) et, dans les bases, il donne des stannites, qui contiennent l'anion Sn(OH)3−. Dans les solutions très acides, on observe les espèces Sn(OH2)32+ et Sn(OH)(OH2)2+, tandis que, dans les solutions moins acides, on observe l'espèce Sn3(OH)42+. On connaît également des stannites anhydres, comme K2Sn2O3 et K2SnO2[8],[9].
On l'obtient sous forme d'hydrate SnO·xH2O, avec x < 1, à partir d'une solution de sel d'étain(II) mélangée avec un hydroxyde alcalin ou de l'ammoniaque NH3 (aq), ce qui forme un précipité incolore et floconneux très peu soluble dans l'eau. Par chauffage à l'abri de l'air, par exemple dans un flux de dioxyde de carbone, ce précipité est déshydraté de 60 à 70 °C pour donner de l'oxyde d'étain(II) α bleu-noir. Chauffé de 90 à 100 °C en présence d'un phosphinate, il se forme de l'oxyde d'étain(II) β rouge, qui est métastable et tend à redonner l'oxyde α sous l'effet d'un chauffage, d'une pression ou au contact du polymorphe α. Vers 250 à 425 °C, l'oxyde d'étain(II) α se dismute en divers oxydes d'étain mixtes[7].
On peut ainsi l'obtenir à partir du chlorure d'étain(II) SnCl2 via l'hydroxyde d'étain(II) (en) Sn(OH)2 après déshydratation par chauffage[10].
On peut également le préparer au laboratoire comme substance pure par chauffage ménagé d'oxalate d'étain(II) SnC2O4 à l'abri de l'air ou sous atmosphère de dioxyde de carbone ; cette méthode s'applique également pour la production d'oxyde de fer(II) FeO et d'oxyde de manganèse(II) MnO[11].
L'oxyde d'étain(II) brûle dans l'air avec une flamme pâle de couleur verte en formant du dioxyde d'étain SnO2[5] :
Il est principalement utilisé pour la production d'autres composés de l'étain, généralement trivalents. Il peut également être utilisés comme réducteur et pour la production de verre groseille[12]. Il a une utilisation marginale comme catalyseur d'estérification.
L'oxyde de cérium(III) Ce2O3 sous forme de céramique avec l'oxyde d'étain(II) SnO est utilisé pour l'illumination ultraviolette[13].
Notes et références[modifier | modifier le code]
- Entrée « Tin(II) oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 8 mai 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Tin(II) oxide, 99.9% (metals basis) », sur Alfa Aesar (consulté le ).
- (en) Jürgen Köhler, Jianwei Tong, Robert Dinnebier et Arndt Simon, « Crystal Structure and Electronic Structure of Red SnO », Zeitschrift für anorganische und allgemeine Chemie, vol. 638, nos 12-13, , p. 1970-1975 (DOI 10.1002/zaac.201200263, lire en ligne)
- (en) Egon Wiberg et Arnold Frederick Holleman, Inorganic Chemistry, Elsevier, 2001. (ISBN 0-12-352651-5)
- (de) G. Murken et M. Trömel, « Uber das bei der Disproportionierung von SnO entstehende Zinnoxid, Sn2O3 », Zeitschrift für anorganische und allgemeine Chemie, vol. 397, no 2, , p. 117-126 (DOI 10.1002/zaac.19733970204, lire en ligne)
- (de) Arnold F. Holleman et Nils Wiberg, Grundlagen und Hauptgruppenelemente, Walter de Gruyter GmbH, 2016, p. 1182. (ISBN 978-3-11-049585-0)
- (en) Rolf Michael Braun et Rudolf Hoppe, « The First Oxostannate(II): K2Sn2O3 », Angewandte Chemie International Edition, vol. 17, no 6, , p. 449-450 (DOI 10.1002/anie.197804491, lire en ligne)
- (de) M. Braun et R. Hoppe, « Über Oxostannate(II). III. K2Sn2O3, Rb2Sn2O3 und Cs2Sn2O3 – ein Vergleich », Zeitschrift für anorganische und allgemeine Chemie, vol. 485, no 1, , p. 15-22 (DOI 10.1002/zaac.19824850103, lire en ligne)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. I, 1975, p. 759. (ISBN 3-432-02328-6)
- (en) Satya Prakash, Advanced Inorganic Chemistry, vol. 1, S. Chand, 2000. (ISBN 81-219-0263-0)
- (en) Torun Bring, Bo Jonson, Lars Kloo, Jan Rosdahl et Reine Wallenberg, « Colour development in copper ruby alkali silicate glasses. : Part 1. The impact of tin(II) oxide, time and temperature », European journal of glass science and technology. A, Glass technology, vol. 48, no 2, , p. 101-108 (ISSN 1753-3546, OCLC 1234701228)
- (en) D. R. Peplinski, W. T. Wozniak et J. B. Moser, « Spectral Studies of New Luminophors for Dental Porcelain », Journal of Dental Research, vol. 59, no 9, , p. 1501-1506 (PMID 6931128, DOI 10.1177/00220345800590090801, lire en ligne)





