« Carbure de silicium » : différence entre les versions
Rédaction. |
Rédaction. |
||
| Ligne 159 : | Ligne 159 : | ||
Le carbure de silicium a également des applications [[électronique]]s qui remontent au début du {{s|XX|e}} avec les premières radios, puis des [[Diode électroluminescente|diodes électroluminescentes]] ({{Abréviation|LED|Light-Emitting Diode}}) ; aujourd'hui, ce matériau est employé dans les [[Composant électronique|composants électroniques]] devant fonctionner à température élevée, ou sous des [[Tension électrique|tensions]] élevées. Il est possible d'obtenir de grands [[Monocristal|monocristaux]] de carbure de silicium par le {{Lien|langue=en|trad=Lely method|fr=procédé Lely}}, cristaux qui peuvent ensuite être taillés en [[gemme]]s appelées ''moissanite synthétique''. |
Le carbure de silicium a également des applications [[électronique]]s qui remontent au début du {{s|XX|e}} avec les premières radios, puis des [[Diode électroluminescente|diodes électroluminescentes]] ({{Abréviation|LED|Light-Emitting Diode}}) ; aujourd'hui, ce matériau est employé dans les [[Composant électronique|composants électroniques]] devant fonctionner à température élevée, ou sous des [[Tension électrique|tensions]] élevées. Il est possible d'obtenir de grands [[Monocristal|monocristaux]] de carbure de silicium par le {{Lien|langue=en|trad=Lely method|fr=procédé Lely}}, cristaux qui peuvent ensuite être taillés en [[gemme]]s appelées ''moissanite synthétique''. |
||
Le carbure de silicium présente plus de 250 [[Polymorphisme (chimie)|polymorphes]]<ref name="1-86094-624-0">{{en}} Rebecca Cheung, ''Silicon carbide microelectromechanical systems for harsh environments'', Imperial College Press, 2006, {{p.|3}}. {{ISBN|1-86094-624-0}}</ref>, dont les principaux sont l'α-SiC (ou polytype 6''H'', [[Système cristallin hexagonal|hexagonal]]), le β-SiC (ou polytype 3''C'', de type [[Système cristallin cubique#Structure blende|sphalérite]]), et le carbure de silicium 4''H''. |
|||
== Structure et propriétés == |
== Structure et propriétés == |
||
Le carbure de silicium pur est incolore, mais le produit industriel est noir tirant sur le vert en raison d'impuretés d'[[alumine]] {{fchim|Al|2|O|3}} |
Le carbure de silicium pur est incolore, mais le produit industriel est noir tirant sur le vert en raison d'impuretés d'[[alumine]] {{fchim|Al|2|O|3}}. Le SiC le plus pur tend vers le vert bouteille. Le matériau massif a une [[masse volumique]] de {{unité/2|3.217|g||cm|-3}}<ref name="GESTIS"/> à {{tmp|20|°C}}, et il est à peu près insoluble dans l'eau. Il résiste à l'[[oxydation]] dans l'[[Atmosphère terrestre|atmosphère]] au-dessus de {{tmp|800|°C}} en formant une couche de [[passivation]] en [[dioxyde de silicium]] {{fchim|SiO|2}} qui protège le matériau de l'[[Dioxygène|oxygène]] de l'[[air]]. Au-dessus de {{tmp|1600|°C}} et sous [[pression partielle]] d'oxygène inférieure à {{unité/2|5|kPa}}, il se forme plutôt du [[monoxyde de silicium]] SiO, qui est [[gaz]]eux à cette température et ne protège donc plus le matériau contre l'oxydation, de sorte que le SiC brûle rapidement dans ces conditions. |
||
Le carbure de silicium présente une [[Dureté (matériau)|dureté]] de 9,0 à 9,5 sur l'[[échelle de Mohs]], comparable à celle du [[carbure de bore]] {{fchim|B|4|C}} et de l'[[alumine]] {{fchim|Al|2|O|3}}. Il a une [[conductivité thermique]] d'environ {{unité/2|350|W||m|-1|K|-1}} pour le SiC pur, généralement ramenée de {{unité/2|100|à=140|W||m|-1|K|-1}} pour le SiC technique |
Le carbure de silicium présente une [[Dureté (matériau)|dureté]] de 9,0 à 9,5 sur l'[[échelle de Mohs]], comparable à celle du [[carbure de bore]] {{fchim|B|4|C}} et de l'[[alumine]] {{fchim|Al|2|O|3}}. Il a une [[conductivité thermique]] d'environ {{unité/2|350|W||m|-1|K|-1}} pour le SiC pur, généralement ramenée de {{unité/2|100|à=140|W||m|-1|K|-1}} pour le SiC technique, en fonction du procédé de fabrication. Sa largeur de [[bande interdite]] varie selon le [[Polymorphisme (chimie)|polytype]] considéré, par exemple {{unité/2|2.39|eV}} pour le β-SiC (polytype 3''C'') et {{unité/2|3.33|eV}} pour le polytype 2''H''<ref name="978-3-540-47235-3">{{en}} K. Takahashi, A. Yoshikawa et A. Sandhu, ''Wide Bandgap Semiconductors: Fundamental Properties and Modern Photonic and Electronic Devices'', Springer-Verlag, New York, 2007. {{ISBN|978-3-540-47235-3}}</ref>{{,}}<ref name="10.1103/PhysRevB.54.10257"> |
||
{{Article |
{{Article |
||
| langue = en |
| langue = en |
||
| Ligne 264 : | Ligne 264 : | ||
=== Polymorphisme === |
=== Polymorphisme === |
||
Le carbure de silicium est |
Le carbure de silicium est notable pour son [[Polymorphisme (chimie)|polymorphisme]] particulièrement développé, avec plus de {{unité|250|formes}} [[cristal]]lines<ref name="1-86094-624-0"/>. Ce polymorphisme est caractérisé par des structures cristallines très proches appelées ''polytypes'', identiques dans deux dimensions mais différant entre eux dans la troisième dimension, ce qui permet de les décrire comme différant les uns des autres par l'ordre d'empilement de couches atomiques de structure déterminée<ref name="10.1063/1.358463"> |
||
{{Article |
{{Article |
||
| langue = en |
| langue = en |
||
| Ligne 283 : | Ligne 283 : | ||
}}</ref>. |
}}</ref>. |
||
Le carbure de silicium ''alpha'' (α-SiC) est le |
Le carbure de silicium ''alpha'' (α-SiC) est le polytype le plus courant. Il se forme au-dessus de {{tmp|1700|°C}}, avec une [[structure cristalline]] [[Système cristallin hexagonal|hexagonale]] dite 6''H''. Le carbure de silicium ''bêta'' (β-SiC) se forme en-dessous de {{tmp|1700|°C}}<ref name="10.1088/1468-6996/9/4/044204"> |
||
{{Article |
{{Article |
||
| langue = en |
| langue = en |
||
| Ligne 763 : | Ligne 763 : | ||
| consulté le = 29 janvier 2019 |
| consulté le = 29 janvier 2019 |
||
}}.</ref>, suivis en 2011 par les premiers MOSFET fonctionnant à {{unité/2|1200|V}}. Les diodes Schottky en carbure de silicium sont largement répandus sur le marché dans les modules de puissance à [[facteur de puissance]] et [[Transistor bipolaire à grille isolée|IGBT]]. |
}}.</ref>, suivis en 2011 par les premiers MOSFET fonctionnant à {{unité/2|1200|V}}. Les diodes Schottky en carbure de silicium sont largement répandus sur le marché dans les modules de puissance à [[facteur de puissance]] et [[Transistor bipolaire à grille isolée|IGBT]]. |
||
=== Joaillerie === |
|||
[[Fichier:Moissanite ring natural light.jpg|vignette|[[Bague de fiançailles]] avec moissanites.]] |
|||
Le carbure de silicium utilisé en [[joaillerie]] est appelée ''moissanite synthétique'', ou simplement ''{{Lien|langue=en|trad=Moissanite|fr=moissanite}}'', en référence au minéral du même nom. La moissanite synthétique est semblable au [[diamant]] par plusieurs aspects importants : c'est une pierre transparente et dure (9,0 à 9,5 sur l'[[échelle de Mohs]], contre 10 pour le diamant]]), avec un [[indice de réfraction]] de 2,65 à 2,69 (contre 2,42 pour le diamant). Elle est un peu plus dure que la [[Dioxyde de zirconium|zircone]] ordinaire. Contrairement au diamant, elle peut être fortement [[Biréfringence|biréfringente]]. Pour cette raison, les bijoux en moissanite sont taillés le long de l'[[axe optique]] du [[cristal]] afin de limiter les effets de biréfringence. Elle est plus légère ([[masse volumique]] de {{unité/2|3.21|g||cm|-3}} contre {{unité/2|3.53|g||cm|-3}}) et bien plus résistante à la chaleur que le diamant. Elle présente de ce fait un éclat plus brillant, des facettes plus nettes et une meilleure résilience. Les pierres de moissanite peuvent être placés directement dans un moule pour la coulée à la [[cire perdue]], comme les diamants, car la moissanite résiste à des températures atteignant {{tmp|1800|°C}}. |
|||
La moissanite est une imitation de diamant appréciée et qui peut être confondue avec le diamant véritable en raison de sa [[conductivité thermique]] particulièrement proche de celle du diamant. Elle se distingue en revanche du diamant par sa biréfringence et sa très légère fluorescence verte ou jaune sous lumière [[ultraviolet]]te. Certaines moissanites présentent également des inclusions courbes en forme de fils qui sont absentes des diamants<ref name="0-7506-5856-8">{{en}} M. O'Donoghue, ''Gems'', Elsevier, 2006, {{p.|89}}. {{ISBN|0-7506-5856-8}}</ref>. |
|||
=== Astronomie === |
=== Astronomie === |
||
[[Fichier:Schéma-gaia.png|vignette|Schéma du [[télescope spatial]] [[Gaia (satellite)|Gaia]], dont le [[Banc d'optique|banc optique]] ('''1''') est en carbure de silicium.]] |
[[Fichier:Schéma-gaia.png|vignette|Schéma du [[télescope spatial]] [[Gaia (satellite)|Gaia]], dont le [[Banc d'optique|banc optique]] ('''1''') est un tore en carbure de silicium.]] |
||
Le faible [[coefficient de dilatation thermique]] |
Le faible [[coefficient de dilatation thermique]] couplé à la grande [[Dureté (matériau)|dureté]] du carbure de silicium, sa forte rigidité et sa [[conductivité thermique]] élevée en font un matériau intéressant pour les [[télescope]]s utilisés en [[astronomie]]. Le procédé de croissance par [[dépôt chimique en phase vapeur]] ({{Abréviation|CVD|Chemical Vapor Deposition}}) a été adapté à la production de disques en SiC [[polycristallin]] pouvant atteindre {{unité/2|3.5|m}} de diamètre. Plusieurs télescopes, comme le [[télescope spatial]] [[Herschel (télescope spatial)|Herschel]], sont équipés d'optique en SiC polycristallin<ref name="10.1117/12.176195"> |
||
{{Article |
{{Article |
||
| langue = en |
| langue = en |
||
| Ligne 785 : | Ligne 793 : | ||
| pmid = |
| pmid = |
||
| bibcode = 1994SPIE.2199..263P |
| bibcode = 1994SPIE.2199..263P |
||
}}</ref>, tandis que les instruments du |
}}</ref>, tandis que les instruments du télescope spatial [[Gaia (satellite)|Gaia]] sont montés sur un [[Banc d'optique|banc optique]] rigide en carbure de silicium qui fournit une structure stable peu sujette à la dilatation thermique. |
||
=== Éléments chauffants === |
=== Éléments chauffants === |
||
| Ligne 814 : | Ligne 822 : | ||
}}</ref>, et enfin une couche externe en PyC dense. |
}}</ref>, et enfin une couche externe en PyC dense. |
||
Le carbure de silicium a été étudié pour remplacer le [[Zircaloy]] des revêtements dans les [[Réacteur à eau légère|réacteurs à eau légère]]. L'une des raisons motivant ces recherches est que le Zircaloy est fragilisé par l'[[Dihydrogène|hydrogène]] |
Le carbure de silicium a été étudié pour remplacer le [[Zircaloy]] des revêtements dans les [[Réacteur à eau légère|réacteurs à eau légère]]. L'une des raisons motivant ces recherches est que le Zircaloy est fragilisé par l'[[Dihydrogène|hydrogène]] produit par [[corrosion]] au contact de l'[[eau]], ce qui réduit sensiblement la [[ténacité]] du matériau. Ce phénomène est largement amplifié à température élevée<ref name="10.1016/S0925-8388(01)01576-6"> |
||
{{Article |
{{Article |
||
| langue = en |
| langue = en |
||
| Ligne 847 : | Ligne 855 : | ||
| consulté le = 30 janvier 2019 |
| consulté le = 30 janvier 2019 |
||
}}.</ref>. |
}}.</ref>. |
||
=== Production d'acier === |
|||
[[Fichier:Silicon carbide chunk.jpg|vignette|Bloc de SiC utilisé en [[sidérurgie]].]] |
|||
Le carbure de silicium dissous dans les fourneaux de production d'[[acier]] par [[procédé LD]] est utilisé comme [[combustible]] élevant la température du mélange et permettant de retraiter davantage de résidus avec la même charge de métal chaud. Il est meilleur marché qu'une combinaison de [[ferrosilicium]] et de [[carbone]], produit un acier plus propre et libère moins de [[Pollution de l'air|polluants atmosphériques]] car il contient moins d'impuretés, peu de gaz et n'abaisse pas la température de l'acier. |
|||
=== Support de catalyseur === |
|||
Le fait que carbure de silicium résiste naturellement à l'[[oxydation]] et le développement de nouvelles méthodes permettant de produire du β-SiC, avec une [[structure cristalline]] de type [[Système cristallin cubique#Structure blende|sphalérite]], font du carbure de silicium un matériau intéressant comme support de [[catalyse]]ur en [[catalyse hétérogène]] en raison de sa surface étendue. Ces propriétés sont mises à profit dans l'oxydation des [[hydrocarbure]]s, comme la conversion du [[Butane|''n''-butane]] en [[anhydride maléique]]<ref name="0-8493-9417-1">{{en}} Howard F. Rase, ''Handbook of commercial catalysts: heterogeneous catalysts'', CRC Press, 2000, {{p.|258}}. {{ISBN|0-8493-9417-1}}</ref>{{,}}<ref name="10.1007/BF02071177"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = S. K. Singh, K. M. Parida, B. C. Mohanty et S. B. Rao |
|||
| titre = High surface area silicon carbide from rice husk: A support material for catalysts |
|||
| périodique = Reaction Kinetics and Catalysis Letters |
|||
| volume = 54 |
|||
| numéro = 1 |
|||
| jour = |
|||
| mois = janvier |
|||
| année = 1995 |
|||
| pages = 29-34 |
|||
| url texte = https://link.springer.com/article/10.1007%2FBF02071177 |
|||
| consulté le = 31 janvier 2019 |
|||
| doi = 10.1007/BF02071177 |
|||
| pmid = |
|||
| bibcode = |
|||
}}</ref>. |
|||
== Découverte == |
== Découverte == |
||
| Ligne 861 : | Ligne 896 : | ||
</gallery> |
</gallery> |
||
{{message galerie}} |
{{message galerie}} |
||
== Carborandite == |
|||
La '''carborandite''' est un [[minéral]] artificiel résultant du chauffage à plus de {{tmp|1200|°C}} d'un mélange de [[carbone]] et de [[silice]] en présence d'un [[fondant (chimie)|fondant]] contenant des éléments [[métal]]liques. |
|||
La couleur du minéral peut varier selon son état d'[[oxydoréduction]]. Elle peut être un [[déchet]] lors de la fabrication du carborundum. C'est une pierre très légère et résistante aux chocs. |
|||
La carborandite est supposée être composée de [[carbure]] de [[silice]]. |
|||
La [[Dureté (minéral)|dureté]] de la carborandite est de l'ordre de celle du [[corindon]], soit 9 sur l'[[échelle de Mohs]] mais peut parfois rayer le diamant (soit plus de 10 sur l'échelle de Mohs).{{référence nécessaire}} |
|||
La carborandite est de [[système cristallin monoclinique]]. |
|||
Elle a une [[densité]] (ou PS) de 3,21.{{refsou}} |
|||
== Notes et références == |
== Notes et références == |
||
Version du 31 janvier 2019 à 09:30
| Carbure de silicium | |
 Pastilles de SiC pur (~3 mm de diamètre). |
|
| __ Si __ C Structure cristalline du carbure de silicium β (polymorphe 3C, ou sphalérite). |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.006.357 |
| No CE | 206-991-8 |
| No RTECS | VW0450000 |
| PubChem | 9863 |
| ChEBI | 29390 |
| SMILES | |
| InChI | |
| Apparence | solide cristallisé[1] |
| Propriétés chimiques | |
| Formule | CSi |
| Masse molaire[2] | 40,096 2 ± 0,001 1 g/mol C 29,95 %, Si 70,05 %, |
| Propriétés physiques | |
| T° fusion | 2 700 °C[1] (décomposition) |
| Solubilité | insoluble dans l'eau[1], à hauteur de 10 mg·L-1[3] |
| Masse volumique | 3,16 g·cm-3[1] à 20 °C |
| Cristallographie | |
| Symbole de Pearson | [4] |
| Classe cristalline ou groupe d’espace | R3m, (no 160) [4] |
| Structure type | wurtzite[5] |
| Précautions | |
| SGH[1] | |
| H315, H319, H335, H351, P201, P261, P280, P305+P351+P338, P405 et P501 |
|
| SIMDUT[1] | |
 D2B, |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le carbure de silicium est un composé chimique de formule SiC. C'est une céramique réfractaire ultradure semiconductrice synthétique, qu'on peut trouver dans la nature sous la forme d'un minéral très rare, la moissanite.
De la poudre de carbure de silicium est produite industriellement depuis la fin du XIXe siècle comme abrasif. Les grains de SiC peuvent être traités par frittage pour obtenir des pièces en céramique très dures — de 9,0 à 9,5 sur l'échelle de Mohs — qui sont largement utilisées pour des applications exigeant une résistance élevée comme les freins, les embrayages, ou encore les plaques de certains gilets pare-balles.
Le carbure de silicium a également des applications électroniques qui remontent au début du XXe siècle avec les premières radios, puis des diodes électroluminescentes (LED) ; aujourd'hui, ce matériau est employé dans les composants électroniques devant fonctionner à température élevée, ou sous des tensions élevées. Il est possible d'obtenir de grands monocristaux de carbure de silicium par le procédé Lely (en), cristaux qui peuvent ensuite être taillés en gemmes appelées moissanite synthétique.
Le carbure de silicium présente plus de 250 polymorphes[6], dont les principaux sont l'α-SiC (ou polytype 6H, hexagonal), le β-SiC (ou polytype 3C, de type sphalérite), et le carbure de silicium 4H.
Structure et propriétés
Le carbure de silicium pur est incolore, mais le produit industriel est noir tirant sur le vert en raison d'impuretés d'alumine Al2O3. Le SiC le plus pur tend vers le vert bouteille. Le matériau massif a une masse volumique de 3,217 g·cm-3[3] à 20 °C, et il est à peu près insoluble dans l'eau. Il résiste à l'oxydation dans l'atmosphère au-dessus de 800 °C en formant une couche de passivation en dioxyde de silicium SiO2 qui protège le matériau de l'oxygène de l'air. Au-dessus de 1 600 °C et sous pression partielle d'oxygène inférieure à 5 kPa, il se forme plutôt du monoxyde de silicium SiO, qui est gazeux à cette température et ne protège donc plus le matériau contre l'oxydation, de sorte que le SiC brûle rapidement dans ces conditions.
Le carbure de silicium présente une dureté de 9,0 à 9,5 sur l'échelle de Mohs, comparable à celle du carbure de bore B4C et de l'alumine Al2O3. Il a une conductivité thermique d'environ 350 W·m-1·K-1 pour le SiC pur, généralement ramenée de 100 à 140 W·m-1·K-1 pour le SiC technique, en fonction du procédé de fabrication. Sa largeur de bande interdite varie selon le polytype considéré, par exemple 2,39 eV pour le β-SiC (polytype 3C) et 3,33 eV pour le polytype 2H[7],[8]. Il ne fond pas, même sous atmosphère inerte, et se décompose à 2 700 °C, 2 830 °C ou 3 070 °C selon différentes mesures menées respectivement en 1986, 1988 et 1998.
| Polytype | 6H (α) | 3C (β) | 4H |
|---|---|---|---|
| Structure cristalline | Hexagonale | Cubique (sphalérite) | Hexagonale |
| Groupe d'espace | C4 6v–P63mc |
T2 d–F43m |
C4 6v–P63mc |
| Symbole de Pearson | hP12 | cF8 | hP8 |
| Paramètre cristallin | 3,081 0 Å ; 15,12 Å | 4,359 6 Å | 3,073 0 Å ; 10,053 Å |
| Masse volumique | 3,21 g·cm-3 | 3,21 g·cm-3 | 3,21 g·cm-3 |
| Largeur de bande interdite | 3,05 eV | 2,36 eV | 3,23 eV |
| Module de compression | 220 GPa | 250 GPa | 220 GPa |
| Conductivité thermique à 300 K[11] | 490 W·m-1·K-1 | 360 W·m-1·K-1 | 370 W·m-1·K-1 |
Polymorphisme
Le carbure de silicium est notable pour son polymorphisme particulièrement développé, avec plus de 250 formes cristallines[6]. Ce polymorphisme est caractérisé par des structures cristallines très proches appelées polytypes, identiques dans deux dimensions mais différant entre eux dans la troisième dimension, ce qui permet de les décrire comme différant les uns des autres par l'ordre d'empilement de couches atomiques de structure déterminée[12].
Le carbure de silicium alpha (α-SiC) est le polytype le plus courant. Il se forme au-dessus de 1 700 °C, avec une structure cristalline hexagonale dite 6H. Le carbure de silicium bêta (β-SiC) se forme en-dessous de 1 700 °C[13], avec une structure cubique dite 3C de type sphalérite, semblable à celle du diamant. Le β-SiC était relativement peu utilisé jusqu'au début du siècle mais a trouvé des applications industrielles comme support de catalyse hétérogène car il présente une plus grande surface que l'α-SiC.
Conductivité électrique
Le carbure de silicium est un semiconducteur qui peut être dopé n par l'azote et le phosphore et p par le béryllium, le bore, l'aluminium et le gallium[9]. La supraconductivité a été observée dans le 3C-SiC:Al, le 3C-SiC:B et le 6H-SiC:B à la même température de 1,5 K[13],[14]. On observe cependant une différence de comportement essentielle entre le dopage au bore et le dopage à l'aluminium : le SiC:Al est un supraconducteur de type II, comme le Si:B, tandis que le SiC:B est un supraconducteur de type I. On a montré que les sites du silicium dans le réseau cristallin du carbure de silicium sont plus importants pour la supraconductivité que les sites du carbone ; ceci pourrait expliquer la différence de comportement magnétique selon les modes de dopage car le bore se substitue au carbone tandis que l'aluminium se substitue au silicium dans le carbure de silicium[15].
Carbure de silicium naturel

Le carbure de silicium existe en très petites quantités dans le milieu naturel sous forme d'un minéral d'α-SiC appelé moissanite. D'infimes quantités de ce minéral peuvent être trouvées dans certaines types de météorites et dans les dépôts de corindon et de kimberlite. Le premier fragment de moissanite a été observé en 1893 par Henri Moissan[16] — qui a donné son nom au minéral — dans la météorite de Canyon Diablo, en Arizona (États-Unis). Cette découverte a souvent été discutée car l'échantillon sur lequel Moissan travaillait aurait pu avoir été contaminé par des lames de scie en carbure de silicium qui étaient déjà sur le marché à cette époque[17].
La moissanite a été trouvée comme minéral accessoire dans les kimberlites, essentiellement sous la forme des polytypes 6H et 15R[18]. Des grains de moissanite ont également été trouvés au sein d'une syénite peralcaline du volcan Água de Pau (île de São Miguel, aux Açores). Il s'agit surtout du polytype 6H, mais le polytype 4H est également présent. La formation de moissanite témoigne de conditions extrêmement réductrices, et peut-être d'un flux de méthane et d'hydrogène[19].
Bien qu'il soit extrêmement rare sur Terre, le carbure de silicium est particulièrement abondant dans l'espace. C'est un constituant important de la poussière interstellaire et c'est pourquoi on en retrouve souvent dans les météorites les plus primitives, c'est-à-dire les moins altérées depuis leur formation. Il s'agit presque toujours de β-SiC. On trouve ainsi de la moissanite dans certaines météorites chondritiques, sous la forme de grains présolaires. La composition isotopique de ces grains apporte des informations sur la nucléosynthèse stellaire explosive et sur certaines réactions nucléaires au sein des supernovae de type II[20]. L'analyse des grains de carbure de silicium de la météorite de Murchison, une chondrite carbonée tombée en Victoria (Australie), a également révélé des rapports isotopiques de carbone et de silicium inhabituels indiquant une origine extérieure au Système solaire[21].
Production

La moissanite étant un minéral extrêmement rare, le carbure de silicium est un matériau essentiellement synthétique. Il est utilisé comme abrasif, comme semiconducteur ainsi que comme gemme semblable au diamant. La méthode la plus simple consiste à combiner du sable de silice avec du carbone dans un four électrique selon le procédé Acheson, entre 1 600 et 2 500 °C. Il est également possible de produire du carbure de silicium à partir des grains de silice présents dans le son (par exemple celui de riz) en chauffant le tout pour faire réagir le dioxyde de silicium SiO2 avec le carbone de la matière organique[22]. La fumée de silice, qui est un sous-produit de la production de silicium et d'alliages de ferrosilicium, peut également donner du carbure de silicium par chauffage avec du graphite à 1 500 °C[23].
La pureté du matériau formé dans un four d'Acheson dépend de la distance par rapport aux résistances de graphite. Les cristaux les plus purs sont incolore, jaune clair ou verts et se trouvent au plus près des résistances. La couleur vire au bleu marine et au noir à mesure qu'on s'éloigne des résistances et que les cristaux deviennent moins purs. Les impuretés les plus courants sont l'azote et l'aluminium, qui affectent la conductivité électrique du matériau[24].

On peut obtenir du carbure de silicium pur par le procédé Lely (en)[25], au cours duquel le carbure de silicium est sublimé pour libérer du silicium, du carbone, du dicarbure de silicium SiC2 et du carbure de disilicium Si2C dans une atmosphère d'argon à 2 500 °C, espèces qui sont ensuite condensées sous forme de monocristaux d'environ 2 cm de diamètre sur un substrat plus froid. Ce procédé donne des monocristaux de bonne qualité, essentiellement sous forme d'α-SiC (polytype 6H) en raison de la température de croissance élevée. Un procédé Lely modifié utilisant le chauffage par induction dans des creusets en graphite donne des cristaux encore plus grands, pouvant atteindre 10 cm[26].
-
Cristaux de SiC obtenus par procédé Lely (en).
Le carbure de silicium cubique (β-SiC) est généralement obtenu par des procédés plus chers de dépôt chimique en phase vapeur (CVD). Il est possible de réaliser des homoépitaxies et des hétéroépitaxies de couches en carbure de silicium à partir de précurseurs liquides ou gazeux[27]. Du carbure de silicium pur peut également être préparé par décomposition thermique d'un polymère, le poly(méthylsilyne), sous atmosphère inerte à température plus basse. Par rapport aux méthodes par CVD, la pyrolyse d'un polymère présente l'avantage de pouvoir donner une forme précise au polymère avant de le convertir en céramique[10],[28],[29],[30].
Applications
Abrasifs et outils de coupe

Le carbure de silicium est un abrasif couramment utilisé dans les arts plastiques en raison de sa durabilité et de son faible coût. Dans l'industrie, il est utilisé dans les procédés d'usinage par abrasion comme le meulage, le polissage, le découpage jet d'eau et le sablage. Des particules de carbure de silicium sont laminées sur du papier pour produire du papier de verre ainsi que des bandes antidérapantes pour skateboards.
Un composite d'alumine Al2O3 et de barbes de carbure de silicium SiC particulièrement résistant a été observé en 1982 et commercialisé dans des outils de coupe dès 1985[31].
Matériau structurel
Comme d'autres céramiques ultradures (l'alumine Al2O3 et le carbure de bore B4C), le carbure de silicium est utilisé dans les blindages composites (par exemple le blindage Chobham) et dans les plaques en céramique de certains gilets pare-balles.
Le carbure de silicium est utilisé comme support et matériau de rayonnage dans les fours à haute température, notamment pour la cuisson de la céramique, la fusion du verre ou la coulée du verre. Les étagères de four en carbure de silicium sont sensiblement plus légères et plus durables que les étagères traditionnelles en alumine.
En décembre 2015, l'injection de nanoparticules de carbure de silicium dans du magnésium fondu a été proposée à l'université de Californie à Los Angeles comme moyen de produire un nouvel alliage plastique résistant pouvant être utilisé dans le secteur aéronautique et spatial, la construction automobile et la microélectronique[32].
Équipements automobiles

Le composite carbone-carbone infiltré de silicium est utilisé pour les disques de freins « céramiques » à hautes performances, car il est capable de résister à des températures extrêmes. Le silicium réagit avec le graphite dans le composite carbone-carbone pour donner du carbure de silicium renforcé par des fibres de carbone (C/SiC). Ces disques sont utilisés sur certaines voitures de sport et véhicules haut de gamme.
Le carbure de silicium est également utilisé sous forme frittée pour les filtres à particules Diesel[33]. Il est également utilisé comme additif dans l'huile pour réduire les frottements, les émissions et les harmoniques[34].
Parafoudres à éclateurs
La première application du carbure de silicium dans les installations électriques a été pour réaliser des parafoudres. Ces équipements présentent une résistance élevée lorsque que la tension électrique qui leur est appliquée est inférieure à une tension de seuil, et une résistance faible lorsque la tension électrique qui leur est appliquée est supérieure à cette tension de seuil[35].
Il a rapidement été remarqué que la résistance électrique du carbure de silicium dépend de la tension auquel il est soumis, de sorte qu'on a branché des colonnes de pastilles en SiC entre des lignes à haute tension et la terre. Si la foudre qui tombe sur la ligne élève la tension par rapport à la terre au-dessus d'une valeur limite, les piles de SiC deviennent conductrices et évacuent l'excès de tension vers la terre en préservant le reste de l'installation électrique. En pratique, les colonnes de SiC se sont révélées être très conductrices aux tensions de service normales et doivent par conséquent être montées en série avec des éclateurs. Ces éclateurs sont ionisés et rendus conducteurs lorsque la foudre élève la tension de la ligne électrique, ce qui établit un contact avec la terre à travers la colonnes de SiC, qui n'est plus isolée.
Les colonnes de SiC étaient initialement destinées à remplacer les éclateurs des parafoudres, qui ne sont généralement pas fiables car ils ne forment pas toujours l'arc électrique attendu et demeurent conducteurs trop longtemps, par exemple à la suite d'une défaillance du matériel ou d'une contamination par de la poussière ou du sel. De tels parafoudres à éclateurs et colonnes de carbure de silicium ont été commercialisés notamment par General Electric et Westinghouse Electric Corporation. Ces équipements ont depuis été largement remplacés par des varistances à colonnes de pastilles d'oxyde de zinc ZnO[36].
Pyromètres à filaments

Des fibres en carbure de silicium peuvent être utilisées dans des pyromètres à filaments, qui mesurent la température d'un courant de gaz chaud à l'aide de filaments fins dont on capte le spectre d'émission pour déterminer la température. On utilise pour cela des fibres en SiC de 15 μm de diamètre, suffisamment fine pour ne pas perturber le flux de gaz et pour assurer que la température de la fibre soit aussi proche que possible de la température du courant de gaz. Ceci permet de mesurer des températures d'environ 500 à 2 200 °C[37].
Composants électroniques
Le carbure de silicium a été le premier matériau semiconducteur important du point de vue commercial. Une diode de détection de signal radio à cristal en « carborindon » (carbure de silicium synthétique, carborundum en anglais) a été brevetée en 1906 par Henry Harrison Chase Dunwoody (en). Elle a rapidement été largement utilisée dans les récepteurs radio des navires.
Diodes électroluminescentes
L'électroluminescence a été découverte en 1907 à partir de composants en carbure de silicium et les premières diodes électroluminescentes (LED) étaient à base de SiC. Des LED jaunes en 3C-SiC ont été produites en URSS dans les années 1970 et des LED bleues dans le monde entier dans les années 1980[38]. Ces diodes ont néanmoins rapidement laissé la place aux diodes en nitrure de gallium GaN, qui présentent une émission bleue dix à cent fois plus puissante car le GaN est un semiconducteur à gap direct, contrairement au SiC qui est un matériau à gap indirect. Le SiC demeure cependant largement utilisé dans les LED comme substrat sur lequel on fait croître les couches actives en nitrure de gallium, ainsi que comme dissipateur thermique dans les LED haute puissance[38].
Électronique de puissance
Le carbure de silicium est un semiconducteur utilisé en électronique de puissance dans les composants électroniques destinés à un fonctionnement hyperfréquence, à haute température ou à haute tension. Les premiers composants disponibles étaient des diodes Schottky puis des JFET et des MOSFET pour la commutation haute puissance. Des transistors bipolaires et des thyristors font l'objet de développements[39].
La commercialisation du SiC s'est heurtée au problème de l'élimination des défauts cristallins, comme les dislocations coin et vis[40]. C'est la raison pour laquelle les composants en carbure de silicium ont initialement affiché de piètres performances bien qu'ils aient fait l'objet de recherches pour les améliorer[41]. Outre la qualité des cristaux de SiC, des problèmes d'interface entre le SiC et le dioxyde de silicium SiO2 ont entravé le développement d'IGBT et de MOSFET de puissance à base de carbure de silicium. Bien que le mécanisme n'en soit pas clairement compris, la nitruration a sensiblement réduit le nombre de défauts à l'origine des problèmes d'interface dans ces composants[42].
Les premiers JFET commerciaux fonctionnant sous en tension de 1 200 V ont été mis sur le marché en 2008[43], suivis en 2011 par les premiers MOSFET fonctionnant à 1 200 V. Les diodes Schottky en carbure de silicium sont largement répandus sur le marché dans les modules de puissance à facteur de puissance et IGBT.
Joaillerie

Le carbure de silicium utilisé en joaillerie est appelée moissanite synthétique, ou simplement moissanite, en référence au minéral du même nom. La moissanite synthétique est semblable au diamant par plusieurs aspects importants : c'est une pierre transparente et dure (9,0 à 9,5 sur l'échelle de Mohs, contre 10 pour le diamant]]), avec un indice de réfraction de 2,65 à 2,69 (contre 2,42 pour le diamant). Elle est un peu plus dure que la zircone ordinaire. Contrairement au diamant, elle peut être fortement biréfringente. Pour cette raison, les bijoux en moissanite sont taillés le long de l'axe optique du cristal afin de limiter les effets de biréfringence. Elle est plus légère (masse volumique de 3,21 g·cm-3 contre 3,53 g·cm-3) et bien plus résistante à la chaleur que le diamant. Elle présente de ce fait un éclat plus brillant, des facettes plus nettes et une meilleure résilience. Les pierres de moissanite peuvent être placés directement dans un moule pour la coulée à la cire perdue, comme les diamants, car la moissanite résiste à des températures atteignant 1 800 °C.
La moissanite est une imitation de diamant appréciée et qui peut être confondue avec le diamant véritable en raison de sa conductivité thermique particulièrement proche de celle du diamant. Elle se distingue en revanche du diamant par sa biréfringence et sa très légère fluorescence verte ou jaune sous lumière ultraviolette. Certaines moissanites présentent également des inclusions courbes en forme de fils qui sont absentes des diamants[44].
Astronomie

Le faible coefficient de dilatation thermique couplé à la grande dureté du carbure de silicium, sa forte rigidité et sa conductivité thermique élevée en font un matériau intéressant pour les télescopes utilisés en astronomie. Le procédé de croissance par dépôt chimique en phase vapeur (CVD) a été adapté à la production de disques en SiC polycristallin pouvant atteindre 3,5 m de diamètre. Plusieurs télescopes, comme le télescope spatial Herschel, sont équipés d'optique en SiC polycristallin[45], tandis que les instruments du télescope spatial Gaia sont montés sur un banc optique rigide en carbure de silicium qui fournit une structure stable peu sujette à la dilatation thermique.
Éléments chauffants
Des éléments chauffants en carbure de silicium sont mentionnés dans la littérature depuis le début du XXe siècle. Ils permettaient d'atteindre des températures de fonctionnement plus élevées que les éléments métalliques. De tels éléments chauffants en SiC sont utilisés de nos jours dans la fusion du verre et de métaux non ferreux, le traitement thermique d'un métal, la production de verre flotté, la production de céramiques et de composants électroniques, l'allumage des veilleuses pour chauffage au gaz, etc.[46]
Particules TRISO pour combustible nucléaire
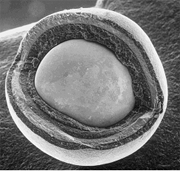
Le carbure de silicium est un constituant important des particules de combustible nucléaire de type TRISO (« tristructural isotropic »), utilisées par les réacteurs nucléaires à très haute température, comme les réacteurs à lits de boulets. Chaque particule TRISO est formée d'un cœur en dioxyde d'uranium ou en carbure d'uranium entouré de quatre couches de trois matériaux isotropes : une couche tampon poreuse en carbone, puis une couche interne en carbone pyrolytique (PyC) dense, puis une couche en SiC destinée à retenir les produits de fission à des températures élevées et à renforcer l'intégrité structurelle de la particule TRISO[47], et enfin une couche externe en PyC dense.
Le carbure de silicium a été étudié pour remplacer le Zircaloy des revêtements dans les réacteurs à eau légère. L'une des raisons motivant ces recherches est que le Zircaloy est fragilisé par l'hydrogène produit par corrosion au contact de l'eau, ce qui réduit sensiblement la ténacité du matériau. Ce phénomène est largement amplifié à température élevée[48]. Les revêtements en carbure de silicium ne subissent pas ce type de dégradation mécaniques, et gardent au contraire leur résistance aux températures élevées. Le matériau composite consiste en des fibres de SiC enroulées autour d'une couche interne en SiC et entourée d'une couche externe en SiC[49].
Production d'acier

Le carbure de silicium dissous dans les fourneaux de production d'acier par procédé LD est utilisé comme combustible élevant la température du mélange et permettant de retraiter davantage de résidus avec la même charge de métal chaud. Il est meilleur marché qu'une combinaison de ferrosilicium et de carbone, produit un acier plus propre et libère moins de polluants atmosphériques car il contient moins d'impuretés, peu de gaz et n'abaisse pas la température de l'acier.
Support de catalyseur
Le fait que carbure de silicium résiste naturellement à l'oxydation et le développement de nouvelles méthodes permettant de produire du β-SiC, avec une structure cristalline de type sphalérite, font du carbure de silicium un matériau intéressant comme support de catalyseur en catalyse hétérogène en raison de sa surface étendue. Ces propriétés sont mises à profit dans l'oxydation des hydrocarbures, comme la conversion du n-butane en anhydride maléique[50],[51].
Découverte
Le carbure de silicium a été découvert accidentellement par Jöns Jacob Berzelius en 1824 lors d'une expérience pour synthétiser du diamant. Acheson, grâce à ses travaux, fonde la Carborundum Company dans l'intention de produire un abrasif.
Synonymes
- Moissanite, forme naturelle et très rare du carbure de silicium ; elle a été nommée en l'honneur du chimiste français Henri Moissan, qui en 1905 a identifié de petits cristaux naturels de SiC dans la météorite Canyon Diablo.
- Carborundum, nom populaire de la forme synthétique, mais qui est une marque déposée.
Galerie
-
Moissanite artificielle. -
Moissanite.
Notes et références
- « Fiche du composé Silicon carbide, beta-phase, 99.8% (metals basis) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Silicon carbide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 janvier 2019 (JavaScript nécessaire)
- « The Moissanite-9R CSi Crystal Structure », sur http://cst-www.nrl.navy.mil/ (consulté le )
- (en) Bodie E. Douglas et Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, Pittsburgh, PA, États-Unis, Springer Science + Business Media, , 346 p. (ISBN 0-387-26147-8)
- (en) Rebecca Cheung, Silicon carbide microelectromechanical systems for harsh environments, Imperial College Press, 2006, p. 3. (ISBN 1-86094-624-0)
- (en) K. Takahashi, A. Yoshikawa et A. Sandhu, Wide Bandgap Semiconductors: Fundamental Properties and Modern Photonic and Electronic Devices, Springer-Verlag, New York, 2007. (ISBN 978-3-540-47235-3)
- (en) C. Persson et U. Lindefelt, « Detailed band structure for 3C-, 2H-, 4H-, 6H-SiC, and Si around the fundamental band gap », Physical Review B, vol. 54, no 15, , article no 10257 (PMID 9984797, DOI 10.1103/PhysRevB.54.10257, Bibcode 1996PhRvB..5410257P, lire en ligne)
- (en) « SiC - Silicon Carbide », sur http://www.ioffe.ru/, Institut physico-technique Ioffe (consulté le ).
- (en) Yoon-Soo Park, SiC materials and devices, Academic Press, 1998, p. 20–60. (ISBN 0-12-752160-7)
- (en) « SiC - Silicon Carbide: Thermal Properties », sur http://www.ioffe.ru/, Institut physico-technique Ioffe (consulté le ).
- (en) H. Morkoç, S. Strite, G. B. Gao, M. E. Lin, B. Sverdlov et M. Burns, « Large‐band‐gap SiC, III‐V nitride, and II‐VI ZnSe‐based semiconductor device technologies », Journal of Applied Physics, vol. 76, no 3, , p. 1363-1398 (DOI 10.1063/1.358463, Bibcode 1994JAP....76.1363M, lire en ligne)
- (en) Takahiro Muranaka, Yoshitake Kikuchi, Taku Yoshizawa, Naoki Shirakawa et Jun Akimitsu, « Superconductivity in carrier-doped silicon carbide », Science and Technology of Advanced Materials, vol. 9, no 4, , article no 044204 (PMID 27878021, PMCID 5099635, DOI 10.1088/1468-6996/9/4/044204, Bibcode 2008STAdM...9d4204M, lire en ligne)
- (en) Markus Kriener, Takahiro Muranaka, Junya Kato, Zhi-An Ren, Jun Akimitsu et Yoshiteru Maeno, « Superconductivity in heavily boron-doped silicon carbide », Science and Technology of Advanced Materials, vol. 9, no 4, , article no 044205 (PMID 27878022, PMCID 5099636, DOI 10.1088/1468-6996/9/4/044205, Bibcode 2008STAdM...9d4205K, arXiv 0810.0056, lire en ligne)
- (en) Youichi Yanase et Naoyuki Yorozu, « Superconductivity in compensated and uncompensated semiconductors », Science and Technology of Advanced Materials, vol. 9, no 4, , article no 044201 (PMID 27878018, PMCID 5099632, DOI 10.1088/1468-6996/9/4/044201, Bibcode 2008STAdM...9d4201Y, lire en ligne)
- Henri Moissan, « Nouvelles recherches sur la météorite de Cañon Diablo », Comptes rendus hebdomadaires des séances de l'Académie des science, vol. 139, , p. 773-786 (lire en ligne)
- (en) Simonpietro Di Pierro, Edwin Gnos, Bernard H. Grobety, Thomas Armbruster, Stefano M. Bernasconi et Peter Ulmer, « Rock-forming moissanite (natural α-silicon carbide) », American Mineralogist, vol. 88, nos 11-12, , p. 1817-1821 (DOI 10.2138/am-2003-11-1223, Bibcode 2003EAEJA.....8764D, lire en ligne)
- (en) A. A. Shiryaev, W. L. Griffin et E. Stoyanov, « Moissanite (SiC) from kimberlites: Polytypes, trace elements, inclusions and speculations on origin », Lithos, vol. 122, nos 3-4, , p. 152-164 (DOI 10.1016/j.lithos.2010.12.011, Bibcode 2011Litho.122..152S).
- (en) Sabrina Nazzareni, Fabrizio Nestola, Vittorio Zanon, Luca Bindi, Enrico Scricciolo et al., « Discovery of moissanite in a peralkaline syenite from the Azores Islands », Lithos, vol. 324-325, , p. 68-73 (DOI 10.1016/j.lithos.2018.10.036, Bibcode 2019Litho.324...68N).
- (en) Wataru Fujiya, Peter Hoppe et Ulrich Ott, « Hints for Neutrino-process Boron in Presolar Silicon Carbide Grains from Supernovae », The Astrophysical Journal Letters, vol. 730, no 1, , article no L7 (DOI 10.1088/2041-8205/730/1/L7/meta, Bibcode 2011ApJ...730L...7F, lire en ligne [PDF], consulté le ).
- (en) Jim Kelly, « The Astrophysical Nature of Silicon Carbide: on the origins of Moissanite », sur http://img.chem.ucl.ac.uk/, University College de Londres (consulté le ).
- (en) A. S. Vlasov, A. I. Zakharov, O. A. Sarkisyan et N. A. Lukasheva, « Obtaining silicon carbide from rice husks », Refractories, vol. 32, nos 9-10, , p. 521-523 (DOI 10.1007/bf01287542, lire en ligne)
- (en) Yang Zhong, Leon L. Shaw, Misael Manjarres et Mahmoud F. Zawrah, « Synthesis of Silicon Carbide Nanopowder Using Silica Fume », Journal of the American Ceramic Society, vol. 93, no 10, , p. 3159-3167 (DOI 10.1111/j.1551-2916.2010.03867.x, lire en ligne)
- (en) Gary Lynn Harris, Properties of silicon carbide, IET, 1995, p. 19, 170–180. (ISBN 0-85296-870-1)
- (de) Jan Anthony Lely, (1955). « Darstellung von Einkristallen von Silicium Carbid und Beherrschung von Art und Menge der eingebauten Verunreinigungen », Berichte der Deutschen Keramischen Gesellschaft, vol. 32, p. 229–236
- (en) « Large High-Quality Silicon Carbide Single Crystal Substrate », Nippon Steel Technical Report, sur la Wayback Machine, (consulté le ).
- (en) Andrey S. Bakin, « SiC Homoepitaxy and Heteroepitaxy », M. Shur, S. Rumyantsev, M. Levinshtein, SiC materials and devices, World Scientific, 2006, p. 43–76. (ISBN 981-256-835-2)
- (en) M. W. Pitcher, S. J. Joray et P. A. Bianconi, « Smooth Continuous Films of Stoichiometric Silicon Carbide from Poly(methylsilyne) », Advanced Materials, vol. 16, no 8, , p. 706-709 (DOI 10.1002/adma.200306467, lire en ligne)
- (en) A. R. Bunsell et A. Piant, « A review of the development of three generations of small diameter silicon carbide fibres », Journal of Materials Science, vol. 41, no 3, , p. 823-839 (DOI 10.1007/s10853-006-6566-z, Bibcode 2006JMatS..41..823B, lire en ligne)
- (en) Richard M. Laine et Florence Babonneau, « Preceramic polymer routes to silicon carbide », Chemistry of Materials, vol. 5, no 3, , p. 260-279 (DOI 10.1021/cm00027a007, lire en ligne)
- (en) Narottam P. Bansal, Handbook of ceramic composites, Springer, 2005, p. 312. (ISBN 1-4020-8133-2)
- (en) Matthew Chin, « UCLA researchers create exceptionally strong and lightweight new metal », sur http://newsroom.ucla.edu/, Université de Californie à Los Angeles, (consulté le ).
- (en) D. O’Sullivan, M. J. Pomeroy, S. Hampshire et M. J. Murtagh, « Degradation resistance of silicon carbide diesel particulate filters to diesel fuel ash deposits », Journal of Material Research, vol. 19, no 10, , p. 2913-2921 (DOI 10.1557/JMR.2004.0373, Bibcode 2004JMatR..19.2913O, lire en ligne)
- (en) P. Studt, « Influence of lubricating oil additives on friction of ceramics under conditions of boundary lubrication », Wear, vol. 115, nos 1-2, , p. 185-191 (DOI 10.1016/0043-1648(87)90208-0, lire en ligne)
- (en) Jerry C. Whitaker, The electronics handbook, CRC Press, 2005, p. 1108. (ISBN 0-8493-1889-0)
- (en) Colin R. Bayliss, Transmission and distribution electrical engineering, Newnes, 1999, p. 250. (ISBN 0-7506-4059-6)
- (en) Jignesh D. Maun, Peter B. Sunderland et David L. Urban, « Thin-filament pyrometry with a digital still camera », Applied Optics IP, vol. 46, no 4, , p. 483-488 (DOI 10.1364/AO.46.000483, Bibcode 2007ApOpt..46..483M, lire en ligne)
- (en) Gerald B. Stringfellow, (1997). High brightness light emitting diodes, Academic Press, 1997, p. 48, 57, 425. (ISBN 0-12-752156-9)
- (en) M. Bhatnagar et B.J. Baliga, « Comparison of 6H-SiC, 3C-SiC, and Si for power devices », IEEE Transactions on Electron Devices, vol. 40, no 3, , p. 645-655 (DOI 10.1109/16.199372, Bibcode 1993ITED...40..645B, lire en ligne)
- (en) Hui Chen, Balaji Raghothamachar, William Vetter, Michael Dudley, Y. Wang et B. J. Skromme, « Effects of Different Defect Types on the Performance of Devices Fabricated on a 4H-SiC Homoepitaxial Layer », MRS Online Proceedings Library Archive, vol. 911, , B12-03 (DOI 10.1557/PROC-0911-B12-03, lire en ligne)
- (en) Roland Madar, « Silicon carbide in contention », Nature, vol. 430, no 7003, , p. 974-975 (PMID 15329702, DOI 10.1038/430974a, Bibcode 2004Natur.430..974M, lire en ligne)
- (en) Z. Chen, A. C. Ahyi, X. Zhu, M. Li, T. Isaacs-Smith, J. R. Williams et L. C. Feldman, « MOS Characteristics of C-Face 4H-SiC », Journal of Electronic Materials, vol. 39, no 5, , p. 526-529 (DOI 10.1007/s11664-010-1096-5, Bibcode 2010JEMat..39..526C, lire en ligne)
- (en) « At 1200 V and 45 Milliohms, SemiSouth Introduces the Industry`s Lowest Resistance SiC Power Transistor for Efficient Power Management », sur http://www.reuters.com/, Reuters, (consulté le ).
- (en) M. O'Donoghue, Gems, Elsevier, 2006, p. 89. (ISBN 0-7506-5856-8)
- (en) Gury Timofeevic Petrovsky, Michael N. Tolstoy, Sergey V. Ljubarsky, Yuri P. Khimitch et Paul N. Robb, « 2.7-meter-diameter silicon carbide primary mirror for the SOFIA telescope », Proceedings SPIE, vol. 2199, , p. 263-270 (DOI 10.1117/12.176195, Bibcode 1994SPIE.2199..263P, lire en ligne)
- (en) Yeshvant V. Deshmukh, Industrial heating: principles, techniques, materials, applications, and design, CRC Press, 2005, p. 383–393. (ISBN 0-8493-3405-5)
- (en) E. López-Honorato, J. Tan, P. J. Meadows, G. Marsh et P. Xiao, « TRISO coated fuel particles with enhanced SiC properties », Journal of Nuclear Materials, vol. 392, no 2, , p. 219-224 (DOI 10.1016/j.jnucmat.2009.03.013, Bibcode 2009JNuM..392..219L, lire en ligne)
- (en) G. Bertolino, G. Meyer et J. Perez Ipiña, « Degradation of the mechanical properties of Zircaloy-4 due to hydrogen embrittlement », Journal of Alloys and Compounds, vol. 330-332, , p. 408-413 (DOI 10.1016/S0925-8388(01)01576-6, lire en ligne)
- (en) David Carpenter, K. Ahn, S. P. Kao, Pavel Hejzlar et Mujid S. Kazimi, « Assessment of Silicon Carbide Cladding for High Performance Light Water Reactors », Nuclear Fuel Cycle Program, Volume MIT-NFC-TR-098 (2007), sur http://canes.mit.edu/, MIT Center for Advanced Nuclear Energy Systems, (consulté le ).
- (en) Howard F. Rase, Handbook of commercial catalysts: heterogeneous catalysts, CRC Press, 2000, p. 258. (ISBN 0-8493-9417-1)
- (en) S. K. Singh, K. M. Parida, B. C. Mohanty et S. B. Rao, « High surface area silicon carbide from rice husk: A support material for catalysts », Reaction Kinetics and Catalysis Letters, vol. 54, no 1, , p. 29-34 (DOI 10.1007/BF02071177, lire en ligne)
Voir aussi
Liens externes
- (en) « Moissanite », sur Mindat.org (consulté le )









