Maladie de Whipple
| Causes | Infection |
|---|
| Spécialité | Gastro-entérologie |
|---|
| CISP-2 | D99 |
|---|---|
| CIM-10 | K90.8 |
| CIM-9 | 040.2 |
| ICD-O | 000209 |
| DiseasesDB | 14124 |
| MedlinePlus | 000209 |
| eMedicine |
183350 neuro/397 |
| MeSH | D008061 |
La maladie de Whipple est une maladie rare due à la bactérie Tropheryma whipplei. L'évolution spontanée de la maladie est longue, marquée par des épisodes de rémission et de rechutes, évoluant jusqu'à la mort en absence de traitement antibiotique.
Historique[modifier | modifier le code]
Sa première description est due à George Hoyt Whipple en 1907[1]. La cause en est alors inconnue. De manière empirique, un traitement par antibiotique est tenté dès 1954 et s'est révélé être efficace. Une nouvelle bactérie est détectée en 1961 par Chears, Ashworth, Yardley et Hendrix. Son patrimoine génétique est partiellement séquencé au début des années 1990 et elle reçoit le nom de Tropheryma whippelii (du grec Trophi signifiant alimentation et eryma pour barrière, soulignant ainsi la malabsorption, atteinte typique de la maladie). La culture du bacille n'a été faite qu'en 2000 par Didier Raoult et al.[2]. Le bacille est renommé en 2001 en Tropheryma whipplei[3].
Épidémiologie[modifier | modifier le code]
Il s'agit d'une maladie rare avec une incidence annuelle inférieure à un cas pour un million, concernant préférentiellement les hommes (sex ratio 9/1), occidentaux d'âge intermédiaire[4].
Cause[modifier | modifier le code]
Elle est secondaire à une infection à Tropheryma whipplei, associée à un dysfonctionnement d'origine auto-immune, la plupart des personnes contaminées ne développant pas la maladie. Ce germe est décelé essentiellement dans les eaux usées et la contamination est probablement féco-orale[5].
Il existe un facteur génétique probable (plus fréquent chez les hommes et chez les porteurs du HLA B-27) ou d'une mutation sur le gène IRF4[6].
Signes et symptômes[modifier | modifier le code]
Les manifestations classiques sont à type de douleurs articulaires, le plus souvent atteignant plusieurs sites de façon séquentielle (arthrites migratrices), faisant parfois faussement porter le diagnostic de polyarthrite séronégative, qui s'aggrave sous le traitement par immunosuppresseur[7].
Il existe un syndrome de malabsorption avec diarrhée et amaigrissement, parfois un saignement digestif, des douleurs abdominales. Une pigmentation cutanée est décrite. Le malade est souvent fébrile.
Il peut exister une atteinte du système nerveux central avec des troubles des fonctions supérieures pouvant aller jusqu'à la démence, des mouvements anormaux des globes oculaires, une hydrocéphalie à pression normale. L'atteinte neurologique et/ou oculaire sont de mauvais pronostic.
L'atteinte cardiovasculaire est, le plus souvent, de type péricardites et, plus rarement, une endocardite à hémocultures négatives (sans germe décelé à la culture du sang).
L'évolution se fait typiquement en deux temps : elle débute par une atteinte articulaire et se poursuit, quelques années plus tard, par un syndrome digestif avec diarrhée et amaigrissement.
Évolution[modifier | modifier le code]
Spontanément fatale à plus ou moins long terme, le traitement par antibiotiques permet une amélioration notable de la maladie mais n'empêche pas des rechutes.
Diagnostic[modifier | modifier le code]
Le diagnostic est difficile et peut être retardé de plusieurs années par rapport au début des symptômes[8].
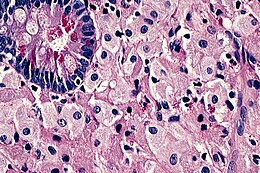
Il se fait par endoscopie digestive haute associée à la réalisation de biopsies multiples (> 10) duodénales et si possible jéjunales.
La présence en microscopie optique d'un infiltrat de macrophages spumeux PAS+ est caractéristique.
Examens complémentaires[modifier | modifier le code]
- Dosage des graisses dans les selles pour confirmer la stéatorrhée.
- Au transit baryté on note une atrophie villositaire. Cet examen est supplanté de nos jours par la fibroscopie gastroduodénale permettant de visualiser un aspect fragilisé de la muqueuse du duodénum et surtout, d'en faire une biopsie (prélèvement de tissus à l'aide d'une pince coupante permettant son analyse au microscope).
Aspect des biopsies[modifier | modifier le code]
Après coloration au PAS, des inclusions sont visualisées dans les macrophages de la lamina propria. Cet aspect n'est cependant ni spécifique ni sensible[9] et le diagnostic peut être aidé par le marquage aux anticorps anti-T. whipplei.
La réaction en chaîne par polymérase (PCR) permet de détecter également l'ADN bactérien de T. whipplei dans la salive ou les selles, avec une très bonne sensibilité et spécificité[10].
Traitement[modifier | modifier le code]
Cette maladie nécessite une antibiothérapie au long cours. Le plus souvent elle associe un traitement « d'attaque », par exemple pénicilline G + streptomycine injectées pendant 2 semaines puis cotrimoxazole (triméthoprime + sulfaméthoxazole) per os pendant un à deux ans[11]. On y associe dans les formes graves une corticothérapie.
Le méropénème peut constituer une alternative à la ceftriaxone[12].
Un traitement par interféron-Gamma a été proposé en cas d'atteinte neurologique[13].
Notes et références[modifier | modifier le code]
- (en) Whipple GH. « A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acid in the intestinal and mesenteric lymphatic tissues » Bull Johns Hopkins Hosp. 1907;18:382-93.
- (en) Raoult D, Birg ML, La Scola B, Fournier PE, Enea M, Lepidi H, Roux V, Piette JC, Vandenesch F, Vital-Durand D, Marrie TJ. « Cultivation of the bacillus of Whipple's disease » N Engl J Med. 2000;342(9):620-5.
- (en) La Scola B, Fenollar F, Fournier PE, Altwegg M, Mallet MN, Raoult D. « Description of Tropheryma whipplei gen. nov., sp. nov., the Whipple's disease bacillus » Int J Syst Evol Microbiol. 2001;51(Pt 4):1471-9.
- (en) Schneider T, Moos V, Loddenkemper C, Marth T, Fenollar F, Raoult D, « Whipple’s disease: new aspects of pathogenesis and treatment » Lancet Infect Dis, 2008;8:179-190
- (en) Schöniger-Hekele M, Petermann D, Weber B, Müller C, « Tropheryma whipplei in the environment: survey of sewage plant influxes and sewage plant workers » Appl Environ Microbiol, 2007;73:2033-2035
- Guérin A, Kerner G, Marr N et al. IRF4 haploinsufficiency in a family with Whipple’s disease. Elife, 2018;7:e32340-e32340
- Tison A, Preuss P, Leleu C et al. Rheumatological features of Whipple disease, Sci Rep, 2021;11:12278-12278
- (en) Durand DV, Lecomte C, Cathébras P, Rousset H, Godeau P, « Whipple disease: clinical review of 52 cases » Medicine (Baltimore), 1997;76:170-184
- Dolmans RA, Boel CH, Lacle MM, Kusters JG, Clinical manifestations, treatment, and diagnosis of tropheryma whipplei infections, Clin Microbiol Rev, 2017;30:529-555
- Fenollar F, Laouira S, Lepidi H, Rolain J-M, Raoult D, Value of Tropheryma whipplei quantitative polymerase chain reaction assay for the diagnosis of Whipple disease: usefulness of saliva and stool specimens for first-line screening, Clin Infect Dis, 2008;47:659-667
- (en) Feurle GE, Moos V, Bläker H, Loddenkemper C, Moter A, Stroux A, Marth T, Schneider T. « Intravenous ceftriaxone, followed by 12 or three months of oral treatment with trimethoprim-sulfamethoxazole in Whipple's disease » J Infect. 2013;66(3):263-70. DOI 10.1016/j.jinf.2012.12.004
- (en) Feurle GE, Junga NS, Marth T. « Efficacy of ceftriaxone or meropenem as initial therapies in Whipple's disease » Gastroenterology 2010;138(2):478-86; quiz 11-2. DOI 10.1053/j.gastro.2009.10.041
- New England Journal of Medicine, Whipple's Disease 4 janvier 2007
Annexes[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- (it) « Whipple, morbo di », dans Enciclopedia medica italiana, (lire en ligne), p. 7597-7598
Liens externes[modifier | modifier le code]
- (en) Whipple's disease, Florence Fenollar, Xavier Puéchal, Didier Raoult, New Eng J Med, 2007;356:55-66