« Métabolisme » : différence entre les versions
Compléments. |
Compléments. |
||
| Ligne 299 : | Ligne 299 : | ||
| pmc = 1798440 |
| pmc = 1798440 |
||
}} {{DOI|10.1042/BJ20061638}} {{PMID|17295611}}</ref>. Le couple {{nobr|NAD<sup>+</sup> / NADH}} intervient davantage dans les réactions cataboliques tandis que le couple {{nobr|NADP<sup>+</sup> / NADPH}} est spécifique à l'anabolisme. |
}} {{DOI|10.1042/BJ20061638}} {{PMID|17295611}}</ref>. Le couple {{nobr|NAD<sup>+</sup> / NADH}} intervient davantage dans les réactions cataboliques tandis que le couple {{nobr|NADP<sup>+</sup> / NADPH}} est spécifique à l'anabolisme. |
||
=== Sels minéraux === |
|||
{{Article principal|sel minéral|chimie bioinorganique}} |
|||
Les [[Sel minéral|sels minéraux]] jouent un rôle déterminant dans le métabolisme. Certains sont abondants, comme le [[sodium]] et le [[potassium]], tandis que d'autres ne sont actifs qu'à faible concentration. Environ 99 % de la masse des [[mammifère]]s est constituée des [[Élément chimique|éléments]] [[carbone]], [[azote]], [[calcium]], [[sodium]], [[sodium]], [[chlore]], [[potassium]], [[hydrogène]], [[phosphore]], [[oxygène]] et [[soufre]]<ref name="PMID 1872381"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = S. B. Heymsfield, M. Waki, J. Kehayias, S. Lichtman, F. A. Dilmanian, Y. Kamen, J. Wang et R. N. Pierson Jr |
|||
| titre = Chemical and elemental analysis of humans in vivo using improved body composition models |
|||
| périodique = American Journal of Physiology - Endocrinology and Metabolism |
|||
| volume = 261 |
|||
| numéro = |
|||
| jour = |
|||
| mois = août |
|||
| année = 1991 |
|||
| pages = E190-E198 |
|||
| url texte = http://ajpendo.physiology.org/content/261/2/E190 |
|||
| consulté le = 19 décembre 2013 |
|||
}} {{PMID|1872381}}</ref>. Les [[Composé organique|composés organiques]] ([[protéine]]s, [[lipide]]s et [[glucide]]s) contiennent l'essentiel du carbone et de l'azote, tandis que l'essentiel de l'oxygène et de l'hydrogène sont présents sous forme d'[[eau]]. |
|||
Les sels minéraux les plus abondants agissent comme [[électrolyte]]s. Les principaux [[ion]]s sont le [[sodium]] Na<sup>+</sup>, le [[potassium]] K<sup>+</sup>, le [[calcium]] Ca<sup>2+</sup>, le [[magnésium]] Mg<sup>2+</sup>, le [[chlore]] Cl<sup>–</sup>, le [[phosphate]] {{fchim|PO|4|<sup>3−</sup>}} et l'ion [[Composé organique|organique]] [[bicarbonate]] {{fchim|HCO|3|<sup>–</sup>}}. Le maintien de [[Gradient de concentration|gradients de concentration]] déterminés à travers les [[Membrane (biologie)|membranes cellulaires]] permet de maintenir l'[[Pression osmotique|équilibre osmotique]] et le [[Potentiel hydrogène|pH]] du milieu intracellulaire. Les ions sont également essentiels au fonctionnement des [[nerf]]s et des [[muscle]]s à travers le [[potentiel d'action]] issu de l'échange d'ions, à travers la [[membrane plasmique]], entre le {{lien|fr=fluide extracellulaire|trad=Extracellular fluid|lang=en}} et le fluide intracellulaire, c'est-à-dire le [[cytosol]]. Les ions entrent et quittent les cellules en empruntant des [[Protéine membranaire|protéines membranaires]] appelés [[Canal ionique|canaux ioniques]]. Ainsi, la [[contraction musculaire]] dépend du passage des ions calcium, sodium et potassium à travers les canaux ioniques de la membrane cellulaire et les {{lien|fr=Tubule T|texte=tubules T|trad=T-tubule|lang=en}}<ref name="10.1111/j.1440-1681.2006.04441.x"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = A.F. Dulhunty |
|||
| titre = EXCITATION–CONTRACTION COUPLING FROM THE 1950s INTO THE NEW MILLENNIUM |
|||
| périodique = Clinical and Experimental Pharmacology and Physiology |
|||
| volume = 33 |
|||
| numéro = 9 |
|||
| jour = |
|||
| mois = septembre |
|||
| année = 2006 |
|||
| pages = 763-772 |
|||
| url texte = http://onlinelibrary.wiley.com/doi/10.1111/j.1440-1681.2006.04441.x/abstract |
|||
| consulté le = 19 décembre 2013 |
|||
}} {{DOI|10.1111/j.1440-1681.2006.04441.x}} {{PMID|16922804}}</ref>. |
|||
Les [[Métal de transition|métaux de transition]] sont généralement présents à l'état de trace chez les organismes vivants, le [[zinc]] et le [[fer]] étant les plus abondants d'entre eux<ref name="PMID 9498359"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = D. C. Mahan et R. G. Shields Jr |
|||
| titre = Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight |
|||
| périodique = Journal of Animal Science |
|||
| volume = 76 |
|||
| numéro = 2 |
|||
| jour = |
|||
| mois = février |
|||
| année = 1998 |
|||
| pages = 506-512 |
|||
| url texte = http://www.journalofanimalscience.org/content/76/2/506.short |
|||
| consulté le = 19 décembre 2013 |
|||
}} {{PMID|9498359}}</ref>{{,}}<ref name="10.1007/s00216-003-2219-0"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Søren Husted, Birgitte F. Mikkelsen, Jacob Jensen et Niels Erik Nielsen |
|||
| titre = Elemental fingerprint analysis of barley (''Hordeum vulgare'') using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics |
|||
| périodique = Analytical and Bioanalytical Chemistry |
|||
| volume = 378 |
|||
| numéro = 1 |
|||
| jour = |
|||
| mois = |
|||
| année = 2004 |
|||
| pages = 171-182 |
|||
| url texte = http://link.springer.com/article/10.1007%2Fs00216-003-2219-0 |
|||
| consulté le = 19 décembre 2013 |
|||
}} {{DOI|10.1007/s00216-003-2219-0}} {{PMID|14551660}}</ref>. Ces métaux interviennent comme [[Cofacteur (biochimie)|cofacteurs]] de certaines [[protéine]]s et [[enzyme]]s et sont essentiels à leur bon fonctionnement. C'est par exemple le cas d'une enzyme telle que la [[catalase]] et d'une protéine transporteuse d'[[Dioxygène|oxygène]] telle que l'[[hémoglobine]]<ref name="10.1126/science.1085049"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Lydia A. Finney, Thomas V. O'Halloran |
|||
| titre = Transition Metal Speciation in the Cell: Insights from the Chemistry of Metal Ion Receptors |
|||
| périodique = Science |
|||
| volume = 300 |
|||
| numéro = 5621 |
|||
| jour = 9 |
|||
| mois = mai |
|||
| année = 2003 |
|||
| pages = 931-936 |
|||
| url texte = http://www.sciencemag.org/content/300/5621/931 |
|||
| consulté le = 19 décembre 2013 |
|||
}} {{DOI|10.1126/science.1085049}} {{PMID|12738850}}</ref>. Les cofacteurs métalliques se lient spécifiquement à certains sites des protéines. Bien que les cofacteurs puissent être modifiés au cours de la réaction catalysée, il reviennent toujours à leur état d'origine à la fin de la réaction. Ils sont absorbés par les organismes à l'aide de transporteurs spécifiques, par exemple les [[sidérophore]]s pour absorber le fer, et sont liés à des protéines de stockage telles que la [[ferritine]] et les [[métallothionéine]]s lorsqu'ils ne sont pas utilisés<ref name="10.1074/jbc.R600011200"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Robert J. Cousins, Juan P. Liuzzi et Louis A. Lichten |
|||
| titre = Mammalian Zinc Transport, Trafficking, and Signals |
|||
| périodique = Journal of Biological Chemistry |
|||
| volume = 281 |
|||
| numéro = |
|||
| jour = 25 |
|||
| mois = août |
|||
| année = 2006 |
|||
| pages = 24085-24089 |
|||
| url texte = http://www.jbc.org/content/281/34/24085 |
|||
| consulté le = 19 décembre 2013 |
|||
}} {{DOI|10.1074/jbc.R600011200}} {{PMID|16793761}}</ref>{{,}}<ref name="10.1016/j.tcb.2006.12.003"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Louise L. Dunn, Yohan Suryo Rahmanto et Des R. Richardson |
|||
| titre = Iron uptake and metabolism in the new millennium |
|||
| périodique = Trends in Cell Biology |
|||
| volume = 17 |
|||
| numéro = 2 |
|||
| jour = |
|||
| mois = février |
|||
| année = 2007 |
|||
| pages = 93-100 |
|||
| url texte = http://www.cell.com/trends/cell-biology//retrieve/pii/S0962892406003400 |
|||
| consulté le = 19 décembre 2013 |
|||
}} {{DOI|10.1016/j.tcb.2006.12.003}} {{PMID|17194590}}</ref>. |
|||
== Principes du métabolisme == |
== Principes du métabolisme == |
||
Version du 20 décembre 2013 à 02:26



Le métabolisme est l'ensemble des réactions physicochimiques qui se déroulent au sein d'un organisme pour lui permettre notamment de se maintenir en vie, de se reproduire, de se développer et de répondre aux stimulus de son environnement. Certaines de ces réactions chimiques se déroulent en dehors des cellules de l'organisme, comme la digestion ou le transport de substances entre cellules. Cependant, la plupart de ces réactions ont lieu dans les cellules elles-mêmes et constituent le métabolisme intermédiaire.
La biochimie cellulaire repose sur des réactions chimiques catalysées par des enzymes, c'est-à-dire des protéines possédant la faculté de faciliter chacune une réaction chimique spécifique. Ces réactions sont régies par les principes de la thermodynamique et s'organisent en voies métaboliques constituées d'un ensemble de transformations permettant de convertir un composé chimique en un autre à travers des transformations successives ou parallèles catalysées par des enzymes. Certaines de ces enzymes sont soumises à une régulation par des métabolites cellulaires ou par des signaux extracellulaires. Ces facteurs de régulation modifient la cinétique enzymatique, accélérant ou ralentissant certaines réactions déterminantes, et aboutissant à l'autorégulation du système par l'ouverture et la fermeture de certaines voies métaboliques plutôt que d'autres.
Au sein des réactions constituant le métabolisme, on distingue généralement l'anabolisme, qui représente l'ensemble des voies de biosynthèse des constituants cellulaires, du catabolisme, qui représente quant à lui l'ensemble des voies de dégradation de ces constituants cellulaires en petites molécules pour en libérer l'énergie par oxydation ou pour rebâtir d'autres constituants cellulaires. Les réactions de l'anabolisme et du catabolisme sont interconnectées à travers des molécules spécialisées jouant le rôle de cofacteurs enzymatiques. C'est par exemple le cas de l'adénosine triphosphate (ATP), dont l'hydrolyse en adénosine diphosphate (ADP) et phosphate inorganique (Pi) est souvent couplée aux réactions d'anabolisme pour les rendre thermodynamiquement favorables. Le nicotinamide adénine dinucléotide (NAD+ à l'état oxydé) et le nicotinamide adénine dinucléotide phosphate (NADPH à l'état réduit), quant à eux, sont des transporteurs d'électrons utilisés dans les réactions d'oxydoréduction cellulaires, le NAD+ plutôt dans le catabolisme et le NADPH dans l'anabolisme. Des coenzymes permettent également d'échanger de la matière entre les différentes voies métaboliques. Ainsi, la coenzyme A permet d'activer des groupes acyle pour former une acyl-CoA, dont la plus importante est l'acétyl-CoA : cette dernière se trouve au carrefour de plusieurs voies métaboliques majeures, telles que la dégradation des glucides et des lipides, la production d'énergie métabolique, ou encore la biosynthèse des acides gras et des oses.
Le métabolisme d'un organisme définit les types de substances chimiques qui pour lui sont nutritifs et lesquels sont au contraire toxiques : ainsi, certains procaryotes ont besoin de sulfure d'hydrogène H2S pour se développer, alors que ce gaz est toxique pour les animaux[1]. L'intensité du métabolisme de base détermine également la quantité de nourriture nécessaire à l'organisme.
Il est frappant d'observer la similitude des voies métaboliques fondamentales et des composés biochimiques à travers des organismes les plus divers[2]. Ainsi, les acides carboxyliques constituant les intermédiaires du cycle de Krebs se retrouvent chez tous les organismes connus, allant d'un procaryote tel qu'E. coli jusqu'à un métazoaire tel que l'éléphant[3]. Ces similitudes remarquables sont très certainement dues à l'apparition précoce de ces voies métaboliques au cours l'évolution des formes de vie sur Terre et à leur conservation en raison de leur efficacité[4],[5].
Composés biochimiques fondamentaux

Les animaux, les plantes et les microbes sont formés de trois grandes familles de molécules :
- les lipides, qui jouent un rôle à la fois de réserve d'énergie, de constituant principal des membranes de leurs cellules, et de communication entre cellules par des mécanismes de signalisation lipidique ;
- les peptides, qui jouent un rôle déterminant à la fois dans la structure des organismes (protéines), leur biochimie (enzymes) et d'intégration physiologique entre les organes (hormones peptidiques) ;
- les glucides, qui servent à la fois à stocker de l'énergie, à stabiliser certaines protéines et à favoriser l'adhérence des cellules entre elles, par exemple dans les mécanismes de reconnaissance du système immunitaire à travers les lectines.
Ces molécules étant essentielles à la vie, le métabolisme cellulaire consiste ou bien à les synthétiser pour produire de nouvelles cellules et faire croître les tissus, ou bien à les dégrader lors de la digestion pour les utiliser comme sources d'énergie et de constituants élémentaires qui peuvent être recyclés dans la biosynthèse de nouvelles biomolécules.
Les macromolécules biologiques sont elles-mêmes des polymères appartenant à trois familles différentes :
- les polypeptides, qui sont constitués d'acides aminés, au sein desquels ont trouve les protéines et les enzymes ;
- les polysaccharides, qui sont constitués d'oses — par exemple l'amidon, la cellulose, le glycogène ;
- les polynucléotides, qui sont constitués de nucléotides, et dont les deux représentants sont les acides ribonucléiques (ARN) et les acides désoxyribonucléiques (ADN), lesquels portent le code génétique, qui détermine la nature des protéines et des enzymes — et donc la physiologie — de chaque cellule.
Acides aminés et protéines
Les protéines sont constituées d'acides α-aminés liés entre eux par une liaison peptidique pour former une chaîne linéaire. De nombreuses protéines sont des enzymes qui catalysent des réactions chimiques du métabolisme. D'autres protéines ont un rôle structurel ou mécanique, comme celles du cytosquelette, qui maintient la forme générale de la cellule[6]. Les protéines jouent également un rôle clé dans la signalisation cellulaire, comme anticorps du système immunitaire, l'adhérence cellulaire, le transport actif à travers les membranes et le cycle cellulaire. Les acides aminés contribuent également à fournir de l'énergie au métabolisme cellulaire en alimentant le cycle de Krebs[7], en particulier lorsque les principales sources d'énergie, telles que le glucose, font défaut, ou lorsque la cellule est soumise à un stress métabolique[8].
Lipides
Les lipides sont le groupes de composés biochimiques le plus diversifié. Leur fonction structurelle principale est en tant que constituant des membranes des cellules, notamment de leur membrane plasmique et du système endomembranaire des cellules eucaryotes, ainsi que de celles d'organites telles que les mitochondries et les chloroplastes. Ils sont également utilisés comme sources d'énergie. On les définit généralement comme des molécules biologiques hydrophobes et amphiphiles solubles dans les solvants organiques tels que le benzène et le chloroforme[9]. Les graisses sont, parmi les lipides, un grand groupe de composés solides essentiellement constitués d'acides gras et de glycérol. Une molécule formée de trois résidus d'acides gras estérifiant les trois hydroxyles d'un résidu de glycérol est appelée triglycéride. Il existe diverses variations autour de ce thème central, par exemple avec de la sphingosine dans le cas des sphingolipides, et des groupes hydrophiles tels que le groupe phosphate dans le cas des phospholipides. Les stéroïdes, tels que le cholestérol, sont une autre famille importante de lipides[10].

Glucides
Les glucides sont des aldéhydes ou des cétones ayant plusieurs groupes hydroxyle. Ces molécules peuvent exister sous forme linéaire ou cyclique. Ce sont les molécules biologiques les plus abondantes. Elles remplissent un grand nombre de fonctions, comme substances de stockage et le transport de l'énergie (amidon, glycogène) ou comme composants structurels (cellulose chez les plantes, chitine chez les animaux). Les monomères glucidiques sont appelés oses : ce sont par exemple le galactose, le fructose, et surtout le glucose. Ils peuvent polymériser en donnant des polysaccharides avec une variété de structures quasiment infinie[11].
Nucléotides
Les deux acides nucléiques, l'acide ribonucléique (ARN) et l'acide désoxyribonucléique (ADN), sont des polymères de nucléotides. Chaque nucléotide est constitué d'un groupe phosphate, d'un résidu de ribose (ARN) ou de désoxyribose (ADN), et d'une base azotée. Les acides nucléiques sont responsables du stockage et de l'expression de l'information génétique ainsi que de son décodage à travers le processus de transcription et de synthèse des protéines. Cette information est préservée par un mécanisme de réparation de l'ADN et propagé à travers le processus de réplication de l'ADN. De nombreux virus, dits virus à ARN, ont un génome constitué d'ARN et non d'ADN — c'est par exemple le cas du virus de l'immunodéficience humaine (VIH) — et ont recours à des transcriptases inverses pour générer dans la cellule hôte une matrice d'ADN à partir du génome viral en ARN[12]. L'ARN des ribozymes, tels que les splicéosomes (ou particules d'épissage) et des ribosomes, est semblable aux enzymes dans ma mesure où il est capable de catalyser des réactions chimiques. Les nucléosides résultent de la liaison d'une molécule de ribose à une base azotée. Ces dernières sont des composés hétérocycliques contenant des atomes d'azote ; elles se divisent en purines et pyrimidines.
Coenzymes et cofacteurs
Le métabolisme implique un très grand nombre de réactions chimiques différentes formant un réseau de transformations complexe, mais la plupart d'entre elles peuvent être rapprochées de quelques types de réactions basiques consistant en des transferts de groupes fonctionnels[13]. Cela résulte du fait que la biochimie cellulaire fait appel à un nombre relativement restreint de molécules agissant comme des activateurs susceptibles de transporter des groupes d'atomes entre différentes réactions[14]. De telles molécules sont appelées coenzymes. Chaque type de transfert de groupe fonctionnel fait appel à une coenzyme spécifique. Chacune de ces coenzymes est également spécifique d'un certain nombre d'enzymes qui catalysent les réactions de transfert, enzymes qui les altèrent et les régénèrent en permanence[15].
L'adénosine triphosphate (ATP) est la coenzyme universelle des échanges d'énergie chez tous les organismes connus. Ce nucléotide permet de transférer de l'énergie métabolique entre les réactions qui libèrent de l'énergie et celles qui en absorbent. Il n'y a à chaque instant qu'une faible quantité d'ATP dans les cellules, mais, comme ce capital d'ATP est continuellement consommé et régénéré, le corps humain peut en réalité consommer chaque jour une masse d'ATP pratiquement équivalent à son poids total[15]. L'ATP permet de coupler l'anabolisme au catabolisme, le premier consommant l'ATP produit par le second. Il sert également de transporteur de groupes phosphate dans les réactions de phosphorylation.
Les vitamines sont des composés organiques indispensables en petite quantité au fonctionnement des cellules mais que ces dernières ne peuvent pas produire elles-mêmes. Chez l'homme, la plupart des vitamines deviennent des coenzymes après quelques transformations dans les cellules. Ainsi, les vitamines hydrosolubles (vitamines B) sont phosphorylées ou couplées à des nucléotides lorsqu'elles sont utilisées dans les cellules. Par exemple, la niacine (acide nicotinique) entre dans la composition du nicotinamide adénine dinucléotide (NAD+) et du nicotinamide adénine dinucléotide phosphate (NADP+), qui sont des coenzymes importantes impliquées dans les réactions d'oxydoréduction comme accepteurs d'hydrogène. Il existe des centaines de déshydrogénases, qui soustraient des électrons de leur substrat et réduisent le NAD+ en NADH et H+. Cette forme réduite de la coenzyme peut alors être utilisée par une réductase[16]. Le couple NAD+ / NADH intervient davantage dans les réactions cataboliques tandis que le couple NADP+ / NADPH est spécifique à l'anabolisme.
Sels minéraux
Les sels minéraux jouent un rôle déterminant dans le métabolisme. Certains sont abondants, comme le sodium et le potassium, tandis que d'autres ne sont actifs qu'à faible concentration. Environ 99 % de la masse des mammifères est constituée des éléments carbone, azote, calcium, sodium, sodium, chlore, potassium, hydrogène, phosphore, oxygène et soufre[17]. Les composés organiques (protéines, lipides et glucides) contiennent l'essentiel du carbone et de l'azote, tandis que l'essentiel de l'oxygène et de l'hydrogène sont présents sous forme d'eau.
Les sels minéraux les plus abondants agissent comme électrolytes. Les principaux ions sont le sodium Na+, le potassium K+, le calcium Ca2+, le magnésium Mg2+, le chlore Cl–, le phosphate PO43− et l'ion organique bicarbonate HCO3–. Le maintien de gradients de concentration déterminés à travers les membranes cellulaires permet de maintenir l'équilibre osmotique et le pH du milieu intracellulaire. Les ions sont également essentiels au fonctionnement des nerfs et des muscles à travers le potentiel d'action issu de l'échange d'ions, à travers la membrane plasmique, entre le fluide extracellulaire (en) et le fluide intracellulaire, c'est-à-dire le cytosol. Les ions entrent et quittent les cellules en empruntant des protéines membranaires appelés canaux ioniques. Ainsi, la contraction musculaire dépend du passage des ions calcium, sodium et potassium à travers les canaux ioniques de la membrane cellulaire et les tubules T[18].
Les métaux de transition sont généralement présents à l'état de trace chez les organismes vivants, le zinc et le fer étant les plus abondants d'entre eux[19],[20]. Ces métaux interviennent comme cofacteurs de certaines protéines et enzymes et sont essentiels à leur bon fonctionnement. C'est par exemple le cas d'une enzyme telle que la catalase et d'une protéine transporteuse d'oxygène telle que l'hémoglobine[21]. Les cofacteurs métalliques se lient spécifiquement à certains sites des protéines. Bien que les cofacteurs puissent être modifiés au cours de la réaction catalysée, il reviennent toujours à leur état d'origine à la fin de la réaction. Ils sont absorbés par les organismes à l'aide de transporteurs spécifiques, par exemple les sidérophores pour absorber le fer, et sont liés à des protéines de stockage telles que la ferritine et les métallothionéines lorsqu'ils ne sont pas utilisés[22],[23].
Principes du métabolisme

Le métabolisme repose sur des réactions chimiques, qui sont catalysées par des enzymes. Ces dernières ne font qu'abaisser l'énergie nécessaire à la réalisation de cette réaction. On distingue deux types de réaction, les réactions thermodynamiquement favorables, ou réaction spontanées au sens thermodynamique qui sont apparentée au catabolisme, ces réactions libèrent de l'énergie sous diverses formes. Et les réactions non spontanées qui nécessitent un apport en énergie pour avoir lieu, ces dernières sont plutôt affiliée à l'anabolisme. Les formes d'énergie libérées ou absorbée par ces réactions sont de différentes natures. De plus comme prédit par les principes de la thermodynamique, une fraction d’énergie est toujours "perdue" dans toute réaction chimique sous forme d'agitation thermique (énergie cinétique).
Anabolisme
L'anabolisme est le métabolisme qui permet à la cellule de synthétiser les substances indispensables à sa vie et à sa fonction. Cette synthèse s'effectue à partir des matériaux que la cellule a absorbés du milieu extérieur et de l'énergie dégagée par le catabolisme ou provenant de l'extérieur, cas de la photosynthèse.
Catabolisme
Le catabolisme désigne l'ensemble des réactions de dégradation d'un organisme qui aboutissent à un bénéfice énergétique. Ces dégradations ont lieu sur des molécules issues du milieu extérieur acquises par la nutrition ou bien par utilisation des réserves énergétiques d'un organisme ou de recyclage de molécules, cas de la glycogénolyse.
Exemples de réactions métaboliques

Le métabolisme de dégradation de grosses molécules en petites molécules, qui permet la libération d'énergie, est appelé catabolisme. L'énergie est mise en réserve lors de la phosphorylation de l'ADP (adénosine diphosphate) en ATP (adénosine-triphosphate). Cette énergie servira à assurer les différentes fonctions de la cellule.
Trois modes de productions principaux d’énergie :
- Métabolisme anaérobie alactique : Il fourni une grande quantité d’énergie sur une courte durée, par dégradation des faibles réserves d'ATP en donnant de l'ADP.
- métabolisme anaérobie lactique : L'ATP est créé sans dioxygène au prix d'une fermentation lactique donnant un poison cellulaire l'acide lactique.
- métabolisme aérobie : Avec un apport en dioxygène normal on observe une respiration cellulaire classique.
Cependant diverses voies métaboliques existent comme en témoigne cette image :
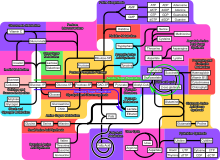
Métabolisme et température
Chez les organismes fongiques, bactériens, végétaux ou animaux à sang chaud ou froid, divers processus font intéragir la température interne, externe et le métabolisme[24], avec des boucles de rétroactions plus ou moins complexes, variant selon les espèces, les individus, leur forme et taille[24] et leur masse corporelle[25] et les milieux[26] ;
Plantes et levures semblent disposer d'un thermostat biologique simple ; Chez l’arabette Arabidopsis thaliana, une seule protéine (l'histone H2A.Z) joue ce rôle pour des variations de température de moins de 1 °C. Cette protéine modifie l’enroulement de l’ADN sur lui-même et contrôle ainsi l’accès à l’ADN de certaines molécules inhibant ou activant plusieurs dizaines de gènes. Cet effet « bio-thermostat » semble fréquent dans la nature, car également détecté chez des organismes aussi différents que la levure et une crucifère commune[27],[28].
La compréhension de ces mécanismes devrait aussi aider à mieux comprendre certains effets (sur les gènes) du dérèglement climatique.
Métabonomique
La métabonomique mesure l'empreinte des perturbations biochimiques causées par les maladies, les médicaments ou des produits toxiques. Introduite dans les années 1980, la métabonomique (Nicholson et al. 1999)[Quoi ?] n'a commencé à jouer un rôle important en Recherche & Développement dans l’industrie pharmaceutique que récemment. Cette technologie, complémentaire de la génomique et de la protéomique, permet par exemple de caractériser les modèles animaux de diverses pathologies afin d’identifier de nouvelles cibles pharmacologiques. La particularité de la métabonomique est l'analyse simultanée d'un très grand nombre de métabolites (petites molécules issues du métabolisme) dans les milieux biologiques tels que l'urine, le plasma... Des outils de screening (exploration large et systématique) métabolique tels que la Résonance Magnétique Nucléaire et la Spectrométrie de Masse sont utilisés afin d’identifier des marqueurs (ou des séries de marqueurs = profils métaboliques) de toxicité, dans le but de déceler, tôt dans le cycle de développement, les médicaments candidats qui présenteront des effets indésirables. Idéalement, les biomarqueurs identifiés en phase préclinique seront non-invasifs et utilisables en phase clinique pour suivre le déclenchement, la progression et la guérison d’une pathologie. Afin d’identifier de nouveaux métabolites marqueurs de toxicité, il est également nécessaire de connaître les variations dites « normales » du pool métabolique (effet du cycle diurne, du stress, du régime alimentaire, de la perte de poids, etc.). Il est ainsi possible de découvrir les perturbations métaboliques qui sont spécifiques de la pathologie étudiée.
Autre contenu sémantique
Métaphoriquement et par extension on parle parfois de métabolisme urbain, industriel social[29],[30] ou sociétal[31] pour décrire les intrants (ressources naturelles, foncières, humaines..) et extrants (déchets) qui caractérisent ces systèmes.
Notes et références
- (en) Cornelius G. Friedrich, « Physiology and Genetics of Sulfur-oxidizing Bacteria », Advances in Microbial Physiology, vol. 39, , p. 235-289 (lire en ligne) DOI 10.1016/S0065-2911(08)60018-1
- (en) Norman R. Pace, « The universal nature of biochemistry », Proceedings of the National Academy of Sciences of the United States of America, vol. 98, no 3, , p. 805-808 (lire en ligne) DOI 10.1073/pnas.98.3.805
- (en) Eric Smith et Harold J. Morowitz, « Universality in intermediary metabolism », Proceedings of the National Academy of Sciences of the United States of America, vol. 101, no 36, , p. 13168-13173 (lire en ligne) DOI 10.1073/pnas.0404922101
- (en) Oliver Ebenhöh et Reinhart Heinrich, « Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems », Bulletin of Mathematical Biology, vol. 63, no 1, , p. 21-55 (lire en ligne) DOI 10.1006/bulm.2000.0197
- (en) Enrique Meléndez-Hevia, Thomas G. Waddell et Marta Cascante, « The puzzle of the Krebs citric acid cycle: Assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution », Journal of Molecular Evolution, vol. 43, no 3, , p. 293-303 (lire en ligne) DOI 10.1007/BF02338838
- (en) Katharine A. Michie et Jan Löwe, « Dynamic Filaments of the Bacterial Cytoskeleton », Annual Review of Biochemistry, vol. 75, , p. 467-492 (lire en ligne) DOI 10.1146/annurev.biochem.75.103004.142452
- (en) A. L. McCall, W. R. Millington et R. J. Wurtman, « Metabolic fuel and amino acid transport into the brain in experimental diabetes mellitus », Proceedings of the National Academy of Sciences of the United States of America, vol. 79, no 17, , p. 5406-5410 (PMID 6752947, PMCID 346906, lire en ligne)
- (en) John S. Hothersall et Aamir Ahmed, « Metabolic Fate of the Increased Yeast Amino Acid Uptake Subsequent to Catabolite Derepression », Journal of Amino Acids, vol. 2013, , e461901 (PMCID 3575661, lire en ligne) DOI 10.1155/2013/461901
- (en) Eoin Fahy, Shankar Subramaniam, H. Alex Brown, Christopher K. Glass, Alfred H. Merrill Jr., Robert C. Murphy, Christian R. H. Raetz, David W. Russell, Yousuke Seyama, Walter Shaw, Takao Shimizu, Friedrich Spener, Gerrit van Meer, Michael S. VanNieuwenhze, Stephen H. White, Joseph L. Witztum et Edward A. Dennis, « A comprehensive classification system for lipids », Journal of Lipid Research, vol. 46, , p. 839-862 (lire en ligne) DOI 10.1194/jlr.E400004-JLR200
- (en) Fausto G. HEGARDT, « Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis », Biochemical Journal, vol. 338, , p. 569-582 (PMCID 1220089, lire en ligne) DOI 10.1042/0264-6021:3380569
- (en) Rahul Raman, S. Raguram, Ganesh Venkataraman, James C. Paulson et Ram Sasisekharan, « Glycomics: an integrated systems approach to structure-function relationships of glycans », Nature Methods, vol. 2, , p. 817-824 (lire en ligne) DOI 10.1038/nmeth807
- (en) Saleta Sierra, Bernd Kupfer et Rolf Kaiser, « Basics of the virology of HIV-1 and its replication », Journal of Clinical Virology, vol. 34, no 4, , p. 233-244 (lire en ligne) DOI 10.1016/j.jcv.2005.09.004
- (en) Peter MITCHELL, « Compartmentation and Communication in Living Systems. Ligand Conduction: a General Catalytic Principle in Chemical, Osmotic and Chemiosmotic Reaction Systems », European Journal of Biochemistry, vol. 95, no 1, , p. 1-20 (lire en ligne) DOI 10.1111/j.1432-1033.1979.tb12934.x
- (en) M. J. Wimmer et I. A. Rose, « Mechanisms of Enzyme-Catalyzed Group Transfer Reactions », Annual Review of Biochemistry, vol. 47, , p. 1031-1078 (lire en ligne) DOI 10.1146/annurev.bi.47.070178.005123
- (en) Peter Dimroth, Christoph von Ballmoos et T. Meier, « Catalytic and mechanical cycles in F-ATP synthases », EMBO reports, vol. 7, , p. 276-282 (PMCID 1456893, lire en ligne) DOI 10.1038/sj.embor.7400646
- (en) Nadine POLLAK, Christian DÖLLE et Mathias ZIEGLER, « The power to reduce: pyridine nucleotides – small molecules with a multitude of functions », Biochemical Journal, vol. 402, , p. 205-218 (PMCID 1798440, lire en ligne) DOI 10.1042/BJ20061638
- (en) S. B. Heymsfield, M. Waki, J. Kehayias, S. Lichtman, F. A. Dilmanian, Y. Kamen, J. Wang et R. N. Pierson Jr, « Chemical and elemental analysis of humans in vivo using improved body composition models », American Journal of Physiology - Endocrinology and Metabolism, vol. 261, , E190-E198 (lire en ligne)
- (en) A.F. Dulhunty, « EXCITATION–CONTRACTION COUPLING FROM THE 1950s INTO THE NEW MILLENNIUM », Clinical and Experimental Pharmacology and Physiology, vol. 33, no 9, , p. 763-772 (lire en ligne) DOI 10.1111/j.1440-1681.2006.04441.x
- (en) D. C. Mahan et R. G. Shields Jr, « Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight », Journal of Animal Science, vol. 76, no 2, , p. 506-512 (lire en ligne)
- (en) Søren Husted, Birgitte F. Mikkelsen, Jacob Jensen et Niels Erik Nielsen, « Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics », Analytical and Bioanalytical Chemistry, vol. 378, no 1, , p. 171-182 (lire en ligne) DOI 10.1007/s00216-003-2219-0
- (en) Lydia A. Finney, Thomas V. O'Halloran, « Transition Metal Speciation in the Cell: Insights from the Chemistry of Metal Ion Receptors », Science, vol. 300, no 5621, , p. 931-936 (lire en ligne) DOI 10.1126/science.1085049
- (en) Robert J. Cousins, Juan P. Liuzzi et Louis A. Lichten, « Mammalian Zinc Transport, Trafficking, and Signals », Journal of Biological Chemistry, vol. 281, , p. 24085-24089 (lire en ligne) DOI 10.1074/jbc.R600011200
- (en) Louise L. Dunn, Yohan Suryo Rahmanto et Des R. Richardson, « Iron uptake and metabolism in the new millennium », Trends in Cell Biology, vol. 17, no 2, , p. 93-100 (lire en ligne) DOI 10.1016/j.tcb.2006.12.003
- Gillooly JF, Brown JH, West GB, Savage VM, Charnov EL (2001) Effects of size and temperature on metabolic rate. Science, 293, 2248–2251.
- Clarke A, Johnston N (1999) Scaling of metabolic rate with body mass and temperature in teleost fish . Journal of Animal Ecology, 68, 893–905.
- Clarke A (2004) Is there a universal temperature dependence of metabolism ? Functional Ecology, 18, 252–256.
- S.V. Kumar et P.A. Wigge, H2A.Z-containing nucleosomes mediate the thermosensory response in Arabidopsis, Cell, vol. 140, pp. 136-147, 2010
- Brève du journal Pour la Science (par Jean-Jacques Perrier, 2010/01/25)
- Fischer-Kowalski, M. (2011) Analyzing sustainability transitions as shifts between sociometabolic regimes. In: Environmental Innovation and Societal Transitions
- Fischer-Kowalski, M. and H. Haberl (2007) Socioecological transitions and global change: Trajectories of Social Metabolism and Land Use. Edward Elgar, Cheltenham, UK and Northhampton, USA.
- Eisenmenger, N. and Giljum, S. (2006) “Evidence from Societal Metabolism Studies for Ecological Unequal Trade” ; In: A. Hornborg and C.L. Crumley (eds.). The World System and the Earth System. Global Socio-Environmental Change and Sustainability since the Neolithic. Left Coast Press Inc.: Walnut Creek, California. 288-302.
Annexes
Articles connexes
Bibliographie
- Brown JH, Gillooly JF, Allen AP, Savage VM, West GB (2004) Toward a metabolic theory of ecology. Ecology, 85, 1771–1789.
Nicholson JK, Lindon JC, Holmes E. ‘Metabonomics’ : understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data. Xenobiotica 1999 ; 29 : 1181-9.
Liens externes
- Les principales voies du métabolisme : un cours de Biochimie sur wikilivres
- Interactive flow chart of the major metabolic pathways (engl.)
- Le métabolisme interactif, Université P& M Curie
- « métabolisme »
Modèle:Lien AdQ Modèle:Lien AdQ Modèle:Lien AdQ Modèle:Lien AdQ Modèle:Lien AdQ Modèle:Lien AdQ Modèle:Lien AdQ Modèle:Lien BA
