« Tyrosine » : différence entre les versions
Cet Acide Aminé absorbe dans l'UV à 275 et non 280nm. (Source cours médecine) |
absorption UV : correction lambda max + source |
||
| Ligne 178 : | Ligne 178 : | ||
Elle est [[Biosynthèse des protéines|synthétisée]] par le [[corps humain]], à partir de la [[phénylalanine]], sauf dans un cas, plus ou moins marqué, de [[phénylcétonurie]] (maladie résultant d'une accumulation de phénylalanine dans le sang, due à l'affaiblissement d'une enzyme hydroxylase : la [[phénylalanine hydroxylase]]). {{Référence nécessaire|Elle est donc indispensable, en présence de [[phénylalanine]]}}, et se trouve être un marqueur signifiant de la présence de [[phénylalanine]] dans l'environnement. |
Elle est [[Biosynthèse des protéines|synthétisée]] par le [[corps humain]], à partir de la [[phénylalanine]], sauf dans un cas, plus ou moins marqué, de [[phénylcétonurie]] (maladie résultant d'une accumulation de phénylalanine dans le sang, due à l'affaiblissement d'une enzyme hydroxylase : la [[phénylalanine hydroxylase]]). {{Référence nécessaire|Elle est donc indispensable, en présence de [[phénylalanine]]}}, et se trouve être un marqueur signifiant de la présence de [[phénylalanine]] dans l'environnement. |
||
Le noyau aromatique de la tyrosine (ou parahydroxy phénylalanine) comprend un groupement hydroxyl qui rend sa chaine latérale moins hydrophobe que celle de la phénylalanine (mais la tyrosine est un acide aminé nettement moins soluble dans l'eau que la phénylalanine). Le groupement phénol (benzène+hydroxyle) lui confère une absorption dans l'UV à {{unité| |
Le noyau aromatique de la tyrosine (ou parahydroxy phénylalanine) comprend un groupement hydroxyl qui rend sa chaine latérale moins hydrophobe que celle de la phénylalanine (mais la tyrosine est un acide aminé nettement moins soluble dans l'eau que la phénylalanine). Le groupement phénol (benzène+hydroxyle) lui confère une absorption dans l'UV à {{unité|277|nm}} |
||
<ref name="spectro">{{Chapitre |
|||
| langue = en |
|||
| auteur1 = J.B.A. Ross |
|||
| auteur2 = W.R. Laws |
|||
| auteur3 = K.W. Rousslang |
|||
| auteur4 = H.R. Wyssbrod |
|||
| titre chapitre = Tyrosine Fluorescence and Phosphorescence from Proteins and Polypeptides |
|||
| auteurs ouvrage = J.R. Lakowicz |
|||
| titre ouvrage = Topics in Fluorescence Spectroscopy |
|||
| volume = 3 |
|||
| titre volume = Biochemical applications |
|||
| lieu = New-York |
|||
| éditeur = Springer |
|||
| isbn = 978-0-306-47059-2 |
|||
| dnb = |
|||
| doi = 10.1007/b112909 |
|||
| lire en ligne = https://link.springer.com/content/pdf/10.1007/0-306-47059-4_1.pdf |
|||
| consulté le = 11 septembre 2018 |
|||
| page début chapitre = 1 |
|||
}}</ref> |
|||
. Sa fonction hydroxyle lui permet d'être phosphorylée par des [[enzyme]]s appelés [[kinase]]s. La phosphorylation d'un acide aminé a très souvent un rôle de régulation de l'activité de l'enzyme elle-même. La [[thréonine]] et la [[sérine]] sont deux autres acides aminés pouvant subir la même [[phosphorylation]]. La tyrosine peut également subir une sulfatation ou une hydroxylation. |
|||
La tyrosine peut également être modifiée en (3-)nitrotyrosine. Cette réaction de nitration peut affecter la tyrosine en tant qu'acide aminé libre ou que résidu d'acide aminé intégré dans une chaîne polypeptidique. ''In vivo'', cette réaction est majoritairement due à l'action de l'acide péroxynitreux (ou péroxynitrite, ONOOH), mais d'autres voies réactionnelles peuvent également aboutir à la formation de nitrotyrosine. ''In vitro'', le [[tétranitrométhane]] (TNM) a aussi été utilisé dans ce but. La nitration de tyrosines est généralement vue comme un phénomène pathologique (''e.g.'' l'augmentation de la concentration plasmatique de nitrotyrosine est considérée comme un [[biomarqueur]] de phénomènes inflammatoires), bien que la possibilité que cette réaction soit également un phénomène physiologique ait récemment été suggérée. |
La tyrosine peut également être modifiée en (3-)nitrotyrosine. Cette réaction de nitration peut affecter la tyrosine en tant qu'acide aminé libre ou que résidu d'acide aminé intégré dans une chaîne polypeptidique. ''In vivo'', cette réaction est majoritairement due à l'action de l'acide péroxynitreux (ou péroxynitrite, ONOOH), mais d'autres voies réactionnelles peuvent également aboutir à la formation de nitrotyrosine. ''In vitro'', le [[tétranitrométhane]] (TNM) a aussi été utilisé dans ce but. La nitration de tyrosines est généralement vue comme un phénomène pathologique (''e.g.'' l'augmentation de la concentration plasmatique de nitrotyrosine est considérée comme un [[biomarqueur]] de phénomènes inflammatoires), bien que la possibilité que cette réaction soit également un phénomène physiologique ait récemment été suggérée. |
||
Version du 11 septembre 2018 à 17:33
| Tyrosine | |
 L ou S(–)-tyrosine 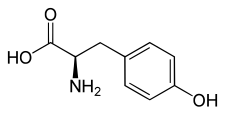 D ou R(+)-tyrosine |
|
| Identification | |
|---|---|
| Nom UICPA | acide (S)-2-amino-3-(4-hydroxyphényl)propanoïque |
| Synonymes |
Y, Tyr |
| No CAS | (racémique) (L) ou S(–) (D) ou R |
| No ECHA | 100.000.419 |
| No CE | 200-460-4 |
| DrugBank | DB00135 |
| PubChem | 6057 |
| ChEBI | 18186 |
| FEMA | 3736 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C9H11NO3 [Isomères] |
| Masse molaire[2] | 181,188 5 ± 0,009 1 g/mol C 59,66 %, H 6,12 %, N 7,73 %, O 26,49 %, |
| pKa | 2,2 pour l'acide ; 9,11 pour la base et 10,07 pour le groupement phénol [1] |
| Propriétés physiques | |
| T° fusion | 343 °C (décomposition) [1] |
| Solubilité | 479 mg·l-1 (eau,25 °C) [1] |
| Thermochimie | |
| S0solide | 214,01 J·mol-1·K-1 [3] |
| ΔfH0solide | −685,6 kJ·mol-1 [3] |
| Cp | 216,44 J·mol-1·K-1 (solide,25 °C)[3] |
| Propriétés biochimiques | |
| Codons | UAU, UAC |
| pH isoélectrique | 5,66[4] |
| Acide aminé essentiel | selon les cas |
| Occurrence chez les vertébrés | 3,3 %[5] |
| Précautions | |
| SIMDUT[6] | |
Produit non contrôlé |
|
| Écotoxicologie | |
| LogP | -2.26 [1] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La tyrosine (abréviations IUPAC-IUBMB : Tyr et Y) est un acide α-aminé dont l'énantiomère L est l'un des 22 acides aminés protéinogènes, encodé sur les ARN messagers par les codons UAU et UAC. Elle est caractérisée par un groupe phénol dont l'hydroxyle est légèrement acide. Elle n'est pas essentielle pour l'humain mais peut néanmoins être produite en quantité insuffisante par l'organisme dans certains cas particuliers, nécessitant alors un apport alimentaire.
La tyrosine participe à la synthèse des catécholamines : l'adrénaline, la noradrénaline, la dopamine et la DOPA. Elle est aussi précurseur de la mélanine (pigment qui colore la peau, les poils, l'iris) et des hormones thyroïdiennes (formation de thyronine à partir de deux tyrosines).

Elle est synthétisée par le corps humain, à partir de la phénylalanine, sauf dans un cas, plus ou moins marqué, de phénylcétonurie (maladie résultant d'une accumulation de phénylalanine dans le sang, due à l'affaiblissement d'une enzyme hydroxylase : la phénylalanine hydroxylase). Elle est donc indispensable, en présence de phénylalanine[réf. nécessaire], et se trouve être un marqueur signifiant de la présence de phénylalanine dans l'environnement.
Le noyau aromatique de la tyrosine (ou parahydroxy phénylalanine) comprend un groupement hydroxyl qui rend sa chaine latérale moins hydrophobe que celle de la phénylalanine (mais la tyrosine est un acide aminé nettement moins soluble dans l'eau que la phénylalanine). Le groupement phénol (benzène+hydroxyle) lui confère une absorption dans l'UV à 277 nm [7] . Sa fonction hydroxyle lui permet d'être phosphorylée par des enzymes appelés kinases. La phosphorylation d'un acide aminé a très souvent un rôle de régulation de l'activité de l'enzyme elle-même. La thréonine et la sérine sont deux autres acides aminés pouvant subir la même phosphorylation. La tyrosine peut également subir une sulfatation ou une hydroxylation.
La tyrosine peut également être modifiée en (3-)nitrotyrosine. Cette réaction de nitration peut affecter la tyrosine en tant qu'acide aminé libre ou que résidu d'acide aminé intégré dans une chaîne polypeptidique. In vivo, cette réaction est majoritairement due à l'action de l'acide péroxynitreux (ou péroxynitrite, ONOOH), mais d'autres voies réactionnelles peuvent également aboutir à la formation de nitrotyrosine. In vitro, le tétranitrométhane (TNM) a aussi été utilisé dans ce but. La nitration de tyrosines est généralement vue comme un phénomène pathologique (e.g. l'augmentation de la concentration plasmatique de nitrotyrosine est considérée comme un biomarqueur de phénomènes inflammatoires), bien que la possibilité que cette réaction soit également un phénomène physiologique ait récemment été suggérée.
Applications thérapeutiques
Henri Laborit fut un des premiers chercheurs à l'employer et à obtenir les brevets mondiaux d'application thérapeutique, dans le traitement des états de choc, des dépressions, de l'hypertension artérielle et de la maladie de Parkinson. Il dut abandonner car il ne trouva personne à l'époque pour les exploiter.
Trouble du déficit de l'attention
L'administration de tyrosine par voie orale, en conjonction avec le 5-HTP (précurseur immédiat de la sérotonine) et un certain nombre de cofacteurs et d'adjuvants[8], a causé une amélioration significative chez 67 % des 85 participants dans un essai clinique sur le trouble du déficit de l'attention avec hyperactivité. À la suite d'un ajustement de la dose basé sur l'excrétion de métabolites urinaires chez ceux qui ne répondaient pas au traitement, le taux de succès s'élevait à 77 %. Il a été fréquemment observé que l'administration de tyrosine n'était pas suffisante, et que la DOPA, sous forme d'extrait standardisé à 40 % de la plante mucuna pruniens (pois mascate) était nécessaire pour atteindre les hausses de catécholamines souhaitées (telles qu'évaluées par la mesure de métabolites urinaires)[9]. Les auteurs de l'étude font remarquer que le degré d'innocuité de ce protocole se compare avantageusement aux méthodes pharmacologiques couramment employées (par exemple, le méthylphénidate (ritaline))[10].
Aliments sources de tyrosine
Comme tous les acides aminés, la tyrosine est présente là où il y a des protéines.
On trouve notamment de la tyrosine dans les aliments suivants :
- amande ;
- avocat ;
- banane ;
- fève de Lima ;
- graine de citrouille ;
- graine de sésame ;
- fromages à pâte dure ;
- soja ;
- jambon cru.
Cependant, la quantité de tyrosine ingérée ne dépendra pas seulement de ses concentrations dans un aliment donné, mais aussi de la quantité totale consommée. Par exemple, il est plus rare que l'on consomme autant de protéines en mangeant des graines de sésame ou de citrouille que l'on en consomme en mangeant des fèves.
On peut observer de petites étoiles blanches visibles sur la tranche de section de certains fromages à pâte dure comme le parmesan et le comté[11]. Ce sont des cristaux de tyrosine, qui attestent de la protéolyse qui a eu lieu lors de la maturation du fromage. Cette tyrosine peu soluble dans l'eau se rassemble en fines cristallisations.
Action dans le corps humain
La tyrosine intervient dans la synthèse de la mélanine, le pigment naturel de la peau et des cheveux, et dans celle de la thyroxine, l'hormone thyroïdienne. Fin 2017, des recherches[Lesquelles ?] ont émis la possibilité de mort cérébrale suite a la prise en excès, par voie intra veineuse ou voie respiratoire.
Elle a une action sur la dépression ou l’anxiété et intervient dans la formation du neurotransmetteur épinéphrine dans la médullosurrénale[12]. Elle est aussi considérée comme un antioxydant.
Un athlète ou un bodybuilder qui s'entraîne intensivement peut tirer profit d'un complément de L Tyrosine qui, en affectant directement les niveaux de dopamine, peut aider à combattre la fatigue et le stress associés à des séances d'entraînement lourdes et intensives. Certaines études semblent aussi indiquer que la L Tyrosine pourrait être utile dans la perte de poids.
Notes et références
- (en) « Tyrosine », sur ChemIDplus, consulté le 8 juillet 2009
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Tyrosine », sur NIST/WebBook, consulté le 8 juillet 2009
- (en) Francis A. Carey, « Table of pKa and pI values », sur Département de chimie de l'université de Calgary, (consulté le )
- (en) M. Beals, L. Gross, S. Harrell, « Amino Acid Frequency », sur The Institute for Environmental Modeling (TIEM) à l'université du Tennessee (consulté le )
- « Tyrosine (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) J.B.A. Ross, W.R. Laws, K.W. Rousslang et H.R. Wyssbrod, « Tyrosine Fluorescence and Phosphorescence from Proteins and Polypeptides », dans J.R. Lakowicz, Topics in Fluorescence Spectroscopy, vol. 3 : Biochemical applications, New-York, Springer (ISBN 978-0-306-47059-2, DOI 10.1007/b112909, lire en ligne)
- Il s'agissait de cofacteurs nécessaires à la synthèse de catécholamines et de sérotonine ainsi que de molécules utiles pour augmenter l'efficacité du traitement : vitamine C : 1 000 mg ; calcium (citrate) : 220 mg ; vitamine B6 : 75 mg ; acide folique : 400 μg ; lysine : 500 mg ; cystéine : 4 500 mg chez les adultes, 2 250 mg chez les enfants ; sélénium : 400 μg chez les adultes et 200 μg chez les enfants. Voir tyrosine hydroxylase et tryptophane hydroxylase.
- La DOPA et le 5HTP sont les précurseurs immédiats de la dopamine et de la sérotonine, respectivement, et les enzymes les synthétisant (tyrosine hydroxylase et tryptophane hydroxylase sont limitantes)
- (en) Hinz M, Stein A, Neff R, Weinberg R, Uncini T, « Treatment of attention deficit hyperactivity disorder with monoamine amino acid precursors and organic cation transporter assay interpretation », Neuropsychiatr Dis Treat, vol. 7, , p. 31–8 (PMID 21326653, PMCID 3035600, DOI 10.2147/NDT.S16270, lire en ligne)
- http://www.produits-laitiers.com/2012/10/15/question-pas-bete-cest-quoi-ces-cristaux-de-sel-dans-mon-fromage/
- (en) McLean A, Rubinsztein JS, Robbins TW, Sahakian BJ., « The effects of tyrosine depletion in normal healthy volunteers: implications for unipolar depression. », Psychopharmacology, vol. 171, no 3, , p. 286-97. (PMID 12955284, lire en ligne)


