Hydrure d'aluminium
Alane
| Hydrure d'aluminium | |

| |
| __ Al3+ __ H– Structure cristalline de l'hydrure d'aluminium α. |
|
| Identification | |
|---|---|
| Nom systématique | trihydrure d'aluminium |
| Synonymes |
alane |
| No CAS | |
| No ECHA | 100.029.139 |
| No CE | 232-053-2 |
| PubChem | 14488 |
| ChEBI | 30136 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | AlH3 |
| Masse molaire[1] | 30,005 36 ± 0,000 21 g/mol H 10,08 %, Al 89,92 %, |
| Propriétés physiques | |
| T° fusion | 100 °C[2] (décomposition) |
| Masse volumique | 1,48 g·cm-3[2] |
| Précautions | |
| SGH[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'hydrure d'aluminium, ou alane, est un composé chimique de formule AlH3. Il se présente sous la forme d'une poudre blanche tirant sur le gris lorsque la taille des grains diminue ainsi que lorsque le taux d'impuretés croît. Il est soluble dans le tétrahydrofurane (THF) et dans l'éther diéthylique ; le taux de précipitation d'alane solide depuis une solution d'éther dépend de la méthode de préparation. Très sensible à l'humidité et à l'oxydation, la surface des grains peut être passivée par une fine couche d'alumine Al2O3 ou d'hydroxyde d'aluminium Al(OH)3. Il se décompose en ses constituants lorsqu'il est chauffé au-dessus de 100 °C.
L'alane brûle de manière explosive dans l'air. On connaît plusieurs polymorphes cristallins d'hydrure d'aluminium, notés α, α’, β, γ, δ, ε, ζ, etc. Les phases α et α’ sont les plus étudiées. L'alane α cristallise dans le système cubique ou dans le système trigonal à réseau rhomboédrique tandis que l'alane α’ forme des cristaux en forme d'aiguilles et l'alane γ forme des faisceaux d'aiguilles.
La stabilité sous vide de l'hydrure d'aluminium α peut être sensiblement augmentée en incorporant une fraction massique de 0,01 à 3 % de magnésium[4]. Sa résistance à l'hydrolyse peut également être améliorée par recuit. Sous forme passivée, l'alane est un bon candidat pour les applications de stockage de l'hydrogène pour véhicules à hydrogène ainsi que pour les technologies de production d'électricité par piles à combustibles haut rendement pour applications légères et voitures électriques. L'alane contient une fraction massique d'hydrogène atteignant 10 % du matériau, soit 148 g/L, près du double de l'hydrogène liquide cryogénique à pression atmosphérique (71 g/L). Sous forme non passivée, il fait l'objet de recherches pour des applications comme additif énergétique pour explosifs et dopant pour propergols dans l'astronautique[5], dont il permettrait d'accroître les performances jusqu'à 10 %[6].
La molécule AlH3 seule a été isolée dans une matrice de gaz noble à basse température et s'est révélée être plane[7].
Préparation
Les hydrures d'aluminium et leurs complexes sont connus de longue date[8], une publication de 1947 rapportant déjà la synthèse de tels composés[9]. On obtient de l'hydrure d'aluminium en traitant de l'aluminohydrure de lithium LiAlH4 avec du chlorure d'aluminium AlCl3 en éliminant soigneusement le chlorure de lithium LiCl :
Les solutions d'hydrure d'aluminium dans l'éther diéthylique doivent être utilisées rapidement car l'alane tend à précipiter rapidement et ces solutions se dégradent généralement après trois jours ; AlH3 est plus réactif que LiAlH4.
Il existe plusieurs autres voies de synthèse pour la préparation de l'hydrure d'aluminium :
- 2 LiAlH4 + BeCl2 ⟶ 2 AlH3 + Li2BeH2Cl2 :
- 2 LiAlH4 + H2SO4 ⟶ 2 AlH3 + Li2SO4 + 2 H2 ;
- 2 LiAlH4 + ZnCl2 ⟶ 2 AlH3 + 2 LiCl + ZnH2 (en) ;
- 2 LiAlH4 + I2 ⟶ 2 AlH3 + 2 LiI + H2.
Synthèse électrochimique
Plusieurs équipes ont obtenu de l'hydrure d'aluminium par voie élecrochimique[10],[11],[12],[13], et plusieurs méthodes de production électrochimique d'hydrure d'aluminium ont été brevetées[14],[15]. L'intérêt de ces procédés est qu'ils permettent d'obtenir de l'hydrure d'aluminium sans impuretés de chlorure. Deux réactions se produisent dans la pile électrochimique de Clasen, constituée de THF comme solvant, d'aluminohydrure de sodium NaAlH4 comme électrolyte, d'une anode en aluminium et d'un fil de fer immergé dans du mercure comme cathode. Le sodium forme un amalgame avec le mercure de la cathode, ce qui évite les réactions parasites, tandis que l'hydrogène produit par la première réaction est piégé et réagit avec l'amalgame de mercure et de sodium pour produire de l'hydrure de sodium NaH. Ce système permet de ne pas perdre de matière initiale. La réaction (1) se produit avec les anodes insolubles, tandis que la dissolution anodique de la réaction (2) se produit pour les anodes solubles :
L'anode en aluminium est progressivement dissoute au cours de la réaction (2), ce qui limite la production d'hydrure d'aluminium pour une cellule électrochimique donnée.
La cristallisation et la récupération d'hydrure d'aluminium généré par voie électrochimique a été démontrée par l'équipe de R. Zidan[12],[13], à l'origine du brevet US[15].
Hydrogénation de l'aluminium à haute pression
Il est également possible de produire de l'hydrure d'aluminium α par hydrogénation directe d'aluminium à 600 °C sous 10 GPa, ce qui donne de l'AlH3 α pouvant être récupéré à température ambiante[16].
Réactions
Formation d'adduits avec des bases de Lewis
L'hydrure d'aluminium forme facilement des adduits avec les bases de Lewis fortes. Il se forme par exemple les complexes 1:1 et 1:2 avec la triméthylamine. Le complexe 1:1 est tétraédrique en phases gazeuse, mais dimérise à l'état solide avec des atomes d'hydrogène pontants (NMe3Al(μ-H))2[17]. Le complexe 1:2 présente quant à lui une géométrie bipyramidale trigonale[18]. Certains adduits, comme le diméthyléthylamine alane NMe2Et·AlH3 se décomposent sous l'effet de la chaleur pour donner de l'aluminium et peuvent être employés en épitaxie en phase vapeur aux organométalliques (MOCVD)[19].
L'hydrure d'aluminium forme un complexe avec l'éther diéthylique (C2H5)2O, tandis qu'il réagit avec l'hydrure de lithium LiH pour donner de l'aluminohydrure de lithium LiAlH4 :
Réduction de groupes fonctionnels
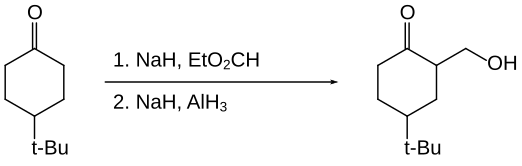
En chimie organique, l'hydrure d'aluminium est utilisé essentiellement pour la réduction de groupes fonctionnels[20]. L'hydrure d'aluminium présente une réactivité à bien des égards semblable à celle de l'aluminohydrure de lithium. L'hydrure d'aluminium réduit les aldéhydes, les cétones, les acides carboxyliques, les anhydrides d'acides, les chlorures d'acyle, les esters et les lactones en leur alcool correspondant. Les amides, les nitriles et les oximes sont réduits en leur amine correspondante. L'hydrure d'aluminium diffère cependant des autres hydrures par sa sélectivité vis-à-vis des différents groupes fonctions. Ainsi, au cours de la réduction d'une cyclohexanone substituée comme représentée ci-dessous, l'aluminohydrure de lithium donne un ratio trans:cis de 1,9:1 tandis que l'hydrure d'aluminium donne un ratio trans:cis de 7,3:1[21] :
L'hydrure d'aluminium permet l'hydroxyméthylation de certaines cétones, c'est-à-dire le remplacement d'un C–H par un groupe C–CH2OH au niveau du carbone α[22]. La cétone elle-même n'est pas réduite car protégée sous forme d'énolate.
L'hydrure d'aluminium peut réduire lentement des halocarbures. Les groupes fonctionnels réactifs comme les acides carboxyliques peuvent être réduits en présence d'halogénures[23] :
-
Conversion d'un acide carboxylique en alcool primaire.
Les groupes nitro ne sont pas réduits par l'hydrure d'aluminium, de sorte que LaH3 peut réduire un groupe ester sans affecter les groupes nitro[24] :
AlH3 peut réduire les acétals en diols[25] :
AlH3 peut également ouvrir un cycle époxyde[26] :
Il est possible de réaliser un réarrangement allylique avec AlH3, qui est une substitution nucléophile SN2[27] :
AlH3 réduit le dioxyde de carbone CO2 en méthane CH4[28] :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie, 102e éd., Walter de Gruyter, 2007. (ISBN 978-3-11-017770-1)
- « Aluminium trihydride », sur https://echa.europa.eu/fr/, ECHA (consulté le ).
- (en) N. E. Matzek et H. C. Roehrs, Brevet U.S. 3857922A : Stabilization of light metal hydride, déposé le 13 juillet 1965, publié le 31 décembre 1974, sur Google Patents.
- (en) Volker Weiser, Norbert Eisenreich, Andreas Koleczko et Evelin Roth, « On the Oxidation and Combustion of AlH3 a Potential Fuel for Rocket Propellants and Gas Generators », Propellants, Explosives, Pyrotechnics, vol. 32, no 3, , p. 213-221 (DOI 10.1002/prep.200700022, lire en ligne)
- (en) M. Calabro, « Overview on hybrid propulsion », EUCASS Proceedings Series, vol. 2, , p. 353-374 (DOI 10.1051/eucass/201102353, Bibcode 2011EUCAS...2..353C, lire en ligne)
- (en) Fabian A. Kurth, Robert A. Eberlein, Hansgeorg Schnöckel, Anthony J. Downs et Colin R. Pulham, « Molecular aluminium trihydride, AlH3: generation in a solid noble gas matrix and characterisation by its infrared spectrum and Ab initio calculations », Journal of the Chemical Society, Chemical Communications, no 16, , p. 1302-1304 (DOI 10.1039/C39930001302, lire en ligne)
- (en) Frank M. Brower, Norman E. Matzek, Paul F. Reigler, Harold W. Rinn, Charles B. Roberts, Donald L. Schmidt, John A. Snover et Kazuji Terada, « Preparation and properties of aluminum hydride », Journal of the American Chemical Society, vol. 98, no 9, , p. 2450-2453 (DOI 10.1021/ja00425a011, lire en ligne)
- (en) A. E. Finholt, A. C. Bond Jr. et H. I. Schlesinger, « Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry », Journal of the American Chemical Society, vol. 69, no 5, , p. 1199-1203 (DOI 10.1021/ja01197a061, lire en ligne)
- (ru) Ninel M. Alpatova, T. N. Dymova, Yu M. Kessler et O. R. Osipov, « Physicochemical Properties and Structure of Complex Compounds of Aluminium Hydride », Russian Chemical Reviews, vol. 37, no 2, , p. 99-114 (DOI 10.1070/RC1968v037n02ABEH001617, Bibcode 1968RuCRv..37...99A)
- (ru) Kirill N. Semenenko, Boris M. Bulychev et E. A. Shevlyagina, « Aluminium Hydride », Russian Chemical Reviews, vol. 35, no 9, , p. 649-658 (DOI 10.1070/RC1966v035n09ABEH001513, Bibcode 1966RuCRv..35..649S)
- (en) Ragaiy Zidan, Brenda L. Garcia-Diaz, Christopher S. Fewox, Ashley C. Stowe, Joshua R. Gray et Andrew G. Harter, « Aluminium hydride: a reversible material for hydrogen storage », Chemical Communications, vol. 2009, no 25, , p. 3717-3719 (PMID 19557259, DOI 10.1039/B901878F, lire en ligne)
- (en) Michael J. Martínez-Rodríguez, Brenda L. García-Díaz, Joseph A. Teprovich Jr., Douglas A. Knight et Ragaiy Zidan, « Advances in the electrochemical regeneration of aluminum hydride », Applied Physics A, vol. 106, no 3, , p. 545-550 (DOI 10.1007/s00339-011-6647-y, Bibcode 2012ApPhA.106..545M, lire en ligne)
- (de) Hermann Clasen pour Metallgesellschaft AG, « DE Patent 1141623 : Verfahren zur Herstellung von Aluminiumhydrid bzw. aluminiumwasserstoffreicher komplexer Hydride », (consulté le ).
- (en) Ragaiy Zidan pour Savannah River Nuclear Solutions LLC, Brevet U.S. 8470156 : Electrochemical process and production of novel complex hydrides, déposé le 9 août 2007, publié le 25 juin 2013, sur Google Patents..
- (en) H. Saitoh, Y. Sakurai, A. Machida, Y. Katayama et K. Aoki, « In situ X-ray diffraction measurement of the hydrogenation and dehydrogenation of aluminum and characterization of the recovered AlH3 », Journal of Physics: Conference Series, vol. 215, no 1, , article no 012127 (DOI 10.1088/1742-6596/215/1/012127, Bibcode 2010JPhCS.215a2127S, lire en ligne)
- (en) Jerry L. Atwood, Frederick R. Bennett, Fiona M. Elms, Cameron Jones, Colin L. Raston et Kerry D. Robinson, « Tertiary amine stabilized dialane », Journal of the American Chemical Society, vol. 113, no 21, , p. 8183-8185 (DOI 10.1021/ja00021a063, lire en ligne)
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, 2e éd., Butterworth-Heinemann, 1997. (ISBN 978-0-08-037941-8)
- (en) Jong-Ho Yun, Byoung-Youp Kim et Shi-Woo Rhee, « Metal-organic chemical vapor deposition of aluminum from dimethylethylamine alane », Thin Solid Films, vol. 312, nos 1-2, , p. 259-264 (DOI 10.1016/S0040-6090(97)00333-7, Bibcode 1998TSF...312..259Y, lire en ligne)
- (en) Paul Galatsis, Matthieu Sollogoub et Pierre Sinaÿ, « Diisobutylaluminum Hydride », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rd245.pub2, lire en ligne)
- (en) D. C. Ayres et R. Sawdaye, « The stereoselective reduction of ketones by aluminium hydride », Journal of the Chemical Society B: Physical Organic, , p. 581-583 (DOI 10.1039/J29670000581, lire en ligne)
- (en) E. J. Corey et David E. Cane, « Controlled hydroxymethylation of ketones », The Journal of Organic Chemistry, vol. 36, no 20, , p. 3070 (DOI 10.1021/jo00819a047, lire en ligne)
- (en) Margaret Jefraim Jorgenson, « Selective reductions with aluminum hydride », Tetrahedron Letters, vol. 3, no 13, , p. 559-562 (DOI 10.1016/S0040-4039(00)76929-2, lire en ligne)
- (en) Takano Seiichi, Akiyama Masashi, Sato Seiji et Ogasawara Kunio, « A Facile Cleavage of Benzylidene Acetals with Diisobutylaluminum Hydride », Chemistry Letters, vol. 12, no 10, , p. 1593-1596 (DOI 10.1246/cl.1983.1593, lire en ligne)
- (en) Wolf Juergen Richter, « Asymmetric synthesis at prochiral centers: substituted 1,3-dioxolanes », The Journal of Organic Chemistry, vol. 46, no 25, , p. 5119-5124 (DOI 10.1021/jo00338a011, lire en ligne)
- (en) Keiji Maruoka, Susumu Saito, Takashi Ooi et Hisashi Yamamoto, « Selective Reduction of Methylenecycloalkane Oxides with 4-Substituted Diisobutylaluminum 2,6-Di-tert-butylphenoxides », Synlett, vol. 1991, no 4, , p. 255-256 (DOI 10.1055/s-1991-20698, lire en ligne)
- (en) Alf Claesson et Lars-Inge Olsson, « Allenes and acetylenes. 22. Mechanistic aspects of the allene-forming reductions (SN2' reaction) of chiral propargylic derivatives with hydride reagents », The Journal of the American Chemical Society, vol. 101, no 24, , p. 7302-7311 (DOI 10.1021/ja00518a028, lire en ligne)
- (en) « Aluminum Hydride », sur https://cameochemicals.noaa.gov/, CAMEO Chemicals (consulté le ).