Flavonoïde

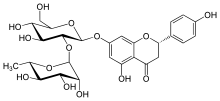
Les flavonoïdes (ou bioflavonoïdes) sont des métabolites secondaires des plantes vasculaires, partageant tous une même structure de base formée par deux cycles aromatiques reliés par trois carbones : C6-C3-C6, chaîne souvent fermée en un hétérocycle oxygéné hexa- ou pentagonal. Certains auteurs, comme Bruneton[1], préfèrent séparer, pour tenir compte de leurs propriétés particulières, les dérivés flavaniques, les anthocyanosides et les isoflavonoïdes, et conserver l'appellation de flavonoïdes stricto sensu pour les autres.
Ils forment une classe de composés polyphénoliques omniprésents dans les plantes vasculaires (y compris les légumes et les céréales) où ils se rencontrent à la fois sous forme libre, ou le plus souvent sous forme de glycosides (hétérosides) dans tous les organes végétatifs et floraux[2]. Ils constituent notamment des pigments impliqués dans la coloration des pétales et des péricarpes, donnant une gamme colorée qui va de ivoire à crème (flavones et flavonols), de jaune à orange (chalcones et aurones), de rouge à bleu (anthocyanes). Ce sont également des molécules de photoprotection interne et externe[3] et qui ont d'autres rôles. En effet, dès leur « sortie des eaux », les végétaux ont abandonné la voie métabolique des acides aminés analogues de la mycosporine et développé un métabolisme phénolique, plus particulièrement celui des flavonoïdes, constituant un élément important de la stratégie végétale pour lutter contre les stress biotiques et abiotiques (exposition aux UV ou au froid, blessures, carence nutritionnelle, défense des plantes contre les herbivores et contre les pathogènes…)[4].
Ces composés suscitent un grand intérêt en raison de leurs nombreux effets bénéfiques pour la santé : leurs propriétés antibactériennes, antivirales, antiagrégants plaquettaires, antiallergiques (de), anti-inflammatoires, anti-tumorales et leurs activités antioxydantes font l'objet d'études in vitro et épidémiologiques dans un but de thérapeutique dans le traitement de certains cancers, de maladies inflammatoires, cardiovasculaires et neurodégénératives. Certains d'entre eux sont également utilisés comme additifs dans les aliments, les produits pharmaceutiques et cosmétiques[5],[6],[7].
Les flavonoïdes ont été découverts en 1936 par Albert Szent-Györgyi, qui a reçu le prix Nobel de physiologie ou médecine en 1937 (voir la section « histoire » en fin d'article). Dans les années 1950, Jacques Masquelier, de l'université de Bordeaux, entreprend une étude des composés flavaniques de l'écorce de pin et des pépins de raisin, puis dépose des brevets sur la purification des procyanidines oligomères (ou pycnogénol) et leurs utilisations thérapeutiques.
Plus de 6 000 ont été décrits chez les plantes.
Étymologie
[modifier | modifier le code]Le mot est issu de flavedo, lui-même dérivé du latin flavus, « jaune », et du grec eidos, « aspect »[8], décrivant en médecine les ictères et l'aspect jaune en général[9] avant de désigner la couche externe des écorces d'oranges[8] ou de citron[10].
Distribution
[modifier | modifier le code]Les flavonoïdes sont largement distribués dans le règne végétal où ils sont présents le plus souvent sous la forme soluble d'hétérosides. Ils sont fréquents chez les Bryophyta (mousses et hépatiques), les Pteridophyta (fougères) et les Gymnospermes (conifères), mais c'est chez les Angiospermes qu'ils manifestent la plus grande diversité.
Ils interviennent dans la symbiose entre les fabacées et les bactéries du groupe rhizobium[11]. Les racines de luzerne relâchent des flavonoïdes qui attirent la bactérie Rhizobium meliloti et induisent chez elle les gènes de nodulation.
Couleur
[modifier | modifier le code]Les flavonoïdes sont des pigments responsables de la coloration des fleurs et des fruits. Ils couvrent une large gamme de couleurs allant du rouge à l'ultraviolet en passant par le jaune. Leur couleur dépend de leur structure mais aussi de l'acidité du milieu (pH). La gamme colorée allant des pigments ivoire à crème vient des flavones et flavonols. Les jaunes à orange viennent des chalcones, aurones ; les rouges et les mauves des anthocyanosides ; les bleus trouvent leurs origines dans les co-pigments flavones-anthocyanosides. L'absorption dans l'ultraviolet produit des motifs perceptibles par les insectes et pouvant les guider vers le nectar[1],[12].
Les pigments colorés des fleurs servent à attirer les insectes pollinisateurs. Ils jouent aussi un rôle dans la protection de la plante contre les UV, ainsi qu'un rôle de défense contre les pathogènes et les insectes ravageurs.
On trouve ces pigments dans le rouge des pommes et des poires, dans les baies de genièvre, le miel, le raisin et le vin.
Les formes hétérosidiques des flavonoïdes sont hydrosolubles et s'accumulent dans les vacuoles.
Sources dans le règne végétal
[modifier | modifier le code]Les flavonoïdes sont naturellement présents dans de nombreuses plantes comme la passiflore, l'aubépine, la reine des prés, le millepertuis, le mélilot, le cassis. Les principales sources alimentaires réparties dans leur classe de flavonoïdes[13] :

- Les flavanones : naringine, naringénine, hespérétine, ériodictyol, gallate d'épigallocatéchine se rencontrent principalement dans le chou, la banane, le kiwi, l'ail, l'olives, l'oignon, les graines germée, le citron.
- Les flavanols : épigallocatéchine, épicatéchine, catéchine, lutéoline dans le thé vert, le vin rouge, le raisin, les fèves de cacao, les abricots, les baies, la pomme.
- Les flavones : nobilétine, diosmine, apigénine, wogonine dans le kiwi, le thé vert, l'origan, les épinards, la laitue, le brocoli, la pastèque, les pois, la fleur de camomille, l'orange, le raisin, la citrouille, le pois chiche, le riz brun, le romarin. Pour la nobelitine, voir le shikuwasa.
- Les flavonols : morine, galangine, kaempférol, malvidine dans les petit pois, les pépins de raisin, la pomme, les agrumes, le soja, les oignons, le concombre, les fraises, les tomates.
- Les anthocyanes : cyanidine, hirsutidine, pélargonidine, génistéine dans les baies rouges, violettes et bleues, le raisin rouge, la grenade, la pomme rouge, l'abricot, les haricots noirs, le chou rouge, la carotte violette, l'aubergine, les pommes de terre colorées, les oignons rouges, les radis rouges ou violets, les céréales colorées.
- Les isoflavones : glycitéine, équol, daidzeine, dans le soja, les préparations à base de soja, les légumineuses, le persil, le tofu, les fèves, le trèfle rouge.
Structure chimique
[modifier | modifier le code]Les flavonoïdes présentent un squelette de base à 15 atomes de carbone, fait de deux cycles benzéniques C6 reliés par une chaîne en C3. Le pont à 3 carbones entre les deux phényles forme généralement un troisième cycle pyrone.
La distinction des sous-classes se fait en fonction de la conformation de cette structure centrale C. On peut distinguer notamment parmi les flavonoïdes[1],[15] :
FLAVONOIDES stricto sensu 
| ||||
| CLASSE | SQUELETTE | Aglycones | Hétérosides | Dérivés méthoxylés |
|---|---|---|---|---|
| FLAVONE | 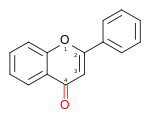 2-phénylchromén-4-one |
Lutéoline (OH:5,7,3',4') Apigénine (OH:5,7,4') |
7-O-glucoside de lutéoline 6-C-glucoside d'apigénine Apiine |
Tangéritine (CH3:5,6,7,8,4') Nobilétine (CH3:5,6,7,8,3',4') Géraldone (7,4'-dihydroxy-3'-méthoxyflavone) |
| FLAVONOL | 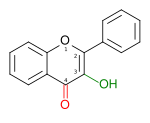 3-hydroxy-2-phénylchromén-4-one |
Quercétine, Kaempférol, Myricétine, Fisétine | Rutine (ou rutoside), 3,7,4'-O-triglucoside de kaempférol, 3-O-galactoside d'isorhamnétol |
Pachypodol, Rhamnazine, 3,7-diméthylquercétol, Isorhamnétol (=3-méthylquercétol) |
| DIHYDROFLAVONOL ou FLAVANONOL |
 3-hydroxy-2,3-dihydro-2-phénylchromén-4-one |
Dihydrokaempférol, Dihydroquercétol (=Taxifoline, extraite du mélèze Larix gmelinii[16]) | 3-O-rhamnoside de dihydroquercétol, 3-O-rhamnoside de dihydromyricétol | |
| FLAVANONE |  2,3-dihydro-2-phenylchromén-4-one 2,3-dihydro-2-phenylchromén-4-one
|
Naringétol, Ériodictyol, Butine | Hespéridine (7-O-rutoside d'hespérétine), Naringine, Néohespéridine, Didymine |
Hespérétine, Homoeriodictyol |
| AURONE | 
|
Hispidol, Aureusidine, Sulfurétine, Maritimetine | ||
| CHALCONE | 
|
Isoliquiritigénine, Butéine | Xanthohumol | |
| DIHYDROCHALCONE | 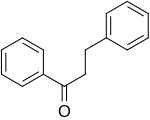
|
Phlorétine | Aspalathine (=3-C-glucopyranosyldihydrochalcone), Naringine dihydrochalcone, Néohespéridine dihydrochalcone, Nothofagine, Phloridzine |
|
1. les flavones
- aglycones : lutéolol (dans le thym, la sauge officinale, apigénol dans la bière, la ciboule, la marjolaine)
- leurs hétérosides : lutéolol 7-O-glucoside (dans les feuilles et les graines de céleri)
- dérivés méthoxylés : tangérétine, nobilétine (dans le jus d'orange)
2. les flavonols réputés être les antioxydants les plus efficaces parmi les flavonoïdes, très nombreux
- les aglycones : environ 380, kaempférol (dans les câpres, les mûres, les tomates) ; quercétol (dans le piment, le cacao) ; myricétol (dans la bière, le vin rouge, la ciboule) ; fisétine
- leurs hétérosides : nombreux dans les produits alimentaires comme le kaempférol 3-O-glucoside (dans le vin rouge, les framboises, les haricots communs)
- les dérivés méthoxylés : rhamnétine
3. les dihydroflavonols ou flavanonols, sans double liaison entre C2 et C3 par rapport aux flavonols
- aglycones : dihydroquercétol (dans l'origan américain Lippia graveolens)
- leurs hétérosides : dihydroquercétol 3-O-rhamoside (dans le vin rouge)
4. les flavanones, dérivés aussi 2,3-dihydrogénés
- aglycones surtout présents dans les agrumes : ériodictyol (dans la marjolaine) ; naringétol (dans le pomelo)
- leurs hétérosides : naringine (dans le pamplemousse, l'orange)
- leurs dérivés méthoxylés : homoeriodictyol (dans l'Herba Santa)
5. les aurones, 2-benzylidène-coumaranones : hispidol, Aureusidin
6. les chalcones, au cycle pyranique ouvert
- aglycones : butéine (dans les fèves)
- des hétérosides, des dérivés méthoxylés et prénylés : xanthohumorol (dans le houblon et la bière)
7. les dihydrochalcones
- aglycones : phlorétine (dans les feuilles de pommier)
- leurs hétérosides : phloretin 2'-O-xylosyl-glucoside (dans les pommes) ; naringine dihydrochalcone (à la saveur sucrée intense) ; néohespéridine dihydrochalcone (édulcorant)
Ces 7 classes constituent les flavonoïdes stricto sensu. Au sens large, il faut inclure aussi :
| FLAVANOLS, ANTHOCYANIDOLS | |||||
| CLASSE | SQUELETTE | Aglycones | Gallates | Polymères | Hétérosides |
|---|---|---|---|---|---|
| FLAVAN-3-OL | 
|
Afzéléchol, Catéchine, (-)-épicatéchine, Gallocatéchine | (-)-épicatéchine gallate EGC, (–)-épigallocatéchine gallate EGCG | PROANTHOCYANIDOL (=tanin condensé), procyanidine, prodelphinidine Théaflavine (dimère de catéchine), Théaflavine 3'-O-gallate, Théaflavine 3,3'-O-digallate |
épicatéchine (3-O-b)-D-glucopyranoside |
| FLAVAN-3,4-DIOL | 
|
Leucopélargonidol, Leucocyanidol, Leucodelphinidol |
PROANTHOCYANIDOL (=tanin condensé) procyanidine, prodelphinidines, proanthocyanidines oligomères | ||
| ANTHOCYANIDOL ou ANTHOCYANIDINE |
 Cation flavylium |
Pélargonidol, Cyanidol, Delphinidol, Malvidol, Péonidol, Pétunidol | ANTHOCYANOSIDES (=anthocyanes) : cyanidol 3,5-diglucoside, cyanidol 3-O-(6"-acétyl-galactoside), cyanidol 3-O-arabinoside, delphinium 3,5-O-diglucoside | ||
8. les flavan-3-ols ou flavanols ou catéchines sans double liaison dans le cycle central
- (+)-catéchine et (-)-épicatéchine (dans le thé, le raisin, le cacao)
- leurs gallates : GC (+)-gallocatéchine, EGC, ECG, EGCG du thé vert
- leurs polymères appelés proanthocyanidols ou tanins condensés sont classés dans les tanins. La théaflavine est un dimère du thé noir.
9. les flavane-3,4-diols ou flavanediols ou leucoanthocyanidines
- leucopélargonidol (dans la noix de cajou), leucocyanidol (= procyanidol) (dans la cacahouète, la cacao, le raisin) ; guibourtacacidine (dans l'écorce d' Acacia cultriformis). Les proanthocyanidols sont des polymères de 3-flavanols, mais aussi de flavane-3,4--diols, de flavane, et de 5-désoxyflavan-3-ols.
10. les anthocyanidols (ou anthocyanidines sur le modèle anglais) construites sur le cation flavylium
- aglycones : pélargonidol (dans géraniums, framboises, prunes) ; cyanidol (dans les baies rouges, raisin rouge, cerises)
- leurs hétérosides forment la classe des anthocyanes (ou anthocyanosides, ou anthocyanines sur le modèle anglais). Leur manifestation la plus spectaculaire se réalise dans les couleurs des feuilles à l'automne quand leur présence est révélée (ainsi que celle des caroténoïdes) par la disparition de la chlorophylle.
Les isoflavonoïdes, les néoflavonoïdes ou les tanins condensés sont structurellement rattachés aux flavonoïdes.
Les polyméthoxyflavonoïdes sont un grand groupe de flavonoïdes dont la charpente carbonée (flavane) est décorée d'un nombre variable de groupes méthoxy. Les polyméthoxyflavonoïdes hydroxylés (groupes hydroxyle et méthoxy) sont spécialement présent dans la peau des fruits du genre Citrus, dans le gingembre noir (Kaempferia parviflora (en)) et certaines Artemisia, ils font l'objet de nombreuses études pour leurs propriétés en santé humaine[17]. Les polymétaflavones sont la casticine, la sinensétine, la sudachitine, la 3,5,6,7,8,3',4'-heptaméthoxyflavone, la 5,7-diméthoxyflavone, la 5-hydroxy-3,7,3',4'-tétraméthoxyflavone et enfin la nobilétine et la tangéritine importants dans l'alimentation. Leur disponibilité dans les principaux agrumes a été publiée en 2022[18].

Propriétés physico-chimiques
[modifier | modifier le code]Les hétérosides de flavonoïdes sont en général peu solubles dans l'eau et les alcools. Les génines sont, pour la plupart, solubles dans les solvants organiques apolaires.
L'extraction est réalisée habituellement à l'aide du méthanol ou de mélanges méthanol-eau, parfois acétonitrile-eau.
Biodisponibilité
[modifier | modifier le code]Les flavonoïdes ont généralement une faible biodisponibilité. Plusieurs facteurs l'expliquent dont la structure chimique et le poids moléculaire, la faible solubilité dans l'eau, l'absorption et le métabolisme dans le tractus gastro-intestinal et leur élimination rapide. Leur potentiel thérapeutique et nutritionnel à travers l'alimentation ou le traitement oral s'en trouve considérablement réduit (lorsqu'ils sont consommés avec d'autres aliments, les flavonoïdes peuvent subir une précipitation, une complexation et une dégradation microbienne importantes, ce qui affecte considérablement leur stabilité et leur biodisponibilité[20]). De plus, certains composés sont sensibles à la dégradation lors de l'exposition à l'oxygène, aux changements de température, au rayonnement ultraviolet ou au changement de pH. Les travaux actuels portent sur l'amélioration de leur biodisponibilité. L'encapsulation des flavonoïdes est un moyen efficace d'améliorer leur pharmacocinétique, une étude portugaise (2021) sur la délivrance de flavonoïdes par voie cutanés est encourageante[21].
Effets sur la santé humaine
[modifier | modifier le code]
Les flavonoïdes sont naturellement présents dans les fruits et légumes couramment consommés dans l'alimentation humaine. On retrouve aussi ces composés bioactifs dans de nombreuses boissons : vin rouge, bière, lait de soja, thé et chocolat noir. Deux études de 2007 et 2010 évaluent l'apport quotidien à 182 mg au Royaume-Uni[23] et à 190 mg aux États-Unis[24]. En 2022, un inventaire systématique des flavonoïdes présents dans les zestes d'agrume permet aux auteurs d'écrire qu'elles sont sources potentielles de nouveaux médicaments et nutraceutiques contre l'obésité et les maladies métaboliques liées à l'obésité[22].
Les études épidémiologiques suggèrent un effet protecteur des fruits et légumes contre les maladies cardiovasculaires et le cancer, selon des mécanismes (propriétés anti-mutagènes contre les amines hétérocycliques (en), inhibition des protéines kinases…). Cependant, la quercétine comme les flavonoïdes de structure voisine, sont cancérogènes selon le test d'Ames, ce qui montre la complexité de ces composés, en raison de leurs interactions avec de nombreuses autres substances masquant les réactions spécifiques[25].
Outre les flavonoïdes, de nombreux constituants de ces fruits et légumes peuvent aussi concourir à expliquer cette association : fibres, vitamines et minéraux, glucosinolates, caroténoïdes, etc. Arts & Hollman[26], après avoir passé en revue les études épidémiologiques relatives aux effets sur la santé de la consommation de flavonoïdes, concluent que « les données à l'heure actuelle suggèrent des effets bénéfiques des flavonoïdes et des lignanes sur les maladies cardiovasculaires mais pas sur le cancer, avec l'exception possible du cancer du poumon. »

Menée à partir de questionnaires auprès de 334 850 femmes âgées de 35 à 70 ans et incluses dans la cohorte EPIC (European Prospective Investigation into Cancer and Nutrition[28], durée de suivi : 11,5 ans), une étude datée d' montre qu'il n'y a pas de lien entre la consommation de flavonoïdes et de lignane et le risque de cancer du sein, que l'on prenne en compte ou non le statut ménopausique et le statut des récepteurs hormonaux[29]. Dans un synthèse portant sur 3 202 publications sur les flavonoïdes d'agrumes une équipe chinoise montre que le nombre de publications s'accélère d'année en année (80 en 2010, plus de 300 par an en 2023), la Chine a publié le plus grand nombre d'articles. Les auteurs concluent: «Parmi les nombreux flavonoïdes d'agrumes, la nobilétine est un agent anti-angiogénique prometteur avec un grand potentiel pour la prévention et le traitement du cancer»[27].
Effets sur les troubles neurodégénératifs liés à l'âge
[modifier | modifier le code]La même étude poursuite «En termes de neuroprotection, la nobilétine pourrait améliorer les déficits d'apprentissage et de mémoire, suggérant son potentiel anti-Alzheimer et Parkinson. De plus, l'hespéridine et la naringine pourraient prévenir la dégénérescence des neurones dopaminergiques liée à la maladie de Parkinson, les dommages oxydatifs et les troubles cognitifs. En bref, les flavonoïdes d'agrumes possèdent une valeur nutritionnelle et médicinale élevée»[27].
Il y a des preuves naissantes que les flavonoïdes ont un effet inhibiteur de l'apoptose neuronale, améliorent la fonction neuronale et induisent la régénération des neurones. La consommation alimentaire de flavonoïdes améliore visiblement la mémoire humaine et les capacités neurocognitives, en quoi le processus de vieillissement neuronal et les maladies neurodégénératives associées sont retardés (2023)[30].
Renforcement de la résistance des capillaires
[modifier | modifier le code]Historiquement, c'est la première propriété reconnue aux flavonoïdes. On les dit « veinotoniques » car on peut montrer qu'ils sont capables de diminuer la perméabilité des capillaires et de renforcer leur résistance. Pour Bruneton[1] : « les revues générales et les synthèses méthodiques avec méta-analyse récentes aboutissent plutôt à constater l'absence ou la faiblesse de preuves de l'effet des flavonoïdes dans le traitement de l'insuffisance veineuse chronique, effet au demeurant de valeur clinique incertaine ». Selon une méta-revue Cochrane revue en 2012, des études de qualité modérée suggèrent que les phlébotoniques par voie orale, dont plusieurs à base de flavonoïdes, réduisent les œdèmes dus à l'insuffisance veineuse par rapport à un placebo, et qu'ils auraient des effets bénéfiques sur les autres troubles trophiques, crampes, agitation des jambes et picotements[31].
Activité antioxydante[32]
[modifier | modifier le code]Les flavonoïdes agissent principalement comme antioxydants primaires, en stabilisant les radicaux peroxydes mais ils peuvent aussi désactiver les espèces oxygénées réactives (ion superoxyde, radical OH•, oxygène singulet), inhiber la lipoxygénase ou encore chélater les métaux[33]
La limitation principale de cette activité antioxydante est la faible biodisponibilité des flavonoïdes après ingestion d'aliments riches en ces composés. La faible quantité absorbée entre en concurrence avec les autres piégeurs de radicaux libres (α-tocophérol, ascorbates et glutathione) présents dans des concentrations très supérieures[34]. Exception faite du tractus gastro-intestinal et peut-être du sang, l'action potentielle des polyphénols comme piégeurs de radicaux libres n'a probablement aucune signification physiologique dans la plupart des organes[35].
- Inhibiteurs enzymatiques. Les flavonoïdes sont, in vitro, des inhibiteurs enzymatiques de :
- l'histidine décarboxylase (par le quercétol et la naringénine)
- l'élastase
- l’hyaluronidase (par les flavones et les proanthocyanidols)
- la catéchol-O-méthyltransférase, etc.
- Interactions avec les facteurs de transcription
Les flavanols (catéchines et procyanidines) peuvent moduler l'expression de nombreux gènes régulés par le facteur de transcription NF-κB[35].
Activité anti-inflammatoire
[modifier | modifier le code]Les publications sur le sujet sont nombreuses. L'activation des voies antioxydantes produisent un effet anti-inflammatoire. Ils inhibent les sécrétions d'enzymes et de l'acide arachidonique, qui réduit les réactions inflammatoires. La génistéine, l'apigénine, le kaempférol et l'épigallocatéchine 3-gallate modulent l'expression et l'activation d'une cytokine (l'interleukine-1bêta IL-1β), d'un facteur de nécrose tumorale, régulent l'expression génique de nombreuses molécules pro-inflammatoires. Elles présentent un potentiel dans le traitement de maladies inflammatoires de l'intestin, pulmonaire, de l'arthrite, la maladie d'Alzheimer, les maladies cardiovasculaires, l'athérosclérose et le cancer (2022)[36]. Une activité anti-allergique semble liée: la quercétine, le kaemférol, la myricétine et la lutéoline sont des anti-allergiques et anti-inflammatoires, ils atténuent les symptômes allergiques en inhibant l'activation des mastocytes et des basophiles[37].
Traitement de la perte osseuse, remodelage osseux[20]
[modifier | modifier le code]Les flavonoïdes ont des effets favorables et préventifs sur la perte osseuse et l'apparition de l'ostéoporose. 2 voies de signalisation majeures induisant la formation osseuse sont affectées par les flavonoïdes. La quercétine, l'hespéridine, la coryline, l'icaridine, l'apigénine et la baicaléine stimulents la voie de signalisation Wnt/β-caténine. L'icariine, la nobilétine, la myricétine et le kaempférol stimulent la différenciation ostéogénique en stimulant la protéine morphogénétique osseuse BMP2, la quercétine cible la molécule Smad 1/5/8 impliquée dans la voie de signalisation BMP pour stimuler l'ostéogenèse. Les recherches actuelles montrent qu'on pourrait remédier à leur faible biodisponibilité et à leur leur instabilité à long terme par la nano encapsulation.
Histoire
[modifier | modifier le code]Albert Szent-Gyorgyi découvrit par hasard les « bioflavonoïdes » en cherchant à traiter un patient souffrant d'une fragilité des vaisseaux capillaires entraînant un saignement sous-cutané. Il administra d'abord une préparation impure de vitamine C, qui donna de bons résultats, mais quand, plus tard, il eut recours à une solution pure d'acide ascorbique, à sa grande surprise, il n'obtint aucun résultat. Il retourna donc à la première préparation, et avec son collègue, Rusznyak, ils isolèrent dans le jus de citron un facteur, nommé « citrine », ayant la propriété de diminuer la perméabilité des capillaires et d'accroître leur résistance[38]. Il la nomma aussi vitamine P, avec la lettre P pour « perméabilité ». Avec son associé, V. Bruckner, il montra que la citrine était en fait un mélange d'hespéridine et de glycoside d'ériodictyol.
Après études, on s'aperçut qu'une carence en cette substance n'entrainait aucun syndrome particulier, ce qui fait qu'on ne pouvait en toute rigueur retenir le qualificatif de « vitamine »[39].
Noyau flavène
[modifier | modifier le code]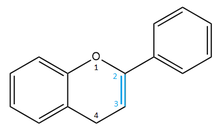
Les composés à noyau flavène ne sont pas courants dans la nature. Ce seraient des composés faciles à obtenir par voie de synthèse artificielle[40]. Le noyau serait trouvé dans les composés impliqués dans le phénomène de rosissement du vin blanc[41].
Bibliographie
[modifier | modifier le code]Publications académiques
[modifier | modifier le code]- Raquel Costa et al. On the Development of a Cutaneous Flavonoid Delivery System: Advances and Limitations. Antioxidants, 2021, 10(9)[42]
- Nur Farisya Shamsudin et al. Flavonoids as Antidiabetic and Anti-Inflammatory Agents: A Review on Structural Activity Relationship-Based Studies and Meta-Analysis. International Journal Molecular Sciences. 2022[43].
- Shyam Sunder Rabidas et al. A Comprehensive Review on Anti-Inflammatory Response of Flavonoids in Experimentally-Induced Epileptic Seizures. Brain Science. 2023, 13(1)[44].
- Hilda Martínez-Coria et al. Anti-Inflammatory Effects of Flavonoids in Common Neurological Disorders Associated with Aging. International Journal Molecular Sciences, 2023, 24(5)[45].
- Meng Li et al. Evidence of Flavonoids on Disease Prevention. Antioxidants. 2023, 12(2)[46].
- Chang-Qing Zhu et al. Advances in extraction and purification of citrus flavonoids. Food Frontiers. mai 2023 (accès libre)[19]. Synthèse concernant les agrumes et les méthodes d'extraction, les auteurs proposent d'extraire les flavonoïdes des feuilles pour pallier l'irrégularité de la production fruitière chez Citrus.
Références
[modifier | modifier le code]- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8)
- (en) Joseph H. Hulse, Polyphenols in Cereals and Legumes, International Development Research Centre, , p. 217
- (en) Barker DH, Seaton GGR & Robinson SA., « Internal and external photoprotection in developing leaves of the CAM plant Cotyledon orbiculata », Plant, Cell & Environnement, vol. 20, no 5, , p. 617–624 (DOI 10.1111/j.1365-3040.1997.00078.x).
- (en) Herwig O. Gutzeit, Jutta Ludwig-Müller, Plant Natural Products: Synthesis, Biological Functions and Practical, John Wiley & Sons, (lire en ligne), p. 21
- (en) Julie A Ross 1, Christine M Kasum, « Dietary flavonoids: bioavalibility, metabolic effects and safety », Ann. Review Nut., vol. 22, no 1, , p. 19-34 (DOI 10.1146/annurev.nutr.22.111401.144957).
- (en) Luisa Helena Cazarolli, Leila Zanatta, Elga Heloisa Alberton, Maria Santos Reis Bonorino Figueiredo, Poliane Folador, Rosangela Guollo Damazio, Moacir Geraldo Pizzolatti, Fátima Regina Mena Barreto Silva, « Flavonoids: prospective drug candidates », Mini rev. med. Chem., vol. 8, no 13, , p. 1429-1440 (DOI 10.2174/138955708786369564).
- (en) Ovidiu Burta, Felicia Tirlea, Olivia Ligia Burta and Syed Minnatullah Qadri, « Phytotherapy in cardiovascular diseases: From ethnomedicine to evidence based medicine », Journal of Biological Sciences, vol. 8, no 2, , p. 242-247.
- K. Ghedira, « Les flavonoïdes: structure, propriétés biologiques, rôle prophylactique et emplois en thérapeutique », Phytotherapie, vol. 3, no 4, , p. 162 (DOI 10.1007/s10298-005-0096-8).
- Œuvres complètes de Philippe Aureolus Theophraste Bombast de Hohenheim, dit Paracelse, vol. 2, Bibliothèque Chacornac, (lire en ligne), p. 192
- Carl von Linné, Hortus Upsaliensis, exhibens plantas exoticas, Laurentii Salvii, (lire en ligne), p. 236
- Ueli A. Hartwig, Cecillia M. Joseph, and Donald A. Phillips, « Flavonoids Released Naturally from Alfalfa Seeds Enhance Growth Rate of Rhizobium meliloti », Plant Physiol., vol. 95, no 3, , p. 797-803
- Gérard Guillot, La planète fleurs, Quae, , p. 178
- (en) Tarun Minocha, Hareram Birla, Ahmad A. Obaid et Vipin Rai, « Flavonoids as Promising Neuroprotectants and Their Therapeutic Potential against Alzheimer’s Disease », Oxidative Medicine and Cellular Longevity, vol. 2022, , tableau 1 (ISSN 1942-0900, DOI 10.1155/2022/6038996, lire en ligne, consulté le )
- (en) Shyam Sunder Rabidas, Chandra Prakash, Jyoti Tyagi et Jyoti Suryavanshi, « A Comprehensive Review on Anti-Inflammatory Response of Flavonoids in Experimentally-Induced Epileptic Seizures », Brain Sciences, vol. 13, no 1, , p. 102 (ISSN 2076-3425, DOI 10.3390/brainsci13010102, lire en ligne, consulté le )
- phenol-explorer
- Avis de l'anses sur la taxifoline
- (en) Gianfranco Fontana, Maurizio Bruno, Francesco Sottile, Natale Badalamenti, « The Chemistry and the Anti-Inflammatory Activity of Polymethoxyflavonoids from Citrus Genus », Antioxidants 2023, 12, 23, , p. 40 (lire en ligne [PDF])
- (en) Ren-You Gan, Yi Liu, Hang Li, Yu Xia, Huan Guo, Fang Geng, Qi-Guo Zhuang, Hua-Bin Li, Ding-Tao Wu, « Natural sources, refined extraction, biosynthesis, metabolism, and ioactivities of dietary polymethoxyflavones (PMFs) », Food Science and Human Wellness 13, 2022 (on line), p. 42 p. importante bibliographie (lire en ligne [PDF])
- (en) Chang‐Qing Zhu, Jie‐Biao Chen, Chen‐Ning Zhao et Xiao‐Juan Liu, « Advances in extraction and purification of citrus flavonoids », Food Frontiers, (ISSN 2643-8429 et 2643-8429, DOI 10.1002/fft2.236, lire en ligne, consulté le )
- (en) Ashish Ranjan Sharma, Yeon-Hee Lee, Altanzul Bat-Ulzii et Srijan Chatterjee, « Bioactivity, Molecular Mechanism, and Targeted Delivery of Flavonoids for Bone Loss », Nutrients, vol. 15, no 4, , p. 919 (ISSN 2072-6643, DOI 10.3390/nu15040919, lire en ligne, consulté le )
- (en) Raquel Costa, Sofia A. Costa Lima, Paula Gameiro et Salette Reis, « On the Development of a Cutaneous Flavonoid Delivery System: Advances and Limitations », Antioxidants, vol. 10, no 9, , p. 1376 (ISSN 2076-3921, DOI 10.3390/antiox10091376, lire en ligne, consulté le )
- (en) Kaihui Lu et Yew Mun Yip, « Therapeutic Potential of Bioactive Flavonoids from Citrus Fruit Peels toward Obesity and Diabetes Mellitus », Future Pharmacology, vol. 3, no 1, , p. 14–37 (ISSN 2673-9879, DOI 10.3390/futurepharmacol3010002, lire en ligne, consulté le )
- Beking K, Vieira A., « An assessment of dietary flavonoid intake in the UK and Ireland », International journal of food sciences and nutrition, vol. 62, no 1, , p. 17-19 (lire en ligne)
- Chun OK, Chung SJ, Song WO., « Estimated dietary flavonoid intake and major food sources of U.S. adults », The Journal of nutrition, vol. 137, no 5, , p. 1244-1252 (lire en ligne)
- (en) Joseph Vercauteren, Catherine Chèze, Janine Triaud, Polyphenols 96, Editions Quae, , p. 188-191
- Ilja CW Arts and Peter CH Hollman, « Polyphenols and disease risk in epidemiologic studies », The American Journal of Clinical Nutrition, vol. 81, (lire en ligne)
- (en) Mingyang Qiu, Wenlong Wei, Jianqing Zhang et Hanze Wang, « A Scientometric Study to a Critical Review on Promising Anticancer and Neuroprotective Compounds: Citrus Flavonoids », Antioxidants, vol. 12, no 3, , p. 669 (ISSN 2076-3921, DOI 10.3390/antiox12030669, lire en ligne, consulté le )
- (en) E. Riboli et al., « European Prospective Investigation into Cancer and Nutrition (EPIC): study populations and data collection », Public health nutrition, vol. 5, no 6B, , p. 1113-1124 (PMID 12639222, lire en ligne [html], consulté le )
- (en) R. Zamora-Ros et al., « Dietary flavonoid and lignan intake and breast cancer risk according to menopause and hormone receptor status in the European Prospective Investigation into Cancer and Nutrition (EPIC) Study », Breast cancer research and treatment, (PMID 23572295, lire en ligne [html], consulté le )
- (en) Sanjib Kumar Das, Koushik Sen, Tanmay Sanyal et Aloke Saha, « Flavonoids: A Promising Neuroprotectant and Its Salutary Effects on Age-Related Neurodegenerative Disorders », dans Neuroprotective Effects of Phytochemicals in Brain Ageing, Springer Nature, , 221–255 p. (ISBN 978-981-99-7269-2, DOI 10.1007/978-981-99-7269-2_11, lire en ligne)
- Pittler MH. et Ernst E., « Extrait de graine de marron d'Inde pour l'insuffisance veineuse chronique ou à long terme », sur www.cochrane.org, (consulté le )
- encadré Flavonoïdes sur vidal.fr
- P. Sarni-Manchado, V. Cheynier, Les polyphénols en agroalimentaire, Lavoisier, Editions Tec & Doc, , 398 p. (ISBN 2-7430-0805-9)
- (en) Mónica Galleano, Sandra V. Verstraeten, Patricia I. Oteiza, Cesar G. Fraga, « Antioxidant actions of flavonoids: Thermodynamic and kinetic analysis », Archives of Biochemistry and Biophysics, vol. 501,
- (en) Cesar G. Fraga, Monica Galleano, Sandra V. Verstraeten, Patricia I. Oteiza, « Basic biochemical mechanisms behind the health benefits of polyphenols », Molecular Aspects of Medicine, , doi:10.1016/j.mam.2010.09.006
- (en) Jameel M. Al-Khayri, Gandasi Ravikumar Sahana, Praveen Nagella et Biljo V. Joseph, « Flavonoids as Potential Anti-Inflammatory Molecules: A Review », Molecules, vol. 27, no 9, , p. 2901 (ISSN 1420-3049, DOI 10.3390/molecules27092901, lire en ligne, consulté le )
- (en) Allah Rakha, Nehal Umar, Roshina Rabail et Masood Sadiq Butt, « Anti-inflammatory and anti-allergic potential of dietary flavonoids: A review », Biomedicine & Pharmacotherapy, vol. 156, , p. 113945 (ISSN 0753-3322, DOI 10.1016/j.biopha.2022.113945, lire en ligne, consulté le )
- (en) V. Bruckner et A. Szent-Györgyi, « Chemical Nature of Citrin », Nature, vol. 138, no 3503, , p. 1057 (ISSN 0028-0836, DOI 10.1038/1381057b0, résumé)
- Miklos Gabor
- Ring-closing metathesis as a new methodology for the synthesis of monomeric flavonoids and neoflavonoids. Bradley J.Miller, Tanya Pieterse, Charlene Marais Barend & C.B. Bezuidenhoudt, Tetrahedron Letters, Volume 53, Issue 35, 29 August 2012, Pages 4708-4710, DOI 10.1016/j.tetlet.2012.06.094
- (en) Australian Wine Research Institute, « Not so pretty in pink » [PDF], sur awri.com, (consulté le )
- (en) Raquel Costa, Sofia A. Costa Lima, Paula Gameiro et Salette Reis, « On the Development of a Cutaneous Flavonoid Delivery System: Advances and Limitations », Antioxidants, vol. 10, no 9, , p. 1376 (ISSN 2076-3921, DOI 10.3390/antiox10091376, lire en ligne, consulté le )
- (en) Nur Farisya Shamsudin, Qamar Uddin Ahmed, Syed Mahmood et Syed Adnan Ali Shah, « Flavonoids as Antidiabetic and Anti-Inflammatory Agents: A Review on Structural Activity Relationship-Based Studies and Meta-Analysis », International Journal of Molecular Sciences, vol. 23, no 20, , p. 12605 (ISSN 1422-0067, DOI 10.3390/ijms232012605, lire en ligne, consulté le )
- (en) Shyam Sunder Rabidas, Chandra Prakash, Jyoti Tyagi et Jyoti Suryavanshi, « A Comprehensive Review on Anti-Inflammatory Response of Flavonoids in Experimentally-Induced Epileptic Seizures », Brain Sciences, vol. 13, no 1, , p. 102 (ISSN 2076-3425, DOI 10.3390/brainsci13010102, lire en ligne, consulté le )
- (en) Hilda Martínez-Coria, Isabel Arrieta-Cruz, Roger Gutiérrez-Juárez et Héctor Eduardo López-Valdés, « Anti-Inflammatory Effects of Flavonoids in Common Neurological Disorders Associated with Aging », International Journal of Molecular Sciences, vol. 24, no 5, , p. 4297 (ISSN 1422-0067, DOI 10.3390/ijms24054297, lire en ligne, consulté le )
- (en) Meng Li, Mengqi Qian, Qian Jiang et Bie Tan, « Evidence of Flavonoids on Disease Prevention », Antioxidants, vol. 12, no 2, , p. 527 (ISSN 2076-3921, DOI 10.3390/antiox12020527, lire en ligne, consulté le )
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8)
- Jacques Masquelier, « Aspect pharmacologique nouveau de certains flavonoïdes », Vie Médicale, vol. 50, 1969, p. 62-70.
Liens externes
[modifier | modifier le code]
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
