Fluorure de gallium(III)
| Fluorure de gallium(III) | |||
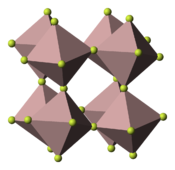
| |||
| __ Ga __ F Maille cristalline du fluorure de gallium(III) |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | trifluorogallane | ||
| Nom systématique | fluorure de gallium(III) | ||
| Synonymes |
trifluorure de gallium |
||
| No CAS | |||
| No ECHA | 100.029.094 | ||
| No CE | 232-004-5 | ||
| PubChem | 82211 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide incolore et inodore[1] | ||
| Propriétés chimiques | |||
| Formule | GaF3 | ||
| Masse molaire[2] | 126,718 ± 0,001 g/mol F 44,98 %, Ga 55,02 %, |
||
| Propriétés physiques | |||
| T° fusion | 800 °C[3] | ||
| T° ébullition | ~ 1 000 °C[3] | ||
| Masse volumique | 4,47 g/cm3[3] à 20 °C | ||
| Cristallographie | |||
| Système cristallin | Trigonal | ||
| Classe cristalline ou groupe d’espace | R3c (no 167) |
||
| Précautions | |||
| SGH[3] | |||
| H314, P280, P310, P301+P330+P331, P303+P361+P353 et P305+P351+P338 |
|||
| NFPA 704[3] | |||
| Transport[3] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le fluorure de gallium(III) est un composé chimique de formule GaF3. Il s'agit d'un solide incolore et inodore stable dans l'eau, y compris dans l'eau chaude. Il est très légèrement soluble dans l'eau[4], contrairement à son trihydrate GaF3·3H2O. Il est susceptible de se sublimer sans se décomposer au-dessus de 800 °C dans une atmosphère protectrice d'azote. Comme le fluorure d'aluminium, il présente une structure cristalline polymère semblable à celle de trioxyde de rhénium ReO3 : système trigonal, groupe d'espace R3c (no 167), paramètres a = 501,2 pm et c = 1 299 pm[5].
Le fluorure de gallium(III) peut être obtenu en faisant réagir le gallium avec le fluorure d'hydrogène[1] :
Une autre voie par la thermolyse de l'hexafluorogallate d'ammonium (NH4)3[GaF6] dans un flux de fluor[1] :
- (NH4)3[GaF6] ⟶ GaF3 + 3 NH4F.
Le trihydrate GaF3·3H2O peut être obtenu en faisant réagir de l'hydroxyde de gallium(III) Ga(OH)3 ou de l'oxyde de gallium(III) Ga2O3 avec du fluorure d'hydrogène[5].
Les solutions de GaF3 dans l'acide fluorhydrique peuvent former le trihydrate par évaporation ; GaF3·3H2O peut à son tour être déshydraté par chauffage pour donner GaF2(OH)[4].
Notes et références[modifier | modifier le code]
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 1, Ferdinand Enke, Stuttgart, 1975, p. 239. (ISBN 3-432-02328-6)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Gallium(III) fluoride, 99.995% (metals basis) », sur Alfa Aesar (consulté le ).
- (en) A. J. Downs, Chemistry of Aluminium, Gallium, Indium and Thallium, Springer, 1993. (ISBN 978-0-7514-0103-5)
- (de) Arnold Frederik Holleman, Egon Wiberg et Nils Wiberg, Lehrbuch der Anorganischen Chemie, 101e éd., de Gruyter, Berlin, 1995, p. 1096. (ISBN 3-11-012641-9)






