Tétrafluorure de sélénium
| Tétrafluorure de sélénium | |
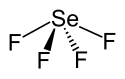
| |
| Structure du tétrafluorure de sélénium | |
| Identification | |
|---|---|
| Synonymes |
fluorure de sélénium(IV) |
| No CAS | |
| No ECHA | 100.033.352 |
| No CE | 236-703-6 |
| PubChem | 123311 |
| ChEBI | 30435 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | F4Se |
| Masse molaire[1] | 154,95 ± 0,03 g/mol F 49,04 %, Se 50,96 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le tétrafluorure de sélénium est un composé chimique de formule SeF4. Il se présente sous la forme d'un liquide incolore qui réagit fortement avec l'eau. Il peut être utilisé pour réaliser des fluorations en synthèse organique (fluoration d'alcools, d'acides carboxyliques ou de carbonyles) et présente l'avantage, par rapport au tétrafluorure de soufre SF4, d'être liquide et non gazeux, et de pouvoir être utilisé dans des conditions plus douces.
La molécule de SeF4 en phase gazeuse présente une géométrie en balançoire semblable à celle observée pour SF4, bien décrite par la théorie VSEPR. Les liaisons Se–F axiales ont une longueur de 177 pm avec un angle de liaison F–Se–F de 169,2°. Les deux autres atomes de fluor sont liés par des liaisons plus courtes (168 pm) en formant un angle de liaison de 100,6°. Cette configuration prédomine en solution à faible concentration mais évolue vers une géométrie octaédrique déformée à mesure que la concentration augmente. Cette configuration est également observée à l'état solide.
La première synthèse du tétrafluorure de sélénium, publiée en 1907[2], a été réalisée par Paul Lebeau en faisant réagir du sélénium avec du fluor F2 :
Une méthode de synthèse faisant appel à des réactifs plus faciles à utiliser consiste à fluorer du dioxyde de sélénium SeO2 avec du tétrafluorure de soufre SF4[3] :
Cette réaction fait intervenir l'oxyfluorure de sélénium SeOF2. Il est également possible de fluorer directement le sélénium avec du trifluorure de chlore ClF3 :
Dans le fluorure d'hydrogène HF, SeF4 se comporte comme une base faible, plus faible que SF4 (Kb = 2 × 10-2) :
- SeF4 + HF SeF3+ + HF2−, avec Kb = 4 × 10−4.
Des adduits ioniques contenant le cation SeF3+ se forment avec SbF5, AsF5, NbF5 (en), TaF5 (en) et BF3[4].
Avec le fluorure de césium CsF, il se forme l'anion SeF5−, qui présente une géométrie pyramidale carrée semblable à celle du pentafluorure de chlore ClF5 et au pentafluorure de brome BrF5[5].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Note de M. Paul Lebeau, présentée par M. Ditte, « Action du fluor sur le sélénium. Tétrafluorure de sélénium », Comptes Rendus de l'Académie des Sciences de Paris, tome 144, 1907, p. 1042-1044.
- (en) Konrad Seppelt, Dieter Lentz, Gerhard Klöter et Carl J. Schack, « Selenium Tetrafluoride, Selenium Difluoride Oxide (Seleninyl Fluoride), and Xenon Bis[Pentafluorooxoselenate(VI)] », Inorganic Syntheses, vol. 24, , p. 27-31 (DOI 10.1002/9780470132555.ch9, lire en ligne)
- (en) R. J. Gillespie et A. Whitla, « Selenium tetrafluoride adducts. II. Adducts with boron trifluoride and some pentafluorides », Revue canadienne de chimie, vol. 48, no 4, , p. 657-663 (DOI 10.1139/v70-106, lire en ligne)
- (en) Karl O. Christe, E. C. Curtis, Carl J. Schack et D. Pilipovich, « Vibrational spectra nad force constants of the square-pyramidal anions SF5−, SeF5−, and TeF5− », Inorganic Chemistry, vol. 11, no 7, , p. 1679-1682 (DOI 10.1021/ic50113a046, lire en ligne)

