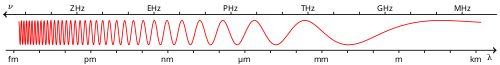
Spectre électromagnétique

Le spectre électromagnétique est le classement des rayonnements électromagnétiques par fréquence et longueur d'onde dans le vide ou énergie photonique[1].
Le spectre électromagnétique s'étend sans rupture de zéro à l'infini. Pour des raisons tant historiques que physiques, on le divise en plusieurs grandes classes, dans lesquelles le rayonnement s'étudie par des moyens particuliers.

Domaines du spectre électromagnétique[modifier | modifier le code]
Vue générale[modifier | modifier le code]
On décrit un rayonnement électromagnétique par ses caractéristiques les plus accessibles, selon sa forme et son utilisation.
On caractérise habituellement les ondes radio par la fréquence, qui s'applique aussi bien aux circuits des appareils qu'on utilise pour les produire.
Quand les fréquences croissent, les longueurs d'onde correspondantes se raccourcissent jusqu'à devenir du même ordre de grandeur que les appareils, et deviennent le paramètre d'utilisation le plus courant.
Au-delà d'une certaine limite, on utilise principalement des instruments d'optique, tout comme pour la lumière, et la longueur d'onde dans le vide devient la caractéristique la plus commode. Elle joue directement dans le calcul des interférences dans les réseaux de diffraction et dans beaucoup d'autres applications.
À partir des rayons X, les longueurs d'onde sont rarement utilisées : comme il s'agit de particules très énergétiques, c'est l’énergie correspondant au photon X ou γ détecté qui est plus utile.
On découpe habituellement le spectre électromagnétique en divers domaines selon la longueur d'onde et le type de phénomène physique émettant ce type d'onde[2] :

| Nom | Longueur d'onde | Fréquence | Énergie du photon (eV) | Type de phénomène physique |
|---|---|---|---|---|
| Rayon gamma | < 5 pm | > 6 × 1019 Hz | > 2,5 × 105 eV | Transitions au sein du noyau atomique, souvent émis lors de la désexcitation de noyaux-fils issu de la désintégration radioactive d'un noyau instable, de façon spontanée ou sous l'effet d'une accélération au sein d'un accélérateur de particules. |
| Rayon X | 5 pm — 10 nm | 30 PHz — 60 EHz | 1,2 × 102 eV — 2,5 × 105 eV | Transitions d'électrons des couches profondes au sein d'un atome, accélération ou décélération (bremsstrahlung) d'électrons libres de haute énergie. |
| Ultraviolet | 1 nm — 380 nm | 789 THz — 300 PHz | 4,1 eV — 1,2 × 103 eV | Transitions d'électrons de valence d'atomes ou de molécules de plus haute énergie encore, non observables par l'œil humain. |
| Visible | 380 nm — 780 nm | 384 THz — 789 THz | 1,7 eV — 3,3 eV | |
| Infrarouge | 780 nm — 100 µm | 3 THz — 384 THz | 1,2 × 10−2 eV — 1,7 eV | Oscillations de particules, vibration moléculaire, transitions d'électrons de valence au sein d'atomes ou de molécules. |
| Térahertz / submillimétrique | 0,1 mm — 1 mm | 300 GHz — 3 THz | 1,2 × 10−3 eV — 1,2 × 10−2 eV | Vibration de molécules complexes, de réseaux cristallins. |
| Micro-ondes | 1 mm — 1 m | 300 MHz — 300 GHz | 1,2 × 10−6 eV — 1,2 × 10−3 eV | Oscillations d'électrons au sein de composants électriques spécifiques (comme une diode Gunn par exemple), rotation moléculaire, ou d'antenne (comme c'est le cas pour la téléphonie mobile, qui peuvent utiliser des micro-ondes comme ondes porteuses, comme 60 GHz). |
| Ondes radio | 1 m — 100 000 km | 3 Hz — 300 MHz | 1,2 × 10−14 eV — 1,2 × 10−6 eV | Oscillations d'électrons au sein d'un circuit électrique comme une antenne. |
Le découpage détaillé en bandes de fréquence selon les normes de l'UIT se trouve dans le paragraphe « Usages et classification » ci-dessous.
Spectre optique[modifier | modifier le code]
Le spectre optique recouvre les domaines de l'infrarouge, le spectre visible, et de l'ultraviolet. La discipline étudiant les lois et comportements des ondes de ce domaine est l'optique.
Spectre visible[modifier | modifier le code]
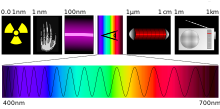
Le rayonnement électromagnétique visible est la très étroite portion du spectre électromagnétique accessible à la perception humaine visuelle ; elle correspond à la plus forte énergie de rayonnement solaire arrivant à la surface de la Terre. La sensibilité humaine est maximale aux alentours d'une longueur d'onde dans le vide de 550 nm en vision photopique, avec des éclairements importants, de l'ordre de grandeur de ceux qui se trouvent dans la journée à la surface de la Terre. De part et d'autre de ce maximum, la sensibilité diminue progressivement. Elle est de moins de 1 % du maximum à 410 nm et à 690 nm, et il n'en reste rien à 360 nm. Du côté des basses énergies, on détecte au plus jusqu'à 820 nm, bien que très faiblement, mais les êtres humains et autres animaux terrestres sentent le rayonnement infrarouge sous forme de chaleur sur la peau. En vision scotopique, nocturne, le maximum est à 510 nm et on ne distingue pas les couleurs.
La colorimétrie relie la mesure physique du rayonnement à la couleur perçue. Un humain normal peut distinguer des ondes monochromatiques dont la longueur d'onde diffère d'un peu moins de 1 nm, et plus d'une centaine de niveaux de luminosité[3]. Pourtant, la description d'une couleur n'a pas besoin d'autant de données que pourrait laisser croire la spectroscopie. Les humains n'ont en vision diurne que trois types de récepteurs, et de nombreux mélanges de radiations de longueurs d'onde différentes, dites « métamères », se perçoivent identiquement.
Histoire[modifier | modifier le code]
Jusqu'au XIXe siècle, la seule partie du spectre électromagnétique qui était connue était le spectre visible ou spectre optique. Si le phénomène d'arc-en-ciel était connu des premiers humains, ce n'est qu'au XVIIe siècle que Newton a mis en évidence le fait que la lumière blanche peut être décomposée en diverses couleurs.
Le terme spectre, signifiant « apparence immatérielle », « illusion » s'appliquait, au XVIIe siècle, à tous les phénomènes optiques qu'on ne s'expliquait pas. Synonyme de couleur accidentelle, il servait pour les impressions rétiniennes du contraste simultané ou successif aussi bien que pour les irisations vues au bord d'un objet regardé à travers un prisme[4]. Newton l'employa une seule fois pour présenter ses expériences en optique dans son article de 1671[5]. Ayant expliqué que la lumière blanche est « un mélange hétérogène de rayons différemment réfrangibles » (op. cit., p. 3079) et que les couleurs ne sont pas des qualifications de la lumière, comme on l'estimait depuis Aristote, mais des propriétés originales, différentes dans chaque rayon ; que les moins réfrangibles sont de couleur rouge, et les plus réfrangibles sont d'un violet profond, et cette association de propriétés ne peut être brisée par aucun moyen (op. cit., p. 3081) ; que les transmutations de couleurs ne se produisent que lorsqu'il y a mélange de rayons. Ce sont ces couleurs de mélange, et non celles séparées par le prisme, qui sont illusoires, fugaces et apparentes. Dès lors, Newton utilise toujours l'expression « couleurs prismatiques », laissant le spectre pour les phénomènes douteux ou inexpliqués. Mais l'usage d'appeler ces couleurs « spectrales » persiste, alimenté et promu par les opposants à la théorie physique de la lumière comme Goethe[6] suivi par Schopenhauer[7].
En 1800 William Herschel découvre de façon plutôt fortuite l'existence d'une radiation lumineuse non visible, le rayonnement infrarouge. L'année suivante, le physicien allemand Johann Wilhelm Ritter prolonge le spectre électromagnétique connu du côté des courtes longueurs d'onde en mettant en évidence l'existence du rayonnement ultraviolet.
L'interprétation de la lumière comme la propagation d'une onde électromagnétique est due à James Clerk Maxwell dans les années 1860, qui prédit également l'existence d'ondes électromagnétiques de toutes les fréquences possibles, se déplaçant toutes dans le vide à la vitesse de la lumière c. Les travaux du physicien Heinrich Hertz permettent la découverte en 1886 des ondes hertziennes, dites aussi ondes radio, qui étendent encore le spectre électromagnétique en deçà de l'infrarouge dans le domaine des basses fréquences ou des grandes longueurs d'onde. Les expériences sur les tubes électroniques permettent à Wilhelm Röntgen de mettre en évidence l'existence d'un nouveau type de rayonnement, de plus courte longueur d'onde que l'ultraviolet, les rayons X.
La dernière portion du spectre électromagnétique, les rayons gamma, commence à être explorée au début du XXe siècle avec les travaux de Paul Villard et William Henry Bragg.
Usages et classification[modifier | modifier le code]
Les définitions des bandes mentionnées dans le tableau sont les suivantes (normalisation internationale effectuée par l’UIT[8], sauf pour la bande THF) ; elles sont aussi communément désignées par leur catégorie de longueur d’onde métrique.
| Bandes | Fréquence | Longueur d’onde (dans le vide) | Usages | |
|---|---|---|---|---|
| Ondes TLF (tremendously low frequency) | 0 Hz à 3 Hz | 100 000 km à ∞ | Champs magnétiques, ondes et bruits électromagnétiques naturels | |
| Ondes ELF (extremely low frequency) | 3 Hz à 30 Hz | 10 000 km à 100 000 km | Ondes électromagnétiques naturelles, résonance terrestre de Schumann, ondes du cerveau humain, recherches en géophysique, raies spectrales moléculaires | |
| Ondes SLF (super low frequency) | 30 Hz à 300 Hz | 1 000 km à 10 000 km | Ondes électromagnétiques naturelles, résonance terrestre de Schumann, ondes physiologiques humaines, ondes des lignes électriques, usages inductifs industriels, télécommandes EDF Pulsadis, harmoniques ondes électriques | |
| Ondes ULF (ultra low frequency) | 300 Hz à 3 kHz | 100 km à 1 000 km | Ondes électromagnétiques naturelles notamment des orages solaires, ondes physiologiques humaines, ondes électriques des réseaux téléphoniques, harmoniques ondes électriques, signalisation TVM des TGV | |
| Ondes VLF (very low frequency) | 3 kHz à 30 kHz | 10 km à 100 km | Ondes électromagnétiques naturelles, radiocommunications submaritimes militaires, transmissions par CPL, systèmes de radionavigation, émetteurs de signaux horaires | |
| Ondes LF (low frequency) ou ondes kilométriques | 30 kHz à 300 kHz | 1 km à 10 km | Ondes électromagnétiques naturelles des orages terrestres, radiocommunications maritimes et submaritimes, transmissions par CPL, radiodiffusion en OL, émetteurs de signaux horaires, systèmes de radionavigation | |
| Ondes MF (medium frequency) ou ondes hectométriques | 300 kHz à 3 MHz | 100 m à 1 km | Systèmes de radionavigation, radiodiffusion en OM, radiocommunications maritimes et aéronautiques, radioamateurs, signaux horaires et ADSL | |
| Ondes HF (high frequency) ou ondes décamétriques | 3 MHz à 30 MHz | 10 m à 100 m | Radiodiffusion internationale, radioamateurs, radiocommunications maritimes, aéronautiques, militaires et d’ambassades, aide humanitaire, transmissions gouvernementales, applications inductives autorisées, transmissions par CPL, signaux horaires, CB en 27 MHz, radar trans-horizon | |
| Ondes VHF (very high frequency) ou ondes métriques | 30 MHz à 300 MHz | 1 m à 10 m | Radiodiffusion et télédiffusion, radiocommunications professionnelles, transmissions militaires, liaisons des secours publics, radionavigation (VOR et ILS) et radiocommunications aéronautiques, radioamateurs, satellites météo, radioastronomie, recherches spatiales | |
| Ondes UHF (ultra high frequency) ou ondes décimétriques | 300 MHz à 3 GHz | 10 cm à 1 m | Télédiffusion, radiodiffusion numérique, radioamateurs, radiocommunications professionnelles, transmissions militaires y compris aéronautiques, liaisons gouvernementales, liaisons satellites, FH terrestres, radiolocalisation et radionavigation, services de la DGAC, usages spatiaux, satellites météo, téléphonie GSM, UMTS et DECT, liaisons Wi-Fi et Bluetooth, systèmes radar, fours à micro-ondes | |
| Ondes SHF (super high frequency) ou ondes centimétriques | 3 GHz à 30 GHz | 1 cm à 10 cm | FH terrestres et par satellite, systèmes radar, liaisons et FH militaires divers, systèmes BLR, radioastronomie et usages spatiaux, radiodiffusion et télédiffusion par satellite, liaisons Wi-Fi | |
| Ondes EHF (extremely high frequency) ou ondes millimétriques | 30 GHz à 300 GHz | 1 mm à 1 cm | FH terrestres et par satellite, recherches spatiales, radioastronomie, satellites divers, liaisons et FH militaires, radioamateurs, systèmes radar, raies spectrales moléculaires, expérimentations et recherches scientifiques | |
| Ondes THF (tremendously high frequency) | 300 GHz à 384 THz | 0,78 µm à 1 mm
(Ondes micrométriques) |
Ondes infrarouges
(subdivis. recommandée par la CIE)
|
Ondes infrarouges
(suivant autre schéma de subdivision)
|
| 384 THz à 789 THz | 380 nm à 780 nm
(Spectre visible par l’homme : couleurs « spectrales ») |
|
(suivant autre schéma de subdivision) | |
| 789 THz à 30 PHz | 10 nm à 380 nm
(Ondes nanométriques) |
| ||
| 30 PHz à 300 EHz | 1 pm à 10 nm
(Ondes picométriques) |
| ||
Spectroscopie[modifier | modifier le code]
La spectroscopie ou spectrométrie est l'étude expérimentale des spectres électromagnétiques par des procédés d’observation et de mesure avec décomposition des radiations en bandes de fréquences idéalement étroites. La spectroscopie s'intéresse en général au spectre d'absorption ou au spectre d'émission d'un objet. Suivant le domaine du spectre électromagnétique, on distingue différentes spectroscopies. Les plus utilisées sont :
- la résonance magnétique nucléaire (RMN, IRM) qui utilise le domaine 100 à 1000 MHz (THF)
- la résonance paramagnétique électronique (RPE) qui utilise le domaine des GHz (UHF)
- la spectroscopie infrarouge qui utilise le domaine 400 - 4000 cm-1 soit 25 à 250 µm (IR-C)
- la spectroscopie visible qui utilise le domaine 12500 - 25000 cm-1 soit 380 à 780 nm
- la spectroscopie UV qui utilise le domaine 25000 à 50000 cm-1 soit 380 à 200 nm (UV-A, UV-B et UV-C).
Les spectroscopies des domaines IR, visible et UV utilisent principalement l'unité cm-1 pour caractériser les fréquences d'absorption.
Spectre d'émission[modifier | modifier le code]
Des atomes ou molécules excités (par exemple par chocs) se désexcitent en émettant une onde électromagnétique. Celle-ci peut se décomposer en une superposition d'ondes sinusoïdales (monochromatiques) caractérisées par leurs longueurs d'onde. Le spectre est constitué par l'ensemble des longueurs d'onde présentes. On peut le matérialiser à l'aide d'un prisme de décomposition de la lumière en un ensemble de lignes, les raies spectrales, qui correspondent aux différentes longueurs d'onde émises. Pour plus de précision, on peut également représenter ce spectre comme un graphe de l'intensité lumineuse en fonction de la longueur d'onde.
L'observation du spectre d'émission de l'hydrogène se fait au moyen d'un tube Geissler qui comporte deux électrodes et de l'hydrogène sous faible pression. Les électrodes sont soumises à une différence de potentiel de 1 000 V. L'important champ électrique accélère les ions présents qui, par chocs, excitent les atomes d'hydrogène. Lors de leur désexcitation, ils émettent de la lumière qui est analysée par un spectroscope. Dans tous les cas, on observe (dans le visible) le même spectre composé de quatre raies (spectres de raies) aux longueurs d'onde : 410 nm, 434 nm, 486 nm, 656 nm.
Niels Bohr interprétera alors l'émission de lumière par l'émission d'un photon lorsque l'atome passe d'un niveau d'énergie à un autre. Le spectre d'émission de n'importe quel élément peut être obtenu en chauffant cet élément, puis en analysant le rayonnement émis par la matière. Ce spectre est caractéristique de l'élément.
Spectre d'absorption[modifier | modifier le code]
Le principe est exactement le même que celui du spectre d'émission : à un niveau d'énergie donné correspond une longueur d'onde. Mais au lieu d'exciter de la matière (par exemple en la chauffant) pour qu'elle émette de la lumière, on l'éclaire avec de la lumière blanche (donc contenant toutes les longueurs d'onde) pour voir quelles longueurs d'onde sont absorbées. Les niveaux d'énergie étant caractéristiques de chaque élément, le spectre d'absorption d'un élément est exactement le complémentaire du spectre d'émission. On s'en sert notamment en astrophysique : par exemple, pour déterminer la composition de nuages gazeux, on étudie leur spectre d'absorption en se servant des étoiles se situant en arrière-plan comme source de lumière. C'est d'une manière générale le but de la spectrographie d'absorption : identifier des éléments inconnus (ou des mélanges) par leur spectre.
Absorption atmosphérique[modifier | modifier le code]

La plus grande partie du rayonnement ultraviolet et des rayons X sont absorbés dans la haute atmosphère.
Pour la partie visible du rayonnement électromagnétique, l'atmosphère est relativement bien transparente.
Dans le domaine infrarouge, le rayonnement électromagnétique est fortement absorbé par l'atmosphère, en particulier selon différents modes d'excitation de la vapeur d'eau.
Ensuite, dans le domaine des fréquences radio, lorsque l'énergie des photons diminue, l'atmosphère redevient transparente sauf pour les fréquences les plus basses (ondes longues) qui sont arrêtées par l'ionosphère.
Grandeurs physiques caractéristiques[modifier | modifier le code]
Présentation[modifier | modifier le code]
Un rayonnement électromagnétique peut se considérer soit comme une onde progressive, soit comme un ensemble de particules.
Si on le considère comme une onde, on peut le décomposer, selon la transformation de Fourier, en une somme d'ondes monochromatiques, dont chacune est entièrement décrite par deux grandeurs physiques :
- Son amplitude ;
- Sa fréquence ou sa longueur d'onde, grandeurs corrélées par la célérité de l'onde.
Si on le considère comme un ensemble de particules, chacune d'entre elles est entièrement décrite par son énergie. La répartition des énergies et leur somme obéissent aux lois statistiques.
- Unités
- La fréquence, notée ou , s'exprime en hertzs (Hz) dans le Système international d'unités (SI).
- La pulsation, notée , s'exprime en radians par seconde (rad/s) dans le SI.
- Le nombre d'onde, aussi appelé pulsation spatiale, est noté et s'exprime en radians par mètre (rad/m).
- La longueur d'onde, notée , s'exprime en unités de longueur (en mètres (m) dans le SI).
- L'énergie des photons, notée , s'exprime en joules (J) dans le SI, et aussi couramment en électron-volts (1 eV = 1,602 176 53 × 10−19 J).
Relations[modifier | modifier le code]
On passe de la définition comme onde à la définition comme particule, par les relations suivantes :
- où est la constante de Planck : ≈ 6,626 070 040 × 10−34 J s ≈ 4,135 667 662 × 10−15 eV s.
La longueur d'onde dépend de la célérité de la lumière dans le milieu de propagation. Si celui-ci n'est pas précisé, c'est la longueur d'onde dans le vide
- où est la vitesse de la lumière dans le vide : = 299 792 458 m s−1 (cette valeur est exacte, du fait de la définition actuelle du mètre)
sinon
- où est l'indice de réfraction dans le milieu à la fréquence , toujours égal à 1 dans le vide.
Notes et références[modifier | modifier le code]
- Richard Taillet, Loïc Villain et Pascal Febvre 2013, p. 635 « Spectre ».
- Richard Taillet, Loïc Villain et Pascal Febvre 2013, p. 634 Fig. 175.
- Robert Sève, Science de la couleur : Aspects physiques et perceptifs, Marseille, Chalagam, , p. 120-122.
- Trésor de la langue française, Oxford English Dictionnary.
- « A letter from M. Isaac Newton », Philosophical Transactions, , p. 3075-3087 (lire en ligne) ; voir Spectre visible
- Traité des couleurs, 1810.
- Sur la vue et les couleurs, 1816.
- Union internationale des télécommunications, « Nomenclature des bandes de fréquences et de longueurs d'onde employées en télécommunication », sur itu.int pour les bandes 3 à 15, soit de 300 Hz à 3 000 THz.
Voir aussi[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- Richard Taillet, Loïc Villain et Pascal Febvre, Dictionnaire de physique, Bruxelles, De Boeck, , p. 634-635
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :