Production d'hydrogène
La production d'hydrogène, ou plus exactement de dihydrogène, est en grande majorité réalisée par extraction chimique depuis des combustibles fossiles, principalement du méthane, du charbon et de coupes pétrolières. La production de dihydrogène par cette voie présente l'avantage d'un coût compétitif, mais l'inconvénient d'être à l'origine d'émissions de CO2 non biogénique, qui dépassent généralement dix kilogrammes de CO2 par kilogramme d'hydrogène produit.
L'électrolyse de l'eau permet de produire un hydrogène dont l'empreinte carbone est due uniquement au mode de production de l'électricité nécessaire (en tenant compte du rendement plus faible du procédé) et au cycle de fabrication et de recyclage des électrolyseurs.
Le dihydrogène est un vecteur énergétique majeur dans beaucoup de bactéries : il y est un sous-produit de la fermentation et de la fixation de l'azote. De façon artificielle, il peut être produit par réduction chimique ou par la chaleur (thermolyse) ; ces autres méthodes sont moins propices à la production industrielle, voire encore expérimentales. La découverte et le développement de méthodes moins coûteuses de production d'hydrogène en masse permettraient une « économie hydrogène ».
Histoire
[modifier | modifier le code]Au XVIe siècle, l'alchimiste Paracelse, entrevoit le gaz[Comment ?]. Un siècle plus tard, Robert Boyle parvient à recueillir du dihydrogène, mais ne le distingue pas de l’air ordinaire.[réf. nécessaire]
En 1603, Théodore de Mayerne l’enflamme et John Mayow, vers la fin du XVIIe siècle, le distingue de l’air. Enfin, au commencement du XVIIIe siècle, Nicolas Lémery en constate aussi l’inflammabilité[1].
Ce n’est qu’en 1766 que le gaz est étudié par Henry Cavendish. En 1783, Antoine Lavoisier découvre que l’« air inflammable » de Cavendish, qu’il baptise hydrogène (du grec « formeur d’eau »), réagit avec l’oxygène pour former de l’eau.
La découverte de l’« air inflammable », comme on l’appelait alors, est donc ancienne. Théodore de Mayerne et Paracelse l’obtenaient par réaction entre l’« huile de vitriol » (de l’acide sulfurique) diluée et versée sur du fer ou du zinc[2][réf. incomplète]. En 1870, le gaz produit pour les besoins des ballons à gaz n’utilise pas d’autre moyen[3]. Au XXIe siècle, le gros du dihydrogène requis est produit à partir du méthane présent dans le gaz naturel, par catalyse hétérogène[4].
Procédés
[modifier | modifier le code]Production mondiale de dihydrogène (2021)[5]
- Vaporeformage du méthane (62 %)
- Gazéification du charbon (19 %)
- Oxydation partielle du pétrole (18 %)
- Utilisation d'énergie fossile avec captage et valorisation du CO2 (0,7 %)
- Électrolyse de l'eau (0,04 %)
La production mondiale de dihydrogène représente 94 millions de tonnes en 2021, dont 62 % provient du vaporeformage du méthane, 18 % de l'oxydation partielle du pétrole, 19 % de la gazéification du charbon, 0,7 % d'un de ces trois procédés avec captage et valorisation du CO2 et 0,04 % de l'électrolyse de l'eau[5]. D'autres procédés sont largement minoritaires ou à l'état d'expérimentations, qui peuvent s'avérer prometteurs selon l'évolution relative des coûts des matières premières. Les procédés principaux consistent essentiellement à dissocier des hydrocarbures par une température élevée et l'adjonction de vapeur d'eau ou de dioxygène, éventuellement en présence d'un catalyseur ; les réactions ainsi entretenues donnent H2 et CO2, l'hydrogène provenant à la fois de l'eau et de l'hydrocarbure. Les émissions de CO2 de ces procédés atteignent, en 2021, 900 millions de tonnes par an, soit environ 2 % des émissions mondiales[6]
Le dihydrogène ainsi produit est dans sa grande majorité consommé localement[7]. Il entre en jeu dans la synthèse d'ammoniac comme engrais par le procédé Haber-Bosch (44 % de la consommation en 2015) et pour la conversion du pétrole lourd en fractions plus légères, par hydrocraquage (46 %)[8].
Utilisation du dihydrogène produit (2015)[8] :
- Industrie pétrolière : raffineries (hydrocraquage du pétrole lourd) (46 %)
- Agriculture : engrais (synthèse d'ammoniac) (44 %)
- Autres (10 %)
Classement par couleurs
[modifier | modifier le code]Les modes de production de l'hydrogène sont distingués par des noms de couleur[9],[10],[11],[12], variables selon les pays faute de consensus :
- hydrogène brun ou noir, produit par gazéification du charbon ;
- hydrogène gris, produit par vaporeformage du méthane (mode de production le plus utilisé) sans séquestration géologique du dioxyde de carbone ;
- hydrogène vert :
- au sens large, produit sans émission directe de gaz à effet de serre (incluant donc l'hydrogène jaune, rouge, bleu, turquoise, orange ou blanc, détaillés ci-dessous),
- au sens restreint, produit par électrolyse de l'eau[13]. Il est par exemple produit par électrolyse de l'eau à partir d'électricité renouvelable, par thermolyse de la biomasse[14] ou, selon la terminologie du plan de relance français de 2020, à partir d'électricité bas carbone (de source renouvelable ou nucléaire)[15].
- hydrogène jaune : produit par électrolyse de l'eau à partir d’électricité d’origine nucléaire[16], il est rose pour certains[17],[18], ou violet pour d’autres[19] ;
- hydrogène rouge : produit à partir du nucléaire (réacteurs VHTR à très haute température) par dissociation catalytique de l'eau à haute température[20] ;
- hydrogène bleu : produit par conversion de combustibles fossiles avec capture et séquestration du dioxyde de carbone[21] ou, pour d'autres auteurs, à partir d'énergie bas carbone non renouvelable, par exemple par électrolyse de l'eau alimentée par l'énergie nucléaire[22] (soit l'hydrogène jaune ci-dessus) ;
- hydrogène turquoise : extrait du méthane par pyrolyse, sans émission directe de CO2[12],[23] ;
- hydrogène orange : obtenu par réaction de l'eau avec les roches du substratum, qui offre la possibilité de séquestrer géologiquement du dioxyde de carbone dissous dans l'eau injectée[24] ;
- hydrogène blanc : hydrogène natif ou naturel[25],[26].
Devant cette absence de consensus, les députés européens pointent la nécessité d'un accord sur une terminologie uniforme afin de, notamment, distinguer clairement l'hydrogène renouvelable, l'hydrogène à faible teneur en carbone et l'hydrogène d'origine fossile[27].
Par vaporeformage d'hydrocarbures
[modifier | modifier le code]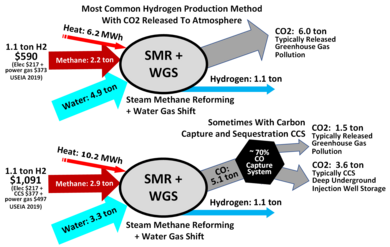

Le dihydrogène qualifié d'hydrogène gris[28] est produit par vaporeformage du gaz naturel ou, moins souvent, du GPL ou du naphta, selon leur prix et leur disponibilité[7]. Le rendement énergétique de conversion atteint 72-82 % (sur pouvoir calorifique inférieur) selon le procédé mis en œuvre[29]. Le vaporeformage du méthane fournit, en 2015, 49 % du dihydrogène produit dans le monde[8].
La méthode de conversion des hydrocarbures cause des rejets de gaz à effet de serre. Le vaporeformage du méthane rejette ainsi de 10 à 12 tonnes de CO2 par tonne d’hydrogène produite[23]. Étant donné que la production est concentrée dans un seul établissement, il est possible de séparer les gaz et de les séquestrer (l'hydrogène est alors qualifié d'hydrogène bleu[28]), par exemple pour les injecter dans une couche de pétrole ou de gaz naturel, mais les coûts de tels procédés et l'incertitude sur les risques de relargage du CO2 font qu'il ne sont que rarement mis en œuvre, dans les années 2010[réf. souhaitée]. Par exemple, un projet d'injection de dioxyde de carbone dans le gisement de gaz de Sleipner (en) a été lancé par la compagnie norvégienne StatoilHydro[30].
Réduction de la vapeur d'eau
[modifier | modifier le code]La première étape est la réaction de vaporeformage proprement dit[31].
À haute température (840 à 920 °C, obtenue par combustion d'un quart du méthane[32]) et à pression modérée (20-30 bar), de la vapeur d'eau (H2O) réagit avec le méthane (CH4) sur un catalyseur au nickel (Ni) pour obtenir un mélange de monoxyde de carbone (CO) et de dihydrogène (H2), mélange connu sous le nom de « gaz de synthèse »[31].
- CH4 + H2O → CO + 3 H2
Cette réaction endothermique absorbe 191,7 kJ/mol d'énergie.
La chaleur nécessaire au processus est généralement fournie par combustion d'une partie du méthane.
Conversion du monoxyde de carbone
[modifier | modifier le code]
Du dihydrogène supplémentaire peut être récupéré par ajout d'eau, par le biais de la réduction de l'eau, dans la réaction du gaz à l'eau réalisée à environ 130 °C :
- CO + H2O → CO2 + H2
Cette oxydation est exothermique, qui libère 40,4 kJ/mol pour entretenir la réaction en cours.
Essentiellement, l'atome d'oxygène (O) est extrait de l'eau (vapeur) ajoutée pour oxyder le CO en CO2.
Bilan
[modifier | modifier le code]Le bilan des deux réactions est alors une réaction endothermique :
- CH4 + 2H2O → CO2 + 4H2
Le gaz de synthèse obtenu contient 16 à 25 % de CO2 en volume.
Par oxydation partielle
[modifier | modifier le code]L'oxydation partielle peut s'effectuer sur du gaz naturel, des fractions plus lourdes du pétrole, du charbon ou de la biomasse, les charges solides étant alors gazéifiées. Le rendement énergétique de conversion atteint typiquement 53-67 % (sur pouvoir calorifique inférieur) selon le procédé mis en œuvre[29]. Quelle que soit la charge, ce procédé implique alors un surcoût par rapport au vaporeformage du méthane[33]. Il est donc employé essentiellement dans quelques cas :
- pour fournir des gaz de synthèse avec un ratio H2/O particulier utile à la pétrochimie ;
- lorsque les hydrocarbures légers sont indisponibles ;
- pour détruire des résidus d'hydrocarbures lourds peu valorisables.
Le principe du procédé est similaire à celui du vaporeformage du méthane pour former également du gaz de synthèse, à ceci près que l'oxydation de l'hydrocarbure choisi est effectuée par du dioxygène au lieu d'eau, que la réaction bilan est exothermique, et qu'on n'a (généralement) pas recours à un catalyseur. Au lieu de celui-ci, les conditions sont plus contraignantes, la température (900 à 1 500 °C) et la pression (20-60 bar étant plus élevées[34].
Par électrolyse de l'eau
[modifier | modifier le code]

L'électrolyse de l'eau est un procédé électrolytique qui décompose l'eau en dioxygène et dihydrogène grâce à un courant électrique. Environ 0,04 % du dihydrogène gazeux produit dans le monde est produit par électrolyse[5].
Le rendement énergétique de l'électrolyse de l'eau atteint 40 %, sur pouvoir calorifique inférieur (PCI), ou 80 % sur pouvoir calorifique supérieur (PCS), c'est-à-dire si toute la chaleur latente de la vapeur produite est valorisée en sus de l'hydrogène[8],[35]. Ces valeurs se réfèrent seulement au rendement de la conversion de l'énergie électrique en énergie chimique de l'hydrogène ; l'énergie perdue lors de la génération de l'électricité et du traitement de l'eau n'est pas comptabilisée. L'eau pure nécessaire au procédé est en effet obtenue par osmose inverse, procédé coûteux en énergie et émetteur de CO2[23].
Une électrolyse alimentée en électricité décarbonée, d'origine renouvelable (hydroélectricité, éolien, solaire photovoltaïque) ou nucléaire, permettrait de réduire la pollution émise[Combien ?], par rapport au vaporeformage ou à l'électrolyse alimentée en électricité carbonée. Selon la source d'énergie utilisée, l'hydrogène est qualifié d'hydrogène vert dans le cas d'énergie renouvelable, ou d'hydrogène jaune dans le cas d'un apport par le nucléaire[28].
En 2023, en France, une plateforme offshore flottante baptisée « Sealhyfe » et équipée d'une éolienne est le premier prototype d'une production d’hydrogène en mer. Elle est équipée pour tester, sur une plateforme en mouvement et exposée à l'atmosphère saline, la production et la conversion d'électricité éolienne en hydrogène. Elle doit pour cela pomper, désaliniser et purifier l'eau de mer, puis la dissocier par électrolyse pour produire 400 kilogrammes de dihydrogène par jour[36].
Produire de l'hydrogène par voie chimique directe ou thermochimique reste plus efficace que par électrolyse[réf. nécessaire], mais la filière chimique est associée à des risques de pollution ou de génération de sous-produits toxiques lors de l'extraction de l'hydrogène.
Des procédés alternatifs électrolytiques, encore émergents ou marginaux, sont présentés ci-dessous.
Fractionnement photoélectrochimique de l'eau
[modifier | modifier le code]Utiliser l'électricité produite par des systèmes photovoltaïques est la façon la plus « propre » de produire de l'hydrogène vert. L'eau est séparée en dihydrogène et dioxygène par électrolyse dans une cellule photoélectrochimique (PEC), éventuellement en présence d'un catalyseur, un procédé également nommé « photosynthèse artificielle ». Les recherches menées, en lien avec l'industrie photovoltaïque, concernent l'élaboration de cellules multijonctions plus efficaces et à durée de vie plus longue, ainsi que de « photoréacteurs ».
En 2019, le département de l'Énergie des États-Unis a lancé, dans le cadre de son programme de développement de réacteurs nucléaires avancés (Nuclear Energy’s Advanced Reactor Development Project), quatre projets de démonstration de production d'hydrogène par des centrales nucléaires : un en (Exelon) et trois en septembre : FirstEnergy Solutions (FES) dans sa centrale nucléaire de Davis-Besse dans l'Ohio, Xcel Energy dans l'une de ses deux centrales du Minnesota et Arizona Public Service (APS) dans sa centrale nucléaire de Palo Verde, avec subventions et appui de plusieurs laboratoires de recherche publics. Ils s'agit notamment d'absorber la variabilité de la production par les énergies renouvelables[37].
Électrolyse à haute température
[modifier | modifier le code]Quand l'énergie est disponible sous forme de très haute température (centrale nucléaire ou moindrement concentration solaire thermique), la meilleure voie de production du dihydrogène pourrait être l'électrolyse à haute température (HTE). Contrairement à l'électrolyse à basse température, la HTE convertit davantage de chaleur initiale en énergie chimique (le dihydrogène), ce qui permet d'augmenter l'efficacité de conversion d'environ 50 %[réf. nécessaire]. L'électrolyse à haute température est ainsi théoriquement plus efficace que le procédé à température ambiante (jusqu'à 92 % sur pouvoir calorifique supérieur (PCS)[38]), puisqu'une partie de l'énergie nécessaire à la réaction est apportée via la chaleur, moins chère à obtenir que l'électricité, et que les réactions d'électrolyse ont un meilleur rendement à haute température.
Le Laboratoire d'innovation pour les technologies des énergies nouvelles et les nanomatériaux (Liten) du CEA, à Grenoble (Isère), développe l'électrolyse à haute température dont il estime le rendement supérieur de 15 points à celui des technologies concurrentes, car « sous forme de vapeur, casser la molécule d'eau nécessite moins d'énergie ». Il a créé pour cela en 2021 la coentreprise Genvia avec Schlumberger, Vicat et la région Occitanie[39].
L'HTE a été démontrée en laboratoire, mais pas encore à échelle industrielle. Des prototypes de réacteurs nucléaires dits « de quatrième génération » fonctionnent de 850 à 1 000 °C, température considérablement plus élevée que celle des réacteurs nucléaires actuels[réf. nécessaire]. General Atomics prédit que le dihydrogène produit dans un réacteur nucléaire à très haute température coûterait 1,53 $/kg[réf. nécessaire]. En 2003, le vaporeformage produisait du dihydrogène à 1,40 $/kg. En 2005, avec l'envolée du prix du pétrole, le prix du dihydrogène était de 2,70 $/kg. Par conséquent, pour les seuls États-Unis, une économie de dizaines de milliards de dollars par an est possible sur le dihydrogène produit par le nucléaire.
Une telle production centralisée viserait un approvisionnement en hydrogène compétitif face au procédé de vaporeformage.
Production biologique
[modifier | modifier le code]Par fermentation
[modifier | modifier le code]La production de dihydrogène par fermentation est la conversion de substrat organique en « biohydrogène » par divers groupes de bactéries utilisant plusieurs systèmes d'enzyme, impliquant trois étapes semblables à la digestion anaérobie. On distingue et oppose :
- la photofermentation, qui ne se produit qu'en présence d'une lumière suffisante, par exemple avec Rhodobacter sphaeroides SH2C qui peut être employée pour convertir de petites molécules d'acides gras en hydrogène[40]. L'électrohydrogenèse (en) est utilisée dans la pile à combustible microbienne ;
- la fermentation en obscurité (dark fermentation en anglais), qui résulte de l'action de bactéries capables de produire constamment l'hydrogène à partir de composés organiques (de jour comme de nuit).
Un prototype de bioréacteur à hydrogène utilisant des déchets comme matière première est opérationnel à l'usine de jus de raisin Welch, dans le nord-est de la Pennsylvanie[réf. nécessaire].
Photoproduction
[modifier | modifier le code]
Dans certains organismes comme les algues ou les cyanobactéries, et dans certaines conditions de croissance, une partie des électrons issus de la production photosynthétique d'oxygène peut être utilisée pour la production d'hydrogène. Il ne s'agit pas d'un métabolisme naturel, et il n'est que transitoire parce que les enzymes hydrogénases qui catalysent la production de dihydrogène sont inhibées par l'oxygène. Ce phénomène a été expliqué dans les années 1990 et fait depuis l'objet de développements[41], ce qui ouvrirait la voie à l'exploitation.
Par la nitrogénase
[modifier | modifier le code]Le dihydrogène est un sous-produit de la réaction de réduction bactérienne de l'azote en ammonium catalysée par la nitrogénase[42].
Production chimique
[modifier | modifier le code]La production chimique de dihydrogène exploite une réaction de corrosion en solution aqueuse.
Des différents métaux envisagés, l'aluminium et ses alliages sont parmi les plus appropriés pour le développement à venir[43]. L'aluminium peut être stocké et transporté d'une manière simple, plus sûre et moins chère que le dihydrogène. Il est stable dans les conditions habituelles et beaucoup moins cher que le borohydrure de sodium (NaBH4) (3 $/kg)[44].
Les réactions de l'aluminium avec les solutions aqueuses d'hydroxyde de sodium sont les suivantes[45] :
- 2Al + 6H2O + 2NaOH → 2NaAl(OH)4 + 3H2 (1) ;
- NaAl(OH)4 → NaOH + Al(OH)3 (2) ;
- 2Al + 6H2O → 2Al(OH)3 + 3H2 (3).
Initialement, la réaction de la génération du dihydrogène (1) consomme de l'hydroxyde de sodium, mais lorsque la concentration d'aluminate de sodium est supérieure à la limite de saturation, l'aluminate subit une réaction de décomposition (2) qui produit un précipité cristallin, de l'hydroxyde d'aluminium, avec la régénération de l'alcali. La réaction (2) a été étudiée en profondeur au sujet de la pile à aluminium. La réaction totale (1 et 2) de l'aluminium dans une solution aqueuse, qui génère du dihydrogène, est décrite par la réaction (3). Il a été démontré que ce processus est en mesure de produire du dihydrogène à partir de l'aluminium avec régénération des ions hydroxyde[46]. Un obstacle majeur à la production de dihydrogène par cette voie vient du fait que la surface de l'aluminium peut être facilement passivée[47], mais la passivation peut être minimisée en optimisant plusieurs paramètres expérimentaux tels que la température, la concentration de l'alcali, la forme de la matière première (l'aluminium) et la composition de la solution.
Les systèmes de production de dihydrogène reposant sur la corrosion de l'aluminium n'ont pas besoin d'un apport de chaleur externe, puisque la corrosion de l'aluminium est une réaction exothermique. Celle-ci peut être obtenue dans des états de température et de pression douces, offrant une source de dihydrogène stable et compacte. Cette réduction chimique est particulièrement adaptée pour les applications à distance, mobiles, ou marines. Un kilogramme d'aluminium produit environ 4 kWh d'énergie sous forme de dihydrogène[48] et, pour un objectif de génération de dihydrogène de 100 % d'efficacité, il est possible de parvenir à une capacité gravimétrique d'hydrogène de 11,2 %m H2, qui est une valeur significative à l'accomplissement des objectifs de recherche du département de l'Énergie des États-Unis[49]. Cette capacité gravimétrique d'hydrogène peut être augmentée en utilisant une combinaison d'aluminium et de tétrahydruroborate de sodium (NaBH4)[50].
Le magnésium est également considéré[51].
Production thermochimique
[modifier | modifier le code]Certains procédés thermochimiques peuvent produire du dihydrogène et du dioxygène à partir d'eau et de chaleur sans utiliser d'électricité. Étant donné que le seul apport énergétique pour de tels processus est la chaleur, ils peuvent être plus efficaces que l'électrolyse à haute température, car l'efficacité de la production d'électricité est intrinsèquement limitée[C'est-à-dire ?]. La production thermochimique de dihydrogène utilisant l'énergie chimique du charbon (hydrogène noir ou brun[28]) ou du gaz naturel n'est généralement pas considérée, parce que la voie chimique directe est plus efficace.
Des centaines de cycles thermochimiques ont été présélectionnés. Certains des plus prometteurs comprennent :
- cycle soufre-iode (cycle IS) ;
- chlorure de cérium (cycle Ce-Cl) ;
- chlorure de fer
 (cycle Fe-Cl) ;
(cycle Fe-Cl) ; - iodure de magnésium (cycle Mg-I) ;
- chlorure de vanadium (cycle V-Cl) ;
- sulfate de cuivre (cycle Cu-SO4).
Des variantes « hybrides » exploitent des cycles thermochimiques comprenant une étape électrochimique :
- cycle hybride soufre ;
- cycle cuivre-chlore (Cu-Cl).
Pour tous les procédés thermochimiques, la réaction résumée est celle de la décomposition de l'eau :
- .
Tous les autres produits chimiques utilisés sont recyclés.
Aucun des processus thermochimiques de production d'hydrogène n'a été appliqué à un niveau de production, bien que plusieurs aient été démontrés en laboratoire.
À partir des sables bitumineux
[modifier | modifier le code]En , la société canadienne Proton Technologies expose un nouveau procédé d'extraction de l'hydrogène des sables bitumineux du Canada[52]. Il repose sur l'injection d'oxygène dans des sables bitumineux, qui élève la température et libère de l’hydrogène. Celui-ci peut ensuite être séparé des autres gaz via des filtres idoines, ce qui ne laisse remonter en surface que l'hydrogène pur. Cette technologie permettrait d'extraire l'hydrogène d'une manière beaucoup plus propre que tous les procédés connus jusqu'alors, et pour un coût moindre[53].
Par pyrolyse plasmatique
[modifier | modifier le code]La pyrolyse plasmatique consiste à casser directement par plasma la molécule du méthane (CH4) en hydrogène et en carbone. Celui-ci est obtenu sous forme de poudre impalpable de noir de carbone, sans aucune production de CO2. La consommation d’électricité est de quatre à cinq fois moindre que celle de l'électrolyse. La poudre de carbone peut être revendue à certaines industries (pneumatiques, par exemple). Ce procédé est developpé par la startup française Spark Cleantech en partenariat avec le CNRS[54][source secondaire nécessaire].
Autres méthodes
[modifier | modifier le code]- L'électrolyse chlore-soude, à partir de saumure (eau chargée en sel) et d'énergie électrique, produit également du dihydrogène, en même temps que du dichlore et de la soude.
- Le reformage plasma, qui permet de décomposer un hydrocarbure en hydrogène et carbone[55],[56].
- Le craquage de l'eau par photocatalyse fait appel à des photons de diverses longueurs d'onde et à des catalyseurs, éventuellement dopés par des cocatalyseurs qui améliorent les performances du système.
Notes et références
[modifier | modifier le code]- Carilian-Goeury et Dalmont, Leçons de chimie élémentaire appliquées aux arts industriels et faites aux Ouvriers du XIIe arrondissement ... aux écoles du gouvernement, vol. 1, 1855 (lire en ligne).
- Buck, p. 265.
- James Glaisher, Wilfrid de Fonvielle, Camille Flammarion et Gaston Tissandier, Voyages Aériens, 1870 (lire en ligne).
- (en) « Ammonia Process Overview », Nexant, (consulté le ).
- « Un « élan croissant » pour la production d'hydrogène bas carbone mais... », sur Connaissances des énergies, (consulté le ), citant AIE 2022.
- AIE 2022.
- AFHYPAC 2014, p. 1.
- « Hydrogène énergie », sur Connaissance des Énergies, (consulté le ) (mis à jour le ).
- « Fin du gaz russe : l’hydrogène et l’ammoniac bleu comme alternative de luxe ? », sur France 24, (consulté le ).
- (en) Gas Decarbonisation Pathways 2020–2050, Gas for climate, , 226 p. (lire en ligne [PDF]), p. 17-18.
- « Quelle différence entre hydrogène noir/brun, vert, bleu, rose, blanc ou gris ? », sur Media24, (consulté le ).
- Laurent Fulcheri, « « L’hydrogène turquoise », une solution viable sans CO2 ? », Polytechnique Insights, Institut polytechnique de Paris, (consulté le ).
- L'hydrogène pourra-t-il verdir le transport lourd?, lesaffaires.com, .
- « Hydrogène vert », sur Gouvernement du Québec (consulté le ).
- « Plan de relance : quelle place pour l’énergie ? », sur connaissancedesenergies.org, .
- « Les 7 couleurs de l’hydrogène », sur H2H24 (consulté le ).
- Olivier Daelen, « Cette centrale nucléaire britannique veut produire de l’hydrogène rose : une première en Europe », sur fr.businessam.be, 2 août 2021.
- « Le plan hydrogène français entérine discrètement la relance du nucléaire », sur Reporterre, .
- (en) « Hydrogen produced from nuclear will be considered ‘low-carbon’, EU official says » [« L'hydrogène produit à partir du nucléaire sera considéré comme « à faible empreinte en carbone », selon un fonctionnaire de l'UE »], sur EURACTIV, .
- (en-US) admin, « Colors », sur Hydrogen x Revolve (consulté le ).
- (en) « L’hydrogène et ses 50 nuances de gris, vert, bleu… », sur Energy Cities, (consulté le ).
- Official CertifHy definitions (CertifHy 2016) Green and Blue Hydrogen, sur certifhy.ca (consulté le 19 janvier 2022).
- « Une nouvelle technologie de pyrolyse plasma du méthane pour produire de l'hydrogène », sur Éditions techniques de l'ingénieur, (consulté le ).
- (en) Florian Osselin, Cyprien Soulaine, C. Fauguerolles, Éric C. Gaucher, Bruno Scaillet et al., « Orange hydrogen is the new green », Nature Geoscience, vol. 15, no 10, , p. 765-769 (DOI 10.1038/s41561-022-01043-9, lire en ligne
 [PDF], consulté le ).
[PDF], consulté le ).
- « Et si l'hydrogène naturel était le game changer de la transition énergétique ? », sur La Tribune (consulté le ).
- « La France a une carte à jouer dans l'hydrogène naturel », sur h2-mobile.fr (consulté le ).
- « Changement climatique: un plan pour l'hydrogène renouvelable et l'intégration des systèmes énergétiques », Parlement européen, 19 mai 2021.
- « Les couleurs de l'hydrogène français au cœur d'un débat avec l'Allemagne », L'Usine nouvelle.
- AFHYPAC 2014, p. 5.
- Captage et stockage géologique du CO2 : retour d’expérience et perspectives (rapport d'étude), Ineris, , 63 p. (lire en ligne [PDF]), p. 13.
- AFHYPAC 2014, p. 2.
- Bellona 2002, p. 18.
- AFHYPAC 2014, p. 6-8.
- AFHYPAC 2014, p. 6.
- AFHYPAC 2014, p. 2.
- « De l’hydrogène renouvelable en mer, une première mondiale », sur Gouvernement.fr, (consulté le ).
- (en) « Three More Nuclear Plant Owners Will Demonstrate Hydrogen Production », Powermag, 11 septembre 2019.
- Bellona 2002, p. 20.
- Le CEA-Liten, « accélérateur de particules » dans l'hydrogène, Les Échos, 16 novembre 2022.
- (en) YongZhen Tao, Yang Chen, YongQiang Wu, YanLing He et ZhiHua Zhou, « High hydrogen yield from a two-step process of dark-and photo-fermentation of sucrose », International Journal of Hydrogen Energy, Oxford, Elsevier, vol. 32, no 2, , p. 200-206 (ISSN 0360-3199, résumé).
- (en) Christopher Williams, « Pond life: the future of energy : Hydrogen-producing algae breakthrough », sur The Register, (consulté le ).
- (en) Brian M. Hoffman, Dmitriy Lukoyanov, Zhi-Yong Yang et Dennis R. Dean, « Mechanism of nitrogen fixation by nitrogenase: the next stage », Chemical Reviews, vol. 114, no 8, , p. 4041–4062 (ISSN 1520-6890, PMID 24467365, PMCID 4012840, DOI 10.1021/cr400641x, lire en ligne, consulté le ).
- (en) H.Z. Wang, D.Y.C. Leung, M.K.H. Leung et M. Ni, « A review on hydrogen production using aluminum and aluminum alloys », Renewable and Sustainable Energy Reviews, Elsevier, vol. 13, no 4, , p. 845-853 (DOI 10.1016/j.rser.2008.02.009, résumé).
- http://www.lme.co.uk/dataprices_daily_metal.asp
- (en) David Belitskus, « Reaction of Aluminum with Sodium Hydroxide Solution as a Source of Hydrogen », Journal of The Electrochemical Society, Pennington (New Jersey), The Electrochemical Society, vol. 117, no 8, , p. 1097–1099 (ISSN 0013-4651, DOI 10.1149/1.2407730).
- (en) Lluís Soler, Jorge Macanás, Maria Muñoz et Juan Casado, « Aluminum and aluminum alloys as sources of hydrogen for fuel cell applications », J. Power Sources, Elsevier, vol. 169, no 1, , p. 144–149 (DOI 10.1016/j.jpowsour.2007.01.080, résumé).
- (en) D. Stockburger (dir.), J.H. Stannard (dir.), B.M.L. Rao, W. Kobasz et C.D. Tuck, Hydrogen storage materials, batteries, and electrochemistry, Pennington (New Jersey), The Electrochemical Society, (ISBN 978-1-56677-006-4, OCLC 25662899, LCCN 92070850), p. 431–444.
- (en) Steven C. Amendola (dir.), Michael Binder (dir.), Michael T. Kelly, Phillip J. Petillo et Stefanie L. Sharp-Goldman, Advances in Hydrogen Energy, New York, Kluwer Academic Publishers, , 192 p. (ISBN 978-0-306-46429-4 et 978-0-306-46922-0, LCCN 00055103, DOI 10.1007/0-306-46922-7_6, lire en ligne), « A Novel Catalytic Process for Generating Hydrogen Gas from Aqueous Borohydride Solutions », p. 69–86.
- (en) http://www.sc.doe.gov/bes/hydrogen.pdf [PDF].
- (en) Lluís Soler, Jorge Macanás, Maria Muñoz et Juan Casado, « Synergistic hydrogen generation from aluminum, aluminum alloys and sodium borohydride in aqueous solutions », International Journal of Hydrogen Energy, Elsevier, vol. 32, no 18, , p. 4702–4710 (ISSN 0360-3199, DOI 10.1016/j.ijhydene.2007.06.019, résumé).
- « Génération d’hydrogène par hydrolyse en présence de magnésium », sur Techniques de l'ingénieur (consulté le ).
- (en) Ian Gates et al., « Clean Hydrogen Production (Only!) from Heavy Oil Reservoir », Goldschmidt Abstract, Barcelone, (lire en ligne, consulté le ).
- « Une nouvelle méthode non-polluante permet d’extraire de l’hydrogène à partir de pétrole et de bitume », Trust My Science, 22 août 2019, citant (en) I. Gates, J. Wang, G. Strem et S. Afshordi, « Clean Hydrogen Production (Only!) from Heavy Oil Reservoir », Goldschmidt Abstracts, Barcelone, 18-23 août 2019, p. 1098 (lire en ligne, consulté le ).
- « Spark Cleantech », (consulté le ).
- AFHYPAC 2014.
- Bellona 2002, p. 19.
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hydrogen production » (voir la liste des auteurs).
Annexes
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Hydrogène
- Économie hydrogène
- Hydrogène vert
- Véhicule à hydrogène
- Station à hydrogène
- Électrolyse de l'eau
- Reformage du méthane
- Production d'ammoniac
- Réacteur nucléaire à très haute température
- Vecteur énergétique
- Stockage d'hydrogène
- Technologie de l'hydrogène
- Chronologie des technologies de l'hydrogène
- Détection de fuite
- Détection de fuite d'hydrogène (en)
- The Hype about Hydrogen (en)
Liens externes
[modifier | modifier le code]- U.S. DOE 2007-Technical progress in hydrogen production
- U.S. DOE Hydrogen from Coal Research
- U.S. NREL article on hydrogen production
- Article advocating the use of nuclear power to produce hydrogen
- Génie génétique des protéines du sang peut être utilisé pour produire du gaz hydrogène à partir de l'eau
- Bio-hydrogène
- Ressources sur les centrales à hydrogène
Bibliographie
[modifier | modifier le code]![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- (en-GB) Global Hydrogen Review 2022, Agence internationale de l'énergie, , 284 p. (présentation en ligne, lire en ligne
 [PDF]).
[PDF]). 
- Thierry Alleau, chap. 3.2.1 « Production d’hydrogène par électrolyse de l’eau », dans Mémento de l’hydrogène, Association française pour l'hydrogène et les piles à combustible (AFHYPAC), (lire en ligne [PDF]).

- CGEDD, CGE, Filière hydrogène-énergie (rapport no 010177-01), (rendu public le ), 161 p. [PDF] ; résumé.
- Jean-Pierre Jonchère, chap. 3.1.1 « Production d’hydrogène à partir des procédés de reformage et d’oxydation partielle », dans Mémento de l’hydrogène, Association française pour l'hydrogène et les piles à combustible (Afhypac), (lire en ligne [PDF]).

- (en) Bjørnar Kruse, Sondre Grinna et Cato Buch, Hydrogen : Status og muligheter (rapport no 6), Bellona, , 53 p. (lire en ligne [PDF]).

- Jeremy Rifkin, L'économie hydrogène : après la fin du pétrole, la nouvelle révolution économique, La Découverte, 2002.


