Chlorure de potassium
| Chlorure de potassium | |

| |
| Identification | |
|---|---|
| Nom UICPA | Chlorure de potassium |
| Synonymes |
Murate de potassium |
| No CAS | |
| No ECHA | 100.028.374 |
| No CE | 231-211-8 |
| Code ATC | A12, B05 |
| No E | E508 |
| Apparence | cristaux incolores,hygroscopiques[1]. |
| Propriétés chimiques | |
| Formule | KCl |
| Masse molaire[3] | 74,551 ± 0,002 g/mol Cl 47,55 %, K 52,45 %, |
| Moment dipolaire | 10,269 ± 0,001 D [2] |
| Propriétés physiques | |
| T° fusion | 770 à 773 °C[1] |
| T° ébullition | Point de sublimation : 1 500 °C |
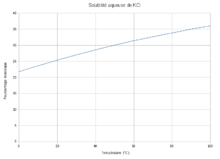
| Solubilité | 0,340 g·cm-3 dans l'eau 0,4 dans l'éthanol insoluble dans l'acétone |
| Masse volumique | 1,98 g·cm-3[1] |
| Thermochimie | |
| ΔfH0liquide | −421,79 kJ·mol-1 [4] |
| ΔfH0solide | −436,68 kJ·mol-1 [4] |
| Cp | 51,29 J·K-1·mol-1 (solide, 24,85 °C)[4] |
| Cristallographie | |
| Structure type | NaCl[5] |
| Propriétés optiques | |
| Indice de réfraction | 1,495 01 1,489 69 |
| Précautions | |
| SIMDUT[6] | |
Produit non contrôlé |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le chlorure de potassium est un composé chimique de formule KCl.
Sa forme minéralogique est la sylvine (ou sylvite ou sylvinite) et sa structure cristallographique est cubique face-centré. On peut le rayer à l'ongle.
Utilisation
Alimentation
Le chlorure de potassium (numéro E508[7]) est utilisé dans les denrées alimentaires comme remplacement du sel de cuisine (halite, NaCl) car il possède une saveur salée similaire. Cependant il développe aussi un arrière-goût amer qui permet de les différencier.
Agriculture
Le terme « potasse » englobe le chlorure de potassium, le chlorure de potassium-magnésium (carnallite), le sulfate de potassium-magnésium, le sulfate de potassium (c'est un engrais obtenu par l'action de l'acide sulfurique sur KCl), le nitrate de potassium et l'hydroxyde de potassium KOH, base bien plus forte que l'hydroxyde de sodium NaOH.
Poison
La dose létale 50 (dose mesurée sur la souris) de chlorure de potassium est à peu près de 2 500 mg·kg-1 par voie orale (c'est-à-dire 190g pour 75 kg; à titre de comparaison, le chlorure de sodium (sel de table) a une DL50 orale de 3 750 mg·kg-1) et de 100 mg·kg-1 en voie intraveineuse. Il est utilisé lors des exécutions de condamnés à mort aux États-Unis, par injection létale : l'administration en intraveineuse d'une solution excessive de KCl provoque un arrêt cardiaque. C’est en raison de cette toxicité qu’en pratique médicale une perfusion de ce soluté ne doit pas dépasser un débit de 1,5 g par heure.
Il peut être aussi utilisé pour les interruptions médicales de grossesse par injection intracardiaque fœtale.
Extraction du gaz de schiste par hydrofracturation
Le documentaire GasLand (2010) de l'américain Josh Fox montre que l'industrie américaine de l'extraction du gaz de schiste reconnaît l'usage du chlorure de potassium, dilué dans un mélange d'eau, à d'autres produits chimiques toxiques et de sable pour l'injection dans les puits d'extraction du gaz de schiste comme liquide d'hydrofracturation. Le chlorure de potassium est employé comme absorbeur d'oxygène, mais cette technique visant à libérer le gaz contenu dans la couche de schiste a aussi pour conséquences de polluer les nappes phréatiques avec le liquide de fracturation. Pour un puits d'extraction, il faut entre 10 à 30000 mètres cubes d'eau, la moitié environ est récupérée après fracturation.
Divers
Le chlorure de potassium fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en avril 2013)[8].
Référence
- CHLORURE DE POTASSIUM, Fiches internationales de sécurité chimique
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Potassium chloride », sur NIST/WebBook, consulté le 7 mars 2010
- (en) Bodie E. Douglas, Shih-Ming Ho, Structure and Chemistry of Crystalline Solids, Pittsburgh, PA, USA, Springer Science + Business Media, Inc., , 346 p. (ISBN 0-387-26147-8), p. 64
- « Chlorure de potassium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Noms de catégorie et système international de numérotation des additifs alimentaires - Codex Alimentarius
- WHO Model List of Essential Medicines, 18th list, avril 2013
Robin Cook : "Facteur de risque"


