« Cycle de Krebs » : différence entre les versions
m Mise en forme. |
Complément. |
||
| Ligne 401 : | Ligne 401 : | ||
* Le [[Complexe alpha-cétoglutarate déshydrogénase|complexe α-cétoglutarate déshydrogénase]] est activé par le [[calcium]] et inhibé par le [[Nicotinamide adénine dinucléotide|NADH]], l'[[Adénosine triphosphate|ATP]] et son produit de réaction, la [[Succinyl-coenzyme A|succinyl-CoA]]. |
* Le [[Complexe alpha-cétoglutarate déshydrogénase|complexe α-cétoglutarate déshydrogénase]] est activé par le [[calcium]] et inhibé par le [[Nicotinamide adénine dinucléotide|NADH]], l'[[Adénosine triphosphate|ATP]] et son produit de réaction, la [[Succinyl-coenzyme A|succinyl-CoA]]. |
||
La régulation du cycle de Krebs repose essentiellement sur la disponibilité du [[Substrat enzymatique|substrat]] et l'[[Inhibiteur enzymatique|inhibition]] par les produits de réaction. Si ces réactions n'étaient pas régulées, le cycle de Krebs gaspillerait de grandes quantités d'énergie métabolique en produisant un excès d'[[Adénosine triphosphate|ATP]] et de [[coenzyme]]s [[Réduction (chimie)|réduites]] telles que le [[Nicotinamide adénine dinucléotide|NADH]]. |
|||
Il y a donc une régulation selon la disponibilité du substrat, le pouvoir réducteur, la concentration en produit et la charge énergétique. On peut noter qu'il n'y a pas de régulation par covalence ([[phosphorylation]] des [[protéine]]s). |
|||
* Le NADH est produit par toutes les [[déshydrogénase]]s du cycle hormis la [[succinate déshydrogénase]] et a pour effet d'inhiber le [[complexe pyruvate déshydrogénase]], l'[[isocitrate déshydrogénase]], le [[Complexe alpha-cétoglutarate déshydrogénase|complexe α-cétoglutarate déshydrogénase]] ainsi que la [[citrate synthase]]. |
|||
* L'[[Acétyl-coenzyme A|acétyl-CoA]] inhibe le complexe pyruvate déshydrogénase, tandis que la [[Succinyl-coenzyme A|succinyl-CoA]] inhibe le complexe α-cétoglutarate déshydrogénase et la [[citrate synthase]]. Les essais ''[[in vitro]]'' sur les enzymes du cycle de Krebs montrent que l'ATP inhibe la citrate synthase et le complexe α-cétoglutarate déshydrogénase ; cependant, le taux d'ATP ''[[in vivo]]'' ne varie pas de plus de 10 % entre les périodes de repos et d'activité soutenue, et aucun mécanisme [[Allostérie|allostérique]] connu ne permet de moduler significativement l'activité d'une enzyme avec une variation d'au plus 10 % de la concentration d'un effecteur allostérique. |
|||
* Le [[cation]] de [[calcium]] Ca<sup>2+</sup> intervient comme régulateur. Le taux de calcium dans la [[matrice mitochondriale]] peut atteindre quelques dizaines de [[Concentration molaire|micromoles par litre]]<ref name="10.1016/j.bpj.2013.03.064"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Maxim V. Ivannikov et Gregory T. Macleod |
|||
| titre = Mitochondrial Free Ca2+ Levels and Their Effects on Energy Metabolism in ''Drosophila'' Motor Nerve Terminals |
|||
| périodique = Biophysical Journal |
|||
| volume = 104 |
|||
| numéro = 11 |
|||
| jour = 4 |
|||
| mois = juin |
|||
| année = 2013 |
|||
| pages = 2353-2361 |
|||
| url texte = http://www.cell.com/biophysj/abstract/S0006-3495%2813%2900503-1 |
|||
| consulté le = 14 novembre 2015 |
|||
| doi = 10.1016/j.bpj.2013.03.064 |
|||
| pmid = 23746507 |
|||
| pmc = 3672877 |
|||
}}</ref>. Il active la [[pyruvate déshydrogénase phosphatase]], laquelle active à son tour la composante [[pyruvate déshydrogénase]] (E1) du complexe pyruvate déshydrogénase. Il active également l'isocitrate déshydrogénase et le complexe α-cétoglutarate déshydrogénase<ref name="10.1007/BF01731731"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Richard M. Denton , Philip J. Randle, Barbara J. Bridges, Ronald H. Cooper, Alan L. Kerbey, Helen T. Pask, David L. Severson, David Stansbie et Susan Whitehouse |
|||
| titre = Regulation of mammalian pyruvate dehydrogenase |
|||
| périodique = Molecular and Cellular Biochemistry |
|||
| volume = 9 |
|||
| numéro = 1 |
|||
| jour = |
|||
| mois = octobre |
|||
| année = 1975 |
|||
| pages = 27-53 |
|||
| url texte = http://link.springer.com/article/10.1007%2FBF01731731 |
|||
| consulté le = 14 novembre 2015 |
|||
| doi = 10.1007/BF01731731 |
|||
| pmid = 171557 |
|||
| pmc = |
|||
}}</ref>. Ceci accroît la vitesse de réaction de plusieurs étapes du cycle, et accroît donc le flux de composés à travers cette [[voie métabolique]]. |
|||
* Le [[citrate]] agit en inhibant la [[phosphofructokinase]], laquelle intervient dans la [[glycolyse]] et donc contribue à la formation de [[pyruvate]] ''via'' le [[fructose-1,6-bisphosphate]]. Ceci constitue une boucle de rétroaction entre les deux voies métaboliques. |
|||
Des travaux publiés en 2007 ont montré un lien important entre les intermédiaires du cycle de Krebs et la régulation des [[Facteur induit par l’hypoxie|facteurs induits par l'hypoxie]] ({{Abréviation|HIF|Hypoxia-inducible factors}}). Ces derniers jouent un rôle dans l'[[homéostasie]] de l'[[Dioxygène|oxygène]] comme [[Facteur de transcription|facteurs de transcriptions]] intervenant dans l'[[angiogenèse]], le remodelage vasculaire, la mobilisation du [[glucose]], le transport des [[ion]]s et l'[[apoptose]]. Les HIF sont synthétisés de façon constitutive et l'[[hydroxylation]] d'au moins l'un de deux [[Résidu (biochimie)|résidus]] de [[proline]] intervient dans leur interaction avec le complexe [[ubiquitine ligase]], ce qui les désigne comme cible pour une dégradation rapide. Cette réaction est catalysée par des {{Lien|trad=Procollagen-proline dioxygenase|lang=en|fr=Procollagène-proline dioxygénase|texte=procollagène-proline dioxygénases}}. Le [[Acide fumarique|fumarate]] et le [[Acide succinique|succinate]] sont des inhibiteurs efficaces de ces enzymes, ce qui pourrait stabiliser les HIF<ref name="10.1074/jbc.M610415200"> |
|||
{{Article |
|||
| langue = en |
|||
| nom1 = Inhibition of Hypoxia-inducible Factor (HIF) Hydroxylases by Citric Acid Cycle Intermediates. POSSIBLE LINKS BETWEEN CELL METABOLISM AND STABILIZATION OF HIF |
|||
| titre = Peppi Koivunen, Maija Hirsilä, Anne M. Remes, Ilmo E. Hassinen, Kari I. Kivirikko et Johanna Myllyharju |
|||
| périodique = Journal of Biological Chemistry |
|||
| volume = 282 |
|||
| numéro = 7 |
|||
| jour = 16 |
|||
| mois = février |
|||
| année = 2007 |
|||
| pages = 4524-4532 |
|||
| url texte = http://www.jbc.org/content/282/7/4524 |
|||
| consulté le = 14 novembre 2015 |
|||
| doi = 10.1074/jbc.M610415200 |
|||
| pmid = 17182618 |
|||
| pmc = |
|||
}}</ref>. |
|||
== Notes et références == |
== Notes et références == |
||
{{Références}} |
{{Références|taille=30}} |
||
== Voir aussi == |
== Voir aussi == |
||
=== Articles connexes === |
=== Articles connexes === |
||
* [[Chaîne respiratoire]] : le devenir des NADH,H+ |
* [[Chaîne respiratoire]] : le devenir des NADH,H+ |
||
* [[Respiration cellulaire]] |
* [[Respiration cellulaire]] |
||
Version du 14 novembre 2015 à 16:45
Le cycle de Krebs, parfois appelé cycle de l'acide citrique par anglicisme, est une voie métabolique présente chez tous les organismes aérobies et dont la fonction première est d'oxyder les groupes acétyle, issus notamment de la dégradation des glucides, des graisses et des protéines, pour en récupérer l'énergie sous forme de huit électrons à haut potentiel de transfert et d'une molécule de GTP ou d'ATP ; les électrons à haut potentiel de transfert, récupérés sur le NADH et l'ubiquinol (CoQ10H2, ou coenzyme Q10 réduite), peuvent ensuite circuler à travers la chaîne respiratoire pour permettre à leur tour la formation de molécules d'ATP supplémentaires par la phosphorylation oxydative.
Ce cycle a été découvert en plusieurs étapes dans les années 1930, plusieurs de ses éléments ayant été identifiés par le biologiste moléculaire hongrois Albert Szent-Györgyi[1] tandis que son fonctionnement cyclique était mis en évidence par le biochimiste allemand Hans Adolf Krebs en 1937[2]. Il se déroule dans le cytoplasme des procaryotes et dans les mitochondries des eucaryotes. Il s'agit d'un cycle car le dernier métabolite, l'oxaloacétate, est aussi impliqué dans la première réaction. La première étape consiste à transférer le groupe acétyle de l'acétyl-CoA sur de l'oxaloacétate pour former du citrate, lequel a donné son nom au cycle en anglais et dans les langes germaniques. Les étapes suivantes forment une séquence de réactions, catalysées chacune par une enzyme spécifique, qui conduit à l'oxydation progressive du groupe acétyle en deux molécules de dioxyde de carbone (CO2). Ce faisant, ce cycle produit également des précurseurs pour la biosynthèse de certains acides aminés protéinogènes, tandis que le NADH peut être utilisé dans un grand nombre de réactions biochimiques.

Le cycle de Krebs est le point final commun de la dégradation des polyholosides (glycolyse, voie des pentoses phosphates), des lipides (β-oxydation) et des acides aminés, qui aboutissent à la formation d'acétyl-CoA ; ce dernier est une forme de transport des groupes acétyle provenant du pyruvate. Il existe par ailleurs des réactions d'échappement au cycle qui permettent diverses biosynthèses ; le cycle du glyoxylate, absent chez les animaux mais présent notamment chez les plantes, est un exemple parmi d'autres de telles voies métaboliques utilisant le cycle de Krebs.
Le fait que le cycle de Krebs soit indispensable à de nombreuses voies métaboliques, tant anaboliques que cataboliques, suggère qu'il a probablement été l'un des premiers éléments fondateurs du métabolisme cellulaire à s'être mis en place au cours de l'évolution, peut-être par abiogenèse. Il est apparenté à des réactions se produisant chez les bactéries anaérobies et aurait évolué en plusieurs fois[3] ; il existe théoriquement plusieurs alternatives au cycle de Krebs, mais ce dernier semble être le plus efficace : si plusieurs alternatives ont évolué indépendamment, elles ont dû toutes converger vers le cycle de Krebs[4],[5].
Étapes du cycle de Krebs
| Substrats | Produits | Enzyme | Type de réaction | Remarques | |
|---|---|---|---|---|---|
| 1 | Oxaloacétate + Acétyl-CoA + H2O |
Citrate + CoA-SH |
Citrate synthase (EC ) |
Crotonisation | Irréversible, allonge l'oxaloacétate (4C) en une molécule à six atomes de carbone |
| 2 | Citrate | cis-Aconitate + H2O |
Aconitase (EC ) |
Déshydratation | Isomérisation réversible |
| 3 | cis-Aconitate + H2O |
Isocitrate | Hydratation | ||
| 4 | Isocitrate + NAD+ |
Oxalosuccinate + NADH + H+ |
Isocitrate déshydrogénase (EC ) |
Oxydation | Produit du NADH (équivalent à 2,5 ATP) |
| 5 | Oxalosuccinate | α-Cétoglutarate + CO2 |
Décarboxylation | Réaction limitante, étape irréversible, produisant une molécule à cinq atomes de carbone. | |
| 6 | α-Cétoglutarate + NAD+ + CoA-SH |
Succinyl-CoA + NADH + H+ + CO2 |
Complexe α-cétoglutarate déshydrogénase (EC ) |
Décarboxylation oxydative |
Étape irréversible, produisant du NADH (équivalent à 2,5 ATP), conduisant à une molécule à quatre atomes de carbone (hors coenzyme A) |
| 7 | Succinyl-CoA + GDP + Pi |
Succinate + CoA-SH + GTP |
Succinyl-CoA synthétase (EC ) |
Phosphorylation | ou ADP → ATP à la place de GDP → GTP, produit une molécule d'ATP ou d'un équivalent La réaction de condensation du GDP avec le Pi et l'hydrolyse de la succinyl-CoA implique la molécule d'H2O requise pour l'équilibre de la réaction. |
| 8 | Succinate + CoQ10 |
Fumarate + Ubiquinol (CoQ10H2) |
Succinate déshydrogénase (EC ) |
Oxydation | Utilise le FAD comme groupe prosthétique (FAD → FADH2 à la première étape de la réaction), équivalent à 1,5 ATP |
| 9 | Fumarate + H2O |
L-malate | Fumarase (EC ) |
Hydratation | |
| 10 | L-malate + NAD+ |
Oxaloacétate + NADH + H+ |
Malate déshydrogénase (EC ) |
Oxydation | Réversible (en réalité, l'équilibre favorise la formation du L-malate), produit du NADH (équivalent à 2,5 ATP) |
Synthèse du citrate
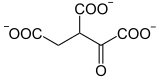
La citrate synthase condense l'oxaloacétate et l'acétyl-CoA en citrate avec libération de la coenzyme A. Il se forme un intermédiaire transitoire, la citroyl-CoA. La liaison thioester de l'acétyl-CoA est une liaison à haut potentiel d'hydrolyse. Le couplage des activités hydrolase et synthase rend la réaction de synthèse thermodynamiquement possible. Cette réaction est une étape régulatrice du cycle, avec comme effecteur négatif sur la vitesse de réaction la succinyl-CoA, le NADH, l'acétyl-CoA, le citrate et l'ATP.

+ acétyl-CoA + H2O → CoA + 
Oxaloacétate Citrate Citrate synthase – EC
Déshydratation du citrate
L'aconitase, une lyase, catalyse la déshydratation du citrate en cis-aconitate. Bien que la molécule de citrate semble être symétrique, on a montré que le départ d'eau a lieu entre les atomes de carbone issus de l'oxaloacétate :
Hydratation du cis-aconitate
L'aconitase catalyse également l'hydratation du cis-aconitate en isocitrate :
Les deux étapes précédentes, catalysées par l'aconitase, aboutissent à l'isomérisation du citrate en isocitrate :
Oxydation de l’isocitrate
L'isocitrate déshydrogénase, une oxydoréductase, catalyse l'oxydation de l'isocitrate en oxalosuccinate :
L'isocitrate déshydrogénase NAD+ dépendante exige également comme cofacteur des ions Mn2+ ou Mg2+.
Décarboxylation de l'oxalosuccinate
L'isocitrate déshydrogénase catalyse également la décarboxylation de l'oxalosuccinate, instable, en α-cétoglutarate avec dégagement de CO2, en une réaction irréversible :
C'est également une étape régulatrice du cycle, avec comme effecteurs négatifs le NADH et l'ATP. La présence d'ADP favorise au contraire l'activité de l'isocitrate déshydrogénase, et ainsi la vitesse de cette réaction.
Décarboxylation oxydative de l'α-cétoglutarate
Le complexe α-cétoglutarate déshydrogénase catalyse la décarboxylation oxydative de l'α-cétoglutarate en succinyl-CoA avec production de NADH+H+ et dégagement de CO2. C'est une réaction semblable à celle convertissant le pyruvate en acétyl-CoA, catalysée par le complexe pyruvate déshydrogénase. Ce complexe enzymatique fait intervenir successivement trois enzymes — l'α-cétoglutarate déshydrogénase, la dihydrolipoamide S-succinyltransférase et la dihydrolipoyl déshydrogénase — et cinq cofacteurs : le TPP, le lipoamide, la coenzyme A, le FAD et le NAD+. Cette réaction est irréversible.

+ CoA-SH + NAD+ → NADH + H+ + CO2 + 
α-Cétoglutarate Succinyl-CoA Complexe α-cétoglutarate déshydrogénase – EC
Le NADH, le GTP et la succinyl-CoA sont des effecteurs négatifs sur l'activité du complexe enzymatique.
Formation du succinate
La succinyl-CoA synthétase, ou succinate thiokinase, convertit la succinyl-CoA en succinate et coenzyme A avec formation d'une molécule de GTP chez les animaux ou d'ATP chez les plantes et les bactéries. Cette réaction est réversible.

+ GDP/ADP + Pi GTP/ATP + CoA + 
Succinyl-CoA Succinate succinyl-CoA synthétase (formant GTP/ATP) – EC / EC
Oxydation du succinate
La succinate déshydrogénase, une oxydoréductase, catalyse l'oxydation du succinate en fumarate avec réduction concomitante de l'ubiquinone (coenzyme Q10) en ubiquinol (CoQ10H2). Cette enzyme flavoprotéique à FAD est le complexe II de la chaîne respiratoire. Elle est inhibée par le malonate. Le FAD étant un groupe prosthétique lié de manière covalente à l'enzyme, il ne fait que transmettre les électrons et protons au « vrai » substrat CoQ10.
Cette réaction est la quatrième et dernière réaction régulatrice du cycle. Le malonate est ici l'inhibiteur compétitif.
Hydratation du fumarate
La fumarase, une lyase, catalyse l'hydratation du fumarate en L-malate.
Oxydation du malate : fermeture du cycle
La malate déshydrogénase, une oxydoréductase, convertit le L-malate en oxaloacétate avec formation de NADH+H+.
Bilan du cycle de Krebs
Le cycle de Krebs est composé de 10 étapes catalysées par huit enzymes différentes. Au cours du cycle sont produites, à partir d'une mole d'acétate et jusqu'au stade CO2 et H2O :
On constate que le cycle de Krebs ne produit qu'un seul équivalent ATP (une GTP), soit moins que la glycolyse (quatre molécules d'ATP pour une molécule de glucose dont deux sont utilisées lors de la phase « d'activation » de la glycolyse — étapes 1 et 3, qui correspondent à des phosphorylations). L'essentiel de l'énergie chimique potentielle est produite sous forme de pouvoir réducteur (NADH + H+ et CoQ10H2). Ce pouvoir réducteur est ultérieurement utilisé dans la chaîne respiratoire des mitochondries pour produire 11 autres molécules d'ATP via un gradient de protons et une ATP synthase qu'on attribue parfois de façon erronée au cycle de Krebs.
| Description | Substrats | Produits |
| La somme de toutes les réactions d'oxydation de l'acétyl-CoA par le cycle de Krebs (hors chaîne respiratoire) correspond à : | Acétyl-CoA + 3 NAD+ + CoQ10 + GDP + Pi + 2 H2O | → CoA-SH + 3 (NADH + H+) + CoQ10H2 + GTP + 2 CO2 |
| En remontant jusqu'à la décarboxylation du pyruvate, le bilan devient : | Pyruvate + 4 NAD+ + CoQ10 + GDP + Pi + 2 H2O | → 4 (NADH + H+) + Q10H2 + GTP + 3 CO2 |
| En remontant jusqu'à l'oxydation du glucose par la glycolyse, le bilan devient : | Glucose + 10 NAD+ + 2 CoQ10 + 2 ADP + 2 GDP + 4 Pi + 2 H2O | → 10 (NADH + H+) + 2 CoQ10H2 + 2 ATP + 2 GTP + 6 CO2 |
Ce qui correspond, au total, pour l'ensemble de la respiration aérobie (glycolyse, cycle de Krebs, réduction des coenzymes NAD+ et CoQ10 par la chaîne respiratoire) entre 30 et 38 ATP pour une molécule de glucose selon les estimations[6], dépendant en partie de la navette mitochondriale ATP-dépendante utilisée pour transporter le NAD+ de la glycolyse.
L’utilisation du glucose par respiration aérobie est plus énergétique que les fermentations.
En présence d'une grande quantité d'acétyl-CoA, le cycle de Krebs peut être débordé, en particulier chez les diabétiques ayant un déficit sévère en insuline ou après un jeûne prolongé (cf. cétoacidose diabétique pour de plus amples détails).
Régulation du cycle
Les étapes irréversibles du cycle de Krebs peuvent être régulées : étape de la citrate synthase, de l'isocitrate déshydrogénase et du complexe α-cétoglutarate déshydrogénase.
- La citrate synthase est activée par l'ADP mais inhibée par le NADH, l'ATP et le citrate. Elle est donc respectivement inhibée par le pouvoir réducteur, la charge énergétique et le produit de la réaction qu'elle catalyse.
- L'isocitrate déshydrogénase est activée par le calcium et l'ADP, et est inhibée par le NADH et l'ATP.
- Le complexe α-cétoglutarate déshydrogénase est activé par le calcium et inhibé par le NADH, l'ATP et son produit de réaction, la succinyl-CoA.
La régulation du cycle de Krebs repose essentiellement sur la disponibilité du substrat et l'inhibition par les produits de réaction. Si ces réactions n'étaient pas régulées, le cycle de Krebs gaspillerait de grandes quantités d'énergie métabolique en produisant un excès d'ATP et de coenzymes réduites telles que le NADH.
- Le NADH est produit par toutes les déshydrogénases du cycle hormis la succinate déshydrogénase et a pour effet d'inhiber le complexe pyruvate déshydrogénase, l'isocitrate déshydrogénase, le complexe α-cétoglutarate déshydrogénase ainsi que la citrate synthase.
- L'acétyl-CoA inhibe le complexe pyruvate déshydrogénase, tandis que la succinyl-CoA inhibe le complexe α-cétoglutarate déshydrogénase et la citrate synthase. Les essais in vitro sur les enzymes du cycle de Krebs montrent que l'ATP inhibe la citrate synthase et le complexe α-cétoglutarate déshydrogénase ; cependant, le taux d'ATP in vivo ne varie pas de plus de 10 % entre les périodes de repos et d'activité soutenue, et aucun mécanisme allostérique connu ne permet de moduler significativement l'activité d'une enzyme avec une variation d'au plus 10 % de la concentration d'un effecteur allostérique.
- Le cation de calcium Ca2+ intervient comme régulateur. Le taux de calcium dans la matrice mitochondriale peut atteindre quelques dizaines de micromoles par litre[7]. Il active la pyruvate déshydrogénase phosphatase, laquelle active à son tour la composante pyruvate déshydrogénase (E1) du complexe pyruvate déshydrogénase. Il active également l'isocitrate déshydrogénase et le complexe α-cétoglutarate déshydrogénase[8]. Ceci accroît la vitesse de réaction de plusieurs étapes du cycle, et accroît donc le flux de composés à travers cette voie métabolique.
- Le citrate agit en inhibant la phosphofructokinase, laquelle intervient dans la glycolyse et donc contribue à la formation de pyruvate via le fructose-1,6-bisphosphate. Ceci constitue une boucle de rétroaction entre les deux voies métaboliques.
Des travaux publiés en 2007 ont montré un lien important entre les intermédiaires du cycle de Krebs et la régulation des facteurs induits par l'hypoxie (HIF). Ces derniers jouent un rôle dans l'homéostasie de l'oxygène comme facteurs de transcriptions intervenant dans l'angiogenèse, le remodelage vasculaire, la mobilisation du glucose, le transport des ions et l'apoptose. Les HIF sont synthétisés de façon constitutive et l'hydroxylation d'au moins l'un de deux résidus de proline intervient dans leur interaction avec le complexe ubiquitine ligase, ce qui les désigne comme cible pour une dégradation rapide. Cette réaction est catalysée par des procollagène-proline dioxygénases. Le fumarate et le succinate sont des inhibiteurs efficaces de ces enzymes, ce qui pourrait stabiliser les HIF[9].
Notes et références
- (en) « The Nobel Prize in Physiology or Medicine 1937 : Albert Szent-Györgyi », (consulté le ) : « The Nobel Prize in Physiology or Medicine 1937 was awarded to Albert Szent-Györgyi "for his discoveries in connection with the biological combustion processes, with special reference to vitamin C and the catalysis of fumaric acid". ».
- (en) « The Nobel Prize in Physiology or Medicine 1953 : Hans Krebs, Fritz Lipmann » (consulté le ) : « The Nobel Prize in Physiology or Medicine 1953 was divided equally between Hans Adolf Krebs "for his discovery of the citric acid cycle" and Fritz Albert Lipmann "for his discovery of co-enzyme A and its importance for intermediary metabolism". ».
- (en) H. Gest, « Evolutionary roots of the citric acid cycle in prokaryotes », Biochemical Society Symposium, vol. 54, , p. 3-16 (PMID 3332996)
- (en) Enrique Meléndez-Hevia, Thomas G. Waddell et Marta Cascante, « The puzzle of the Krebs citric acid cycle: Assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution », Journal of Molecular Evolution, vol. 43, no 1, , p. 293-303 (PMID 8703096, DOI 10.1007/BF02338838, lire en ligne)
- (en) Oliver Ebenhöh et Reinhart Heinrich, « Evolutionary Optimization of Metabolic Pathways. Theoretical Reconstruction of the Stoichiometry of ATP and NADH Producing Systems », Bulletin of Mathematical Biology, vol. 63, no 1, , p. 21-55 (PMID 11146883, DOI 10.1006/bulm.2000.0197, lire en ligne)
- (en) R. K. Porter et M. D. Brand, « Mitochondrial proton conductance and H+/O ratio are independent of electron transport rate in isolated hepatocytes », Biochemical Journal, vol. 310, , p. 379–382 (lire en ligne)
- (en) Maxim V. Ivannikov et Gregory T. Macleod, « Mitochondrial Free Ca2+ Levels and Their Effects on Energy Metabolism in Drosophila Motor Nerve Terminals », Biophysical Journal, vol. 104, no 11, , p. 2353-2361 (PMID 23746507, PMCID 3672877, DOI 10.1016/j.bpj.2013.03.064, lire en ligne)
- (en) Richard M. Denton , Philip J. Randle, Barbara J. Bridges, Ronald H. Cooper, Alan L. Kerbey, Helen T. Pask, David L. Severson, David Stansbie et Susan Whitehouse, « Regulation of mammalian pyruvate dehydrogenase », Molecular and Cellular Biochemistry, vol. 9, no 1, , p. 27-53 (PMID 171557, DOI 10.1007/BF01731731, lire en ligne)
- (en) Inhibition of Hypoxia-inducible Factor (HIF) Hydroxylases by Citric Acid Cycle Intermediates. POSSIBLE LINKS BETWEEN CELL METABOLISM AND STABILIZATION OF HIF, « Peppi Koivunen, Maija Hirsilä, Anne M. Remes, Ilmo E. Hassinen, Kari I. Kivirikko et Johanna Myllyharju », Journal of Biological Chemistry, vol. 282, no 7, , p. 4524-4532 (PMID 17182618, DOI 10.1074/jbc.M610415200, lire en ligne)
Voir aussi
Articles connexes
- Chaîne respiratoire : le devenir des NADH,H+
- Respiration cellulaire
- Glycolyse
- Les principales voies du métabolisme (sur wikibooks)
- Hans Adolf Krebs