Échinococcose
| Causes | Echinococcus ou Echinococcus granulosus |
|---|---|
| Symptômes | Douleur abdominale, hépatomégalie, amaigrissement, pyrosis, nausée, vomissement, toux et hémoptysie |
| Traitement | Opération chirurgicale et endoscopie chirurgicale |
|---|---|
| Médicament | Albendazole |
| Spécialité | Infectiologie et helminthologiste (d) |
| CIM-10 | B67 |
|---|---|
| CIM-9 | 122.4, 122 |
| DiseasesDB | 4048 |
| MedlinePlus | 000676 |
| eMedicine |
178648 med/1046 |
| MeSH | D004443 |
| Patient UK | Hydatid-disease-pro |
L'échinococcose est une zoonose provoquée par un ver plat échinocoque. En Europe, il s'agit principalement d'Echinococcus multilocularis, mais il existe d'autres échinocoques parasites, dans presque toutes les régions du monde.
Le parasite
Une échinococcose peut être cystique ou hydatique (causée par Echinococcus granulosus), alvéolaire (E. multilocularis), ou polycystique (E. vogeli ou E. oligarthrus). Ces deux derniers echinococcus sont plus rares et sont retrouvés essentiellement en Amérique du Sud et en Amérique centrale[1]. Il existe deux autres espèces, E shiquicus et E felidis, sans rôle défini dans l'atteinte humaine.
L'échinocoque est avalé par l'hôte. Les animaux concernés sont essentiellement des canidés (chiens pour E. granulosus, renards pour E. multilocularis) où la larve se transforme en adulte dans le tube digestif de l'hôte, permettant la reproduction et le relargage d'œufs par le tube digestif. L'être humain constitue le plus souvent un « hôte en impasse » ne permettant pas la reproduction du parasite. Ce dernier traverse la paroi du tube digestif avant de s'implanter dans différents organes.
Contamination humaine

L'homme se contamine accidentellement par contact direct (exemple : léchage par les chiens et chats, ou en les laissant manger dans nos assiettes) ou indirect (avec chien ou chat principalement, et éventuellement un renard ou autres canidés) aboutissant à l'ingestion d'œufs (microscopiques) du parasite.
Selon les données épidémiologiques disponibles[2], les facteurs de risque pour l'homme sont (en ordre décroissant) :
- être propriétaire de chiens « qui tuent par jeu » : OR=18.0
- vivre dans une exploitation agricole : OR=6.4
- être propriétaire de chiens qui rodent sans surveillance : OR=6.1
- collecter du bois : OR=4.7
- être agriculteur : OR=4.7
- mâcher de l’herbe : OR=4.4
- vivre dans une habitation proche des champs : OR=3.0
- aller en forêt pour des raisons professionnelles : OR=2.8
- faire pousser des légumes (racines et feuilles) : OR=2.5
- être propriétaire de chats qui rôdent sans surveillance : OR=2.3
- manger des baies (fraises) non lavées : OR=2.2
Les modes de transmission d’Echinococcus multilocularis restent mal connus dans leur détail : les œufs du ténia sont dispersés dans l'environnement via les crottes de carnivores contaminés (et pas l'urine) : renards, chiens et chats (bien que ce dernier ne soit pas un hôte optimal pour le parasite). Manger les fruits des bois crus poussant à ras du sol, des pissenlits, ou tout autre végétal poussant à ras du sol doit donc être évité car ces aliments sont susceptibles d'avoir été souillés par les excréments. Tel n'est pas le cas des produits végétaux poussant à plus de 30 cm de hauteur.
Les cas de contamination groupée semblent rares, mais un cas documenté au moins a été signalé[3].
Pathogénèse

Chez l'homme, les œufs ingérés se transforment en larves qui vont coloniser le foie et former une pseudo-tumeur au bout de plusieurs années. Les larves peuvent exceptionnellement également atteindre d'autres organes comme les poumons ou le cerveau. Curieusement les enfants semblent épargnés par cette maladie alors que ce sont ceux qui portent le plus les mains à la bouche et se font lécher par les chiens et chats. Leur système immunitaire semble facilement se débarrasser des échinocoques.
Signes cliniques et diagnostic

L'échinococcose alvéolaire est une maladie grave qui se développe lentement, essentiellement au niveau du foie, sur plus de 15 ans, et de manière asymptomatique. Elle était autrefois souvent confondue avec cirrhose ou cancer du foie, se présentant par une hépatomégalie, des douleurs abdominales, un ictère, une fièvre.
La forme cystique concerne essentiellement le foie et le poumon. La croissance des parasites est longue, sur plusieurs années et le patient est très souvent asymptomatique au début de l'atteinte (ne se plaint d'aucun signe. Les signes apparaissent soit en raison d'une compression d'un organe, soit en raison d'une complication, rupture ou infection. La rupture (comme une chirurgie mal faite) peut se compliquer d'une dissémination des kystes à d'autres endroits de l'organisme.
La symptomatologie est atypique chez 1/3 environ des patients, avec douleurs abdominales isolées chez 1/3 environ des patients, le dernier tiers présentant une association de symptômes : douleurs abdominales (90 % des cas), hépatomégalie (61 %), altération modérée de l’état général (48 %), ictère, subictère ou prurit (41 %). Il existe une corrélation entre symptômes et invasion des lésions[4].
Un diagnostic peut être effectué par la détection des anticorps spécifiques au parasite dans le sang du patient (test remboursé par l’Institut national d'assurance maladie invalidité belge), et en cas de résultat positif être confirmé par imagerie médicale[5].
Mortalité
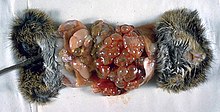

La mortalité de la forme cystique est comprise entre 2 et 4 %[1]. Celle de la forme alvéolaire est beaucoup plus importante si elle n'est pas traitée correctement avec une diminution de l'espérance de vie pouvant atteindre 20 ans[6].
Traitement
Le seul traitement curatif existant peut être une intervention chirurgicale avec une éventuelle greffe du foie, mais la maladie reste gravissime pour le contaminé.
L'albendazole est le seul traitement oral disponible en France pour cette maladie. Il ne fait que ralentir la progression du parasite, sans le tuer.
Prévention
L'échinocoque est insensible à la congélation à −20 °C, mais il est tué par la congélation à −80 °C ou par la chaleur (cuisson). Par ailleurs, il a besoin d'un minimum d'humidité pour survivre. Le séchage à l'air ou au four est donc une bonne solution pour tuer les œufs. Un lavage soigneux des plantes ou fruits issus de la cueillette est recommandé, mais probablement peu efficace.
Zones à risque
Echinococcus granulosus est présent dans le monde entier. Echinococcus multilocularis n'est présent que dans l'hémisphère Nord[7].
En Europe et en France

Dans les années 1980 en Europe, les zones touchées étaient presque toutes des zones de moyenne montagne, avec couverture de neige plusieurs mois par an, dont certaines étaient très favorables à la pullulation de rongeurs prairiaux (Campagnol des champs et campagnols terrestres). En France, les études de terrain et cartes de cas[8],[9](sachant qu'une personne peut déclarer la maladie dans une région, mais l'avoir acquise dans une autre) montrent que les zones où la prévalence est la plus élevée sont la Franche-Comté, la Lorraine, les Alpes, le Massif central, et les Ardennes. On rapporte cependant quelques cas hors de ces régions.
Depuis les années 1990, le parasite a étendu son aire de distribution traditionnelle (essentiellement le Massif Central, l'Est de la France et la partie nord de l'Arc alpin), vers le nord, l'est, et l'ouest couvrant maintenant l'Ouest et le Nord de la France, le Sud de la Belgique et de la Hollande, l'Allemagne, le Danemark, le Sud de la Suède, la Pologne, et la Slovaquie.
On estime actuellement qu'il y a entre 15 et 20 nouveaux cas par an en France.
Au Japon, les campagnols prairiaux n’existent pas. Là, Clethrionomys rufocanus, un rongeur forestier, est l’hôte intermédiaire principal de l'échinocoque. Ailleurs dans le monde, ce sont toujours des rongeurs (campagnols le plus souvent) et des petits lagomorphes comme les pikas, qui semblent être le réservoir du parasite, mais chiens et chats sont, avec les renards, et d'autres canidés, les maillons de transmission à l'homme.
Constatant la présence importante de renards, chiens, chats dans certaines villes, on s'est intéressé aux cycles urbains de la faune vectrice de E. multilocularis (renard en particulier)[10].
Épidémiologie
La maladie atteindrait 2 à 3 millions de personnes dans le monde, la plupart étant de type cystique[1]. Le coût annuel de la maladie est proche de 200 millions de dollars[11].
En France, au début des années 1980, un observatoire de l'échinococcose alvéolaire [4] a été mis en place, basé sur l'enregistrement des cas humains d'échinococcose alvéolaire, dans un registre (Registre FrancEchino, créé en 1997, en même temps que le réseau européen de surveillance Eurechinoreg, avec étude rétrospective pour la période précédant 1997)[4]. Ce registre a notamment mis en évidence un ratio hommes/femmes d'environ 1 (0,96 ; stable), ainsi qu'un âge médian au diagnostic de 59 ans (stable) avec comme âges extrêmes : 12 et 89 ans, avec très peu de cas déclarés avant 20-30 ans, pour 339 cas diagnostiqués ou suspectés de 1982 à 2005, dont 222 certains avec une moyenne relativement stable de 14 cas incidents/an[4].
Le diagnostic semble se faire plus précocement ce qui pourrait expliquer que statistiquement, le nombre de formes strictement hépatiques a tendance à augmenter et le nombre des formes métastatiques à diminuer[4].
Sur une plus longue période (du 1er janvier 1982 au 31 décembre 2009), ce sont quatre cent dix-sept cas d’EA qui ont été recensés par FrancEchino avec 8 à 29 cas par an, selon les années. L’incidence annuelle moyenne est de 0,26 cas par million d'habitants (de 0,16 à 0,56 selon les années). Sur ce pas de temps, le ratio homme/femme est de 1,00 et l’âge médian au diagnostic est de 60 ans (de 12 à 89). Au moment du diagnostic, 73 % des patients étaient symptomatiques (douleurs abdominales + signes de cholestase en général), avec atteinte primitive hépatique dans 97 % des cas, et métastases extra-hépatiques dans 8 % des cas.
Il existe, à échelle régionale, de fortes variations locales de prévalences et de charge parasitaire, selon l’altitude, l'écologie du paysage et, au sein des paysages, selon le « grain écopaysager » qui caractérise la structure et l’hétérogénéité éco-paysagère, variations confirmées dans d’autres régions du monde (dont dans le canton de Zhang (Sichuan, Chine) où une forte prévalence de la maladie existe chez l’homme). Ainsi en France cinq départements (Doubs, Haute-Saône, Jura, Vosges, Haute-Savoie), bien que plutôt peu peuplés ont déclaré 60 % des cas recensés sur cette période, avec pour ces départements une incidence moyenne annuelle supérieure à deux cas par million d'habitants de 1982 à 2009[12].
Le risque d'atteinte semble lié à
- la probabilité pour le renard de consommer des hôtes intermédiaires ;
- la vitesse de décomposition des fèces[13] ;
- la survie des œufs d’échinocoques (cf. humidité et condition du sol qui varie selon l’hydromorphie, le drainage, pâturage, jachères, zones fréquentées par l’homme[14],[15], etc. ;
- la durée de vie des fèces et des œufs : ce facteur reste à étudier in situ. Elle doit varier selon le milieu et des conditions climatiques (activité des coprophages, vers de terre…). Marie-Hélène Guislain (voir note de pas de page) suggère d'étudier la vitesse de décomposition de fèces de renards (élevés en captivité avec des régimes alimentaires connus), dans des conditions microclimatiques et environnementales variées, pour mieux identifier d’éventuelles « zones à risque, là où ces fèces seraient plus présentes ou plus biodisponibles.
On s’intéresse aux œufs présents dans les fèces, mais on mesure mal la quantité excrétée par les canidés, félins et d’autres animaux, et on ne sait pas combien d’entre eux survivent ni combien de temps aux attaques virales, fongiques et bactériennes ou à l’ingestion par des animaux coprophages et détritivores dans l’environnement réel.
Les œufs d’échinocoques ne sont pas mobiles dans l’environnement. Les rongeurs prairiaux ne se déplacent que sur des distances inférieures à quelques centaines de mètres au plus, et généralement moins de quelques dizaines de mètres[16],[17].
Chiens, chats et renards pour se contaminer doivent donc venir manger un campagnol contaminé, ou se déplacer dans un site où un renard (ou autre carnivore) contaminé a déféqué.
Le comportement du renard est lui-même modifié par la fréquentation humaine, des chiens et/ou par la chasse qu’on lui donne, ainsi que par diverses modifications anthropiques du paysage, ce qui peut modifier la répartition et localisation de ses fèces dans l’environnement, et sa consommation d’hôtes intermédiaires contaminés.
Les déplacements des rongeurs comme de leurs prédateurs sont également influencés par les lisières artificielles fixes imposées par l’homme au paysage (Cf. Propriété privée), qu’on sait propices aux rongeurs, réservoirs intermédiaires. L’étude des terrains de chasse et des lieux de défécation communs à plusieurs renards (Poulle et al. 1994; Henry et al. 2005)[source insuffisante], ou à des renards et chiens et chats, présente un intérêt éco-épidémiologique.
Ici encore, des marqueurs microsatellites détectables dans les fèces permettraient de mieux mesurer la dispersion de fèces de renards peu ou très contaminées, et aiderait à comprendre comment le parasite se disperse dans le paysage. Cette méthode a déjà été utilisée pour compter des blaireaux (Meles meles) en Angleterre[18], le wombat commun (Vombatus ursinus) en Australie[19] ou des outardes barbues (Otis tarda) au Maroc[20].
Enfin, le rôle du chien et du chat comme vecteur du parasite vers l'homme pourrait avoir été sous-estimé.
Notes et références
- McManus DP, Gray DJ, Zhang W, Yang Y, Diagnosis, treatment, and management of echinococcosis, BMJ, 2012;344:e3866
- (en) Kern P. et al. « Risk Factors for Alveolar Echinoccocosis in Humans » Emerg Infect Dis. 2004;10(12):2088-93. PMID 15663843
- Unique family clustering of human echinococcosis cases in a chinese community. Am J Trop Med Hyg 2006 74:487-494 (Résumé)
- observatoire de l'échinococcose alvéolaire
- [www.lasante.net/maladies/fromanimal/echinococcose.htm L'echinococcose alvéolaire humaine]LaSante.net - Janvier 2003
- Torgerson PR, Schweiger A, Deplazes P et al. Alveolar echinococcosis: from a deadly disease to a well-controlled infection. Relative survival and economic analysis in Switzerland over the last 35 years, J Hepatol, 2008;49:72-7
- Eckert J, Deplazes P, Biological, epidemiological, and clinical aspects of echinococcosis, a zoonosis of increasing concern, Clin Microbiol Rev, 2004;17:107-35
- Carte des cas humains de 1982 à 2001, en France, publiée parle réseau SAGIR/ONCFS, lettre n°149, p 5 sur 12
- Site de référence européen (en 3 langues), avec nombreuses cartes
- (en) Deplazes, P., D. Hegglin, S. Gloor and T. Romig, « Wilderness in the city: the urbanization of Echinococcus multilocularis » Trends in Parasitology 2004;20:77-84. PMID 14747021
- (en) Budke CM, Deplazes P, Torgerson PR, « Global socioeconomic impact of cystic echinococcosis » Emerg Infect Dis. 2006;12:296-303
- Encadré. L’échinococcose alvéolaire humaine en France en 2010 Box. Humanalveolar echinococcosis in France, update 2010
- (en) WHO (2000) World health report – 2000. World Health Organization. Geneva, Switzerland. Williams, B., Warren, J. « Effects of spatial distribution on the decomposition of sheep faeces in different vegetation types » Agric., Ecosyst. Environ., 2003;103:237-43.
- (en) Graham, A.J., Danson, F.M., Giraudoux, P., Craig, P.S. « Ecological epidemiology: landscape metrics and human alveolar echinococcosis » Acta Trop. 2004;91:267-78.
- (en) Danson, F.M., Craig, P.S., Man, W., Shi, D., Giraudoux, P. « Landscape dynamics and risk modeling of human alveolar echinococcosis » Photogramm. Eng. Remote Sens. 2004;70:359-66.
- Spitz, F. (1977) « Le campagnol des champs (Microtus arvalis (Pallas)) en Europe » Bull. OEPP 1977;7:165-75.
- Airoldi, J.P. « Étude par capture et recapture d’une population de Campagnols terrestres Arvicola terrestris » scherman Shaw. Rev. Ecol. (Terre Vie) 1978;32:3-45.
- (en) Wilson GJ, Frantz AC, Pope LC, Roper TJ, Burke TA, Cheeseman CL, Delahay RJ. « Estimation of badger abundance using faecal DNA typing » J. Applied Ecol. 2003;40:658-66.
- (en) S. C. Banks, M. P. Piggott, B. D. Hansen, N. A. Robinson et A. C. Taylor « Wombat coprogenetics: enumerating a common wombat population by microsatellite analysis of faecal DNA » Australian Journal of Zoology 2002;50(2):193-204 résumé
- (en) Idaghdour, Y., D. Broderick, et A. Korrida. « Faeces as a source of DNA for molecular studies in a threatened population of great bustards » Conservation Genetics 2003;4(6):789-92.
Voir aussi
Bibliographie
- Vuitton DA, Millon L, Gottstein B, Giraudoux P, « Proceedings of the international symposium — innovation for the management of echinococcosis. Besançon, March 27–29, 2014 », Parasite, vol. 21, , p. 28 (DOI 10.1051/parasite/2014024, lire en ligne)
Articles connexes
- épidémiologie
- écoépidémiologie
- Echinococcus granulosus (qui semble présent dans le monde entier)
- Echinococcus multilocularis (Hémisphère nord)
- Echinococcus vogeli (Amérique centrale et du Sud).
- Echinococcus oligarthrus (Amérique centrale et du Sud).
- Parasitisme
- Interactions durables
- Jacques Euzéby (parasitologue)
- Félix Dévé


