Pathologie hémorroïdaire
| Médicament | Benzocaïne, cortisol, phényléphrine, pramocaïne (en) et Euphorbia prostrata |
|---|---|
| Spécialité | Chirurgie générale et digestive |
| CISP-2 | K96 |
|---|---|
| CIM-10 | I84 |
| CIM-9 | 455 |
| DiseasesDB | 10036 |
| MedlinePlus | 000292 |
| eMedicine |
195401 emerg/242 |
| MeSH | D006484 |
| Patient UK | Haemorrhoids-piles-pro |
La pathologie hémorroïdaire, ou la maladie hémorroïdaire (ou les hémorroïdes dans le langage courant, du grec αἱμορροΐς, « flux de sang »), désigne la pathologie du canal anal en rapport avec les plexus rectaux (ou hémorroïdaires). Ces plexus veineux sont des anastomoses entre les veines rectales situées dans la paroi du canal anal. Ce type de pathologie est en rapport avec des anomalies mécaniques et vasculaires. Elles peuvent s'exprimer par une douleur, un saignement ou une gêne locale. Plusieurs traitements, médicaux, instrumentaux ou chirurgicaux sont disponibles.
Anatomie[modifier | modifier le code]

La pathologie hémorroïdaire touche les plexus veineux du canal anal. On distingue : le plexus veineux interne, dans la portion supérieure du canal anal, sous la muqueuse ; et le plexus veineux externe, dans la portion inférieure, sous la peau[1],[2]. Le plexus veineux interne est plus important par endroits, que l'on appelle « paquets » ou « coussinets » hémorroïdaires ; on en distingue habituellement un à gauche et deux à droite[1].
En principe, les coussinets hémorroïdaires participent à l'occlusion du canal anal par les sphincters, et donc à la continence anale[1].
Épidémiologie[modifier | modifier le code]

C'est une maladie liée au mode de vie, extrêmement fréquente dans les pays développés[3] : sa prévalence est d'environ 5 % aux États-Unis et 50 % des Américains seraient affectés durant leur vie[4]. En France, on estime qu'un tiers de la population adulte a eu au moins un symptôme hémorroïdaire au cours de la dernière année, mais seulement un tiers a consulté pour cela[2]. La prévalence augmente avec l’âge, avec un pic d’incidence au cours de la septième décennie[1]. Les caucasiens[5] et les couches sociales les plus favorisées[6] se plaignent plus souvent de manifestations hémorroïdaires[1].
Physiopathologie[modifier | modifier le code]
La physiopathologie n'est pas complètement connue[1],[7]. Deux théories principales coexistent, vasculaire et mécanique. La théorie vasculaire suppose une baisse du retour veineux du fait de la poussée abdominale au cours de la défécation. La théorie mécanique suppose une augmentation de laxité du tissu de soutien[1].
Les troubles du transit tels que la constipation, la dyschésie ou la diarrhée semblent jouer un rôle prépondérant, quand bien même ils ne sont pas systématiquement présents[1],[2]. La grossesse, l'accouchement et le post-partum chez la femme constituent également des facteurs favorisants[2],[8].
La régulation du transit par la consommation de fibres alimentaires est efficace[1].
La crise hémorroïdaire peut se manifester après une consommation excessive d’alcool ou d’un plat épicé[2].
Des antécédents familiaux sont fréquemment rapportés[1].
De nombreux facteurs sont évoqués pour expliquer leur apparition[9],[10],[11].
Expression clinique[modifier | modifier le code]
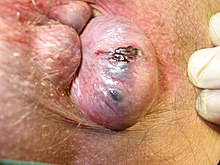

Les hémorroïdes sont asymptomatiques dans plus de la moitié des cas[12]. Les symptômes sont essentiellement l'hémorragie (typiquement après une défécation), la douleur, la gêne locale, le suintement (10 % des cas[13]) ou le prurit[1],[2]. Ils ne sont pas spécifiques et peuvent se voir dans d'autres maladies anales. L'aggravation des symptômes en cas d'ingestion d'épices n'a pas été scientifiquement démontrée[14].
Une douleur importante n'est pas classique et doit faire rechercher une autre cause (fissure anale ou infections).
L'examen clinique proctologique peut comporter l'inspection ou la palpation de l'anus et de la zone péri-anale, le toucher rectal et l'anuscopie, afin de porter le diagnostic et d'éliminer d'autres maladies comme certaines pathologies anales, péri-anales ou rectales. Ce dernier examen est nettement plus fiable que la fibroscopie pour les maladies hémorroïdaires[15].
Classification[modifier | modifier le code]
On distingue plusieurs formes de la pathologie : la thrombose, le prolapsus, l'érosion et la crise simple. La thrombose peut affecter le plexus externe ou interne[1],[2]. Les autres manifestations peuvent toucher le plexus interne. Ces formes cliniques peuvent survenir isolément ou en association, que ce soit de manière simultanée ou comme « complication ».
Thrombose[modifier | modifier le code]
La thrombose hémorroïdaire est une thrombose d'un des plexus, le plus souvent externe[1],[2]. Le symptôme principal est la douleur, de survenue brutale, intense, non rythmée par la défécation[1],[2]. L'examen clinique retrouve une tuméfaction bleutée[1],[2]. L'évolution est spontanément favorable en quelques jours[1].
Crise[modifier | modifier le code]
La crise hémorroïdaire est en quelque sorte une inflammation des plexus. Le symptôme principal est la douleur, variable, rythmée par la défécation ou l'effort[2]. L'examen clinique retrouve un aspect congestif[2]. L'évolution est spontanément favorable en quelques jours[2].

Prolapsus[modifier | modifier le code]

Le prolapsus hémorroïdaire interne est une procidence du plexus interne, pouvant entraîner une extériorisation d'importance variable. Le symptôme principal est initialement une gêne locale[1],[2]. L'examen clinique distingue quatre stades[1],[16] :
- le premier équivaut à un plexus uniquement œdématié et non prolabé ;
- le deuxième correspond à une procidence intermittente, au cours d'un effort de poussée, et spontanément réductible ;
- le troisième équivaut à une procidence permanente et réductible à l'examen clinique ;
- le quatrième correspond à une procidence irréductible.
En dehors du premier stade pour lequel il n'y a pas de procidence proprement dite, cette classification ne préjuge pas de la taille du prolapsus.
Érosion[modifier | modifier le code]
L'érosion hémorroïdaire interne est une érosion du plexus interne[1]. Le symptôme principal est le saignement, survenant typiquement en fin de défécation et pouvant tacher le papier à l'essuyage[1]. Les examens complémentaires peuvent rarement montrer une anémie[1].
Évolution[modifier | modifier le code]
La pathologie hémorroïdaire s'exprime par des manifestations fonctionnelles intermittentes[1]. Lorsque la pathologie évolue depuis plusieurs années, les douleurs peuvent être quotidiennes, les saignements peuvent être abondants, la procidence peut être permanente[2]. De ce fait, d’autres symptômes peuvent se surajouter comme les suintements muco-glaireux et le prurit[1],[2].
Diagnostic différentiel[modifier | modifier le code]

En cas de douleur, les principaux diagnostics différentiels de la pathologie hémorroïdaire sont une fissure anale, un abcès, un fécalome, un herpès ou une proctalgie fugace[2].
En cas de saignement, le principal diagnostic différentiel est une origine digestive autre, principalement le côlon ou le rectum.
Examens complémentaires[modifier | modifier le code]
Aucun examen complémentaire n'est nécessaire pour le diagnostic[2]. Cependant, lorsqu'il existe un saignement, l'examen clinique ne permet pas d'affirmer une origine hémorroïdaire[1],[2]. Un hémogramme peut être réalisé à la recherche d'une anémie. Le diagnostic différentiel principal de la cause d'un saignement étant un cancer, du côlon ou du rectum, plusieurs critères peuvent faire discuter la pratique d'une coloscopie : antécédents familiaux et personnels, âge élevé, altération de l'état général, douleur abdominale, saignement atypique, anémie. Ainsi, en cas de saignement, chez un patient de plus de 40 ans, une autre cause doit être recherchée[17] (polype ou tumeur) par une coloscopie courte ou un colo-scanner.
Traitement[modifier | modifier le code]
La pathologie hémorroïdaire est une affection bénigne ; le traitement est par conséquent essentiellement symptomatique, c'est-à-dire basé sur la gêne du patient[1]. Sa prise en charge a fait l'objet de recommandations de l'American Gastroenterological Association, publiées en 2004[18]. Celles de la Société nationale française de colo-proctologie datent de 2001[1].
Hygiène de vie[modifier | modifier le code]

Le traitement médical principal de la pathologie hémorroïdaire est la lutte contre les troubles du transit, en particulier la constipation, qu'il s'agit de prévenir ou de diminuer. Ceci passe dans un premier temps par :
- un apport suffisant en fibres dans l'alimentation[16], celles-ci ayant pour effet de ramollir les selles ; les céréales, les légumineuses et les fruits secs sont à privilégier en cas de constipation de manière générale[19] ; il est prouvé que la supplémentation en fibres diminue l'incidence du prolapsus symptomatique et de l'hémorragie[20] ;
- une hydratation suffisante[16].
D'autres attitudes plus spécifiques sont conseillées concernant l'utilisation des toilettes : le recours aux efforts de poussée doit être limité, et la station assise prolongée doit être évitée[16].
L'évitement d'un facteur déclenchant, s'il est clairement identifié, peut être envisagé[réf. souhaitée].
Aucune recommandation ne peut être faite concernant l'utilisation locale de froid ou de bain de siège[1].
Médicaments[modifier | modifier le code]
Le traitement médicamenteux de la pathologie hémorroïdaire comporte plusieurs médicaments pour lesquels peu de preuves d'efficacité sont disponibles[21]. On distingue des médicaments par voie orale ou des médicaments par voie locale (topiques).
Voie orale[modifier | modifier le code]

Pour la constipation, le traitement peut comporter un laxatif de type mucilage afin de ramollir les selles[1]. Les mucilages augmentent la fréquence des selles et améliorent leur consistance ; ils comportent le psyllium, l'ispaghule, la gomme de sterculia et le son de blé[19]. En cas de diarrhée, un traitement adéquat peut être proposé[1].
Le traitement symptomatique de la pathologie hémorroïdaire peut faire appel à plusieurs classes médicamenteuses : les antalgiques simples, les anti-inflammatoires non stéroïdiens et les veinotoniques[1]. La famille des veinotoniques comporte essentiellement le groupe des flavonoïdes qui sont des extraits de plantes. Parmi ceux-ci, la diosmine est la plus étudiée[1]. Un autre groupe de veinotoniques est constitué par de molécules de synthèse comme le dobésilate de calcium[22]. Les veinotoniques peuvent agir sur l'hémorragie, le prurit, le suintement et améliorer globalement la symptomatologie[22], leur efficacité restant toutefois discutée[23]. Ces médicaments sont bien tolérés y compris chez la femme enceinte, en dehors de cas de colite lymphocytaire rapportés[1].
Les traitements à base d'aescine aident à lutter contre les hémorroïdes[24][réf. à confirmer].
Voie locale[modifier | modifier le code]
Le traitement local peut faire appel à de nombreux médicaments sous forme de suppositoire, crème ou pommade, et dont il n'existe pas de preuve d'efficacité[1]. Les corticoïdes, les lubrifiants et les « protecteurs » peuvent être utilisés compte tenu de leur mode d'action supposé[1]. En revanche, aucune recommandation ne peut être faite vis-à-vis des anesthésiques, des prokinétiques ou des veinotoniques, bien qu'ils soient largement utilisés en pratique[1].
Un traitement consistant à rincer le canal anal de ses résidus serait efficace sur les symptômes bien que potentiellement douloureux[25],[26][réf. à confirmer].
Traitement instrumental[modifier | modifier le code]
Les traitements instrumentaux de la pathologie hémorroïdaire ont pour but commun de provoquer une fibrose qui fixe la muqueuse et réduit la vascularisation ; ces traitements sont réalisés par endoscopie en ambulatoire et sans anesthésie[2]. On en dénombre trois principaux : la ligature élastique, la photocoagulation et la sclérothérapie.
- La ligature élastique, diffusée par Barron en 1962[27], provoque par strangulation de la base du pédicule la nécrose des tissus[1], ce qui permet éventuellement leur destruction par une autre technique (par congélation, par exemple). C'est la technique instrumentale la plus efficace[16],[28] avec un taux de complications inférieur à 7 % et essentiellement bénignes[29].
- La photocoagulation par infrarouge, présentée en 1977 par Neiger, provoque une coagulation des capillaires par la focalisation de faisceau infrarouge au niveau de la base des pédicules[1]. Cette technique semble un peu mieux tolérée que la ligature élastique[30] mais a un taux de succès un peu moindre que la ligature élastique[28].
- La sclérothérapie, introduite en France vers 1920 par Raoul Bensaude, provoque une sclérose grâce à l’injection de chlorhydrate double de quinine et d'urée à la base des pédicules[1]. Cette technique permet de soulager rapidement le patient mais n'a pas démontré d'efficacité supérieure par rapport à un traitement médical[31].
Traitement chirurgical[modifier | modifier le code]
Le traitement chirurgical de la pathologie hémorroïdaire est réservé aux formes importantes ou en cas d'échec du traitement médical ou instrumental[13]. Il comporte plusieurs aspects. L'intervention peut être sous anesthésie locale ou générale en fonction de l’acte à effectuer. On distingue essentiellement la thrombectomie, l'hémorroïdectomie et l'hémorroïdopexie.
- La thrombectomie consiste en l'excision d'un thrombus, essentiellement dans le cadre d'une thrombose externe, en principe sous anesthésie locale[1]. Elle entraîne une sédation plus rapide de la douleur et un risque inférieur de récidive[32]. Toutefois, l'évolution d'une thrombose hémorroïdaire non opérée est favorable dans la très grande majorité des cas en quelques jours et une prise en charge chirurgicale tardive n'a pas beaucoup d'intérêt[33].
- L'hémorroïdectomie classique comporte plusieurs techniques dont le choix est à la discrétion du chirurgien. Il peut s'agir d'une résection de type pédiculaire ou circulaire, avec une plaie laissée ouverte ou fermée, sans qu'une technique soit supérieure à une autre[16]. La majorité des proctologues français réalise l'intervention dite de Miligan et Morgan, c'est-à-dire une hémorroïdectomie pédiculaire à plaie ouverte[1].
- L'hémorroïdopexie ou anopexie (intervention de Longo) consiste en un agrafage circulaire par l'exérèse d'une collerette rectale[2].
- La ligature des artères hémorroïdales guidée par Doppler est une technique décrite en 1995[34] et consiste en la ligature des artères irriguant les pédicules sous contrôle doppler[16]. Ses avantages supposés sont qu'elle n’implique pas l’exérèse des tissus et qu'elle réduit potentiellement la douleur postopératoire[16].
Indication[modifier | modifier le code]
En cas de thrombose hémorroïdaire externe, le traitement par thrombectomie est souhaitable[1],[16]. Un régime sera conseillé uniquement en cas de trouble du transit avéré. Un éventuel traitement médicamenteux par voie locale ou orale n'est pas étayé[1].
En cas de pathologie hémorroïdaire interne, le traitement comprend systématiquement une supplémentation en fibres et des conseils sur l'utilisation des toilettes[16]. Un traitement d'un trouble de transit associé peut être prescrit[1]. Concernant le traitement spécifique, il est d'abord médical pour les stades 1 à 3 avec possibilité d'utiliser un médicament oral en cure courte[1],[16]. L'utilisation d'un traitement local seul n'est pas étayée bien que, le plus souvent, ce traitement est prescrit en association avec un traitement oral pour une durée brève, sans qu'il existe une quelconque preuve de supériorité d'une telle association[1]. Lorsque le traitement médical est insuffisamment efficace, on peut proposer un traitement instrumental, le plus efficace étant la ligature élastique[16]. Le traitement chirurgical est quant à lui indiqué aux cas de pathologie réfractaire au traitement instrumental, ou en cas de prolapsus important associé à une pathologie hémorroïdaire externe[16].
Dans la culture populaire[modifier | modifier le code]
Dans la Bible, les hémorroïdes sont l'une des plaies de Dieu qui frappe les rebelles[35],[36].
Les hémorroïdes étaient désignées sous le terme de « mal de saint Fiacre », du nom du saint réputé soulager les personnes souffrant de cette affection[37].
Annexes[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Bibliographie[modifier | modifier le code]
- Patrick Atienza, Hémorroïdes et maladie hémorroïdaire, Medi-text éd., Paris, 2004, 159 p. (ISBN 2-915400-01-6)
Notes et références[modifier | modifier le code]
- Société nationale française de colo-proctologie (SNFCP), Recommandations pour la pratique clinique du traitement de la maladie hémorroïdaire, , 148 p. (lire en ligne).
- « Pathologie hémorroïdaire (Item 273) », dans Collégiale des universitaires en hépato-gastro-entérologie, Hépato-gastro-entérologie, édition Masson, (lire en ligne), p. 460 à 484
- (en) D.P. Burkitt, « Western diseases and their emergence related to diet », South African Medical Journal, vol. 61, no 26, (ISSN 0256-9574 et 2078-5135, lire en ligne, consulté le )
- S Lorenzo-Rivero, « Hemorrhoids: diagnosis and current management », Am Surg, vol. 75, no 8, , p. 635–42 (PMID 19725283)
- Dana Christian Lynge et Barry D. Weiss, 20 Common Problems : Surgical Problems And Procedures In Primary Care, McGraw-Hill Professional, , 457 p. (ISBN 978-0-07-136002-9), p. 114
- David E. Beck, The ASCRS textbook of colon and rectal surgery : Second Edition, New York, Springer, , 2e éd., 946 p. (ISBN 978-1-4419-1581-8, lire en ligne [archive du ]), p. 175
- (en) GE Reese, « Haemorrhoids », Clinical evidence, vol. 2009, (PMID 19445775).
- L. Abramowitz, A. Batallan Épidémiologie des lésions anales (fissure et thrombose hémorroïdaire externe) pendant la grossesse et le post-partum.
- (en) S Lorenzo-Rivero, « Hemorrhoids: diagnosis and current management », Am Surg, vol. 75, no 8, , p. 635–642 (PMID 19725283).
- (en) O Kaidar-Person, « Hemorrhoidal disease: A comprehensive review », Journal of the American College of Surgeons (en), vol. 204, no 1, 2007 jan, p. 102-117 (PMID 17189119, lire en ligne).
- Franceschi C, Hémorroïdes : maladie des veines ou d’un quatrième facteur. Essai d’analyse physiopathologique. Conséquences thérapeutiques[PDF], Actualités Médicales Internationales. Angiologie (8), no 145, .
- Riss S, Weiser FA, Schwameis K et al. The prevalence of hemorrhoids in adults, Int J Colorectal Dis, 2012;27:215-220
- Jacobs D, Hemorrhoids, N Engl J Med, 2014;371:944-951
- Altomare DF, Rinaldi M, La Torre F et al. Red hot chili pepper and hemorrhoids: the explosion of a myth: results of a prospective, randomized, placebo-controlled, crossover trial, Dis Colon Rectum, 2006;49:1018-1023
- Kelly SM, Sanowski RA, Foutch PG, Bellapravalu S, Haynes WC, A prospective comparison of anoscopy and fiberendoscopy in detecting anal lesions, J Clin Gastroenterol, 1986;8:658-660
- (en)American society of the colon and rectal surgeons, Practice parameters for the management of hemorrhoids, 2010 ([1])
- (en) Cheson AG, Scholefield JH, Management of haemorrhoids, BMJ, 2008;336:380-383
- (en) Clinical Practice Committee, American Gastroenterological Association, « American Gastroenterological Association medical position statement: diagnosis and treatment of hemorrhoids », Gastroenterology, 2004;126:1461-1462
- Société nationale française de gastroentérologie, Recommandations pour la pratique clinique dans la prise en charge et le traitement de la constipation chronique de l'adulte, 2007 ([2])
- (en) Alonso-Coello P, Mills E, Heels-Ansdell D et al. « Fiber for the treatment of hemorrhoid complications: a systematic review and meta-analysis » Am J Gastroenterol, 2006;101:181-8
- A. Sénéjoux, « Hémorroïdes », EMC (Elsevier Masson SAS, Paris), Gastro-entérologie, 9-086-A-10, 2010
- (en + fr) Perera N, Phlebotonics for haemorrhoids, Cochrane database syst rev, 2012 ([3]).
- (en) Alonso-Coello P, Zhou Q, Martinez-Zapata MJ et al. Meta-analysis of flavonoids for the treatment of haemorrhoids, Br J Surg, 2006;93:909-20
- L'aescine a été testée auprès de 38 personnes souffrant d’hémorroïdes et a entraîné une réduction significative des symptômes (taille, saignement et douleur), dès la première semaine de traitement [4]
- Maladie hémorroïdaire, maladie des veines ?
- Vergeau B, Clément R, Massoneau M, « Évaluation de l’efficacité et de la tolérance d’un nouveau procédé symptomatique de traitement des hémorroïdes appelé Intrajet », Médecine et chirurgie digestives Tome 24-no 2 mars-avril 1995
- (en) Barron J « Office ligation treatment of hemorrhoids » Dis Colon Rectum 1963;6:109-13
- (en) MacRae HM, McLeod RS, « Comparison of hemorrhoidal treatment modalities. A meta-analysis », Dis Colon Rectum, 1995;38:687-94
- (en) El Nakeeb AM, Fikry AA, Omar WH et al. « Rubber band ligation for 750 cases of symptomatic hemorrhoids out of 2200 cases » World J Gastroenterol, 2008;14:6525-6530
- (en) Marques CF, Nahas SC, Nahas CS, Sobrado CW Jr, Habr-Gama A, Kiss DR, « Early results of the treatment of internal hemorrhoid disease by infrared coagulation and elastic banding: a prospective randomized cross-over trial » Tech Coloproctol, 2006;10:312-317
- (en) Senapati A, Nicholls RJ, « A randomised trial to compare the results of injection sclerotherapy with a bulk laxative alone in the treatment of bleeding haemorrhoids » Int J Colorectal Dis, 1988;3:124-6
- (en) Greenspon J, Williams SB, Young HA, Orkin BA, « Thrombosed external hemorrhoids: outcome after conservative or surgical management » Dis Colon Rectum, 2004;47:1493-1498
- (en) Jacobs D, « Hemorrhoids » N Engl J Med. 2014; 371:944-951
- « A novel therapy for internal hemorrhoids: ligation of the hemorrhoidal artery with a newly devised instrument (Moricorn) in conjunction with a Doppler flowmeter »
- Deutéronome 28:27
- 1 Samuel 5:6-12
- Paulette Leblanc, « Saint Fiacre, patron des jardiniers », sur Radio-Silence (consulté le ).

