Grayanotoxine
| Grayanotoxine | |
| |
| Identification | |
|---|---|
| PubChem | 14965368 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C20H34O5 [Isomères] |
| Masse molaire[1] | 354,481 ± 0,019 9 g/mol C 67,77 %, H 9,67 %, O 22,57 %, |
| Propriétés optiques | |
| Indice de réfraction | 1.602 |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Les grayanotoxines sont un groupe de neurotoxines étroitement apparentées nommées d'après Leucothoe grayana, une plante originaire du Japon elle-même nommée à l'origine d'après le botaniste américain du XIXe siècle Asa Gray[2]. La grayanotoxine I (grayanotaxane-3,5,6,10,14,16-hexol 14-acétate) est également connue sous le nom de andromedotoxine, acetylandromedol, rhodotoxine et asebotoxine[3]. Les grayanotoxines sont produites par des espèces de Rhododendron et d'autres plantes de la famille des Éricacées.
Le miel fabriqué à partir du nectar et contenant ainsi du pollen de ces plantes contient également des grayanotoxines et est communément appelé « le miel qui rend fou »[4],[5]. La consommation de la plante ou de l'un de ses dérivés, y compris le miel, peut provoquer une réaction toxique rare appelée empoisonnement à la grayanotoxine, maladie du miel qui rend fou, intoxication au miel ou empoisonnement au rhododendron[6]. Cette drogue est le plus souvent produite et consommée dans les régions du Népal et de la Turquie comme drogue récréative ou utilisée en médecine traditionnelle[7].
Origine[modifier | modifier le code]

Les grayanotoxines sont produites par des plantes de la famille des Éricacées, en particulier des membres des genres Rhododendron, Pieris, Agarista et Kalmia[5]. Le genre Rhododendron comprend à lui seul plus de 750 espèces qui poussent dans le monde, dans certaines parties de l'Europe, de l'Amérique du Nord, du Japon, du Népal et de la Turquie. Ces plantes peuvent pousser à une variété d'altitudes allant du niveau de la mer à plus de 3000 mètres d'altitude. Alors que beaucoup de ces espèces contiennent des grayanotoxines, seules quelques-unes contiennent des niveaux significatifs. Les espèces à fortes concentrations de grayanotoxines telles que R. ponticum, R. flavum et R. luteum se trouvent le plus souvent au Népal et dans les régions de Turquie bordant la mer Noire[7].

Presque toutes les parties des rhododendrons produisent des grayanotoxines y compris la tige, les feuilles, les fleurs, le pollen et le nectar. Les grayanotoxines peuvent également être trouvées dans les produits végétaux dérivés tels que le miel, le thé du Labrador, les cigarettes et les plantes médicinales[5].
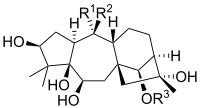
Structure chimique[modifier | modifier le code]

| Grayanotoxine | R 1 | R 2 | R 3 |
| Grayanotoxine I | OH | CH 3 | Ac |
| Grayanotoxine II | CH 2 | H | |
| Grayanotoxine III | OH | CH 3 | H |
| Grayanotoxine IV | CH 2 | Ac | |
Ac = acétyle
Les grayanotoxines sont des composés hydrophobes de bas poids moléculaire[8]. Ils sont structurellement caractérisés comme des diterpènes cycliques polyhydroxylés. La structure de base est un système cyclique 5/7/6/5 qui ne contient pas d'azote[5]. Plus de 25 isoformes de grayanotoxines ont été identifiées chez les espèces de Rhododendron [7], mais les grayanotoxines I et III sont considérées comme les principales isoformes toxiques. Différentes espèces de Rhododendron contiennent plusieurs isoformes de grayanotoxines différentes contribuant aux différences de toxicité des plantes.
Mécanisme d'action[modifier | modifier le code]

La toxicité de la grayanotoxine est dérivée de sa capacité à interférer avec les canaux sodiques régulés par la tension situés dans la membrane cellulaire des neurones. Les canaux Na v1.x se composent de quatre domaines homologues (I-IV), chacun contenant six segments alpha-hélicoïdaux transmembranaires (S1-S6). La grayanotoxine a une concentration inhibitrice médiane (IC 50) d'environ 10 μM et se lie au site récepteur du groupe II situé sur le segment 6 des domaines I et IV (IS6 et IVS6)[5] . Les autres toxines qui se lient à cette région sont entre autres les alcaloïdes vératridine, batrachotoxine et aconitine[8].
Des expériences utilisant des membranes axonales de calmar indiquent que la liaison des canaux sodiques se produit probablement sur la face interne du neurone[9]. De plus, la grayanotoxine ne se lie qu'à la conformation activée des canaux sodiques. Normalement, les canaux sodiques régulés par la tension ne sont activés (ouverts) que lorsque le potentiel de la membrane cellulaire atteint une tension de seuil spécifique. Cette conformation activée permet un afflux d'ions sodium entraînant une dépolarisation cellulaire, suivie du déclenchement d'un potentiel d'action. Au pic du potentiel d'action, les canaux sodiques régulés par la tension sont rapidement inactivés et ne sont réinitialisés qu'une fois que la cellule s'est repolarisée au potentiel de repos. Lorsque la grayanotoxine est présente, la liaison induit d'autres changements conformationnels qui empêchent l'inactivation des canaux sodiques et conduisent à une dépolarisation prolongée. En raison de sa capacité transitoire à activer les canaux et à augmenter la perméabilité de la membrane aux ions sodium, la grayanotoxine est classée comme un agoniste réversible Nav1.x[8].
Effets biologiques[modifier | modifier le code]
L'activation prolongée des canaux sodiques et la dépolarisation cellulaire entraînent une surstimulation du système nerveux central. Les symptômes physiques d'une intoxication à la grayanotoxine apparaissent après une période de latence dose-dépendante de plusieurs minutes à environ trois heures. Les symptômes cliniques les plus courants comprennent divers effets cardiovasculaires, des nausées et des vomissements et une altération de la conscience. Les effets cardiovasculaires peuvent inclure l'hypotension (pression artérielle basse) et divers troubles du rythme cardiaque tels que la bradycardie sinusale (rythme cardiaque régulier lent), la bradyarythmie (rythme cardiaque irrégulier lent) et le bloc auriculo-ventriculaire partiel ou complet[5],[10].
D'autres symptômes précoces peuvent inclure une diplopie et une vision trouble, des étourdissements, une hypersalivation, une transpiration, une faiblesse et une paresthésie dans les extrémités et autour de la bouche. À des doses plus élevées, les symptômes peuvent prendre la forme d'une perte de coordination, d'une faiblesse musculaire sévère et progressive, de changements électrocardiographiques du bloc de branche et / ou d'élévations du segment ST, comme on le voit dans la maladie cardiaque ischémique, le rythme nodal ou le syndrome de Wolff-Parkinson-White[11].
Le principal médiateur de cette physiopathologie est le nerf vague (dixième nerf crânien)[5]. Le nerf vague est une composante majeure du système nerveux parasympathique (une branche du système nerveux autonome) et innerve divers organes, notamment les poumons, l'estomac, les reins et le cœur. Dans une étude, l'administration expérimentale de grayanotoxine à des rats vagotomisés bilatéralement n'a pas induit de bradycardie, un symptôme courant d'empoisonnement à la grayanotoxine, soutenant le rôle de la stimulation vagale[12]. Dans les cas graves d'intoxication à la grayanotoxine, l'atropine (un antagoniste mAChR non spécifique ou un antimuscarinique) peut être utilisée pour traiter la bradycardie et d'autres dysfonctionnements du rythme cardiaque. En plus de corriger les troubles du rythme, l'administration de liquides et de vasopresseurs peut également aider à traiter l'hypotension et à atténuer d'autres symptômes[13].
Les patients exposés à de faibles doses de grayanotoxine se rétablissent généralement en quelques heures. Dans les cas plus graves, les symptômes peuvent persister pendant 24 heures ou plus et peuvent nécessiter un traitement médical. Malgré le risque de problèmes cardiaques l'empoisonnement à la grayanotoxine est rarement mortel chez l'homme[13].
Intoxication animale[modifier | modifier le code]
Contrairement à l'homme, l'empoisonnement à la grayanotoxine peut être mortel pour d'autres animaux[5]. Le nectar contenant de la grayanotoxine peut tuer les abeilles même si certaines semblent y résister et peuvent produire du miel à partir du nectar. Selon une équipe de chercheurs du Royaume-Uni et d'Irlande, les bourdons ne sont pas touchés par la toxine et peuvent être préférables comme pollinisateurs car ils transfèrent plus de pollen. Par conséquent, il peut être avantageux pour les plantes de produire de la grayanotoxine afin d'être pollinisées par les bourdons[14].
Intoxication au miel qui rend fou[modifier | modifier le code]
Les abeilles qui collectent le pollen et le nectar des plantes contenant des grayanotoxines produisent souvent du miel qui contient également des grayanotoxines[5],[10]. Ce miel censé rendre fou est la cause la plus fréquente d'empoisonnement à la grayanotoxine chez l'homme. Les petits producteurs de ce miel récoltent généralement le miel d'une petite zone ou d'une seule ruche afin de produire un produit final contenant une concentration significative de grayanotoxine. En revanche, la production de miel à grande échelle mélange souvent du miel récolté à différents endroits, diluant la concentration de tout miel contaminé.
Ce miel est délibérément produit dans certaines régions du monde, notamment au Népal et dans la région de la mer Noire en Turquie. Au Népal, ce type de miel est utilisé par les Gurungs à la fois pour ses propriétés hallucinogènes et pour ses prétendues propriétés médicinales[15]. En Turquie, ce miel appelé deli bal est également utilisé comme drogue récréative et en médecine traditionnelle. Il est le plus souvent fabriqué à partir du nectar de Rhododendron luteum et de Rhododendron ponticum dans la région du Caucase[16]. Au XVIIIe siècle, ce miel a été exporté vers l'Europe pour être ajouté aux boissons alcoolisées pour leur donner un effet supplémentaire. À l'époque moderne, il est consommé localement et exporté vers l'Amérique du Nord, l'Europe et l'Asie[10],[17],[18].
En plus de diverses espèces de Rhododendron, le miel qui rend fou peut également être fabriqué à partir de plusieurs autres plantes contenant des grayanotoxines. Le miel produit à partir du nectar d’Andromeda polifolia contient des niveaux suffisamment élevés de grayanotoxine pour provoquer une paralysie complète du corps et des difficultés respiratoires potentiellement fatales dues à la paralysie du diaphragme[10],[19]. Le miel obtenu à partir de kalmia latifolia et d'espèces apparentées telles que le laurier-mouton peut également provoquer des symptomes. Le miel de Lestrimelitta limao produit également cet effet paralysant observé dans le miel d'A. Polifolia et est également toxique pour l'homme[20].
Usage médicinal[modifier | modifier le code]
Bien que le miel qui rend fou soit utilisé en médecine traditionnelle en Turquie[5] la majorité des cas d'empoisonnement à la grayanotoxine surviennent chez des hommes d'âge moyen qui utilisent le miel dans le but, non avéré, d'améliorer leurs performances sexuelles[21].
Utilisation historique[modifier | modifier le code]
Les effets enivrants du miel qui rend fou sont connus depuis des milliers d'années. Xénophon, Aristote, Strabon, Pline l'Ancien [17],[22] et Columella documentent les cas de consommation de ce miel « qui rend fou », censé provenir du pollen et du nectar de Rhododendron luteum et de Rhododendron ponticum[23]. Selon Anabasis de Xenophon, une armée grecque est accidentellement empoisonnée en récoltant et en mangeant le miel local d'Asie Mineure[24]. Ayant entendu parler de cet incident et se rendant compte que les envahisseurs étrangers ignorent les dangers du miel local, le roi Mithridate utilise de manière délibérée le miel comme poison lorsque l'armée de Pompée attaque les Heptakometes en Asie Mineure en [25]. Les soldats romains devinrent délirants et nauséeux après avoir été trompés en mangeant du miel toxique, à ce moment-là l'armée de Mithridate attaqua[26],[27],[28].
Notes et références[modifier | modifier le code]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Grayanotoxin » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Alexander Senning, Elsevier's Dictionary of Chemoetymology, Amsterdam, Elsevier, (ISBN 978-0-444-52239-9, lire en ligne), p. 170
- The Merck Index, Rahway, NJ, 10th, , 652–653 (lire en ligne)
- « En Turquie, ce miel rend fou », sur LCI, (consulté le )
- « Grayanotoxin poisoning: 'mad honey disease' and beyond », Cardiovascular Toxicology, vol. 12, no 3, , p. 208–15 (PMID 22528814, PMCID 3404272, DOI 10.1007/s12012-012-9162-2)
- « Mad honey sex: therapeutic misadventures from an ancient biological weapon », Annals of Emergency Medicine, vol. 54, no 6, , p. 824–9 (PMID 19683834, DOI 10.1016/j.annemergmed.2009.06.010)
- Sahin, « Grayanotoxin-III Detection and Antioxidant Activity of Mad Honey », International Journal of Food Properties, vol. 18, no 12, , p. 2665–2674 (DOI 10.1080/10942912.2014.999866)
- Nicholas Sperelakis, Cell Physiology Source Book: Essentials of Membrane Biophysics, Elsevier Science & Technology, , 510–513 p. (ISBN 9780123877383)
- « Grayanotoxin opens Na channels from inside the squid axonal membrane », Biophysical Journal, vol. 53, no 2, , p. 271–4 (PMID 2449919, PMCID 1330147, DOI 10.1016/s0006-3495(88)83088-1, Bibcode 1988BpJ....53..271S)
- (en) « Grayanotoxins », Foodborne Pathogenic Microorganisms and Natural Toxins Handbook, US FDA, (consulté le )
- (en) « Transient ST segment elevation and left bundle branch block caused by mad-honey poisoning », Wiener Klinische Wochenschrift, vol. 124, nos 7–8, , p. 278–81 (PMID 22527815, DOI 10.1007/s00508-012-0152-y)
- « Site of action of grayanotoxins in mad honey in rats », Journal of Applied Toxicology, vol. 11, no 3, , p. 199–201 (PMID 1918794, DOI 10.1002/jat.2550110308)
- (en) « Bad Bug Book: Handbook of Foodborne Pathogenic Microorganisms and Natural Toxins », FDA (consulté le )
- (en) Stephanie Pain, « Bitter sweet nectar: Why some flowers poison bees », New Scientist, (lire en ligne)
- (en) Treza, « Hallucinogen honey hunters », topdocumentaryfilms.com, (consulté le )
- (en) Jamie Waters, « The buzz about 'mad honey', hot honey and mead », The Guardian, (lire en ligne)
- (en) Mayor, « Mad Honey! », Archaeology, vol. 46, no 6, , p. 32–40 (lire en ligne)
- (en) Cheryll Williams, Medicinal Plants in Australia Volume 1: Bush Pharmacy, Rosenberg Publishing, (ISBN 978-1877058790, lire en ligne), p. 223
- (en) Yaacov Lensky, Bee Products: Properties, Applications, and Apitherapy, Springer, (ISBN 0-306-45502-1, lire en ligne)
- (en) « Robber bees (Lestrimelitta limao) and their host chemical and visual cues in nest defense byTrigona (Tetragonisca) angustula (Apidae: Meliponinae) », Journal of Chemical Ecology, vol. 16, no 2, , p. 631–41 (PMID 24263518, DOI 10.1007/bf01021793)
- « Grayanotoxin (mad honey) - ongoing consumption after poisoning », Balkan Medical Journal, vol. 30, no 3, , p. 293–5 (PMID 25207122, PMCID 4115918, DOI 10.5152/balkanmedj.2013.8100)
- « Pliny the Elder on Mad Honey »
- Kelhoffer, « John the Baptist's "Wild Honey" and "Honey" in Antiquity », Greek, Roman, and Byzantine Studies, vol. 45, , p. 59–73 (lire en ligne)
- « Greek and Roman Materials: Chapter 8: Xenophon, Anabasis », Perseus Hopper, Department of the Classics, Tufts University.
- Richard W. Lane et Joesph F. Borzelleca, Principles and methods of toxicology, Boca Raton, 5th, (ISBN 978-0-8493-3778-9), « Harming and Helping Through Time: The History of Toxicology »
- « Strabo, Geography »
- The ABC and XYZ of Bee Culture, Medina, Ohio, A.I. Root Company, , 17–21 p., « Ancient Beekeeping »
- Bees and Warfare: Gleanings in Bee Culture, , 343–6 p.
