Perborate de sodium
| Perborate de sodium | |
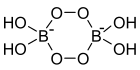 Dimère de perborate de sodium monohydraté |
|
| Identification | |
|---|---|
| No CAS | NaBO3 NaBO3·H2O |
| No ECHA | 100.035.597 |
| No CE | 239-172-9 NaBO3 234-390-0 NaBO3·H2O |
| No RTECS | SC7350000 |
| Code ATC | A01 |
| PubChem | 517072 NaBO3 23711812 NaBO3·H2O |
| ChEBI | 30178 |
| SMILES | |
| InChI | |
| Apparence | Solide blanc cristallisé |
| Propriétés chimiques | |
| Formule | Na2B2O4(OH)4 |
| Masse molaire[1] | 199,628 ± 0,017 g/mol H 2,02 %, B 10,83 %, Na 23,03 %, O 64,12 %, |
| Propriétés physiques | |
| T° fusion | ≥ 60 °C (décomposition[2]) |
| Solubilité | 15,5 g·l-1 à 20 °C [2] |
| Précautions | |
| SGH[2],[3] | |
| H272, H302, H318, H331, H335, H360Df, P201, P220, P261, P280, P311 et P305+P351+P338 |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le perborate de sodium est un composé chimique de formule NaBO3. Il s'agit d'un solide blanc, cristallisé et anhydre, très instable.
Il existe aussi le perborate monohydraté de sodium, composé monohydratée de formule brute NaBO3·H2O, également écrite NaBO2(OH)2, ou dimérisée en Na2B2O4(OH)4. C'est une poudre, de masse molaire 99,83 g/mol (ou le double pour son dimère). Elle se décompose lentement à partir de 40 °C dans l'état sec ou encore plus vite dans l'eau chaude. Elle est peu soluble dans l'eau froide. Ce perborate est soluble dans le glycérol et les alcalis ou solutions aqueuses alcalines.
Les composés perborates de sodium tétrahydraté NaBO2(OH)2·3H2O et trihydratés NaBO2(OH)2·2H2O existent également, mais c'est le composé monohydrate qui possède la meilleure solubilité dans l'eau ainsi que la meilleure résistance à la chaleur. D'où son usage industriel dans le nettoyage et le blanchiment.
Production
[modifier | modifier le code]Le perborate de sodium peut être produit en deux temps à partir de borax Na2B4O7·10H2O, d'hydroxyde de sodium NaOH et de peroxyde d'hydrogène H2O2 en passant par le métaborate de sodium NaBO2 :
Le tétrahydrate NaBO2(OH)2·3H2O issu de cette synthèse donne du monohydrate NaBO2(OH)2 simplement par chauffage[4] :
- NaBO2(OH)2·3H2O → 3 H2O + NaBO2(OH)2.
Utilisation
[modifier | modifier le code]Le perborate de sodium est utilisé notamment comme source « d'oxygène actif » dans les détergents et les lessives, ainsi que dans les produits de nettoyage et de blanchiment. Il s'hydrolyse en effet en borate et peroxyde d'hydrogène H2O2 au contact de l'eau, le peroxyde réagissant avec la tétraacétyléthylènediamine (TAED) des lessives pour libérer de l'acide peracétique CH3COOOH, « activateur » dont l'action commence à température plus basse que celle du peroxyde d'hydrogène — dès 40 °C pour CH3COOOH contre plus de 60 °C pour H2O2 — et est moins agressive pour les teintures et les textiles que celle de l'hypochlorite de sodium NaClO :

Libération d'acide peracétique par le TAED en présence de peroxyde d'hydrogène H2O2 :
1 tétraacétyléthylènediamine ; 2 diacétyléthylènediamine ; 3 acide peracétique.
En raison des risques sanitaires liés au perborate de sodium, notamment à ses risques reprotoxiques[5], ce composé est remplacé notamment par le percarbonate de sodium 2Na2CO3·3H2O2 dans les lessives « vertes ».
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Sodium perborate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 avril 2011 (JavaScript nécessaire)
- SIGMA ALDRICH
- (en) B. J Brotherton, « Boron: Inorganic Chemistry Encyclopedia of Inorganic Chemistry », Ed. R. Bruce King, John Wiley & Sons, 1994. (ISBN 0-471-93620-0)
- Que Choisir, Blanchiment des dents - Certains rient jaune, 7 octobre 2011
- (fr) Solvay Chemicals, Inc. – 26 mars 2009 FICHE DE DONNÉES DE SÉCURITÉ : « Perborate de sodium monohydraté. »






