Iodate de sodium
| Iodate de sodium | |||
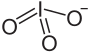 Structure de l'iodate de sodium. |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.028.793 | ||
| No CE | 231-672-5 | ||
| SMILES | |||
| InChI | |||
| Apparence | cristaux blancs | ||
| Propriétés chimiques | |||
| Formule | NaIO3 | ||
| Masse molaire[1] | 197,892 4 ± 0,000 9 g/mol I 64,13 %, Na 11,62 %, O 24,25 %, |
||
| Propriétés physiques | |||
| T° fusion | 425 °C | ||
| Solubilité | 9,47 g·l-1 | ||
| Masse volumique | 4,28 g·cm-3 | ||
| Précautions | |||
| SGH[2] | |||
| H272, H302, H334, P220, P261, P311 et P342 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
L’iodate de sodium est un composé chimique de formule NaIO3. C'est un sel de l'acide iodique HIO3. C'est un agent oxydant et donc un comburant responsable d'incendies lorsqu'il est en contact avec des matériaux combustibles ou des agents réducteurs.
Préparation[modifier | modifier le code]
L'iodate de sodium peut être obtenu en faisant réagir de l'acide iodique avec une base contenant du sodium :
On l'obtient également en ajoutant du diiode I2 à une solution chaude et concentrées d'hydroxyde de sodium NaOH ou d'un carbonate de sodium Na2CO3 :
Réactions[modifier | modifier le code]
L'iodate de sodium peut être oxydé en periodate de sodium NaIO4 par des solutions aqueuses d'hypochlorite ClO− ou d'autres agents oxydants énergiques :
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- SIGMA ALDRICH




