Hexaborure de calcium
| Hexaborure de calcium | |
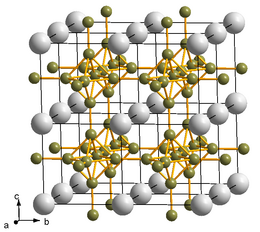
| |
| __ Ca2+ __ B Maille cristalline de l'hexaborure de calcium |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.031.374 |
| No CE | 234-525-3 |
| PubChem | 16212529 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | CaB6 |
| Masse molaire[1] | 104,944 ± 0,046 g/mol B 61,81 %, Ca 38,19 %, |
| Propriétés physiques | |
| Masse volumique | 2,3 g·cm-3 à 25 °C[2] |
| Cristallographie | |
| Système cristallin | Cubique |
| Classe cristalline ou groupe d’espace | (no 221) [3] |
| Précautions | |
| SGH[2] | |
| H315, H319, H335, P261 et P305+P351+P338 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'hexaborure de calcium, parfois simplement écrit borure de calcium, est un composé chimique de formule CaB6. Il se présente comme une poudre noire brillante chimiquement inerte de faible masse volumique. Il s'agit d'un solide cristallisé de structure cubique typique des hexaborures métalliques, avec des unités octaédriques formées de six atomes de bore combinés avec des atomes de calcium. L'hexafluorure de calcium pur et dopé au lanthane présente des propriétés ferromagnétiques, ce qui est remarquable dans la mesure où ni le bore ni le calcium ne sont magnétiques, et ne possèdent pas non plus de sous-couche électronique 3d ou 4f, qui sont généralement requises pour le ferromagnétisme.
Propriétés
[modifier | modifier le code]L'hexaborure de calcium est un matériau important en raison de la valeur élevée de sa conductivité électrique, de sa dureté, de sa stabilité chimique et de sa température de fusion. Il a été étudié par le passé du point de vue de propriétés particulières comme la supraconductivité, la fluctuation de valence et l'effet Kondo[4]. Sa propriété la plus remarquable reste cependant le ferromagnétisme. Il s'observe à une température étonnamment élevée (326,85 °C) et avec un moment magnétique faible (inférieur à 0,07 µB par atome). Ce ferromagnétisme haute température proviendrait de la phase ferromagnétique d'un gaz d'électrons dilué en relation avec un état excitonique dans le borure de calcium ou des impuretés externes à la surface du matériau. Ces impuretés seraient notamment du fer et du nickel issus probablement des impuretés du bore utilisé pour produire l'hexafluorure de calcium[5].
L'hexaborure de calcium est insoluble dans l'eau H2O, le méthanol CH3OH et l'éthanol CH3CH2OH, et se dissout lentement dans les acides. Sa microdureté vaut 27 GPa, sa dureté Knoop 2 600 kg·mm-2, son module de Young 379 GPa, et sa résistivité est supérieure à 2 × 1010 Ω·m pour les cristaux purs[6]. C'est un semiconducteur, dont la largeur de bande interdite est estimée à 1,0 eV. La faible conductivité électrique, de type semi-métallique, de nombreux échantillons de CaB6 peut s'expliquer par un dopage fortuit provenant d'impuretés, voire d'un possible écart à la stœchiométrie[7].
Production
[modifier | modifier le code]L'une des principales réactions utilisées pour produire de l'hexaborure de calcium est[8] :
Parmi les autres méthodes de production d'hexaborure de calcium pulvérulent, on compte la réaction directe de calcium ou d'oxyde de calcium CaO sur le bore à 1 000 °C ainsi que la réaction sous vide de l'hydroxyde de calcium Ca(OH)2 avec le bore à 1 700 °C[9] (réduction carbothermique) :
Il est également possible de faire réagir sous vide du carbonate de calcium CaCO3 avec du carbure de bore B4C à plus de 1 400 °C (réduction carbothermique) ou encore de faire réagir de l'oxyde de calcium CaO et de l'acide borique H3BO3 en présence de magnésium à 1 100 °C. La synthèse à basse température (500 °C) :
donne un matériau de qualité médiocre[10]. La production de monocristaux de CaB6, par exemple pour réaliser une cathode, nécessite de purifier et de recristalliser ce matériau primaire par la méthode de la zone fondue. Le cristal croît généralement à une vitesse de 30 cm·h-1 pour atteindre des dimensions de l'ordre de 1 cm × 10 cm[9]. Des nanofils monocristallins de CaB6 d'environ 15 à 40 nm de diamètre pour 1 à 10 µm de long peuvent être obtenus par pyrolyse de diborane B2H6 sur poudre d'oxyde de calcium CaO de 860 à 900 °C en présence de catalyseur nickel[6].
Applications
[modifier | modifier le code]L'hexaborure de calcium est utilisé dans la production d'aciers alliés au bore[6] et comme désoxydant pour la production de cuivre dépourvu d'oxygène, ce qui permet d'obtenir du cuivre ayant une meilleure conductivité électrique que celle obtenue par les techniques habituelles de désoxydation au phosphore grâce à la faible solubilité du bore dans cuivre[8]. Il peut également être utilisé comme matériau pour hautes températures, pour la protection des surfaces, comme abrasif, ou encore pour réaliser des outils.
L'hexaborure de calcium est un très bon conducteur de l'électricité avec un faible travail de sortie, de sorte qu'il peut être utilisé comme cathode chaude. À température élevée cependant, l'hexaborure de calcium s'oxyde, ce qui dégrade ses propriétés et réduit la durée de vie des composants qui en sont faits. C'est également un candidat prometteur comme matériau thermoélectrique de type n en raison de son facteur de puissance au moins égal à celui de matériaux thermoélectriques courants tels que le tellurure de bismuth(III) Bi2Te3 et le tellurure de plomb(II) PbTe[6].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Calcium hexaboride −200 mesh, 99.5%, consultée le 27 juillet 2017.
- S. Yahia, S. Turrell, G. Turrell, J. P. Mercurio, Infrared and Raman spectra of hexaborides: force-field calculations, and isotopic effects,J. Mol. Struct., 1990, vol. 224(1-2), pp. 303–312. Bibcode : 1990JMoSt.224..303Y, DOI 10.1016/0022-2860(90)87025-S.
- (en) J. Etourneau et P. Hagenmuller, « Structure and physical features of the rare-earth borides », Philosophical Magazine Part B, vol. 52, no 3, , p. 589-610 (DOI 10.1080/13642818508240625, Bibcode 1985PMagB..52..589E, lire en ligne)
- (en) D. P. Young, D. Hall, M. E. Torelli, Z. Fisk, J. L. Sarrao, J. D. Thompson, H.-R. Ott, S. B. Oseroff, R. G. Goodrich et R. Zysler, « High-temperature weak ferromagnetism in a low-density free-electron gas », Nature, vol. 397, no 6718, , p. 412-414 (DOI 10.1038/17081, Bibcode 1999Natur.397..412Y, lire en ligne)
- (en) Terry T. Xu, Jian-Guo Zheng, Alan W. Nicholls, Sasha Stankovich, Richard D. Piner et Rodney S. Ruoff, « Single-Crystal Calcium Hexaboride Nanowires: Synthesis and Characterization », Nano Letters, vol. 4, no 10, , p. 2051-2055 (DOI 10.1021/nl0486620, Bibcode 2004NanoL...4.2051X, lire en ligne)
- (en) S. Souma, H. Komatsu, T. Takahashi, R. Kaji, T. Sasaki, Y. Yokoo et J. Akimitsu, « Electronic Band Structure and Fermi Surface of CaB6 Studied by Angle-Resolved Photoemission Spectroscopy », Physical Review Letters, vol. 90, no 2, , article no 027202 (PMID 12570575, DOI 10.1103/PhysRevLett.90.027202, Bibcode 2003PhRvL..90b7202S, lire en ligne)
- (en)« Borides: Solid State Chemistry », Encyclopedia of Inorganic Chemistry, John Wiley & Sons, 1994.
- (en) Shigeki Otani, « Preparation of CaB6 crystals by the floating zone method », Journal of Crystal Growth, vol. 192, nos 1-2, , p. 346-349 (DOI 10.1016/S0022-0248(98)00444-8, Bibcode 1998JCrGr.192..346O, lire en ligne)
- (en) Liang Shi, Yunle Gu, Luyang Chen, Zeheng Yang, Jianhua Ma et Yitai Qian, « Low Temperature Synthesis and Characterization of Cubic CaB6 Ultrafine Powders », Chemistry Letters, vol. 32, no 10, , p. 958 (DOI 10.1246/cl.2003.958, lire en ligne)




