1,1-Diméthyldiborane
| 1,1-Diméthyldiborane | |
| |
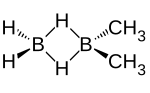
| Structure du 1,1-diméthyldiborane | |
| Identification | |
|---|---|
| Synonymes |
diméthyldiborane asymétrique |
| No CAS | |
| PubChem | 18380881 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C2H10B2 |
| Masse molaire[1] | 55,723 ± 0,016 g/mol C 43,11 %, H 18,09 %, B 38,8 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le 1,1-diméthyldiborane est un composé organoboré de formule chimique H2B(μ-H)2B(CH3)2. Il en existe deux isomères, le cis- et trans-1,2-diméthyldiborane CH3HB(μ-H)2BHCH3[2]. À température ambiante, il est à l'équilibre avec le méthyldiborane H2BH2BHCH3, le 1,2-diméthyldiborane CH3HBH2BHCH3, le triméthyldiborane CH3HBH2B(CH3)2, le tétraméthyldiborane (CH3)2BH2B(CH3)2 et le triméthylborane B(CH3)3, de sorte qu'il est difficile de disposer de 1,1-diméthyldiborane pur[3]. Il se présente comme un gaz pyrophorique incolore.
Histoire et préparation[modifier | modifier le code]
Les méthylboranes ont été préparés pour la première fois dans les années 1930[4],[5]. On les obtient en faisant réagir du diborane H2BH2BH2 et du triméthylborane B(CH3)3, ce qui donne quatre composés différents : le méthyldiborane H2BH2BHCH3, le 1,1-diméthyldiborane H2BH2B(CH3)2, le 1,2-diméthyldiborane CH3HBH2BHCH3 et le tétraméthyldiborane (CH3)2BH2B(CH3)2[6].
Le tétraméthylplomb Pb(CH3)4 réagit avec le diborane à température ambiante dans le diméthoxyéthane pour donner une série de diboranes à substituants méthyle pour aboutir au triméthylborane mais avec du 1,1-diméthyldiborane et du triméthyldiborane CH3HBH2B(CH3)2. Les autres produits sont l'hydrogène et le plomb[7].
On peut également obtenir des méthyldiboranes en chauffant du triméthylborane en présence d'hydrogène. Le triméthylborane réagit avec les sels métalliques de borohydrure en présence de chlorure d'hydrogène HCl, de chlorure d'aluminium AlCl3 ou de trichlorure de bore BCl3. Il y a libération de méthane avec le borohydrure de sodium NaBH4, mais pas avec le borohydrure de lithium LiBH4[5]. Le diméthylchloroborane BCl(CH3)2 et le méthyldichloroborane BCl2CH3 sont également des produits gazeux de ces réactions.
La réaction de Cp2Zr(CH3)2 avec du borane BH3 dissous dans le tétrahydrofurane (THF) conduit à l'insertion d'un groupe borohydro dans la liaison Zr–C et à la production de dérivés méthylés du diborane[8].
Le diméthylcalcium Ca(CH3)2 réagit dans l'éther avec le diborane pour produire du diméthyldiborane et du borohydrure de calcium Ca(BH4)2[9] :
- Ca(CH3)2 + 2 B2H6 ⟶ Ca(BH4)2 + B2H4(CH3)2.
Le 1,2-diméthyldiborane au repos se convertit lentement en 1,1-diméthyldiborane[10].
La chromatographie en phase gazeuse peut être utilisée pour déterminer les proportions de boranes méthylés dans un mélange. La séquence d'extraction est la suivante : diborane, méthyldiborane, triméthylborane, 1,1-diméthyldiborane, 1,2-diméthyldiborane, triméthyldiborane et tétraméthyldiborane[11].
Réactions[modifier | modifier le code]
Le méthyldiborane H2BH2BHCH3 se dismute lentement à −78,5 °C, d'abord en diborane H2BH2BH2 et 1,1-diméthyldiborane H2BH2B(CH3)2[12]. En solution, le méthylborane BH2CH3 est plus stable par rapport à la dismutation que le diméthylborane BH(CH3)2[6],[13].
- 2 H2BH2BHCH3 H2BH2B(CH3)2 + H2BH2BH2 ;
- 3 H2BH2B(CH3)2 2 CH3HBH2B(CH3)2 + H2BH2BH2.
Le triméthylborane B(CH3)3 se dismute partiellement à température ambiante en quelques heures pour donner du tétraméthyldiborane (CH3)2BH2B(CH3)2 et du 1,2-diméthyldiborane CH3HBH2BHCH3. Il se forme également du 1,1-diméthyldiborane au bout de quelques semaines[14].
L'oxydation ménagée du 1,1-diméthyldiborane à 80 °C donne du 2,5-diméthyl-1,3,4-trioxadiboralane, un liquide volatil qui contient un cycle formé de deux atomes de bore et trois atomes d'oxygène[15]. Cette réaction a comme intermédiaire deux molécules de diméthylborylhydroperoxyde (CH3)2BOOH[16]. Il se forme une substance semblable, le méthyltrioxadiboralane, lorsque le méthyldiborane est oxydé vers 150 °C. Il se forme également du diméthyltrioxadiboralane et de la triméthylboroxine ainsi que des hydrocarbures, du diborane, de l'hydrogène et du diméthoxyborane (ester diméthylméthylboronique)[15].
Notes et références[modifier | modifier le code]
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Morris Srebnik, Thomas E. Cole et Herbert C. Brown, « Methylborane - a remarkable unhindered monoalkylborane which achieves the controlled sequential hydroboration of representative alkenes », Tetrahedron Letters, vol. 28, no 33, , p. 3771-3774 (DOI 10.1016/S0040-4039(00)96380-9, lire en ligne)
- (en) R. P. Bell et H. J. Emeléus, « The boron hydrides and related compounds », Quarterly Reviews, Chemical Society, vol. 2, no 2, , p. 132-151 (DOI 10.1039/QR9480200132, lire en ligne)
- (en) H. I. Schlesinger et A. O. Walker, « Hydrides of Boron. IV. The Methyl Derivatives of Diborane », Journal of the American Chemical Society, vol. 57, no 4, , p. 621-625 (DOI 10.1021/ja01307a009, lire en ligne)
- (en) L. H. Long et M. G. H. Wallbridge, « 646. The chemistry of boron. Part VI. New preparative methods and decomposition studies relating to methyldiboranes », Journal of the Chemical Society (Resumed), , p. 3513-3520 (DOI 10.1039/JR9650003513, lire en ligne)
- (en) Herbert C. Brown, Thomas E. Cole, Morris Srebnik et Kee Won Kim, « Hydroboration. 79. Preparation and properties of methylborane and dimethylborane and their characteristics as hydroborating agents. Synthesis of tertiary alcohols containing methyl groups via hydroboration », The Journal of Organic Chemistry, vol. 51, no 25, , p. 4925-4930 (DOI 10.1021/jo00375a031, lire en ligne)
- (en) A. K. Holliday et G. N. Jessop, « The reaction of tetramethyllead with diborane », Journal of Organometallic Chemistry, vol. 10, no 2, , p. 291-293 (DOI 10.1016/S0022-328X(00)93089-4, lire en ligne)
- (en) John A. Marsella et Kenneth G. Caulton, « Dealkylation of zirconium(IV) by borane: the intimate mechanism of an alkyl transfer reaction », Journal of the American Chemical Society, vol. 104, no 9, , p. 2361-2365 (DOI 10.1021/ja00373a005, lire en ligne)
- (en) B. D. James et M. G. H. Wallbridge, « Metal Tetrahydroborates », Stephen J. Lippard, Progress in Inorganic Chemistry, vol. 11, Wiley, 1970, p. 185. (ISBN 0471-54081-1)
- (en) Walter J. Lehmann, Charles O. Wilson Jr. et I. Shapiro, « Infrared Spectra of Alkyldiboranes. III. 1,2‐Dimethyl‐ and 1,2‐Diethyldiboranes », The Journal of Chemical Physics, vol. 33, no 2, , p. 590-597 (DOI 10.1063/1.1731190, Bibcode 1960JChPh..33..590L, lire en ligne)
- (en) G. R. Seely, J. P. Oliver et D. M. Ritter, « Gas-Liquid Chromatographic Analysis of Mixtures Containing Methyldiboranes », Analytical Chemistry, vol. 31, no 12, , p. 1993-1995 (DOI 10.1021/ac60156a032, lire en ligne)
- (en) Roger K. Bunting, « 55 1-Methyldiborane », Duward F. Shriver, Inorganic Syntheses, vol. 19, John Wiley and Sons, 22 septembre 2009, p. 237–238. (ISBN 978-0471045427)
- (en) Thomas Onak, « Carboranes and Organo-Substituted Boron Hydrides », F. G. A. Stone et Robert West, Advances in Organometallic Chemistry, Academic Press, janvier 1966, p. 284. (ISBN 978-0080580043)
- (en) Walter J. Lehmann, Charles O. Wilson Jr. et I. Shapiro, « Infrared Spectra of Alkyldiboranes. V. Tri‐ and Tetramethyl‐ and Ethyldiboranes », The Journal of Chemical Physics, vol. 34, no 3, , p. 783-792 (DOI 10.1063/1.1731675, Bibcode 1961JChPh..34..783L, lire en ligne)
- (en) Lawrence Barton, John M. Crump et Jeffrey B. Wheatley, « Trioxadiborolanes from the oxidation of methyldiborane », Journal of Organometallic Chemistry, vol. 72, no 1, , C1-C3 (DOI 10.1016/S0022-328X(00)82027-6, lire en ligne)
- (en) Lawrence Barton et John M. Crump, « Oxidation of 1,1-dimethyldiborane. Gas-phase peroxide intermediates », Inorganic Chemistry, vol. 12, no 11, , p. 2506-2510 (DOI 10.1021/ic50129a003, lire en ligne)

