Nitrure de bore
| Nitrure de bore | |
| |
| __ B __ N Structure cristalline du nitrure de bore cubique |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.030.111 |
| No CE | 233-136-6 |
| PubChem | 66227 |
| SMILES | |
| InChI | |
| Apparence | solide blanc cristallisé[1] |
| Propriétés chimiques | |
| Formule | BN [Isomères] |
| Masse molaire[2] | 24,818 ± 0,007 g/mol B 43,56 %, N 56,44 %, |
| Propriétés physiques | |
| T° fusion | 2 967 °C[3] |
| Masse volumique | 2,25 g cm−3 (BN hexagonal) 3,45 g cm−3 (BN cubique) |
| Propriétés électroniques | |
| Mobilité électronique | 200 cm2 V−1 s−1) (BN cubique) |
| Propriétés optiques | |
| Indice de réfraction | 1,8 (BN hexagonal) 2,1 (BN cubique) |
| Précautions | |
| SGH[1] | |
| H319, H335, P261, P280, P304+P340, P305+P351+P338, P405 et P501 |
|
| SIMDUT[1] | |
 D2B, |
|
| NFPA 704[1] | |
| Composés apparentés | |
| Autres cations | Nitrure d'aluminium Nitrure de gallium Nitrure d'indium |
| Autres anions | Phosphure de bore Arséniure de bore Antimoniure de bore |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le nitrure de bore est un composé chimique de formule BN. C'est une céramique réfractaire ultradure et semiconductrice. Il est isoélectronique avec le carbone et, comme ce dernier, existe sous plusieurs polymorphes, les plus courants étant le nitrure de bore hexagonal, noté h-BN, analogue au graphite, et le nitrure de bore cubique, noté c-BN, analogue au diamant. Le premier est utilisé comme lubrifiant ainsi que dans certains produits cosmétiques, tandis que le second, qui présente une structure cristalline de type sphalérite, est un peu moins dur que le diamant — le c-BN a une dureté Knoop d'environ 48 GPa, contre 70 à 100 GPa pour le diamant — mais avec une meilleure stabilité chimique et thermique — il conserve sa dureté jusqu'à 1 000 °C quand le diamant perd la sienne dès 700 °C. Il existe également du nitrure de bore amorphe, notée a-BN, analogue au carbone amorphe, et une structure plus rare de type wurtzite, notée w-BN, analogue à la lonsdaléite, qui pourrait être plus dure que le polymorphe c-BN. Le nitrure de bore hexagonal est stable à température ambiante, tandis que le polymorphe cubique ne l'est qu'au-dessus de 1 200 °C, et que w-BN n'est stable qu'à une pression supérieure à 10 GPa.
En raison de leur très grande stabilité thermique et chimique, les céramiques en nitrure de bore sont généralement utilisées comme composants dans les équipements devant fonctionner à température élevée. Le nitrure de bore fait également l'objet de recherches en vue d'applications dans le domaine des nanotechnologies. Il est ainsi possible de produire des nanotubes en nitrure de bore de structure très semblable à celle des nanotubes en carbone mais avec des propriétés très différentes. Par ailleurs, le nitrure de bore hexagonal et cubique présente des propriétés d'absorption des ondes radar[4].
Nitrure de bore amorphe (a-BN)[modifier | modifier le code]
Le nitrure de bore amorphe, noté a-BN, est le polymorphe amorphe analogue au carbone amorphe. Comme ce dernier, il peut présenter localement une régularité relative de ses atomes, mais est dépourvu d'ordre à grande échelle, contrairement à toutes les autres formes de nitrure de bore, qui sont cristallisées.
Production[modifier | modifier le code]
Le nitrure de bore est produit industriellement de manière synthétique et est toujours obtenu en premier lieu sous forme amorphe. On peut ainsi faire réagir du sesquioxyde de bore B2O3 ou de l'acide borique H3BO3 avec de l'ammoniac NH3 ou de l'urée CO(NH2)2 voire de l'hexaborure de calcium B6Ca dans une atmosphère d'azote N2 :
- B2O3 + 2 NH3 ⟶ 2 BN + 3 H2O à 900 °C ;
- B(OH)3 + NH3 ⟶ BN + 3 H2O à 900 °C ;
- B2O3 + CO(NH2)2 ⟶ 2 BN + CO2 + 2 H2O à plus de 1 000 °C ;
- B2O3 + 3 CaB6 + 10 N2 ⟶ 20 BN + 3 CaO à plus de 1 500 °C.
La substance obtenue contient environ 92 à 95 % de nitrure de bore amorphe et de 5 à 8 % de sesquioxyde de bore. Le B2O3 résiduel peut être évaporé par la suite à une température supérieure à 1 500 °C afin d'obtenir des concentrations de nitutre de bore supérieures à 99 %, ce qui a également pour effet d'induire un recuit formant des cristallites dont la taille croît avec la température.
Applications[modifier | modifier le code]
Des couches actives en nitrure de bore amorphe sont utilisées dans certains composants électroniques à semiconducteurs comme des MOSFET. Elles peuvent être obtenues par décomposition chimique de trichloroborazine avec du césium, ou par des méthodes de dépôt chimique en phase vapeur (CVD). Une technologie de CVD thermique peut également être utilisée pour déposer des couches de nitrure de bore hexagonal ou, à température élevée, de nitrure de bore cubique[5].
Nitrure de bore hexagonal (h-BN)[modifier | modifier le code]
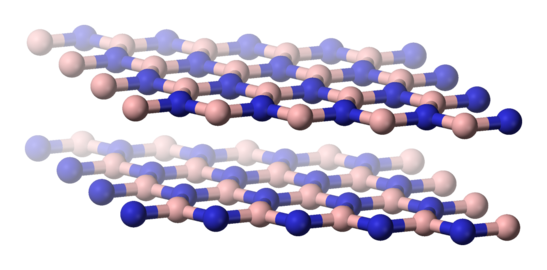
Le nitrure de bore hexagonal, noté h-BN, voire α-BN, est la forme thermodynamiquement stable à température ambiante. Analogue au graphite, il présente une structure cristalline hexagonale (groupe ponctuel D6h, groupe d'espace P63/mmc) en feuillets. Dans chaque feuillet, les atomes de bore et d'azote sont liés par des liaisons covalentes fortes, tandis que les feuillets sont unis entre eux par des forces de van der Waals, qui sont des liaisons faibles, de telle sorte que les atomes de bore d'un feuillet soient situés entre les atomes d'azote des deux feuillets adjacents. Cette structure diffère légèrement de celle du graphite mais demeure suffisamment proche pour que des hybrides BC6N aient pu être produits[6].
-
Structure cristalline du h-BN, analogue au graphite.
Production[modifier | modifier le code]
On obtient le nitrure de bore hexagonal à partir du nitrure de bore amorphe par chauffage induisant un recuit qui cristallise progressivement le matériau. Les pièces en nitrure de bore hexagonal sont fabriquées par pressage à chaud suivi d'un usinage. On utilise des poudres de nitrure de bore avec de l'oxyde de bore pour une meilleure compressibilité. Il est également possible d'obtenir des couches minces en nitrure de bore par dépôt chimique en phase vapeur (CVD) à partir de trichlorure de bore BCl3 et d'azote[7] N2. La combustion de poudres de bore dans un plasma d'azote à 5 500 °C donne une poudre de nitrure de bore ultrafine utilisée dans les lubrifiants et les toners[8].
Applications[modifier | modifier le code]
C'est un bon lubrifiant jusqu'à des températures atteignant 900 °C, et ce même dans un environnement oxydant. Il est particulièrement utile dans les cas où la conductivité électrique ou la réactivité chimique du graphite rend ce dernier impropre à l'utilisation comme lubrifiant alternatif. Comme le nitrure de bore ne requiert pas non plus que des molécules d'eau ou de gaz soient présentes entre les feuillets pour assurer sa fonction de lubrifiant, il peut être utilisé dans le vide, et notamment pour des applications spatiales. Les propriétés lubrifiantes du nitrure de bore hexagonal sous forme de poudre fine sont utilisées dans des cosmétiques, des peintures, des ciments dentaires et des mines de crayon[9].
Les céramiques en nitrure de bore sont généralement utilisées comme composants dans les équipements destinés à fonctionner à température élevée. Le nitrure de bore lui-même peut être incorporé dans des céramiques, mais aussi des alliages, des résines, des plastiques, des élastomères et divers autres matériaux, ce qui leur confère des propriétés lubrifiantes. De tels matériaux sont utilisés en construction mécanique par exemple pour réaliser des paliers et dans la fabrication des aciers. Les matières plastiques chargées en nitrure de bore présentent une dilatation thermique plus faible ainsi qu'une plus grande conductivité thermique et une plus grande résistivité. En raison de ses très bonnes propriétés diélectriques et thermiques, le nitrure de bore est utilisé en électronique comme substrat pour déposer des couches minces semiconductrices ou comme fenêtre transparente aux micro-ondes. Il peut également être utilisé comme diélectrique pour RRAM[10],[11].
Le nitrure de bore hexagonal est utilisé en xérographie et dans les imprimantes laser comme barrière anti-fuite[12]. Dans l'industrie automobile, le nitrure de bore hexagonal est utilisé avec un liant, le sesquioxyde de bore B2O3, pour sceller les sondes lambda, qui permettent d'ajuster le débit d'alimentation en carburant. Des pièces en nitrure de bore hexagonal massif peuvent être réalisées par pressage à chaud à partir de quatre qualités commerciales de h-BN. La qualité HBN contient un liant d'oxyde de bore ; il peut être utilisé jusqu'à 550 à 850 °C sous atmosphère oxydante et jusqu'à 1 600 °C dans le vide, mais est sensible à l'eau en raison de l'oxyde de bore. La qualité HBR utilise un liant borate de calcium et peut être utilisé jusqu'à 1 600 °C. Les qualités HBC et HBT ne contiennent pas de liant et peuvent être utilisées jusqu'à près de 3 000 °C[13].
Le nitrure de bore hexagonal a été utilisé dans les cosmétiques pour la première fois vers 1940 au Japon, mais son prix élevé l'a écarté de ce marché jusque dans les années 1990 à la suite de l'optimisation de ses procédés de production, et, depuis, pratiquement tous les produits cosmétiques haut de gamme en contiennent, qu'il s'agisse de fond de teint, de produit de maquillage, de ligneur, de rouge à lèvres, de fard ou d'autres produits à appliquer sur la peau.
Des nanofeuillets de nitrure de bore hexagonal peuvent être déposés par décomposition catalytique de borazine B3N3H6 à environ 1 100 °C sur des surfaces pouvant atteindre 10 cm2. Comme ils sont très uniformes avec une structure semblable au graphène avec un désaccord de maille d'environ 2 % par rapport à ce matériau, ils peuvent être utilisés comme substrat pour composants à base de graphène[14]. Les nanofeuillets de nitrure de bore sont également de très bons conducteurs de protons (en), en même temps qu'ils sont de très bons isolants électriques, ce qui permet d'envisager de possibles applications dans les piles à combustibles et l'électrolyse de l'eau[15].
Le nitrure de bore hexagonal est utilisé depuis le milieu des années 2000 comme lubrifiant pour balles de fusils de précision comme alternative au disulfure de molybdène, par rapport auquel il présenterait certains avantages.
Nitrure de bore cubique (c-BN)[modifier | modifier le code]
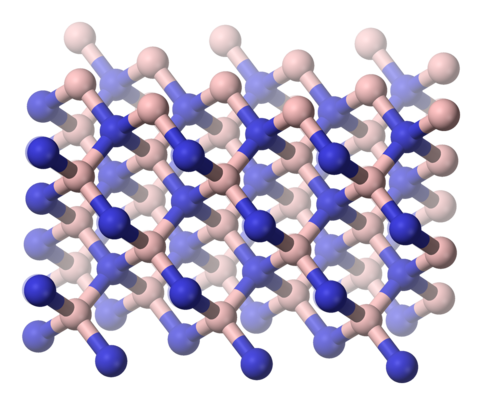
Le nitrure de bore cubique, noté c-BN, voire β-BN, est une forme métastable dont la vitesse conversion en nitrure de bore hexagonal à température ambiante est négligeable. Analogue au diamant — également métastable par rapport au graphite — il présente une structure cristalline cubique de type sphalérite.
-
Structure cristalline du c-BN, analogue au diamant.
Production[modifier | modifier le code]
La synthèse du nitrure de bore cubique suit la même méthode que celle du diamant à partir du graphite. Du nitrure de bore hexagonal est traité à pression et température élevées afin d'induire une transition de phase. Celle-ci a été observée pour le nitrure de bore à des pressions de 5 à 18 GPa et des températures de 1 730 à 3 230 °C, c'est-à-dire des valeurs semblables à celles de la transition entre le graphite et le diamant[16]. L'addition d'une petite quantité de sesquioxyde de bore B2O3 peut réduire la pression et la température requises pour la réaction jusqu'à environ 4 à 7 GPa et 1 500 °C. Comme pour le diamant, il est nécessaire d'ajouter un catalyseur pour réduire davantage la pression et la température de la réaction, par exemple du lithium, du potassium ou du magnésium, leur nitrures, leur fluoronitrures, de l'eau avec des sels d'ammonium NH4+, ou de l'hydrazine N2H4[17],[18]. D'autres méthodes industrielles, également empruntées aux techniques de production de diamants synthétiques, utilisent la croissance de cristaux dans un gradient de température, ou encore font appel à des ondes de choc explosives. La méthode par onde de choc est utilisée pour produire un matériau appelé hétérodiamant, composé ultradur de bore, de carbone et d'oxygène[19].
Il est possible de déposer des couches minces de nitrure de bore cubique mais la principale difficulté consiste à éviter la croissance de phases hexagonales, ce qu'on réalise en ajoutant du trifluorure de bore BF3. Il est également possible d'utiliser des techniques de dépôt par faisceau d'ions (en) (IBD), dépôt chimique en phase vapeur assisté par plasma (PECVD), dépôt laser pulsé (PLD), dépôt par pulvérisation cathodique (en) (sputter deposition), et d'autres méthodes de dépôt physique en phase vapeur (PVD)[7].
Applications[modifier | modifier le code]
Le nitrure de bore cubique est largement utilisé comme abrasif[20]. Son intérêt réside dans le fait que, contrairement au diamant, il n'est pas soluble dans le fer, le nickel et leurs alliages à haute température (le diamant donne des carbures métalliques dans ces conditions). Les abrasifs en c-BN polycristallin sont par conséquent utilisés pour usiner l'acier tandis que les abrasifs en diamant sont plutôt utilisés pour les alliages d'aluminium, les céramiques et les blocs de pierre. Lorsqu'il est en contact avec l'oxygène de l'air, le nitrure de bore forme une couche de passivation en sesquioxyde de bore B2O3. Le nitrure de bore se lie facilement aux métaux en raison de la formation de couches intermédiaires de borures ou de nitrures de métaux. Les matériaux contenant des cristaux de nitrure de bore cubique sont souvent utilisés dans les embouts des outils de coupe. Pour les applications de meulage, on peut utiliser des liants plus doux, comme des résines, des céramiques poreuses ou des métaux mous, voire des liants en céramique. Les dénominations commerciales sont par exemple Borazon (en) (par Diamond Innovations), Elbor ou Cubonite (ces derniers par des fournisseurs russes)[9].
Contrairement au diamant, il est possible de produire de grandes pièces en nitrure de bore cubique par un procédé simple de frittage à partir de poudres de nitrure de bore cubique dans un flux d'azote à une température légèrement inférieure à celle de décomposition du nitrure de bore. La possibilité de faire fondre les poudres de nitrure de bore cubique et hexagonal permet de produire à bas coût de grandes structures en nitrure de bore[9].
La combinaison d'une conductivité thermique et d'une résistivité électrique élevées fait que le nitrure de bore cubique, tout comme le diamant, est idéal pour les distributeurs ou dissipateurs de chaleur.
Composé d’atomes légers, résistant à la fois chimiquement et mécaniquement, le nitrure de bore cubique est un matériau très utilisé pour réaliser des membranes radiographiques : sa faible masse volumique fait que ce matériau n'absorbe qu’une faible partie des rayons X, et ses bonnes propriétés mécaniques permettent de réaliser des membranes très minces qui réduisent encore davantage l'absorption[21].
Nitrure de bore wurtzite (w-BN)[modifier | modifier le code]
Le nitrure de bore wurtzite, noté w-BN, voire γ-BN, est un polymorphe métastable de structure cristalline de type wurtzite (groupe ponctuel C6v, groupe d'espace P63mc), analogue à la lonsdaléite, un polymorphe rare du carbone. Comme c'est le cas dans le nitrure de bore cubique, les atomes de bore et d'azote du w-BN forment des tétraèdres, mais dont la disposition les uns par rapport aux autres forme des angles différents de ceux observés dans le c-BN[4]. De la même manière, ces atomes forment des cycles à six sommets, qui sont tous en configuration chaise dans le c-BN, tandis que les cycles situés entre les feuillets sont en configuration bateau dans le w-BN.
La forme wurtzite est probablement très résistante, la lonsdaléite étant peut-être 58 % plus résistante que le diamant, tandis que le w-BN serait 18 % plus résistant que le diamant, mais cela n'a jamais pu être vérifié expérimentalement en raison de la faible quantité de lonsdaléite et de w-BN disponible[22].
-
Structure cristalline du w-BN, analogue à la lonsdaléite.
Le nitrure de bore wurtzite peut être obtenu à partir de nitrure de bore hexagonal par pression à chaud statique ou par choc dynamique[23]. Les limites de sa stabilité ne sont pas bien établies. La compression du nitrure de bore hexagonal peut donner du nitrure de bore cubique ou wurtzite, mais la forme wurtzite se forme à une température bien moins élevée, environ 1 700 °C[17].
Propriétés[modifier | modifier le code]
La structure partiellement ionique des feuillets de nitrure de bore hexagonal réduit la covalence et la conductivité électrique du matériau mais accroît les interactions entre les feuillets, ce qui rend le h-BN plus dur que le graphite. La faible délocalisation des électrons dans ce matériau est également responsable de son absence de coloration — le h-BN est blanc — et de sa grande largeur de bande interdite. La grande différence de force entre les liaisons covalentes au sein des feuillets hexagonaux et les liaisons faibles entre les feuillets est responsable de l'anisotropie entre le plan des feuillets et la direction qui lui est orthogonale. Ainsi, la dureté, la conductivité électrique et la conductivité thermique du h-BN sont bien plus élevées dans ce plan que perpendiculairement à lui ; a contrario, ces propriétés sont bien plus isotropes et homogènes dans le c-BN et le w-BN.
Le nitrure de bore cubique et wurtzite sont des matériaux très durs, la dureté du c-BN massif étant un peu inférieure à celle du diamant tandis que celle du w-BN serait légèrement supérieure[24]. Le c-BN polycristallin avec des grains de l'ordre de 10 nm ont été mesurés avec une dureté Vickers comparable, voire supérieure, à celle du diamant[25]. Le c-BN surpasse le diamant dans les applications mécaniques exigeantes, comme l'usinage de l'acier, en raison de sa plus grande stabilité thermique et de sa meilleure résistance aux métaux de transition[26]. La conductivité thermique du nitrure de bore est parmi les plus élevées de tous les isolants électriques.
Le nitrure de bore peut être dopé au béryllium (dopage p) ou au bore, au soufre, au silicium (dopage n), voire co-dopé au carbone et à l'azote[27]. Les polymorphes hexagonal et cubique sont tous les deux des semiconducteurs à large bande interdite, correspondant à la région ultraviolette du spectre électromagnétique. Une couche active en h-BN[28],[29] ou en c-BN[30] soumise à une tension électrique émet une lumière ultraviolette dans l'intervalle de 215 à 250 nm, de sorte que ces matériaux peuvent servir à fabriquer des diodes électroluminescentes et des lasers.
On sait peu de choses sur le mode de fusion du nitrure de bore. Il se sublime à 2 973 °C à pression atmosphérique en libérant de l'azote et du bore, mais il fond à pression élevée[31],[32].
| Propriété | a-BN[33],[34],[35] | h-BN[27],[36] | c-BN[27],[36] | w-BN[27],[36] | Graphite[37] | Diamant[36] |
|---|---|---|---|---|---|---|
| Masse volumique / g·cm–3 | 2,28 | ~2,1 | 3,45 | 3,49 | ~2,1 | 3,515 |
| Dureté Knoop / GPa | 10 | 45 | 34 | 100 | ||
| Module d'élasticité isostatique / GPa | 100 | 36,5 | 400 | 400 | 34 | 440 |
| Conductivité thermique / W·m–1·K–1 | 3 | 600 ∥ ; 30 ⟂ | 740 | 200–2 000 ∥ ; 2–800 ⟂ | 600–2 000 | |
| Dilatation thermique / 10–6·K–1 | −2,7 ∥ ; 38 ⟂ | 1,2 | 2,7 | −1,5 ∥ ; 25 ⟂ | 0,8 | |
| Largeur de bande interdite / eV | 5,05 | 5,2 | 6,4 | 4,5–5,5 | 0 | 5,5 |
| Indice de réfraction | 1,7 | 1,8 | 2,1 | 2,05 | 2,4 | |
| Susceptibilité magnétique[38] | −0,48 ∥ ; −17,3 ⟂ | −0,2…−2,7 ∥ ; −20…−28 ⟂ | −1,6 |
Le nitrure de bore hexagonal et cubique, ainsi probablement que la forme wurtzite, présentent une stabilité chimique et thermique remarquables. Ainsi, le nitrure de bore hexagonal est stable par rapport à la décomposition à des températures atteignant 1 000 °C à l'air libre, 1 400 °C dans le vide, et 2 800 °C sous atmosphère inerte. La réactivité chimique des polymorphes hexagonal et cubique sont relativement semblables, et les données correspondant au c-BN sont résumées dans le tableau ci-dessous :
| Substance | Environnement | Comportement | Seuil |
|---|---|---|---|
| Mo | Vide 10 mPa | Réaction | > 1 360 °C |
| Ni | Vide 10 mPa | Mouillage | > 1 360 °C |
| Fe, Ni, Co | Argon | Réaction | 1 400 à 1 500 °C |
| Al | Vide 10 mPa | Mouillage et réaction | > 1 050 °C |
| Si | Vide 1 mPa | Mouillage | > 1 500 °C |
| Cu, Ag, Au, Ga, In, Ge, Sn | Vide 1 mPa | Pas de mouillage | > 1 100 °C |
| B | Pas de mouillage | > 2 200 °C | |
| Al2O3 + B2O3 | Vide 10 mPa | Pas de mouillage | > 1 360 °C |
On observe notamment que, dans l'air ou dans l'oxygène, le nitrure de bore cubique se recouvre d'une couche de passivation en sesquioxyde de bore B2O3 qui bloque l'oxydation jusqu'à environ 1 300 °C. On n'observe aucune conversion vers le polymorphe hexagonal à 1 400 °C. Sous atmosphère d'azote, on observe une certaine conversion en nitrure de bore hexagonal après 12 h à 1 525 °C. Sous vide (à 10−5 Pa), on observe la conversion en nitrure de bore hexagonal dès 1 550 à 1 600 °C[27].
Le nitrure de bore est insoluble dans les acides courants, mais est soluble dans les sels alcalins fondus comme l'hydroxyde de lithium LiOH, l'hydroxyde de potassium KOH, l'hydroxyde de sodium-carbonate de sodium NaOH-Na2CO3, le nitrate de sodium NaNO3, le nitrure de lithium Li3N, le nitrure de magnésium Mg3N2, le nitrure de strontium Sr3N2, le nitrure de baryum Ba3N2 ou le nitrure de lithium et de baryum Li3BN2[27].
Le nitrure de bore réagit avec le monofluorure d'iode IF dans le trichlorofluorométhane CCl3F à −30 °C pour produire, avec un faible rendement, du triiodure d'azote NI3, un explosif de contact très puissant[39]. Le nitrure de bore réagit également avec les nitrures de métaux alcalins et de lanthanides pour former des nitruroborates, comme ci-dessous avec le lithium :
- Li3N + BN → Li3BN2.
La conductivité thermique théorique de nanorubans en nitrure de bore hexagonal (BNNR) peut approcher 1 700 à 2 000 W m−1 K−1, ce qui est du même ordre de grandeur que les valeurs mesurées pour le graphène, et est comparable aux valeurs calculées pour les nanorubans en graphène[40],[41].
Notes et références[modifier | modifier le code]
- « Fiche du composé Boron nitride », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, 90e éd., Taylor & Francis, 2009 (ISBN 978-1-4200-9084-0)
- (en) Martin S. Silberberg, Chemistry: The Molecular Nature of Matter and Change, 5e éd., McGraw-Hill, New York, 2009, p. 483 (ISBN 978-0077216504)
- (en) W. Schmolla, « Positive drift effect of BN-InP enhancement n-channel MISFET », International Journal of Electronics, vol. 58, no 1, , p. 35-41 (DOI 10.1080/00207218508939000, lire en ligne)
- (en) Masayuki Kawaguchi, Shinya Kuroda et Yasuji Muramatsu, « Electronic structure and intercalation chemistry of graphite-like layered material with a composition of BC6N », Journal of Physics and Chemistry of Solids, vol. 69, nos 5-6, , p. 1171-1178 (DOI 10.1016/j.jpcs.2007.10.076, Bibcode 2008JPCS...69.1171K, lire en ligne)
- (en) P. B. Mirkarimi, K. F. McCarty et D. L. Medlin, « Review of advances in cubic boron nitride film synthesis », Materials Science and Engineering: R: Reports, vol. 21, no 2, , p. 47-100 (DOI 10.1016/S0927-796X(97)00009-0, lire en ligne)
- (en) Robert T. Paine et Chaitanya K. Narula, « Synthetic routes to boron nitride », Chemical Reviews, vol. 90, no 1, , p. 73-91 (DOI 10.1021/cr00099a004, lire en ligne)
- (en) Jochen Greim et Karl A. Schwetz, « Boron Carbide, Boron Nitride, and Metal Borides », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a04_295.pub2, lire en ligne)
- (en) Chengbin Pan, Yanfeng Ji, Na Xiao, Fei Hui, Kechao Tang, Yuzheng Guo, Xiaoming Xie, Francesco M. Puglisi, Luca Larcher, Enrique Miranda, Lanlan Jiang, Yuanyuan Shi, Ilia Valov, Paul C. McIntyre, Rainer Waser et Mario Lanza, « Coexistence of Grain‐Boundaries‐Assisted Bipolar and Threshold Resistive Switching in Multilayer Hexagonal Boron Nitride », Advanced Functional Materials, vol. 27, no 10, , article no 1604811 (DOI 10.1002/adfm.201604811, lire en ligne)
- (en) F. M. Puglisi, L. Larcher, C. Pan, N. Xiao, Y. Shi, F. Hui et M. Lanza, « 2D h-BN based RRAM devices », 2016 IEEE International Electron Devices Meeting (IEDM), , p. 34.8.1-34.8.4 (DOI 10.1109/IEDM.2016.7838544, lire en ligne)
- (en) L. B. Schein, « Electrophotography and Development Physics », Physics Today, vol. 42, no 12, , p. 66 (DOI 10.1063/1.2811250, Bibcode 1989PhT....42l..66S, lire en ligne)
- (en) Charles A. Harper, Handbook of Ceramics, Glasses and Diamonds, McGraw-Hill, 2001 (ISBN 978-0070267121)
- (en) Ji-Hoon Park, Jin Cheol Park, Seok Joon Yun, Hyun Kim, Dinh Hoa Luong, Soo Min Kim, Soo Ho Choi, Woochul Yang, Jing Kong, Ki Kang Kim† et Young Hee Lee, « Large-Area Monolayer Hexagonal Boron Nitride on Pt Foil », ACS Nano, vol. 8, no 8, , p. 8520-8528 (PMID 25094030, DOI 10.1021/nn503140y, lire en ligne)
- (en) S. Hu, M. Lozada-Hidalgo, F. C. Wang, A. Mishchenko, F. Schedin, R. R. Nair, E. W. Hill, D. W. Boukhvalov, M. I. Katsnelson, R. A. W. Dryfe, I. V. Grigorieva, H. A. Wu et A. K. Geim, « Proton transport through one-atom-thick crystals », Nature, vol. 516, no 7530, , p. 227-230 (PMID 25470058, DOI 10.1038/nature14015, Bibcode 2014Natur.516..227H, lire en ligne)
- (en) R. H. Wentorf Jr., « Synthesis of the Cubic Form of Boron Nitride », The Journal of Chemical Physics, vol. 34, no 3, , p. 809-812 (DOI 10.1063/1.1731679, Bibcode 1961JChPh..34..809W, lire en ligne)
- (en) Laurence Vel, Gérard Demazeau et Jean Etourneau, « Cubic boron nitride: synthesis, physicochemical properties and applications », Materials Science and Engineering: B, vol. 10, no 2, , p. 149-164 (DOI 10.1016/0921-5107(91)90121-B, lire en ligne)
- (en) Osamu Fukunaga, « Science and technology in the recent development of boron nitride materials », Journal of Physics: Condensed Matter, vol. 14, no 44, , p. 10979-10982 (DOI 10.1088/0953-8984/14/44/413/meta, Bibcode 2002JPCM...1410979F, lire en ligne)
- (en) Tamikuni Komatsu, Miho Samedima, Ternyuki Awano, Yozo Kakadate et Syuzo Fujiwara, « Creation of superhard B–C–N heterodiamond using an advanced shock wave compression technology », Journal of Materials Processing Technology, vol. 85, nos 1-3, , p. 69-73 (DOI 10.1016/S0924-0136(98)00263-5, lire en ligne)
- (en) R. H. Todd, D. K. Allen, K. Dell et L. Alting, Manufacturing Processes Reference Guide, Industrial Press Inc. 1994, p. 43–48 (ISBN 978-0-8311-3049-7)
- (en) M. A. El Khakani et M. Chaker, « Physical properties of the x‐ray membrane materials », Journal of Vacuum Science & Technology B: Microelectronics and Nanometer Structures Processing, Measurement, and Phenomena, vol. 11, no 6, , p. 2930-2937 (DOI 10.1116/1.586563, Bibcode 1993JVSTB..11.2930E, lire en ligne)
- (en) Jessica Griggs, « Diamond no longer nature’s hardest material », sur newscientist.com, New Scientist, (consulté le ).
- (en) T. Sōma, A. Sawaoka et S. Saito, « Characterization of wurtzite type boron nitride synthesized by shock compression », Materials Research Bulletin, vol. 9, no 6, , p. 755-762 (DOI 10.1016/0025-5408(74)90110-X, lire en ligne)
- (en) Zicheng Pan, Hong Sun, Yi Zhang et Changfeng Chen, « Harder than Diamond: Superior Indentation Strength of Wurtzite BN and Lonsdaleite », Physical Review Letters, vol. 102, no 5, , article no 055503 (PMID 19257519, DOI 10.1103/PhysRevLett.102.055503, Bibcode 2009PhRvL.102e5503P, lire en ligne)
- (en) Yongjun Tian, Bo Xu, Dongli Yu, Yanming Ma, Yanbin Wang, Yingbing Jiang, Wentao Hu, Chengchun Tang, Yufei Gao, Kun Luo, Zhisheng Zhao, Li-Min Wang, Bin Wen, Julong He et Zhongyuan Liu, « Ultrahard nanotwinned cubic boron nitride », Nature, vol. 493, no 7432, , p. 385-388 (PMID 23325219, DOI 10.1038/nature11728, Bibcode 2013Natur.493..385T, lire en ligne)
- (en) M. Engler (2007), « Hexagonal Boron Nitride (hBN) – Applications from Metallurgy to Cosmetics », Cfi/Ber, DKG, vol. 84, 2007, p. D25 (ISSN 0173-9913)
- (en) G. Leichtfried et al. (2002), « 13.5 Properties of diamond and cubic boron nitride », P. Beiss et al., Group VIII Advanced Materials and Technologies: Powder Metallurgy Data. Refractory, Hard and Intermetallic Materials, vol. 2A2, Landolt-Börnstein, Springer, Berlin, p. 118–139, DOI 10.1007/b83029 (ISBN 978-3-540-42961-6)
- (en) Yoichi Kubota, Kenji Watanabe, Osamu Tsuda et Takashi Taniguchi, « Deep Ultraviolet Light-Emitting Hexagonal Boron Nitride Synthesized at Atmospheric Pressure », Science, vol. 317, no 5840, , p. 932-934 (PMID 17702939, DOI 10.1126/science.1144216, Bibcode 2007Sci...317..932K, lire en ligne)
- (en) Kenji Watanabe, Takashi Taniguchi et Hisao Kanda, « Direct-bandgap properties and evidence for ultraviolet lasing of hexagonal boron nitride single crystal », Nature Materials, vol. 3, no 6, , p. 404-409 (PMID 15156198, DOI 10.1038/nmat1134, Bibcode 2004NatMa...3..404W, lire en ligne)
- (en) T. Taniguchi, K. Watanabe, S. Koizumi, I. Sakaguchi, T. Sekiguchi et S. Yamaoka, « Ultraviolet light emission from self-organized p–n domains in cubic boron nitride bulk single crystals grown under high pressure », Applied Physics Letters, vol. 81, no 22, , article no 4145 (DOI 10.1063/1.1524295, Bibcode 2002ApPhL..81.4145T, lire en ligne)
- (en) Lloyd H. Dreger, V. V. Dadape et John L. Margrave, « Sublimation and Decomposition Studies on Boron Nitride and Aluminum Nitride », The Journal of Physical Chemistry, vol. 66, no 8, , p. 1556-1559 (DOI 10.1021/j100814a515, lire en ligne)
- (en) R. H. Wentorf Jr., « Cubic Form of Boron Nitride », The Journal of Chemical Physics, vol. 26, no 4, , p. 956-956 (DOI 10.1063/1.1745964, Bibcode 1957JChPh..26..956W, lire en ligne)
- (en) R. Zedlitz, M. Heintze et M. B. Schubert, « Properties of amorphous boron nitride thin films », Journal of Non-Crystalline Solids, vol. 189-200, , p. 403-406 (DOI 10.1016/0022-3093(95)00748-2, Bibcode 1996JNCS..198..403Z, lire en ligne)
- (en) C. H. Henager et W. T. Pawlewicz, « Thermal conductivities of thin, sputtered optical films », Applied Optics, vol. 32, no 1, , p. 91-101 (PMID 20802666, DOI 10.1364/AO.32.000091, Bibcode 1993ApOpt..32...91H, lire en ligne)
- (en) Steffen Weissmantel, Guenter Reisse, BerndKeiper et Steffen Schulze, « Microstructure and mechanical properties of pulsed laser deposited boron nitride films », Diamond and Related Materials, vol. 8, nos 2-5, , p. 377-381 (DOI 10.1016/S0925-9635(98)00394-X, Bibcode 1999DRM.....8..377W, lire en ligne)
- (en) « BN - Boron Nitride », sur ioffe.ru, Institut physico-technique Ioffe (consulté le ).
- (en) P. Delhaes, Graphite and Precursors, CRC Press, 2000 (ISBN 978-9056992286)
- (en) T. P. Crane et B. P. Cowan, « Magnetic relaxation properties of helium-3 adsorbed on hexagonal boron nitride », Physical Review B, vol. 62, no 17, , p. 11359-11362 (DOI 10.1103/PhysRevB.62.11359, Bibcode 2000PhRvB..6211359C, lire en ligne)
- (en) Inis Tornieporth‐Oetting et Thomas Klapötke, « Nitrogen Triiodide », Angewandte Chemie. International Edition, vol. 29, no 6, , p. 677-679 (DOI 10.1002/anie.199006771, lire en ligne)
- (en) Jinghua Lan, Jian-Sheng Wang, Chee Kwan Gan et Sai Kong Chin, « Edge effects on quantum thermal transport in graphene nanoribbons: Tight-binding calculations », Physical Review B, vol. 79, no 11, , article no 115401 (DOI 10.1103/PhysRevB.79.115401, Bibcode 2009PhRvB..79k5401L, lire en ligne)
- (en) Jiuning Hu, Xiulin Ruan et Yong P. Chen, « Thermal Conductivity and Thermal Rectification in Graphene Nanoribbons: A Molecular Dynamics Study », Nano Letters, vol. 9, no 7, , p. 2730-2735 (PMID 19499898, DOI 10.1021/nl901231s, Bibcode 2009NanoL...9.2730H, arXiv 1008.1300, lire en ligne)
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- « Société française de chimie : Le bore et ses dérivés »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- « Diamants-dsd »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- Nitrure de bore cubique (CBN), Technologies Meister Abrasives