« Peste porcine africaine » : différence entre les versions
→Introduction : + vaccin 2019 (section spécifique et réfs à suivre) |
→Notes et références : + vaccination et réfs |
||
| Ligne 184 : | Ligne 184 : | ||
|719<ref name="4 avril" /> |
|719<ref name="4 avril" /> |
||
|} |
|} |
||
== Vaccination == |
|||
Le développement d'un vaccin a été entravé par la complexité génétique du virus de la peste porcine africaine, par un manque de compréhension de son mode d'infection, par l'absence de développement d'anticorps neutralisant le virus, et aussi par des difficultés techniques telles que l'absence de lignées cellulaires stables, si bien qu'aucun vaccin n'était attendu avant 2027. |
|||
En 2017, un sanglier abattu en [[Lettonie]] s'est révélé être porteur du virus sans présenter de symptômes de la maladie. La culture de son sérum a permis de produire un vaccin vivant. Il s'agit d'une souche faiblement virulente : inoculée à des sangliers en captivité, elle n'a entraîné aucun symptôme de la maladie, mais en revanche la production d'anticorps efficaces, non seulement contre cette souche virale mais aussi contre la forme la plus dangereuse. Le vaccin peut être administré oralement (dans des appâts pour ce qui est des animaux sauvages), et il est apparu que des sangliers pouvaient aussi être immunisés après un simple contact avec des sangliers vaccinés. Des études de sécurité et de stabilité génétique doivent encore être conduites avant de généraliser la vaccination aux animaux domestiques et à toutes les zones infectées<ref>{{lien web| langue=en| titre=Vaccine for African swine fever may save our bacon| site=Frontiers. Science News| url=https://blog.frontiersin.org/2019/05/16/veterinary-science-swine-fever-vaccine-boar/?utm_source=em&utm_medium=f-nlt&utm_campaign=eco_fvets_20190500_swine-fever| date=16 mai 2019| consulté le=29 mai 2019}}.</ref>{{,}}<ref>{{article| langue=en| titre=First Oral Vaccination of Eurasian Wild Boar Against African Swine Fever Virus Genotype II| auteur1=Jose A. Barasona| auteur2=Carmina Gallardo| auteur3=Estefanía Cadenas-Fernández| auteur4=Cristina Jurado| auteur5=Belén Rivera| et al.=oui| périodique=Frontiers in Veterinary Science| date=26 avril 2019| doi=10.3389/fvets.2019.00137}}.</ref>. |
|||
== Notes et références == |
== Notes et références == |
||
Version du 29 mai 2019 à 16:56
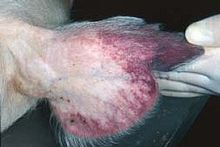
La peste porcine africaine ou PPA (en anglais, african swine fever ou ASF) est une maladie animale qui touche les porcs, mais aussi les sangliers[1], les phacochères, les potamochères et les tiques, qui en sont le vecteur probable. La PPA est endémique dans le milieu naturel en Afrique subsaharienne, avec des cycles d'infection impliquant les tiques (du genre Ornithodoros), les phacochères et les potamochères.
La PPA est une maladie virale, dont l'agent est Asfivirus, un grand virus à ADN double-brin qui se réplique dans le cytoplasme des cellules infectées. Asfivirus et Faustovirus sont les seuls représentants de la famille des Asfarviridae[2]. Asfivirus est le seul virus à ADN transmis par des arthropodes. Attaquant certaines cellules du système immunitaire, il cause des hémorragies mortelles chez les porcs domestiques. Certains isolats sont retrouvés dans tous les organes du porcelet seulement 30 h après l'inoculation[3] et ils peuvent provoquer leur mort en à peine une semaine. Chez toutes les autres espèces et sous-espèces, le virus ne provoque aucune maladie apparente.
Le virus ne menace pas la santé humaine, mais étant hautement mortel pour les cochons et des espèces-gibier, il est source d'importants dégâts socio-économiques. C'est donc une maladie à enjeu vétérinaire et à déclaration obligatoire. Une seule détection faite dans un pays peut justifier des interdictions d'exporter vers d'autres pays.
La PPA est détectée depuis plusieurs décennies en Sardaigne chez des sangliers et des porcs semi-sauvages. Au début des années 2000 pour la première fois des sangliers sont touchés, et en grand nombre, de même que des porcs en Europe de l’Est (Pologne, Lituanie, Lettonie, Estonie, République tchèque, Russie, Biélorussie, Ukraine, Moldavie), faisant craindre qu'ils ne véhiculent le virus vers toute l'Europe, et que des chasseurs et/ou leurs chiens ou des charcuteries contaminées[4],[5] puissent involontairement le transporter[1].
En 2018, une épidémie de peste porcine africaine en Chine aboutit à l'abattage de 20.000 bêtes[6]. Idem en Roumanie où plus d'une centaine de milliers de porcs sont tués durant l'été après la survenue de nombreux foyers d'infection. En septembre 2018, neuf sangliers porteurs du virus sont retrouvés morts en Belgique, dans le sud de la Wallonie[7]. Depuis lors, la maladie progresse en Chine, en Europe de l'Est et en Belgique malgré les moyens mis en œuvre pour tenter de limiter sa propagation.
Aucun vaccin n'étant attendu avant 2027, les chercheurs ont tenté de comprendre pourquoi et comment cette maladie mortelle persiste chez le sanglier et comment limiter si cela est possible la circulation du virus[1]. La découverte sérendipiteuse, en 2017, d'un sanglier immunisé naturellement a cependant permis la distribution en 2019 d'un vaccin administrable oralement, qui semble efficace.
Histoire
Elle a été décrite pour la première fois lorsque des colons européens ont introduit des porcs domestiques dans les régions affectées, ce qui en fait un bon exemple de maladie émergente.
La peste porcine africaine était limitée au continent africain jusqu'en 1957, quand elle a été signalée à Lisbonne, au Portugal. Une autre éruption y a eu lieu en 1960. Après ces introductions, la maladie s'est installée dans la péninsule ibérique et des éruptions sporadiques ont eu lieu en France, en Belgique et dans d'autres pays d'Europe dans les années 1980. L'Espagne et le Portugal ont réussi à éradiquer la maladie au milieu des années 1990 grâce à une politique d'abattage.
La maladie a traversé l'Océan Atlantique et des éruptions ont été signalées dans plusieurs îles des Caraïbes, notamment en République dominicaine. En 1971, le régime cubain a dû faire abattre 500 000 porcs pour éviter une épizootie à l'échelle nationale. Cet épisode a été qualifié d'« événement le plus inquiétant » de 1971 par l'Organisation des Nations unies pour l'alimentation et l'agriculture (FAO). Il a été avancé que le virus avait été introduit dans le pays par des opposants anti-castristes, avec le soutien tacite de membres de la CIA, pour déstabiliser l'économie du pays et encourager l'opposition interne à Fidel Castro. Le virus leur aurait été fourni depuis une base de l'armée américaine de la zone du canal de Panama par un agent américain anonyme[8]. Cependant l'accusation de complot n'est apparue que six ans après les faits, dans le journal Newsday, citant des sources invérifiables[9],[10].
D'importantes épidémies en Afrique sont régulièrement déclarées à l'Organisation mondiale de la santé animale (OIE, ex-Office international des épizooties). La maldie s'étend particulièrement en Afrique depuis la fin des années 1990, mais passe relativement inaperçue[11].

La plus récente épizootie non-africaine s'est déclaré début 2007 en Géorgie. De là elle a gagné l'Arménie, l'Azerbaïdjan, l'Iran et la Russie. Le virus a été signalé en Lituanie en 2014 (1ère apparition dans l'Union européenne) puis s'est répandu dans les États baltes (alors qu'il progressait aussi en Extrême-Orient, décimant de nombreux élevages de porcs). L'été 2017, il était en République tchèque puis en novembre 2017 près de Varsovie en Pologne, inquiétant l'Allemagne et le Danemark deux grands producteurs de porcs. En septembre 2018, 9 cas de sangliers porteurs du virus sont découverts dans le sud de la Belgique en Province de Luxembourg, une zone de confinement de 63.000 hectares de forêts avec interdiction de circuler et de chasser est immédiatement instaurée en accord avec les autorités européennes. [12],[13].
Sous l'égide de l'AFSCA en Europe les mesures sanitaires ont été renforcées, et il est interdit d'importer de la viande de porc ou de sanglier ou des produits de viande de porc ou de sanglier d'un pays ou de zones où sévissent la PPA vers des zones indemnes. Les visites d'exploitations porcines et tout contact avec des porcs dans les 72h suivant le retour d’une zone à risque sont également interdits[14]. La chasse au sanglier n'est pas interdite dans les pays où le virus est endémique, mais dans certains pays (belgique par ex) les chasseurs ne doivent pas utiliser de chien au cours de la chasse et diverses mesures de désinfections et nettoyage sont ensuite obligatoire ;
Symptômes

Les symptômes de la maladie sont très proches de ceux de la peste porcine classique ; Seuls des examens de laboratoire permettent normalement de les distinguer. De plus dans les deux cas, les symptômes cliniques et visuels varient considérablement selon les souches et leurs virulence[1]. De même chez le porc, comme chez le sanglier selon la souche l'animal sera porteur sain (sans maladie apparente) ou pourra mourir en quelques dizaines d'heures.
Les infections aiguës dues à des souches hautement pathogènes du virus conduisent à une présentation clinique évoquant une fièvre hémorragique virale, caractérisée par[1] :
- une déplétion prononcée des tissus lymphoïdes ;
- une apoptose des sous-populations lymphocytaires ;
- une altération de l'hémostase ;
- une dégradation des fonctions immunitaires.
On admet généralement qu'un grande partie des lésions résulte indirectement des effets des cytokines produites par les monocytes et des macrophages infectés, plutôt que des effets directs du virus sur les cellules[1].
Structure du virus et réplication
L'agent de la peste porcine africaine est un grand virus à ADN double-brin (groupe I) possédant un génome d'au moins 150 gènes (le nombre de gènes varie légèrement selon les isolats viraux considérés). Il ressemble aux autres grands virus à ADN comme les poxvirus, les iridovirus et les mimivirus. Comme dans les autres fièvres hémorragiques virales, ses principales cellules-cibles sont celles de la lignée des monocytes et macrophages.
Le virus cause chez les porcs une fièvre hémorragique avec un fort taux de mortalité (souvent proche de 100%), tout en infectant ses hôtes naturels (les phacochères, les potamochères et les tiques du genre Ornithodoros) de manière chronique et sans signe clinique[15].
Le virus code les enzymes nécessaires à la réplication et à la transcription de son génome, notamment les éléments de son système de réparation par excision de base, ses protéines structurelles et beaucoup d'autres qui ne sont pas essentielles à sa réplication, mais jouent un rôle dans sa survie et dans sa transmission.
La réplication du virus a lieu dans les régions entourant le noyau cellulaire. Sa capside icosaédrale est assemblée sur des membranes modifiées du réticulum endoplasmique. Des produits issus de polyprotéines protéolysées forment l'enveloppe entre la membrane interne et le centre nucléoprotéique. Une membrane extérieure supplémentaire est ajoutée à partir de particules de la membrane plasmique. Le virus code des protéines qui inhibent la transmission du signal des macrophages infectés et régulent ainsi l'activation des gènes de la réponse immunitaire. Il code en outre des protéines inhibant l'apoptose (la mort) des cellules infectées, ce qui facilite la production des virions. Des protéines membranaires virales possédant des similitudes avec des protéines d'adhésion cellulaire régulent l'interaction des cellules infectées et des virions extra-cellulaires avec les organes de l'hôte[2].
Génotypes
En 2012, 22 génotypes avaient déjà été identifiés (sur la base des variations de la séquence de la région C-terminale du gène p72[16]). Le génotype VIII est limité à quatre pays d'Afrique orientale.
Épidémies
Europe du Sud à partir de 1960
La maladie touche à partir de 1960 l'Espagne et le Portugal, où elle est finalement éradiquée respectivement en 1995 et 1993[17].
Enzootie en Sardaigne
En Sardaigne, la maladie est une enzootie présente depuis 1978, avec plusieurs pics épizootiques en 1995, 2004, 2005 et depuis 2012[18].
Expansion en Europe de L'Est


La maladie est originaire d'Afrique, et est arrivée en Géorgie en 2007. La souche retrouvée en Géorgie est considérée comme beaucoup plus virulente que les épidémies connues jusqu'alors[19]. De là, elle s'est répandue en Russie, puis dans les Pays baltes à partir de 2014[20]. En 2016, elle frappe, en plus de la Russie et des Pays baltes, l'Ukraine, la Moldavie, la Biélorussie et la Pologne[21]. À l'été 2017, la maladie arrive en Tchéquie, mais est contenue notamment grâce à de nombreux abattages préventifs de porcs et de sangliers[22]. Le , la Hongrie connaît son premier cas, à proximité de la frontière slovaque[23]. La maladie est détectée pour la première fois en Roumanie en juillet 2017[24], et en août 2018, 110 000 porcs y sont abattus préventivement en raison de plusieurs foyers d'épidémie[25]. En Pologne, la maladie progresse vers l'ouest de 3 à 5 kilomètres par mois, et risque d'arriver prochainement en Allemagne[26].
En prévision de l'arrivée de la maladie en Allemagne, le Danemark décide en janvier 2019 la construction d'une palissage le long de sa frontière, afin de se protéger de l'arrivée du virus[27].
Afin de tenter d'enrayer la maladie, la Pologne décide des destructions massives de sangliers[28]. 168 000 bêtes ont ainsi été abattues en 2018, alors que la population était estimée à 210 000 au début de l'année. Des scientifiques et des citoyens s'inquiètent cependant des conséquences négatives d'une quasi-disparition de l'espèce pour l'environnement, d'autant plus que les campagnes d'abattage massives, menées depuis 2014, n'ont pas montré leur efficacité pour lutter contre la propagation de la maladie. Pour un spécialiste du sujet, si les grands élevages de porcs sont aux normes sanitaires, ce n'est pas le cas des petites exploitations polonaises, qui sont un réservoir viral important[29].
Chine et Viêt Nam à partir de 2018
En Chine, pour freiner une épidémie qui a émergé à l'été 2018, 38 000 porcs sont abattus[30]. Le premier foyer d'épidémie est détecté le . Le , les premiers cas dans l'agglomération de Pékin ont été détectés. À cette date, 73 cas dans une vingtaine de provinces ont été signalés pour cette maladie, qui a tué ou nécessité l'abattage préventif de 600 000 porcs[31]. Au début de février 2019, les autorités signalent un ralentissement des contaminations, avec seulement cinq cas recensés en janvier, et les mesures d'isolement sont levées dans plusieurs provinces touchées par le virus[32]. À la mi-février, toutes les provinces étaient touchées, sauf Guangxi, Shandong, Tibet et Xinjiang[33].
Les premiers cas sont détectés au nord du Viêt Nam le , le virus étant probablement originaire de Chine[34]. En avril 2019, on estime à plus d'un million le nombre de porcs abattus en Chine pour contenir la maladie, faisant baisser le cheptel porcin du pays de 15 %[35].
La Chine abattant préventivement une grande quantité de porcs, elle doit en importer massivement pour sa consommation interne, ce qui fait fortement augmenter le prix sur le marché mondial[36].
Belgique à partir de 2018


La peste porcine africaine est détectée sur le cadavre de deux sangliers la première fois en Belgique le 13 septembre[37]. De nouveaux cadavres de sangliers porteurs du virus sont ensuite retrouvés les jours suivants, le bilan étant de 18 au 27 septembre[38]. En réaction, le ministre fédéral de l'agriculture décide l'abattage préventif de tous les porcs dans un périmètre de 630 km2 situé au sud de la province du Luxembourg où tous les sangliers porteurs du virus ont été retrouvés[39]. Cela concerne un élevage de 1 000 animaux, un de 400 et cinq ou six élevages d'une cinquantaine de têtes[40]. De façon préventive, la Chine continentale, la République de Chine (Taïwan), la Corée du Sud, les Philippines et la Biélorussie décident de cesser leurs importations de viande de porc belge[41].
Dans les deux départements français contigus au périmètres concernés, la Meuse et la Meurthe-et-Moselle, une zone d'observation renforcée est mise en place le , concernant 41 communes. Dans celles-ci, tout déplacement et activité forestière, y compris exploitation du bois et chasse, est interdite[42]. De même, le Grand-Duché de Luxembourg a mis en place une zone de surveillance délimitée par les frontières françaises et belges, ainsi que par les autoroutes A4 et A6. Dans cette zone, la chasse reste autorisée, mais les porcs doivent rester confinés[43].
Au 12 octobre 2018, 79 sangliers viropositifs ont été découverts, tous autour des villages de Buzenol, Ethe ou du camp militaire Lagland, à l'ouest d'Arlon. La pose de clôtures visant à isoler les massifs forestiers doit alors commencer le 16 octobre[44].
Le périmètre d'exclusion est subdivisé en une zone noyau où de trouvent l'essentiel des cadavres contaminés, une zone tampon autour, et une zone d'observation renforcée exempte. Au , 155 cadavres de sangliers viropositifs ont été retrouvés, 148 dans la zone noyau et 7 dans la zone tampon[45].
Au , 281 animaux ont été trouvés porteurs du virus, qui progresse vers l'ouest et se rapproche de la frontière française. Une nouvelle clôture doit être installée, au niveau de Meix-devant-Virton, le piégeage et les tirs de nuit mis en place[46]. Du côté français de la frontière, une « zone blanche », dans laquelle tous les sangliers doivent être abattus, est mise en place[47], et l'armée est par la suite appelée pour une aide logistique[48]. Le 9 janvier, deux sangliers sont abattus entre Meix-devant-Virton et Sommethonne, à quelques centaines de mètres de la frontière française, et sont contrôlés positifs au virus après analyse[49].
La maladie progresse également vers l'est, puisqu'un sanglier positif est découvert le à Differt, ce qui laisse craindre une expansion du virus dans le Grand-Duché du Luxembourg tout proche[50]. En réaction, les autorités luxembourgeoises décident d'ouvrir la chasse jusqu'au dans la zone de surveillance, de contrôler systématiquement tout sanglier retrouvé mort et prévoient la pose de nouvelles clôtures[51].
En conséquence, le prix du porc belge s'effondre, passant sous les 0,85 €/kg, ce qui est inférieur au coût de revient[52]. La région wallonne souhaite aider les éleveurs, notamment via des réductions de cotisations sociales. Le ministre fédéral de l'Agriculture, Denis Ducarme, reconnaît le la filière porcine comme « secteur en crise »[53], ce qui permet notamment un assouplissement des cotisations sociales pour les quatre trimestres de 2019.
Par ailleurs, la filière bois est lourdement impactée, puisqu'il est interdit de pénétrer dans la forêt. Les scolytes nuisent aux forêts, aidés par un été 2018 particulièrement sec. Le gouvernement wallon décide de mobilier quatre millions d'euros pour soutenir la filière[54].
Le , le parquet du Luxembourg annonce avoir arrêté quatre personnes, dont un agent du département de la nature et des forêts (DNF), qui doivent être interrogées afin d'éclaircir les circonstances de l'apparition de la maladie en Belgique[55].
À parti du , une partie de la forêt, soit 16 000 ha, est rouverte à la circulation, à condition de rester dans les sentiers, de ne pas laisser divaguer d'animal de compagnie, et de ne pas se rendre dans un exploitation agricole dans les trois jours suivant la visite[56]. Cette décision est critiquée par le syndicat agricole flamand Boerenbond[57], ainsi que par la Fédération wallonne de l'agriculture qui juge cette réouverture prématurée[58].
| Date | Nombre de sangliers (cumul) |
|---|---|
| 18[38] | |
| 28[59] | |
| 32[60] | |
| 70[61] | |
| 79[44] | |
| 104[62] | |
| 155[45] | |
| 161[63] | |
| 167[64] | |
| 181[65] | |
| 184[66] | |
| 205[67] | |
| 281[46] | |
| 345[68] | |
| 389[69] | |
| 406[52] | |
| 439[70] | |
| 494[71] | |
| 573[72] | |
| 619[73] | |
| 687[74] | |
| 694[75] | |
| 708[76] | |
| 719[56] |
Vaccination
Le développement d'un vaccin a été entravé par la complexité génétique du virus de la peste porcine africaine, par un manque de compréhension de son mode d'infection, par l'absence de développement d'anticorps neutralisant le virus, et aussi par des difficultés techniques telles que l'absence de lignées cellulaires stables, si bien qu'aucun vaccin n'était attendu avant 2027.
En 2017, un sanglier abattu en Lettonie s'est révélé être porteur du virus sans présenter de symptômes de la maladie. La culture de son sérum a permis de produire un vaccin vivant. Il s'agit d'une souche faiblement virulente : inoculée à des sangliers en captivité, elle n'a entraîné aucun symptôme de la maladie, mais en revanche la production d'anticorps efficaces, non seulement contre cette souche virale mais aussi contre la forme la plus dangereuse. Le vaccin peut être administré oralement (dans des appâts pour ce qui est des animaux sauvages), et il est apparu que des sangliers pouvaient aussi être immunisés après un simple contact avec des sangliers vaccinés. Des études de sécurité et de stabilité génétique doivent encore être conduites avant de généraliser la vaccination aux animaux domestiques et à toutes les zones infectées[77],[78].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « African swine fever virus » (voir la liste des auteurs).
- Blome S, Gabriel C & Beer M (2013). Pathogenesis of African swine fever in domestic pigs and European wild boar. Virus research, 173(1), 122-130|PDF, 9 pp
- (en) Dixon et al., Animal Viruses: Molecular Biology, Caister Academic Press, (ISBN 978-1-904455-22-6, lire en ligne), « African Swine Fever Virus »
- Colgrove et al. (1969) cités par le rapport scientifique de l'EFSA de 2009
- le virus persiste dans certaines denrées alimentaires à base de produits et/ou viande de porc contaminés (charcuteries notamment) ; source AFSCA [http://www.afsca.be/santeanimale/pesteporcineafricaine/Peste porcine africaine , Fiche consultée 12 mars 2018
- http://www.afsca.be/ppa/actualite/europe/
- « La Chine contrainte d'abattre des milliers de porcs atteints de la peste », FIGARO, (lire en ligne, consulté le )
- « Les 3 nouveaux cas de peste porcine africaine en Belgique ont été confirmés », Le Soir, (lire en ligne, consulté le )
- (en) Howard Zinn, A People's History of the United States, chapitre 20.
- (en) Critical Reviews in Microbiology, 25(3):173–227 (1999)
- (en) Mark Wheelis, A Short History of Biological Warfare and Weapons
- José Manuel Sánchez-Vizcaíno et Lina Mur Gil, « La peste porcine africaine : brève vision du passé, du présent...et du futur? », sur 3trois3.com, (consulté le )
- http://collin.wallonie.be/peste-porcine-africaine-interdiction-de-chasse-sur-63000-hectares-0
- http://www.lalibre.be/actu/belgique/peste-porcine-africaine-voici-ce-qui-serait-la-cause-de-la-contamination-5b9f9dc5cd7076ce3b3aa0a2
- AFSCA [http://www.afsca.be/santeanimale/pesteporcineafricaine/Peste porcine africaine , Fiche consultée 12 mars 2018
- Galindo, Inmaculada; Alonso, Covadonga. 2017. "African Swine Fever Virus: A Review." Viruses 9, no. 5: 103. |résumé
- Leblanc N, Cortey M, Fernandez Pinero J, Gallardo C, Masembe C, Okurut AR, Heath L, van Heerden J, Sánchez-Vizcaino JM, Ståhl K, Belák S (2012) Development of a suspension microarray for the genotyping of African swine fever virus targeting the SNPs in the C-terminal end of the p72 gene region of the Genome. Transbound Emerg Dis doi: 10.1111/j.1865-1682.2012.01359.x.
- Christophe Violette, « Le retour de la peste porcine menace l’Europe », sur Ouest-France, (consulté le )
- Elena Arsevska, « Peste porcine africaine en Sardaigne en 2014 – de l’enzootie à l’épizootie ? », (consulté le )
- Loïc Chauveau, « Comment la peste porcine africaine s'est frayée un chemin jusqu'à la frontière française », sur sciencesetavenir.fr, (consulté le )
- Bruno Poussard, « Alsace: Faut-il s'inquiéter de l'épidémie de peste porcine africaine en Europe de l'Est? », sur 20 minutes, (consulté le )
- Christophe Violette et Romain Su, « Peste porcine. Les sangliers polonais terrorisent les éleveurs en France », sur Ouest-France, (consulté le )
- Alexis Rosenzweig, « Limiter la propagation de la peste porcine: l'exemple de la Tchéquie », sur RTBF, (consulté le )
- « La Hongrie est touchée », sur La France agricole,
- Alizé MERCIER, « Déclaration d’un premier foyer de peste porcine africaine en Roumanie », sur Plateforme ESA, (consulté le )
- AFP, « Peste porcine africaine en Roumanie, plus de 110.000 porcs abattus », sur Europe1, (consulté le )
- Thomas Giraudeau, « Pologne: la peste porcine africaine ravage les élevages », sur RFI, (consulté le )
- Le Figaro et AFP, « Danemark: une palissade à la frontière allemande contre la peste porcine », sur Le Figaro, (consulté le )
- Nelly Didelot, « Les sangliers polonais au bord de la disparition programmée », sur Libération, (consulté le )
- « La Pologne, un "véritable réservoir" pour la peste porcine africaine », sur Ouest-France, (consulté le )
- RTS Info, « L'épidémie de peste porcine s'étend en Chine et menace d'autres pays », Radio télévision suisse, 2 septembre 2018 (page consultée le 2 septembre 2018).
- FRÉDÉRIC SCHAEFFER, « Cette nuit en Asie : la peste porcine africaine aux portes de Pékin », sur Les Échos, (consulté le )
- Gao Ke et Yishuang Liu, « La Chine signale moins de cas de peste porcine africaine », sur Le Quotidien du Peuple, (consulté le )
- Stéphane Lagarde, « Des traces de peste porcine africaine retrouvées dans les raviolis en Chin », sur rfi.fr, (consulté le )
- « Des foyers épidémiques de peste porcine africaine découvertes à Hung Yen et Thai Binh », sur vietnamplus.vn, (consulté le )
- Pierre Demoux, « Ce virus tueur de cochon qui fait trembler le marché mondial du soja », sur Les Echos,
- François Lenglet et Quentin Marchal, « La Chine bouleverse le marché mondial du porc », sur RTL, (consulté le ).
- « Deux cas de peste porcine africaine identifiés à Etalle », (consulté le )
- « Peste porcine africaine : trois nouveaux cas de contamination de sangliers, 18 au total », sur La Libre
- Isabelle Lemaire, « Peste porcine: voici l'arrêté ministériel d'ordre d'abattage des porcs », sur La Libre
- Alizé MERCIER, « Point de situation sur la peste porcine africaine en Belgique », sur plateforme épidémiosurveillance santé animal, (consulté le )
- « Peste porcine africaine : six pays cessent d'importer du porc de Belgique », sur Europe1,
- « Peste porcine africaine – Nouvelles mesures contre la peste porcine dans le nord de la France », sur Metro Belgique, (consulté le )
- Ioanna Schmizzi, « La Grande Région face à la peste porcine africaine », sur paperjam, (consulté le )
- « Peste porcine africaine: la pose de clôtures débutera ce mardi », sur RTBF,
- « Peste porcine africaine: 155 sangliers contrôlés positifs au virus », sur Le Soir, (consulté le )
- Nadia Lallemant, « Peste porcine africaine : une clôture supplémentair », sur dh.be, (consulté le )
- Hugo Septier et AFP, « Peste porcine: création d'une "zone blanche" vide de sangliers à la frontière de la Belgique », sur bfmtv.com, (consulté le )
- AFP, « Peste porcine africaine: l'armée en appui logistique, zone blanche étendue », sur L'Express, (consulté le )
- JP, « Peste porcine africaine: des sangliers infectés pourraient avoir franchi la frontière française », sur RTBF, (consulté le )
- LQ, « Un cas de peste porcine à 3 km de la frontière luxembourgeoise », sur lequotidien.lu, (consulté le ).
- « La chasse restera ouverte jusqu'au 15 avril », sur lessentiel.lu, (consulté le ).
- Jordane Meyer, « Nouveau bilan sur le front de la Peste porcine africaine », sur RTBF, (consulté le )
- Belga, « Suite à la peste porcine, le ministre de l'Agriculture reconnaît la filière porcine comme secteur en crise », sur rtlinfo.be, (consulté le )
- « Peste porcine africaine: 4 millions d’euros pour la filière bois », sur sudinfo.be, (consulté le )
- RTBF, « Quatre personnes privées de liberté pour être auditionnées dans le cadre de la Peste Porcine Africaine », sur RTBF, (consulté le )
- Nicoals Poës, « Peste porcine : une partie de la forêt rouverte », sur dhnet.be, (consulté le ).
- Belga, « Peste porcine africaine: le Boerendond juge «irresponsable et incompréhensible» la réouverture de 16.000 ha », sur sudinfo.be, (consulté le ).
- Belga, « Peste porcine africaine: la réouverture de certains sentiers forestiers inquiète », sur Le Soir, (consulté le ).
- N.L., « Sanglier braconné à Tintigny : il n’était pas infecté ! », sur dhnet.be, (consulté le )
- N.L., « Peste porcine africaine : 32 sangliers contrôlés positifs ! », sur dhnet.be, (consulté le )
- N.L., « Peste porcine africaine : 70 sangliers viropositifs », sur dhnet.be, (consulté le )
- Belga, « Peste porcine africaine: un nouveau bilan mentionne 104 sangliers positifs au virus », sur dhnet.be, (consulté le )
- N.L., « Peste porcine africaine: 161 sangliers viropositifs », sur dhnet.be, (consulté le )
- N.L., « Peste porcine africaine : la zone noyau s’agrandit », sur dhnet.be, (consulté le )
- N.L., « Peste porcine africaine : une "zone de vigilance" s’ajoute aux 63.000 hectares », sur dhnet.be, (consulté le )
- N.L., « Peste porcine africaine : le forfait de 50 euros par sanglier accordé », sur dhnet.be, (consulté le )
- « PPA Belgique : Nombre de sangliers infectés », sur 3trois3, (consulté le )
- « Peste porcine africaine: à ce jour, 345 carcasses de sangliers positives au virus de la peste porcine africaine », sur dhnet.be, (consulté le )
- Belga, « Peste porcine: les chasseurs autorisés à tuer des sangliers en zone tampon », sur RTBF, (consulté le )
- Belga, « Peste porcine africaine: deux sangliers abattus lundi à Habay, une première dans cette commune », sur lavenir.net, (consulté le )
- N.L., « Peste porcine africaine : 494 sangliers viropositifs », sur dhnet.be, (consulté le )
- N.L., « Peste Porcine Africaine : 573 sangliers viropositifs », sur dhnet.be, (consulté le ).
- Belga, « Peste porcine africaine: le nombre de sangliers infectés continue à augmenter », sur lesoir.be, (consulté le )
- « Peste porcine africaine : 687 carcasses se sont révélées viropositives », sur sudinfo.be, (consulté le )
- « Peste porcine africaine: les sentiers en forêt gaumaise bientôt rouverts aux promeneurs », sur RTBF, (consulté le )
- Nadia Lallemant, « Peste porcine africaine : 708 carcasses viropositives », sur dhnet.be, (consulté le )
- (en) « Vaccine for African swine fever may save our bacon », sur Frontiers. Science News, (consulté le ).
- (en) Jose A. Barasona, Carmina Gallardo, Estefanía Cadenas-Fernández, Cristina Jurado, Belén Rivera et al., « First Oral Vaccination of Eurasian Wild Boar Against African Swine Fever Virus Genotype II », Frontiers in Veterinary Science, (DOI 10.3389/fvets.2019.00137).
Voir aussi
Liens externes
- Fiche de la maladie sur le site de l'Office international des épizooties.
- Peste porcine africaine - Fiche de renseignements sur le site de l'Agence canadienne d'inspection des aliments (ACIA).
- (en) Présentation de la maladie sur ThePigSite.com
Législation européenne
- Directive 2002/60/CE du Conseil du 27 juin 2002 établissant des dispositions spécifiques pour la lutte contre la peste porcine africaine et modifiant la directive 92/119/CEE, en ce qui concerne la maladie de Teschen et la peste porcine africaine (J.O. du 20/07/2002)
- Décision 2014/709/EU de la Commission du 9 octobre 2014 concernant des mesures zoosanitaires de lutte contre la peste porcine africaine dans certains États membres (J.O. du 11/10/2014)
- sur le site de la Commission Européenne : http://ec.europa.eu/food/animal/diseases/controlmeasures/asf_en.htm
Bibliographie
do, C.; Nieto-Pelegrin, E.; Rivera-Arroyo, B.; Degefa-Negi, T.; Arias, M.; Jenberie, S.; Mulisa, D.D.; Gizaw, D.; Gelaye, E.; et al. Identification of a new genotype of african swine fever virus in domestic pigs from Ethiopia. Transbound. Emerg. Dis. 2016.
- Alcami, A.; Carrascosa, A.L.; Vinuela, E. Interaction of African swine fever virus with macrophages. Virus Res. 1990, 17, 93–104
- Alcami, A.; Carrascosa, A.L.; Vinuela, E. Saturable binding sites mediate the entry of African swine fever virus into vero cells. Virology 1989, 168, 393–398
- Alcami, A.; Carrascosa, A.L.; Vinuela, E. The entry of African swine fever virus into vero cells. Virology 1989, 171, 68–75.
- Almazan, F.; Rodriguez, J.M.; Andres, G.; Perez, R.; Vinuela, E.; Rodriguez, J.F. Transcriptional analysis of multigene family 110 of african swine fever virus J. Virol. 1992, 66, 6655–6667.
- Alonso, C.; Miskin, J.; Hernaez, B.; Fernandez-Zapatero, P.; Soto, L.; Canto, C.; Rodriguez-Crespo, I.; Dixon, L.; Escribano, J.M. African swine fever virus protein p54 interacts with the microtubular motor complex through direct binding to light-chain dynein. J. Virol. 2001, 75, 9819–9827.
- Anderson, E.C.; Hutchings, G.H.; Mukarati, N.; Wilkinson, P.J. African swine fever virus infection of the bushpig (Potamochoerus porcus) and its significance in the epidemiology of the disease. Vet. Microbiol. 1998, 62, 1–15.
- Andres, G.; Garcia-Escudero, R.; Vinuela, E.; Salas, M.L.; Rodriguez, J.M. African swine fever virus structural protein pE120R is essential for virus transport from assembly sites to plasma membrane but not for infectivity. J. Virol. 2001, 75, 6758–6768.
- Angulo, A.; Vinuela, E.; Alcami, A. Inhibition of African swine fever virus binding and infectivity by purified recombinant virus attachment protein p12. J. Virol. 1993, 67, 5463–5471.
- Ballester, M.; Rodriguez-Carino, C.; Perez, M.; Gallardo, C.; Rodriguez, J.M.; Salas, M.L.; Rodriguez, F. Disruption of nuclear organization during the initial phase of african swine fever virus infection. J. Virol. 2011, 85, 8263–8269.
- Basta, S.; Gerber, H.; Schaub, A.; Summerfield, A.; McCullough, K.C. Cellular processes essential for African swine fever virus to infect and replicate in primary macrophages. Vet. Microbiol. 2010, 140, 9–17.
- Bastos, A.D.; Penrith, M.L.; Cruciere, C.; Edrich, J.L.; Hutchings, G.; Roger, F.; Couacy-Hymann, E.; Thomson, G.R. Genotyping field strains of african swine fever virus by partial p72 gene characterisation. Arch. Virol. 2003, 148, 693–706.
- Benedict, C.A.; Norris, P.S.; Ware, C.F. To kill or be killed: Viral evasion of apoptosis. Nat. Immunol. 2002, 3, 1013–1018.
- Boshoff, C.I.; Bastos, A.D.; Gerber, L.J.; Vosloo, W. Genetic characterisation of african swine fever viruses from outbreaks in southern Africa (1973–1999). Vet. Microbiol. 2007, 121, 45–55.
- Breese, S.S., Jr.; de Boer, C.J. Electron microscope observations of African swine fever virus in tissue culture cells. Virology 1966, 28, 420–428
- Brun, A.; Rivas, C.; Esteban, M.; Escribano, J.M.; Alonso, C. African swine fever virus gene a179l, a viral homologue of BCL-2, protects cells from programmed cell death. Virology 1996, 225, 227–230
- Carvalho, Z.G.; de Matos, A.P.; Rodrigues-Pousada, C. Association of African swine fever virus with the cytoskeleton. Virus Res. 1988, 11, 175–192.
- Chacon, M.R.; Almazan, F.; Nogal, M.L.; Vinuela, E.; Rodriguez, J.F. The African swine fever virus IAP homolog is a late structural polypeptide. Virology 1995, 214, 670–674.
- Cubillos, C.; Gomez-Sebastian, S.; Moreno, N.; Nunez, M.C.; Mulumba-Mfumu, L.K.; Quembo, C.J.; Heath, L.; Etter, E.M.; Jori, F.; Escribano, J.M.; et al. African swine fever virus serodiagnosis: A general review with a focus on the analyses of african serum samples. Virus Res. 2013, 173, 159–167.
- Cuesta-Geijo, M.A.; Chiappi, M.; Galindo, I.; Barrado-Gil, L.; Munoz-Moreno, R.; Carrascosa, J.L.; Alonso, C. Cholesterol flux is required for endosomal progression of african swine fever virions during the initial establishment of infection. J. Virol. 2015, 90, 1534–1543.
- Cuesta-Geijo, M.A.; Galindo, I.; Hernaez, B.; Quetglas, J.I.; Dalmau-Mena, I.; Alonso, C. Endosomal maturation, Rab7 GTPase and phosphoinositides in African swine fever virus entry. PLoS ONE 2012, 7, e48853.
- De Matos, A.P.; Carvalho, Z.G. African swine fever virus interaction with microtubules. Biol. Cell 1993, 78, 229–234.
- Dixon, L.K.; Escribano, J.M.; Martins, C.; Rock, D.L.; Salas, M.L.; Wilkinson, P.J. Asfarviridae. In Virus Taxonomy. VIIIth Report of the ICTV; Fauquet, C.M., Mayo, M.A., Maniloff, J., Desselberger, U., Ball, L.A., Eds.; Elsevier/Academic Press: London, UK, 2005; pp. 135–143
- Fabregas, J.; Garcia, D.; Fernandez-Alonso, M.; Rocha, A.I.; Gomez-Puertas, P.; Escribano, J.M.; Otero, A.; Coll, J.M. In vitro inhibition of the replication of haemorrhagic septicaemia virus (VHSV) and African swine fever virus (ASFV) by extracts from marine microalgae. Antivir. Res. 1999, 44, 67–73.
- Galindo, I.; Cuesta-Geijo, M.A.; Hlavova, K.; Munoz-Moreno, R.; Barrado-Gil, L.; Dominguez, J.; Alonso, C. African swine fever virus infects macrophages, the natural host cells, via clathrin and cholesterol-dependent endocytosis. Virus Res. 2015, 200, 45–55
- Galindo, I.; Hernaez, B.; Berna, J.; Fenoll, J.; Cenis, J.L.; Escribano, J.M.; Alonso, C. Comparative inhibitory activity of the stilbenes resveratrol and oxyresveratrol on african swine fever virus replication. Antivir. Res. 2011, 91, 57–63.
- Galindo, I.; Hernaez, B.; Diaz-Gil, G.; Escribano, J.M.; Alonso, C. A179l, a viral BCL-2 homologue, targets the core BCL-2 apoptotic machinery and its upstream BH3 activators with selective binding restrictions for bid and noxa. Virology 2008, 375, 561–572.
- Galindo, I.; Hernaez, B.; Munoz-Moreno, R.; Cuesta-Geijo, M.A.; Dalmau-Mena, I.; Alonso, C. The ATF6 branch of unfolded protein response and apoptosis are activated to promote African swine fever virus infection. Cell Death Dis. 2012, 3, e341.
- Galindo, Inmaculada; Alonso, Covadonga. 2017. "African Swine Fever Virus: A Review." Viruses 9, no. 5: 103. |résumé
- Garcia-Beato, R.; Salas, M.L.; Vinuela, E.; Salas, J. Role of the host cell nucleus in the replication of African swine fever virus DNA. Virology 1992, 188, 637–649.
- Gomez-Puertas, P.; Rodriguez, F.; Oviedo, J.M.; Brun, A.; Alonso, C.; Escribano, J.M. The african swine fever virus proteins p54 and p30 are involved in two distinct steps of virus attachment and both contribute to the antibody-mediated protective immune response. Virology 1998, 243, 461–471.
- Heath, C.M.; Windsor, M.; Wileman, T. Aggresomes resemble sites specialized for virus assembly. J. Cell Biol. 2001, 153, 449–455.
- Hernaez, B.; Alonso, C. Dynamin and clathrin-dependent endocytosis in African swine fever virus entry. J. Virol. 2010, 84, 2100–2109.
- Hernaez, B.; Cabezas, M.; Munoz-Moreno, R.; Galindo, I.; Cuesta-Geijo, M.A.; Alonso, C. A179l, a new viral Bcl2 homolog targeting Beclin 1 autophagy related protein. Curr. Mol. Med. 2013, 13, 305–316.
- Hernaez, B.; Escribano, J.M.; Alonso, C. Visualization of the African swine fever virus infection in living cells by incorporation into the virus particle of green fluorescent protein-p54 membrane protein chimera. Virology 2006, 350, 1–14.
- Hernaez, B.; Guerra, M.; Salas, M.L.; Andres, G. African swine fever virus undergoes outer envelope disruption, capsid disassembly and inner envelope fusion before core release from multivesicular endosomes. PLoS Pathog. 2016, 12, e1005595.
- Hernaez, B.; Tarrago, T.; Giralt, E.; Escribano, J.M.; Alonso, C. Small peptide inhibitors disrupt a high-affinity interaction between cytoplasmic dynein and a viral cargo protein. J. Virol. 2010, 84, 10792–10801.
- Hurtado, C.; Bustos, M.J.; Sabina, P.; Nogal, M.L.; Granja, A.G.; Gonzalez, M.E.; Gonzalez-Porque, P.; Revilla, Y.; Carrascosa, A.L. Antiviral activity of lauryl gallate against animal viruses. Antivir. Ther. 2008, 13, 909–917.
- Jouvenet, N.; Monaghan, P.; Way, M.; Wileman, T. Transport of african swine fever virus from assembly sites to the plasma membrane is dependent on microtubules and conventional kinesin. J. Virol. 2004, 78, 7990–8001.
- Kleiboeker, S.B.; Scoles, G.A.; Burrage, T.G.; Sur, J. African swine fever virus replication in the midgut epithelium is required for infection of ornithodoros ticks. J. Virol. 1999, 73, 8587–8598.
- Klionsky, D.J. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy 2016, 12, 1–222.
- Lacasta, A.; Ballester, M.; Monteagudo, P.L.; Rodriguez, J.M.; Salas, M.L.; Accensi, F.; Pina-Pedrero, S.; Bensaid, A.; Argilaguet, J.; Lopez-Soria, S.; et al. Expression library immunization can confer protection against lethal challenge with african swine fever virus. J. Virol. 2014, 88, 13322–13332.
- Lozach, P.Y.; Mancini, R.; Bitto, D.; Meier, R.; Oestereich, L.; Overby, A.K.; Pettersson, R.F.; Helenius, A. Entry of bunyaviruses into mammalian cells. Cell Host Microbe 2010, 7, 488–499.
- Montgomery, R.E. On a form of swine fever occurring in british east Africa (Kenya Colony). J. Comp. Pathol. Ther. 1921, 34, 159–191.
- Mottola, C.; Freitas, F.B.; Simoes, M.; Martins, C.; Leitao, A.; Ferreira, F. In vitro antiviral activity of fluoroquinolones against African swine fever virus. Vet. Microbiol. 2013, 165, 86–94.
- Munoz-Moreno, R.; Barrado-Gil, L.; Galindo, I.; Alonso, C. Analysis of HDAC6 and BAG3-aggresome pathways in African swine fever viral factory formation. Viruses 2015, 7, 1823–1831.
- Netherton, C.L.; Parsley, J.C.; Wileman, T. African swine fever virus inhibits induction of the stress-induced proapoptotic transcription factor CHOP/GADD153. J. Virol. 2004, 78, 10825–10828.
- Nogal, M.L.; Gonzalez de Buitrago, G.; Rodriguez, C.; Cubelos, B.; Carrascosa, A.L.; Salas, M.L.; Revilla, Y. African swine fever virus IAP homologue inhibits caspase activation and promotes cell survival in mammalian cells. J. Virol. 2001, 75, 2535–2543.
- O’Donnell, V.; Risatti, G.R.; Holinka, L.G.; Krug, P.W.; Carlson, J.; Velazquez-Salinas, L.; Azzinaro, P.A.; Gladue, D.P.; Borca, M.V. Simultaneous deletion of the 9gl and uk genes from the African swine fever virus georgia 2007 isolate offers increased safety and protection against homologous challenge. J. Virol. 2017, 91, e01760-16.
- OIE-WAHID. World Animal Health Information Database (Wahid) [Database on the Internet]. World Organisation for Animal Health (OIE), 2017. [Cited World Animal Health Information System (WAHIS)]. URL:http://www.Oie.Int/wahis/public.Php?Page=home
- Orvedahl, A.; Alexander, D.; Talloczy, Z.; Sun, Q.; Wei, Y.; Zhang, W.; Burns, D.; Leib, D.A.; Levine, B. HSV-1 ICP34.5 confers neurovirulence by targeting the Beclin 1 autophagy protein. Cell Host Microbe 2007, 1, 23–35.
- Parker, J.; Plowright, W.; Pierce, M.A. The epizootiology of african swine fever in Africa. Vet. Rec. 1969, 85, 668–674.
- Pasqual, G.; Rojek, J.M.; Masin, M.; Chatton, J.Y.; Kunz, S. Old world arenaviruses enter the host cell via the multivesicular body and depend on the endosomal sorting complex required for transport. PLoS Pathog. 2011, 7, e1002232
- Pejsak, Z.; Truszczynski, M.; Niemczuk, K.; Kozak, E.; Markowska-Daniel, I. Epidemiology of african swine fever in Poland since the detection of the first case. Pol. J. Vet. Sci. 2014, 17, 665–672
- Penrith, M.L.; Vosloo, W. Review of african swine fever: Transmission, spread and control. J. S. Afr. Vet. Assoc. 2009, 80, 58–62.
- Popescu, L.; Gaudreault, N.N.; Whitworth, K.M.; Murgia, M.V.; Nietfeld, J.C.; Mileham, A.; Samuel, M.; Wells, K.D.; Prather, R.S.; Rowland, R.R. Genetically edited pigs lacking cd163 show no resistance following infection with the African swine fever virus isolate, georgia 2007/1. Virology 2017, 501, 102–106
- Quetglas, J.I.; Hernaez, B.; Galindo, I.; Munoz-Moreno, R.; Cuesta-Geijo, M.A.; Alonso, C. Small Rho GTPases and cholesterol biosynthetic pathway intermediates in African swine fever virus infection. J. Virol. 2012, 86, 1758–1767.
- Ramiro-Ibanez, F.; Ortega, A.; Brun, A.; Escribano, J.M.; Alonso, C. Apoptosis: A mechanism of cell killing and lymphoid organ impairment during acute african swine fever virus infection. J. Gen. Virol. 1996, 77, 2209–2219.
- Reis, A.L.; Abrams, C.C.; Goatley, L.C.; Netherton, C.; Chapman, D.G.; Sanchez-Cordon, P.; Dixon, L.K. Deletion of African swine fever virus interferon inhibitors from the genome of a virulent isolate reduces virulence in domestic pigs and induces a protective response. Vaccine 2016, 34, 4698–4705.
- Revilla, Y.; Callejo, M.; Rodriguez, J.M.; Culebras, E.; Nogal, M.L.; Salas, M.L.; Vinuela, E.; Fresno, M. Inhibition of nuclear factor kappa b activation by a virus-encoded I kappa b-like protein. J. Biol. Chem. 1998, 273, 5405–5411.
- Rivera, J.; Abrams, C.; Hernaez, B.; Alcazar, A.; Escribano, J.M.; Dixon, L.; Alonso, C. The MyD116 African swine fever virus homologue interacts with the catalytic subunit of protein phosphatase 1 and activates its phosphatase activity. J. Virol. 2007, 81, 2923–2929.
- Rodriguez, C.I.; Nogal, M.L.; Carrascosa, A.L.; Salas, M.L.; Fresno, M.; Revilla, Y. African swine fever virus IAP-like protein induces the activation of nuclear factor kappa B. J. Virol. 2002, 76, 3936–3942.
- Rodriguez, J.M.; Salas, M.L. frican swine fever virus transcription. Virus Res. 2013, 173, 15–28.
- Rodriguez, J.M.; Salas, M.L.; Vinuela, E. Intermediate class of mRNAs in African swine fever virus. J. Virol. 1996, 70, 8584–8589.
- Rojo, G.; Garcia-Beato, R.; Vinuela, E.; Salas, M.L.; Salas, J. Replication of african swine fever virus DNA in infected cells. Virology 1999, 257, 524–536
- Salas, M.L.; Andres, G. African swine fever virus morphogenesis. Virus Res. 2013, 173, 29–41.
- Salas, M.L.; Kuznar, J.; Vinuela, E. Polyadenylation, methylation, and capping of the RNA synthesized in vitro by African swine fever virus. Virology 1981, 113, 484–491.
- Sanchez, E.G.; Quintas, A.; Perez-Nunez, D.; Nogal, M.; Barroso, S.; Carrascosa, A.L.; Revilla, Y. African swine fever virus uses macropinocytosis to enter host cells. PLoS Pathog. 2012, 8, e1002754.
- Sanchez-Torres, C.; Gomez-Puertas, P.; Gomez-del-Moral, M.; Alonso, F.; Escribano, J.M.; Ezquerra, A.; Dominguez, J. Expression of porcine cd163 on monocytes/macrophages correlates with permissiveness to African swine fever infection. Arch. Virol. 2003, 148, 2307–2323
- Schloer, G.M. Polypeptides and structure of African swine fever virus. Virus Res. 1985, 3, 295–310
- Stefanovic, S.; Windsor, M.; Nagata, K.I.; Inagaki, M.; Wileman, T. Vimentin rearrangement during African swine fever virus infection involves retrograde transport along microtubules and phosphorylation of vimentin by calcium calmodulin kinase II. J. Virol. 2005, 79, 11766–11775.
- Stenmark, H. Rab GTPases as coordinators of vesicle traffic. Nat. Rev. Mol. Cell Biol. 2009, 10, 513–525.
- Thomson, G.R.; Gainaru, M.D.; van Dellen, A.F. Experimental infection of warthos (Phacochoerus aethiopicus) with african swine fever virus. Onderstepoort J. Vet. Res. 1980, 47, 19–22.
- Valdeira, M.L.; Geraldes, A. Morphological study on the entry of African swine fever virus into cells. Biol. Cell 1985, 55, 35–40.
- Wozniakowski, G.; Kozak, E.; Kowalczyk, A.; Lyjak, M.; Pomorska-Mol, M.; Niemczuk, K.; Pejsak, Z. Current status of african swine fever virus in a population of wild boar in eastern Poland (2014–2015). Arch. Virol. 2016, 161, 189–195
- Zhang, F.; Moon, A.; Childs, K.; Goodbourn, S.; Dixon, L.K. The African swine fever virus DP71L protein recruits the protein phosphatase 1 catalytic subunit to dephosphorylate eIF2alpha and inhibits chop induction but is dispensable for these activities during virus infection. J. Virol. 2010, 84, 10681–10689.

