Pentaborane
| Pentaborane | |||
| |||
 | |||
| Structure du pentaborane(9) | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | nido-pentaborane(9) | ||
| Synonymes |
pentaborane stable, 2,3:2,5:3,4:4,5-tétra-μH-nido-pentaborane(9) |
||
| No CAS | |||
| No ECHA | 100.039.253 | ||
| No CE | 243-194-4 | ||
| No RTECS | RY8925000 | ||
| ChEBI | 33591 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur âcre[1]. | ||
| Propriétés chimiques | |||
| Formule | B5H9 | ||
| Masse molaire[3] | 63,126 ± 0,036 g/mol H 14,37 %, B 85,63 %, |
||
| Moment dipolaire | 2,13 ± 0,04 D [2] | ||
| Propriétés physiques | |||
| T° fusion | −47 °C[1] | ||
| T° ébullition | 60 °C[1] | ||
| Solubilité | dans l'eau : réaction[1] | ||
| Masse volumique | 0,6 g·cm-3[1] | ||
| T° d'auto-inflammation | ~35 °C[1] | ||
| Point d’éclair | 30 °C[1] (coupelle fermée) | ||
| Limites d’explosivité dans l’air | 0,42–98 %vol[1] | ||
| Pression de vapeur saturante | 22,8 kPa[1] à 20 °C | ||
| Précautions | |||
| SIMDUT[4] | |||
  B2, B6, D1A, D2B, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le pentaborane, également appelé pentaborane stable et pentaborane(9) pour le distinguer du pentaborane(11), est un hydrure de bore de formule chimique B5H9. C'est l'un des boranes les plus courants, bien qu'il soit très réactif. Il se présente sous la forme d'un liquide incolore diamagnétique à l'odeur âcre. En raison de sa très grande réactivité avec l'oxygène, il a été considéré dans les années 1950 en URSS et aux États-Unis comme un ergol prometteur en astronautique, et était alors qualifié de « carburant exotique ». En raison de la couleur verte caractéristique de la flamme produite par la combustion des composés du bore, le pentaborane avait été surnommé « Green Dragon » dans l'industrie américaine.
Structure, synthèse et propriétés
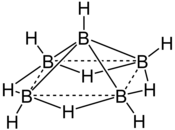
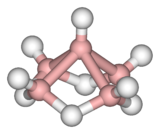
La molécule de pentaborane est constituée de cinq atomes de bore disposés selon un arrangement pyramidal à base carrée. Chaque atome de bore est lié à un ligand hydrure terminal, tandis que quatre ligands hydrure pontants sont liés aux atomes de bore de la base. L'ensemble est qualifié de cage nido, d'où la dénomination IUPAC de nido-pentaborane(9).
Le pentaborane a été préparé pour la première fois par pyrolyse du diborane B2H4 à environ 200 °C[5]. Une meilleure voie de synthèse part de l'anion [B3H8]–, converti en bromure [B3H7Br]– par le bromure d'hydrogène HBr, bromure dont la pyrolyse donne du pentaborane[6] :
Le pentaborane se décompose au-dessus de 150 °C en libérant de l'hydrogène H2, ce qui peut provoquer des surpressions dangereuses si cela se produit dans une enceinte fermée. Il est bien plus stable en présence d'eau que le diborane. Il est soluble dans les hydrocarbures comme le benzène C6H6 et le cyclohexane C6H12, ainsi que dans les graisses, y compris celles utilisées dans les équipements de laboratoire. Sa décomposition lors du stockage demeure limitée, en libérant de l'hydrogène avec un résidu solide.
Réactions
La chimie du pentaborane est variée[7]. L'halogénation donne un dérivé symétrique B5H8X, avec l'halogène sur le sommet de la pyramide, qui peut être isomérisé pour placer l'halogène sur l'un des atomes de bore de la base carrée de la pyramide.
Avec les bases fortes, comme les organolithiens, il peut être déprotoné, et les sels de lithium qui en résultent réagissent avec divers électrophiles pour donner des dérivés substitués.
C'est un acide de Lewis, qui forme des adduits doubles avec deux équivalents de triméthylphosphine P(CH3)3.
Le pentaborane est utilisé pour synthétiser d'autres boranes.
Risques
Les vapeurs de pentaborane sont plus lourdes que l'air et peuvent former des concentrations explosives dès au-dessus de 30 °C. C'est un composé pyrophorique, c'est-à-dire qu'il s'enflamme spontanément au contact de l'air. Il forme facilement des composés explosifs sensibles aux chocs, et réagit violemment avec certaines substances utilisées pour combattre les incendies, notamment l'eau et les halogénoalcanes (et les hydrocarbures halogénés en règle générale). Il est très toxique, et les symptômes d'une intoxication à faible concentration peuvent se manifester jusqu'à 48 heures après l'exposition. Sa toxicité aiguë est comparable à celle de certains agents innervants.
La limite d'exposition fixée aux États-Unis par l'OSHA et le NIOSH est de 0,005 ppm (0,01 mg·m-3) sur une période de huit heures, avec une limite d'exposition à court terme de 0,015 ppm (0,03 mg·m-3)[8]. La toxicité aiguë du pentaborane le rend immédiatement dangereux pour la santé et pour la vie au-delà de 1 ppm[9].
Notes et références
- PENTABORANE, Fiches internationales de sécurité chimique
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Pentaborane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- (en) Alfred Stock, The Hydrides of Boron and Silicon, Cornell University Press, 1933, New York, (ISBN 0-8014-0412-6).
- (en) V. R. Miller, G. E. Ryschkewitsch, D. F. Gaines et N. Keipe, « Pentaborane(9) (B5H9) », Inorganic Syntheses, vol. 15, (DOI 10.1002/9780470132463.ch26, lire en ligne)
- (en) Norman N. Greenwood, Alan Earnshaw, (1997). Chemistry of the Elements, 2e édition, Butterworth-Heinemann, 1997, (ISBN 0-08-037941-9).
- (en) « Pentaborane », sur The National Institute for Occupational Safety and Health (NIOSH), (consulté le ).
- (en) « Pentaborane », sur The National Institute for Occupational Safety and Health (NIOSH), (consulté le ).

