Insuffisance rénale chronique du chat
L’insuffisance rénale chronique du chat (IRC) – préférentiellement appelée maintenant maladie rénale chronique (MRC) – est une maladie irréversible, qui se traduit par une perte progressive des fonctions (insuffisance) des reins. Elle est une des causes principales de décès des chats domestiques âgés.
Introduction
[modifier | modifier le code]Les facteurs déclenchants peuvent être multiples, mais sont toujours difficiles à déterminer au cas par cas. Le plus souvent l'IRC chez les chats fait suite à une inflammation du tissu interstitiel du rein, sans cause identifiée (néphrite interstitielle idiopathique). Les principaux symptômes sont le manque d'appétit, une soif augmentée et une miction plus abondante (polyuro-polydipsie), un abattement, des vomissements et une perte de poids chronique.
La MRC est subdivisée pour les chats en quatre stades principaux, selon la concentration en créatinine dans le plasma sanguin ; c'est la classification IRIS (International Renal Interest Society). Ces stades principaux sont subdivisés en fonction de la concentration en protéines de l’urine et de la pression artérielle. Le traitement repose d'une part sur une modification de l'alimentation (modération du contenu en protéines et en phosphates de la nourriture), d'autre part sur la modulation des mécanismes compensateurs mis en place au niveau du rein et qui participent à la progression de la maladie (lutte contre l'hypertension et l'hyperfiltration glomérulaire) ainsi que le contrôle des facteurs aggravants de la maladie que sont l'hypertension artérielle systémique et la protéinurie. De plus, le traitement s'attachera à diminuer les conséquences de la maladie : troubles de l'équilibre hydro-électrolytique et de l'homéostasie, anémie, syndrome urémique avec troubles digestifs.
Son évolution progressive caractérisée par une phase "pré-clinique" avec une diminution de la fonction rénale n'étant pas détectable par l'examen extérieur, ainsi que l'installation progressive des signes cliniques quand ceux-ci surviennent, est un facteur majeur retardant fréquemment le diagnostic donc la prise en charge si une approche préventive de dépistage de la maladie avec suivi médical régulier ne sont pas mis en place.
Un diagnostic et un traitement précoces sont essentiels et peuvent ralentir la progression de la maladie, améliorer la qualité de vie et ainsi augmenter la durée de survie globale ainsi que la durée de vie sans signes cliniques de l'animal.
Définition
[modifier | modifier le code]L'insuffisance rénale chronique chez le chat, peut être définie comme une altération significative et irréversible du débit de filtration glomérulaire[1].

Bases physiologiques
[modifier | modifier le code]Principales fonctions rénales
[modifier | modifier le code]Le rein est un organe vital doté de multiples fonctions. Il joue un rôle important dans
- l'équilibre des échanges hydrique, électrolytique et acido-basique,
- l'élimination des métabolites toxiques comme l'urée,
- ainsi que la recapture de composés qui ont été excrétés dans l'urine primitive par ultrafiltration dans les glomérules rénaux, comme le glucose, les acides aminés, et les sels minéraux.
- De plus, de nombreuses réactions chimiques ont lieu dans le rein, impliquant des composés produits par l'organisme ou d'origine externe (résidus médicamenteux etc.). Le rein est donc un organe métaboliquement très actif .
- Enfin, le rein synthétise certaines substances à action hormonale, comme la rénine, l'érythropoïétine (EPO) et le calcitriol (forme active de la vitamine D3). C'est pourquoi cet organe a une importance essentielle pour la régulation de la pression artérielle, de l'hématopoïèse, ainsi que de l'équilibre des réserves en calcium et en phosphore, maintenant ainsi la densité osseuse.
Métabolisme protéique chez le chat
[modifier | modifier le code]
En tant que carnivores, les chats sont particulièrement dépendants de l'apport de protéines animales, parce que leur principale source d'énergie est la formation de glucose à partir d'acides aminés (néoglucogenèse), ainsi que l'utilisation des lipides, associée à une capacité existante mais limitée de digestion des amidons.
Les besoins protéiques conséquents, en cas d'apports insuffisants peuvent donc créer une fonte musculaire permettant d'utiliser les acides aminés du tissu musculaire à défaut d'apport alimentaire (situation catabolique)[2],[3]
Les enzymes digestives chez le chat sont adaptées à une alimentation riche en protéines. La viande et les abats contiennent en plus des nutriments essentiels pour le chat comme la vitamine A, la taurine ou l'acide arachidonique[3].
L'alimentation du chat incluant des denrées animales, cela implique un apport conjoint inévitable en phosphore. C'est pourquoi il est difficile d'obtenir une alimentation adaptée à la physiologie du chat, mais permettant parallèlement une réduction du phosphore telle que celle que l'on essaie d'atteindre en médecine humaine pour les diètes rénales de l'homme[4].
Épidémiologie
[modifier | modifier le code]
Prévalence
[modifier | modifier le code]La prévalence globale de la maladie est estimée à 1-3% des chats toutes catégories d'âge confondues. De nombreuses études ont rapporté des prévalences de 50 à plus de 80% des chats de 15 ans ou plus[5].
L'IRC survient donc plus fréquemment chez les vieux chats : plus de 50 % des chats atteints ont 7 ans ou plus[6],[7].
Dans une étude concernant la population féline du Royaume Uni, l'IRC était considérée comme la première cause de décès des chats de plus de 5 ans[8].
Néanmoins la maladie peut apparaître chez de très jeunes animaux notamment en cas de malformation[6] bien que cette situation soit moins fréquente. Une prédisposition raciale pour le maine coon, l'abyssin, le siamois, le bleu russe et le burmese a été démontrée[9].
Difficultés de prise en charge
[modifier | modifier le code]L'insuffisance rénale chronique est l'une des causes de décès les plus fréquentes chez les vieux chats domestiques[10],[11].
Pourtant, chez bien des animaux, la maladie reste méconnue aux yeux du grand public:
- premièrement parce que dans les stades les plus précoces, en raison de la capacité de compensation des reins, les signes cliniques sont souvent absents, et il n'existe pas de tests diagnostiques suffisamment sensibles pour détecter systématiquement la maladie lors de l'apparition des premières lésions rénales[12],[7]. Néanmoins, l'absence de tels marqueurs n'empêche pas un dépistage précoce de la maladie avant l'apparition des signes cliniques [13] dans un certain nombre de cas. L'un des enjeux actuels de la recherche est donc la mise au point de marqueurs précoces de défaillance fonctionnelle, afin de prendre en charge la maladie au plus vite.
- L'IRC, lorsqu'elle produit des signes visibles par les propriétaires, se trouve donc d'ores et déjà à un stade d'évolution avancé.
Ainsi cette maladie, pourtant bien caractérisée et connue des praticiens, est souvent diagnostiquée tardivement, après l'apparition progressive de signes cliniques au long cours, donc quand près des 3/4 de la masse rénale fonctionnelle sont perdus [13].
- De plus en raison d'une médicalisation faible de la population féline adulte comparativement à la population canine (en France 44% des chats contre 77% des chiens)[14], l'absence d'un suivi médical et d'examens réguliers (suivi de poids, examen clinique, bilans sanguins en vue de l'établissement des valeurs de référence) limite la possibilité d'anticipation et de détection la maladie par le biais d'analyses sanguines aux stades asymptomatiques.
- Enfin, pour la même raison l'absence de suivi médical régulier, ne permet pas d'alerter les propriétaires concernant l'apparition de signes cliniques progressifs, insidieux donc pouvant passer inaperçus, ou même être sans importance à leurs yeux.
Par exemple, une perte de poids progressive chez un chat souffrant auparavant d'obésité, et qui n'est pas régulièrement pesé, pourra ne pas être vue, ou même être prise pour une "régulation" de l'appétit.
De même une perte de masse musculaire, avec une ossature plus proéminente pourra être vue comme peu importante, si l'animal est âgé et que son propriétaire pense qu'il est normal d'observer une dégradation de l'état corporel et de certaines fonctions (digestion, émonction etc.).
À ce titre, il est donc très important de favoriser une approche préventive afin de transmettre les connaissances de bonnes pratiques de suivi de la santé du chat, qu'il s'agisse du suivi médical ou de l'observation du chat.
Étiologie
[modifier | modifier le code]Lésions rénales primaires
[modifier | modifier le code]Les déclencheurs d'une IRC sont multiples. Toute maladie ou traumatisme susceptible de créer une lésion irréversible dans le tissu rénal (glomérules, tubules, interstitium, voies urinaires, etc.)[15] est susceptible d'entraîner une IRC à terme.
La lésion rénale primaire la plus fréquente est cependant la néphropathie tubulo-interstitielle chronique, idiopathique, c'est-à-dire une inflammation tubulo-interstitielle, sans que la cause initiale soit déterminée[6].
Les lésions rénales primaires peuvent notamment être :
- Infectieuses: notamment des infections ascendantes (cystite bactérienne) chez des animaux prédisposés (diabète sucré, etc.). Ces infections peuvent aussi être une conséquence d'une IRC
- A médiation immune: En pratique, n'importe quelle infection ou maladie à médiation immune comme un lupus érythémateux peut amener au dépôt de complexes antigène-anticorps sur la lame basale des glomérules rénaux, et ainsi les endommager.
- Liées à des Intoxications: Chez les chats, parmi les toxiques les plus fréquents on peut citer l'éthylène glycol, la mélamine, l'acide cyanhydrique et quelques métaux lourds (cadmium, plomb, mercure). Certains médicaments peuvent aussi avoir une toxicité rénale variable comme l'amphotéricine B, le cholécalciférol, la doxorubicine, les polymyxines, les aminosides, et de nombreux anti-inflammatoires non stéroïdiens dont l'aspirine, ainsi que le paracétamol (plus connu pour sa haute toxicité hépatique chez le chat)[16].
- D'origine tumorale: la plus fréquente étant le lymphome
| Cause | Remarques |
|---|---|
| Lésions des glomérules rénaux | |
| Glomérulonéphrite chronique | Inflammation des glomérules rénaux |
| Glomérulosclérose | Envahissement des glomérules par un tissu fibreux |
| Lésions des tubules rénaux et de l'interstitium | |
| Néphrite interstitielle chronique |
Inflammation interstitielle chronique du rein |
| Pyélonéphrite chronique | Infection du bassinet et du parenchyme rénal |
| Néphrocalcinose | Lésions liées à des dépôts calciques dans le parenchyme rénal à cause d'une hypercalcémie (excès de calcium dans le sang) |
| Néphropathie hypokaliémique | Lésions tubulaires rénales liées à un manque de potassium dans le sang, lui-même secondaire à une cause rénale ou extra-rénale. |
| Néphrite granulomateuse | Inflammation granulomateuse des reins, chez le chat notamment lors de péritonite infectieuse féline |
| Tumeurs rénales | Principalement lymphomes |
| Amyloïdose rénale | Dépôt pathologique de substance amyloide, principalement de type AA, fréquent chez l'abyssin et les races apparentées notamment[17] |
| Polykystose rénale type dominant du chat | Formation héréditaire de kystes chez les persans (gène PKD1) |
| Lésions des voies urinaires | |
| Calculs rénaux ou urétéraux | Formation de calculs rénaux dans la cavité pyélique ou les uretères |
| Hydronéphrose | « Rein en outre » à la suite d'une obstruction urinaire |
| Masse compressive | Kystes, hématomes et autres processus comprimant le rein |
| Migration parasitaire | Infection par Dioctophyma renale, rare sauf en Europe du Sud, Asie et Amérique du Nord |
| Lésions vasculaires | |
| Hypertension artérielle | Augmentation de la pression artérielle systémique |
| Hypertension glomérulaire | Hypertension des artères glomérulaires |
| Coagulation intravasculaire disséminée |
Formation de multiples thrombi au sein des vaisseaux |

Evolution des lésions
[modifier | modifier le code]À la suite des lésions primaires, en raison de mécanismes de compensation et de réparation tissulaire activés par ces lésions, un tissu fibreux se forme progressivement au sein du parenchyme rénal, venant remplacer les néphrons sains par un tissu fibreux non fonctionnel.
D'autre part, les mécanismes de compensation (voir ci-dessous) peuvent à leur tour engendrer d'autres lésions rénales, entretenant un cercle vicieux.
Physiopathologie
[modifier | modifier le code]
La maladie n'est cliniquement visible qu'à un stade avancé, quand plus des deux tiers de la masse rénale initiale sont déjà perdus. Ceci est dû aux mécanismes de compensation et à la capacité de réserve du rein, qui permettent de faire face à une fonction rénale réduite jusqu'à un certain point, et maintiennent l’excrétion des déchets métaboliques[4],[18].
Avec la perte de fonction des néphrons – les unités fonctionnelles de construction du rein – la capacité de filtration des glomérules rénaux (le taux de filtration glomérulaire) diminue, et la capacité à éliminer les déchets également.
De même, les autres fonctions du rein (cf supra) sont touchées en conséquence.
En raison de son métabolisme très important, le rein nécessite un débit sanguin important (permettant l'apport d'O2 pour la production d'énergie sous forme ATP) équivalent à 25% du débit cardiaque, et des mécanismes de régulation permettent de maintenir cet apport constant.
Système Rénine Angiotensine Aldostérone, hyperfiltration, super-néphrons
[modifier | modifier le code]Régulation du débit de perfusion sanguine
[modifier | modifier le code]Le rein élabore les urines par filtration du sang en regard des glomérules. Cette urine primitive passe ensuite par les tubules rénaux et le canal collecteur pour devenir l'urine définitive qui se dirigera vers le bassinet rénal, les uretères, la vessie et l'urètre pour être évacuée.
Les tubules vont sécréter diverses substances dans les urines, et certains composés urinaires qui ont été filtrés ou sécrétés (comme le glucose ou le sodium) seront réabsorbés en plusieurs étapes. L'ensemble de ces transports permet notamment de créer des mouvements d'eau qui finalement permettent de produire une urine définitive, plus concentrée que l'urine primitive sortant du glomérule, du fait que la majorité de l'eau qu'elle contenait après filtration, a été réabsorbée par le rein, et remise en circulation dans le sang.
Le maintien de la pression artérielle est donc essentiel entre autres au processus de filtration et à l'élaboration des urines.
Quand l'apport sanguin du rein diminue
- les cellules juxtaglomérulaires du rein sécrètent la rénine, qui catalyse la conversion de l’angiotensinogène en angiotensine I
- cette dernière est rapidement hydrolysée en angiotensine II sous l’action de l’enzyme de conversion de l’angiotensine (ECA). L’angiotensine II est responsable d’une vasoconstriction de l'artériole glomérulaire efférente et d’une remontée de la pression sanguine dans le glomérule, avec augmentation également des résistances périphériques.
- L'angiotensine II provoque également une augmentation de la sécrétion d’aldostérone. Cette dernière est à l’origine d’une rétention sodée, d’eau et d’une élévation de la pression artérielle systémique.
Rôle de l'angiotensine II
[modifier | modifier le code]Les actions de l’angiotensine II sont sous la dépendance de récepteurs de surface spécifiques, situés sur différents organes cibles, tels que le rein, mais aussi le cœur, le cerveau, les vaisseaux.
Les récepteurs de l’angiotensine II sont classés en deux sous-types : AT1 et AT2.
- L’angiotensine II, via les récepteurs AT1, est responsable de la quasi-totalité des effets périphériques délétères : vasoconstriction, rétention hydrosodée, stimulation de la sécrétion d’aldostérone, remaniements tissulaires.
- Les récepteurs AT2 sont, au contraire, responsables d'effets protecteurs : vasodilatation, natriurèse, inhibition de la croissance cellulaire, apoptose.
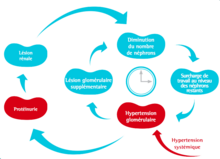
L’angiotensine II, via ses récepteurs AT1, entraîne une hypertension glomérulaire, qui est le principal facteur de progression de la maladie, ainsi qu'une augmentation de perméabilité du filtre glomérulaire. L’hypertension glomérulaire et la perméabilité accrue entraînent une hyperfiltration et une protéinurie, responsable d’une inflammation secondaire des tubules rénaux, qui accentue également la progression de la maladie.

Conséquences
[modifier | modifier le code]L'activation chronique du SRAA: aggravation des lésions primaires
[modifier | modifier le code]À la suite d'une perte de tissu rénal, les néphrons restant déclenchent une activation du SRAA et deviennent des "super-néphrons": ils augmentent leur capacité de filtration, en compensation de la perte d'activité des autres néphrons.
- Hélas, cette hyperfiltration est associée à une hypertension glomérulaire chronique, créant des lésions glomérulaires supplémentaires sur les "super-néphrons" qui conduisent sur le long terme à une perte progressive des derniers néphrons fonctionnels.
- En plus de ces effets hémodynamiques, l’angiotensine II altère la sélectivité du filtre glomérulaire, conduisant à une protéinurie. La stimulation chronique du rein par l’angiotensine II induit la formation de cytokines et chémokines ainsi que des facteurs pro-fibrotiques pro-inflammatoires. Cette situation est aggravée par la sécrétion d’aldostérone.
Accumulation de déchets
[modifier | modifier le code]Une valeur élevée d'urée et de créatinine dans le sang (urémie) indique un défaut du débit de filtration glomérulaire, qui résulte en l'accumulation de déchets (appelés toxines urémiques comme le phosphore notamment) provoquant entre autres des troubles digestifs:
- Ces toxines peuvent stimuler les chémorécepteurs du centre du vomissement.
- une inflammation des vaisseaux (vascularite urémique), est l'un des mécanismes supposés pouvant également conduire à des lésions supplémentaires au tube digestif[19],[20].
- Le rôle de la production d'ammoniaque par les bactéries de la flore digestive dégradant notamment l'urée salivaire est l'un des mécanismes évoqués mais non encore élucidé [21]
Équilibre phospho-calcique
[modifier | modifier le code]L'équilibre phospho-calcique est perturbé par le dysfonctionnement rénal
- L'excès de phosphate, qui n'est plus assez évacué du sang (hyperphosphatémie) et vient complexer le calcium
- la diminution de la production de calcitriol (vitamine D3) dans les tubules proximaux fonctionnels restants, produit également une chute du niveau de calcium dans le sang (hypocalcémie)
- les parathyroïdes sécrètent alors plus de parathormone afin de remonter la calcémie. Une insuffisance rénale chronique conduit dans 84 % des cas à un fonctionnement anormalement élevé des parathyroïdes (hyperparathyroïdie rénale secondaire)[22]. La parathormone entraîne une libération de calcium et de phosphate à partir des os, ce qui conduit à des lésions osseuses, rénales, cardiaques, vasculaires et cutanées. Dans les reins, la calcification contribue à une destruction supplémentaire du tissu rénal. La sensibilité diminuée des parathyroïdes au calcium perturbe la rétroaction de la sécrétion de la parathormone, si bien que malgré l'élévation du niveau de calcium, la parathormone continue à être sécrétée. La filtration diminuée du phosphate et sa baisse dans les tubules rénaux, en raison du taux de filtration diminué, rend peu efficace la diminution de sa réabsorption par les tubules, sous l'effet de la parathormone[22],[23]. La phosphorémie n'est donc que peu diminuée par la parathormone dans ce contexte.
- Il est à noter que chez une proportion non négligeable de patients, au contraire, une hypercalcémie peut être présente. Son mécanisme est encore mal élucidé mais elle ne semble pas être dépendante de la parathormone qui peut être diminuée chez ces animaux, montrant un bon fonctionnement du rétrocontrôle négatif[24].
Bilan hydrique et électrolytique
[modifier | modifier le code]La perte de néphrons et celle liée du nombre de canaux ioniques à sodium conduit à une chute du gradient de concentration des urines dans le rein. Mais cette concentration progressive des urines étant le déclencheur de la réabsorption d'eau dans les tubules distaux et – en présence d'ADH – dans les tubes collecteurs, la conséquence est la perte excessive d'eau par la production d'une urine qui n'est pas assez concentrée, et ainsi une déshydratation, aggravée par les pertes de liquide dues aux vomissements[20]et à la diarrhée.
La dilution excessive des urines est par ailleurs un facteur pouvant favoriser la multiplication d'éventuelles bactéries, donc la survenue d'infections du tractus urinaire, pouvant à leur tour aggraver davantage les lésions d'IRC.
Une conséquence de la capacité diminuée du rein à excréter certains acides organiques ou minéraux, ainsi qu'une perte excessive d'ions bicarbonate est la survenue d'une acidification excessive du sang (acidose métabolique)[9]. Une acidémie métabolique survient chez 80 % des chats insuffisants rénaux chroniques[25].
Hypertension artérielle systémique
[modifier | modifier le code]La diminution de la natriurèse (excrétion de sodium) associée à l'activation du système rénine-angiotensine-aldostérone favorise la rétention hydro-sodée et l'hypertension artérielle systémique. Environ 60% chats affectés d'IRC sont touchés par ce mécanisme[9].
Protéinurie
[modifier | modifier le code]La perméabilisation des glomérules déclenche une perte excessive de protéines dans les urines, qui, outre la perte de masse musculaire, crée une aggravation des lésions rénales, ainsi qu'une perte de l'activité antithrombine III et un risque de formation de thrombi (thrombo-embolie pulmonaire, AVC, coagulation intravasculaire disséminée, etc.).
Baisse de synthèse d'EPO
[modifier | modifier le code]Les lésions rénales limitent la capacité du rein à produire l'érythropoïétine, et engendrent progressivement une diminution de plus en plus sévère de la quantité de globules rouges circulants (anémie). D'autres mécanismes favorisent également la survenue de l'anémie (inflammation chronique, surinfections etc.).
Infections du tractus urinaire
[modifier | modifier le code]Des infections bactériennes sont fréquentes chez les chats insuffisants rénaux. Elles peuvent donc être une cause ou une conséquence de la maladie[1].La présence de bactéries dans les urines est rapportée chez 15-30% des chats, en particulier chez les femelles. La chute de densité urinaire est un facteur prédisposant. D'autre part certains de ces germes, notamment les uréase +, peuvent être responsables d'une alcalinisation urinaire favorisant la formation de calculs, en particulier les phosphates ammoniaco-magnésiens (struvites).

Signes cliniques
[modifier | modifier le code]Les principaux signes cliniques de l'IRC chez le chat, qui peuvent apparaître seuls ou en combinaison suivant le stade de la maladie, sont
- une baisse d'appétit (dysorexie) voire une absence d'appétit (anorexie),
- Une augmentation anormale de la quantité des urines (polyurie),
- une prise de boisson anormalement élevée (polydipsie) par compensation de la polyurie (l'animal boit plus parce qu'il perd plus d'urine, donc plus d'eau)
- un abattement (apathie),
- des vomissements fréquents (souvent plusieurs fois par mois ou par semaine)
- et un amaigrissement avec amyotrophie.
- une déshydratation (avec une perte d'élasticité cutanée parfois très marquée)
- une faiblesse musculaire (notamment en cas d'hypokaliémie, avec un port de tête penché ventralement fréquemment associé) avec tremblements
- une diarrhée,
- Une inflammation de la muqueuse buccale (stomatite) avec formation d'ulcères et hypersalivation (hypersialorrhée)
- une haleine désagréable (halitose).
D'autres anomalies peuvent être présentes en intensité et en nombre variable
- Une pression artérielle élevée (hypertension artérielle systémique) parfois détectable par observation d'hémorragies du fond d'oeil (rétinopathie hypertensive (en)),
- une baisse du nombre de globule rouges sanguins (anémie) qui peut être sévère au point de donner une teinte claire aux muqueuses,
- prurit,
- calcification des tissus mous,
- saignements
- rétention hydrique et sodée (œdèmes)
- Quand l'azotémie atteint un niveau élevé, il peut également y avoir des signes neurologiques, comme la léthargie, des convulsions, un coma[9].
- Hypothermie

Les signes cliniques de l'IRC apparaissent progressivement dans la plupart des cas - contrairement au cas classique de l'insuffisance rénale aiguë - sur plusieurs semaines, mois voire plusieurs années Cette évolution insidieuse peut ainsi très facilement passer inaperçue aux yeux des propriétaires, en particulier si leur animal n'a pas de suivi médical régulier à l'âge adulte, et ainsi fortement retarder le diagnostic et la prise en charge.
Cependant il arrive souvent qu'une insuffisance rénale chronique soit mise en évidence à la suite d'une brusque dégradation des signes cliniques (crise d'Insuffisance Rénale Aiguë-ou IRA- sur fond d'IRC), et devienne ainsi flagrante pour le propriétaire du chat. Ceci est par exemple le cas lorsqu'un calcul vient obstruer l'uretère de l'un des deux reins alors que le second est déjà sévèrement touché, ou quand une hyperthyroïdie commence à être traitée, ce qui abaisse soudain le débit de filtration glomérulaire[6] qui est majoré par l'excès d'hormone thyroïdienne (maladie rénale occulte démasquée par le traitement de l'hypertrhyroïdie)
La palpation rénale peut permettre d'évaluer la taille, la forme et la consistance des reins, toutefois, cet examen, comme l'atteste une étude du JAVMA, ne présente que peu de fiabilité et ne saurait remplacer les examens d'imagerie, en particulier l'échographie [26].
Examens d'imagerie
[modifier | modifier le code]
Radiographie
[modifier | modifier le code]Un examen radiographique peut permettre de détecter des modifications de taille, d'opacité et de position des reins, et mettre en évidence certaines urolithiases : les calculs de struvite sont parfois visibles (phosphate de magnésium et d'ammonium) et les calculs d'oxalate de calcium sont opaques aux rayons X. Des minéralisations des tissus mous peuvent également être observées autre part, notamment en région sous-pleurale. Chez les chats fortement amaigris, ou dans le cas d'épanchement liquidien dans l'espace rétropérinéal, le contraste abdominal peut être diminué. L'urographie intraveineuse peut permettre de visualiser les voies urinaires, par injection d'un produit de contraste (p. ex. iopamidol ou iohexol) dans la circulation sanguine, qui est ensuite excrété par le rein. Cet examen est indiqué notamment pour la recherche d'une obstruction des voies urinaires, par des urolithiases par exemple, et de visualiser une éventuelle distension de la cavité pyélique qui en résulte (hydronéphrose)[27].
Echographie
[modifier | modifier le code]
L'échographie permet de visualiser plus finement l'architecture du parenchyme rénal. Outre les modifications de taille et de forme, on peut détecter des kystes rénaux, des malformations, des lésions inflammatoires ou tumorales, des urolithiases, etc. Néanmoins, si l'échographie peut permettre d'identifier des lésions rénales, elle ne permet pas forcément d'en identifier la cause[27]. Au moyen de l'échographie doppler pulsée, on peut aussi mettre en évidence des anomalies vasculaires[28],[29].
La biopsie rénale n'est pas utilisée en routine, mais peut être indiquée dans certaines circonstances – par exemple chez de jeunes animaux présentant des signes de néphropathie pour détecter une amyloïdose[6] ou une glomérulopathie. La tomodensitométrie et l'IRM permettent toutes deux une très bonne reconnaissance des détails, mais en raison de leur coût élevé et de leur disponibilité limitée, ces dernières ne sont pas employées en routine[27].
Autres examens complémentaires
[modifier | modifier le code]
Analyse d'urine
[modifier | modifier le code]L'analyse d'urine est indispensable en cas d'IRC du chat, et fait presque partie intégrante de l'examen clinique aux yeux du néphrologue. Les urines sont idéalement prélevées par cystocentèse (ponction à la seringue de la vessie à travers la paroi abdominale) afin de ne pas fausser les résultats des examens.
L'analyse d'urine comprend:
- La mesure de la densité urinaire (par réfractométrie le plus souvent)
- La réalisation d'un examen de bandelette urinaire (pour détecter notamment la présence de protéines si la quantité est suffisante pour être détectée, de sang, etc.)
- La réalisation d'un examen cytologique du culot de centrifugation
Il est classiquement considéré qu'une perte de deux tiers de la masse fonctionnelle du rein environ, précède l'apparition d'une chute de la densité urinaire (moins de 1,039 chez le chat), mais ceci reste une simplification[30].
- La perte de protéines par les reins est en général évaluée par une mesure du rapport protéine/créatinine dans l'urine (prélèvement par cystocentèse). Ce rapport, en particulier sa variation, est un bon marqueur de lésion glomérulaire pour le diagnostic précoce d'IRC, et peut parfois permettre de détecter une anomalie fonctionnelle du rein avant l'élévation de la créatininémie[22]. Dans le culot de centrifugation de l'urine, on peut aussi trouver des déchets issus des tubules rénaux (cylindres), des bactéries ou du pus dans les inflammations chroniques bactériennes du bassinet.
- La mise en évidence d'une faible quantité de protéines par électrophorèse (moins de 300 mg/l, microprotéinurie) est très sensible, mais peu spécifique[18].
Biochimie
[modifier | modifier le code]Détection de l'azotémie
[modifier | modifier le code]| Paramètre | Intervalle de référence |
|---|---|
| Créatinine | < 170 µmol/l (< 2 mg/dl) |
| Urée | 5–11 mmol/l (30–65 mg/dl) |
| Phosphate | 0,8–1,9 mmol/l |
| Calcium | 2,3–3 mmol/l |
| Potassium | 3–4,8 mmol/l |
| Sodium | 145–158 mmol/l |
- Dans le sérum sanguin, un excès de substances azotées comme l'urée et la créatinine (appelé urémie ou azotémie) est typiquement détecté. Les phosphates sanguins (hyperphosphatémie) sont fréquemment élevés.
- Plus récemment, un nouveau marqueur, la SDMA (Symetric Dimethyl Arginine), une forme méthylée de l'arginine, présente dans toutes les protéines des cellules nucléées, excrétée dans les urines, et qui, comme la créatinine, est un bon indicateur du débit de filtration glomérulaire[32], mais plus sensible car non-corrélé à la masse musculaire.
Détection des troubles hydro-électrolytiques
[modifier | modifier le code]- Le contenu en potassium sanguin est par contre la plupart du temps abaissé (hypokaliémie), mais peut parfois être augmenté. La concentration sanguine en sodium, est variable en fonction des pertes relatives en eau ou en sodium.
Évaluation de l'équilibre acido-basique
[modifier | modifier le code]- L'ionogramme ainsi que la mesure du pH et des gaz du sang, par les calculs de trou anionique ou du SID (strong ion difference) peut permettre d'évaluer l'équilibre acido-basique.
Recherche d'une hypoprotéinémie associée à la protéinurie
[modifier | modifier le code]- Si la cause de l'insuffisance rénale se situe dans les glomérules, une perte de protéines (hypoprotéinémie) et un excès de cholestérol (hypercholestérolémie par synthèse compensatrice de lipoprotéines transportant le cholestérol en réaction à la perte de protéines sanguines)[19] peuvent se produire.
Autres méthodes d'évaluation du débit de filtration glomérulaire
[modifier | modifier le code]- La méthode la plus sensible pour diagnostiquer le fonctionnement du rein est la détermination directe du taux de filtration glomérulaire par la clairance (biologie), qui est déjà diminuée en cas d'IRC avant d'en arriver à une azotémie. Une substance exclusivement éliminée par le rein est injectée dans la circulation sanguine, et la concentration dans le sang est mesurée plusieurs fois au cours du temps. Pour les chats, on peut utiliser diverses substances, comme l'iohexol.
Hématologie
[modifier | modifier le code]- Dans une IRC avancée, l'hémogramme démontre fréquemment une diminution du nombre d'érythrocytes, et donc de l'hématocrite, sans changement de la charge en hémoglobine, ni de la taille des érythrocytes, mais sans signe de formation de nouvelles cellules (anémie normochrome, normocytaire, arégénérative)[19].
- Par ailleurs des signes d'inflammation peuvent être détectés à l'hémogramme
Stades de l'IRC
[modifier | modifier le code]L'IRC du chat a été graduée par l’International Renal Interest Society (IRIS), et adaptée par la Société européenne de néphrologie et urologie vétérinaire en quatre stades principaux, où la concentration de créatinine plasmatique est le critère principal.
Cette évaluation n'est pratiquée que sur un animal cliniquement stable et non sur un animal en crise d'insuffisance rénale aiguë.
En outre, on définit des sous-stades selon le quotient protéine/créatinine dans l’urine ainsi que la tension artérielle[18],[33]. La concentration de créatinine dans le plasma doit être mesurée au moins deux fois à un intervalle d'une à deux semaines, le quotient protéine/créatinine dans l'urine deux ou trois fois au cours de deux à quatre semaines[34]. L'évaluation du stade du patient n'est pas figée: le stade doit être régulièrement réévalué à chaque suivi.
| Stade | Concentration de créatinine dans le plasma | Remarques |
|---|---|---|
| I | < 140 µmol/l (1,6 mg/dl) | Absence d'azotémie, autres anomalies possiblement détectables (densité urinaire faible, augmentation progressive de la créatininémie, modification d'architecture rénale en imagerie, urolithiases, protéinurie, SDMA>14µmol/l) |
| II | 140–248 µmol/l (1,6–2,8 mg/dl) | Faible azotémie, signes cliniques faibles à absents |
| III | 250–442 µmol/l (2,9–5 mg/dl) | Azotémie moyenne, signes cliniques évidents, fonction rénale résiduelle environ 25 % |
| IV | > 442 µmol/l (5 mg/dl) | Forte azotémie, signes cliniques nombreux et/ou marqués, fonction rénale résiduelle < 10 % |
| Sous-stade | Ratio protéine/créatinine urinaire (RPCU) | Remarques |
|---|---|---|
| a | < 0,2 | Non protéinurique |
| b | 0,2–0,4 | Possible protéinurie ("borderline proteinuric") |
| c | > 0,4 | Perte de protéine dans l'urine (Protéinurie) |
| Sous-stade | Pression artérielle systolique |
Remarques |
|---|---|---|
| 1 | < 150 | Pression artérielle normale |
| 2 | 150–159 | Pré-hypertension |
| 3 | 160-179 mmHg | Hypertension |
| 4 | > 180 | Hypertension sévère |
Récemment, il a été proposé d'intégrer le marqueur SDMA au système de stade[32]ce marqueur pouvant être plus sensible que la créatinine
| Stade | Remarques | |
|---|---|---|
| 1 | < 14 μg/L | Pas de preuve de fonction rénale réduite |
| 2 | 14-24 μg/L | Chez un animal non classé comme IRC, suggère une possible lésion rénale, donc un stade IRIS I |
| 3 | 25-44 μg/L | Si le patient est classé comme IRIS II mais avec un mauvais état corporel, ce dernier peut être classé en IRIS III |
| 4 | > 45 μg/L | Si le patient est classé comme IRIS III mais avec un mauvais état corporel, ce dernier peut être classé en IRIS IV |
Diagnostic différentiel
[modifier | modifier le code]Le diagnostic de l'IRC est relativement aisé lorsque des signes cliniques sont présents. Cette étape ne pose en général pas de difficulté.
En outre, devant toute crise d'insuffisance rénale aiguë, la question de savoir s'il existe une IRC sous-jacente dont la crise serait une manifestation, est posée. L'un des enjeux du diagnostic est donc de faire la part des choses entre insuffisance rénale aiguë et/ou chronique.
Les signes cliniques (cf supra) permettent très souvent de faire la différence, car dans la plupart des cas d'IRC, ils sont apparus au fur et à mesure. Même s'ils n'ont pas été considérés comme importants par le propriétaire (vomissements fréquents, amaigrissement etc.) ils sont néanmoins facilement remarqués. Les examens complémentaires (cf supra) permettent ensuite aisément de confirmer ou infirmer les hypothèses.
S'il n'existe pas d'IRC, d'autres maladies peuvent causer une insuffisance rénale aiguë (IRA). Ces causes sont fréquemment subdivisées en causes dites pré-rénales (causes de modification de perfusion sanguine rénale), rénales ou post-rénales (obstacle à l'écoulement de l'urine)
Parmi les causes pré-rénales on peut citer, le choc hypovolémique, ou le choc septique.
Les intoxications diverses font partie des causes rénales d'IRA
Dans les causes post-rénales d'IRA, on retrouve, outre l'obstruction des canaux urinaires par des calculs ou des tumeurs, des ruptures de la vessie, des uretères ou de l'urètre[31].
Traitement
[modifier | modifier le code]Principes généraux
[modifier | modifier le code]L'IRC étant irréversible l'objectif du traitement à défaut de pouvoir restaurer l'intégralité de la fonction rénale, est de ralentir l'évolution de la maladie en offrant des conditions de vie compatibles avec le bien être de l'animal.
Le but est donc de diagnostiquer l'IRC au stade le plus précoce, tant que le rein a encore assez de capacité de réserve, et d'administrer des traitements visant à l'empêcher de mettre en place ses mécanismes délétères de compensation.
Simultanément, on essaie par des mesures diététiques en amont de diminuer les déchets que le rein devra éliminer – avant tout les composés azotés et les phosphates.
Quand la maladie provoquera des signes cliniques comme des crises d'insuffisance rénale aiguë, ces derniers seront alors traités au cas par cas.
Traitement étiologique: Modulation du Système rénine angiotensine aldostérone
[modifier | modifier le code]Le fonctionnement du système Rénine-Angiotensine-Aldostérone (SRAA) joue un rôle décisif dans la régulation de la pression sanguine, du volume des fluides corporels et dans les équilibres électrolytiques.
Les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA)
[modifier | modifier le code]Les inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) inhibent la conversion de l’angiotensine I en angiotensine II, bloquant ainsi ses effets, tant délétères que protecteurs.
Il existe cependant des voies alternatives de synthèse d’angiotensine II, comme la voie des chymases, qui limitent l’efficacité au long-terme des IECA : on parle d’échappement à l’ECA. Ces voies sont particulièrement actives chez le chat, ce qui explique peut-être le faible effet anti-hypertenseur de cette classe thérapeutique dans cette espèce, contrairement à ce qu'on observe chez l'homme.
Néanmoins, les IECA, permettent également de limiter la protéinurie en s'opposant à l'hypertension glomérulaire, qui est délétère pour les reins. Ainsi leur utilisation reste indiquée en cas d'IRC avec protéinurie, même s'ils ne permettent pas totalement de contrôler la pression artérielle systémique.
Le bénazépril par exemple (Fortekor®, Novartis – Benefortin®, Boehringer Ingelheim – Nelio®, Sogeval) est un IECA ayant une AMM pour le traitement de la MRC du chat protéinurique.
Les antagonistes des récepteurs de l’angiotensine
[modifier | modifier le code]Les sartans (antagonistes des récepteurs de type 1 de l’angiotensine II, aussi appelés AT1RA = angiotensin Type-1 receptor Antagonist, ou ARB = Angiotensin receptor Blocker) entraînent également un blocage sélectif des récepteurs AT1 de l’angiotensine II : ils permettent ainsi de limiter les effets délétères médiés par le récepteur AT1, sans bloquer les effets bénéfiques liés au récepteur AT2. Ils sont donc plus sélectifs que les IECA.
Ils ne sont pas affectés par l’échappement à l’ECA non plus.
Le telmisartan (Semintra®, Boehringer Ingelheim), est un antagoniste spécifique des récepteurs AT1 de l’angiotensine, qui présente vis-à-vis de ceux-ci une très forte affinité sélective ; la fixation du telmisartan aux récepteurs AT1 est de longue durée, et la molécule ne possède aucune action agoniste sur ces derniers. Le telmisartan dispose d'un effet anti-hypertenseur possiblement plus efficace que le bénazépril [1]
Substitution ou soutien de la fonction rénale
[modifier | modifier le code]Transplantation rénale
[modifier | modifier le code]La transplantation rénale, bien que pratiquée depuis de nombreuses années chez le chat contrairement au chien, n'est possible que dans un faible nombre d'hôpitaux vétérinaires, avec diverses implications éthiques et financières. L'indication la plus fréquente est une insuffisance rénale chronique décompensée à un stade précoce, qui ne répond pas au traitement conventionnel sur certains points (hématopoièse, maintien de la note d'état corporel), l'absence d'autres maladies graves (myocardiopathie, hyperthyroïdie,infection des voies urinaires chronique, etc.), ainsi que des tests négatifs pour certaines maladies infectieuses comme la leucose féline ou l'immunodéficience féline[35].
Dialyse
[modifier | modifier le code]Les protocoles de dialyse[36], bien qu'étant de plus en plus disponibles en médecine vétérinaire, sont encore peu fréquemment pratiqués notamment en raison de leur coût.
Traitement des complications
[modifier | modifier le code]Traitement des crises d'IRA
[modifier | modifier le code]Lorsque les signes cliniques de la maladie se manifestent, des épisodes d'insuffisance rénale aiguë peuvent survenir, caractérisés par une dégradation brutale de la fonction rénale, et par une aggravation brutale de l'état général.
Le but est alors de tenter de restaurer la fonction rénale, autant que possible compte tenu du tissu irréversiblement lésé. Une fluidothérapie intraveineuse fait partie des mesures de première intention: les fluides ont traditionnellement été administrés de façon à provoquer une hypervolémie modérée et de restaurer le débit de filtration glomérulaire mais il n'est pas démontré qu'une surcharge volémique induise systématiquement une amélioration de la diurèse[37].
D'autres mesures visant à améliorer la filtration glomérulaire et la diurèse peuvent être effectués (furosémide, mannitol) en fonction des émissions d'urine: si les reins ne produisent pas d'urine (anurie) ou en produisent trop peu (oligurique), les fluides risquent de provoquer une surcharge hydrique, notamment un œdème pulmonaire.
L'espèce féline étant particulièrement vulnérable à la surcharge hydrique, des pompes à perfusion sont couramment utilisées afin de contrôler la vitesse d'administration.
Les protocoles de rétablissement de la diurèse font donc l'objet d'une surveillance stricte (pesée de l'animal, mesure des fluides entrants et sortants, vérification de l'absence d'obstruction des voies urinaires). Si nécessaire, un sondage urinaire à demeure peut être effectué[37].
Traitement de la déshydratation
[modifier | modifier le code]
Pour lutter contre la déshydratation, diverses mesures favorisant la prise de boisson (alimentation humide, appétente, fontaine à eau), et limitant les pertes hydriques (maintien d'une température adéquate lors des épisodes de chaleur, traitement des vomissements et de la diarrhée, ou des inflammations du bas appareil urinaire). Si ces mesures n’aboutissent pas, à partir du stade III, l'utilisation de protocoles de réhydratation via une administration de solutés cristalloïdes, le plus souvent isotoniques initialement, par voie intraveineuse peut être indiqué[38]. Néanmoins, dans certaines situations, l'administration contrôlée par voie sous-cutanée, peut être envisagée.
Traitement de l'acidémie métabolique et des troubles électrolytiques
[modifier | modifier le code]Le contenu en bicarbonates devrait dans l’idéal se situer entre 17 et 22 mEq/l. En cas d'acidémie, le traitement de cette dernière permet en général de restaurer la concentration en bicarbonates.
Si nécessaire, on administre du bicarbonate de sodium ou du citrate de potassium, ce dernier pouvant combler simultanément un manque de potassium. Une alimentation riche en potassium et en magnésium est recommandée[25] ce qui est le cas de la plupart des aliments thérapeutiques destinés aux chats souffrant d'IRC. On peut aussi utiliser le gluconate de potassium pour compenser un déficit en potassium (K for cat ND). Le chlorure de potassium n'est pas recommandé en raison de son effet acidifiant par apport excessif de chlorures. Toutefois, moins fréquemment une hyperkaliémie est possible et la kaliémie fait partie des paramètres fréquemment réévalués[34].
En cas d'acidémie, l'hospitalisation et la fluidothérapie sont fréquemment utilisée pour rétablir le pH et l'équilibre hydro-électrolytique.
Traitement de l'hypertension artérielle systémique
[modifier | modifier le code]
Plus de 60 % des chats malades des reins développent une hypertension artérielle systémique. Son diagnostic nécessite souvent plusieurs mesures en clinique, en raison de perturbations liées au stress chez le chat, susceptibles de faire faussement augmenter la pression artérielle lors de l'examen (effet "blouse blanche")[39].
Pour le traitement, l'amlodipine (AMODIP ND) fait partie des molécules les plus utilisées[40]. Si l'effet de diminution de la tension artérielle de ces médicaments ne suffit pas, on peut donner en plus un inhibiteur de l'enzyme de conversion, comme le benazepril, l'énalapril ou le ramipril. La seule administration d'un inhibiteur de l'enzyme de conversion ne conduit pas en général à une diminution suffisante de la tension artérielle, mais peut, jusqu'au stade III, ralentir l'évolution de la maladie[41]. Au stade IV, ces médicaments sont contre-indiqués de façon relative (risque d'hypotensions brutales)[6]. L'utilité d'une alimentation à faible teneur en sodium selon les recommandations du NRC, afin de réduire les risques d'hypertension artérielle[9]n'a pas été démontrée avec certitude, aucun lien avéré n'étant pour l'heure établi entre une alimentation hypersodée et des effets délétères sur la fonction rénale du chat âgé. En outre, en raison de la stimulation de la prise de boisson liée à une alimentation hypersodée, cette dernière est susceptible de limiter le risque de développement de calculs vésicaux, urétéraux ou rénaux d'oxalates de calcium, par la dilution des urines qui en résulte [42].
Traitement de l'anémie
[modifier | modifier le code]Pour combattre l’anémie,l'alimentation peut être supplémentée en fer, sous forme de composés organiques, ou de sulfate de fer (moins bien absorbé et moins bien toléré). Une administration par injections espacées est également possible. En dessous d'un certain seuil d'hématocrite des protocoles de transfusions sanguines de sang autologue ou hétérologue à défaut de donneur félin compatible, ou l'administration d'autres produits tels que l'oxyglobine, peuvent être nécessaires[43]. L'utilité des stéroïdes anabolisants (nandrolone, stanozolol) dans l'augmentation de l'hématopoièse n'a pas été démontrée, bénéfice qui semble très inférieur, en revanche, au risque de lésion hépatique induite . L'EPO recombinante humaine peut être indiquée pour un hématocrite inférieur à 20 %. Ce traitement est néanmoins coûteux et environ un tiers des chats développent des anticorps contre cette substance, ce qui conduit à une anémie qu'on ne peut plus traiter par ce biais[40]. Avec la darbépoétine alpha, le risque de formation d'anticorps est significativement plus faible, sa demi-vie plasmatique est plus longue et son action est plus puissante[34].
D'autres suppléments peuvent également être ajoutés au traitement sous forme de composés vitaminiques (Fercobsang ND), utiles à l'hématopoièse (vitamine B6, vitamine B12, etc.) en particulier chez les patients polyuriques, mais leur impact reste limité.
Traitement des troubles digestifs
[modifier | modifier le code]Pour limiter les conséquences secondaires de l'azotémie sur le tube digestif
- des anti-émétiques comme le métoclopramide (EMEPRID ND), le citrate de maropitant (CERENIA ND), l'odansétron ou le dolasétron, sont fréquemment utilisés, ainsi que des anti-acides comme la ranitidine ou l'oméprazole
- des pansements gastriques permettant de couvrir et protéger la muqueuse stomacale comme le sucralfate, ou des pansements intestinaux protégeant la muqueuse intestinale comme le phosphate d'aluminium (PHOSPHALUVET ND) ou la diosmectite (SMECTA ND) sont employés.
Le traitement des troubles digestifs, outre le confort qu'il apporte à l'animal en limitant la douleur ressentie à la suite des lésions digestives (ulcères, gastrite, entérite, œsophagite, stomatite, etc.) et aux contractions liées aux vomissements et à la diarrhée, permet de maintenir plus facilement la prise alimentaire ainsi que la prise de boisson, donc de limiter l'amaigrissement ainsi que les risques de déshydratation, chez des patients dont le rein remplit difficilement son rôle de maintien de l'équilibre hydro-électrolytique.
Le traitement de ces troubles est également nécessaire pour garantir une bonne observance vis-à-vis des autres traitements (un animal qui vomit tous ses traitements avant leur effet pourra difficilement en bénéficier).
Gestion des déséquilibres phospho-calciques
[modifier | modifier le code]Outre les mesures diététiques (voir plus loin) si le changement alimentaire est insuffisant pour abaisser la phosphorémie, des chélateurs spécifiques peuvent être ajoutés à l'alimentation comme le carbonate de calcium (IPAKITINE ND), l'hydroxyde d'aluminium, le carbonate d'aluminium, l'acétate de calcium ou le carbonate de lanthane[38].
Le carbonate de calcium peut ultérieurement conduire à l'hypercalcémie[22] (suivi nécessaire). Dans de nombreuses études, il a été établi qu'une réduction des phosphates alimentaires était associée à une médiane de survie plus élevée[44],[45],[46].Une hypophosphorémie peut également survenir à la suite de cette thérapeutique[23].
L'utilisation d'une supplémentation en vitamine D3 n'a pas prouvé son efficacité. Elle n'est donc pas recommandée pour l'heure[1].
Traitement des infections du tractus urinaire
[modifier | modifier le code]Afin d'empêcher ces infections de s'aggraver et de toucher les reins en amont, ces infections bactériennes doivent faire l'objet d'un diagnostic (cytologie, uroculture, PCR) et d'un traitement antibiotique appropriés.
Mesures diététiques
[modifier | modifier le code]Changement alimentaire
[modifier | modifier le code]L'un des rôles essentiels de l'alimentation chez le patient insuffisant rénal est le maintien de l'état corporel, notamment de la masse musculaire, ce qui s'avère difficile si l'animal présente une maladie à un stade clinique: l'appétit est plus faible alors même que certains besoins alimentaires (énergie, protéines) sont plus élevés. Dans ce but, des aliments industriels spécifiques prescrits par le praticien vétérinaire, sont disponibles sur le marché.
De plus, les transitions alimentaires étant fréquemment source d'un rejet du nouvel aliment chez le chat, celles-ci risquent d'autant plus d'engendrer une anorexie si elles sont effectuées chez un animal dont les signes cliniques ne sont pas traités (nausée, vomissements, déshydratation, etc)[19]. Ainsi, en cas de mise en évidence de signes cliniques d'insuffisance rénale, la transition alimentaire ne peut être effectuée que chez un patient cliniquement stable.
Chez l'animal anorexique, certains composés cyproheptadine ou la mirtazapine peuvent être utilisés pour stimuler l'appétit mais leur efficacité est limitée. Si ces mesures n'aboutissent pas, il faudra recourir à une alimentation forcée par sonde naso-œsophagienne, voire œsophagostomie sur une période plus longue (meilleure tolérance)[34].
Les dernières recommandations actuelles, recommandent la mise en place d'une "diète rénale" à partir du stade IRIS 2 de la maladie[47].La question de mettre en place cette alimentation au stade I ne fait pas l'objet d'une recommandation officielle[48].
Dans une étude clinique d'Elliott et al.[44], 34 % des chats n'ont pas pu être mis à la diète rénale, et pour Plantinga et al.[45] ce sont même 54 %. On peut essayer d'améliorer l’acceptation de la nourriture en la chauffant, ou en y ajoutant des compléments permettant d'en améliorer le goût. Les aliments thérapeutiques mis au point dans ce but ont en général une teneur en lipides augmentée pour améliorer l'appétence et garantir de meilleurs apports énergétiques malgré une prise alimentaire plus faible.
Réduction des phosphates
[modifier | modifier le code]Un but important pour la gestion de l’IRC du chat est de réduire précocement les phosphates (Cf supra) dans la nourriture au cours de l’évolution de la maladie[4],[49]. Dans ce but, les aliments thérapeutiques utilisés chez ces patients ont une faible teneur en phosphore.
Contrôle de la quantité de protéines
[modifier | modifier le code]Pour lutter contre l'azotémie, on peut minimiser proportion de protéines dans la nourriture, et donc la quantité d'azote apportée dans le corps. Mais ceci ne peut être fait chez le chat que de façon limitée, car leur métabolisme nécessite un apport en protéines obligatoire (voir supra).
Le contenu en protéines ne peut donc descendre en dessous d'un certain seuil. En conséquence, la qualité des protéines qui vont devoir être données est très importante afin d'en minimiser l'impact sur la production de déchets azotés.
Les protéines animales de grande qualité réduisent par ailleurs la quantité des composés azotés arrivant dans le gros intestin, et ainsi la quantité de l’ammoniaque provenant de décomposition bactérienne par la flore intestinale[50].
À l'heure actuelle, la question de la quantité optimale de protéines à inclure dans l'alimentation des patients atteints d' IRC ne fait pas encore l'objet d'un consensus:
- D'un côté, la consommation de protéines entraîne nécessairement l'augmentation de la production de déchets azotés, que l'on peut certes réduire
- D'un autre côté, en raison des pertes importantes en protéines liées à la maladie, on peut également considérer que ces besoins en protéines sont plus importants[47].
Les aliments actuellement disponibles sur le marché pour les patients, pour la plupart, contiennent un pourcentage de protéines équivalent aux besoins recommandés pour l'adulte. Il ne s'agit donc pas d'aliments déficients en protéines[48].
La plupart des essais cliniques menés avec les aliments thérapeutiques actuellement utilisés, montrent que ces derniers peuvent permettre de maintenir une stabilité du poids des animaux. Néanmoins, ces dernières ne prennent pas toujours en compte la quantité de masse maigre et la masse adipeuse, ce qui ne permet pas de déterminer si ces aliments sont suffisants pour le maintien de la masse maigre[47].
Pourtant des études récentes, de 2010 et 2011, semblent montrer une efficacité des aliments classiques destinés aux insuffisants rénaux dans le maintien de la masse maigre, pour peu que les animaux mangent suffisamment pour couvrir leurs besoins énergétiques, donc maintenir également leur masse grasse[51],[52].
Autres suppléments
[modifier | modifier le code]D'autres nutriments, contenus notamment dans les aliments industriels formulés à cet effets, sont utiles dans le traitement de l'IRC
- Les acides gras essentiels, en particulier les omégas 3
- Les antioxydants: dont la vitamine C et la vitamine E
Autres traitements
[modifier | modifier le code]Utilisation de cellules souches
[modifier | modifier le code]À ce jour, ces traitements n'ont pas encore montré de preuves d'efficacité[1].
Pronostic
[modifier | modifier le code]La perte de fonction des néphrons lésés est irréversible. Le traitement de la maladie, excepté la transplantation rénale, à l'heure actuelle, n'a donc pas de visée curative.
Les mesures thérapeutiques ont donc deux fonctions:
- ralentir l'évolution de la maladie autant que possible en préservant au maximum le tissu rénal fonctionnel qui reste
- améliorer la qualité de vie du patient en traitant chaque complication si possible (troubles digestifs, déshydratation, acidose, dysorexie...).
Le pronostic lors du diagnostic de la maladie, est fortement corrélé à divers indicateurs comme la sévérité de l'azotémie, de la protéinurie, de l'hyperphosphatémie, ou de l'anémie[18],[53]à cet instant: en effet, plus les anomalies cliniques et paracliniques seront importantes, plus cela signifie que la maladie se trouve à un stade avancé, ce qui diminue la durée de survie.
L'espérance de vie moyenne a été dans une étude statistique chez les chats au stade IIb de 1151 j., au stade III de 778j., et au stade IV seulement de 103 jours[54]. La mise en œuvre raisonnée d'une diète rénale réduite en phosphates présente de très bons résultats jusqu'au stade III[44],[45],[46]. Si les mesures prises ne donnent pas de résultat, il ne reste plus dans le cas d'une IRC avancée le plus souvent que l'issue de l'euthanasie.
Bibliographie
[modifier | modifier le code]- (de) Reto Neiger, « Chronische Niereninsuffizienz », dans Marian C. Horzinek al., Krankheiten der Katze., Enke, (ISBN 3-8304-1049-2), p. 404–412
- (en) Gregory F. Grauer, « Chronic renal failure. », dans R. W. Nelson et C. G. Couto, Small animal internal medicine., Mosby, (ISBN 0-323-01724-X), p. 615–623
Voir aussi
[modifier | modifier le code]- Insuffisance rénale chronique de l’homme.
Références
[modifier | modifier le code]- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Chronische Niereninsuffizienz der Katze » (voir la liste des auteurs).
- Andrew H Sparkes, Sarah Caney, Serge Chalhoub et Jonathan Elliott, « ISFM Consensus Guidelines on the Diagnosis and Management of Feline Chronic Kidney Disease », Journal of Feline Medicine and Surgery, vol. 18, no 3, , p. 219–239 (ISSN 1098-612X et 1532-2750, DOI 10.1177/1098612x16631234, lire en ligne, consulté le )
- (en) K. Sturgess, « Nutritional management of Renal Disease. », Proceedings of the 33rd WSAVA/FECAVA Congress, Dublin, , p. 281–284
- (en) R. Kirby, « The cat ist not a small dog », ICU: Parts I and II, Proceedings 29th World Congress of the WSAVA, Rhodes,
- (en) D. J. Chew, « The role of phosphorus in feline chronic renal disease. », ESFM Feline Congress : Scientific Proceedings, Édimbourg, , p. 59–65
- Xavier Roura, « IRIS Kidney - Education - Risk Factors », sur www.iris-kidney.com (consulté le ).
- (de) Thierry Francey et Ariane Schweighauser, « Klinische Epidemiologie von Nierenerkrankungen bei der Katze. », Vet. Focus, vol. 28, , p. 2–7 (ISSN 0965-4593)
- (en) R. E. Jepson et al., « Evaluation of predictors of the development of azotemia in cats. », J. Vet. Intern. Med., vol. 23, , p. 806–813 (ISSN 0891-6640, PMID 19566846)
- Dan G O’Neill, David B Church, Paul D McGreevy et Peter C Thomson, « Longevity and mortality of cats attending primary care veterinary practices in England », Journal of Feline Medicine and Surgery, vol. 17, no 2, , p. 125–133 (ISSN 1098-612X et 1532-2750, DOI 10.1177/1098612x14536176, lire en ligne, consulté le )
- (en) D. J. Polzin al., « Chronic renal failure. », dans S. J. Ettinger et E. C. Feldmann, Textbook of Veterinary Internal Medicine., Philadelphia, Saunders, (ISBN 0-7216-7256-6), partie II, p. 1634–1662
- (en) G. F. Grauer, « Early detection of renal damage and disease in dogs and cats. », Vet Clin Small Animal, vol. 35, , p. 581–596
- (en) A. M. Wolf, « Chronic Progressive Renal Disease in the Cat: Recognition and Management : Small Animal Edition », North American Veterinary Conference Orlando, NAVC Proceedings, vol. 20, , p. 701–703
- (de) A. Parotat et B. Kohn, « Die chronische Niereninsuffizienz – Wie sieht ein effektives Management aus? », kleintier konkret, vol. 12, , p. 6–10
- « IRIS Kidney - Education - Early Diagnosis », sur www.iris-kidney.com (consulté le )
- « VetFuturs, Le Livre Bleu »
- Neiger 2005, p. 404
- (de) Johanna Fink-Gremmels, « Vergiftungen. », dans Marian C. Horzinek al., Krankheiten der Katze., Enke-Verlag, (ISBN 3-8304-1049-2), p. 789–803
- (en) K. A. Terio et al., « Amyloidosis in black-footed cats (Felis nigripes). », Vet. Pathol., vol. 45, , p. 393–400 (ISSN 0300-9858, PMID 18487501)
- (de) R. Heine, « Labordiagnostik bei felinen Nierenerkrankungen », Veterinary Focus, vol. 18, , p. 16–22 (ISSN 0965-4593)
- Neiger 2005, p. 406
- Grauer 2003, p. 617
- Jan Freund, « Extrarenal manifestations of uremia in a keeshond with juvenile nephropathy », GHENT UNIVERSITY FACULTY OF VETERINARY MEDICINE, year 2015-2016
- (de) Thierry Francey et Elisabeth Müller, « Chronische Nierenerkrankung – Früherkennung und Bedeutung der Phosphate », veterinärspiegel, vol. 3, , p. 107–112
- Neiger 2005, p. 411
- « IRIS Kidney - Education - Using Urine Specific Gravity », sur www.iris-kidney.com (consulté le )
- Neiger 2005, p. 410
- Anne-Sophie Bua, Marilyn E. Dunn et Pascaline Pey, « Respective associations between ureteral obstruction and renomegaly, urine specific gravity, and serum creatinine concentration in cats: 29 cases (2006-2013) », Journal of the American Veterinary Medical Association, vol. 247, no 5, , p. 518–524 (ISSN 1943-569X, PMID 26295557, DOI 10.2460/javma.247.5.518, lire en ligne, consulté le )
- (de) Deniz Seyrek-Intas et Martin Kramer, « Bild gebende Diagnostik der Niere bei Katzen. », Vet. Focus, vol. 18, , p. 23–30 (ISSN 0965-4593)
- (en) B.J. Rivers et al., « Duplex Doppler estimation of Pourcelot resistive index in arcuate arteries of sedated normal cats. », J. Vet. Intern. Med., vol. 10, , p. 28–33 (PMID 8965265)
- (en) B.J. Rivers et al., « Duplex doppler estimation of intrarenal Pourcelot resistive index in dogs and cats with renal disease. », J. Vet. Intern. Med., vol. 11, , p. 250–260 (PMID 9298481)
- « IRIS Kidney - Education - Using Urine Specific Gravity », sur www.iris-kidney.com (consulté le )
- (de) Christian F. Schrey, Leitsymptome und Leitbefunde bei Hund und Katze., Schauttauer, , 2e éd., 447 p. (ISBN 3-7945-2384-9, lire en ligne)
- « IRIS CKD Guidelines Updates 2014 - 2015 »
- (en)« IRIS Guidelines » (consulté le )
- (de) Katharine Arnell et Sheri Ross, « Fortschritte in der Behandlung chronischer Nierenerkrankungen bei der Katze. », Vet. Focus, vol. 19, no 3, , p. 6–14
- « Penn Vet | Renal Transplantation », sur www.vet.upenn.edu (consulté le )
- (en) J.R. Fischer et al., « Veterinary hemodialysis: advances in management and technology. », Vet. Clin. North Am. Small Anim. Pract., vol. 34, , p. 935–967 (ISSN 0195-5616, PMID 15223210)
- (en) Ronald Li, Adam Mugford et Karen Humm, « Acute kidney injury in dogs and cats 2. Management, treatment and outcome », In Practice, vol. 35, no 6, , p. 302–316 (ISSN 0263-841X et 2042-7689, DOI 10.1136/inp.f3640, lire en ligne, consulté le )
- (en) « Treatment recommendation for CKD in cats (2017) »
- (en) Martha Cannon, « Diagnosis and investigation of chronic kidney disease in cats », In Practice, vol. 38, no Suppl 3, , p. 2–9 (ISSN 0263-841X et 2042-7689, DOI 10.1136/inp.i4914, lire en ligne, consulté le )
- Neiger 2005, p. 409
- (en) H. Mizutani et al., « Evaluation of the clinical efficacy of benazepril in the treatment of chronic renal insufficiency in cats. », J. Vet. Intern. Med., vol. 20, , p. 1074–1079 (ISSN 0891-6640, PMID 17063698)
- P. Nguyen, B. Reynolds, J. Zentek et N. Paßlack, « Sodium in feline nutrition », Journal of Animal Physiology and Animal Nutrition, vol. 101, no 3, , p. 403–420 (ISSN 0931-2439, DOI 10.1111/jpn.12548, lire en ligne, consulté le )
- Mary Beth Callan et Virginia T. Rentko, « Clinical application of a hemoglobin-based oxygen-carrying solution », The Veterinary Clinics of North America. Small Animal Practice, vol. 33, no 6, , p. 1277–1293, vi (ISSN 0195-5616, PMID 14664199, lire en ligne, consulté le )
- (en) J. Elliott et al., « Survival of cats with naturally occurring renal failure: effect of conventional dietary management. », Journal of Small Animal Practice, vol. 41, , p. 235–242 (ISSN 0022-4510)
- (en) E. A. Plantinga et al., « Retrospective study of the survival of cats with acquired chronic renal insufficiency offered different commercial diets. », Veterinary Record, vol. 13, , p. 185–187 (ISSN 0042-4900, PMID 16100367)
- (en) P. J. Barber et al., « Effect of dietary phosphate restriction on secondary renal hyperparathyreoidism in the cat. », Journal of Small Animal Practice, vol. 40, , p. 62–70 (ISSN 0022-4510, PMID 10088085)
- « IRIS Kidney - Education - Diets for Cats with Chronic Kidney Disease (CKD) », sur www.iris-kidney.com (consulté le )
- « Protein Requirements in Dogs and Cats in Stage 1 Chronic Kidney Disease: Is There An Answer? »
- (en) J. Elliott, « The role of phosphate in chronic kidney disease (CKD) progression. », Small Animal Medicine UK Vet., vol. 13, , p. 23–28; 37–46
- Neiger 2005, p. 405–407
- S.A. Center, K.L. Warner, J.F. Randolph et J.J. Wakshlag, « Resting Energy Expenditure per Lean Body Mass Determined by Indirect Calorimetry and Bioelectrical Impedance Analysis in Cats », Journal of Veterinary Internal Medicine, vol. 25, no 6, , p. 1341–1350 (ISSN 0891-6640, DOI 10.1111/j.1939-1676.2011.00824.x, lire en ligne, consulté le )
- Catherine Anne McLeonard, « Are Adult Cats Fed on Wet Maintenance Diets Less at Risk of Developing Chronic Kidney Disease Compared to Adult Cats Fed on Dry Maintenance Diets? », Veterinary Evidence, vol. 2, no 4, (ISSN 2396-9776, DOI 10.18849/ve.v2i4.130, lire en ligne, consulté le )
- (en) J.N. King et al., « Prognostic factors in cats with chronic kidney disease. », J. Vet. Intern. Med., vol. 21, , p. 906–916 (ISSN 0891-6640, PMID 17939542)
- (en) L. M. Boyd et al., « Survival in cats with naturally occurring chronic kidney disease (2000–2002). », J. Vet. Intern. Med., vol. 22, , p. 1111–1117 (ISSN 0891-6640, PMID 18691369)

