Diéthyléthérate de trifluorure de bore
| Diéthyléthérate de trifluorure de bore | |
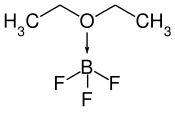
| |
| Structure du diéthyléthérate de trifluorure de bore | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.003.355 |
| No CE | 203-689-8 |
| PubChem | 8000 |
| SMILES | |
| InChI | |
| Apparence | liquide inflammable de couleur jaune à l'odeur piquante[1] |
| Propriétés chimiques | |
| Formule | C4H10BF3O |
| Masse molaire[2] | 141,928 ± 0,011 g/mol C 33,85 %, H 7,1 %, B 7,62 %, F 40,16 %, O 11,27 %, |
| Propriétés physiques | |
| T° fusion | −58 °C[1] |
| T° ébullition | 126 °C[1] |
| Masse volumique | 1,12 g/cm3[1] à 20 °C |
| T° d'auto-inflammation | 185 °C[1] |
| Point d’éclair | 59 °C[1] |
| Pression de vapeur saturante | 2,35 hPa[1] à 20 °C |
| Précautions | |
| SGH[1] | |
| H226, H314, H332, H372, P210, P280 et P301+P330+P331 |
|
| NFPA 704[3] | |
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le diéthyléthérate de trifluorure de bore est un composé chimique de formule BF3·O(CH3CH2)2, souvent abrégée BF3·OEt2. Il s'agit d'un complexe constitué d'éther diéthylique CH3CH2OCH2CH3 agissant comme base de Lewis donneuse d'électrons coordonné à du trifluorure de bore BF3 agissant comme acide de Lewis accepteur d'électrons. Il se présente sous la forme d'un liquide jaune corrosif et très inflammable à l'odeur piquante qui fume dans l'air sous l'effet de son hydrolyse. Il présente un atome de bore tétraédrique coordonné à un ligand éther diéthylique[4]. On en connaît de nombreux analogues, dont un complexe à base de méthanol.
Il peut être obtenu en faisant réagir du BF3 avec du (CH3CH2)2O anhydre en phase gazeuse. Il est utilisé dans les réactions de Friedel-Crafts, et plus généralement comme source de BF3 dans de nombreuses réactions chimiques qui requièrent un acide de Lewis[5].
Le diéthyléthérate de trifluorure de bore est utilisé comme réactif de dépolymérisation pour le recyclage des silicones[6]. La dépolymérisation permet de récupérer les monomères d'un polymère afin de les utiliser pour la production d'autres matériaux.
Notes et références
[modifier | modifier le code]- Entrée « Boron trifluoride diethyl etherate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 avril 2021 (JavaScript nécessaire).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Boron trifluoride diethyl etherate, 98+% », sur Alfa Aesar (consulté le )..
- (en) V. V. Saraev, P. B. Kraikivskii, I. Svoboda, A. S. Kuzakov et R. F. Jordan, « Synthesis, Molecular Structure, and EPR Analysis of the Three-Coordinate Ni(I) Complex [Ni(PPh3)3][BF4] », The Journal of Physical Chemistry A, vol. 112, no 48, , p. 12449-12455 (PMID 18991433, DOI 10.1021/jp802462x, Bibcode 2008JPCA..11212449S, lire en ligne)
- (en) Veronica Cornel et Carl J. Lovely, « Boron Trifluoride Etherate », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/9780470842898.rb249.pub2, lire en ligne).
- (en) Peter Döhlert, Johannes Pfrommer et Stephan Enthaler, « Recycling Concept for End-of-Life Silicones: Boron Trifluoride Diethyl Etherate as Depolymerization Reagent to Produce Difluorodimethylsilane as Useful Commodity », ACS Sustainable Chemistry & Engineering, vol. 3, no 1, , p. 163-169 (DOI 10.1021/sc500666d, lire en ligne).







